一种HLA-G全长蛋白及其表达载体、表达工程菌和制备方法与流程
 2021-02-02 11:02:58|
2021-02-02 11:02:58| 350|
350| 起点商标网
起点商标网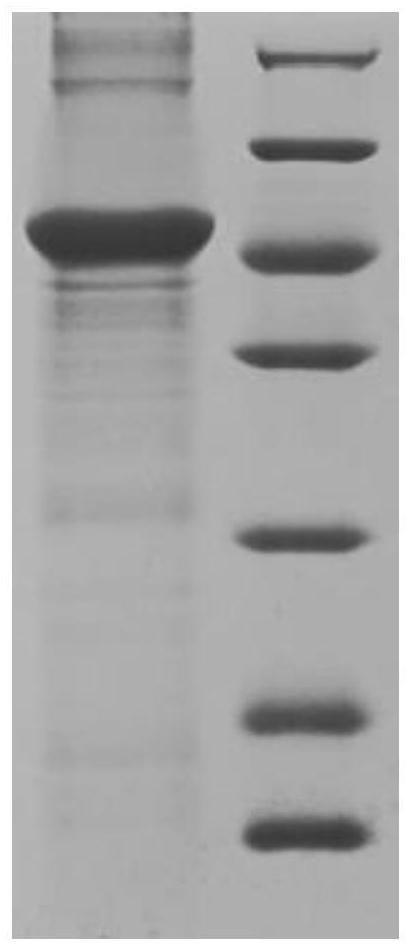
一种hla-g全长蛋白及其表达载体、表达工程菌和制备方法
技术领域
[0001]
本发明属于生物技术领域,涉及一种hla-g全长蛋白及其表达载体、表达工程菌和制备方法。
背景技术:
[0002]
hla-g是由geraghty于1987年首次克隆出来的位于6号染色体短臂的一类免疫耐受分子,属于人类一种非经典的主要组织相容性复合体(major histocompatibility complex, mhc)的i类分子,选择性高表达于侵入子宫蜕膜的绒毛外滋养细胞。妊娠被认为是成功的同种异体移植,很多妊娠相关疾病与滋养细胞异常增殖、浸润、胎盘形成不良有关。hla
-ꢀ
g基因与经典的hla i类基因具有高度同源性,均含有8个外显子、7个内含子和3'非翻译区(3'utr)。hla-g初始转录产物经选择性剪切产生7种mrna异构体,分别编码4种膜结合型hla-g分子(hla-g1-hla-g4)和3种可溶型hla-g分子(hla-g5-hla-g7)。到目前为止,临床上检测到的hla-g主要是hla-g1和hla-g5分子。hla-g由含α1、α2和α3结构域的重链以非共价键结合15号染色体编码的轻链蛋白b2m及抗原肽,组成抗原肽复合物结构。其作用是将内源性加工处理的抗原肽呈递给t细胞供其识别。在缺少b2m的情况下,hla-g也可以不结合b2m,而以游离的重链或以二硫键连接两条重链形成同源二聚体的形式存在于细胞表面。早期发现hla-g由羊膜细胞、红系前体细胞、细胞滋养层等分泌,其主要作用是抑制nk细胞的功能,避免nk细胞攻击具有抗原性的同种异体的胎儿。研究发现妊娠失败率的升高与胎盘hla-g的表达减少有关。在健康人群体中发现hila-g蛋白质仅在角膜、胰岛细胞、胸腺等组织器官中表达。有人认为 hla-g可能与血管生成和(或)胎盘形成有关,普遍接受的观点认为hla-g是一种免疫耐受分子,可以直接结合各种抑制性受体对免疫系统起到免疫抑制作用,也可以使t细胞分化为抑制性t细胞,从而发挥免疫抑制作用。后续研究陆续发现,hla-g在病理状态如习惯性流产,先兆子痫,感染性疾病,肿瘤,移植排斥和其他免疫相关性疾病等情况时也能被诱导异常表达。目前普遍认为,hla-g抗原可诱导胎儿逃避母体的免疫识别,由于它主要在母胎界面表达,其限制性表达、多态性及稳定性能阻断宫内nk细胞的杀伤功能,因此能保护胎儿滋养层细胞免受nk细胞杀伤。如果滋养层细胞hla-g表达下降,就会激活nk细胞介导的溶胞作用,造成母体对胚胎抗原的免疫攻击而导致流产。先兆子痫 (pre-eclampsia,pe)患者hla-g基因第8外显子的插入/缺失多态性分布显著性偏离hardy
-ꢀ
weinberg平衡,表现为杂合度过高,且在多数pe患者的胎盘中hla-g缺乏或表达水平降低,说明hla-g的表达对pe也有一定的影响。据认为在抗感染方面对各种炎性紊乱性疾病如多发性硬化症、颅内出血、肠胃炎、皮肤病、风湿性疾病、哮喘等hla-g具有免疫调节作用。在如cmv,hsv-1、hiv-1、狂犬病毒、hcv、甲流感病毒等病毒感染中, hla-g具有逃逸免疫监视的作用。hla-g表达于实体肿瘤,如黑素瘤、肉瘤和淋巴瘤等。在原发性黑素瘤细胞和转移细胞表面高表达各种hla-g异构体。这些hla-g分子使肿瘤细胞能逃避nk细胞和ctl细胞的杀伤,溶解作用,这是一种新的肿瘤细胞逃脱免疫监视的机制。非实体肿瘤,绒毛膜癌的发生也可能与hla-g分子抑制nk细胞的杀伤作用有关。hla-g可能通过抑制nk细胞和(或)ctl细胞激
活而下调移植排斥反应。hla-g 分子的参与有助于在供受者hla不相配时提高移植受者生存率,并可能抑制异种移植排斥。hla-g是一种免疫耐受分子,其在习惯性流产、先兆子痫、感染性疾病、肿瘤、移植排斥和其他免疫相关性疾病发生中的作用及应用受到了广泛关注。同时,hla-g具有抗原呈递功能,可与nk、t、b细胞等免疫细胞上的抑制性受体ilt2/ilt4/kir2dl4结合,参与调控免疫炎症反应,抑制nk、t、b细胞的增殖;在母亲血液、卵泡液、生殖道,胎盘的胚胎及滋养层细胞及父亲精液中的综合表达在妊娠免疫调节中发挥着重要作用。说明 hla-g是一个很有前景的研发靶点,有非常大的潜在价值。然而因hla-g是跨膜蛋白,其全长蛋白难以体外表达纯化。
[0003]
目前市面上仅有很少的几个截短型hla-g重组蛋白,且表达量低,无活性检测。截短型hla-g重组蛋白是hla-g蛋白的一部分氨基酸表达出来的,不具有hla-g蛋白的完整构象,在蛋白的活性、作用研究及相应药物筛选等方面有很大的缺陷。全长重组蛋白具有hla-g蛋白的完整构象,对于蛋白的活性及作用研究更具有说服力,对于相关药物筛选能起到更好的协助作用。然而目前市场上无论是截短型hla-g重组蛋白还是全长蛋白都处于一个空缺阶段,说明目前体外表达hla-g重组蛋白具有一定的困难性。
[0004]
因此迫切需要开发一种体外表达hla-g全长蛋白,对目前hla-g的相关病理研究、诊断及治疗等提供一定的帮助。
技术实现要素:
[0005]
为了解决所述技术问题,本发明提供了一种hla-g全长蛋白及其表达载体、表达工程菌和制备方法,本发明提供人hla-g全长蛋白,包含跨膜区,且经过elisa验证具有与天然蛋白相似的结构,所述方法制备得到的人hla-g全长蛋白高产量、高纯度并具有结构活性。
[0006]
在本发明的第一方面,提供了一种hla-g全长蛋白表达载体,所述表达载体的表达区的核苷酸序列包括如seq id no.3所示的核苷酸序列。
[0007]
进一步地,所述表达载体的表达区的核苷酸序列如seq id no.6所示。
[0008]
在本发明的第二方面,提供了所述的hla-g全长蛋白表达载体的制备方法,所述方法包括:
[0009]
获得hla-g全长蛋白的优化密码子片段,所述优化密码子片段的核苷酸序列如seq id no.3所示;
[0010]
获得表达载体,将所述hla-g全长蛋白的优化密码子片段插入到所述表达载体的表达区,获得hla-g全长蛋白表达载体。
[0011]
进一步地,所述获得hla-g全长蛋白的优化密码子片段,具体包括:
[0012]
合成得到含有所述hla-g全长蛋白的优化密码子片段的载体,以所述载体为模板,采用如seq id no.4-5所示的引物对进行pcr,获得hla-g全长蛋白的优化密码子片段。
[0013]
进一步地,所述表达载体为pet-28a-sumo载体。
[0014]
进一步地,所述将所述hla-g全长蛋白的优化密码子片段插入到所述表达载体的表达区,获得hla-g全长蛋白表达载体,具体包括:
[0015]
将所述pet-28a-sumo载体采用cpoi/noti双酶切,获得酶切载体;
[0016]
将所述hla-g全长蛋白的优化密码子片段采用cpoi/noti双酶切,获得酶切片段;
[0017]
将所述酶切载体与所述酶切片段进行酶连,获得hla-g全长蛋白表达载体。
[0018]
在本发明的第三方面,提供了一种hla-g全长蛋白表达工程菌,所述工程菌包含所述的hla-g全长蛋白表达载体。
[0019]
进一步地,所述工程菌的制备方法为:用所述的hla-g全长蛋白表达载体转化大肠杆菌感受态细胞,筛选转化子,获得所述hla-g全长蛋白表达工程菌。
[0020]
在本发明的第四方面,提供了一种hla-g全长蛋白,所述hla-g全长蛋白由所述的 hla-g全长蛋白表达工程菌经诱导表达和纯化制备得到。
[0021]
进一步地,所述hla-g全长蛋白的氨基酸序列如seq id no.7所示。
[0022]
本发明实施例中的一个或多个技术方案,至少具有如下技术效果或优点:
[0023]
本发明提供的一种hla-g全长蛋白及其表达载体、表达工程菌和制备方法,本发明首次体外制备得到了人hla-g全长蛋白,所述人hla-g全长蛋白包含跨膜区,且经过 elisa验证具有与天然蛋白相似的结构,所述方法制备得到的人hla-g全长蛋白高产量、高纯度并具有结构活性。
附图说明
[0024]
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
[0025]
图1为实施例1中pcr产物回收图;
[0026]
图2为实施例1中载体回收图;
[0027]
图3为实施例1中转化后的挑斑检测图;
[0028]
图4为实施例1中的hu-hla-g-pet28a-sumo质粒图谱;
[0029]
图5为实施例2中小量表达上清sds-page检测图;
[0030]
图6为实施例2中小量表达上清western blot检测图;
[0031]
图7为实施例2中浓缩后的人hla-g蛋白sds-page检测图;
[0032]
图8为hla-g与b2m蛋白结合的ec
50
图;
[0033]
图9为对比例1中小量表达上清sds-page检测图;
[0034]
图10为对比例1中小量表达上清使用sumo tag monoclonal antibody,1/1000进行的 western blot检测图。
具体实施方式
[0035]
下文将结合具体实施方式和实施例,具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明,而非限制本发明。
[0036]
在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
[0037]
除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等,均可通过市场购买得到或者可通过现有方法制备得到。
[0038]
本发明实施例提供的技术方案为解决上述技术问题,总体思路如下:
[0039]
(1)本发明实施例首先将人hla-g密码子优化,使得采用本发明的表达系统进行蛋白表达时,对密码子偏爱性好,优化后基因片段的核苷酸序列如seq id no.3所示;
[0040]
(2)获得hla-g全长蛋白的表达工程菌
[0041]
合成得到含有所述hla-g全长蛋白的优化密码子片段的载体,以所述载体为模板,采用如seq id no.4-5所示的引物对进行pcr,获得hla-g全长蛋白的优化密码子片段。
[0042]
将所述pet-28a-sumo载体采用cpoi/noti双酶切,获得酶切载体;
[0043]
将所述hla-g全长蛋白的优化密码子片段采用cpoi/noti双酶切,获得酶切片段;
[0044]
将所述酶切载体与所述酶切片段进行酶连,获得hla-g全长蛋白表达载体。
[0045]
用所述的hla-g全长蛋白表达载体转化大肠杆菌感受态细胞,筛选转化子,获得所述hla-g全长蛋白表达工程菌。
[0046]
(3)将所述的hla-g全长蛋白表达工程菌经诱导表达和纯化制备得到hla-g全长蛋白。
[0047]
本发明首次体外制备得到了人hla-g全长蛋白,所述人hla-g全长蛋白包含跨膜区,且经过elisa验证具有与天然蛋白相似的结构,所述方法制备得到的人hla-g全长蛋白高产量、高纯度并具有结构活性。现有技术中尚没有体外表达的人hla-g全长蛋白,难以得到具有与天然蛋白相似的结构,或者活性不高纯度低等技术难点。
[0048]
根据本发明的一种典型实施方式,提供了一种hla-g全长蛋白表达载体,所述表达载体的表达区的核苷酸序列包括如seq id no.3所示的核苷酸序列。
[0049]
作为优选的实施方式,所述表达载体的表达区的核苷酸序列如seq id no.6所示。
[0050]
根据本发明的另一种典型实施方式,提供了所述的hla-g全长蛋白表达载体的制备方法,所述方法包括:
[0051]
获得hla-g全长蛋白的优化密码子片段(具体包括:合成得到含有所述hla-g全长蛋白的优化密码子片段的载体,以pet-28a-sumo载体为模板,采用如seq id no.4-5所示的引物对进行pcr,获得hla-g全长蛋白的优化密码子片段),所述优化密码子片段的核苷酸序列如seq id no.3所示;
[0052]
获得表达载体,将所述hla-g全长蛋白的优化密码子片段插入到所述表达载体的表达区,获得hla-g全长蛋白表达载体;具体包括:
[0053]
将所述pet-28a-sumo载体采用cpoi/noti双酶切,获得酶切载体;
[0054]
将所述hla-g全长蛋白的优化密码子片段采用cpoi/noti双酶切,获得酶切片段;
[0055]
将所述酶切载体与所述酶切片段进行酶连,获得hla-g全长蛋白表达载体。
[0056]
本实施例中hla-g全长蛋白表达载体具体为hu-hla-g-pet28a-sumo的测序结果为:核苷酸序列如seq id no.6所示。
[0057]
根据本发明的另一种典型实施方式,提供了一种hla-g全长蛋白表达工程菌,所述工程菌包含所述的hla-g全长蛋白表达载体。
[0058]
所述工程菌的制备方法为:用所述的hla-g全长蛋白表达载体转化大肠杆菌感受态细胞,筛选转化子,获得所述hla-g全长蛋白表达工程菌。
[0059]
根据本发明的另一种典型实施方式,提供了一种hla-g全长蛋白,所述hla-g全长蛋白由所述的hla-g全长蛋白表达工程菌经诱导表达和纯化制备得到。
[0060]
本实施例中,所述hla-g全长蛋白的氨基酸序列如seq id no.7所示。
[0061]
下面将结合实施例及实验数据对本申请的效果进行详细说明。
[0062]
实施例1 hla-g质粒制备
[0063]
1、人hla-g密码子优化
[0064]
根据ncbi编号bc021708.2,选择人hla-g核酸序列如seq id no.1所示,其编码的氨基酸为如seq id no.2所示。
[0065]
考虑到不同表达系统进行蛋白表达时,对密码子偏爱性不同,本申请人对上述密码子进行优化,优化后基因片段的核苷酸序列如seq id no.3所示。
[0066]
2、人hla-g基因片段的获得
[0067]
所述优化后的基因片段由武汉金开瑞生物工程有限公司进行基因合成。根据人hla-g 优化后的核酸序列设计引物,引物如表1所示。
[0068]
表1
[0069][0070]
以合成的所述优化后的基因片段为模板,采用如seq id no.4-5所示的引物对进行pcr 反应,反应体系如表2所示。
[0071]
表2
[0072][0073][0074]
pcr反应程序为:94℃预变性4min;94℃变性30sec,52℃退火45sec,72℃延伸90sec,共30个循环;72℃延伸10min;15℃保温5min。反应结束后,以1%琼脂糖凝胶电泳检测扩增产物。目的片段长度为942bp,与预期的一致,见图1。marker从大到小依次为:5000、3000、 2000、1500、1000、750、500、250、100(bp)。
[0075]
根据目的片段的大小切胶,放置干净离心管。离心管放置-80℃冰箱,15min后取出室温溶解,用1ml蓝色枪头将胶捣碎,12000r/min,2min。离心后上清移至的新空白ep管,备
用。
[0076]
3、载体的酶切cpoi/noti
[0077]
选择优化的pet-28a-sumo载体使用的双酶切体系(150μl)如表3所示(单位:μl)
[0078]
表3
[0079]
项目体积载体20μlbuffer o15μlcpoi4μlnoti4μl加水至150μl
[0080]
用枪轻轻吹吸混合均匀,37℃水浴酶切20h以上为佳
[0081]
4、载体回收
[0082]
采用常规方法进行载体pet-28a-sumo(约5.6kb)回收后,1%琼脂糖凝胶电泳检测回收产物。目的载体长度为5633bp,与预期的一致,见图2。marker从大到小依次为:5000、3000、 2000、1500、1000、750、500、250、100(bp)。
[0083]
5、连接反应
[0084]
目的片段hla-g和载体pet-28a-sumo的酶切产物分别经过回收后做连接反应,反应体系(10μl)如表4所示,后于冰上15min后转化后得到hu-hla-g-pet28a-sumo。
[0085]
表4
[0086]
项目体积目的片段hla-g4μl载体pet-28a-sumo1μlbuffer0.2μl连接酶2.5μl加水至10μl
[0087]
6、转化和阳性克隆筛选
[0088]
从-80℃冰箱中取出感受态细胞,打开盖子,加入连接产物hu-hla-g-pet28a-sumo (10μl);轻轻吹吸并旋转小枪头,使dna与感受态细胞充分混匀,冰上30min,42℃热击90s,冰上1min;加入700μl预热的lb培养基,置37℃摇床中158r/1.5h。
[0089]
6000r离心4min,在超净台里面吸掉700μl上清,剩余菌液混匀,涂至含有卡那霉素的平板上;倒置平板,于37℃恒温培养箱中培养,12~16h后可出现菌落。
[0090]
挑斑检测,挑斑检测体系中上游引物选择通用引物t7,下游引物用r,经过pcr扩增后条带大小约为1407bp。泳道lane 2、lane 3、lane 4与预期一致,见图3。marker从大到小依次为:5000、3000、2000、1500、1000、750、500、250、100(bp)。
[0091]
选择lane 2、lane 3的单克隆菌液接种至3ml加相应抗生素的lb培养基中培养过夜,第二天进行保种,送测。测序无误后提取质粒得hu-hla-g-pet28a-sumo质粒。hu-hla
-ꢀ
g-pet28a-sumo质粒图谱如图4所示。
[0092]
hu-hla-g-pet28a-sumo的测序结果为:核苷酸序列如seq id no.6所示;氨基酸序列如seq id no.7所示。
[0093]
实施例2 hla-g全长蛋白的表达与纯化
[0094]
准备大肠杆菌表达宿主菌rosetta(de3)至冰上融化,加入hu-hla-g-pet28a-sumo 质粒。冰上30min;42℃热击90s、冰上1min、加入800μl预热的lb培养基,置37℃摇床中 158r/120min。6000r离心4min,超净台里面吸掉800μl上清,剩余菌液混匀,涂至含有k+ 的平板上;倒置平板,于37℃恒温培养箱中培养过夜。
[0095]
挑取单菌落加入对应抗性的lb(3ml)试管中,放入摇床培养3h后,取700μl悬液加入到100μl(c=50%)的保种甘油中,震匀,放入冰箱(-20℃)冻存。然后再剩余的菌液中加入iptg诱导表达。sds-page检测表达结果。
[0096]
检测后上清用镍离子亲和层析纯化,分别用60mm咪唑,200mm咪唑,500mm咪唑洗脱,融合蛋白大部分被200mm咪唑洗脱下来,200mm咪唑洗脱峰浓缩,进行sds-page检测。
[0097]
1、hu-hla-g-pet28a-sumo小量表达sds-page检测结果
[0098]
小量表达上清sds-page检测如图5所示:泳道3在50kd左右检测到目的条带,分子量与理论相符。其中1:marker,2:空白对照,3:hu-hla-g-pet28a-sumo小量表达结果。marker从上自下一依次为:116kd、66.2kd、45kd、35kd、25kd、18kd、14.4kd。
[0099]
2、hu-hla-g-pet28a-sumo小量表达western blot检测
[0100]
小量表达上清使用sumo tag monoclonal antibody,1/1000进行western blot检测。结果如图6所示:1:原液上样10μl,2:原液上样5μl在52kd左右检测到目的条带,与sds
-ꢀ
page分子量相符。
[0101]
3、人hla-g蛋白纯化浓缩后sds-page检测
[0102]
人hla-g蛋白纯化浓缩后,sds-page如图7所示,纯度大于85%,产量大于10mg/l。 marker从上自下一依次为:116kd、66.2kd、45kd、35kd、25kd、18kd、14.4kd。
[0103]
实施例3 elisa检测蛋白活性
[0104]
将b2m蛋白(cusabio,csb-np057841h)用cb缓冲稀释成10μg/ml后加入到elisa板中, 4℃包被过夜;倾掉包被液后,以pbs洗3次,4%pbsm(pbs含4%脱脂牛奶)封闭1h;以 pbs洗1次后,每孔加入100μl 4%pbsm稀释后的人hla-g蛋白(人hla-g蛋白从200μg/ml 开始2倍梯度稀释18个梯度),于37℃反应1h;用pbs和pbst各洗3次后;每孔加入100μlsumo tag monoclonal antibody(cusabio,csb-ma000132m0m,以4%pbsm按1:1000稀释),于37℃反应1h;用pbs和pbst各洗3次后,每孔加入100μl goat anti-mouse igg(h+l) antibody;hrp conjugated(cusabio,csb-pa573747,以4%pbsm按1:5000稀释),37℃保温1h;用pbst和pbs洗涤三次,加入100μl tmb底物溶液,避光反应15min,加入25μlh
2
so
4
(2mol/l)终止反应,用酶标仪测定od450
nm
值。
[0105]
吸光度值读出后,进行数据分析,将实验组浓度1-浓度18数据复制到graphpad软件里面,作图,读取ec
50
数据,绘制曲线图。所述人hla-g蛋白elisa检测结果如表5和图8所示。
[0106]
表5
[0107][0108][0109]
b2m蛋白(cusabio,csb-np057841h)包被10μg/ml,人hla-g蛋白从200μg/ml开始2倍梯度稀释18个梯度,对照组正常的情况下,hla-g与b2m蛋白结合的ec
50
为1.58
-ꢀ
2.00μg/ml。说明我们制备的hla-g蛋白结构与天然蛋白结构相似,可以与b2m蛋白结合。
[0110]
对比例1
[0111]
该对比例没有进行密码子优化,其他方法均同实施例1,体外表达人hla-g全长蛋白存在难以表达获得的缺点。
[0112]
小量表达上清sds-page检测如图9所示:泳道3在50kd左右未检测到明显的目的条带。其中1:marker,2:空白对照,3:没有进行密码子优化的载体小量表达结果。marker 从上自下一依次为:116kd、66.2kd、45kd、35kd、25kd、18kd、14.4kd。
[0113]
小量表达上清使用sumo tag monoclonal antibody,1/1000进行western blot检测。结果如图10所示:1:原液上样10μl在52kd左右检测到较弱目的条带,与理论分子量相符;2:原液上样5μl未检测到明显的目的条带。
[0114]
综上可知,本发明采用优化的大肠杆菌表达系统,体外表达人hla-g全长蛋白,实现了人hla-g全长蛋白的高产量、高纯度表达。并通过b2m蛋白进行elisa验证,说明其具有活性。同时本方法也适用于制备结构相似的hla其他系列全长蛋白。本发明提供人 hla-g全长蛋白,包含跨膜区,且经过elisa验证具有与天然蛋白相似的结构,该方法可以制备出高产量、高纯度的人hla-g全长蛋白的,并具有结构活性。现有技术中尚没有体外表达的人hla-g全长蛋白,最大的技术难点就是难以得到具有与天然蛋白相似的结构,或者活性不高纯度低。
[0115]
最后,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且
还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
[0116]
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
[0117]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



