一株高产杀粉蝶菌素A1和高效抑制植物病原黄单胞菌生长的链霉菌菌株的制作方法
 2021-02-02 11:02:26|
2021-02-02 11:02:26| 388|
388| 起点商标网
起点商标网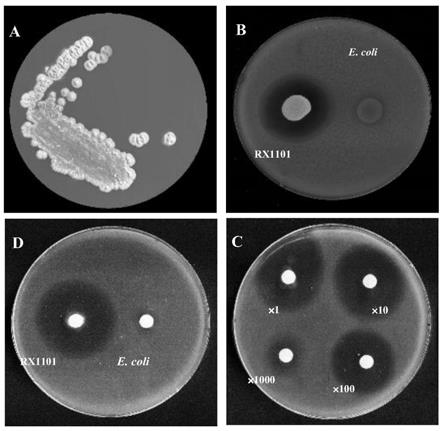
一株高产杀粉蝶菌素a1和高效抑制植物病原黄单胞菌生长的链霉菌菌株
技术领域
[0001]
本发明属于微生物技术领域,具体涉及一株链霉菌菌株,尤其涉及一种高产杀粉蝶菌素a1和高效抑制植物病原黄单胞菌生长的链霉菌菌株。
背景技术:
[0002]
链霉菌属(streptomyces)是细菌界、厚壁菌门、放射细菌纲、放射细菌亚纲、放线菌目、链霉菌亚目、链霉菌科中的一个特大属,是放线菌的典型代表。广泛分布于含水量较低、通气良好、有机质丰富和微碱性的土壤中。革兰氏阳性,菌丝体发达,无分隔,以伸展在空间较粗的气生菌丝和较细、分枝、不会断裂的基内菌丝两种状态存在。好氧菌,化能有机营养型,以好氧呼吸获取能量。营养要求低,能利用多种碳源,包括较复杂的纤维素、角蛋白和几丁质等。最适生长温度为25~35℃;最适ph为6.5~8.0。目前应用的绝大多数抗生素都是链霉菌的次生代谢物,如链霉素、氯霉素、卡那霉素、丝裂霉素c、万古霉素、四环素、金霉素、土霉素、红霉素、新生霉素、新霉素、春日霉素、博莱霉素、庆大霉素和井冈霉素等。
[0003]
根据链霉菌属各个种的气生菌丝、孢子丝和孢子的颜色,基内菌丝的颜色及其产生色素的颜色,以及孢子丝是否会吸水自溶等特征,本属划分为12个类群:(1)白孢类群,如白色链霉菌(s.albus)等;(2)黄色类群,如黄色长孢链霉菌(s.longisporoflavus)等;(3)粉红孢类群,如弗氏链霉菌(s.fradiae)等;(4)淡紫灰(即薰衣草)类群,如淡紫灰链霉菌(s.lavendulae)等;(5)青色类群,如青色链霉菌(s.glaucus)等;(6)烬灰灰群,如烬灰链霉菌(s.cinerogriseus)等;(7)绿色类群,如绿色链霉菌(s.viridis)等;(8)蓝色类群,如天蓝色链霉菌(s.coelicolor)等;(9)灰红紫类群,如紫色直丝链霉菌(s.violaceorectus)等;(10)灰褐类群,如黑化链霉菌(s.nigrificans)等;(11)金色链霉菌(s.aureus)等;(12)吸水类群,如吸水链霉菌(s.hygroscopicus)等。常用的还有除虫链霉菌(s.avermitilis)。
[0004]
专利文献cn101979630a中记载了杀粉蝶菌素a的制备方法,通过产生菌为票霉素链霉菌杭州湾变种(拉丁文名称为streptomuces piomogeues var.hangzhouwanensis,菌种保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏号为cgmcc no.4029,保藏日期2010年7月20日)发酵生产杀粉蝶菌素a。但该生产菌生产杀粉蝶菌素a的发酵效价也仅为1.8-1.9g/l。
技术实现要素:
[0005]
本发明的目的是为了克服现有技术的不足,提供一株高产杀粉蝶菌素a1和高效抑制植物病原黄单胞菌生长的链霉菌菌株。
[0006]
本发明的目的是通过以下技术方案实现的:
[0007]
第一方面,本发明提供了一株高产杀粉蝶菌素a1和高效抑制植物病原黄单胞菌生长的链霉菌菌株,所述菌株名称为链霉菌rx1101(streptomyces sp.rx1101),保藏于中国普通微生物菌种保藏中心,保藏编号为:cctcc no:m 2020069。
[0008]
优选地,所述链霉菌菌株的16s rrna基因序列如seq id no.1所示。
[0009]
优选地,扩增所述链霉菌菌株的16s rrna基因序列的pcr引物序列如seq id no.2和seq id no.3所示。
[0010]
第二方面,本发明提供了一种根据前述的链霉菌菌株在抑制植物病原黄单胞菌生长中的应用。
[0011]
优选地,所述植物病原黄单胞菌包括水稻白叶枯病菌、水稻细菌性条斑病菌、十字花科植物黑腐病菌、柑橘溃疡病菌。
[0012]
第三方面,本发明提供了一种根据前述的链霉菌菌株抑制植物病原黄单胞菌生长的方法,包括以下步骤:将链霉菌菌株接种到包含植物病原黄单胞菌的na平板培养基上,恒温培养,即可。
[0013]
第四方面,本发明提供了一种根据前述的链霉菌菌株在生产杀粉蝶菌素a1中的应用,其特征在于,所述杀粉蝶菌素a1的结构式如下:
[0014][0015]
第五方面,本发明提供了一种根据前述的链霉菌菌株生产杀粉蝶菌素a1的方法,包括以下步骤:
[0016]
a1、将链霉菌菌株rx1101接种到na液体培养基中,恒温摇床培养48-72h;
[0017]
a2、培养后所得培养液进行萃取脂溶性产物,所得萃取物旋转蒸发后加入甲醇溶解得粗提物;
[0018]
a3、将粗提物层析分离后,洗脱,即得杀粉蝶菌素a1;
[0019]
所述杀粉蝶菌素a1的结构式如下:
[0020][0021]
第六方面,本发明提供了一种根据权利要求1所述的链霉菌菌株在用于植物病虫害的生物防治中的应用。
[0022]
优选地,所述植物病虫害为植物病原黄单胞菌引起的细菌性病害,包括水稻白叶枯病、水稻细菌性条斑病、十字花科植物黑腐病。
[0023]
现有技术相比,本发明具有如下的有益效果:
[0024]
1、本发明分离和鉴定了一株高产杀粉蝶菌素a1和高效抑制植物病原黄单胞菌生长的链霉菌。通过基因组序列分析、系列生物化学和表型分析,确定该菌株为一株新型链霉菌菌株,命名为绍武链霉菌(streptomyces shaowuensis)。
[0025]
2、本发明获得的链霉菌菌株的基因型和表型系首先发现,该菌株基因组小,发酵条件简单,目标代谢产物发酵时间仅3天,远远短于传统链霉菌的发酵时间。
[0026]
3、本发明获得的链霉菌菌株生产杀粉蝶菌素a1的发酵效价达到2.65克/升,远远高于目前报道的其它菌株杀粉蝶菌素发酵效价,更有利于产业化。
[0027]
4、本发明获得的链霉菌菌株为一新型放线菌菌株,高产一种脂溶性代谢产物杀粉蝶菌素a1,能有效抑制多种植物病原黄单胞菌的生长。该菌株或其代谢产物可用于防治植
物病原黄单胞菌引起的细菌性病害,如:水稻白叶枯病、水稻细菌性条斑病、十字花科植物黑腐病、柑橘溃疡病等。基于该菌株研发出来的产品可以应用于植物病虫害的生物防治,取得良好的效果。
附图说明
[0028]
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
[0029]
图1为实施例获得的拮抗pxo99a菌株的分离和抑菌活性鉴定结果;其中图1a为实施例1获得的rx1101菌株菌落特征;图1b为实施例1获得的rx1101菌株抑制pxo99a生长活性结果;图1c为实施例3中rx1101菌株的甲醇粗提物(10微升)抑制pxo99a生长活性结果;图1d为实施例3中的rx1101菌株的甲醇粗提物不同稀释倍数下(10微升)的抑菌活性结果;
[0030]
图2为实施例3中rx1101菌株的甲醇粗提物对多种植物病原黄单胞菌的生长抑制作用;其中图2a为定性分析10微升粗提物原液和10-10000倍稀释液对水稻细菌性条斑病菌(xoc rs105)、柑橘溃疡病菌(xac)、野油菜黄单胞菌(xcc xc1和8004)、大肠杆菌(e.coli)和铜绿假单胞菌(pseudomonas aeruginosa)等的生长抑制作用;图2b为定量描述图2a中的抑制作用结果;
[0031]
图3为rx1101发酵液中各个组分抑制pxo99a生长的抑菌效果;其中图3a显示从发酵液中分离到的各个组分;图3b为所有18个组分原液的抑菌活性;图3c为第8至第18组分10倍稀释液和100倍稀释液的抑菌活性;
[0032]
图4为实施例3中收集的组分16的质谱分析结果;
[0033]
图5为实施例3中收集的组分16的nmr分析结果;其中图5a为1h谱;图5b为13c谱;图5c为hsqc关联谱;图5d为h-h关联cosy谱;图5e为组分16的化学结构;
[0034]
图6为rx1101菌株在na培养基上的生长曲线和杀粉蝶菌素a1产量/时间曲线;其中图6a为生长曲线;图6b为杀粉蝶菌素a1产量/时间曲线;
[0035]
图7为rx1101菌株的16s rrna基因dna序列比对和进化树分析;其中图7a为pcr扩增出的dna片段;图7b为进化树分析;
[0036]
图8为rx1101菌株全基因组序列分析;其中,图8a为线型基因组图谱;图8b为基因组编码基因总结;
[0037]
图9为rx1101菌株与其它九个链霉菌全基因组平均核苷酸一致性(ani)分析。
具体实施方式
[0038]
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
[0039]
实施例1链霉菌菌株rx1101的获得
[0040]
本实施例提供了一种从水稻根际分离具有拮抗水稻白叶枯菌活性的链霉菌方法,包括如下步骤:
[0041]
步骤一,分离水稻根际微生物:取上海市郊闵行区吴泾镇一块农田中生长良好的
水稻根系,用无菌水冲洗去表明浮土;将根系剪短,向50克湿重根系中加入50毫升磷酸缓冲盐溶液(磷酸二氢钾(kh
2
po4):0.24g/l,磷酸氢二钠(na
2
hpo4):1.44g/l,氯化钠(nacl):8g/l,氯化钾(kcl):0.2g/l,ph 7.2),碾磨成浆;利用纱布过滤后,取2毫升滤液分别进行2倍,10倍和100倍稀释,各取100微升稀释液涂布在”高氏一号”琼脂平板上(可溶性淀粉20g/l,kno
3 1g/l,k
2
hpo
4 0.5g/l,mgso
4
·
7h
2
o 0.5g/l,nacl 0.5g/l,feso
4
·
7h
2
o 0.01g/l,琼脂20g/l,ph 7.2-7.4),置于28℃恒温培养箱中培养三至五天,直到长出单菌落。将这些单菌落转移到新鲜高氏一号琼脂平板上,长出5029个单菌落。
[0042]
步骤二,准备包含水稻白叶枯菌pxo99a的na平板:挑选pxo99a菌株单克隆,接种到50毫升na液体培养基中(蛋白胨5g/l,牛肉膏3g/l,蔗糖10g/l,酵母提取物1g/l,ph7.2),置于28℃恒温摇床培养两天,摇床转速为200rpm;调节培养液的od
600
至1.0作为pxo99a种子液备用。向100毫升na液体培养基中加入1克琼脂糖,煮沸后冷却至50℃得琼脂糖na液体培养基,备用。取5毫升pxo99a种子液,加到上述100毫升50℃琼脂糖na液体培养基中,混合均匀后倒入无菌培养皿(90mm),每皿25毫升,置于超净工作台中吹干,得包含pxo99a的na平板,备用。
[0043]
步骤三,水稻根际分离菌拮抗pxo99a活性分析:用无菌牙签,挑取步骤一分离得到的水稻根际微生物菌落,接种在步骤二准备的包含pxo99a的na平板上,置于28℃恒温培养箱中培养两天,观察抑菌圈的产生。经过筛选,得到一株具有强烈抑制pxo99a生长的水稻根际链霉菌(图1a和图1b),简称rx1101。将其保藏于中国普通微生物菌种保藏中心,菌株名称为链霉菌rx1101(streptomyces sp.rx1101),保藏编号为:cctcc no:m 2020069,保藏日期为:2020.4.17。
[0044]
实施例2链霉菌菌株rx1101的基因序列分析
[0045]
1.链霉菌菌株rx1101基因组dna提取与纯化:rx1101菌株接种在na液体培养基中28℃恒温培养36小时后,离心收集5ml菌液的菌体。采用bacterial dna kit(omega bio-tek)提取全基因组dna,溶解在100μl无菌水中,最终浓度为120ng/μl。
[0046]
2.rx1101菌种16s rrna基因序列分析:采用引物16s-for:accattccgcagctgc(seq id no.2)和16s-rev:gctatgaccatgattacgg(seq id no.3),以步骤1提取的rx1101基因组dna为模板,采用下述pcr程序扩增。
[0047]
pcr程序如下:
[0048]
1.94℃预变性5min,
[0049]
2.94℃变性30s,
[0050]
3.55℃退火30s,
[0051]
4.72℃延伸40s,重复这三个步骤共25个循环,
[0052]
5.72℃继续延伸8min,
[0053]
6.4℃保存。
[0054]
最终产物用2%的琼脂糖凝胶进行电泳。
[0055]
所得pcr产物送交上海生工科技有限公司测序,所得序列利用clustalx软件进行进化树分析。结果显示得到大约1000-bp长的16s rrna基因扩增序列(图7a),如seq id no.1所示。进化树分析表明菌株rx1101与链霉菌streptomyces zagrosensis和streptomyces youssoufensis起源较近(图7b)。
[0056]
3.rx1101菌种全基因组序列分析:
[0057]
进一步提取rx1101菌株基因组dna,采用二代和三代测序技术,提取和纯化后的基因组dna送交上海派生诺生物科技有限公司,采用全基因组鸟枪法(whole genome shotgun,wgs)策略,构建不同插入片段的文库,利用第二代测序技术(next-generation sequencing,ngs),基于illumina novaseq测序平台,同时利用第三代单分子测序技术,基于pacbio sequel测序平台对这些文库分别进行测序,得到完整的基因组序列。序列分析表明:rx1101基因组为一线性染色体,没有质粒(图8a),大小为8718347bp,预测编码6417个基因。全基因组序列数据汇总见图8b。
[0058]
4.rx1101菌株与其它杀粉蝶菌素产生菌株全基因组比较分析:
[0059]
采用genemarks软件对全基因序列进行基因预测。genemarks用于细菌基因组的蛋白质编码基因预测。该软件预测方法是通过genemark.hmm建立相应的统计模型,利用序列中核酸使用的频率表矩阵作为基础,来预测序列中潜在的编码区域,可提高基因翻译位点识别度,减少基因预测的假阳性率。同时该软件也是ncbi公认的原核生物编码基因预测软件。基于得到的基因组序列,提取比较相近的另外九个基因组序列,采用平均核苷酸一致性(average nucleotide identity,ani)分析工具orthoani软件分析它们之间平均核苷酸一致性,得出rx1101与另外九个链霉菌菌株的ani值都在80以下(图9),说明rx1101是一个新型链霉菌品种。
[0060]
实施例3链霉菌菌株rx1101的液体培养与代谢产物提取
[0061]
1.用牙签挑取单个rx1101菌落,接种在50毫升na液体培养基中,置于28℃恒温摇床中培养48h,摇床转速为200rpm。加入等体积的乙酸乙酯,震荡萃取5分钟,静置10分钟,将上层约40毫升乙酸乙酯相转入另一个离心管;利用旋转蒸馏仪蒸干乙酸乙酯后,加入1毫升甲醇溶解提取物,用于进一步抑菌活性分析。
[0062]
2.rx1101代谢产物抑制稻黄单胞菌pxo99a生长的活性鉴定:将上述所得甲醇粗提物稀释10倍、100倍、1000倍和10000倍后,分别取10微升慢慢滴在无菌圆形滤纸片上,在超净工作台中吹干后,平放置到含有pxo99a的lb琼脂糖平板上。置于28℃恒温培养箱中培养两天,观察抑菌圈。结果如图1c和图1d所示,rx1101菌株在na液体培养基中生长48小时后,甲醇粗提物同样表现出很强的抑制pxo99a生长活性(图1d);甲醇粗提物经10倍、100倍和1000倍稀释后,依然具有抑菌活性(图1c)。这些结果表明:rx1101产生和分泌一种代谢产物,能够抑制pxo99a生长。
[0063]
3.代谢粗提物的抑菌谱鉴定:采用步骤2所用方法,分别检测不同稀释倍数的甲醇粗提物对水稻细菌性条斑病菌(xoc)rs105分离株、柑橘溃疡病菌(xac)、野油菜黄单胞菌(xcc)xc1和8004两个分离株、大肠杆菌(e.coli)和铜绿假单胞菌(pseudomonas aeruginosa)等的生长抑制作用。结果表明:杀粉蝶菌素能有效抑制水稻细菌性条斑病菌rs105、十字花科植物黑腐病菌xc1和8004分离株、柑橘溃疡病菌,但对大肠杆菌、铜绿假单胞菌、白念珠菌、芽孢杆菌和肺炎克雷伯菌等无抑菌活性(图2)。
[0064]
4.活性代谢产物分离纯化:将rx1101接种到10升na液体培养基,在28℃恒温发酵罐中生长48小时后移出,加入等体积的乙酸乙酯,剧烈震荡萃取30分钟。取上层乙酸乙酯相,经旋转蒸发仪蒸干后,溶在10毫升甲醇中。通过c18-硅胶层析分析初步分离发酵液中所有组分,分别收集每一组分于试管中,浓缩后分别稀释10倍和100倍,检测每一组分的原液、
10倍稀释液和100倍稀释液的抑菌活性(图3,其中ce为粗提物原液;me为甲醇)。结果表明:组分16抑制pxo99a生长的活性最强。
[0065]
收集组分16,蒸干后溶于甲醇中,经高效液相色谱(hplc)分析证实为单一化合物,属脂溶性,由上海交通大学生命科学技术学院仪器平台的质谱(ms)分析初步确定分子量为415.2左右(图4),可能的分子结构式为:c
25
h
37
no
4
。
[0066]
纯化的组分16同时交由上海交通大学分析测试中心进行核磁共振仪分析,结果如图5所示。由此获得其结构式为:为杀粉蝶菌素a1,英文名称为:piericidin a1。
[0067]
实施例4 rx1101菌株发酵生产杀粉蝶菌素
[0068]
将rx1101接种到na液体培养基中,在28℃恒温发酵罐中生长良好,采用实施例3的方法分离纯化杀粉蝶菌素a1,结果显示:接种后72小时生长量达到最高,杀粉蝶菌素的产量可以达到2.65克/升(图6)。
[0069]
而用本专利同样的培养方法,目前已经报道的两株产杀粉蝶菌素链霉菌菌株[茂原链霉菌(streptomyces mobaraensis)和票霉素链霉菌杭州湾变种(streptomyces piomogeues var.hangzhouwanensis)]杀粉蝶菌素a1最高产量分别为0.4克/升和0.1克/升。
[0070]
本发明具体应用途径很多,以上所述仅是本发明的优选实施方式。应当指出,以上实施例仅用于说明本发明,而并不用于限制本发明的保护范围。对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进,这些改进也应视为本发明的保护范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



