一种诱导或改善间充质干细胞的创伤愈合性质的方法与流程
 2021-02-02 11:02:12|
2021-02-02 11:02:12| 256|
256| 起点商标网
起点商标网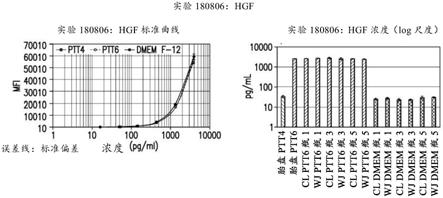
一种诱导或改善间充质干细胞的创伤愈合性质的方法
[0001]
相关专利申请的交叉引用
[0002]
本申请要求于2018年4月12日提交的美国临时申请no.62/656,531的优先权的权益,该申请的内容以引用的方式全文并入本文用于全部目的。
技术领域
[0003]
本发明涉及一种诱导或改善间充质干细胞群的创伤愈合性质的方法。本发明还涉及一种适用于诱导或改善间充质干细胞的创伤愈合性质和/或适用于分离间充质干细胞群的细胞培养基。本发明还涉及该种分离的间充质干细胞群的药物组合物和用途。本发明还涉及治疗疾病或障碍的方法,该方法包括向有此需要的受试者施用本发明的间充质干细胞群或含有此类间充质干细胞群的药物组合物。本发明还涉及高度同质的(homogenous)且定义明确的例如脐带或胎盘的间充质干细胞群。
背景技术:
[0004]
在美国专利申请2006/0078993(得到授权的美国专利9,085,755、9,737,568和9,844,571)及对应的国际专利申请wo2006/019357中首次报道了自脐带的羊膜中分离的间充质干细胞。自此,脐带组织作为多能细胞源而备受关注;由于脐带的广泛可获得性,已将脐带,特别是自脐带的羊膜中分离的干细胞(也称为“脐带衬干细胞(cord lining stem cell)”),看作是用于再生医学的细胞的极好替代来源。参见jeschke等,umbilical cord lining membrane and wharton
’
s jelly-derived mesenchymal stem cells:the similarities and differences;the open tissue engineering and regenerative medicine journal,2011,4,21-27。
[0005]
随后的一项研究比较了源自脐带的羊膜(脐带衬(cl-msc)、脐带血(cb-msc)、胎盘(p-msc)和华通氏胶(wj-msc))的人间充质干细胞(msc)的表型、增殖率、迁移、免疫原性和免疫调节能力(stubbendorf等,immunological properties of extraembryonic human mesenchymal stromal cells derived from gestational tissue,stem cells and development volume 22,number 19,2013,2619-2629)。stubbendorf等的结论是,胚胎外妊娠组织来源的msc群显示了不同的逃避免疫应答以及发挥免疫调节作用的潜力。作者还发现,由于cl-msc显示低免疫原性,其显示出最具希望的用于基于细胞的疗法的潜力,但是它们也表现出增强的增殖和迁移潜力,因此未来的研究应集中在可以在其中施用cl-msc的最佳疾病模型上。
[0006]
尽管采用如美国专利申请2006/0078993和国际专利申请wo2006/019357中描述的方案可以容易地获得羊膜的间充质干细胞,对于使用这些脐带衬msc的临床试验来说,掌握这样一种方法将是有利的,该种方法允许分离这些脐带衬msc的群,该群高度同质并因此能够用于临床试验。此外,掌握一种诱导或改善一般间充质干细胞群的创伤愈合性质的方法将是有利的。
[0007]
因此,本发明的一个目的是提供一种诱导或改善间充质干细胞群的创伤愈合性质
的方法。另一目的是自脐带羊膜中分离满足该种需求的间充质干细胞群。因此,本发明的还一目的是提供高度同质的间充质干细胞群。
技术实现要素:
[0008]
本发明的目的通过具有独立权利要求中所述的特征的方法、间充质干细胞群、相应的药物组合物以及细胞培养基来实现。
[0009]
第一方面,本发明提供一种诱导或改善间充质干细胞群的创伤愈合性质的方法,所述方法包括在培养基中培养所述间充质干细胞群,所述培养基包含dmem(杜尔贝科改良伊格尔培养基)、f12(哈姆f12培养基)、m171(培养基171)和fbs(胎牛血清)。所述间充质干细胞群可以是脐带间充质干细胞群、胎盘间充质干细胞群、脐带血间充质干细胞群、骨髓间充质干细胞群或源自脂肪-组织的间充质干细胞群。
[0010]
第二方面,本发明提供一种分离的间充质干细胞群,其中所述干细胞群的至少约90%或更多的细胞表达以下标记物中的每一个:cd73、cd90和cd105。优选地,所述分离的间充质干细胞群缺乏以下标记物的表达:cd34、cd45和hla-dr。在该第二方面的实施方案中,所述分离的间充质干细胞群的至少约91%或更多、约92%或更多、约93%或更多、约94%或更多、约95%或更多、约96%或更多、约97%或更多、约98%或更多、约99%或更多的细胞表达cd73、cd90和cd105中的每一个。此外,在所述第二方面的这些实施方案中,所述分离的间充质干细胞群的至少约91%或更多、约92%或更多、约93%或更多、约94%或更多、约95%或更多、约96%或更多、约97%或更多、约98%或更多、约99%或更多的细胞缺乏标记物cd34、cd45和hla-dr的表达。通过第一方面的诱导或改善创伤愈合性质的方法可以获得所述间充质干细胞群。因此,所述第一方面的方法还可以是一种分离间充质干细胞群的方法。
[0011]
第三方面,本发明提供一种包含本发明的(第二方面的)哺乳动物细胞的药物组合物。
[0012]
第四方面,本发明提供一种制备用于诱导或改善间充质干细胞群的创伤愈合性质或用于分离间充质干细胞群的培养基的方法,所述方法包括将以下混合以获得终体积为500ml的培养基:
[0013]
i.250ml的dmem
[0014]
ii.118ml m171
[0015]
iii.118ml dmem/f12
[0016]
iv.12.5ml胎牛血清(fbs),以得到2.5%(v/v)的终浓度。
[0017]
第五方面,本发明提供一种通过第四方面所述的方法可获得的细胞培养基。
[0018]
第六方面,本发明提供一种分离间充质干细胞群的方法,所述方法包括在通过第四方面所述的方法制备的培养基中培养所述间充质干细胞群。
[0019]
第七方面,本发明提供一种细胞培养基,其包含:
[0020]-终浓度为约55至65%(v/v)的dmem,
[0021]-终浓度为约5至15%(v/v)的f12,
[0022]-终浓度为约15至30%(v/v)的m171和
[0023]-终浓度为约1至8%(v/v)的fbs。
[0024]
第八方面,本发明提供第七方面所述的细胞培养基用于诱导或改善间充质干细胞
群的创伤愈合性质或用于分离间充质干细胞群的的用途。
附图说明
[0025]
结合非限制性实施例和附图考虑并参照发明详述将会更好地理解本发明,附图中:
[0026]
图1示出了lonza的杜尔贝科改良伊格尔培养基(dulbecco
’
s modified eagle medium)的技术信息表,其包括用于制备实验部分中的本发明培养基的示例性实例(ptt-6)的dmem的产品目录号;
[0027]
图2示出了lonza的哈姆f12培养基(ham
’
s f12 medium)的技术信息表;
[0028]
图3示出了lonza的dmem:f12(1:1)培养基的技术信息表,其包括用于制备实验部分中的本发明培养基的示例性实例(ptt-6)的dmem:f12(1:1)培养基的产品目录号;
[0029]
图4示出了life technologies corporation的m171培养基的技术信息表,其包括用于制备实验部分中的本发明培养基的示例性实例(ptt-6)的m171培养基的产品目录号;
[0030]
图5示出了成分列表,其包括在实验部分中用于制备ptt-6培养基的各成分的商业供应商和产品目录号;
[0031]
图6a-c示出了流式细胞术实验的结果,在这些实验中分析了自脐带中分离的间充质干细胞的间充质干细胞标记物cd73、cd90和cd105的表达。对于这些实验,通过在三种不同的培养基中培养脐带组织,自所述脐带组织中分离间充质干细胞,然后在相应的培养基中进行所述间充质干细胞的传代培养。在这些实验中,采用了以下三种培养基:a)补充了10%fbs(v/v)的90%(v/v)dmem,b)在美国专利申请us 2008/0248005和对应的国际专利申请wo2007/046775中描述的ptt-4培养基,其由90%(v/v)cmrl1066和10%(v/v)fbs组成(参见wo2007/046775的第[0183]段)和c)本发明的ptt-6培养基,其组成在本文中描述。在该流式细胞术分析中,在所采用的三种培养基的每一种中分析了脐带衬间充质干细胞(clmc)群的两种不同样品。结果示于图6a至图6c。
[0032]
更详细地,图6a示出了在自脐带组织中分离并在dmem/10%fbs中培养后,表达干细胞标记物cd73、cd90和cd105的分离的间充质脐带衬干细胞的百分数,图6b示出了在自脐带组织中分离并在ptt-4中培养后,表达干细胞标记物cd73、cd90和cd105的分离的间充质脐带衬干细胞的百分数,和图6c示出了在自脐带组织中分离并在ptt-6中培养后,表达干细胞标记物cd73、cd90和cd105的分离的间充质脐带衬干细胞的百分数。
[0033]
图7a-b示出了流式细胞术实验的结果,在这些实验中分析了自脐带中分离的间充质干细胞的干细胞标记物(cd73、cd90和cd105,cd34、cd45和hla-dr(人类白细胞抗原-抗原d相关的),这些干细胞标记物用于定义多能人间充质干细胞用于细胞疗法的适用性)的表达,并将其与骨髓间充质干细胞的这些标记物的表达进行了比较。对于该实验,通过在本发明的ptt-6培养基中培养脐带组织从该脐带组织中分离脐带的羊膜的间充质干细胞,而所述骨髓间充质干细胞采用标准规程自人骨髓中分离。
[0034]
图7a示出了在自脐带组织中分离并在ppt-6培养基中培养后,表达干细胞标记物cd73、cd90和cd105且缺乏cd34、cd45和hla-dr的表达的分离的间充质脐带衬干细胞的百分数,而图7b示出了表达cd73、cd90和cd105且缺乏cd34、cd45和hla-dr的表达的分离的骨髓间充质干细胞的百分数。
[0035]
图8示出了实验设置,其中深灰孔,用ptt-4培养基重构的标准品和相应的来自在ptt-4中培养的msc的样品;浅灰色孔,用ptt-6培养基重构的标准品和相应的来自在ptt-6中培养的msc的样品。斜体标记的样品为对照上清液,作为贮存样品反复测定的一部分对其进行测定。
[0036]
图9示出了tgfβ1的单重测量。可以看出,培养物cl-msc和wj-msc在ptt-6中生长时比在ptt-4中生长时产生更多的tgfβ1。当在ptt-6或ptt-4中生长时,只有at-msc和bm-msc培养物产生大约相等量的tgfβ1。所有误差线均为三次测量的标准偏差。
[0037]
图10a示出了pdgf-aa的多重测量。可以看出,培养物cl-msc、wj-msc、at-msc和bm-msc培养物在ptt-4中生长时比在ptt-6中生长时产生更多的pdgf-aa。所有误差线均为三次测量的标准偏差。
[0038]
图10b示出了vegf的多重测量。可以看出,培养物cl-msc、wj-msc、at-msc和bm-msc培养物在ptt-6中生长时比在ptt-4中生长时产生更多的vegf。所有误差线均为三次测量的标准偏差。
[0039]
图10c示出了ang-1的多重测量。可以看出,培养物cl-msc和wj-msc培养物在ptt-6中生长时比在ptt-4中生长时产生多得多的ang-1。培养物at-msc和bm-msc基本上不产生任何ang-1。所有误差线均为三次测量的标准偏差。
[0040]
图11示出了hgf的多重测量。可以看出,培养物cl-msc和wj-msc培养物在ptt-6中生长时比在ptt-4中生长时产生多得多的hgf。培养物at-msc和bm-msc基本上不产生任何hgf。所有误差线均为三次测量的标准偏差。
[0041]
图12示出了pdgf-aa的多重测量。可以看出,培养物cl-msc和wj-msc培养物在ptt-4中生长时比在ptt-6中生长时产生更多的pdgf-aa。培养物at-msc和bm-msc在两种培养基中产生等量的pdgf-aa。所有误差线均为三次测量的标准偏差。
[0042]
图13a示出了vegf的多重测量。可以看出,培养物cl-msc、wj-msc、at-msc和bm-msc培养物在ptt-6中生长时比在ptt-4中生长时产生更多的vegf。所有误差线均为三次测量的标准偏差。
[0043]
图13b示出了ang-1的多重测量。可以看出,培养物cl-msc和wj-msc培养物在ptt-6中生长时比在ptt-4中生长时产生多得多的ang-1。培养物at-msc和bm-msc基本上不产生任何ang-1。所有误差线均为三次测量的标准偏差。
[0044]
图13c示出了hgf的多重测量。可以看出,培养物cl-msc和wj-msc培养物在ptt-6中生长时比在ptt-4中生长时产生多得多的hgf。培养物at-msc和bm-msc基本上不产生任何hgf。所有误差线均为三次测量的标准偏差。
[0045]
图14示出了bfgf的多重测量。可以看出,培养物cl-msc和wj-msc培养物在ptt-6中生长时比在ptt-4中生长时产生更多的bfgf。培养物at-msc和bm-msc在ptt-4和ptt-6中培养时产生等量的bfgf。所有误差线均为三次测量的标准偏差。
[0046]
图15汇总了5个不同实验(170328、170804、170814、180105、180226)的tgfβ1测量。各实验测量的tgfβ标准曲线的平均荧光强度(mfi)描绘在下方左侧小图中。上方小图中示出了在ptt-4和ptt-6培养基中获得的tgfβ标准曲线的mfi。下方右侧小图描绘了培养物cl-msc和wj-msc在ptt-6中生长时比在ptt-4中生长时产生更多的tgfβ1。at-msc和bm-msc培养物在ptt-6或ptt-4中生长时产生等量的tgfβ1。所有误差线均为来自针对实验170328、
170804、170814、180105、180226的不同测量值的标准偏差。
[0047]
图16汇总了6个不同实验(170602、170511、170414、170224、180105、180226)的ang-1测量。各实验测量的ang-1标准曲线的平均荧光强度(mfi)描绘在下方左侧小图中。上方小图中示出了在ptt-4和ptt-6培养基中获得的ang-1标准曲线的mfi。下方右侧小图描绘了培养物cl-msc和wj-msc在ptt-6中生长时比在ptt-4中生长时产生更多的ang-1。当在ptt-6或ptt-4中生长时,只有at-msc和bm-msc培养物产生基本相等量的ang-1。所有误差线均为来自针对实验170602、170511、170414、170224、180105、180226的不同测量值的标准偏差。
[0048]
图17汇总了6个不同实验(170602、170511、170414、170224、180105、180226)的pdgf-bb测量。各实验测量的pdgf-bb标准曲线的平均荧光强度(mfi)描绘在下方左侧小图中。上方小图中示出了在ptt-4和ptt-6培养基中获得的pdgf-bb标准曲线的mfi。值得注意的是,在所有实验中均未检测到pdgf-bb。
[0049]
图18汇总了6个不同实验(170602、170511、170414、170224、180105、180226)的pdgf-aa测量。各实验测量的pdgf-aa标准曲线的平均荧光强度(mfi)描绘在下方左侧小图中。上方小图中示出了在ptt-4和ptt-6培养基中获得的pdgf-aa标准曲线的mfi。下方右侧小图描绘了培养物cl-msc、at-msc和bm-msc以及wj-msc培养物在ptt-4中生长时比在ptt-6中生长时产生略多的pdgf-aa。所有误差线均为来自实验170602、170511、170414、170224、180105、180226的测量值的标准偏差。
[0050]
图19汇总了6个不同实验(170602、170511、170414、170224、180105、180226)的il-10测量。各实验测量的il-10标准曲线的平均荧光强度(mfi)描绘在下方左侧小图中。上方小图中示出了在ptt-4和ptt-6培养基中获得的il-10标准曲线的mfi。值得注意的是,在所有实验中均未检测到il-10。
[0051]
图20汇总了6个不同实验(170602、170511、170414、170224、180105、180226)的vegf测量。各实验测量的vegf标准曲线的平均荧光强度(mfi)描绘在下方左侧小图中。上方小图中示出了在ptt-4和ptt-6培养基中获得的vegf标准曲线的mfi。下方右侧小图描绘了培养物cl-msc、at-msc和bm-msc以及wj-msc在ptt-6中生长时比在ptt-4中生长时产生更多的vegf。所有误差线均为来自实验170602、170511、170414、170224、180105、180226的不同测量值的标准偏差。
[0052]
图21汇总了6个不同实验(170602、170511、170414、170224、180105、180226)的hgf测量。各实验测量的hgf标准曲线的平均荧光强度(mfi)描绘在下方左侧小图中。上方小图中示出了在ptt-4和ptt-6培养基中获得的hgf标准曲线的mfi。下方右侧小图描绘了培养物cl-msc和wj-msc在ptt-6中生长时比在ptt-4中生长时产生更多的hgf。另一方面,培养物at-msc和bm-msc未如其它培养物一样产生那么多的hgf。所有误差线均为来自实验170602、170511、170414、170224、180105、180226的不同测量值的标准偏差。
[0053]
图22:tgfβ1的单重测量。各实验测量的tgfβ1标准曲线的平均荧光强度(mfi)描绘在左侧小图中。从右侧小图可以看出,全部cl-msc、wj-msc和胎盘msc在ptt-6中生长时比在ptt-4或dmem/f12(在图22中仅称为dmem)中生长时产生更多的tgfβ1。
[0054]
图23汇总了所分析的在ptt-6、ptt-4或dmem/f12中培养的cl-msc、wj-msc和胎盘msc的上清液中pdgf-bb的测量。各实验测量的pdgf-bb标准曲线的平均荧光强度(mfi)描绘
在左侧小图中。值得注意的是,在所有实验中均未检测到pdgf-bb。
[0055]
图24汇总了所分析的在ptt-6、ptt-4或dmem/f12中培养的cl-msc、wj-msc和胎盘msc的上清液中il-10的测量。各实验测量的vegf标准曲线的平均荧光强度(mfi)描绘在左侧小图中。s6表示测定中使用的最低标准。任何低于此的样品均被视为低于检测限。从右侧小图可以看出,当在ptt-6中生长时,所有cl-msc、wj-msc和胎盘msc均产生可检测水平的il-10,而当msc在ptt-4或dmem/f12中生长时,则检测到很少或检测不到il-10。
[0056]
图25汇总了所分析的在ptt-6、ptt-4或dmem/f12中培养的cl-msc、wj-msc和胎盘msc的上清液中vegf的测量。各实验测量的vegf标准曲线的平均荧光强度(mfi)描绘在左侧小图中。s1表示测定中使用的最高标准。任何高于此的样品均被视为是推测的(过浓)。从右侧小图可以看出,与msc在ptt-4或dmem/f12中生长时相比,所有cl-msc、wj-msc和胎盘msc在ptt-6中生长时均产生水平高得多的vegf。
[0057]
图26汇总了bfgf的多重测量。各实验测量的pdgf-aa标准曲线的平均荧光强度(mfi)描绘在左侧小图中。从右侧小图可以看出,培养的cl-msc和wj-msc在ptt-6中生长时比在ptt-4中生长时产生更多的bfgf。可以看出,与msc在ptt-4或dmem/f12中生长时相比,所有cl-msc、wj-msc和胎盘msc在ptt-6中生长时产生水平低得多的bfgf。
[0058]
图27汇总了pdgf-aa的测量。各实验测量的pdgf-aa标准曲线的平均荧光强度(mfi)描绘在左侧小图中。s6表示测定中使用的最低标准。任何低于此的样品均被视为低于检测限。可以看出,与msc在ptt-4或dmem/f12中生长时相比,所有cl-msc、wj-msc和胎盘msc在ptt-6中生长时产生更高水平的pdgf-as。
[0059]
图28汇总了ang-1的测量。各实验测量的ang-1标准曲线的平均荧光强度(mfi)描绘在左侧小图中。s1表示测定中使用的最高标准。任何高于此的样品均被视为是推测的(过浓)。右侧小图描绘了,与msc在ptt-4或dmem/f12中生长时相比,所有cl-msc、wj-msc和胎盘msc在ptt-6中生长时均产生水平高得多的ang-1。
[0060]
图29汇总了hgf的测量。各实验测量的hgf标准曲线的平均荧光强度(mfi)描绘在左侧小图中。右侧小图描绘了,与msc在ptt-4或dmem/f12中生长时相比,所有cl-msc、wj-msc和胎盘msc在ptt-6中生长时均产生水平高得多的ang-1。
[0061]
发明详述
[0062]
如上所述,第一方面,本发明涉及一种诱导或改善间充质干细胞群的创伤愈合性质的方法,所述方法包括在培养基中培养所述间充质干细胞群,所述培养基包含dmem(杜尔贝科改良伊格尔培养基)、f12(哈姆f12培养基)、m171(培养基171)和fbs(胎牛血清)。本申请中惊奇地发现,采用此类培养基具有诱导或改善广泛的间充质干细胞群的创伤愈合性质的作用,而与间充质干细胞群的天然环境/隔室无关。不希望受理论的束缚,认为所述对间充质干细胞群的创伤愈合性质的诱导或改善是由本发明的培养基使间充质干细胞群表达和/或分泌血管生成素1(ang-1)、tgf-β1、vegf和hgf中的至少一种、两种、三种或全部四种增加的能力所引起的。参见实验部分,该实验部分表明,相对于在培养基(ptt-4)中的此类间充质干细胞群的培养,在本发明的ptt-6培养基中培养的脐带羊膜的间充质干细胞群表达和/或分泌的血管生成素1(ang-1)、tgf-β1、vegf和hgf增加,所述培养基(ptt-4)已在美国专利申请us 2008/0248005中和相应的国际专利申请wo2007/046775中使用以用于分离脐带羊膜间充质干细胞群,所述细胞群在美国专利申请us 2008/0248005中和国际专利申
请wo2007/046775中显示出具有优异的创伤愈合性质(参见wo 2007/046775的实施例23-26,其表明此类脐带羊膜间充质干细胞群(ucmc)减轻了全层烧伤(实施例23),部分皮层创伤(实施例24),非愈合性辐射创伤(实施例25)以及非愈合性糖尿病创伤和非愈合性糖尿病足创伤(实施例26))。如本文的实验部分所示,在包含dmem(杜尔贝科改良伊格尔培养基)、f12(哈姆f12培养基)、m171(培养基171)和fbs(胎牛血清)的培养基中培养,不仅使脐带羊膜间充质干细胞群中还使脐带其它隔室(比如华尔通胶)或(相邻)隔室(比如胎盘)的间充质干细胞群中血管生成素1(ang-1)、tgf-β1、vegf和hgf的量增加。因此认为本申请提供了一种通过在本发明的培养基(比如培养基ptt-6)中培养间充质干细胞群来诱导或改善给定的间充质干群的创伤愈合性质的普适性教导。
[0063]
在本文上下文中,本发明的发现在于,间充质干细胞群产生的ang-1、tgf-β1、vegf和/或hgf的量的组合增加将改善或会改善此类干细胞群的创伤愈合性质,并且通过含有ang-1、tgf-β1、vegf或hgf的三种或四种作为唯一创伤愈合蛋白的组合物/溶液,也开启了对干细胞群创伤愈合性质的模拟。
[0064]
在本文上下文中,应注意血管生成素1(ang-1)、tgf-β1、vegf和hgf蛋白参与创伤愈合过程是本领域技术人员已知的。对于血管生成素1参与创伤愈合,参见例如li等,stem cell research&therapy 2013,4:113“mesenchymal stem cells modified with angiopoietin-1 gene promote wound healing”或bitto等,“angiopoietin-1gene transfer improves the impaired wound healing of the genetically diabetic mice without increasing vegf expression”,clinical science may 14,2008,114(12)707-718。在li等的研究中,将血管生成素-1基因插入骨髓间充质干细胞中,结果表明“相较于msc、ad-ang1、或伪治疗,ang1-msc显著改善创伤愈合,伴随表皮与真皮再生增加,且血管生成作用增强”。值得注意的是,li等作者提到,单独的间充质干细胞(msc)不产生足够的ang-1,且针对此原因,作者将ang1-基因插入msc,以产生基因修饰的细胞。与li的研究相对地,本申请惊讶地发现,在比如ptt-6的培养基中培养“天然”间充质干细胞,可提供这样的条件,在该种条件下,例如脐带组织间充质干细胞(即在ptt-6中培养的间充质干细胞群)产生增加水平的ang-1,并因此使间充质干细胞适合用于创伤愈合或进一步改善其创伤愈合性质。这意味着本发明提供的优势为,代替基因修饰天然存在的间充质干细胞以诱导间充质干细胞中的创伤愈合性质(这不仅费力,而且由于基因治疗的固有风险也不是治疗应用的优选方案),通过在本发明的培养基中“简单地”培养间充质干细胞群来诱导或增强天然存在的间充质干细胞的创伤愈合性质。此方法更简便、更安全、且更具成本效益。
[0065]
针对其他蛋白质诸如肝细胞生长因子(hgf)参与创伤愈合方面,特别是慢性/非愈合性创伤的愈合,参见例如,yoshida等,“neutralization of hepatocyte growth factor leads to retarded cutaneouswound healing associated with decreased neovascularization and granulation tissue formation”j.invest.dermatol.120:335-343,2003;li,jin-feng等,“hgf accelerates wound healing by promoting the dedifferentiation of epidermal cells throughβ1-integrin/ilk pathway.”biomed research international 2013(2013):470418或conway等,“hepatocyte growth factor regulation:an integral part of why wounds become chronic”.wound rep reg(2007)15 683
–
692。
[0066]
对于血管内皮生长因子(vegf)参与创伤愈合,特别是慢性/非愈合性创伤的愈合,参见例如,froget等,eur.cytokine netw.,vol.14,march 2003,60
–
64或bao等,“the role of vascular endothelial growth factor in wound healing”j surg res.2009may 15;153(2):347
–
358。
[0067]
对于转化生长因子β(包括tgf-β1、tgf-β2和tgf-β3)参与创伤愈合,特别是慢性/非愈合性创伤的愈合,参见例如,ramirez等,“the role of tgfb signaling in wound epithelialization”advances in wound care,volume 3,number 7,2013,482-491或pakyari等,critical role of transforming growth factor beta in different phases of wound healing,advances in wound care,volume 2,number 5,2012,215-224。
[0068]
在本文上下文中,还应注意本发明进一步的惊人优势在于,在本发明的培养基中培养提供了间充质干细胞群(比如脐带羊膜间充质干细胞群)的分离,该间充质干细胞群中大于90%或甚至99%或更多的细胞对三种间充质干细胞标记物cd73、cd90呈阳性,且同时这些干细胞缺乏cd34、cd45和hla-dr的表达(参见实验部分),意味着该群的99%或甚至更多的细胞表达干细胞标记物cd73、cd90和cd105而不表达标记物cd34、cd45和hla-dr。此类高度同质且定义明确的细胞群是临床试验和基于细胞的疗法的理想候选者,因为该细胞群例如完全符合普遍接受的用于细胞疗法的人间充质干细胞的标准,所述标准例如由以下定义:dominici等,“minimal criteria for defining multipotent mesenchymal stromal cells.the international society for cellular therapy position statement”,cytotherapy(2006)vol.8,no.4,315-317,sensebe等,“production of mesenchymal stromal/stem cells according to good manufacturing practices:a,review”,stem cell research&therapy 2013,4:66,vonk等,stem cell research&therapy(2015)6:94或kundrotas acta medica lituanica.2012.vol.19.no.2.p.75
–
79。此外,采用比如quantum细胞扩增系统(quantum cell expansion system)的生物反应器,能够获得大量间充质干细胞,比如每次运行的3亿至7亿间充质干细胞(同样参见实验部分)。因此,本发明提供了进一步的优势,即以一种具成本效益的方式提供治疗应用(比如在创伤愈合中使用)所需的干细胞数量。此外,用于制备本发明的培养基的所有组分均是以gmp质量商购可获得的。因此,本发明为gmp地生产一种高度同质的间充质干细胞群开辟了道路,例如胎盘组织或脐带组织的间充质干细胞群,例如脐带羊膜的间充质干细胞群或华通氏胶的间充质干细胞群。
[0069]
(通过在进行本发明培养过程之前没有创伤愈合性质的群中诱导创伤愈合性质或通过改善创伤愈合性质)而使得适合用于创伤愈合的间充质干细胞群可以是本领域已知的任何合适间充质干细胞,例如,成人干细胞群或新生儿干细胞。间充质干细胞群可源自已知含有间充质干细胞的任何哺乳类动物组织或隔室/身体部分。在示例性实例中,间充质干细胞群可以是脐带间充质干细胞群(这些为新生儿干细胞的实例)、胎盘间充质干细胞群(新生儿干细胞的另一实例)、脐带-胎盘连接处的间充质干细胞群(新生儿干细胞群的另一实例)、脐带血间充质干细胞群(新生儿干细胞的又另一实例)、骨髓间充质干细胞群(其可以是成人干细胞群)或源自脂肪-组织的间充质干细胞群(成人干细胞群的又另一实例)。
[0070]
脐带间充质干细胞群可来自(源自)含有间充质干细胞的脐带组织的任何隔室。间充质干细胞群可以是羊膜(am)间充质干细胞群、血管周的(pv)间充质干细胞群、华通氏胶
sources for regenerative medicine”eur j med res.2017;22:17作为其中引用的参考文献所述地分离脂肪-组织来源的间充质干细胞群并随后在本发明的培养基中培养(也参见实验部分)。作为另一个示例性实例,也可以首先如beeravolu等,“isolation and characterization of mesenchymal stromal cells from human umbilical cord and fetal placenta.”j vis exp.2017;(122):55224所述地分离脐带-胎盘连接处的间充质干细胞群并随后在本发明的培养基中培养。
[0072]
或者,且特别是对于可利用组织分离块分离的间充质干细胞,可以通过将天然组织在本发明的细胞培养基中培养从其天然组织环境中直接分离间充质干细胞群。此类方法学特别适用于从脐带组织、胎盘组织(胎盘组织可,例如,包含或为胎盘羊膜)、或脐带-胎盘连接处培养间充质干细胞群。
[0073]
在本文上下文中,应注意到本发明的培养基因此还允许自其天然环境中分离间充质干细胞群(这里也称为“间充质干细胞”)。因此,本发明的培养基还允许在允许间充质干细胞/祖细胞增殖而所述间充质干细胞/祖细胞不分化的条件下分离间充质干细胞群。
[0074]
在一个实施方案中,本发明的培养基允许在允许间充质干细胞/祖细胞增殖而所述间充质干细胞/祖细胞不分化的条件下自羊膜中分离间充质干细胞群。因此,按照本文所述自羊膜中分离所述间充质干细胞后,该分离的间充质干细胞/祖细胞群具有分化为多种细胞类型的能力,例如如美国专利申请2006/0078993、美国专利9,085,755、国际专利申请wo2006/019357、美国专利8,287,854或wo2007/046775中所述。例如如美国专利申请2006/0078993中所述,脐带羊膜间充质干细胞具有梭形,表达以下基因:pou5f1、bmi-1、白血病抑制因子(lif),并分泌激活素a和卵泡抑素。在本发明中分离的间充质干细胞能够例如分化为任何类型的间充质细胞,比如、但不限于皮肤成纤维细胞、软骨细胞、成骨细胞、肌腱细胞、韧带成纤维细胞、心肌细胞、平滑肌细胞、骨骼肌细胞、脂肪细胞、产生粘蛋白的细胞、源自内分泌腺的细胞比如产生胰岛素的细胞(例如,β-胰岛细胞)或神经外胚层细胞。本发明中分离的干细胞可以体外分化,以便随后将分化的细胞用于医学目的。这种方法的示例性实例是将间充质干细胞分化为产生胰岛素的β-胰岛细胞,然后可以例如通过植入将其施用于患有胰岛素缺乏症(比如糖尿病)的患者(这一方面还参见wo2007/046775)。可选地,本发明的间充质干细胞可以其未分化状态用于基于细胞的疗法,例如,用于创伤愈合目的,比如用于治疗烧伤或慢性糖尿病创伤。在这些治疗应用中,本发明的间充质干细胞既可以通过与周围患病组织相互作用来促进创伤愈合,也可以分化成相应的皮肤细胞(例如再次参见wo2007/046775)。
[0075]
根据上述公开内容,在此应注意到本文所述的此类间充质干细胞群可以自任何脐带组织中分离并培养(即源自任何脐带组织),只要该脐带组织含有羊膜(也称为“脐带衬(cord lining)”)。因此,如本申请的实验部分中所述,可以从整个脐带(的一部分)中分离所述间充质干细胞群。因此,除了羊膜之外,该脐带组织可以包含脐带的任何其它组织/组分。例如,如美国专利申请2006/0078993或国际专利申请wo2006/019357的图16所示,脐带的羊膜是脐带的最外部,覆盖了脐带。此外,脐带含有一条静脉(其向胎儿输送含氧的、营养丰富的血液)和两条动脉(其携带脱氧、营养耗尽的血液离开胎儿)。为了保护和机械支撑,这三条血管嵌入华通氏胶中,所述华通氏胶是一种主要由粘多糖制成的胶状物质。因此,本发明中使用的脐带组织也可包括该一条静脉、两条动脉和华通氏胶。使用脐带的这种整个
(完整)部分具有以下优点:羊膜不需要与脐带的其他组分分离。这减少了分离步骤,并因此使得本发明的方法更简单、更快速、更不易出错并且更经济—这些都是间充质干细胞治疗应用所需的gmp生产的重要方面。因此,间充质干细胞的分离可以通过组织分离块法(tissue explant)开始,如果需要更大量的间充质干细胞,例如用于临床试验,则随后可以进行接下来的传代培养(培养)分离的间充质干细胞。可选地,也可以首先将羊膜与脐带的其他组分分离,然后通过在本发明的培养基中培养羊膜而自羊膜中分离间充质脐带衬干细胞。所述培养也可以通过组织分离块法进行,任选地随后传代培养分离的间充质干细胞。
[0076]
在本文上下文中,术语“组织分离块(法)”或“组织分离块方法”以其在本领域中的常规含义使用,是指一种方法,在该方法中一旦收获了组织(例如胎盘组织或脐带组织),则将组织或组织的一部分放置在含有培养(生长)培养基的细胞培养皿中,随着时间的推移,干细胞自组织迁移出到培养皿的表面。然后可以通过如本文所述的微体繁殖(传代培养)将这些原代干细胞进一步扩增并转移到新鲜培养皿中。在本文上下文中,应注意到就生产用于治疗目的的细胞而言,在分离/获得本发明的间充质干细胞群(例如诸如羊膜或华通氏胶间充质干细胞的脐带间充质干细胞)的第一步中,获得了分离的间充质干细胞的主细胞库,而在随后的传代培养中可以获得工作细胞库。如果将本发明的间充质干细胞群(特别是这样的间充质干细胞群:其中的至少约97%或更多、98%或更多或99%或更多的细胞表达标记物cd73、cd90和cd105中的每一个并且缺少以下标记物中的每一个的表达:cd34、cd45和hla-dr)用于临床试验或作为批准的治疗剂,则工作细胞库的细胞群通常用于此目的。分离步骤的干细胞群(可构成主细胞库)和传代培养步骤的干细胞群(可构成工作细胞库)均可以例如以冷冻保存的形式储存。
[0077]
如上所述,本发明的诱导或改善间充质干细胞群的创伤愈合性质的方法(以及任选地同时自诸如华通氏胶或脐带羊膜中分离间充质干细胞的方法)具有以下优点:本发明的培养基中使用的所有组分均为以gmp质量可获得的,因此提供了在gmp条件下分离间充质干细胞用于后续治疗施用的可能性。
[0078]
在本文中,“诱导或改善间充质干细胞群的创伤愈合性质”意指培养基增加或启动(诱导)间充质干细胞群表达和/或分泌ang-1、tgf-β1、vegf和hgf蛋白中的至少一种的能力。如前文所述,所有该四种蛋白参与创伤愈合是已知的。相对于将间充质干细胞群在参照(培养)培养基中培养来评估“诱导或改善创伤愈合性质”,所述参照培养基比如:已在美国专利申请us 2008/0248005中和相应的国际专利申请wo2007/046775中使用的培养基ptt-4(由90%(v/v)cmrl1066和10%(v/v)fbs组成)以用于分离和培养脐带羊膜间充质干细胞群,在美国专利申请us 2008/0248005中和国际专利申请wo2007/046775中显示所述间充质干细胞群具有优异的创伤愈合性质。与将间充质干细胞群在参照培养基中培养相比,当将其在本发明的培养基中培养时,间充质干细胞群将以更大量(对应于更高分泌水平或更高浓度)将四种标记物蛋白ang-1、tgf-β1、vegf和hgf中的至少一种分泌至上清液/培养基中,随后使间充质干细胞群的创伤愈合性质增加。若在在参照培养基中培养期间,观察到间充质干细胞群未(可检测地)分泌所述四种标记物蛋白中的任一种,而在本发明培养基中培养间充质干细胞群期间或之后,观察到可检测地分泌了四种标记物蛋白中的至少一种,则诱导了干细胞群的创伤愈合性质。并且,相对于将干细胞群在参照培养基中培养,当四种标记物蛋白ang-1、tgf-β1、vegf和hgf中的至少两种或至少三种或全部四种的表达或分泌增加
healthcare、gibco by thermo fisher scientific和life science production,仅举几个例子。在目前优选的实施方案中,fbs以产品目录号a15-151自ge healthcare获得。
[0084]
现在谈谈本发明的培养基,该培养基可包含用于间充质干细胞的创伤愈合性质的诱导或改善,或用于间充质干细胞的分离或培养的终浓度为约55至65%(v/v)的dmem,终浓度为约5至15%(v/v)的f12,终浓度为约15至30%(v/v)的m171和终浓度为约1至8%(v/v)的pbs。本文所用的“%(v/v)”的数值是指相对于该培养基的终体积的单一组分的体积。这意味着,例如,如果dmem在培养基中以约55至65%(v/v)的终浓度存在,则1升的培养基含有约550至650ml dmem。
[0085]
在其它实施方案中,所述培养基可包含终浓度为约57.5至62.5%(v/v)的dmem,终浓度为约7.5至12.5%(v/v)的f12,终浓度为约17.5至25.0%(v/v)的m171和终浓度为约1.75至3.5%(v/v)的fbs。在进一步的实施方案中,所述培养基可包含终浓度为约61.8%(v/v)的dmem,终浓度为约11.8%(v/v)的f12,终浓度为约23.6%(v/v)的m171和终浓度为约2.5%(v/v)的fbs。
[0086]
除了上述组分,所述培养基可包含对培养所述间充质脐带衬干细胞有利的补充物。例如,本发明的培养基可包含表皮生长因子(egf)。如果存在,则在培养基中egf可以约1ng/ml至约20ng/ml的终浓度存在。在一些这样的实施方案中,所述培养基可包含终浓度为约10ng/ml的egf。
[0087]
本发明的培养基还可包含胰岛素。如果存在,则胰岛素可以约1μg/ml至10μg/ml的终浓度存在。在一些这样的实施方案中,所述培养基可包含终浓度为约5μg/ml的胰岛素。
[0088]
所述培养基可进一步包含以下补充物中的至少一种:腺嘌呤、氢化可的松和3,3
’
,5-三碘-l-甲状腺原氨酸钠盐(t3)。在此类实施方案中,所述培养基可包含腺嘌呤、氢化可的松和3,3
’
,5-三碘-l-甲状腺原氨酸钠盐(t3)中的全部三种。在这些实施方案中,所述培养基可以约0.05至约0.1μg/ml腺嘌呤的终浓度包含腺嘌呤,以1至约10μg/ml氢化可的松的终浓度包含氢化可的松,和/或以约0.5至约5ng/ml的终浓度包含3,3
’
,5-三碘-l-甲状腺原氨酸钠盐(t3)。
[0089]
在本发明的方法的一个实施方案中,可以培养比如脐带组织或胎盘的组织,直至合适数量的(原代)间充质干细胞(比如脐带衬干细胞、华通氏胶或胎盘干细胞)自所述组织中长出。在典型的实施方案中,培养脐带组织直至相应组织的间充质干细胞的细胞生长晕(cell outgrowth)达到约70%至约80%融合。这里应注意,术语“融合(confluency/confluence)”以其在细胞培养领域中的常规含义使用,并且意在作为培养皿或培养瓶中贴壁细胞的数量的估计/指标,指被细胞覆盖的表面的比例。例如,50%融合意指大约一半的表面被覆盖,并且仍有细胞生长的空间。100%融合意指表面完全被细胞覆盖,并且不再留有细胞单层生长的空间。
[0090]
一旦通过组织分离块法自相应组织获得了合适数量的原代细胞(间充质干细胞),就从用于培养的培养容器中移除所述间充质干细胞。通过这样做,可以获得含有例如脐带或胎盘的(原代)分离的间充质干细胞的主细胞库。通常,由于此类间充质干细胞是贴壁细胞,因此使用标准酶处理收获所述细胞。例如,所述酶处理可以包括如国际美国专利申请2006/0078993、国际专利申请wo2006/019357或国际专利申请wo2007/046775中所述的胰蛋白酶消化,意味着可以通过胰蛋白酶消化(0.125%胰蛋白酶/0.05%edta)收获向外生长的
细胞以用于进一步扩增。如果将收获的间充质干细胞例如用于产生主细胞库,则也可以将细胞冷冻保存并储存以供进一步使用,如下文所述。
[0091]
一旦收获,则可将间充质干细胞转移至用于传代培养的培养容器中。若采用一先前已从其天然环境分离的间充质干细胞群(如上文所述,用于本发明方法的此类分离的干细胞可来自脐带血、骨髓或脂肪组织,也可来自脐带组织或胎盘组织),则也进行传代培养或培养(这两个术语在下文中可互换使用)。所述传代培养还可以自冷冻的原代细胞,即自所述主细胞库开始。对于传代培养,可以将任何合适数量的细胞接种在比如细胞培养板的培养容器中。基于此目的,可以将间充质细胞以例如约0.5 x 10
6
个细胞/ml至约5.0 x 10
6
个细胞/ml的浓度悬浮于适用于传代培养的培养基(最方便地,本发明的培养基)中。在一个实施方案中,将细胞以约1.0 x 10
6
个细胞/ml的浓度悬浮以传代培养。所述传代培养既可以通过在简单的培养瓶中,也可以在例如能够堆放在培养箱中的多层系统中培养进行,所述多层系统比如cellstacks(corning,corning,ny,usa)或cellfactory(nunc,thermo fisher scientific inc.,waltham,ma,usa的部分)。可选地,所述传代培养也可以在封闭的自给式系统(比如生物反应器)中进行。不同设计的生物反应器是本领域技术人员已知的,例如,平行板、中空纤维或微流体生物反应器。参见,例如sensebe等,“production of mesenchymal stromal/stem cells according to good manufacturing practices:a review”,上文。商购可获得的中空纤维生物反应器的示例性实例为cell expansion system(terumo bct,inc),其已经例如用于扩增骨髓间充质干细胞以进行临床试验(参见hanley等,efficient manufacturing of therapeutic mesenchymal stromal cells using the quantum cell expansion system,cytotherapy.2014august;16(8):1048
–
1058)。可以用于传代培养本发明的间充质干细胞群的商购可获得的生物反应器的另一实例是自ge heathcare可获得的xuri cell expansion system。如果要在gmp条件下生产用于治疗应用的工作细胞库并且需要大量细胞,则在比如cell expansion system的自动化系统中培养间充质干细胞群是特别有益的。
[0092]
本发明的间充质干细胞的传代培养发生在本发明的培养基中。因此,本发明的培养基可以用于自例如胎盘羊膜中或自羊膜中或自脐带的华通氏胶中分离间充质干细胞群和用于随后的通过传代培养的分离的原代细胞的培养。同样对于传代培养,可以培养间充质干细胞直至生长出合适量的细胞。在示例性实施方案中,将间充质干细胞传代培养直至所述间充质干细胞达到约70%至约80%融合。
[0093]
可以在用于培养哺乳动物细胞的标准条件下进行所述间充质干细胞群的分离/培养。通常,本发明的分离间充质干细胞群的方法通常在以下条件(温度、气氛)下进行:所述条件一般用于培养所述细胞自其衍生的物种的细胞。例如,人脐带组织和间充质脐带衬干细胞通常分别在37℃下、含5%co
2
的正常气氛中培养。在本文上下文中,注意到在本发明中,间充质细胞群可以源自任何哺乳动物物种,比如小鼠、大鼠、豚鼠、猪、兔、山羊、马、狗、猫、绵羊、猴子或人,其中在一个实施方案中,人源的间充质干细胞是优选的。
[0094]
一旦自培养或传代培养获得了所需/合适数量的间充质干细胞,则通过自用于传代培养的培养容器中移除它们来收获所述间充质干细胞。通常通过酶处理,包括细胞的胰蛋白酶消化,来再次进行所述间充质干细胞的收获。随后收集分离的间充质干细胞并将其
直接使用或保存以供进一步使用。通常通过冷冻保存进行保存。术语“冷冻保存”在本文中以其常规含义使用,用于描述通过冷却至低的零下温度(比如(通常)-80℃或-196℃(液氮的沸点))来保存间充质干细胞的过程。冷冻保存可以如本领域技术人员已知的进行,且可包括使用比如二甲基亚砜(dmso)或甘油的冷冻保护剂,其减缓脐带细胞中冰晶的形成。
[0095]
通过本发明的培养和/或分离方法获得的分离的间充质干细胞群是高度定义且同质的。在该方法的典型实施方案中,至少约90%或更多、约91%或更多、约92%或更多、约93%或更多、约94%或更多、约95%或更多、约96%或更多、约97%或更多、约98%或更多、约99%或更多的分离的间充质干细胞表达以下标记物:cd73、cd90和cd105。此外,在这些实施方案中,至少约90%或更多、约91%或更多、约92%或更多、约93%或更多、约94%或更多、约95%或更多、约96%或更多、约97%或更多、约98%或更多、约99%或更多的分离的间充质干细胞可缺乏以下标记物的表达:cd34、cd45和hla-dr。在特定实施方案中,约97%或更多、约98%或更多或约99%或更多的分离的间充质干细胞群表达cd73、cd90和cd105,同时缺乏cd34、cd45和hla-dr的表达。
[0096]
因此,根据上述公开内容,本发明还涉及(例如自华通氏胶或脐带的羊膜中分离的)比如胎盘间充质干细胞群或脐带间充质干细胞群的间充质干细胞群,其中干细胞群的至少约90%或更多的细胞表达以下标记物中的每一个:cd73、cd90和cd105。在优选的实施方案中,分离的间充质干细胞群的至少约91%或更多、约92%或更多、约93%或更多、约94%或更多、约95%或更多、约96%或更多、约97%或更多、约98%或更多、约99%或更多的细胞为cd73+、cd90+和cd105+,其含义是分离的细胞群的该百分比表达cd73、cd90和cd105中的每一个(参见本申请的实验部分)。此外,至少约90%或更多、约91%或更多、约92%或更多、约93%或更多、约94%或更多、约95%或更多、约96%或更多、约97%或更多、约98%或更多、约99%或更多的分离的间充质干细胞可缺乏以下标记物的表达:cd34、cd45和hla-dr。在特定实施方案中,约97%或更多、约98%或更多或约99%或更多的分离的间充质干细胞群表达cd73、cd90和cd105,同时缺乏cd34、cd45和hla-dr的表达。本文首次报道了此类高度同质的源自脐带羊膜的间充质干细胞群,并且该细胞群符合用于细胞疗法的间充质干细胞的标准(同样参见实验部分和例如,sensebe等,“production of mesenchymal stromal/stem cells according to good manufacturing practices:a review”,上文)。在本文上下文中应注意,该间充质干细胞群既可通过本发明的分离方法获得,但如果需要,也可通过比如细胞分选的不同方法获得。在本发明的此类脐带间充质干细胞群的一个实施方案中,其中所述干细胞群的至少约91%或更多的细胞表达cd73、cd90和cd105,并缺乏cd34、cd45和hla-dr的表达,排除自脐带羊膜分离的间充质干细胞群。
[0097]
如上所述,本发明还涉及一种包含本文所述的间充质干细胞群的药物组合物,其中所述干细胞群的至少约90%或更多的细胞表达以下标记物中的每一个:cd73、cd90和cd105,和任选地缺乏cd34、cd45和hla-dr的表达。所述药物组合物可包含任何药学上可接受的赋形剂,并可被配制用于任何所需的药学的施用途径。所述药物组合物可例如适于全身或局部应用。在相关的方面,本发明还提供一种药物组合物,其含有ang-1、tgf-β1、vegf或hgf中的三种或四种作为唯一的创伤愈合蛋白。此类药物组合物可例如通过使用药学上合适的缓冲液,比如0.9%盐水、林格氏溶液或磷酸盐缓冲盐水(pbs)配制成液体或配制成冻干物/冷冻干燥制剂。
[0098]
另一方面,本发明涉及一种制备用于诱导或改善创伤愈合性质和/或用于分离间充质干细胞群的培养基的方法,其中所述方法包括将以下混合以获得终体积为500ml的培养基:
[0099]
i.250ml的dmem
[0100]
ii.118ml m171
[0101]
iii.118ml dmem/f12
[0102]
iv.12.5ml胎牛血清(fbs),以得到2.5%(v/v)的终浓度。
[0103]
如上所述,dmem/f12培养基为dmem和哈姆f12培养基的1:1混合物。因此118ml dmem/f12培养基含有59ml dmem和59ml f12。因此,当采用该制备培养基的方法时,500ml总体积中的终浓度(v/v)如下:
[0104]
dmem:250ml+59ml=309ml,对应于309/500=61.8%(v/v)
[0105]
m171:118ml,对应于118/500=23.6%(v/v)
[0106]
f12:59ml,对应于59/500=11.8%(v/v)。
[0107]
该制备培养基的方法的实施方案进一步包括添加:
[0108]
v.1ml egf储备液(5μg/ml)以得到10ng/ml的egf终浓度,和
[0109]
vi.胰岛素0.175ml储备液(14.28mg/ml)以得到5μg/ml的胰岛素终浓度。
[0110]
此处应注意,在这些实施方案中,上述这些组分i至vi的体积混合得到终体积为499.675ml的培养基。如果不再向培养基中添加其他组分,则剩余的0.325ml(加至500ml的体积)可以是例如组分i至iv中的任意者,这意味着可以是dmem、m171、dmem/f12或fbs。可选地,当然可以调节egf或胰岛素储备液的浓度,使得培养基的总体积为500ml。此外,还应注意组分i至iv不必按照它们列出的顺序加入,而是当然可以使用任何顺序使这些组分混合以得到本发明的培养基。这意味着,例如,可以将m171和dmem/f12混合在一起,然后与dmem和fbs组合以达到如本文所述的终浓度,即dmem的终浓度为约55至65%(v/v),f12的终浓度为约5至15%(v/v),m171的终浓度为约15至30%(v/v)和fbs的终浓度为约1至8%(v/v)。
[0111]
在其它实施方案中,所述方法进一步包括向dmem中添加0.325ml体积的以下补充物中的一种或多种:腺嘌呤、氢化可的松、3,3
’
,5-三碘-l-甲状腺原氨酸钠盐(t3),由此得到总体积为500ml的培养基。在该实施方案中,dmem中这些补充物的终浓度可如下:
[0112]
约0.05至0.1μg/ml腺嘌呤,例如约0.025μg/ml腺嘌呤,
[0113]
约1至10μg/ml氢化可的松,
[0114]
约0.5至5ng/ml 3,3
’
,5-三碘-l-甲状腺原氨酸钠盐(t3),例如1.36ng/ml3,3
’
,5-三碘-l-甲状腺原氨酸钠盐(t3)。
[0115]
根据上述公开内容,本发明还涉及通过本文所述的制备培养基的方法可获得的或获得的细胞培养基。
[0116]
此外,本发明还涉及一种自脐带的羊膜中分离间充质干细胞的方法,其中该方法包括在通过本文所述的方法制备的培养基中培养羊膜组织。
[0117]
因此,本发明还涉及一种细胞培养基,其包含:
[0118]-终浓度为约55至65%(v/v)的dmem,
[0119]-终浓度为约5至15%(v/v)的f12,
[0120]-终浓度为约15至30%(v/v)的m171和
[0121]-终浓度为约1至8%(v/v)的fbs。
[0122]
在本文所述的培养基的一些实施方案中,所述培养基包含终浓度为约57.7至62.5%(v/v)的dmem,终浓度为约7.5至12.5%(v/v)的f12,终浓度为约17.5至25.0%(v/v)的m171和终浓度为约1.75至3.5%(v/v)的fbs。在其它实施方案中,所述培养基可包含终浓度为约61.8%(v/v)的dmem,终浓度为约11.8%(v/v)的f12,终浓度为约23.6%(v/v)的m171和终浓度为约2.5%(v/v)的fbs。
[0123]
此外,所述培养基可进一步包含终浓度为约1ng/ml至约20ng/ml的表皮生长因子(egf)。在一些实施方案中,所述培养基包含终浓度为约10ng/ml的egf。本文所述的培养基可进一步包含终浓度为约1μg/ml至约10μg/ml的胰岛素。在此类实施方案中,所述培养基可包含终浓度为约5μg/ml的胰岛素。
[0124]
本发明的细胞培养基可进一步包含以下补充物中的至少一种:腺嘌呤、氢化可的松和3,3
’
,5-三碘-l-甲状腺原氨酸钠盐(t3)。在一些实施方案中,所述培养基包含腺嘌呤、氢化可的松和3,3
’
,5-三碘-l-甲状腺原氨酸钠盐(t3)中的全部三种。如果存在,则所述培养基可以约0.01至约0.1μg/ml腺嘌呤或约0.05至约0.1μg/ml腺嘌呤的终浓度包含腺嘌呤,以约0.1至约10μg/ml氢化可的松或约1至约10μg/ml氢化可的松的终浓度包含氢化可的松,和/或以约0.5至约5ng/ml的终浓度包含3,3
’
,5-三碘-l-甲状腺原氨酸钠盐(t3)。
[0125]
在所述细胞培养基的实施方案中,500ml的本发明的细胞培养基包含:
[0126]
i.250ml的dmem
[0127]
ii.118ml m171
[0128]
iii.118ml dmem/f12
[0129]
iv.12.5ml胎牛血清(fbs)(终浓度为2.5%)。
[0130]
在进一步的实施方案中,所述细胞培养基可进一步包含:
[0131]
v.终浓度为10ng/ml的egf,和
[0132]
vi.终浓度为5μg/ml的胰岛素。
[0133]
可以使用选择的储备液将胰岛素和egf加入培养基中,使得培养基的总体积不超过500ml。
[0134]
在特定的实例中,本发明培养基的组分i至vi为图5中所示的组分,意味着这些组分以图5所示的产品目录号自相应的制造商获得。由将图5所示的组分i至vi混合获得的培养基在本文中也称为“ptt-6”。在本文上下文中还应注意到,成分i至vi以及任何其它成分(比如任何其它商业供应商的抗生素)均可用于制备本发明的培养基。
[0135]
此外,本发明的细胞培养基可以约0.01至约0.1μg/ml腺嘌呤或约0.05至约0.1μg/ml腺嘌呤的终浓度包含腺嘌呤,以约0.1至约10μg/ml、约0.5至约10μg/ml或约1至约10μg/ml氢化可的松的终浓度包含氢化可的松,和/或以约0.1至约5ng/ml或约0.5至约5ng/ml的终浓度包含3,3
’
,5-三碘-l-甲状腺原氨酸钠盐(t3)。
[0136]
最后,本发明还提供一种治疗患有疾病或患有病症的非人哺乳动物(比如猫、狗、马,仅举几个例子)或人患者的方法,所述方法包括向所述非人哺乳动物或人患者施用本文公开的间充质干细胞群或含有本文公开的干细胞群的药物组合物。所述疾病可以是任何疾病或病症,特别地是其中想要/需要创伤愈合的任何疾病或病症。所述受试者(患者或非人哺乳动物)患有创伤,所述创伤是由烧伤、咬伤、外伤、手术或比如皮肤病或代谢障碍的疾病
引起的。作为此类代谢障碍的一个实例,所述患者例如可能患有i型或ii型糖尿病,以及患有慢性足溃疡。为了治疗受试者,可以以任何合适的方式施用本发明的间充质干细胞群,所述方式例如包括、但不限于局部施用,通过植入或通过注射。原则上,本文意指任何局部给药方式。可以通过注射器的方式实施所述间充质干细胞群的施用。然而,在将间充质干细胞应用于受试者之前,还可在霜剂、软膏剂、凝胶剂、悬浮剂或任何其它合适的物质中接触间充质干细胞。然后所述干细胞群可例如直接置于比如烧伤或糖尿病创伤的创伤上(参见国际专利申请wo2007/046775)。在其应用至受试者后,利用敷料(比如敷料)与覆盖所述敷料的弹力绷带(crepe bandage),可将间充质干细胞群保持在适当位置。可选地,也可将所述干细胞群皮下植入,例如直接植入皮肤下、体脂肪中或腹膜中。
[0137]
本发明还涉及单位剂量,其包含本文所述间充质干细胞群的约20百万个细胞、约15百万个细胞、约10百万个细胞、约5百万个细胞、约4百万个细胞、约3百万个细胞、约2百万个细胞、约1百万个细胞、约0.5百万个细胞、约0.25百万个细胞、或小于0.25百万个细胞。
[0138]
还可设想,所述单位剂量包含约10、约9、约8、约7、约6、约5、约4、约3、约2、约1、约0.5、约0.25或约0.1百万个细胞。优选地,所述单位剂量包含约10百万个细胞。进一步设想的是,所述单位剂量包含约1000个细胞至约5百万个细胞。可以以约100,000个细胞、300,000个细胞或500,000个细胞的剂量应用所述单位剂量。如本文所述,所述单位剂量可局部应用,特别是若用于创伤愈合。例如,所述单位剂量可每平方厘米局部应用。
[0139]
若有需要,所述单位剂量可每周应用一次、两次、三次或更多次。例如,所述单位剂量可应用一周、两周、三周、四周、五周、六周、七周、八周、九周、十周、十一周或更多周。含有约100,000个细胞、约300,000个细胞或约500,000个细胞的单位剂量可一周应用两次,持续8周,优选地在1cm
2
上应用。
[0140]
可以将所述单位剂量包含在任何合适的容器中。例如,所述单位剂量可包含在1ml小瓶中。在此类情况下,例如可以将所述小瓶的0.1ml,优选地以每平方厘米应用于受试者。所述单位剂量可可选地包含在注射器中。
[0141]
本发明的单位剂量中,细胞可与药学上可接受的载体(例如液体载体)接触。所述载体可以是任何已知的载体,比如hypothermosol
tm
、hypothermosol
tm-frs或plasmalyte。本发明培养基也可用作本发明间充质干细胞群(单位剂量)的载体。在此情况下,间充质干细胞可在施用之前与载体分开。例如,在施用于受试者之前,可将细胞离心并分离。
[0142]
本发明的治疗方法和单位剂量可包括使用活细胞。采用已知的方法,例如如实验部分所述的台盼蓝(tryphan blue)染色来测定所述间充质干细胞群的存活率。
[0143]
通过以下非限制性实验实施例进一步阐明本发明。
[0144]
通过以下非限制性实验实施例进一步阐明本发明。
[0145]
本文所用的序列描绘在下表1中。
[0146]
表1.本文所用蛋白的序列
[0147]
[0148]
[0149]
[0150]
[0151]
[0152]
[0153]
[0154]
[0155]
[0156][0157]
实验实施例
[0158]
1、间充质干细胞分离前的脐带组织的冷冻保存
[0159]
如下所述,对脐带组织(脐带是经母亲知情同意捐赠的)进行处理,以便随后自脐带的羊膜中分离间充质干细胞。
[0160]
1.1脐带组织样品的洗涤:
[0161]
a.从保护罩上取下手术刀。
[0162]
b.用镊子夹紧脐带,用手术刀将脐带切成10厘米长的一段。将无法使用的脐带放回原来的组织杯中。
[0163]
c.将10厘米长的脐带段转移至新的150mm培养皿中。可以使用150mm培养皿代替所述杯子。
[0164]
d.将150mm培养皿的盖子作为放置镊子和手术刀的地方。
[0165]
e.用30ml注射器取出25ml plasmalyte a(baxter,目录号#2b2543q)。用一只手使注射器保持45
°
角,将plasmalyte a直接分配到脐带组织上。
[0166]
f.将培养皿稍微倾斜,用30ml注射器和钝针取出plasmalyte a。
[0167]
g.将用过的plasmalyte a收集在300ml转移袋中,该转移袋用作垃圾容器并将其丢弃在生物危害箱中。
[0168]
h.重复洗涤程序,如有必要,每次洗涤使用新的培养皿。确保已去除表面上的所有血凝块。如果需要清洗组织,可以使用更多的plasmalyte a。
[0169]
i.将组织放入新的标记的组织培养皿中以继续切割组织。向该培养皿中加入20ml plasmalyte a,从而使所述组织在切割时不会变干。
[0170]
j.将脐带切成等长的约1厘米的切块,共计10个切块。
[0171]
k.然后将每个1cm的切块切成更小的段,每个切块约0.3cm
×
0.3cm至0.5cm
×
0.5cm。
[0172]
l.移除培养皿中的任何plasmalyte a。
[0173]
m.采用30ml注射器自原始plasmalyte a袋中取出25ml plasmalyte a,并直接分配到脐带组织块上。
[0174]
n.将培养皿成角度保持使用于洗涤组织的全部plasmalyte a集中于一侧,然后用注射器和钝针将其取出。
[0175]
o.再次重复洗涤。不应该留下任何凝块。
[0176]
注意:如果脐带没有立即冷冻,则将该脐带组织保存在plasmalyte a中,直到准备冷冻。
[0177]
1.2脐带组织的冷冻保存:
[0178]
a.制备冷冻保存液:
[0179]
i.制备50ml由60%的plasmalyte a、30%的5%人血清白蛋白和10%的二甲基亚砜(dmso)组成的冷冻液。
[0180]
ii.将一个150ml的转移袋标记上“组织冷冻液”,并使用无菌技术将血浆转移装置连接到端口。
[0181]
iii.采用30ml注射器自原始plasmalyte a袋中取出30ml plasmalyte a,并将其转移至具有溶液制备日期和时间的标记了“组织冷冻液”的转移袋中。
[0182]
iv.用20ml注射器取15ml 5%的人血清白蛋白并将其转移至所述标记的转移袋中。
[0183]
v.向该转移袋中加入5ml dmso。
[0184]
vi.混合均匀并记录冷冻液的混合情况。
[0185]
b.在加入冷冻液之前自组织中移除plasmalyte a。
[0186]
c.采用60ml注射器,将全部50ml的冷冻液吸入该注射器,将约30ml冷冻液加入含有脐带组织的150mm细胞培养皿中。在注射器上放一根钝针以保持其无菌。
[0187]
d.每分钟旋转含有组织和冷冻液的培养皿10分钟。
[0188]
e.用镊子选择8个随机选择的切块,将其放入4个4ml的冷冻小瓶的每一个中。选择4个随机选择的切块,将其放入一个1.8ml的冷冻小瓶中。这些切块应无血凝块。
[0189]
f.向每个包含脐带组织的冷冻小瓶中加入剩余的冷冻液,其中4ml的管加入至3.6ml的灌装线,1.8ml的nunc小瓶加入至1.8ml的灌装线。
[0190]
g.用组织id标记一个bactec lytic/10-anaerobic/f瓶和一个bactec plus aerobic/f瓶。
[0191]
h.用注射器和钝针自培养皿中取出20ml冷冻液,酒精棉签擦拭bactec小瓶后,将钝针转换成18g针头,并接种有氧和无氧bactec瓶,每瓶10ml。
[0192]
i.启动控制速率冷冻机。
[0193]
j.控制速率冷冻完成后,将装置置于连续温度监测的液氮冷冻机中,直到进一步使用。
[0194]
2.自脐带组织中分离间充质脐带衬干细胞
[0195]
2.1制备用于处理来自脐带组织的msc的培养基:
[0196]
a.按照所列顺序将以下混合,以制备500ml ptt-6(培养/生长培养基):
[0197]
i.dmem,250ml
[0198]
ii.m171 118ml
[0199]
iii.dmem f12 118ml
[0200]
iv.fbs 12.5ml(终浓度为2.5%)
[0201]
v.egf 1ml(终浓度为10ng/ml)
[0202]
vi.胰岛素0.175ml(终浓度为5μg/ml)
[0203]
上述组分i至vi的体积得到终体积为499.675ml的培养基。如果不再向培养基中添加其它组分,则剩余的0.325ml(加至500ml的体积)可以是例如组分i至iv中的任意者,这意味着可以是dmem、m171、dmem/f12或fbs。可选地,当然可以调节egf或胰岛素储备液的浓度,使得培养基的总体积为500ml。可选地,可以加入抗生素(比如青霉素-链霉素-两性霉素)的
储备液以得到终体积为500ml。还可以向所述培养基中添加0.325ml体积的以下补充物中的一种或多种:腺嘌呤、氢化可的松、3,3
’
,5-三碘-l-甲状腺原氨酸钠盐(t3),由此得到总体积为500ml的培养基。
[0204]
vii.在瓶身上标注“ptt-6”、培养基的制备日期、操作人员的首字母,并在短语“到期”后面标注到期日。到期日是指任何组分的最早到期日,或自制备日期起1个月,以先到者为准。
[0205]
b.在50ml离心管中,将2.5ml fbs加入47.5ml hbss中,以制备漂洗培养基(不含钙或镁、具有5%fbs的hank
’
s缓冲盐溶液(hbss))。在管上标注“漂洗培养基”、操作人员的首字母和培养基的制备日期。
[0206]
c.采用bactec lytic/10
–
anaerobic/f(becton dickinson&company)和bactec pluc+aerobic/f(becton dickinson&company)对所有培养基进行无菌检验。向每个瓶中注入20ml制备的培养基。
[0207]
2.2解冻用于msc收获的脐带组织:
[0208]
a.当操作人员准备好在洁净室中处理样品时,开始解冻。除非这些小瓶来自同一捐赠者,否则每次解冻的小瓶不得超过1瓶。
[0209]
b.用消毒剂擦拭水浴,然后用70%异丙醇擦拭,并将1l无菌水注入水浴。将水浴加热至36-38℃。
[0210]
c.在洁净室中在生物安全柜下准备10ml由70%至90%plasmalyte a组成的漂洗培养基。使用连接到10ml注射器的0.2-μm注射器过滤器对溶液进行无菌过滤,并保持溶液冷藏直至使用。
[0211]
d.将处理标签贴在50ml锥形管上。
[0212]
e.确认水浴温度为36-38℃。
[0213]
f.从液氮储存器中取出组织小瓶,并在装有1l无菌水的37℃水浴中快速解冻。用于mr.frosty nalgenecryo 1℃冷冻容器的小瓶支架与小瓶一起漂浮,可以在解冻样品时用作浮动架。
[0214]
g.将小瓶自水浴中取出,并用70%异丙醇溶液喷洒。将小瓶从水浴中取出的良好时机是可以看到小冰漂浮在小瓶中时——建议小瓶的内部温度低于37℃。
[0215]
h.将小瓶放入传递通道并提醒洁净室处理技术人员。
[0216]
2.3组织处理的准备:
[0217]
a.脐带组织处理应在环境监测(em)的洁净室中进行。在每个班次结束时,都要对整个房间和安全罩(hood)进行清洁。
[0218]
b.准备/清洁生物安全柜。
[0219]
c.在生物安全柜中工作时进行存在(viable)颗粒计数。
[0220]
d.在生物安全柜中组装所有必要的供应品,检查每个供应品的包装破损及到期日。在拿取注射器、血清移液管、无菌镊子、手术刀、组织板和针头时,确保不要触碰任何将与无菌产品接触的表面。仅注射器筒、管道、柱塞头和/或针帽或护套的外部是可以安全地拿取的。如果表面已被触碰或接触到非无菌表面,则丢弃该供应品。
[0221]
e.记录要使用的所有试剂和供应品的批号和到期日(如果适用)。
[0222]
f.通过用浸有70%酒精的无绒布清洁小瓶,然后转移到生物安全柜中,来接收解
冻的小瓶。
[0223]
g.使用带注射器的吸液针,从小瓶中取出尽可能多的液体。避免吸入组织。
[0224]
h.使用无菌镊子,将组织转移到无菌的100mm培养皿中。
[0225]
i.向组织碎片中加入等份的5ml漂洗培养基。
[0226]
j.旋转内容物15-30秒,然后用移液管或带吸液针的注射器取出漂洗培养基。重复此漂洗过程两次。
[0227]
k.向组织中加入2ml漂洗培养基以避免组织干燥。
[0228]
2.4开始msc自组织的向外生长:
[0229]
a.在6孔板底部标记“向外生长1”、msc批号或脐带组织id以及开始向外生长的日期。如果采用60mm组织培养皿,则通过在培养皿底部画一个网格将培养板分成4个象限。
[0230]
b.使用无菌一次性镊子,将一个3x 3mm至5x 5mm的组织放入每个孔中。如果使用60mm组织培养皿,则将组织放入每个象限的中间以保持组织分开(彼此相距超过1cm)。
[0231]
c.向每个孔中加入3ml ptt-6。
[0232]
d.使用连接到30ml注射器的吸液针,吸取足够的培养基以勉强覆盖组织。不要使板倾斜。不要用吸液针接触孔底。
[0233]
e.使用倒置光学显微镜,每天观察细胞生长晕(24
±
6小时)。可以使用实时细胞培养成像系统代替光学显微镜。
[0234]
f.每天更换培养基。在使用前确保将所述培养基平衡至室温。
[0235]
i.吸掉所述培养基。
[0236]
ii.加入3ml ptt-6。
[0237]
iii.抽吸直至组织几乎浸没在培养基中。
[0238]
g.当观察到自组织中的细胞向外生长时,则采用上述如4.a至4.e相同的程序将所述组织移植到一个新的6孔板中,不同的是在板上标记“向外生长2”。通过向每个孔中加入2ml ptt6来维持“向外生长1”板中的细胞生长晕。每天观察融合情况。每2-3天更换培养基(在使用前确保将所述培养基平衡至室温)。
[0239]
h.当在“向外生长2”板中观察到细胞生长晕时,重复步骤4.a至4.e,不同的是在板上标记“向外生长3”。通过向每个孔中加入2ml ptt-6来维持“向外生长2”板中的细胞生长晕。每天观察融合情况。每2-3天更换培养基(在使用前确保将所述培养基平衡至室温)。
[0240]
i.当在“向外生长3”板中观察到生长晕时,弃去组织。如果组织非常小且似乎不干扰细胞生长,则在传代培养时再处置该组织。
[0241]
j.当细胞达到40-50%融合,每天观察细胞以防止过度扩增。
[0242]
k.当细胞达到70-80%融合,使细胞传代培养。不要让细胞扩增到超过80%融合。
[0243]
在组织分离块的尺寸为约1-3mm的情况下,并且组织分离块法/细胞培养在175平方毫米的培养皿中进行,从分离块收获的间充质干细胞的平均数量通常为约4,000-6,000个细胞/分离块。由此,当间充质干细胞同时自48个分离块长出时,在收获时可以获得约300,000个细胞。然后,通过将这300,000个细胞按照下文实施例2.5中所述接种在175cm
2
细胞培养瓶中(这可以称为第1代),将从分离块收集的这300,000个间充质干细胞用于传代培养。然后可以将从该第1代获得的间充质干细胞再次接种在175cm
2
细胞培养瓶中(第2代)并按照下文实施例2.5中所述扩增细胞。从第1代和第2代获得的细胞可以通过冷冻保存成为
“
库”,其中将第2代之后获得的间充质干细胞看作代表主细胞库,其将用于例如在如下实施例2.7中描述的生物反应器中进一步扩增间充质干细胞。
[0244]
2.5.在细胞培养皿中传代培养msc
[0245]
a.在生物安全柜中工作时进行存在颗粒计数。在使用前,将全部培养基平衡至室温。
[0246]
b.当细胞生长晕达到约70-80%融合时,传代培养细胞。
[0247]
i.自培养皿中移除ptt-6。
[0248]
ii.用不含钙或镁的hbss漂洗。
[0249]
iii.加入0.2ml 1x tryple-edta并旋转1-2分钟。
[0250]
iv.将培养皿倾斜30-45
°
,使细胞通过重力流向下移动。在板的侧面轻轻敲击加速分离。
[0251]
v.加入1ml ptt-6。轻轻上下移液,然后将细胞转移到15ml离心管中。每个孔使用干净的移液管头。可以将来自所有6个孔的细胞合并到单个15ml管中。
[0252]
vi.以1200rpm离心10分钟。
[0253]
vii.移除上清液并将细胞用5ml ptt-6重悬浮。
[0254]
c.传代培养msc。
[0255]
i.等分50μl的细胞悬浮液,并分析tnc和通过台盼蓝拒染测定(trypan blue exclusion assay)分析存活率。
[0256]
ii.使用血细胞计数器对细胞计数。预计计数20-100个细胞/平方。如果计数高于100,则将原始样品以1:5稀释,并使用血细胞计数器重复台盼蓝法。
[0257]
iii.计算存活细胞/ml以及总存活细胞:
[0258]
1、存活细胞/ml=存活细胞计数
×
稀释因子
×
10
4
[0259]
2、总存活细胞=存活细胞计数
×
稀释因子
×
总体积
×
10
4
[0260]
iv.计算%存活率:
[0261]
1、%存活率=存活细胞计数
×
100/(存活细胞计数+死亡细胞计数)
[0262]
v.将细胞悬浮液稀释至1.0
×
10
6
个细胞/ml
[0263]
1、“x”体积=总存活细胞/10
6
个细胞/ml
[0264]
2、例如,如果总存活细胞个数为1.0
×
10
7
;
[0265]
3、“x”=10
7
/10
6
个细胞/ml或10ml,因此,通过向细胞悬浮液(即5ml)中加入5ml,可以使总细胞体积达到10ml。
[0266]
vi.如果细胞悬浮液小于10
6
/ml,则确定每个150mm培养皿或175cm
2
瓶中接种2
×
10
6
个细胞所需的体积。
[0267]
1、2
×
10
6
个细胞所需的体积=2
×
10
6
个细胞
÷
存活细胞/ml
[0268]
2、例如,如果存活细胞/ml为8
×
10
5
个细胞/ml,则需要2
×
10
6
个细胞
÷
8
×
10
5
个细胞/ml或2.5ml。
[0269]
vii.留出0.5ml用于msc标记物分析。
[0270]
viii.在具有30ml ptt-6的每个150mm培养皿或175cm
2
瓶中接种2
×
10
6
个细胞。
[0271]
ix.每三天观察细胞的贴壁、集落形成和融合。当细胞达到40-50%融合时,每1-2天观察细胞以防止过度扩增。不要让细胞扩增到超过80%融合。可以使用实时细胞培养监
测系统代替光学显微镜。
[0272]
x.每2-3天更换培养基。
[0273]
2.6冷冻保存msc细胞
[0274]
a.在生物安全柜中工作时进行存在颗粒计数。
[0275]
b.当细胞达到70-80%融合时,对每个150mm培养皿或175cm
2
瓶使用2ml 1x tryple-edta以分离细胞。
[0276]
i.自培养皿中移除ptt-6。
[0277]
ii.用5ml不含钙或镁的hbss或pbs洗涤。
[0278]
iii.加入2ml 1x tryple-edta并旋转1-2分钟。
[0279]
iv.将培养皿倾斜30-45
°
,使细胞通过重力流向下移动。在培养皿的侧面轻轻敲击帮助加速分离。
[0280]
v.加入10ml ptt-6使tryple失活。充分混合使细胞团块分离。
[0281]
vi.采用pasteur移液管将细胞转移至15ml离心管中。
[0282]
vii.以1200rpm离心10分钟。
[0283]
viii.吸取培养基并用10ml ptt-6重悬浮。
[0284]
ix.等分50μl,并如上所述测定总存活细胞数和%存活率。由于细胞可能开始形成团块,因此细胞计数需要在15分钟之内完成。
[0285]
c.准备细胞以冷冻保存。
[0286]
i.准备细胞悬浮培养基和冷冻保存培养基,并冷冻细胞
[0287]
2.7.在quantum生物反应器(terumo btc,inc.)中传代培养(扩增)msc
[0288]
也可以采用quantum生物反应器,其可用于使msc扩增。在quantum生物反应器中用于扩增的起始细胞数量应为每次运行的2千万至3千万个细胞。收获时通常每次运行的产量为3亿至7亿msc。按照制造商的说明操作生物反应器。通常将由此获得的间充质干细胞冷冻保存(参见下述)并作为工作细胞库。
[0289]
材料/试剂:
[0290]
1、quantum扩增装置
[0291]
2、quantum废物袋
[0292]
3、quantum培养基袋
[0293]
4、quantum进入袋
[0294]
5、ptt-6
[0295]
6、pbs
[0296]
7、纤连蛋白
[0297]
8、tryple
[0298]
9、3ml注射器
[0299]
10、葡萄糖试纸
[0300]
11、乳酸试纸
[0301]
12、60ml细胞培养板或等同物
[0302]
13、医疗级5%co
2
气体混合物
[0303]
14、50ml combi-tip
[0304]
设备:
[0305]
1、生物安全柜
[0306]
2、血糖仪(bayer healthcare/ascensia contour血糖仪)
[0307]
3、lactate plus(nova biomedical)
[0308]
4、带头部的蠕动泵(peristaltic pump)
[0309]
5、离心机,eppendorf 5810
[0310]
6、无菌管连接器
[0311]
7、m4重复移液器
[0312]
8、rf密封器
[0313]
过程:
[0314]
1、准备quantum生物反应器
[0315]
a)启动quantum生物反应器
[0316]
b)涂布生物反应器:
[0317]
1)在生物安全柜中准备纤连蛋白溶液。
[0318]
1)使冻干的纤连蛋白适应至室温(在室温下≥15min)
[0319]
2)加入5ml无菌蒸馏水;不要旋转或搅动
[0320]
3)使纤连蛋白形成溶液30分钟。
[0321]
4)使用连接有18g针头的10ml注射器,将纤连蛋白溶液转移到含有95ml pbs的细胞进入袋中。
[0322]
2)将袋子连接到“试剂”管线
[0323]
3)检查气泡(可通过使用“移除ic空气”或“移除ec空气”并使用“洗涤”作为进入源来去除气泡。
[0324]
4)打开或设置涂布生物反应器的程序(图1,步骤3-5)。
[0325]
5)运行程序
[0326]
6)当程序运行以涂布生物反应器时,准备具有4l ptt-6培养基的培养基袋。
[0327]
7)使用无菌管连接器将培养基袋连接到ic培养基管线。
[0328]
8)当生物反应器涂布步骤完成时,使用rf密封器分离用于纤连蛋白溶液的细胞进入袋。
[0329]
c)洗掉过量的纤连蛋白
[0330]
d)用培养基调节生物反应器。
[0331]
2、在quantum生物反应器中培养细胞
[0332]
a)用均匀悬浮液(uniform suspension)加载并附着细胞:
[0333]
b)饲养并培养细胞
[0334]
1)选择培养基流速来喂养细胞。
[0335]
2)每天进行乳酸和葡萄糖的采样。
[0336]
3)随着乳酸水平的增加,调节培养基的流速。实际最大耐受乳酸浓度将由细胞来源的培养瓶培养物确定。确定培养基袋中是否有足够的ptt-6培养基。如有必要,用一个新的ptt-6培养基袋替换所述ptt-6培养基袋。
[0337]
4)当流速达到期望值时,每8-12小时测量一次乳酸水平。如果乳酸水平没有下降
或如果乳酸水平继续增加,则收获细胞。
[0338]
3、自quantum生物反应器中收获细胞
[0339]
a)当乳酸浓度没有降低时,最后一次对乳酸和葡萄糖采样后收获细胞。
[0340]
b)收获细胞:
[0341]
1)使用无菌管连接器将装有100ml tryple的细胞进入袋连接到“试剂”管线上。
[0342]
2)确认pbs袋中有足够的pbs。如果没有,使用无菌管连接器将具有至少1.7升pbs的新袋连接到“洗涤”管线。
[0343]
3)运行harvest程序
[0344]
4、冷冻保存细胞
[0345]
1)一旦收获了细胞,将细胞转移到50ml离心管中以沉淀细胞。
[0346]
2)使用25ml冷细胞悬浮液重悬浮。使用sysmex或biorad细胞计数器计数细胞。将细胞计数报告附加到相应的quantum处理批记录。
[0347]
3)将细胞浓度调节至2
×
10
7
/ml
[0348]
4)加入等体积的冷冻保存液并充分混合(不要震荡或涡旋)
[0349]
5)使用重复移液器,向每个1.8ml小瓶中加入1ml在冷冻保存液中的细胞悬浮液。如sop d6.100 cb cryopreservation using controlled rate freezers中所述,使用crf程序冷冻保存。
[0350]
6)将小瓶存放在指定的液氮储存空间中。
[0351]
7)将crf运行报告附加到相应msc p3-quantum处理批记录的表格中。
[0352]
3、采用不同的培养基,分析自脐带组织中分离的间充质脐带衬干细胞群中干细胞标记物的表达
[0353]
进行流式细胞术实验以分析自脐带中分离的间充质干细胞的间充质干细胞标记物cd73、cd90和cd105表达。
[0354]
对于这些实验,通过在三种不同的培养基中培养脐带组织,自所述脐带组织中分离间充质干细胞,然后如实施例2所示,在相应的培养基中使所述间充质干细胞传代培养。
[0355]
在这些实验中,采用了以下三种培养基:a)补充了10%fbs(v/v)的90%(v/v)dmem,b)在美国专利申请2008/0248005和对应的国际专利申请wo 2007/046775中描述的ptt-4培养基,其由90%(v/v)cmrl1066和10%(v/v)fbs组成(参见wo 2007/046775的第[0183]段)和c)本发明的ppt-6培养基,其组成在本文中描述。在该流式细胞术分析中,在所采用的三种培养基的每一种中分析了脐带衬间充质干细胞(clmc)群的两个不同样品。
[0356]
所述流式细胞术分析采用以下规程。
[0357]
材料和方法
[0358]
仪器名称公司名称系列名称bd facs candobdv07300367倒置显微镜,ckx41sfolympus4k40846离心机,微旋转台面型biosan010213-1201-0003
[0359]
试剂清单公司名称产品目录号10x trypsinbiowestx0930-10010x pbslonza17-517q
dmemlonza12-604f胎牛血清ge healthcarea11-151
[0360][0361][0362]
过程:
[0363]
a)从脐带衬膜中分离并培养细胞
[0364]
1、将分离块组织样品在细胞培养板中温育并浸没在相应的培养基中,然后如实施例2中所述将其保持在37℃的co
2
培养箱中。
[0365]
2、每3天更换一次培养基。
[0366]
3、在光学显微镜下监测来自组织培养分离块的细胞向外生长。
[0367]
4、在约70%融合时,通过胰蛋白酶消化(0.0125%胰蛋白酶/0.05%edta)将细胞自培养皿中分离并用于流式细胞术实验。
[0368]
b)用于实验的细胞的胰蛋白酶消化
[0369]
1、自细胞培养板中移除培养基。
[0370]
2、用无菌1x pbs轻轻漂洗以除去痕量的fbs,因为fbs会干扰胰蛋白酶的酶促作用。
[0371]
3、向细胞培养板中加入1x胰蛋白酶并在37℃下温育3-5min。
[0372]
4、在显微镜下观察细胞并确保细胞脱落。通过添加含有fbs的完全培养基(含10%fbs的dmem)中和胰蛋白酶。
[0373]
5、采用移液管通过将培养基中的细胞对着培养板壁抽吸来打破细胞团块。收集细胞悬浮液并将其转移到50ml离心管中
[0374]
6、将无菌1x pbs加入板中并漂洗,将细胞悬浮液收集到相同的离心管中。
[0375]
7、以1800rpm离心10分钟。
[0376]
8、弃去上清液并用pba培养基使细胞团块重新悬浮。
[0377]
c)计数细胞
[0378]
1、确保血细胞计数器及其盖玻片清洁且干燥,优选地,用70%乙醇洗涤并晾干,然后用kim纸巾(无尘纸)擦拭。
[0379]
2、将少量悬浮的细胞等分到微量离心管中,并从bsc罩中取出。
[0380]
3、用等体积的台盼蓝染色悬浮细胞,例如向500μl悬浮液中加入500μl台盼蓝(稀释因子=2x,得到0.2%台盼蓝溶液)。
[0381]
4、由于台盼蓝有毒并且会导致非存活细胞增加,从而得到错误的细胞计数,因此避免将细胞暴露于台盼蓝超过30分钟。
[0382]
5、将20μl细胞悬浮液混合物加入血细胞计数器的每个槽中,并在光学显微镜下观察。
[0383]
a.在血细胞计数器的每个象限中计数存活细胞(明亮细胞;非存活细胞容易吸收台盼蓝,因此呈暗色)的数量,上下槽中总共8个象限。
[0384]
总细胞计数以(平均细胞数量/象限)
×
10
4
个细胞/ml给出。
[0385]
d)染色细胞
[0386]
i.染色细胞前的准备
[0387]
·
将细胞悬浮液一式两份地等分到3个试管中(cd73、cd90、cd105)和2个试管(阴性对照),每个试管含有50,000个细胞。
[0388]
ii.采用一抗(ab)染色
[0389]
·
向100μl细胞悬浮液中加入1μl[0.5mg/ml ab]一抗。在4℃下温育45min。
[0390]
·
使用pba补充至1ml。
[0391]
·
在4℃下以8000rpm离心5min。
[0392]
·
移除上清液。
[0393]
·
加入1ml pba并将团块重悬浮。
[0394]
·
在4℃下以8000rpm离心5min。
[0395]
·
移除上清液。
[0396]
·
重悬浮于100μl pba中。
[0397]
iii.采用二抗ab染色-在黑暗中
[0398]
·
向100μl细胞悬浮液中加入1μl[0.5mg/ml ab]二抗。在4℃下温育30min。
[0399]
·
使用pba补充至1ml。
[0400]
·
在4℃下以8000rpm离心5min。
[0401]
·
移除上清液。
[0402]
·
加入1ml pba并将团块重悬浮。
[0403]
·
在4℃下以8000rpm离心5min。
[0404]
·
移除上清液。
[0405]
·
重悬浮于200-300μl pba中以用于流式细胞术分析。
[0406]
·
将细胞转移至facs管中以在bd facs cando流式细胞仪中读取。
[0407]
流式细胞术分析的结果示于图6a至图6c。图6a示出了在自脐带组织分离并在dmem/10%fbs中培养后,表达干细胞标记物cd73、cd90和cd105的分离的间充质脐带衬干细胞的百分数,图6b示出了在自脐带组织中分离并在ptt-4中培养后,表达干细胞标记物cd73、cd90和cd105的分离的间充质脐带衬干细胞的百分数,和图6c示出了在自脐带组织中分离并在ptt-6中培养后,表达干细胞标记物cd73、cd90和cd105的分离的间充质脐带衬干细胞的百分数。从图6a可以看出,采用dmem/10%fbs作为培养基培养的分离的细胞群具有约75%cd73+细胞、78%cd90+细胞和80%cd105+细胞(两组实验的平均值),而在采用ppt-4
培养基(参见图6b)的脐带组织的分离/培养后,cd73-阳性、cd90-阳性和cd105-阳性的间充质干细胞的数目为约87%(cd73+细胞)、93%(cd90+细胞)和86%(cd105+细胞),为两组实验的平均值。关于全部三种标记物(cd73、cd90、cd105),通过在本发明的ptt-6培养基中的培养获得的间充质干细胞群的纯度为至少99.0%,意味着该细胞群的纯度显著高于采用ppt-4培养基或dmem/10%fbs的培养。此外且甚至更重要的是,通过在ptt-6中的培养获得的间充质干细胞群基本上是100%纯的且定义的干细胞群。这使得本发明的干细胞群成为基于干细胞的疗法的理想候选者。因此,这种间充质脐带衬干细胞群可能成为基于此类干细胞的治疗方法的黄金标准。
[0408]
通过图7a和图7b中所示的流式细胞术分析的结果进一步证实了示于图6中的发现。图7a示出了在自脐带组织中分离并在ppt-6培养基中培养后,表达干细胞标记物cd73、cd90和cd105且缺乏cd34、cd45和hla-dr的表达的分离的间充质脐带衬干细胞(脐带羊膜的间充质干细胞)的百分数。如图7a所示,间充质干细胞群含有97.5%的存活细胞,其中100%表达cd73、cd90和cd105中的每一个(参见“cd73+cd90+”和“cd73+cd105+”行),而干细胞群的99.2%不表达cd45,并且干细胞群的100%不表达cd34和hla-dr(参见“cd34-cd45
-”
和“cd34-hla-dr
-”
行)。因此,通过在ptt-6培养基中培养获得的间充质干细胞群基本上是100%纯的和定义的干细胞群,其符合要用于细胞疗法的间充质干细胞应满足的标准(干细胞群的95%或更多表达cd73、cd90和cd105,而干细胞群的98%或更多缺乏cd34、cd45和hla-dr的表达,参见sensebe等,“production of mesenchymal stromal/stem cells according to good manufacturing practices:a review”,上文)。这里应注意,本发明的羊膜的间充质干细胞在标准培养条件下粘附于塑料并在体外分化为成骨细胞、脂肪细胞和成软骨细胞,参见美国专利9,085,755、美国专利8,287,854或wo2007/046775,因此符合普遍接受的用于细胞疗法的间充质干细胞的标准。
[0409]
图7b示出了表达cd73、cd90和cd105且缺乏cd34、cd45和hla-dr的表达的分离的骨髓间充质干细胞的百分数。如图7b所示,所述骨髓间充质干细胞群含有94.3%的存活细胞,其中100%表达cd73、cd90和cd105中的每一个(参见“cd73+cd90+”和“cd73+cd105+”行),而该骨髓干细胞群的仅62.8%缺乏cd45的表达,并且干细胞群的99.9%缺乏cd34和hla-dr的表达(参见“cd34-cd45
-”
和“cd34-hla-dr
-”
行)。因此,相比于本申请的(脐带的羊膜的)间充质干细胞群,被认为是间充质干细胞的金标准的骨髓间充质干细胞在干细胞标记物方面具有远远更低的同质性/纯度。这一发现也表明本发明的干细胞群可以是基于干细胞的疗法的理想候选者,并且该干细胞群可成为基于干细胞的治疗方法的金标准。
[0410]
4.培养在本发明培养基中分离的间充质干细胞群的创伤愈合标记物蛋白分泌分析
[0411]
基于高度显著的结果(通过在ptt-6中培养获得基本上100%纯的且定义的间充质干细胞群),将各种分离的间充质干细胞群培养在ptt-6中,并分析其与培养在ptt-4培养基(作为参照培养基)中相比的创伤愈合标记物蛋白的分泌。
[0412]
更详细地,分析了以下分离的间充质干细胞群。
[0413]-脐带羊膜间充质干细胞(脐带衬msc/cl-msc)。如wo2007/046775的实施例2所述通过人脐带衬膜的组织分离块分离该种cl-msc群(培养在补充10%胎牛血清的dmem(dmem/10%fbs)中)。
[0414]-华通氏胶的间充质干细胞(wj-msc)。如beeravolu等,“isolation and characterization of mesenchymal stromal cells from human umbilical cord and fetal placenta.”j vis exp.2017;(122):55224所述,通过人脐带的华通氏胶的组织分离块分离该种wj-msc群(培养在具有4,500mg/ml葡萄糖和2mm l-谷氨酰胺并补充10%人血清/fbs和抗生素溶液的dmem中)。
[0415]-源自脂肪-组织的间充质干细胞(at-msc)。如schneider等,“adipose-derived mesenchymal stem cells from liposuction and resected fat are feasible sources for regenerative medicine”eur j med res.2017;22:17所述,通过组织分离块法自腹部整形术后捐赠皮肤组织的脂肪组织中分离该种at-msc群(培养在补充5%青霉素/链霉素和10%fbs的dmem中)。
[0416]-骨髓间充质干细胞(bm-msc)。该种bm-msc群是由ao foundation,davos,switzerland捐赠的。
[0417]-胎盘间充质干细胞(pt-msc)。如beeravolu等,“isolation and characterization of mesenchymal stromal cells from human umbilical cord and fetal placenta.”j vis exp.2017;(122):55224所述,自胎盘中分离该种pt-msc群。
[0418]
培养分离的msc的培养规程
[0419]
·
将各来源的5百万个msc铺在含有dmem/f12/10%fcs的100mm组织培养皿中达24小时。
[0420]
·
将培养基丢弃并添加ptt-6/ptt-4培养24小时。
[0421]
·
丢弃培养基,并以pbs洗涤细胞。
[0422]
·
将10ml dmem添加至培养物中达24小时。
[0423]
·
丢弃培养基,并将5ml dmem添加至培养物。
[0424]
·
在培养24小时之后,收获条件培养基,离心移除细胞碎片,将上清液分样至管中并保存在-80℃下,随后通过细胞因子试验来分析标记物蛋白的分泌。
[0425]
cl-msc、wj-msc、骨髓msc和脂肪msc来源的msc的ptt-6与ptt-4培养基上清液的细胞因子分析
[0426]
在msc上清液中进行细胞因子检测。采用luminex 200和xponent软件实施测量和分析。
[0427]
本实验的目的是测量细胞培养基上清液中多重(pdgf-aa、pdgf-bb、il-10、vegf、ang-1和hgf)、tgfβ1单重和bfgf2单重细胞因子的相对水平。所述上清液为(msc,间充质干细胞;cl,脐带衬;wj,华通氏胶;at,脂肪组织;bm,骨髓):
[0428]
·
在ptt-4中培养的cl-msc
[0429]
·
在ptt-4中培养的wj-msc
[0430]
·
在ptt-4中培养的at-msc
[0431]
·
在ptt-4中培养的bm-msc
[0432]
·
在ptt-6中培养的cl-msc
[0433]
·
在ptt-6中培养的wj-msc
[0434]
·
在ptt-6中培养的at-msc
[0435]
·
在ptt-6中培养的bm-msc
[0436]
除了在6个孔中测试的ptt-4中提供的样品外,每个样品均一式三份(3个孔)进行测试。此外,包括样品cr001a、cr001c、cr001d和cr001g作为阳性对照组,以验证细胞因子试验(来自cr001a、cr001c、cr001d和cr001g的条件培养基不是通过在ptt-6或ptt-4中培养细胞来制备的)。
[0437]
本实验的目的在于,产生在ptt-4或ptt-6中培养的msc的细胞因子概况(profile)并比较不同组织来源(脐带衬、华通氏胶胶、脂肪组织和骨髓)的msc的概况。该种概况将阐明哪些干细胞群在哪种培养基中生长会分泌更多的目的细胞因子以便促进创伤愈合。
[0438]
图8中描述了所有培养板的板设置。所使用的缩写如下:msc,间充质干细胞;cl,脐带衬;wj,华通氏胶;at,脂肪组织;bm,骨髓。
[0439]
多重分析
[0440]
多重信息:
[0441]
r&d系统/bio-techne cat.#lxsahm。该试剂盒为lot#l123680,08/28/18过期,具有以下分析物:
[0442]
·
ang-1,血管生成素
[0443]
·
vegf,血管内皮生长因子
[0444]
·
pdgf-aa,血小板衍生生长因子(pdgf-aa指由a链组成的二硫键连接同二聚体,而pdgf-bb由b同二聚体组成。r&d表明pdgf-bb抗体还检测pdgf-ab异二聚体)
[0445]
·
pdgf-bb
[0446]
·
hgf,肝细胞生长因子
[0447]
·
il-10,白细胞介素-10
[0448]
tgfβ1单重信息:r&d systems/bio-techne):
[0449]
·
基础试剂盒,cat.#ltgm00,lot#p156217,02/27/18收到,08/30/18过期。
[0450]
·
tgfβ1组分,cat.#ltgm100,lot#p161760,02/27/18收到,11/27/19过期。
[0451]
bfgf2单重信息(2018年3月19日使用):ebioscience/thermo:
[0452]
·
基础试剂盒,cat.#epx010-10420-901,lot#172174000,01/31/20过期。
[0453]
·
bfgf2组分,cat.#epx01a-12074-901,lot#169751102,12/31/19过期。
[0454]
bfgf2单重信息(2018年3月22日使用):ebioscience/thermo:
[0455]
·
基础试剂盒,cat.#epx010-10420-901,lot#172174000,01/31/20过期。
[0456]
·
bfgf2组分,cat.#epx01a-12074-901,lot#166916102,12/31/19过期。
[0457]
多重信息:
[0458]
r&d系统/bio-techne cat.#lxsahm。该试剂盒为lot#l123999,09/25/18过期,具有以下分析物:
[0459]
·
ang-1,血管生成素
[0460]
·
vegf,血管内皮生长因子
[0461]
·
pdgf-aa,血小板衍生生长因子2
[0462]
·
pdgf-bb
[0463]
·
hgf,肝细胞生长因子
[0464]
·
il-10,白细胞介素-10
[0465]
·
bfgf,碱性成纤维细胞生长因子
[0466]
数据输入
[0467]
原始数据输出为pdf和excel格式。excel格式的数据用于处理数据。
[0468]
程序
[0469]
根据详细的规程信息在msc上清液中进行细胞因子检测。作为此实验的一部分,本规程有一修正:不再使用多重试剂盒中的std.8。停止使用std.8的原因在于,r&d系统规程本身仅使用标准品1至6。此外,在clinimmune处对构成该多重的6个分析物中的仅2个验证了std.8:pdgf-bb与hgf。在pdgf-bb的情况下,在上清液中从未检测到该分析物。在hgf的情况下,分析物落在标准曲线的中间区域。由于标准品使用生长培养基重构,以ptt-6和ptt-4二者构建标准曲线。从相应的标准曲线推测生长在ptt-6或ptt-4中的测试样本。
[0470]
通过luminex软件基于分析物特异性标准曲线推测结果,该曲线由同一软件产生:将分析算法设置为具有加权分析的logistic 5p weighted,其中以1/y2进行加权。
[0471]
样品
[0472]
1、ptt-4和ptt-6培养基(未暴露于msc)
[0473]
2、待测msc的上清液
[0474]
3、任选:来自不同捐赠者的cl-msc的上清液;cr001a、c、d以及g。
[0475]
实验结果概述
[0476]
tgfβ1单重分析
[0477]
·
使用等分试样3的1-如图9所示。所有误差线均为三次测量的标准偏差。
[0478]
图9:tgfβ1的单重测量。可以看出,培养物cl-msc和wj-msc在ptt-6中生长时比在ptt-4中生长时产生更多的tgfβ1。当在ptt-6或ptt-4中生长时,只有at-msc和bm-msc培养物产生大约相等量的tgfβ1。所有误差线均为三次测量的标准偏差。
[0479]
第一次多重分析
[0480]
·
使用等分试样3的1。
[0481]
·
在所有样品中均未检测到pdgf-bb和il-10。
[0482]
数据描绘于图10和11。
[0483]
图10:图10a为pdgf-aa的多重测量。可以看出,培养物cl-msc、wj-msc、at-msc和bm-msc培养物在ptt-4中生长时比在ptt-6中生长时产生更多的pdgf-aa。所有误差线均为三次测量的标准偏差。图10b为vegf的多重测量。可以看出,培养物cl-msc、wj-msc、at-msc和bm-msc培养物在ptt-6中生长时比在ptt-4中生长时产生更多的vegf。所有误差线均为三次测量的标准偏差。图10c为ang-1的多重测量。可以看出,培养物cl-msc和wj-msc培养物在ptt-6中生长时比在ptt-4中生长时产生更多的ang-1。培养物at-msc和bm-msc基本上不产生任何ang-1。所有误差线均为三次测量的标准偏差。
[0484]
图11:hgf的多重测量。可以看出,培养物cl-msc和wj-msc培养物在ptt-6中生长时比在ptt-4中生长时产生多得多的hgf。培养物at-msc和bm-msc基本上不产生任何hgf。所有误差线均为三次测量的标准偏差。
[0485]
多重分析(包括bfgf)
[0486]
·
使用等分试样3的3。数据示于图12-14。
[0487]
图12:pdgf-aa的多重测量。可以看出,培养物cl-msc和wj-msc培养物在ptt-4中生长时比在ptt-6中生长时产生更多的pdgf-aa。培养物at-msc和bm-msc在两种培养基中产生
等量的pdgf-aa。所有误差线均为三次测量的标准偏差。
[0488]
图13:图13a为vegf的多重测量。可以看出,培养物cl-msc、wj-msc、at-msc和bm-msc培养物在ptt-6中生长时比在ptt-4中生长时产生更多的vegf。所有误差线均为三次测量的标准偏差。图13b为ang-1多重分析的多重测量。可以看出,培养物cl-msc和wj-msc培养物在ptt-6中生长时比在ptt-4中生长时产生多得多的ang-1。培养物at-msc和bm-msc基本上不产生任何ang-1。所有误差线均为三次测量的标准偏差。图13c为hgf的多重测量。可以看出,培养物cl-msc和wj-msc培养物在ptt-6中生长时比在ptt-4中生长时产生多得多的hgf。培养物at-msc和bm-msc基本上不产生任何hgf。所有误差线均为三次测量的标准偏差。
[0489]
图14:bfgf的多重测量。可以看出,培养物cl-msc和wj-msc培养物在ptt-6中生长时比在ptt-4中生长时产生更多的bfgf。培养物at-msc和bm-msc在ptt-4和ptt-6中培养时产生等量的bfgf。所有误差线均为三次测量的标准偏差。
[0490]
·
应注意,bfgf样本的丰度非常低,处于或接近检测下限。
[0491]
图15至图21描述了不同实验中获得的数据的概况。
[0492]
图15:汇总了5个不同实验(170328、170804、170814、180105、180226)的tgfβ1测量。各实验测量的tgfβ标准曲线的平均荧光强度(mfi)描绘在下方左侧小图中。上方小图中示出了在ptt-4和ptt-6培养基中获得的tgfβ标准曲线的mfi。下方右侧小图描绘了培养物cl-msc和wj-msc在ptt-6中生长时比在ptt-4中生长时产生更多的tgfβ1。at-msc和bm-msc培养物在ptt-6或ptt-4中生长时产生等量的tgfβ1。所有误差线均为来自针对实验170328、170804、170814、180105、180226的不同测量值的标准偏差。
[0493]
图16:汇总了6个不同实验(170602、170511、170414、170224、180105、180226)的ang-1测量。各实验测量的ang-1标准曲线的平均荧光强度(mfi)描绘在下方左侧小图中。上方小图中示出了在ptt-4和ptt-6培养基中获得的ang-1标准曲线的mfi。下方右侧小图描绘了培养物cl-msc和wj-msc在ptt-6中生长时比在ptt-4中生长时产生更多的ang-1。当在ptt-6或ptt-4中生长时,只有at-msc和bm-msc培养物产生基本相等量的ang-1。所有误差线均为来自针对实验170602、170511、170414、170224、180105、180226的不同测量值的标准偏差。
[0494]
图17:汇总了6个不同实验(170602、170511、170414、170224、180105、180226)的pdgf-bb测量。各实验测量的pdgf-bb标准曲线的平均荧光强度(mfi)描绘在下方左侧小图中。上方小图中示出了在ptt-4和ptt-6培养基中获得的pdgf-bb标准曲线的mfi。值得注意的是,在所有实验中均未检测到pdgf-bb。
[0495]
图18:汇总了6个不同实验(170602、170511、170414、170224、180105、180226)的pdgf-aa测量。各实验测量的pdgf-aa标准曲线的平均荧光强度(mfi)描绘在下方左侧小图中。上方小图中示出了在ptt-4和ptt-6培养基中获得的pdgf-aa标准曲线的mfi。下方右侧小图描绘了培养物cl-msc、at-msc和bm-msc以及wj-msc培养物在ptt-4中生长时比在ptt-6中生长时产生略多的pdgf-aa。所有误差线均为来自实验170602、170511、170414、170224、180105、180226的测量值的标准偏差。
[0496]
图19:汇总了6个不同实验(170602、170511、170414、170224、180105、180226)的il-10测量。各实验测量的il-10标准曲线的平均荧光强度(mfi)描绘在下方左侧小图中。上方小图中示出了在ptt-4和ptt-6培养基中获得的il-10标准曲线的mfi。值得注意的是,在
所有实验中均未检测到il-10。
[0497]
图20:汇总了6个不同实验(170602、170511、170414、170224、180105、180226)的vegf测量。各实验测量的vegf标准曲线的平均荧光强度(mfi)描绘在下方左侧小图中。上方小图中示出了在ptt-4和ptt-6培养基中获得的vegf标准曲线的mfi。下方右侧小图描绘了培养物cl-msc、at-msc和bm-msc以及wj-msc在ptt-6中生长时比在ptt-4中生长时产生更多的vegf。所有误差线均为来自实验170602、170511、170414、170224、180105、180226的不同测量值的标准偏差。
[0498]
图21:汇总了6个不同实验(170602、170511、170414、170224、180105、180226)的hgf测量。各实验测量的hgf标准曲线的平均荧光强度(mfi)描绘在下方左侧小图中。上方小图中示出了在ptt-4和ptt-6培养基中获得的hgf标准曲线的mfi。下方右侧小图描绘了培养物cl-msc和wj-msc在ptt-6中生长时比在ptt-4中生长时产生更多的hgf。另一方面,培养物at-msc和bm-msc未如其它培养物一样产生那么多的hgf。所有误差线均为来自实验170602、170511、170414、170224、180105、180226的不同测量值的标准偏差。
[0499]
cl-msc、wj-msc和胎盘msc来源的msc的ptt-6与ptt-4培养基或dmem/f12上清液的细胞因子分析
[0500]
在msc上清中进行细胞因子检测。如上所述进行了测量和分析。
[0501]
本实验的目的是测量细胞培养基上清液中多重(pdgf-aa、pdgf-bb、il-10、vegf、ang-1和hgf)、tgfβ1单重和bfgf2单重细胞因子的相对水平。所述上清液从来自脐带衬(cl)、来自华通氏胶(wj)和来自胎盘的间充质干细胞获得。所述间充质干细胞培养在ptt-6、ppt-4或dmem/f12培养基中。
[0502]
·
在ptt-4中培养的cl-msc
[0503]
·
在ptt-4中培养的wj-msc
[0504]
·
在ptt-4中培养的胎盘msc
[0505]
·
在ptt-6中培养的cl-msc
[0506]
·
在ptt-6中培养的wj-msc
[0507]
·
在ptt-6中培养的胎盘msc
[0508]
·
在dmem/f12中培养的cl-msc
[0509]
·
在dmem/f12中培养的wj-msc
[0510]
除了胎盘的上清液样品外,所有样品均一式三份进行测试。本实验的目的在于,产生在ptt-4或ptt-6中培养的msc的细胞因子概况(profile)并比较不同组织来源(脐带衬vs.华通氏胶胶vs.胎盘msc)的msc的概况。如上所述进行细胞因子的测量。该种概况将阐明哪些干细胞群在哪种培养基中生长会分泌更多的目的细胞因子以便促进创伤愈合。
[0511]
图22:tgfβ1的单重测量。各实验测量的tgfβ1标准曲线的平均荧光强度(mfi)描绘在左侧小图中。从右侧小图可以看出,全部cl-msc、wj-msc和胎盘msc在ptt-6中生长时比在ptt-4或dmem/f12(在图22中仅称为dmem)中生长时产生更多的tgfβ1。
[0512]
图23:汇总了所分析的在ptt-6、ptt-4或dmem/f12中培养的cl-msc、wj-msc和胎盘msc的上清液中pdgf-bb的测量。各实验测量的pdgf-bb标准曲线的平均荧光强度(mfi)描绘在左侧小图中。值得注意的是,在所有实验中均未检测到pdgf-bb。
[0513]
图24:汇总了所分析的在ptt-6、ptt-4或dmem/f12中培养的cl-msc、wj-msc和胎盘
msc的上清液中il-10的测量。各实验测量的vegf标准曲线的平均荧光强度(mfi)描绘在左侧小图中。s6表示测定中使用的最低标准。任何低于此的样品均被视为低于检测限。从右侧小图可以看出,当在ptt-6中生长时,所有cl-msc、wj-msc和胎盘msc均产生可检测水平的il-10,而当msc在ptt-4或dmem/f12中生长时,则检测到很少或检测不到il-10。
[0514]
图25:汇总了所分析的在ptt-6、ptt-4或dmem/f12中培养的cl-msc、wj-msc和胎盘msc的上清液中vegf的测量。各实验测量的vegf标准曲线的平均荧光强度(mfi)描绘在左侧小图中。s1表示测定中使用的最高标准。任何高于此的样品均被视为是推测的(过浓)。从右侧小图可以看出,与msc在ptt-4或dmem/f12中生长时相比,所有cl-msc、wj-msc和胎盘msc在ptt-6中生长时均产生水平高得多的vegf。
[0515]
图26:汇总了bfgf的多重测量。各实验测量的pdgf-aa标准曲线的平均荧光强度(mfi)描绘在左侧小图中。从右侧小图可以看出,培养的cl-msc和wj-msc在ptt-6中生长时比在ptt-4中生长时产生更多的bfgf。可以看出,与msc在ptt-4或dmem/f12中生长时相比,所有cl-msc、wj-msc和胎盘msc在ptt-6中生长时产生水平低得多的bfgf。
[0516]
图27:汇总了pdgf-aa的测量。各实验测量的pdgf-aa标准曲线的平均荧光强度(mfi)描绘在左侧小图中。s6表示测定中使用的最低标准。任何低于此的样品均被视为低于检测限。可以看出,与msc在ptt-4或dmem/f12中生长时相比,所有cl-msc、wj-msc和胎盘msc在ptt-6中生长时产生更高水平的pdgf-as。
[0517]
图28:汇总了ang-1的测量。各实验测量的ang-1标准曲线的平均荧光强度(mfi)描绘在左侧小图中。s1表示测定中使用的最高标准。任何高于此的样品均被视为是推测的(过浓)。右侧小图描绘了,与msc在ptt-4或dmem/f12中生长时相比,所有cl-msc、wj-msc和胎盘msc在ptt-6中生长时均产生水平高得多的ang-1。
[0518]
图29:汇总了hgf的测量。各实验测量的hgf标准曲线的平均荧光强度(mfi)描绘在左侧小图中。右侧小图描绘了,与msc在ptt-4或dmem/f12中生长时相比,所有cl-msc、wj-msc和胎盘msc在ptt-6中生长时均产生水平高得多的ang-1。
[0519]
从上述实验中可以得出以下结论。当将间充质干细胞(特别是自脐带隔室分离的或自胎盘分离的间充质干细胞)培养在ptt-6培养基中时,所述间充质干细胞群与它们在ptt-4培养基或商购可获得的培养基(比如dmem/f12)中的产量水平相比,分泌的因子血管生成素(ang-1)、tgf-β1、vegf和hgf显著增加。值得注意的是,ptt-6培养基能够增加这些因子的产量/分泌,而与间充质干细胞群的天然环境/隔室无关。
[0520]
由于ptt-6培养基致使间充质干细胞群分泌所有ang-1、tgf-β1、vegf和hgf(如本文所讨论地,它们参与创伤愈合是已知的)分泌,很明显,ptt-6培养基具有诱导或改善广泛的间充质干细胞群的创伤愈合性质的作用,而与所述间充质干细胞的原始来源的间充质干细胞群的天然环境/隔室无关-在此还注意到,实验4采用在培养在ptt-6之前已经自其天然环境中分离的细胞群进行。
[0521]
此外,通过组织分离块法在ptt-6中间充质干细胞的培养提供了一种高度同质的脐带羊膜的间充质干细胞群(其含有97.5%活细胞,其中100%表达cd73、cd90和cd105中的每一个,而所述干细胞群的99.2%不表达cd45,并且干细胞群的100%不表达cd34和hla-dr(参见“cd34-cd45
-”
和“cd34-hla-dr
-”
行))。由于在ptt-6中华通氏胶的间充质干细胞群的培养对细胞因子ang-1、tgf-β1、vegf和hgf的产量具有阳性作用,该种阳性作用与其在脐带
衬干细胞中对这些细胞因子的阳性作用相同,因此可以预期在ptt-6中培养华通氏胶也会得到此类高度同质的间充质华通氏胶干细胞群。因此,还可以预期,脐带的其它隔室的组织分离块法(比如脐带血管的培养)将得到类似同质性的血管周的(pv)间充质干细胞群。同样地,通过在ptt-6中培养的胎盘组织的组织分离块(包括胎盘羊膜)可预期可产生类似同质性的胎盘间充质干细胞群。因此,本发明提供一普遍适用的方法以获得间充质干细胞群,其中所述分离的间充质干细胞群的至少约91%或更多、约92%或更多、约93%或更多、约94%或更多、约95%或更多、约96%或更多、约97%或更多、约98%或更多或约99%或更多表达cd73、cd90和cd105中的每一个且缺乏cd34、cd45和hla-dr中的每一个的表达。
[0522]
本发明的特征还在于以下项目。
[0523]
1、一种诱导或改善间充质干细胞群的创伤愈合性质的方法,所述方法包括在培养基中培养所述间充质干细胞群,所述培养基包含dmem(杜尔贝科改良伊格尔培养基)、f12(哈姆f12培养基)、m171(培养基171)和fbs(胎牛血清)。
[0524]
2、根据项目1所述的方法,其中所述间充质干细胞群选自脐带间充质干细胞群、胎盘间充质干细胞群、脐带-胎盘连接处的间充质干细胞群、脐带血间充质干细胞群、骨髓间充质干细胞群以及源自脂肪-组织的间充质干细胞群。
[0525]
3、根据项目2所述的方法,其中所述脐带间充质干细胞群选自羊膜(am)间充质干细胞群、血管周的(pv)间充质干细胞群、华通氏胶(wj)间充质干细胞群、脐带羊膜间充质干细胞群和脐带混合(mc)间充质干细胞群。
[0526]
4、根据项目1至3中任一项所述的方法,其中所述培养基包含终浓度为约55至65%(v/v)的dmem,终浓度为约5至15%(v/v)的f12,终浓度为约15至30%(v/v)的m171和终浓度为约1至8%(v/v)的fbs。
[0527]
5、根据项目4所述的方法,其中所述培养基包含终浓度为约57.5至62.5%(v/v)的dmem,终浓度为约7.5至12.5%(v/v)的f12,终浓度为约17.5至25.0%(v/v)的m171和终浓度为约1.75至3.5%(v/v)的fbs。
[0528]
6、根据项目5所述的方法,其中所述培养基包含终浓度为约61.8%(v/v)的dmem,终浓度为约11.8%(v/v)的f12,终浓度为约23.6%(v/v)的m171和终浓度为约2.5%(v/v)的fbs。
[0529]
7、根据项目1至6中任一项所述的方法,其中所述培养基进一步包含终浓度为约1ng/ml至约20ng/ml的表皮生长因子(egf)。
[0530]
8、根据项目7所述的方法,其中所述培养基包含终浓度为约10ng/ml的egf。
[0531]
9、根据项目1至8中任一项所述的方法,其中所述培养基包含终浓度为约1μg/ml至10μg/ml的胰岛素。
[0532]
10、根据项目9所述的方法,其中所述培养基包含终浓度为约5μg/ml的胰岛素。
[0533]
11、根据项目1至10中任一项所述的方法,其中所述培养基进一步包含以下补充物中的至少一种:腺嘌呤、氢化可的松和3,3
’
,5-三碘-l-甲状腺原氨酸钠盐(t3)。
[0534]
12、根据项目1至11中任一项所述的方法,其中所述培养基包含腺嘌呤、氢化可的松和3,3
’
,5-三碘-l-甲状腺原氨酸钠盐(t3)中的全部三种。
[0535]
13、根据项目12或13所述的方法,其中所述培养基以约0.01至约0.1μg/ml腺嘌呤的终浓度包含腺嘌呤,以约0.1至约10μg/ml氢化可的松的终浓度包含氢化可的松,和/或以
约0.5至约5ng/ml的终浓度包含3,3
’
,5-三碘-l-甲状腺原氨酸钠盐(t3)。
[0536]
14、根据项目1至13中任一项所述的方法,其中相对于不包含全部dmem(杜尔贝科改良伊格尔培养基)、f12(哈姆f12培养基)、m171(培养基171)和fbs(胎牛血清)的参照培养基,在如前述项目1至13中任一项所述的培养基中培养所述间充质干细胞群导致由所述间充质干细胞群表达和/或分泌的血管生成素1(ang-1)、tgf-β(特别是tgf-β1)、vegf和hgf中的至少一种增加。
[0537]
15、根据项目14所述的方法,其中所述参照培养基由90%(v/v)cmrl1066和10%(v/v)fbs组成。
[0538]
16、根据前述项目中任一项所述的方法,其中在在如前述项目1至13中任一项所述的培养基中培养之前,已经将所述间充质干细胞群从其天然环境中分离。
[0539]
17、根据项目1至15中任一项所述的方法,其包括通过在如前述项目1至13中任一项所述的细胞培养基中培养天然组织从天然组织环境中分离所述间充质干细胞群。
[0540]
18、根据项目17所述的方法,其中所述组织为脐带组织。
[0541]
19、根据项目18所述的方法,其中所述脐带组织选自整个脐带组织、包含脐带羊膜的组织、包含华通氏胶的组织、包含羊膜的组织、羊膜和华通氏胶、分离的脐带血管、与脐带组织的其它组分分离的华通氏胶和分离的脐带羊膜。
[0542]
20、根据项目17所述的方法,其中所述组织包含或为胎盘羊膜组织。
[0543]
21、根据前述项目17至20中任一项所述的方法,其中所述脐带组织为整个脐带的一部分、脐带羊膜的一部分或胎盘羊膜的一部分。
[0544]
22、根据项目19至22中任一项所述的方法,其包括培养所述脐带组织或所述胎盘羊膜组织直至所述羊膜间充质干细胞群的细胞生长晕达到约70-80%融合。
[0545]
23、根据项目22所述的方法,其包括自用于所述培养的培养容器中移除所述间充质干细胞群。
[0546]
24、根据项目23所述的方法,其中通过酶处理进行自所述培养容器中移除所述间充质干细胞群。
[0547]
25、根据项目24所述的方法,其中所述酶处理包括胰蛋白酶消化。
[0548]
26、根据项目23至25中任一项所述的方法,其中将所述间充质干细胞群转移至用于传代培养的培养容器中以传代培养。
[0549]
27、根据项目1至16中任一项所述的方法,其中将所述间充质干细胞群转移至用于传代培养的培养容器中以培养。
[0550]
28、根据项目26或27所述的方法,其中所述间充质细胞群以1.0x 10
6
个细胞/ml的浓度悬浮以培养或传代培养。
[0551]
29、根据项目28所述的方法,其中在如项目1至13中任一项所述的培养基中传代培养所述间充质干细胞群。
[0552]
30、根据项目29所述的方法,其中传代培养所述间充质干细胞群直至所述间充质干细胞达到约70-80%融合。
[0553]
31、根据项目26至30中任一项所述的方法,其中所述培养或传代培养在自给式生物反应器中进行。
[0554]
32、根据项目31所述的方法,其中所述生物反应器选自平行板生物反应器、中空纤
维生物反应器和微流控生物反应器。
[0555]
33、根据前述项目中任一项所述的方法,其中在37℃的温度下于co
2
细胞培养箱中进行培养。
[0556]
34、根据项目33所述的方法,其包括自用于所述(传代)培养的培养容器中移除所述间充质干细胞群。
[0557]
35、根据项目34所述的方法,其中通过酶处理进行自所述培养容器中移除所述间充质干细胞群。
[0558]
36、根据项目35所述的方法,其中所述酶处理包括胰蛋白酶消化。
[0559]
37、根据项目36所述的方法,其进一步包括收集分离的间充质干细胞群。
[0560]
38、根据前述项目中任一项所述的方法,其中所述分离的间充质干细胞的至少约90%或更多、约91%或更多、约92%或更多、约93%或更多、约94%或更多、约95%或更多、约96%或更多、约97%或更多、约98%或更多、约99%或更多表达以下标记物:cd73、cd90和cd105。
[0561]
39、根据前述项目中任一项所述的方法,其中所述分离的间充质干细胞的至少约90%或更多、约91%或更多、约92%或更多、约93%或更多、约94%或更多、约95%或更多、约96%或更多、约97%或更多、约98%或更多、约99%或更多缺乏以下标记物的表达:cd34、cd45和hla-dr(人类白细胞抗原-抗原d相关的)。
[0562]
40、根据项目38或39中任一项所述的方法,其中所述分离的间充质干细胞的约97%或更多、约98%或更多、约99%或更多表达cd73、cd90和cd105且缺乏cd34、cd45和hla-dr的表达。
[0563]
41、根据前述项目中任一项所述的方法,其进一步包括保存所述分离的干细胞/祖细胞群以进一步使用。
[0564]
42、根据项目41所述的方法,其中通过冷冻保存进行保存。
[0565]
43、一种分离的间充质干细胞群,其中所述干细胞群的至少约90%或更多的细胞表达以下标记物中的每一个:cd73、cd90和cd105。
[0566]
44、根据项目43所述的间充质干细胞群,其中所述干细胞群的至少约90%或更多的细胞缺乏以下标记物的表达:cd34、cd45和hla-dr。
[0567]
45、根据项目44所述的间充质干细胞群,其中所述分离的间充质干细胞群的至少约91%或更多、约92%或更多、约93%或更多、约94%或更多、约95%或更多、约96%或更多、约97%或更多、约98%或更多、约99%或更多的细胞表达cd73、cd90和cd105中的每一个且缺乏cd34、cd45和hla-dr中的每一个的表达。
[0568]
46、根据项目43至45中任一项所述的间充质干细胞群,其中所述间充质干细胞群选自脐带间充质干细胞群、胎盘间充质干细胞群、脐带血间充质干细胞群、骨髓间充质干细胞群以及源自脂肪-组织的间充质干细胞群。
[0569]
47、根据项目43至46中任一项所述的间充质干细胞群,其中所述脐带间充质干细胞群选自羊膜(am)间充质干细胞群、血管周的(pv)间充质干细胞群、华通氏胶(wj)间充质干细胞群、脐带羊膜间充质干细胞群和脐带混合(mc)间充质干细胞群。
[0570]
48、根据项目43至47中任一项所述的间充质干细胞群,其中通过项目1至42中任一项所述的方法能够获得所述群。
[0571]
49、根据项目43至48中任一项所述的间充质干细胞群,其中通过项目1至42中任一项所述的方法获得所述群。
[0572]
50、一种药物组合物,其包含项目43至47中任一项所述的分离的间充质干细胞群,其中所述干细胞群的至少约90%或更多的细胞表达以下标记物中的每一个:cd73、cd90和cd105,且缺乏以下标记物中的每一个的表达:cd34、cd45和hla-dr。
[0573]
51、根据项目50所述的药物组合物,其中所述药物组合物适于全身或局部应用。
[0574]
52、根据项目50或51所述的药物组合物,其进一步包含药学上可接受的赋形剂。
[0575]
53、一种制备适用于诱导或改善间充质干细胞群的创伤愈合性质的培养基的方法,所述方法包括将以下混合以获得终体积为500ml的培养基:
[0576]
i.250ml的dmem
[0577]
ii.118ml m171
[0578]
iii.118ml dmem/f12
[0579]
iv.12.5ml胎牛血清(fbs)(终浓度为2.5%)。
[0580]
54、根据项目53所述的方法,其进一步包括添加:
[0581]
v.1ml egf储备液(5μg/ml)以得到10ng/ml的终浓度,
[0582]
vi.胰岛素0.175ml储备液(14.28mg/ml)以得到5μg/ml的终浓度。
[0583]
55、根据项目53或54所述的方法,其进一步包括向dmem中添加以下补充物中的一种或多种:腺嘌呤、氢化可的松、3,3
’
,5-三碘-l-甲状腺原氨酸钠盐(t3),由此得到总体积为500ml的培养基。
[0584]
56、根据项目55所述的方法,其中dmem中所述补充物的终浓度如下:
[0585]
约0.05至0.1μg/ml腺嘌呤,例如约0.025μg/ml腺嘌呤,
[0586]
约1至10μg/ml氢化可的松,
[0587]
约0.5至5ng/ml 3,3
’
,5-三碘-l-甲状腺原氨酸钠盐(t3),例如1.36ng/ml3,3
’
,5-三碘-l-甲状腺原氨酸钠盐(t3)。
[0588]
57、一种通过项目53至56中任一项所述的方法能够获得的细胞培养基。
[0589]
58、一种诱导或改善间充质干细胞群的创伤愈合性质的方法,所述方法包括在通过项目53至56中任一项所述的方法制备的培养基中培养羊膜组织。
[0590]
59、根据项目58所述的方法,其中所述间充质干细胞群选自脐带间充质干细胞群、胎盘间充质干细胞群、脐带血间充质干细胞群、骨髓间充质干细胞群以及源自脂肪-组织的间充质干细胞群。
[0591]
60、根据项目59所述的方法,其中所述脐带间充质干细胞群选自羊膜(am)间充质干细胞群、血管周的(pv)间充质干细胞群、华通氏胶(wj)间充质干细胞群、脐带羊膜间充质干细胞群和脐带混合(mc)间充质干细胞群。
[0592]
61、一种细胞培养基,其包含:
[0593]-终浓度为约55至65%(v/v)的dmem,
[0594]-终浓度为约5至15%(v/v)的f12,
[0595]-终浓度为约15至30%(v/v)的m171和
[0596]-终浓度为约1至8%(v/v)的fbs。
[0597]
62、根据项目61所述的细胞培养基,其中所述细胞培养基包含终浓度为约57.7至
组织的间充质干细胞群。
[0619]
77、根据项目76所述的用途,其中所述脐带间充质干细胞群选自羊膜(am)间充质干细胞群、血管周的(pv)间充质干细胞群、华通氏胶(wj)间充质干细胞群、脐带羊膜间充质干细胞群和脐带混合(mc)间充质干细胞群。
[0620]
78、根据项目74至77中任一项所述的用途,其中所述间充质干细胞群的至少约90%或更多的细胞表达以下标记物中的每一个:cd73、cd90和cd105。
[0621]
79、根据项目78所述的用途,其中所述间充质干细胞群的至少约90%或更多的细胞缺乏以下标记物中的每一个的表达:cd34、cd45和hla-dr。
[0622]
80、根据项目79所述的用途,其中所述分离的间充质干细胞群的至少约91%或更多、约92%或更多、约93%或更多、约94%或更多、约95%或更多、约96%或更多、约97%或更多、约98%或更多、约99%或更多的细胞表达cd73、cd90和cd105中的每一个且缺乏cd34、cd45和hla-dr中的每一个的表达。
[0623]
81、一种药物组合物,其含有ang-1、tgf-β1、vegf或hgf中的三种或四种作为唯一的创伤愈合蛋白。
[0624]
82、根据项目81所述的药物组合物,将其配制为液体或冻干/冷冻干燥制剂。
[0625]
在不脱离本发明范围和精神的情况下,可对本文中公开的本发明进行各种替代和修改对于本领域技术人员是显而易见的。
[0626]
本说明书内所提及的所有专利和公开文本代表了本发明所属领域的普通技术人员的水平。所有专利和公开文本以引用的方式并入本文,引用程度如同每个单独公开文本以引用的方式具体且单独地并入一样。
[0627]
本文中以说明性的方式描述的本发明可在本文中未具体公开的任何一个或多个要素、任何一种或多种限制不存在的情况下实施。因此,例如,术语“包括”、“包含”和“含有”等应广泛地理解,并无限制性。此外,本文采用的术语和表达已用作描述的措辞,并非限制性,并且在使用这些术语和表达时没有排除所示和描述的特征或其部分的任何等同形式的意图,而是认可可以在本发明要求保护的范围内进行各种修改。因而,应该理解,尽管通过优选的实施方案和可选的特征具体公开了本发明,但是本领域技术人员可对本文公开的其中呈现的发明进行修改和改变,这种修改和改变被认为是在本发明的范围内。本文对本发明进行了宽泛和一般性描述。落入一般公开内容内的每一个较窄种类和亚属分组也形成本发明的一部分。在从类别中去除任何主题的前提或负面限制情况下,这包括了本发明的一般性描述,无论删除的内容是否在本文详细说明。此外,在本发明的特征或方面按照马库什组进行描述的情况下,本领域技术人员将认识到,本发明还由此按照马库什组的任何单个成员或成员亚组进行了描述。根据以下的权利要求,本发明的其它实施方案将是显而易见的。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签:
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



