一种指数扩增反应触发3-D双腿DNA步行器的microRNA生物传感器的制作方法
 2021-02-02 10:02:43|
2021-02-02 10:02:43| 300|
300| 起点商标网
起点商标网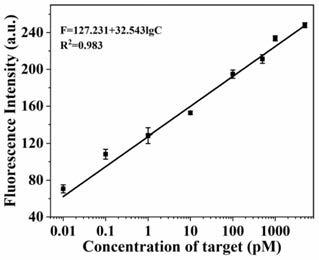
一种指数扩增反应触发3-d双腿dna步行器的microrna生物传感器
技术领域
[0001]
本发明涉及一种生物传感器,特别涉及一种基于指数扩增反应触发的3-d双腿dna步行器用于microrna检测。
背景技术:
[0002]
dna纳米技术在分析化学领域取得了令人瞩目的进步。受自然启发,dna步行器作为dna纳米技术的重要分支,可模拟天然分子步行器,例如动力蛋白,肌球蛋白和驱动蛋白。对于典型的dna步行器,它包含三个基本组件,即步行链,步行轨道和驱动马达。在步行过程中,dna步行器可以沿着不同维度的轨道产生大量信号分子用于信号放大。然而,一维(1-d)轨道和二维(2-d)dna折纸都具有非常有限的持续性和行走空间,这限制了此类dna步行机器的执行能力。为了解决上述问题,研究人员最近在微球或纳米颗粒表面建立了3-d轨道。由于增加了局部有效浓度,因此与1-d和2-d轨道相比,这种3-d轨道可以增加行走步数和提高持续性。同时,研究人员也探索了dna步行器的多种驱动方式。其中,采用高活性核酸工具酶具有卓越的能力。一方面,这归因于酶的天然高催化能力。另一方面,由于颗粒内的相互作用和局部底物浓度的增加,颗粒的生物催化作用可加速酶促反应。
[0003]
值得注意的是,上述的dna步行器将一个摆臂链固定在纳米颗粒的表面,这限制了dna步行器的运动范围和效率。此外,在同一个微球或纳米颗粒表面上构建两种不同的探针,由于摆臂链的占据,不仅减少了轨道dna的局部浓度,还增加了制造不同浓度比的多个dna探针的难度。为了解决这个问题,研究者提出了双腿dna步行器策略以提高步行效率。例如,有研究小组开发了一种自下而上的方法来组装能够探测和控制aunps生物纳米界面上的动态相互作用的双腿dna步行器。这种方法成功地为双腿dna步行器的设计提供了更好的理解。
[0004]
除了粒子上的生物催化外,强大的生物识别组件的构建对于3-d dna步行器同样重要。据报道,与粒子上生物识别相比,溶液中的生物识别可以更好地制造,预测,控制和执行。另一方面,靶分子的常规分析仅产生一个dna步行器,从而限制了步行器的总数及其步行效率。因此,需要一种将生物识别和扩增结合在一起的方法。近年来,等温扩增策略已成为核酸、蛋白质和其他分子分析的有力工具。其中,指数扩增反应(expar)由于放大效率高(10
6-10
8
)和操作简单等突出优点,在灵敏传感器的设计中受到关注。通过聚合酶和核酸内切酶的介导,expar可以在短时间内(<30分钟)激活特定引物来扩增大量单链dna(ssdna)。本发明结合了溶液中的expar扩增和微粒子上的酶切反应。expar作为第一个反应在引入目标microrna时触发并且伴随着大量ssdna的释放。ssdna充当双腿dna步行器,然后连续组装到dna修饰的聚苯乙烯微球表面上。之后加入核酸内切酶来激活dna步行器,其围绕轨道执行机械化和逐步的运动,从而引起持续的荧光信号输出。
技术实现要素:
[0005]
本发明的目的是开发出一种简单、灵敏的microrna生物传感器。
[0006]
具体技术方案如下:
[0007]
(1)、等温指数扩增反应(expar)首先,将100nm模板,各种浓度的靶标microrna,1μl 10
×
cutsmart缓冲液和1μl 10
×
nebuffer 2混合,并在95℃水浴中加热5分钟,然后缓慢降低至室温。然后,将0.2u的kf聚合酶,1u的ns.bsmai,250μm dntp和depc处理水添加到中,使得最终体积为10μl。扩增反应在37℃下进行30分钟。最后,通过在80℃下20分钟的酶灭活处理终止反应体系。将该溶液储存在4℃下以备将来使用。
[0008]
(2)、dna步行器探针的制备将50μl链霉亲和素包被的微球用50μl结合缓冲液洗涤两次,方法是将微球以12000rpm离心3分钟,然后弃去上清液。用50μl结合缓冲液重悬后,将5μl 20μm生物素修饰的轨道链添加到微球中。将混合物在37℃下孵育20分钟。然后将上述溶液在12000rpm下离心3分钟,除去上清液后,将剩余溶液用50μl te缓冲液洗涤3次。最后,将微球复合物悬浮于50μl te缓冲液中。
[0009]
(3)、microrna的荧光测量对于典型的步行器操作,反应溶液在100μl反应体积中于37℃进行20分钟,包括10μl expar产品,5μl制备的微球复合物,在1
×
cutsmart缓冲液中的10u nb.bbvci内切酶。将反应溶液在12000rpm下离心3分钟后,收集上清液以测量荧光信号。
[0010]
所述步骤(1)中expar反应最好是30分钟。
[0011]
所述步骤(2)中生物素修饰的轨道链加入量最好是5μl 20μm。
[0012]
所述步骤(3)中反应最好在37℃进行20分钟。
[0013]
本发明建立了一种基于等温指数扩增反应触发的3-d双腿dna步行器用来灵敏的检测mirna的生物传感器。其检测原理是expar模板设计为x'n'x'n'y'。x'是目标microrna的识别位点。y
’
与双腿dna步行器序列互补,n
’
包含nt.bsmai切口内切酶的互补位点。在存在靶标的情况下,模板可与之结合,并借助kf聚合酶和dntps沿着microrna 3'末端引发聚合反应。因此,产生了包含两个切口内切酶nt.bsmai的识别位点(5
’-
gtctc-3
’
)的双链dna(dsdna)。这种切口酶在识别位点下游的下一个碱基处切割一条dsdna链,形成3'末端,该末端使dna在切口处延伸,并且由于kf聚合酶的聚合活性和链置换活性而把下游dna链(xn和y)置换下来。随后的切口反应引发了新一轮的聚合,切割和置换。同时,含有靶序列的新合成的xn链将与模板杂交并触发另一个循环。结果,整个反应导致了等温指数扩增,产生大量y链(bdw)。bdw设计为在5'和3'末端各具有7nt的切口内切核酸酶nb.bbvci的互补切口序列。底物轨道链被设计为具有7nt的nb.bbvci切口识别序列,其5'端被生物素修饰以固定在链霉亲和素包被的微球表面,而3'端则被羧基荧光素(fam)标记。由于碱基的互补作用,bdw可以附着在微球表面的轨道链上。在切口内切酶nb.bbvci的辅助下,bdw在识别位点催化轨道链的切割,导致bdw和荧光信号的释放。然后,释放的bdw与同一微球上的另一个相邻轨道链杂交。新形成的dna双链体可以触发循环切割过程,直到耗尽所有轨道链。因此,无数用fam标记的短dna片段将分散到溶液中。离心分离后,用荧光分光光度计记录上清液中的荧光信号,信号强度与靶标microrna的浓度有关。
[0014]
我们首先使用实时pcr检测系统阐明了expar的过程。监测混合物中不同靶标浓度的荧光强度随时间的变化,持续40分钟(附图1)。值得注意的是,在靶标存在下(10fm,
100fm,10pm,500pm和5nm),所有混合物的荧光信号均显着增加。与之形成鲜明对比的是,没有靶标的混合物荧光强度的增加可以忽略不计。这些发现强烈地表明expar的反应是成功的。然后,为证实bdw酶促切割反应的可行性,我们在nb.bbvci存在的条件下使用5nm的bdw测量了荧光信号,还进行了不使用bdw的对照实验。如附图2所示,曲线b是不存在bdw时的荧光响应,显然可以看到微弱的荧光信号产生。曲线a中,在存在bdw的情况下可以观察到明显的荧光信号增加。结果表明bdw在微球表面发生了酶促切割反应。制备了具有相同浓度轨道链的单腿dna步行器(sdw)和bdw。附图3显示了sdw和bdw(分别为5nm)在不同测定时间的荧光信号。值得注意的是,sdw的荧光强度以相对较慢的速率增加,直到达到平台期35分钟为止。相比之下,bdw的荧光强度在20分钟内几乎达到平稳状态。但是,随着孵育时间的延长,它们达到了相同的荧光信号值。这显然表明,对于sdw和bdw,最终响应几乎没有差异,但是bdw的行走速度比sdw快。
[0015]
为了进一步验证expar集成3-d dna步行器的策略可行性,我们测试了不同条件下的荧光信号。如附图4所示,曲线a和曲线b分别是没有kf聚合酶或nt.bsmai的荧光响应。显然几乎没有观察到荧光信号,因为在没有聚合酶或切口内切核酸酶的情况下不能启动expar反应。曲线c是没有nb.bbvci的荧光响应。同样,仍未检测到荧光信号。尽管启动了expar,但在缺少nb.bbvci的情况下无法激活3-d dna步行器。相应地,几乎没有荧光信号。当未添加靶标时,观察到较弱的背景信号(曲线d)。但是,当添加所有反应元素时,检测到强烈的荧光信号(曲线e)。这些结果表明,每种酶在扩增过程中都起着至关重要的作用,从而证实了用于microrna检测的两个反应线路的成功设计。此外,为了在视觉上确认步行传感器被靶标激活,还使用荧光显微镜来验证步行传感器的可行性。不出所料,由于荧光标记的dna轨道链已在微球表面成功修饰,因此大量绿色荧光微球随机分布在视场中(附图5)。对于附图6,当在反应系统中未孵育靶标时,观察到相同的绿色荧光。但是,通过添加靶标激活步行器后,几乎看不到绿色荧光(附图7),表明用expar触发的dna步行器传感器是完全可行的。
[0016]
expar的指数性质使其易于非特异性扩增。在目标触发的反应之后,总是会在短时间内观察到这些虚假信号放大。如附图8所示,荧光信号强度随expar反应时间的增加而显着增加,并且信号与背景信号之比(s/b)在30分钟时达到平稳状态。相反,其值在30分钟后下降,因为随着反应时间的延长,背景信号也显着增强。因此,本实验中expar的最佳反应时间为30分钟。随后,我们优化了nb.bbvci介导的dna步行器反应时间。如附图9所示,发现s/b比在20分钟内达到最大值,这表明酶促bdw具有快速的步行速度。另外,酶的用量直接影响反应的效率和信号的输出,kf聚合酶和nb.bbvci的浓度被优化以达到最佳分析结果。附图10显示了在不同kf聚合酶浓度下的荧光强度,发现0.20u/10μl是最佳浓度。由于nb.bbvci是传感器的另一个关键元素,因此我们将nb.bbvci的浓度从1u/100μl变化到20u/100μl。如图11所示,传感器的荧光信号随着切口核酸内切酶浓度的增加而显着上升,在10u/100μl处显示出最高的荧光强度。因此,nb.bbvci的最佳浓度为10u/100μl。
[0017]
在最优化的条件下,我们进一步使用了不同浓度的microrna来研究本发明的分析性能。如附图12所示,荧光信号随着靶标microrna浓度的(从10fm到5nm)增加而增加。此外,荧光强度与microrna浓度的对数表现出良好的线性关系。线性回归方程为f=127.231+32.543lgc,相关系数r
2
为0.983。其中f是荧光强度,c是microrna 21(pm)的浓度。根据公式
lod=3σ/s计算得出的检出限为5.2fm,其中σ是空白溶液三次测量值的标准偏差,而s是校准曲线的斜率。这种优越的性能应归因于expar显著的扩增效率。
[0018]
为了评估方法的选择性,我们测试了四个具有高序列同源性的不同对照物作为干扰物质,包括microrna 141,microrna 155,microrna 199a和let 7a。在相同的实验条件下比较(f-f0)/f0,其中f是不同microrna的荧光强度,f0是空白信号。如附图13所示,目标microrna与其他干扰microrna之间存在显着差异,与其他类似物相比,靶标microrna 21的存在表现出较高的(f-f0)/f0值。这些结果表明,该提议的方法具有良好的选择性,可将microrna21与同源物区分开。
[0019]
为了评估所提出的荧光生物传感器的重复性,我们将不同浓度的microrna 21分别以0.01pm,10pm和500pm进行了五次实验。如附图14所示,相对标准偏差(rsd)分别为4.89%,4.35%和3.00%。这些结果表明我们的扩增策略具有令人满意的稳定性和可靠性。
[0020]
为了评估发明的生物传感器在复杂生物样品中的适用性,我们将不同浓度的microrna 21(0.1pm,10pm和100pm)加标到10倍稀释的人血清样品(depc处理水)中,因为血清是一种实际复杂的基质,其中包含多种蛋白质和其他污染物。如附图15所示,与缓冲液相比,稀释的血清在520nm处获得的响应实际上没有明显变化。这些结果表明,血清不会干扰我们提出的步行器传感器的潜在分析能力。
[0021]
总之,我们已经通过目标触发的expar反应成功构建了三维双足腿dna步行器,并将其用于检测microrna。通过聚合酶和核酸内切酶介导的expar反应以及酶驱动的3-d dna walker在聚苯乙烯微球上实现双重反应。提议的荧光信号双重扩增实现了对低至5.2fm靶标microrna的较高灵敏度。整个过程的反应时间大约需要70分钟,比大多数报道的多层扩增系统要快。此外,我们评估了sdw和bdw的步行行为。与sdw相比,bdw具有更快的步行速度,并且bdw的初始速率是sdw的1.76倍。值得注意的是,整个系统仅需要制备两条不同的核酸链,一条模板链和另一条底物链。我们在这项工作中采用的exapr策略结合3-d dna步行器避免了复杂的核酸设计以及由于多条核酸链而导致信号泄漏的可能性,将为开发灵敏、简单、快速的荧光生物传感器提供新的策略。
附图说明
[0022]
图1是在不同浓度靶标下,expar荧光信号时间依赖性变化
[0023]
图2是bdw的酶促切割反应
[0024]
图3是sdw和bdw在不同分析时间的荧光信号
[0025]
图4是在不同实验条件下测得样品的荧光光谱
[0026]
图5是反应前获得的绿色微球图像
[0027]
图6是未加入靶标后获得的绿色微球图像
[0028]
图7是加入靶标后获得的绿色微球图像
[0029]
图8是不同expar反应时间的荧光强度和s/b比
[0030]
图9是不同bdw反应时间的荧光强度和s/b比。
[0031]
图10是荧光强度与不同浓度的kf聚合酶的关系
[0032]
图11是荧光强度与不同浓度的nb.bbvci的关系
[0033]
图12是荧光强度与靶标浓度在10fm至5nm之间的线性关系
[0034]
图13是该生物传感器对不同microrna的选择性
[0035]
图14是五次独立实验中不同浓度的生物传感器的重现性
[0036]
图15是在缓冲液和稀释的血清样品中不同浓度的microrna 21(0.1、10、100pm)荧光信号的比较
具体实施方式
[0037]
制备一种基于指数扩增反应触发的3-d双腿dna步行器的生物传感器,按以下步骤操作:
[0038]
(1)、等温指数扩增反应(expar)首先,将100nm模板,各种浓度的靶标microrna,1μl 10
×
cutsmart缓冲液和1μl 10
×
nebuffer 2混合,并在95℃水浴中加热5分钟,然后缓慢降低至室温。然后,将0.2u的kf聚合酶,1u的ns.bsmai,250μm dntp和depc处理水添加到混合物中,使得最终体积为10μl。扩增反应在37℃下进行30分钟。最后,通过在80℃下20分钟的酶灭活处理终止反应体系。将该溶液储存在4℃下以备将来使用。
[0039]
(2)、dna步行器探针的制备将50μl链霉亲和素包被的微球用50μl结合缓冲液洗涤两次,方法是将微球以12000rpm离心3分钟,然后弃去上清液。用50μl结合缓冲液重悬后,将5μl 20μm生物素修饰的轨道链添加到微球中。将混合物在37℃下孵育20分钟。然后将上述溶液在12000rpm下离心3分钟,除去上清液后,将剩余溶液用50μl te缓冲液洗涤3次。最后,将微球复合物悬浮于50μl te缓冲液中。
[0040]
(3)、microrna的荧光测量对于典型的步行器操作,反应溶液在100μl反应体积中于37℃进行20分钟,包括10μl expar产品,5μl制备的微球复合物,在1
×
cutsmart缓冲液中的10u nb.bbvci内切酶。将反应溶液在12000rpm下离心3分钟后,收集上清液以测量荧光信号。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



