一种编码GA20ox-氧化酶的基因及其应用的制作方法
 2021-02-02 10:02:38|
2021-02-02 10:02:38| 393|
393| 起点商标网
起点商标网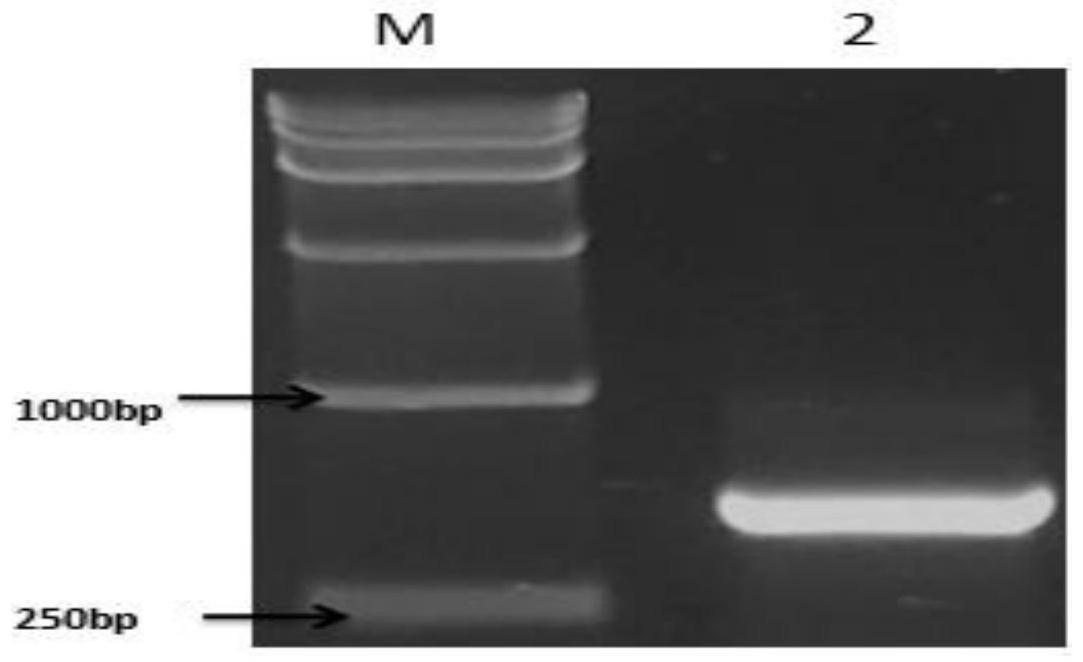
一种编码ga20ox-氧化酶的基因及其应用
技术领域
[0001]
本发明属于基因工程技术领域,具体涉及一种编码ga20ox-氧化酶的基因及其应用。
背景技术:
[0002]
矮化种植是农作物生产不变的发展趋势。植物矮化主要分为遗传性矮化和生理性矮化。单一基因突变属于遗传性矮化,其矮化激励多为基因合成蛋白,蛋白影响激素,激素影响表型;手环境因素影响,导致植株表型发生变化,属于生理性矮化,其矮化作用机理多为环境变化影响植物激素分泌,最终导致变化。但不论哪种矮化模式,都要通过激素来影响表型,植株生长过程中的激素多与赤霉素有关。
[0003]
矮化基因的研究是阐释矮化特性的重要手段。ga20氧化酶是ga生物合成过程中的关键酶,它催化转化ga
12
/ga
53
生成ga
9
/ga
20
,而后者是具有生物活性的ga
4
和ga
1
的前体。深入研究ga20ox的生物合成过程,克隆调控这一过程的关键基因,并对其表达产物进行分析就显得尤为必要。目前拟南芥、水稻、荔波连蕊茶、小叶杨、簇毛麦、棉花、苹果、柿子、葡萄、桃、李和梨等多种植物的ga20ox基因被挖掘,越来越多的矮化基因被报道,为植物矮化分子机理研究提供丰富的素材。
[0004]
ga20ox(ga-20氧化酶)催化氧化c
20-gas形成活性赤霉素代谢前体物,分别催化非羟化gas前体(ga
12
)和羟基化gas前体(ga
53
)合成ga
9
和ga
20
,因此有ga20ox参与ga正向合成代谢至少包括两个平行途径。在拟南芥中atga20ox1起到加速节间细胞的生长作用,atga20ox2则起到加速花的开放。过量表达ga20ox基因常会导致植株生长加快,节间伸长,叶色改变等。但在西葫芦中过量表达ga20ox基因会降低植株高度,且叶的颜色会更深,内源ga含量也会下降。
[0005]
通过对比具有乔化特性和矮化特性植物材料ga20ox基因的表达量,在植物童期预判是否具有矮化特性的,既省时又省力,该方法变得十分迫切和必要。
技术实现要素:
[0006]
为了克服上述技术的不足,本发明提供了一种ga20ox氧化酶基因克隆与表达的方法,并应用实生苗早期预判是否具有矮化特性。
[0007]
本发明解决问题所采用的技术方案:
[0008]
一种编码ga20ox氧化酶的基因,其是从已构建的酵母菌cdna文库中获得,其核苷酸序列如seq id no:1所示。
[0009]
本发明获得的ga20ox氧化酶是编码ga20ox氧化酶基因表达产物,该酶由181个氨基酸组成,其分子量为20627.61da,其氨基酸序列如seq id no:2所示。
[0010]
本发明还提供了一种重组表达质粒,它由表达质粒和编码l-丙氨酸氧化酶的基因重组而得。
[0011]
优选的是,所述的表达质粒为真核表达质粒peasy-t1。
[0012]
本发明还提供一种基因工程菌,其是由重组表达质粒转化宿主菌而得。
[0013]
本发明还提供了所述ga20ox-氧化酶在乔矮化芒果品种预判中的应用,所述ga20ox-氧化酶作用于有生物活性ga
1
和ga
4
,将其转变成无活性的ga
8
和ga
34
,通过减少活性ga表达量来调节植物生长,使植物矮化;所述ga20ox-氧化酶酶解反应条件是:温度37℃,孵育1h。
[0014]
与现有技术相比,本发明具有如下有益效果:
[0015]
(1)本发明是供试材料中直接获取ga20ox基因序列,分析该基因理化活性,把该基因作为调控矮化性状的指标。
[0016]
(2)本发明涉及到该ga20ox氧化酶基因克隆、与之相对应的氨基酸序列分析,通过半荧光定量方法测定ga20ox基因表达量为早期预判供试材料是否具有矮化性状提供了一种新的方法。
[0017]
(3)本发明通过半荧光定量分析法测定ga20ox基因表达量对早期预判供试材料是否具有矮化特性的方法简单高效。
附图说明
[0018]
图1为阳性单克隆摇菌测序图;
[0019]
图2为阳性菌落测序图;
[0020]
图3为pcr反应体系测序图;
[0021]
图4为5个物候期时间段内,矮化特性供试材料和乔化特性种质中ga20ox基因表达量图。
具体实施方式
[0022]
下面结合对本发明专利的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域所属的技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0023]
实施例
[0024]
1.载体及感受态
[0025]
克隆载体pge-t vector购于华大基因生物科技(深圳)有限公司;jm109感受态保存于广西亚热带作物研究所优势作物繁育及综合开发新技术重点实验室;亚细胞定位载体pk7fwgf2.0和peasy-t1由迦康创因生物科技(武汉)有限公司提供。
[0026]
2.主要试剂
[0027]
dna marker、t
4
dna连接酶、超保真dna聚合酶、2
×
taq master mix、first choice rlm-race kit、5
×
rt reaction buffer、dntp、rnaes inhibitor、m-mlv rtase、凝胶回收试剂盒购自天根生化科技(北京)有限公司,接头和引物由华大基因生物科技(深圳)有限公司合成。
[0028]
3、方法
[0029]
3.1、基因的克隆与测序
[0030]
解冻first-strand cdna synthesis kit试剂,上下轻柔颠倒混匀,短暂离心后放
置冰上待用。冰上配制rna-primer mix,在预冷的rnasefree反应管内加入总rna 1μg、250μmol/l随机引物1μg,最后加入depc处理水使终体积至13μl。rna变性:混匀rna-primer mix,进行短暂离心,65℃变性10min后立即放于冰上。
[0031]
配制反转录反应液:在rna-primer mix反应管内,加入rna-primer mix 13μl、5
×
rt reaction buffer 5μl、25mmol/l dntp 1μl、25u/μl rnaes inhibitor 1μl、200u/μl m-mlv rtase 1μl,加入depc处理水使终体积至25μl。
[0032]
反转录反应:混匀反应mix,短暂离心后37℃孵育1h。反应结束后,85℃灭活处理5min,-20℃保存反转录产物,待用。
[0033]
根据genbank中公布的ga20ox cdna序列,设计1对简并引物,分别是ga20ox-f:aaygcygatrtbgchaggrtygatta;ga20ox-r:tcgyayacrctyaaattyctyccattwcaga。进行反转录。
[0034]
pcr反应体系为100ng/μl模板cdna 1μl、50mmol/l primer-f1μl、50mmol/l primer-r 1μl、25mmol/l dntps 4μl,加ddh
2
o至总反应体系50μl。pcr反应程序为94℃5min;94℃40s,58℃40s,72℃1min,35个循环;72℃延伸10min,4℃保存。pcr产物选择2.0%(质量分数)琼脂糖凝胶电泳分析。回收目的片段,连接到pgem-t vector载体上,转化jm109感受态细胞,取阳性单克隆摇菌并进行测序,结果见图1,图1中m为dna maker;2为中间片段条带。
[0035]
由图1可知,以供试材料叶片rna反转录的cdna链为模板,用特异性引物进行pcr扩增,扩增产物经琼脂糖凝胶电泳分离,在约750bp处存在肉眼清晰可见的特异性条带。
[0036]
通用引物r16327(ggtggtagagctcgcaggactgcagctgagtg)和特异的外侧引物ga20ox 3
′
gsp-1(ccgccatgtccggatattca)、ga20ox 3
′
gsp-2(atccaacaacacttccggct)进行首轮扩增。pcr扩增体系为100ng/μl cdna 2μl,10
×
pcr buffer 4μl,2.5mmol/l dntp 4μl,上下游引物各2μl,0.5μl rtaq酶,用ddh
2
o补足至40μl。
[0037]
pcr反应程序为94℃3min;94℃40s,60℃40s,72℃1min,35个循环;72℃延伸10min,4℃保温。以稀释10倍的第1轮pcr产物为模板,以内侧引物r16324(agagctcgcaggactgcagcagctgactgactac)分别与ga2ox 3
′
gsp-1、ga2ox 3
′
gsp-2进行第2轮扩增,pcr反应体系同第1轮扩增。将pcr产物进行1.0%(质量分数)琼脂糖凝胶电泳分析,并进行切胶回收目的片段,连接到peasy-t1载体上转化感受态细胞后,鉴定出阳性菌落进行测序,结果见图2,图2中m为dna mark;3为3
′
端长度大小。
[0038]
由图2可知,根据已获得的ga20ox基因中间片段的序列信息分别设计2条特异引物(ga20ox 3
′
gsp-1、ga20ox 3
′
gsp-2)与通用引物进行pcr扩增,得到约500bp的dna片段。
[0039]
利用ga20ox 5
′
gsp-1(gcacctgcataatcaaccactt)进行pcr的第1轮扩增。pcr反应体系为100ng/μl cdna 2μl,10
×
pcr buffer 4μl,2.5mmol/l dntp 4μl,上下游引物各2μl,0.5μl rtaq酶,补充ddh2o使终体积至40μl。pcr反应程序为94℃5min;94℃50s,60℃50s,72℃2min,35个循环;72℃1min,4℃保温。以稀释10倍的第1轮pcr产物为模板,利用ga2ox 5
′
gsp-2(gcttgggtactggcaaaagc)进行第2轮扩增,pcr反应体系和测序同上的第1轮扩增,结果见图3,图3中m为dna mark;2为5
′
端长度大小。
[0040]
由图3可知,根据已获得的ga20ox基因中间片段的序列信息分别设计2条特异引物(ga20ox 5
′
gsp-1、ga20ox 5
′
gsp-2)与通用引物进行pcr扩增,得到约250bp的dna片段。
[0041]
3.实时荧光定量rt-pcr(qrt-pcr)分析
[0042]
利用beacon designer设计引物,探究ga20ox基因在具有乔化特性种质和矮化特性种质随机不同时期中的表达情况。以种质actin内参基因设计actin-f和actin-r引物。根据已克隆得到的ga20ox序列设计特异引物ga20ox-ygf和ga20ox-ygr。pcr定量反应步骤:
[0043]
1)将all-in-one
tm qpcr mix在室温下融解,轻柔地上下颠倒混匀并进行短暂离心。
[0044]
2)冰上配制pcr reaction mix,包括2
×
all-in one
tm qpcr mix 10μl、qpcr primer(1μmol/l)2μl、cdna template 2μl,加入ddh
2
o使终体积至20μl。在试验中设计了ntc(no template control),其为阴性对照,即用水代替模板cdna,其他试剂不变,从而确保体系无污染。
[0045]
3)将反应管进行短暂离心,确保所有反应液在反应管底部。
[0046]
pcr反应程序为95℃10min;95℃10s,60℃20s,72℃15s,40个循环;72℃10min。pcr反应结束后,进行溶解曲线分析,即温度控制在72-95℃,每间隔10s升高0.5℃,最后25℃保持30s。试验设置3次重复。采用7300system软件和2-δδct
方法进行数据分析,结果见图4,图4中纵坐标,代表基因表达量,横坐标的
‘
矮
’
代表矮化供试材料,
‘
乔
’
代表乔化供试材料,
‘
1、2、3、4、5
’
代表5个不同的时期。
[0047]
由图4可知,在5个物候期时间段,具有矮化特性供试材料的ga20ox基因表达量远高于具有乔化特性种质。
[0048]
综上所述,本发明涉及到该ga20ox氧化酶基因克隆、与之相对应的氨基酸序列分析,通过半荧光定量方法测定ga20ox基因表达量为早期预判供试材料是否具有矮化性状提供了一种新的方法。
[0049]
前述对本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



