肿瘤新抗原表位肽及其应用的制作方法
 2021-02-02 10:02:26|
2021-02-02 10:02:26| 443|
443| 起点商标网
起点商标网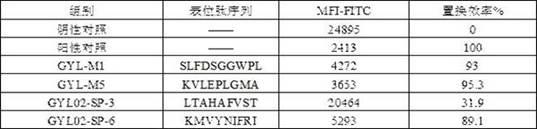
[0001]
本发明涉及分子免疫学的技术领域,尤其涉及一种肿瘤新抗原表位肽及其应用。
背景技术:
[0002]
肿瘤在机体内的发生是一个多阶段、多步骤的复杂过程,这一过程中伴随细胞学、遗传学的改变,出现多种基因突变及基因表达的异常,包括癌基因的激活和/或抑癌基因灭活,激发异常的信号传导通路,导致细胞周期及细胞凋亡异常,从而使得细胞恶性转化,并随着各种分子异常的累积,肿瘤出现进展、转移。因此,了解这些在肿瘤发生过程中、在肿瘤组织中特异表达的基因对于肿瘤发生发展机制的阐明、临床的诊断和治疗都具有重要意义。
[0003]
肿瘤的发生率和死亡率在全球范围内呈现逐年升高的势态,目前存在的最主要问题是缺乏有效的治疗手段。手术治疗辅助局部或全身化疗的治疗方法,多数肿瘤患者术后的生存期并不令人满意。因此,寻求针对实体肿瘤的新的免疫治疗手段已成为科研工作者义不容辞的责任。
[0004]
要进行肿瘤的免疫治疗,首先需要得到肿瘤抗原。在二十世纪末期,随着免疫学理论和分子生物学技术的飞速发展,克隆肿瘤抗原已成为肿瘤免疫研究及治疗的重要方面。大量可以诱导机体产生免疫应答的肿瘤抗原的发现,为肿瘤的免疫治疗开辟了新的纪元。
[0005]
迄今为止,为了寻找肿瘤特异性或相关性抗原用于肿瘤的免疫治疗,人们已经建立了多种方法来分离肿瘤抗原,如利用ctl筛选cdna文库转染的细胞,人们从黑色素瘤中鉴定了第一个肿瘤抗原mz-d2(由mage-a1基因编码);利用serex (serological identification of recombinant expression cloing)筛选方法鉴定了一些非常有价值的抗原,如mage-1、hom-mel-40、ssx2、scp-1、ct7、ny-eso-1和scp-1抗原等。
[0006]
近年来,随着测序技术的飞速发展,肿瘤细胞突变基因编码的新生肿瘤抗原的鉴定和应用已成为肿瘤免疫学的研究热点。利用术后或穿刺获取的肿瘤患者组织进行全外显子测序、转录组测序,配合外周血细胞的测序结果,进行生物信息学分析获取肿瘤细胞特异的突变位点及hla分型并进行抗原表位的预测,通过四聚体结合实验及体外刺激t细胞活化实验确定具有免疫原性的肿瘤新抗原,可用于肿瘤患者的个体化治疗。2017年catherine wu团队报道了一项基于肿瘤新生抗原的肽疫苗的临床研究结果,给6名高复发风险的恶性黑色素瘤术后患者接种了新生抗原肽疫苗,随后的20~32个月的随访中4名iii期患者均未复发,2名iv期患者出现复发,联合给予pd-1单抗治疗后均获得完全缓解;sahin团队使用基于肿瘤新生抗原的rna疫苗,给予13例晚期黑色素瘤患者接种编码新抗原表位的rna疫苗后,转移发生率显著降低,8例患者在随访的12~23个月内无复发,5例转移患者中有2例病情缓解,1例病情稳定,1例联合pd-1单抗治疗后完全缓解。2018年,kandalaft团队报道了用肿瘤细胞裂解液负载自身dc细胞给卵巢癌患者接种,在患者体内可以检测到针对肿瘤新生抗原表位的t细胞应答,dc疫苗的接种可以显著延长肿瘤患者的生存期。上述临床研究结果成功地证实了以新抗原为靶点的肿瘤疫苗治疗肿瘤的可行性及良好的临床应用前景。
技术实现要素:
[0007]
本发明提供了一种肿瘤抗原表位肽及其应用,所述肿瘤抗原表位肽来源于肿瘤患者,其能与人类hla分子结合并能刺激t淋巴细胞活化。
[0008]
本发明具体技术方案如下:1. 一种肿瘤抗原表位肽,所述表位肽包含选自如seq id no:1-6中所示的一种或两种以上的氨基酸序列。
[0009]
2. 根据项1的肿瘤抗原表位肽,其以约500nm或更小的结合亲和力结合mhc i类分子。
[0010]
3. 根据项1的肿瘤抗原表位肽,进一步包含增加体内半衰期、细胞靶向、抗原摄取、抗原处理、mhc亲和力、mhc稳定性、抗原呈递或其组合的修饰,其中所述修饰为与载体蛋白偶联、与配体偶联、与抗体偶联、peg化、聚唾液酸化hes化、fc融合、白蛋白融合、胆固醇融合、铁融合、酰化、酰胺化、糖基化、侧链氧化、磷酸化、生物素化、或添加非天然氨基酸。
[0011]
4. 根据项3的肿瘤抗原表位肽,进一步包含增加针对抗原呈递细胞的细胞靶向的修饰。
[0012]
5. 根据项4的肿瘤抗原表位肽,所述抗原呈递细胞为树突细胞,其中使用dec205、xcr1、cd197、cd80、cd86、cd123、cd209、cd273、cd283、cd289、cd184、cd85h、cd85j、cd85k、cd85d、cd85g、cd85a、cd141、cd11c、cd83、tslp受体、clec9a或cd1a标志物来靶向所述树突细胞。
[0013]
6. 一种融合蛋白或者免疫缀合物,其包括项1-5中任一项所述的肿瘤抗原表位肽。
[0014]
7. 根据项6的融合蛋白或者免疫缀合物,其中所述肿瘤抗原表位肽与载体蛋白、配体蛋白、抗体、fc片段、白蛋白、胆固醇、铁融合、靶向树突细胞的蛋白融合。
[0015]
8. 一种体内递送系统,其包括项1-5中任一项所述的肿瘤抗原表位肽。
[0016]
9. 根据项8所述的递送系统,其中所述递送系统包括细胞穿透肽、纳米颗粒包封、病毒样颗粒、脂质体或其任何组合。
[0017]
10. 根据项9所述的递送系统,其中所述细胞穿透肽为tat肽、单纯疱疹病毒vp22、转运蛋白、antp或其任何组合。
[0018]
11. 一种核酸分子,其编码项1-5中任一项所述的肿瘤抗原表位肽或者项6或7所述的融合蛋白或者免疫缀合物。
[0019]
12. 一种载体,其包括项11所述的核酸分子。
[0020]
13. 根据项12所述的载体,其中,所述核酸分子与启动子可操作地连接,所述载体为自扩增rna复制子、质粒、噬菌体、转座子、粘粒、病毒或病毒粒子。
[0021]
14. 一种体内递送系统,其包含项11所述的核酸分子,所述递送系统包括球形核酸、病毒、病毒样颗粒、质粒、细菌质粒或纳米颗粒。
[0022]
15. 一种细胞,其包含或者表达项1-5中任一项所述的肿瘤抗原表位肽或者项6-7中任一项所述的融合蛋白或者免疫缀合物,或包含项12-13中任一项所述的载体,或包含项8-9或者14中任一项所述的递送系统。
[0023]
16. 根据项15所述的细胞,其为抗原呈递细胞。
[0024]
17. 根据项16所述的细胞,其为树突状细胞,所述树突状细胞选自未成熟、半成熟
或成熟的树突状细胞。
[0025]
18. 根据项15-17中任一项所述的细胞,其为自体细胞。
[0026]
19. 一种药物组合物,其包含项1-5中任一项所述的肿瘤抗原表位肽、或项6-7任一项所述的融合蛋白或者免疫缀合物,或项12-13中任一项所述的载体,或项8-9或者14中任一项所述的递送系统、或项15-18中任一项所述的细胞,以及任选地药学上可接受的载体或佐剂。
[0027]
20. 根据项19所述的药物组合物,其为预防或治疗癌症的疫苗。
[0028]
21. 项1-5中任一项所述的肿瘤抗原表位肽、或项6-7任一项所述的融合蛋白或者免疫缀合物,或项12-13中任一项所述的载体,或项8-9或者14中任一项所述的递送系统、或项15-18中任一项所述的细胞在制备预防或治疗肿瘤的肽疫苗、基因疫苗或者dc疫苗药物中的用途。
[0029]
22. 根据项21的用途,其中所述疫苗药物与一种或多种预防或治疗肿瘤的其它疫苗药物或化疗药物联合使用。
[0030]
23. 项1-5中任一项所述的肿瘤抗原表位肽、或项6-7任一项所述的融合蛋白或者免疫缀合物,或项12-13中任一项所述的载体,或项8-9或者14中任一项所述的递送系统、或项15-18中任一项所述的细胞在制备肿瘤诊断试剂或试剂盒中的用途。发明的效果本发明所提供的肿瘤新生抗原表位肽,该表位肽能与人类细胞上的mhc分子结合,结合后的树突状细胞可以刺激具有肿瘤细胞杀伤作用的t淋巴细胞活化和扩增,因此,结合该表位肽的树突状细胞可以用于治疗肿瘤,以及肿瘤患者术后预防复发和转移。
[0031]
附图说明
[0032]
图1是实施例2的hla-a*02型肿瘤的阴性对照与四聚体的结合能力的荧光强度示意图。
[0033]
图2是实施例2的hla-a*02型肿瘤的阳性对照与四聚体的结合能力的荧光强度示意图。
[0034]
图3是实施例2的hla-a*02型肿瘤的 gyl-m1新生抗原表位肽与四聚体的结合能力的荧光强度示意图。
[0035]
图4是实施例2的hla-a*02型肿瘤的 gyl-m5 新生抗原表位肽与四聚体的结合能力的荧光强度示意图。
[0036]
图5是实施例2的hla-a*02型肿瘤的 gyl-02-sp-3 新生抗原表位肽与四聚体的结合能力的荧光强度示意图。
[0037]
图6是实施例2的hla-a*02型肿瘤的 gyl02-sp-6 新生抗原表位肽与四聚体的结合能力的荧光强度示意图。
[0038]
图7是实施例2的hla-a*11型肿瘤的阴性对照、阳性对照和 yd-m-2新生抗原表位肽与四聚体的结合能力的荧光强度示意图,其中,最左边为阴性对照,中间为阳性对照,最右侧为yd-m-2新生抗原表位肽。
[0039]
图8是实施例2的hla-a*11型肿瘤的yd-m-5新生抗原表位肽、ws-sp-5新生抗原表
位肽和 ws-sp-6新生抗原表位肽与四聚体的结合能力的荧光强度示意图,其中,最左边为yd-m-5新生抗原表位肽,中间为ws-sp-5新生抗原表位肽,最右侧为 ws-sp-6新生抗原表位肽。
[0040]
图9是实施例3中肿瘤患者a的elispot斑点均数示意图。
[0041]
图10是实施例3中肿瘤患者b的elispot斑点均数示意图。
[0042]
图11是实施例3中肿瘤患者c的elispot斑点均数示意图。
[0043]
具体实施方式
[0044]
下面结合附图所描述的实施方式对本发明做以详细说明,其中所有附图中相同的数字表示相同的特征。虽然附图中显示了本发明的具体实施例,然而应当理解,可以以各种形式实现本发明而不应被这里阐述的实施例所限制。相反,提供这些实施例是为了能够更透彻地理解本发明,并且能够将本发明的范围完整的传达给本领域的技术人员。
[0045]
需要说明的是,在说明书及权利要求当中使用了某些词汇来指称特定组件。本领域技术人员应可以理解,技术人员可能会用不同名词来称呼同一个组件。本说明书及权利要求并不以名词的差异作为区分组件的方式,而是以组件在功能上的差异作为区分的准则。如在通篇说明书及权利要求当中所提及的“包含”或“包括”为开放式用语,故应解释成“包含但不限定于”。说明书后续描述为实施本发明的较佳实施方式,然而所述描述乃以说明书的一般原则为目的,并非用以限定本发明的范围。本发明的保护范围当视所附权利要求所界定者为准。
[0046]
本发明提供了一种肿瘤抗原表位肽,所述表位肽包含选自如seq id no:1-6中所示的一种或两种以上的氨基酸序列。
[0047]
其中,seq id no:1的氨基酸序列如下所示:slfdsggwpl,其名称为gyl-m1seq id no:2的氨基酸序列如下所示:kvleplgma,其名称为gyl-m5seq id no:3的氨基酸序列如下所示:kmvynifri,其名称为gyl02-sp-6seq id no:4的氨基酸序列如下所示:ktssehlqk,其名称为yd-m-2seq id no:5的氨基酸序列如下所示:qmfenmlik,其名称为yd-m-5seq id no:6的氨基酸序列如下所示:gstintimgnk,其名称为ws-sp-5。
[0048]
例如,所述表位肽包括上述六个氨基酸序列中的一种或者两种或者三种或者四种或者五种或者六种。
[0049]
或者所述表位肽由seq id no:1所述的氨基酸序列组成,或者由seq id no:2所述的氨基酸序列组成,或者由由seq id no:3所述的氨基酸序列组成或者由seq id no:4所述的氨基酸序列组成,或者由由seq id no:5所述的氨基酸序列组成,或者由seq id no:6所
述的氨基酸序列组成。
[0050]
所述表位通常指抗原决定簇,即指分子中被免疫系统识别(例如被抗体识别)的部分。例如,表位可以是被免疫系统识别的抗原上不连续的三维位点。表位通常由分子的化学活性表明基团(例如氨基酸或糖侧链)组成,并通常具有特定的三维结构特征以及特定的电荷特征。表位根据结构,可以分为构象表位和非构象表位(线性表位)。构象表位和非构象表位的区别在于在变性溶剂存在下前者丧失结合,而后者不会。只位于抗原物质表面、易与抗原识别受体或抗体结合的表位可称为功能性表位,位于分子内部,无免疫原性的表位可称为隐藏性表位。
[0051]
在本发明优选的一种具有实施方式中,其以约500nm或更小的结合亲和力结合mhc i类分子。
[0052]
例如,其可以以约250nm或更小的结合亲和力结合mhc i类分子,或者可以以约50nm或更小的结合亲和力结合mhc i类分子。
[0053]
所述亲和力是指结合对的两个成员(例如hla结合肽和i类或ii类hla)之间结合强度的量度。kd是解离常数并且具有摩尔浓度单位。亲和常数是解离常数的倒数。亲和常数有时用作描述该化学实体的通用术语。其为结合能量的直接量度。亲和力可以例如通过使用市售的biacore spr单元的表面等离子体共振(spr)经由实验确定。亲和力也可以表示为抑制浓度50(ic
50
),即50%的肽被替代时的浓度。同样,ln(ic
50
)是指ic
50
的自然对数。k
off
是指解离速率常数,例如,用于hla结合肽和i类或ii类hla的解离。
[0054]
在本发明优选的一种具体实施方式中,其中,进一步包含增加体内半衰期、细胞靶向、抗原摄取、抗原处理、mhc亲和力、mhc稳定性、抗原呈递或其组合的修饰,其中所述修饰为与载体蛋白偶联、与配体偶联、与抗体偶联、peg化、聚唾液酸化hes化、fc融合、白蛋白融合、胆固醇融合、铁融合、酰化、酰胺化、糖基化、侧链氧化、磷酸化、生物素化、或添加非天然氨基酸。
[0055]
在发明优选的一种具体实施方式中,其中,进一步包含增加针对抗原呈递细胞的细胞靶向的修饰。
[0056]
在本发明优选的一种具体实施方式中,其中,所述抗原呈递细胞为树突细胞,其中使用dec205、xcr1、cd197、cd80、cd86、cd123、cd209、cd273、cd283、cd289、cd184、cd85h、cd85j、cd85k、cd85d、cd85g、cd85a、cd141、cd11c、cd83、tslp受体、clec9a或cd1a标志物来靶向所述树突细胞。
[0057]
本发明提供了一种融合蛋白或者免疫缀合物,其包括上述所述的肿瘤抗原表位肽。
[0058]
优选的,所述肿瘤抗原表位肽与载体蛋白、配体蛋白、抗体、fc片段、白蛋白、胆固醇、铁融合、靶向树突细胞的蛋白融合。
[0059]
所述融合蛋白或者免疫缀合物指的是将上述所述的肿瘤抗原表位肽与一种或多种异源肽相融合,例如,将上述所述的肿瘤抗原表位肽直接(例如,在框内)或间接(例如,通过连接子,如肽连接子)与所述一种或多种异源肽相连接、缀合或融合。可通过本领域技术人员已知的方法制备所述融合蛋白或者免疫缀合物,例如可通过分子可控和蛋白质重组表达的方制备所述融合蛋白或免疫缀合物。
[0060]
本发明提供了一种结合分子,其包括上述所述的肿瘤抗原表位肽。
[0061]
所述结合分子指的是肿瘤抗原表位肽与人类hla分子的聚合物、化合物或者复合物(如二聚体、四聚体及多聚体等)聚合所形成的结合分子。
[0062]
本发明提供了一种体内递送系统,其包含上述所述的肿瘤抗原表位肽。
[0063]
所述递送系统包括细胞穿透肽、纳米颗粒包封、病毒样颗粒、脂质体或其任何组合。
[0064]
优选的,所述细胞穿透肽为tat肽、单纯疱疹病毒vp22、转运蛋白(transportan)、antp或其任何组合。
[0065]
本发明提供了一种核酸分子,其编码上述所述的肿瘤抗原表位肽或者上述所述的融合蛋白或者免疫缀合物。
[0066]
优选的,所述核酸分子为dna。
[0067]
优选的,所述核酸分子为rna。
[0068]
优选的,所述rna为自扩增rna。
[0069]
其中,优选的,编码seq id no:1的氨基酸序列的dna序列如seq id no:7所示,其dna序列为:tccctcttcgactccggcgggtggcccctc编码seq id no:2的氨基酸序列的dna序列如seq id no:8所示,其dna序列为:aaagtgctggagccgctggggatggca编码seq id no:3的氨基酸序列的dna序列如seq id no:9所示,其dna序列为:aaaatggtctacaatatcttcttttgt编码seq id no:4的氨基酸序列的dna序列如seq id no:10所示,其dna序列为:acatcaagtgaacatcttcaaaaagag编码seq id no:5的氨基酸序列的dna序列如seq id no:11所示,其dna序列为:aatatgcttataaaatctgaagaaatt编码seq id no:6的氨基酸序列的dna序列如seq id no:12所示,其dna序列为:ggttcaacaatcaacaccatcatgggc。
[0070]
其中,优选的,编码seq id no:1的氨基酸序列的rna序列如seq id no:13所示,其rna序列为:ucccucuucgacuccggcggguggccccuc编码seq id no:2的氨基酸序列的rna序列如seq id no:14所示,其rna序列为:aaagugcuggagccgcuggggauggca编码seq id no:3的氨基酸序列的rna序列如seq id no:15所示,其rna序列为:aaaauggucuacaauaucuucuuuugu编码seq id no:4的氨基酸序列的rna序列如seq id no:16所示,其rna序列为:acaucaagugaacaucuucaaaaagag编码seq id no:5的氨基酸序列的rna序列如seq id no:17所示,其rna序列为:aauaugcuuauaaaaucugaagaaauu编码seq id no:6的氨基酸序列的rna序列如seq id no:18所示,其rna序列为:gguucaacaaucaacaccaucaugggc。
[0071]
所述核酸也可以称为多核苷酸,并且指任何长度的核苷酸聚合物,包括dna和rna
(例如,mrna)。核苷酸可以是脱氧核糖核苷酸、核糖核苷酸、修饰的核苷酸或碱基和/或它们的类似物或可以通过dna或rna聚合酶掺入聚合物中的任何底物。
[0072]
所述的核酸可以是能够转导树突细胞的任何合适的核酸,从而导致新抗原肽的呈递和免疫的诱导,该核酸可以是能够转导树突细胞的任何合适的多核苷酸,从而导致新抗原肽的呈递和免疫的诱导,也可以是递送媒介物的一部分,例如脂质体、病毒样颗粒、质粒或表达载体,还可以通过无载体递送系统递送该多核苷酸,例如,高效电穿孔和高速细胞变形)。
[0073]
编码本文所述的肿瘤抗原表位肽的核酸分子可以通过化学技术合成,例如,matteucci等人,j .am .chem .soc .103:3185(1981)的磷酸三酯方法。
[0074]
本发明所述的表位肽和核酸分子也可以经由脂质体施用,该脂质体将肽靶向特定的细胞组织(诸如淋巴组织)。脂质体也可用于增加肽的半衰期。脂质体包括乳液、泡沫、胶束、不溶性单层、液晶、磷脂分散体、层状层等。在这些制剂中,待递送的肽作为脂质体的一部分单独或与例如淋巴细胞中普遍存在的受体的分子(诸如,与dec205抗原结合的单克隆抗体)一起或与其它治疗剂或免疫原性组合物掺入。因此,可以将填充有本文所述的期望的肽或多核苷酸的脂质体引导至淋巴细胞的位点,随后该脂质体递送所选的治疗性/免疫原性表位肽/多核苷酸组合物。脂质体可以由标准的形成囊泡的脂质形成,其通常包括中性和带负电荷的磷脂和甾醇(例如胆固醇)。通常通过考虑例如脂质体大小、酸不稳定性和血液中脂质体的稳定性来指导脂质的选择。
[0075]
为了靶向免疫细胞(例如树突细胞),将新生抗原表位肽或多核苷酸掺入脂质体中,用于期望的免疫系统细胞的细胞表面决定簇。含有肽的脂质体悬浮液可以静脉内、局部(locally) 、局部(topically)等施用,其剂量根据施用方式、所递送的表位肽或多核苷酸以及所治疗疾病的阶段等而变化。
[0076]
本发明提供了一种载体,其包括上述所述的核酸分子。
[0077]
在本发明优选的一种具体实施方式中,其中,所述核酸分子与启动子可操作地连接,所述载体为自扩增rna复制子、质粒、噬菌体、转座子、粘粒、病毒或病毒粒子。
[0078]
所述载体来源于腺相关病毒、疱疹病毒、慢病毒或其假型。
[0079]
所述载体意指构建体,其能够在宿主细胞中递送并通常表达一种或多种感兴趣的基因或序列。载体的实例包括但不限于病毒载体、裸dna或rna表达载体、质粒、粘粒或噬菌体载体、与阳离子缩合剂相关的dna或rna表达载体以及包封在脂质体中的dna或rna表达载体。
[0080]
所述载体除了包含上述所述的核酸分子之外,还可以包含其他基因,例如,允许在适当的宿主细胞中和在适当的条件下选择该载体的标记基因。此外,所述载体还包含允许编码区在适当的宿主中正确表达的表达控制元件。这样的控制元件作为本领域技术人员所熟知的,例如,可包括启动子、核糖体结合位点、增强子和调节基因转录或mrna翻译的其他控制元件。例如,表达控制序列为可调的元件,其具体结构可根据物种或细胞类型的功能而变化,但通常包含分别参与转录和翻译起始的5
’
非转录序列和5
’
及3
’
非翻译序列,例如tata盒、加帽序列、caat序列等。例如,5
’
非转录表达控制序列可包含启动子区,启动子区可包含用于转录控制功能性连接核酸的启动子序列。所述表达控制序列还可包括增强子序列或者上游活化子序列。
[0081]
所述载体可以包括,例如质粒、粘粒、病毒、噬菌体或者在例如在遗传工程中通常使用的其他载体,优选的,所述载体为表达载体。
[0082]
例如,可将本发明所述的载体引入到宿主细胞中,例如原核细胞(例如,细菌细胞)、cho细胞、ns/0细胞、hek293t细胞或hek293a细胞,或者引入其他真核细胞,如来自植物的细胞、真菌或酵母细胞等。可通过本领域已知的方法将本发明所述的载体引入到所述宿主细胞中,例如电穿孔、iipofectine转染、iipofectamin转染等。
[0083]
此外,本发明提供了一种制备所述肿瘤抗原表位肽或者所述融合蛋白或者免疫缀合物的方法,所述方法包括,在使得所述肿瘤抗原表位肽或者所述融合蛋白或者免疫缀合物表达的情况下,培养本发明所述的宿主细胞,例如,可以通过使用适当的培养基、适当的温度和培养时间等,这些方法是本领域普通技术人员所熟知的。
[0084]
本发明提供了一种体内递送系统,其包含上述所述的核酸分子,所述递送系统包括球形核酸、病毒、病毒样颗粒、质粒、细菌质粒或纳米颗粒。
[0085]
本发明提供了一种细胞,其包含或者表达上述所述的肿瘤抗原表位肽或者上述所述的融合蛋白或者免疫缀合物,或包含上述所述的载体,或包含上述所述的递送系统。
[0086]
优选的,其为抗原呈递细胞。
[0087]
优选的,其为树突细胞,所述树突状细胞选自未成熟、半成熟或成熟的树突状细胞。
[0088]
优选的,其为未成熟的树突细胞。
[0089]
优选的,其为自体细胞。
[0090]
所述抗原呈递细胞(apc)是在其细胞表面上呈递与mhc分子相关的蛋白质抗原的肽片段的细胞。一些apc可以活化抗原特异性t细胞。专职抗原呈递细胞通过吞噬作用或通过受体介导的内吞作用非常有效地内化抗原,随后在其膜上显示与ii类mhc分子结合的抗原片段。t细胞识别抗原呈递细胞膜上的抗原-ii类mhc分子复合物并与其相互作用。随后由抗原呈递细胞产生其他共刺激信号,从而导致t细胞的活化。共刺激分子的表达是专职抗原呈递细胞的定义性特征。
[0091]
专职抗原呈递细胞的主要类型是树突细胞,其具有最广泛的抗原呈递范围,并且可能是最重要的抗原呈递细胞、巨噬细胞、b细胞和某些活化的上皮细胞。
[0092]
树突细胞(dc)是经由mhc ii类和i类抗原呈递途径将外周组织中捕获的抗原呈递给t细胞的白细胞群。众所周知,树突细胞是免疫反应的有效诱导物,并且这些细胞的活化是诱导抗肿瘤免疫的关键步骤。
[0093]
树突细胞方便地分类为“未成熟的”和“成熟的”细胞,其可以用作区分两种充分表征的表型的简单方法。然而,这种命名法不应被解释为排除所有可能的分化中间阶段。
[0094]
未成熟的树突细胞被表征为具有高抗原摄取和处理能力的抗原呈递细胞,其与fey受体和甘露糖受体的高表达相关。成熟表型的特征通常为这些标志物的较低表达以及负责t细胞活化的细胞表面分子(诸如i类和ii类mhc、粘附分子(例如,cd54和cd11)以及共刺激分子(例如,cd40、cd80、cd86和4-1bb))的高表达。
[0095]
本发明提供了一种药物组合物,其包含上述所述的肿瘤抗原表位肽、或上述所述的融合蛋白或者免疫缀合物,或上述所述的载体,或上述所述的递送系统、或上述所述的细胞,以及任选地药学上可接受的载体或佐剂。
[0096]
优选的,所述药物组合物为预防或治疗癌症的疫苗。
[0097]
所述药学上可接受的载体或者佐剂可以是缓冲剂、抗氧化剂、防腐剂、低分子量小肽、蛋白质、亲水聚合物、氨基酸、糖、螯合剂、反离子、金属复合物和/或非离子表面活性剂等。
[0098]
在本发明中,可按照本领域的常规技术手段将所述药物组合物与可药用载体或稀释剂以及任何其他已知的辅剂和赋形剂配制在一起。
[0099]
所述药物组合物可以用于在体内(例如,生物体内,如动物体内或人体内)或体外(例如分离的细胞或者组织中)产生免疫活性物质。
[0100]
本发明所述的药物组合物可以为适于口服给药的形式,如片剂、胶囊剂、丸剂、粉剂、缓释制剂、溶液剂、混悬剂或者用于肠胃外注射,如无菌溶液剂、混悬剂或乳剂,或者用于软膏或乳膏局部给药或作为栓剂直肠给药。所述药物组合物可以是适合精确剂量单词给药的单位剂量形式。所述药物组合物可以进一步包含常规的药物载体或者赋形剂,此外,所述的药物组合物可以包括其他药物或药剂、载体、佐剂等。
[0101]
本发明提供了上述所述的肿瘤抗原表位肽、或上述所述的融合蛋白或者免疫缀合物,或上述所述的载体,或上述所述的递送系统、或上述所述的细胞在制备预防或治疗肿瘤的肽疫苗、基因疫苗或者dc疫苗药物中的用途。
[0102]
优选的,所述疫苗药物与一种或多种预防或治疗肿瘤的其它疫苗药物或化疗药物联合使用。
[0103]
所述预防或者治疗指:1)治愈、减缓、减轻经诊断的病理状况或病症的症状,和/或中止该病理状况或病症的进展的治疗措施;和2)预防或减缓目标病理状况或病症的发展的预防性或防范性措施。因此,需要治疗的受试者包括已经患有该病症的受试者、易于患该病症的受试者以及要预防该病症的受试者。
[0104]
所述疫苗涉及在施用后诱导免疫反应(例如细胞或体液免疫反应)的药物制剂(药物组合物)或产品,其通过直接或间接作用(例如,将抗原呈递给其他免疫效应细胞)识别并攻击病原体或患病细胞(诸如癌细胞)。疫苗可以用于预防或治疗疾病。
[0105]
本发明所述的疫苗可以用于治疗受试者(例如,哺乳动物,比如人)中的一种或多种癌症。所述癌症可以包括但不限于,例如,黑色素瘤、脑癌、骨癌。白血病、淋巴瘤、上皮细胞癌、腺癌、胃肠道癌(如唇癌、口腔癌、食道癌、小肠癌、胃癌、结肠癌)、肝癌、膀胱癌、胰腺癌、卵巢癌、宫颈癌、肺癌、乳腺癌、皮肤癌、鳞状细胞癌、前列腺癌和/或肾细胞癌等。
[0106]
在某些情形中,所述疫苗中可包含一种或多种免疫原性载体或者佐剂。例如,所述肿瘤抗原表位肽、所述融合蛋白或者免疫缀合物或可与一种或者糖脂类似物相组合或者结合,以增强免疫效果。
[0107]
本发明所述的疫苗或者药物组合物可被用于免疫(例如,通过皮下或者淋巴结内施用)受试者。所述疫苗中也可以包含一种或多种药学上可接受的佐剂,例如缓冲剂、抗氧化剂、防腐剂。低分子量小肽、蛋白质、亲水聚合物、氨基酸、糖、螯合剂、反离子、金属复合物和/或非离子表面活性剂。
[0108]
本发明提供了上述所述的肿瘤抗原表位肽、或上述所述的融合蛋白或者免疫缀合物,或上述所述的载体,或上述所述的递送系统、或上述所述的细胞在制备肿瘤诊断试剂或试剂盒中的用途。
[0109]
实施例
[0110]
本发明对试验中所用到的材料以及试验方法进行一般性和/或具体的描述,在下面的实施例中,如果无其他特别的说明,%表示wt%,即重量百分数。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
[0111]
实施例1肿瘤新生抗原表位肽的预测1、材料准备获取肿瘤患者的肿瘤组织,通过illumina高通量测序平台完成肿瘤组织wes和rna-seq测序。
[0112]
2、数据质量控制dna和rna测序原始fastq数据通过fastqc软件进行质量控制得到质控过滤之后数据clean.fq.gz。
[0113]
3、数据比对质控之后的dna数据使用bwa软件进行与比对分析分别得到肿瘤和正常组织dna数据的bam文件,质控之后的rna使用hisat2软件进行比对分析,得到肿瘤rna数据的bam文件。
[0114]
4、bam文件处理比对之后的bam文件需要进一步处理,dna数据的bam文件使用samtools、picard、gatk等软件进行bam文件的排序,去除重复数据、局部重新比对和碱基质量校正分析,得到过滤之后的dna-bam文件。rna数据bam文件进行排序和质量控制处理得到处理之后的rna-bam文件。
[0115]
5、遗传系突变和体细胞突变检测使用gatk,varscan,strelka,freebayes,vardict,somaticsniper软件综合检测肿瘤患者的遗传系突变和体细胞突变,得到包含572个突变的vcf文件。
[0116]
6、突变位置rna覆盖深度及表达量计算使用bam-readcount软件基于vcf文件和比对得到的bam文件计算突变点rna丰度等特征信息。
[0117]
7、突变注释使用vep对检测得到的突变进行多种数据库的注释,其中包括基因注释,cosmic,clinvar等数据库的注释。
[0118]
8、基因突变导致的表位肽提取基于以上步骤得到遗传系突变和体细胞突变信息,进行突变位点表位肽的综合准确提取,并且相对应的提取正常野生型基因型的表位肽序列。表位肽提取使用滑窗模式,具体的分别以8-11个氨基酸长度的滑窗,在突变位点上下游位置进行逐步滑窗提取包含突变氨基酸的表位肽序列,滑窗的步移长度为1。
[0119]
9、mhc分子类型鉴定基于rna测序数据,使用seq2hla进行mhci和mhcii分子类型进行鉴定,患者a的hla-i分型为:hla-a*02:06、hla-a*24:02、hla-b*40:01、hla-c*03:02、hla-c*03:04;患者b的hla-i分型为:hla-a*11:01、hla-a*26:01、hla-b*40:01、hla-b*38:01、hla-c*07:02、hla-c*12:
03;患者c的hla-i分型为:hla-a*11:01、hla-b*44:03、hla-c*14:03、hla-c*07:02。
[0120]
10、hla亲合力预测基于上述步骤得到的表位肽序列和hla类型,使用netmhcpan、netmhciipan、netmhc、netmhccons、mhcnuggets多软件进行综合预测,得到突变表位肽亲和力预测结果及ic50值。
[0121]
11、对高亲和力突变表位肽进行排序利用打分函数:score=a+fc+e,计算预测的肿瘤新生抗原总得分值,score值大小和新生抗原可信度成呈正相关关系。
[0122]
其中,a=t-r(med[1: n]),a表示突变表位肽亲和力打分,t是候选评估表位肽总体数量,med表示求中位数函数,[1:n]表示第一个软件到第n个软件的亲和力预测值列表,r表示求排序值函数,最小为1,在此表示此突变表位肽在所有表位肽亲和力值排名;fc=t-r(mt/wt),t是候选评估表位肽总体数量,是突变型表位肽mt亲和力值和正常表位肽wt的亲和力比值,r表示求排序值函数,最小为1,在此表示此突变表位肽mt和对应wt亲和力比值在所有表位肽比值中排名;e=t-r(m*n*2+v),t是候选评估表位肽总体数量,m是突变所在位置基因或者转录本表达量,n表示突变位点rna的变异频率,v=vaf(dna)/2、vaf(dna)是dna碱基突变的变异频率,r表示求排序值函数,最小为1,在此表示此突变表位肽在所有表位肽中对应值排名。
[0123]
实施例2肿瘤新生抗原表位肽与四聚体结合能力的检测肿瘤新生抗原刺激t细胞活化,首先要能与抗原提呈细胞(apc)的hla分子结合形成复合物表达在细胞表面,供t细胞表面的t细胞受体识别。因此,利用重组四聚体检测预测的表位肽与四聚体的结合能力。
[0124]
检测方法是基于mhc i类分子肽置换的能力,mhc i类四聚体是由被一种弱亲和力的肽所折叠的单体单元形成,在一种合适的肽置换因子的作用下,可产生结合特异性目的肽的四聚体复合物。检测技术基于流式细胞术,主要试剂包括能够捕获 mhc i类四聚体的抗体偶联的磁珠,和能够识别被置换下的肽段的fitc标记抗体。通过测算初始肽被目的肽竞争性置换掉的百分比,判断目的肽与mhc四聚体结合的能力,以及形成的四聚体是否能够用于抗原特异性cd8+t细胞的流式染色。
[0125]
操作方法如下:(1)制备新抗原肽溶液使用dmso(sigma)溶解实施例1所得到的表位肽冻干粉,制成表肽溶液,将quickswitch tetramer(mbl)加入微孔板,然后分别加入表位肽溶液和肽置换因子(所述肽置换因子是试剂盒quickswitch tetramer(mbl)中的一支试剂,原理是抗原多肽与mhc分子的结合是竞争性的,在肽置换因子的催化反应下,强亲合力的多肽能替换掉原来预置在其中的弱亲和力的多肽,从而获得目标四聚体),避光于室温下孵育4小时以上,然后于2-8℃储存。
[0126]
(2)制备肽标准品:采用与制备新抗原表位肽溶液相同的方法制备肽标准品(阳性对照),然后避光于室温下孵育4小时以上,然后于2-8℃储存。
[0127]
(3)流式细胞仪测定表位肽的置换效率将上述制备得到的新抗原表位肽/肽标准品-四聚体混合物使用流式细胞仪进行分析,其是首先使用磁珠捕获四聚体,然后加入荧光标记抗体,洗涤之后常规方法上机检测,通过各个样本的平均荧光强度(mfi-fitc)换算肽置换效率,其结果如表1和表2所示,hla-a*02:
06型肿瘤新生抗原表位肽与四聚体的结合能力荧光强度分别如图1-图6所示,hla-a*11:01型肿瘤新生抗原表位肽与四聚体的结合能力的应该强度如图7-8所示。
[0128]
表1 hla-a*02:06型肿瘤新生抗原表位肽与四聚体的结合能力其中,阴性对照为不添加多肽的对照;阳性对照为针对hla分型特异性强亲和力的多肽(quickswitch
™ꢀ
custom tetramer 试剂盒,mbl公司)。
[0129]
表2 hla-a*11:01型肿瘤新生抗原表位肽与四聚体的结合能力由表1、表2以及图1-图6可以看出,判断置换效率≥75%为表位肽能成功形成目标四聚体,分别是gyl-m1、gyl-m5、gyl02-sp-6、yd-m-2、yd-m-5、ws-sp-5。抗原肽引起机体免疫应答的前提是其首先能和机体的hla分子形成复合体,而上述6种表位肽能和相应分型的四聚体呈现很高的亲和结合能力,是潜在的可引起特异性免疫应答的候选抗原表位。
[0130]
实施例3. 肿瘤新生抗原表位肽诱导肿瘤患者细胞免疫应答分析将能与hla分子结合的新生抗原表位肽负载dc细胞后给肿瘤患者注射,通过elispot实验检测产生γ-干扰素的抗原特异t细胞频数,分析接种肿瘤新生抗原负载的dc疫苗后肿瘤患者产生的抗原特异t淋巴细胞应答。
[0131]
3.1 患者a外周血特异性细胞毒性t细胞elispot检测从患者a采全血,分离血浆后,按照ge标准(ge healthcare life sciences,ficoll)操作流程分离人外周血单个核细胞(pbmc),并进行计数和活率。取一定量pbmc制备成细胞密度2
×
10
6
/ml的溶液,然后将实施例2所得到的抗原表位肽加入到pbmc中(溶液:表位肽溶液的体积比为1000:1),混匀后加入到预包被的elispot孔板中,每组各做两复孔,设立无关肽对照(人体免疫缺陷病毒(hiv)的抗原表位肽)、pha对照,过夜培养20小时。第二天,按试剂盒标准方法(elispot试剂盒,达科为)进行检测,并用仪器分析检测斑点,其结果如图9所示。
[0132]
3.2 患者b外周血特异性细胞毒性t细胞elispot检测按照与实施例3.1相同的方法进行操作,其结果如图10所示。
[0133]
3.3 患者c外周血特异性细胞毒性t细胞elispot检测按照与实施例3.1相同的方法进行操作,其结果如图11所示。
[0134]
从上面的图可以看出,三名患者在接受完一疗程的dc疫苗治疗后,能在外周血中
检测到针对此6种表位肽产生免疫应答的特异性杀伤型t细胞。
[0135]
以上所述,仅是本发明的较佳实施例而已,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



