一种酮还原酶及S-1-BOC-3羟基哌啶的酶催化制备方法与流程
 2021-02-02 10:02:04|
2021-02-02 10:02:04| 312|
312| 起点商标网
起点商标网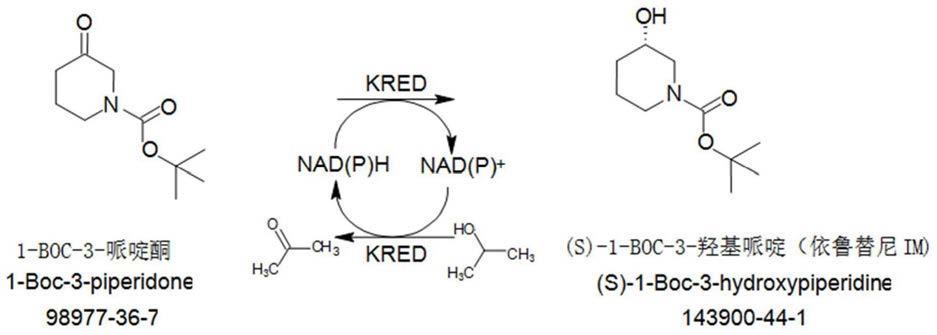
一种酮还原酶及s-1-boc-3羟基哌啶的酶催化制备方法
技术领域
[0001]
本发明属于生物催化技术领域,特别涉及一种酮还原酶及s-1-boc-3羟基哌啶的酶催化制备方法。
背景技术:
[0002]
s-1-boc-3羟基哌啶是合成药物依鲁替尼非常重要的中间体,依鲁替尼(ibrutinib)是由johnson公司和pharmacyclics公司合作研发的靶向抗癌新药,用于治疗套细胞淋巴瘤,其药效从目前情况看是非常强力的。目前依鲁替尼的市场需求量增长强劲,从刚投放市场的5亿美元销售额增长到现在50亿美元以上的销售额,市场前景非常广阔。
[0003]
目前合成s-1-boc-3羟基哌啶主要采用化学拆分法或酶法合成:公告号为cn105801518b“一种(s)-1-boc-3-羟基哌啶的合成方法”专利,发明人以r-甘油醛缩丙酮为起始原料,通过witting反应,钯碳还原双键,催化加氢等步骤合成s-1-boc-3羟基哌啶,该合成方法利用的是化学拆分法,虽然与常规拆分方法相比,改变了起始手性物料,降低了成本,但此方法步骤繁多,所用试剂较多,是一种非常不经济环保的方式。
[0004]
近年来,国内外公司开发了用酮还原酶立体选择性还原1-boc-3-哌啶酮至(s)-1-boc-3-羟基哌啶的技术,公告号为cn105200089b“(s)-1-叔丁氧羰基-3-羟基哌啶制备方法及其装置”的专利,利用酮还原酶催化1-boc-3哌啶酮生成s-1-boc-3羟基哌啶,以异丙醇作为氢供体,该方法相较于传统的化学合成法更为绿色环保,并且在手性产品合成上具有优势,但是该方案中单次反应1-boc-3哌啶酮浓度为125g/l,辅酶浓度较高,在面对较高的1-boc-3哌啶酮及辅酶的原料价格下,难以实现工业化应用。
[0005]
公告号为cn106520856b“(s)-n-叔丁氧羰基-3-羟基哌啶的酶催化制备方法”的专利,利用酮还原酶催化技术,催化n-叔丁氧羰基-3-哌啶酮进行还原反应得到(s)-n-叔丁氧羰基-3-羟基哌啶,但反应过程中底物浓度最高可达250g/l,虽然可以工业化应用,但是由于单次反应底物浓度较低造成生产成本增加。
[0006]
因此,虽然目前对利用酮还原酶催化合成s-1-boc-3羟基哌啶的研究较多,但大都显示单次反应催化底物1-boc-3哌啶酮的浓度较低,酶和辅酶用量较高,增加了成本,同时给后处理提纯步骤带来诸多不便,较难实现工业化生产。
技术实现要素:
[0007]
为了解决上述化学法或酶法合成s-1-boc-3羟基哌啶中存在的至少一个技术问题,本发明提供一种s-1-boc-3羟基哌啶的酶催化制备方法。
[0008]
为达到上述目的,本发明所采用的技术方案如下:一种s-1-boc-3羟基哌啶的酶催化制备方法,所述酶催化制备方法以1-boc-3哌啶酮为底物,在辅酶、辅酶循环体系和酮还原酶存在条件下反应,得到含s-1-boc-3羟基哌啶的反应液;所述的酮还原酶编码基因的核苷酸序列如序列表seq id no:1所示,所述酮还原酶的
氨基酸序列如序列表seq id no:2所示。
[0009]
进一步地,所述制备方法还包括提纯步骤,包括:向所述反应液中加入助滤剂,经过滤、浓缩、萃取、结晶、再过滤和干燥,获得s-1-boc-3羟基哌啶。
[0010]
进一步地,所述助滤剂为硅藻土。
[0011]
进一步地,所述酮还原酶以菌体、菌体破壁后的液体酶、酶粉、固定化细胞或固定化酶粉中的一种或几种形式参与反应。
[0012]
进一步地,所述的辅酶为nad(烟酰胺腺嘌呤二核苷酸)或nadp(烟酰胺腺嘌呤二核苷酸磷酸),辅酶的用量为底物1-boc-3哌啶酮用量的0.25~1wt
‰
。
[0013]
进一步地,辅酶循环体系包括ipa辅酶循环体系、gdh和葡萄糖辅酶循环体系或fdh和甲酸盐辅酶循环体系。
[0014]
进一步地,所述反应中还需要加入缓冲液,缓冲液可以是磷酸盐缓冲液、硼酸盐、tris缓冲液或三乙醇胺缓冲液中的一种,反应ph范围为5.0~9.0,反应温度为20~60℃。
[0015]
进一步地,1-boc-3哌啶酮底物的浓度为400g/l;酮还原酶以菌体形式加入,菌体浓度为15g/l;辅酶为nad,nad的浓度为0.1g/l;辅酶循环体系为ipa辅酶循环体系,ipa体积为总反应体积的20%,反应ph为7.0,反应温度为40℃,反应时间为24小时。
[0016]
本发明还涉及一种酮还原酶,所述酮还原酶编码基因的核苷酸序列如序列表seq id no:1所示,所述酮还原酶的氨基酸序列如序列表seq id no:2所示。
[0017]
进一步地,所述酮还原酶的制备方法包括以下步骤:将核苷酸序列如序列表seq id no:1的所述大肠杆菌菌株接种至含有氯霉素的培养基中进行活化培养,得到培养液;向所述培养液中添加诱导剂诱导酮还原酶表达,得到酮还原酶;优选的,所述诱导剂为异丙基-β-d-硫代半乳糖苷。
[0018]
本发明具有如下所述的有益效果:本发明提供的酮还原酶及s-1-boc-3羟基哌啶的酶催化制备方法,只需一步即可合成得到目标产物,所用试剂少,无需化学法合成s-1-boc-3羟基哌啶所用的手性拆分、催化加氢等繁琐步骤。同时,与目前研究较多的酶催化合成方法相比,本发明的酮还原酶对底物1-boc-3哌啶酮耐受性好,单次反应1-boc-3哌啶酮承载量高,辅酶用量少,最终获得的s-1-boc-3羟基哌啶产品的手性纯度高,降低了成本,能够实现工业化生产。
附图说明
[0019]
图1是本发明s-1-boc-3羟基哌啶的合成路线示意图;图2是本发明实施例2的底物转化率检测方法的gc图谱;图3是本发明实施例3的产物光学纯度检测方法的hplc图谱。
具体实施方式
[0020]
下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述。
[0021]
实施例1酮还原酶菌体及酶粉的制备将核苷酸序列如序列表seq id no:1的所述大肠杆菌菌株接种于含有氯霉素抗性的lb固体培养基,37℃培养20h。挑取单菌落接种于含有氯霉素抗性的50ml lb液体培养基,振荡培养20h,培养结束后移取菌液于250ml tb液体培养基,培养2.5后取菌液稀释检测od值为
0.7,加入0.1mm异丙基-β-d-硫代半乳糖苷诱导蛋白表达,30℃振荡培养18h,8000rpm离心收集菌体。
[0022]
制备的菌体用0.1mol/l的pbs缓冲液(ph=7.0)进行回溶菌体,均质破碎,离心收集酶液上清进行冷冻干燥,得到酮还原酶(酶粉),其中,所述pbs缓冲液的加入量按照重量比是菌体∶pbs缓冲液=1∶5的比例进行添加。
[0023]
实施例2 1-boc-3-哌啶酮转化率检测方法gc分析方法:色谱柱db-wax 30m*0.25μm*0.25mm,检测器:fid,进样温度:230℃,检测器温度:300℃,流速为1.0ml/min,分流比:20∶1,进样体积:1ul,分析时间44min,1-boc-3哌啶酮的保留时间为25.434min,s-1-boc-3羟基哌啶的保留时间为22.572min。
[0024]
实施例3 s-1-boc-3-羟基哌啶光学纯度检测方法hplc分析方法:分析柱chiralpakig,流动相分别为0.1%甲酸水溶液和甲醇,流速为0.2ml/min,柱温25℃,检测波长为210nm,分析时间4min,s-1-boc-3羟基哌啶的保留时间为26.619min,r-1-boc-3羟基哌啶的保留时间为28.410min。
[0025]
实施例4酮还原酶催化合成s-1-boc-3羟基哌啶称取3g(湿重)实施例1制备获得的表达酮还原酶的大肠杆菌菌体,悬浮于160ml的0.1m,ph为7.0的磷酸缓冲液中,加入1-boc-3哌啶酮80g,40ml异丙醇、0.02g的nad,在40℃下,搅拌反应24小时,取样用二氯甲烷淬灭反应,根据实施例2和3检测转化率和手性,1-boc-3哌啶酮的转化率为99.9%,光学纯度e.e%为99.9%。
[0026]
向上述反应24小时的反应液中加入硅藻土,搅拌1小时后减压过滤,收集到的液体旋蒸浓缩除去丙酮异丙醇等低沸点化合物,剩余液体经二氯甲烷萃取,低温结晶,过滤,干燥后获得68g固体,收率为85%,gc检测纯度大于99.5%,ee>99.9%。
[0027]
实施例5 gdh循环体系合成s-1-boc-3羟基哌啶称取3g(湿重)实施例1制备获得的表达酮还原酶的大肠杆菌菌体,悬浮于200ml的0.1m,ph为7.0的磷酸缓冲液中,加入1-boc-3哌啶酮20g,1g葡萄糖脱氢酶(gdh),27g葡萄糖,0.02g的nad,在40℃下,搅拌反应24小时,取样用二氯甲烷淬灭反应,根据实施例2和3检测转化率和手性,1-boc-3-哌啶酮的转化率为99.9%,光学纯度e.e%为99.9%。
[0028]
实施例6 fdh循环体系合成s-1-boc-3羟基哌啶称取3g(湿重)实施例1制备获得的表达酮还原酶的大肠杆菌菌体,悬浮于200ml的0.1m,ph为7.0的磷酸缓冲液中,加入1-boc-3哌啶酮20g,1g甲酸脱氢酶(fdh),10g甲酸铵,0.02g的nad,在40℃下,搅拌反应24小时,取样用二氯甲烷淬灭反应,根据实施例2和3检测转化率和手性,1-boc-3-哌啶酮的转化率为99.9%,光学纯度e.e%为99.9%。
[0029]
实施例7反应温度的优化进行五组平行实验,各称取0.75g(湿重)实施例1制备获得的表达酮还原酶的大肠杆菌菌体,悬浮于40ml的0.1m,ph为7.0的磷酸缓冲液中,加入1-boc-3哌啶酮20g,10ml ipa,0.005g的nad,分别在20-60℃条件下搅拌反应24小时。
[0030]
反应结束后,取样用二氯甲烷淬灭反应,按照实施例2的gc检测方法检测底物1-boc-3哌啶酮的转化率,具体结果如表1表所示。
[0031]
表1不同反应温度条件下的底物转化率温度24小时转化率
20℃85.2%30℃97.8%40℃99.9%50℃87.4%60℃62.1%通过表1的检测结果可知,在40℃条件下反应时,所获得的转化率最高。
[0032]
实施例8反应ph的优化进行五组平行实验,各称取0.75g(湿重)实施例1制备获得的表达酮还原酶的大肠杆菌菌体,分别悬浮于40ml的0.1m,不同ph(5.0~9.0)的磷酸缓冲液中,每组加入1-boc-3哌啶酮20g、10ml ipa、0.005g的nad,在40℃条件下下搅拌反应24小时。
[0033]
反应结束后,取样用二氯甲烷淬灭反应,按照实施例2的gc检测方法检测1-boc-3哌啶酮转化率,具体结果如表2表所示。
[0034]
表2不同ph条件下的的转化率ph24小时转化率5.035.1%6.071.4%7.099.9%8.099.9%9.092.7%通过表2的检测结果可知,ph为7.0~8.0的反应条件下,所获得的转化率最高。
[0035]
以上述依据本发明的理想实施例为启示,通过上述的说明内容,相关工作人员完全可以在不偏离本项发明技术思想的范围内,进行多样的变更以及修改。本项发明的技术性范围并不局限于说明书上的内容,必须要根据权利要求范围来确定其技术性范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



