大豆GmHSFA2和GmHSP20a在增强植物开花期耐热性能中的应用的制作方法
 2021-02-02 09:02:07|
2021-02-02 09:02:07| 273|
273| 起点商标网
起点商标网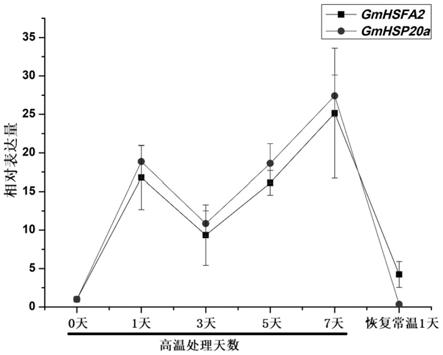
大豆gmhsfa2和gmhsp20a在增强植物开花期耐热性能中的应用
技术领域
[0001]
本发明属于生物基因工程技术领域,具体涉及大豆热激转录因子基因gmhsfa2及其调控的热激蛋白基因gmhsp20a在提高植物开花期耐热性能中的应用。
背景技术:
[0002]
大豆是重要的经济油料作物之一,含有丰富的蛋白质和脂肪,在世界范围内广泛种植。温度是影响植物生理生化过程的重要生态因子,由高温环境引起对植物的生理伤害称为高温胁迫。近年来,随着工农业快速发展,温室气体大量排放,导致大气温度增高。全球气候变暖加剧,使得高温热害变得更加频繁。近30年来,夏季极端高温在我国黄淮海地区和南方地区时有发生。植物雄性生殖器官的发育过程对温度极其敏感,夏季持续的高温会造成大豆雄性生殖发育出现异常,最终导致大豆产量不同程度降低。据预测,21世纪全球气温会在频繁热害事件的伴随下继续稳步上升,高温将会成为未来全球气候的重要特点之一。因此,提高大豆开花期的耐热性,创制和培育大豆耐热新品种是降低高温胁迫危害的关键。随着高通量基因鉴定方法和基因功能验证技术的日趋成熟,为揭示作物开花期响应高温胁迫的分子机理提供依据,更为通过基因工程手段培育耐高温作物奠定基础。其中,作物开花期耐高温相关基因的发掘和解析是关键。
[0003]
植物在感知环境中的高温信号后,可通过诱导高温胁迫相关基因包括热激转录因子(heat-shock factor,hsf)和热激蛋白(heat-shock protein,hsp)在内的基因表达来适应高温环境,且hsf能识别hsp启动子区域的热激元件(heat-shock element,hse)来促进其转录表达。植物hsfa2为hsfa亚家族成员之一,其能够在高温胁迫下激活一系列hsp和高温保护有关基因,从而提高植物的耐热性。近年来,hsfa2在参与植物抵御高温胁迫调控过程中的功能得到越来越多的研究,其被认为是应对高温胁迫的基因调控网络系统的核心之一。目前对hsfa2和hsp基因与开花期高温胁迫的研究主要集中于模式植物拟南芥和番茄。大豆已知至少有38个hsf基因和51个hsp20基因,但未见大豆hsf及其调控的hsp20基因参与调控植物开花期响应高温胁迫的报道。通过生物基因工程技术克隆gmhsfa2基因及其下游调控基因gmhsp20a,并对其进行功能验证,能够为提高大豆开花期耐热能力提供重要基础,更为大豆抗热分子育种提供重要的基因资源,具有重要价值。
技术实现要素:
[0004]
本发明的目的是针对现有技术的上述不足,提供一个大豆热激转录因子基因gmhsfa2及其编码蛋白gmhsfa2、gmhsfa2的下游调控基因gmhsp20a及其编码蛋白gmhsp20a在响应植物开花期高温胁迫过程中的功能,及其培育耐高温植物中的作用。
[0005]
本发明的目的可通过如下技术方案实现:
[0006]
本发明保护如下1)-3)中任一种物质在增强植物开花期耐热性能中的应用:
[0007]
1)蛋白gmhsfa2和/或gmhsp20a;
[0008]
2)编码蛋白gmhsfa2和/或蛋白gmhsp20a的基因;
[0009]
3)含有编码蛋白gmhsfa2和/或蛋白gmhsp20a的基因的重组载体、表达盒、转基因细胞系或重组菌;
[0010]
所述蛋白gmhsfa2为如下(1)或(2):
[0011]
(1)由序列表中seq id no.2所述的氨基酸序列组成的蛋白质;
[0012]
(2)将序列表中seq id no.2所述的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的由(1)衍生的蛋白质。
[0013]
所述蛋白gmhsp20a为如下(1)或(2):
[0014]
(1)由序列表中seq id no.4所述的氨基酸序列组成的蛋白质;
[0015]
(2)将序列表中seq id no.4所述的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的由(1)衍生的蛋白质。
[0016]
gmhsfa2能够响应大豆开花期高温胁迫高度表达,激活下游热激蛋白gmhsp20a等相关抗热基因的表达,提高植物开花期的耐热能力。
[0017]
本发明保护如下1)-3)中任一种物质在培育开花期耐热性能提高的植物中的应用:
[0018]
1)蛋白gmhsfa2和/或gmhsp20a;
[0019]
2)编码蛋白gmhsfa2和/或蛋白gmhsp20a的基因;
[0020]
3)含有编码蛋白gmhsfa2和/或蛋白gmhsp20a的基因的重组载体、表达盒、转基因细胞系或重组菌;
[0021]
所述蛋白gmhsfa2为如下(1)或(2):
[0022]
(1)由序列表中seq id no.2所述的氨基酸序列组成的蛋白质;
[0023]
(2)将序列表中seq id no.2所述的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的由(1)衍生的蛋白质。
[0024]
所述蛋白gmhsp20a为如下(1)或(2):
[0025]
(1)由序列表中seq id no.4所述的氨基酸序列组成的蛋白质;
[0026]
(2)将序列表中seq id no.4所述的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的由(1)衍生的蛋白质。
[0027]
上述应用中,所述编码蛋白gmhsfa2的基因具有序列表中seq id no.1所述的核苷酸序列。
[0028]
上述应用中,所述编码蛋白gmhsp20a的基因具有序列表中seq id no.3所述的核苷酸序列。
[0029]
上述应用中,所述gmhsp20a所在的启动子,具有如seq id no.5所示的核苷酸序列。
[0030]
优选的,所述gmhsp20a所在的启动子hse元件,具有如seq id no.6所示的核苷酸序列。
[0031]
本发明所述的一种大豆热激蛋白基因gmhsp20a起始密码子上游100-500bp hse元件所在区域,核苷酸序列如seq id no.6所示。gmhsp20a启动子hse元件能被gmhsfa2所识别,从而激活gmhsp20a的转录表达。
[0032]
上述应用中,所述植物为单子叶植物或双子叶植物;其中,所述双子叶植物为豆科
植物或十字花科植物。
[0033]
本发明还保护一种培育开花期耐热性能提高的植物的方法,为将编码蛋白gmhsfa2和/或gmhsp20a的dna导入目的植物中,得到转基因植物,所述转基因植物开花期耐热性能高于目的植物:其中,所述编码蛋白gmhsfa2和/或gmhsp20a的dna分子通过重组载体导入所述目的植物中。
[0034]
本发明还保护一种重组载体,为将编码蛋白gmhsfa2和/或gmhsp20a的基因插入表达载体中,得到表达蛋白gmhsfa2和/或gmhsp20a的重组载体:
[0035]
所述蛋白gmhsfa2为如下(1)或(2):
[0036]
(1)由序列表中seq id no.2所述的氨基酸序列组成的蛋白质;
[0037]
(2)将序列表中seq id no.2所述的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的由(1)衍生的蛋白质。
[0038]
所述蛋白gmhsp20a为如下(1)或(2):
[0039]
(1)由序列表中seq id no.4所述的氨基酸序列组成的蛋白质;
[0040]
(2)将序列表中seq id no.4所述的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的由(1)衍生的蛋白质。
[0041]
本发明所述的重组质粒,是将本发明所述的大豆热激转录因子基因gmhsfa2或热激蛋白基因gmhsp20a插入pcambia3301植物过表达载体中。
[0042]
本发明所用农杆菌为农杆菌eha105。
[0043]
本发明还保护所述的大豆热激转录因子基因gmhsfa2和热激蛋白基因gmhsp20a在大豆开花期抗高温的应用。
[0044]
本发明还保护所述的大豆热激转录因子基因gmhsfa2和热激蛋白基因gmhsp20a在培育开花期耐高温大豆品种中的应用。
[0045]
本发明还保护含本发明所述的大豆热激转录因子基因gmhsfa2和热激蛋白基因gmhsp20a的重组质粒在大豆开花期抗高温作用中的应用。
[0046]
本发明还保护含本发明所述的大豆热激转录因子基因gmhsfa2和热激蛋白基因gmhsp20a的重组质粒在培育开花期耐高温植物中的应用。
[0047]
有益效果:
[0048]
本发明所提供的大豆热激转录因子基因gmhsfa2,位于第14条染色体上,读码框长度为1095bp。该基因具有dna结合结构域(dna binding domain,dbd)、寡聚化结构域(oligomerization domain with two adjacent hydrophobic heptad repeats,包含hr-a/b的od)、核定位信号(nuclear localization signal,nls)和激活结构域(aromatic and hydrophobic with acidic,aha)等hsfa2所特有的保守结构域。gmhsfa2序列中存在的dbd能够结合下游耐热功能基因启动子区域的hse元件,如本发明所提供的大豆热激蛋白gmhsp20a。gmhsp20a位于第12条染色体上,读码框长度为636bp。该基因起始密码子上游500bp启动子区域内包含4个hse元件。在高温胁迫下,hsfa2能够结合在hsp基因的hse元件上,帮助因高温胁迫而失活的蛋白质重新组装成有活性的高级结构,维护正常的细胞功能,从而提高植物的耐热能力,因而gmhsfa2/gmhsp20a具有重要的高温胁迫响应功能。
[0049]
利用任何一种可以引导外源基因在植物中表达的载体,将本发明gmhsfa2或gmhsp20a基因导入植物细胞,均可获得对高温胁迫抵抗能力得到提高的转基因植株。使用
本发明的基因构建植物表达载体时,在其转录起始核苷酸前可加上任何一种增强启动子或诱导型启动子。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所使用的载体进行加工,如加入植物可选择性标记(gus基因、萤光素酶基因等)或具有抗性的抗生素标记物(庆大霉素、卡那霉素等)。携带有本发明gmhsfa2和gmhsp20a的表达载体可通过使用ti质粒、ri质粒、植物病毒载体、直接dna转化、微注射、电导、农杆菌介导等常规生物学方法转化植物细胞或组织,并将转化的植物组织培育成植株。被转化的宿主既可以是单子叶植物,也可以是双子叶植物。本发明的基因对大豆开花期具有抗高温作用,特别是培育开花期耐高温大豆品种具有重要意义。
附图说明
[0050]
图1为高温处理前后大豆混合花芽中gmhsfa2与gmhsp20a的表达图谱。横坐标为处理天数,纵坐标为gmhsfa2与gmhsp20a的相对表达量。
[0051]
图2为gmhsfa2蛋白结构模型和gmhsp20a基因结构模型。其中a为gmhsfa2蛋白结构模型,dbd为n端dna结合结构域、od为寡聚化结构域、nls为核定位信号、aha为酸性c端激活结构域;b为gmhsp20a基因结构模型。
[0052]
图3为gmhsfa2与gmhsp20a启动子在酵母中的互作验证。
[0053]
图4为gmhsfa2与gmhsp20a基因过表达载体构建示意图。其中a为gmhsfa2基因过表达载体构建示意图;图b为gmhsp20a基因过表达载体构建示意图。
[0054]
图5为gmhsfa2与gmhsp20a转基因拟南芥gus基因pcr鉴定。wt为野生型植株,1、2和3为转基因株系。其中a为gmhsfa2转基因拟南芥gus基因pcr鉴定;b为gmhsp20a转基因拟南芥gus基因pcr鉴定。
[0055]
图6为wt和转基因株系中gmhsfa2与gmhsp20a的表达量分析。wt为野生型植株,1、2和3为转基因株系。其中a为wt和gmhsfa2转基因拟南芥中gmhsfa2的表达量分析;b为wt和gmhsp20a转基因拟南芥中gmhsp20a的表达量分析。“*”、“**”和“***”分别代表0.01≤p<0.05;0.001≤p<0.01;p<0.001等显著性差异水平。
[0056]
图7为wt和转基因株系的花序耐热性鉴定。wt为野生型植株,1、2和3为转基因株系。其中a为wt和gmhsfa2转基因拟南芥的花序耐热性鉴定;b为wt和gmhsp20a转基因拟南芥的花序耐热性鉴定。
[0057]
图8为高温处理前后wt和gmhsfa2转基因拟南芥中gmhsfa2下游调控基因的表达量分析。
[0058]
图9为wt和转基因株系正常温度和高温处理下的花粉育性比较。其中a为wt和转基因株系正常温度和高温处理2天后的花粉育性表型;b为wt和转基因株系正常温度和高温处理6天后的花粉育性表型。黑色箭头指向的花粉为可育花粉,白色箭头指向的花粉为不育花粉。
[0059]
图10为wt和转基因株系正常温度和高温处理下的花粉育性统计比较。
[0060]
图11为wt和转基因株系正常温度和高温处理下的花药散粉性比较。其中a为wt和转基因株系正常温度下的花药散粉性比较;b为wt和转基因株系高温处理2天后的花药散粉性比较。黑色箭头指向的为散粉花药,灰色箭头指向的为不散粉花药。
具体实施方式:
[0061]
下述实施例中所用方法如无特殊说明,均为本领域的常规方法。
[0062]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0063]
大豆常规品种n4608、野生型拟南芥(col 0)和过表达载体pcambia3301均由南京农业大学国家大豆改良中心提供。
[0064]
实施例1、大豆gmhsfa2和gmhsp20a在大豆开花期响应高温胁迫
[0065]
使用植物培养箱于开花期(r1期)对大豆常规品种n4608进行高温处理:40℃/34℃(白天/夜晚)处理7天(常温30℃/24℃(白天/夜晚)为对照)。分别取高温条件处理0、1、3、5、7天和恢复常温1天的n4608植株不同大小混合花芽,立即冷冻于液氮中,-80℃保存备用。
[0066]
使用植物总rna提取试剂盒(天根)提取高温处理前后不同大小的混合花芽总rna,进行gmhsfa2和gmhsp20a的实时荧光定量表达分析(quantitative real time pcr,qrt-pcr)。
[0067]
用于gmhsfa2和gmhsp20a qrt-pcr分析的cdna合成按照vazyme的hiscript ii q rt supermix for qpcr反转录试剂盒进行反转录。
[0068]
根据gmhsfa2和gmhsp20a基因cds全长为目的序列,并以gmtubulin作为内参基因,利用primer primer5.0软件设计qpcr引物。
[0069]
gmhsfa2-qf:5'-tgaagtgggggagtttggac-3'(seq id no.7)
[0070]
gmhsfa2-qr:5'-agtggcttgcaatctggtct-3'(seq id no.8)
[0071]
gmhsp20a-qf:5'-gcgacgatat cttctcaggt aatg-3'(seq id no.9)
[0072]
gmhsp20a-qr:5'-gacctggtcc atcatgttca ga-3'(seq id no.10)
[0073]
gmtubulin-qf:5'-ctctctctct gtttatctcc gcac-3'(seq id no.11)
[0074]
gmtubulin-qr:5'-ctgaacgtga aggatctccc tc-3'(seq id no.12)
[0075]
将cdna稀释5倍后作为qpcr的模板,使用vazyme的aceq qpcr sybr green master mix配制体系在bio-rad cfx96 machine(cfx96 touch,bio-rad,usa)上进行qpcr反应。qpcr反应程序为:95℃30sec;95℃10sec,60℃30sec,40个循环。
[0076]
结果采用2-δδcq
方法进行基因表达相对定量。首先用内参基因的cq值归一目标基因的cq值得到δcq值,然后用对照样本的cq值归一处理样本的cq值得到δδcq值,高温处理0天为对照,最后计算相对表达水平比率,表达量的比值=2-δδcq
。
[0077]
如图1所示,gmhsfa2和gmhsp20a在大豆开花期响应高温胁迫,且gmhsp20a与gmhsfa2表达趋势一致。
[0078]
实施例2、大豆gmhsfa2和gmhsp20a基因及gmhsp20a启动子的克隆
[0079]
分别使用植物dna和总rna提取试剂盒(天根)提取大豆常规品种n4608混合花芽dna和总rna。总rna经1%琼脂糖凝胶电泳检测rna的完整性和利用nanodrop 2000(thermo scientific)测定rna浓度。cdna的合成按照takara公司primescript 1st strand cdna synthesis kit试剂盒说明进行反转录。
[0080]
根据大豆参考基因组gmhsfa2和gmhsp20a基因cds全长及gmhsp20a起始密码子上游2000bp为目的序列,利用primer primer5.0软件设计pcr引物:
[0081]
gmhsfa2-pmd19tf:5'-atgtacatgg agagaattag agtga-3'(seq id no.13)
[0082]
gmhsfa2-pmd19tr:5'-ttagcctaga tagtccatat gatcc-3'(seq id no.14)
[0083]
gmhsp20a-pmd19tf:5'-atggcgtcct ctctcattg-3'(seq id no.15)
[0084]
gmhsp20a-pmd19tr:5'-ctactcaacc ttaacactga tcac-3'(seq id no.16)
[0085]
pgmhsp20a-pmd19tf:5'-tttgtcattg acattgacga a-3'(seq id no.17)
[0086]
pgmhsp20a-pmd19tr:5'-tgaattgaga ttgcaaaagg t-3'(seq id no.18)
[0087]
分别以cdna和dna为模板使用toyobo的kod plus-(toyobo)体系进行pcr扩增,pcr反应程序为:95℃5min;98℃10sec,变性温度根据引物tm值设定30sec,68℃2min,35个循环;68℃10min;4℃恒温。
[0088]
pcr产物经1%琼脂糖凝胶电泳检测和回收纯化后,将回收片段ta克隆至克隆载体pmd19t simple vector(takara),转化大肠杆菌,挑取单菌落,培养,pcr检测阳性菌株,送往公司测序。测序结果如下:
[0089]
gmhsfa2基因序列长度为1095bp,其核苷酸序列如seq id no.1所示,该基因编码蛋白的氨基酸序列如seq id no.2所示。如图2a所示,该基因蛋白序列中具有n端dna结合结构域dbd、寡聚化结构域od、核定位信号nls和aha酸性c端激活结构域等保守结构域。
[0090]
gmhsp20a基因序列长度为636bp,其核苷酸序列如seq id no.3所示,该基因编码蛋白的氨基酸序列如seq id no.4所示。
[0091]
gmhsp20a基因启动子序列长度为2002bp,其核苷酸序列如seq id no.5所示。如图2b所示,该基因启动子上游500bp区域内包含四个连续的hse元件(seq id no.6)。
[0092]
使用质粒提取试剂盒(axygen)提取提取质粒,获得阳性重组克隆pmd19t-gmhsfa2、pmd19t-gmhsp20a和pmd19t-pgmhsp20a。
[0093]
实施例3、大豆gmhsfa2基因与gmhsp20a存在互作
[0094]
使用内切酶bamhi和xhoi酶切pgadt7质粒,内切酶kpni和xhoi酶切pabai质粒,酶切产物进行琼脂糖凝胶电泳(1%琼脂糖),dna凝胶回收试剂盒(axygen)回收线性化载体,获得线性化载体,使用超微量分光光度计nanodrop 2000(thermo scientific)进行目的线性化载体浓度检测。
[0095]
根据gmhsfa2 cds序列和gmhsp20a起始密码子上游100-500bp hse元件所在序列设计引物:
[0096]
gmhsfa2-pgadt7f:
[0097]
5
’-
cccgggtgggcatcgatacgggatccatatgtacatggagagaattag-3
’
(seq id no.19)
[0098]
gmhsfa2-pgadt7r:
[0099]
5
’-
tatctacgattcatctgcagctcgagttagcctagatagtccatatg-3
’
(seq id no.20)
[0100]
pgmhsp20a-pabaif:
[0101]
5
’-
aaaagcttgaattcgagctcggtacctgagagaacaaattgtaaac-3
’
(seq id no.21)
[0102]
pgmhsp20a-pabair:
[0103]
5
’-
tatacatacagagcacatgcctcgagaggggaatggttgggacttg-3
’
(seq id no.22)
[0104]
分别以实施例2的pmd19t-gmhsfa2和pmd19t-pgmhsp20a质粒为模板,使用toyobo的kod plus-体系进行pcr反应,pcr产物经1%琼脂糖凝胶电泳检测和回收纯化后,使用vazyme clonexpress一步定向克隆无缝克隆试剂盒利用同源重组的方法分别将gmhsfa2基因和pgmhsp20a(hse元件)连接到到表达载体pgadt7和pabai上。转化dh5α,pcr检测阳性菌株,送往公司测序,提取质粒,获得gmhsfa2基因猎物载体pgadt7-gmhsfa2和pgmhsp20a(hse
元件)诱饵载体pabai-pgmhsp20a。
[0105]
对pabai-pgmhsp20a质粒进行自激活和毒性检测:将性化pabai-pgmhsp20a质粒转化y1h gold感受态,涂布sd/-ura平板,从ura平板挑单斑做感受态,将猎物空载转化诱饵感受态,涂布sd/-leu能生长说明重组诱饵质粒成功转入宿主菌,涂布平板sd/-leu/aba 200ng/ml、sd/-leu/aba 500ng/ml、sd/-leu/aba 800ng/ml、sd/-leu/aba 1000ng/ml均无菌落生长,说明诱饵质粒无自激活,可用于后续gmhsfa2基因与gmhsp20a的互作验证。
[0106]
图3所示,将猎物质粒pgadt7-gmhsfa2转化诱饵菌株感受态y1h[pabai-pgmhsp20a(hse元件)],转化后涂布sd/-leu、sd/-leu/aba平板,sd/-leu、sd/-leu/aba200 ng/ml均有菌落生长,说明猎物蛋白能够结合到gmhsp20a启动子区域的hse元件来激活了报告基因表达,表明gmhsfa2和gmhsp20a之间有相互作用。
[0107]
实施例4、大豆gmhsfa2和gmhsp20a基因植物过表达载体的构建
[0108]
使用内切酶bamh-酶切pcambia3301载体,酶切产物进行1%琼脂糖凝胶电泳,dna凝胶回收试剂盒(axygen)回收线性化载体,获得线性化载体,使用超微量分光光度计nanodrop 2000(thermo scientific)进行目的线性化载体浓度检测。
[0109]
分别根据gmhsfa2和gmhsp20a基因cds序列设计引物扩增。引物序列如下:
[0110]
gmhsfa2-pcambia3301f:
[0111]
5
’-
gagctcggtacccggggatccatgtacatggagagaattagagtga-3
’
(seq id no.23)
[0112]
gmhsfa2-pcambia3301r:
[0113]
5
’-
caggtcgactctagaggatccttagcctagatagtccatatgatcc-3
’
(seq id no.24)
[0114]
gmhsp20a-pcambia3301f:
[0115]
5
’-
gagctcggta cccggggatc catggcgtcc tctctcattg-3
’
(seq id no.25)
[0116]
gmhsp20a-pcambia3301r:
[0117]
5
’-
caggtcgact ctagaggatc cctactcaac cttaacactg atcac-3
’
(seq id no.26)
[0118]
分别以实施例2的pmd19t-gmhsfa2和pmd19t-gmhsp20a质粒为模板,使用toyobo的kod plus-体系进行pcr反应,pcr产物经1%琼脂糖凝胶电泳检测和回收纯化后,使用vazyme clonexpress一步定向克隆无缝克隆试剂盒利用同源重组的方法分别将gmhsfa2和gmhsp20a基因连接到到植物过表达载体pcambia3301上。转化dh5α,pcr检测阳性菌株,送往公司测序,提取质粒,获得基因过表达载体:pcambia3301-gmhsfa2、pcambia3301-gmhsp20a(图4)。
[0119]
实施例5、转基因拟南芥的获得
[0120]
1、分别将pcambia3301-gmhsfa2和pcambia3301-gmhsp20a质粒转入到根癌农杆菌eha105中,得到重组农杆菌;
[0121]
2、将重组农杆菌接种于含50μg/ml rif和50μg/ml ka的yeb固体培养基上,28℃恒温培养36
–
48h;
[0122]
3、挑单克隆于1ml含50μg/ml rif和50μg/ml ka的yeb培养液中,28℃,200rpm振荡过夜培养后进行pcr检测阳性菌株;
[0123]
4、菌检成功后按1:100的比例接种量分别转接到新鲜的含有含50μg/ml rif和50μg/ml ka的yeb液体培养基中,至od
600
=1.0左右;
[0124]
5、4℃,4000g离心10min收集菌体;用5%蔗糖溶液(含0.02%tween 20)重悬;
[0125]
6、将拟南芥的花序浸入菌液中1min,浸染后的拟南芥要用黑色塑料袋覆盖,暗培养24h;然后转至正常生长条件(16h光照(23℃)/8h黑暗(18℃),湿度75%)培养。对获得的阳性植株进行pcr检测和qrt-pcr分析。
[0126]
以gus基因全长为目的序列用primer premier5.0软件设计特异性引物,命名为gus-f/gus-r,其引物序列如下:
[0127]
gus-f:5'-cgatgcagat attcgtaatt atgc-3'(seq id no.27)
[0128]
gus-r:5'-catacctgtt caccgacgac g-3'(seq id no.28)
[0129]
pcr程序参考实施例2。
[0130]
gmhsfa2和gmhsp20a转基因拟南芥的qrt-pcr分析按照实施例1的相关步骤开展。并以atactin2作为内参基因,利用primer primer5.0软件设计特异性引物。
[0131]
atactin2-qf:5'-cttgcaccaagcagcatgaa-3'(seq id no.29)
[0132]
atactin2-qr:5'-ccgatccagacactgtacttcctt-3'(seq id no.30)
[0133]
图5为转基因拟南芥gus基因pcr鉴定结果,图6为转基因拟南芥gmhsfa2和gmhsp20a qrt-pcr分析结果。结果表明,gmhsfa2基因已经成功整合到拟南芥基因组中,并且能够在拟南芥中稳定遗传,可用于后续耐热性功能研究。
[0134]
实施例6、gmhsfa2和gmhsp20a转基因拟南芥花序耐热性鉴定
[0135]
使用植物培养箱对转基因拟南芥和wt进行高温处理,45℃/40℃(白天/夜晚)处理3天,23℃/18℃(白天/夜晚)恢复1天后,使用体视显微镜olympus sz61(japan)观察花器官受损情况。
[0136]
图7所示,wt的花序基本全部萎嫣。与wt相比,gmhsfa2和gmhsp20a转基因拟南芥花序损伤程度较小。gmhsfa2和gmhsp20a转基因拟南芥植株的花序表现出优于wt的耐热能力。
[0137]
实施例7、gmhsfa2下游调控基因表达量分析
[0138]
使用植物总rna提取试剂盒(天根)提取实施例6中高温处理前后的gmhsfa2转基因拟南芥和wt植株的总rna,对gmhsfa2潜在的下游基因进行qrt-pcr分析。以atactin2作为内参基因,基于每个下游调控基因的参考基因序列,利用primer primer5.0软件设计特异性引物。
[0139][0140]
反转录体系、qrt-pcr分析体系及程序和相关数据分析参考实施例1。
[0141]
图8所示,与wt相比,高温处理下gmhsfa2转基因拟南芥中atshsp、athsp20、athsp40、athsp70和athsp90均为上调表达。表明过表达gmhsfa2诱导了hsp相关基因的表达,从而提高了gmhsfa2转基因拟南芥开花期花序的耐热性。
[0142]
实施例8、转基因拟南芥雄性育性耐热性鉴定
[0143]
使用植物培养箱对gmhsfa2和gmhsp20a转基因拟南芥和wt开花植株42℃处理4h,然后转入正常生长环境(23℃/18℃,白天/夜晚)培养,在高温处理后的一周内进行雄性育性(花粉育性和花药散粉性)鉴定。
[0144]
每天晚上10点左右取第二天开放的整朵拟南芥小花浸入配制好的亚历山大染色液,65℃孵育12
–
24h;用镊子剥下完整花药,放于载玻片上于olympus cx31(japan)显微镜下进行观察并使用拍照设备(olympus dp27,japan)进行拍照。
[0145]
每天上午8
–
10点左右取当天开放的整朵拟南芥花,于体视显微镜olympus sz61(japan)下进行观察并使用拍照设备(olympus dp27,japan)进行拍照。
[0146]
图9和图10所示,正常温度下,gmhsfa2和gmhsp20a转基因拟南芥和wt植株的花粉育性正常,高温处理后第2天,wt花粉皱缩,而转基因拟南芥基本正常;高温处理后第6天,wt接近全不育,而转基因拟南芥仅为半不育。图11所示,正常温度下,转基因拟南芥和wt植株的花药正常散粉,高温处理后第2天,wt花药不散粉,而转基因拟南芥花药正常散粉。表明gmhsfa2和gmhsp20a转基因拟南芥雄性育性表现出优于wt的耐热能力。结合gmhsfa2和gmhsp20a在大豆开花期高温胁迫下表达趋势的一致性(图1)和酵母单杂实验(图3)论证,表明gmhsfa2能够调控gmhsp20a来提高植物开花期的耐热能力。此外,高温处理后,gmhsfa2转基因拟南芥雄性育性要高于gmhsp20a转基因拟南芥,说明gmhsp20a仅仅是gmhsfa2下游调控的基因之一。
[0147]
本发明的保护内容不局限于以上实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求为保护范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



