一种EZH2可变剪切体及其应用的制作方法
 2021-02-02 09:02:18|
2021-02-02 09:02:18| 353|
353| 起点商标网
起点商标网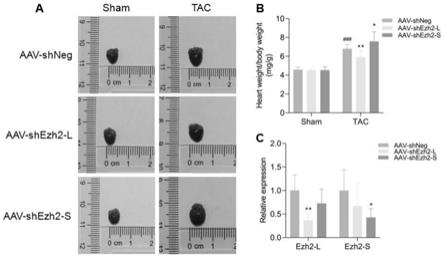
一种ezh2可变剪切体及其应用
技术领域
[0001]
本发明属于生物技术领域,尤其涉及一种ezh2可变剪切体及其应用。
背景技术:
[0002]
表观遗传修饰可以通过dna甲基化,组蛋白修饰,和染色质重塑等调节染色质状态和基因表达,而无需改变dna序列。polycomb group proteins(pcgs)是一组重要的表观遗传调节蛋白。pcg蛋白包含两个核心复合物,分别是prc1复合体(polycomb repressive complex 1)和prc2复合体(polycomb repressive complex 2)。prc2复合体特异催化了h3k27位点的单甲基化、二甲基化和三甲基化,以调节基因转录。prc2复合体的催化亚基ezh2(enhancer of zeste homolog 2)是组蛋白甲基转移酶,用于在lys27(h3k27me3)的组蛋白h3三甲基化。ezh2是高度进化保守的基因,在不同的物种中具有相似的结构域。ezh2做为prc2复合体的催化亚单位,已被证明是多种生物过程的关键调节蛋白,参与各种生物功能,如细胞增殖、胚胎干细胞中的转录网络调节、细胞周期调控、蛋白稳态的维持、心脏发育等。
[0003]
心肌细胞的病理性生长,其发生发展涉及了细胞内从染色质结构改变到基因转录调控、rna剪切、蛋白翻译、翻译后修饰、信号转导等多个生物学过程,其中最为关键的环节是病理基因表达的重编程。成年心肌细胞表达与胚胎期不同亚型的结构蛋白和收缩功能蛋白,从而满足随着人体发育对泵血功能需求的增加;而在心肌肥厚及心力衰竭发病过程中,作为机体应激反应的防御策略,胚胎期基因会被再度诱导表达,该过程被称为胚胎期基因表达重编程。研究发现,表观遗传在调控胚胎期基因表达重编程的过程中发挥了重要的作用。prc2复合体表达或功能的改变与心脏病理的改变的发生密切相关,在基因表达谱重编程的过程中发挥了关键作用。先前的研究表明敲除ezh2会导致致命的先天性心脏畸形,包括压缩心肌发育不良和心室隔膜缺陷。在心肌缺血/再灌注动物模型中,ezh2调节成年小鼠心脏中心肌细胞的凋亡和增殖,从而保护细胞免受缺血再灌注损伤。对心肌细胞特异性ezh2敲除小鼠的研究表明,ezh2抑制心脏生长和胚胎基因表达,同时保护心脏免受氧化损伤。
[0004]
研究发现ezh2在各种恶性肿瘤(如前列腺癌、乳腺癌和卵巢癌)中异常过度表达。ezh2所催化的h3k27me3,是许多恶性肿瘤模型中促进肿瘤生长和转移的关键因素。此外,在各种癌症中也发现了ezh2功能突变。研究表明,通过小分子抑制剂或对ezh2基因敲减会抑制会减少癌细胞生长和肿瘤的形成。除了以pcr2依赖性的方式作为组蛋白修饰器发挥作用外,ezh2还以独立的方式在癌症中发挥作用。ezh2在细胞增殖中起重要的作用,是肿瘤恶性转化过程中异常基因表达的关键因素。
[0005]
ezh2是心血管疾病、代谢疾病、肿瘤等疾病的重要分子靶点。本发明着重于ezh2的可变剪切体在病理性心肌肥厚、心力衰竭以及肿瘤发生过程中的重要调控作用。
技术实现要素:
[0006]
针对现有技术存在的问题,本发明提供了一种ezh2可变剪切体及其应用,目的在于解决现有技术中的一部分问题或至少缓解现有技术中的一部分问题。
[0007]
本发明是这样实现的,一种ezh2可变剪切体,剪切位点位于ezh2第三号外显子3
’
端前27nt的位置,由此得到的两个可变剪切体相差27nt,具有27nt和缺失27nt分别被称为ezh2-l和ezh2-s;所述27nt的序列在小鼠和人中为gtgagctcattgcgcgggactagggag,在大鼠中为gtgagctcattacgcgggactagggag。
[0008]
如上述的ezh2可变剪切体在制备治疗心肌肥厚、心力衰竭、心血管疾病及肿瘤中的至少一种的药物中的应用。
[0009]
进一步地,所述药物包括ezh2-l的抑制剂和/或ezh2-s的激动剂。
[0010]
进一步地,所述ezh2-l的抑制剂优选为ezh2-l基因的sirna、ezh2-l基因的rna干扰载体或ezh2-l的抗体及其他能够抑制ezh2-l表达的抑制剂中的一种;所述ezh2-s的激动剂优选为ezh2-s基因的过表达质粒和能够促进ezh2-s表达的激动剂中的一种。
[0011]
如上述的ezh2可变剪切体作为药物靶标或基因治疗中的靶基因在筛选或制备治疗心肌肥厚、心力衰竭、心血管疾病及肿瘤中的至少一种的药物中的应用。
[0012]
如上述的ezh2可变剪切体在构建ezh2-l和/或ezh2-s基因表达的体外细胞模型或动物模型,用于筛选预防、缓解和/或治疗治疗心肌肥厚、心力衰竭、心血管疾病及肿瘤中的至少一种的药物中的应用。
[0013]
ezh2-l的抑制剂和/或ezh2-s的激动剂在制备治疗心肌肥厚、心力衰竭、心血管疾病及肿瘤中的至少一种的药物中的应用。所述ezh2-l的抑制剂优选为ezh2-l基因的sirna,序列见seq id no.2和seq id no.3所示。
[0014]
进一步地,所述肿瘤包括宫颈癌。
[0015]
本发明首先是鉴定出哺乳动物中ezh2存在多个剪切体亚型,其中第三个外显子缺失27bp,形成两个可变剪切体,分别命名为ezh2-l和ezh2-s,其出现的频率较高,并且第三个外显子3
’
端可变剪切位点在哺乳动物中高度保守。本申请以新生1-3天大鼠心肌细胞(nrvms)为实验对象,使用sirna对ezh2-l和ezh2-s分别进行转录水平的敲低,并通过苯肾上腺素(phenylephrine)诱导建立心肌细胞肥大模型。结果显示,与对照组相比较,使用sirna敲低ezh2-l后可明显降低苯肾上腺素诱导肥大心肌细胞的心肌肥大标志物anp、bnp的表达水平。同时,与对照组相比较,使用sirna敲低ezh2-s后可明显促进苯肾上腺素诱导肥大心肌细胞的心肌肥大标志物anp、bnp的表达水平上升。通过尾静脉注射使小鼠感染ezh2-l和ezh2-s特异的aav9-shrna(aav9-shezh2-l/aav9-shezh2-s),三周后进行主动脉狭窄术诱导心肌肥厚和心力衰竭发生,术后8周观察结果表明,敲低ezh2-l和ezh2-s分别具有促进和抑制心肌肥厚和心力衰竭的作用。另外我们在肿瘤细胞中敲低ezh2-l可以显著抑制肿瘤细胞的增殖。
[0016]
上述结果提示ezh2的可变剪切能够调控心肌肥厚,心力衰竭和肿瘤的发生,ezh2-l和ezh2-s分别具有促进和抑制心肌肥厚,心力衰竭和肿瘤的作用,为研究防治心肌肥厚,心力衰竭和肿瘤的新靶点和新策略提供了理论依据和临床基础。
[0017]
ezh2可变剪切体ezh2-l和ezh2-s可作为药物靶点,构建ezh2-l和ezh2-s基因过表达的体外细胞模型或动物模型,用于筛选预防、缓解和/或治疗心血管疾病和肿瘤的药物;
ezh2可变剪切体ezh2-l和ezh2-s也可作为基因治疗中的靶基因,设计并制备预防、缓解和/或治疗心血管疾病和肿瘤的药物和/或生物学试剂,通过基因工程技术达到预防、缓解和/或治疗心血管疾病和肿瘤的目的;ezh2可变剪切的调控因子也可作为药物靶点或基因治疗中的靶基因,用于筛选、设计并制备预防、缓解和/或治疗心血管疾病和肿瘤的药物和/或生物学试剂,并可通过基因工程技术达到预防、缓解和/或治疗心肌肥厚,心力衰竭和肿瘤的目的。例如以ezh2-l为靶基因,设计可干扰ezh2-l表达的双链sirna,通过化学方法合成以后,注射入人体通过rna干扰的方法使ezh2-l基因表达下调来治疗心肌肥厚,心力衰竭和肿瘤;还可以以ezh2-l为靶点设计小分子化合物抑制剂,利用ezh2-l基因过表达的体外细胞模型或动物模型,通过筛选,发现其中能够特异性抑制ezh2-l的分子,从而为心血管疾病和肿瘤的治疗提供新的治疗性分子。另外,以ezh2-s为靶基因,构建可过表达ezh2-s的质粒,注入人体通过质粒过表达使ezh2-s基因表达上调来治疗心肌肥厚,心力衰竭和肿瘤;还可以ezh2-s为靶点设计合成小分子化合物激动剂,利用ezh2-s基因敲低的体外细胞模型或动物模型,通过筛选,发现其中能够特异性激动ezh2-s的分子,从而为心血管疾病和肿瘤的治疗提供新的治疗性分子。
[0018]
针对ezh2可变剪切体的上述功能,提供ezh2可变剪切体作为药物靶标在筛选治疗心血管疾病和肿瘤的药物中的应用。
[0019]
所述的ezh2-l的抑制剂优选为ezh2-l基因的sirna、ezh2-l基因的rna干扰载体,ezh2-l的抗体及其他能够抑制ezh2-l表达的抑制剂中的一种。而ezh2-s的激动剂优选为ezh2-s基因的过表达质粒和能够促进ezh2-s表达的激动剂中的一种。
[0020]
综上所述,本发明的优点及积极效果为:
[0021]
1.本发明发现ezh2基因的新功能,即ezh2可变剪切体ezh2-l和ezh2-s分别具有促进和抑制心血管疾病和肿瘤的作用;
[0022]
2.基于ezh2-l和ezh2-s在心血管疾病和肿瘤中的功能,为研发治疗心血管疾病和肿瘤的药物提供靶标。
[0023]
3.ezh2-l的抑制剂和ezh2-s的激动剂可用于制备预防、缓解和/或治疗心血管疾病和肿瘤的药物。
附图说明
[0024]
图1是新生大鼠心肌细胞中鉴定出来的ezh2第3号外显子5
’
端的2种可变剪切形式,保留27bp的为ezh2-l,缺少27bp的为ezh2-s;
[0025]
图2是ezh2可变剪切体的检测,以及实时荧光定量pcr(qpcr)验证siezh2-l和siezh2-s敲低效率;a为ezh2-l和ezh2-s特异性的sirna序列;b为新生大鼠心肌细胞中ezh2-l和ezh2-s分别敲低后逆转录pcr(rt-pcr)的琼脂糖凝胶电泳图;c为新生大鼠心肌细胞中ezh2-l和ezh2-s分别被敲低后各自mrna水平的qpcr结果;
[0026]
图3是ezh2-l和ezh2-s敲低后对体外培养新生大鼠心肌细胞肥大标志物anp和bnp的影响;a和b为ezh2-l可变剪切形式敲低后,苯肾上腺素诱导组的心肌细胞肥大标志物anp、bnp的水平;c和d为在ezh2-s可变剪切形式敲低后,苯肾上腺素诱导组的心肌细胞肥大标志物anp、bnp的水平;
[0027]
图4是ezh2-l和ezh2-s敲低后对体外培养新生大鼠心肌细胞面积的影响;a为代表
性的wga染色;b和c为细胞面积统计结果;
[0028]
图5是特异敲低ezh2-l和ezh2-s对主动脉狭窄术诱导心肌肥厚和心力衰竭的影响;通过尾静脉注射使小鼠感染ezh2-l和ezh2-s特异的aav9-shrna(aav9-shezh2-l/aav9-shezh2-s),三周后进行主动脉狭窄术诱导心肌肥厚和心力衰竭发生,术后8周观察心脏形态并测量心脏重量。a为代表性的心脏图片;b为心重体重比(mg/g)的统计结果;c为ezh2-l和ezh2-s分别被aav9-shrna特异敲低的qpcr结果。
[0029]
图6特异敲低ezh2-l和ezh2-s对肿瘤细胞的影响;hela(a),siha(b),和caski(c)。
具体实施方式
[0030]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例对本发明进行进一步详细说明,各实施例及试验例中所用的设备和试剂如无特殊说明,均可从商业途径得到。此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
[0031]
根据本申请包含的信息,对于本领域技术人员来说可以轻而易举地对本发明的精确描述进行各种改变,而不会偏离所附权利要求的精神和范围。应该理解,本发明的范围不局限于所限定的过程、性质或组分,因为这些实施方案以及其他的描述仅仅是为了示意性说明本发明的特定方面。实际上,本领域或相关领域的技术人员明显能够对本发明实施方式作出的各种改变都涵盖在所附权利要求的范围内。
[0032]
为了更好地理解本发明而不是限制本发明的范围,在本申请中所用的表示用量、百分比的所有数字、以及其他数值,在所有情况下都应理解为以词语“大约”所修饰。因此,除非特别说明,否则在说明书和所附权利要求书中所列出的数字参数都是近似值,其可能会根据试图获得的理想性质的不同而加以改变。各个数字参数至少应被看作是根据所报告的有效数字和通过常规的四舍五入方法而获得的。本发明中,“约”指给定值或范围的10%以内,优选为5%以内。
[0033]
本发明下述各实施例中所述常温是指四季中自然室温条件,不进行额外的冷却或加热处理,一般常温控制在10~30℃,最好是15~25℃。
[0034]
本发明披露了一种ezh2可变剪切体及其应用。本发明涉及的实验用动物:实验动物种属,性别,大小及来源:新生大鼠,雌雄均可,2-3天,购自湖北省实验动物研究中心。本发明在前期的研究中鉴定出ezh2一个保守的隐含剪切位点,此剪切位点位于ezh2第三号外显子3
’
端前27nt的位置,由此得到的两个可变剪切体相差27nt(gtgagctcattgcgcgggactagggag,小鼠和人,seq id no.1)或者gtgagctcattacgcgggactagggag(大鼠,seq id no.28)具有27nt和缺失27nt分别被称为ezh2-l和ezh2-s。其中,人ezh2在ncbi中的编号为2146,小鼠的为14056,大鼠的为312299。人的具有27nt的序列见seq id no.18,缺失27nt的序列见seq id no.19;小鼠的具有27nt的序列见seq id no.20,缺失27nt的序列见seq id no.21;大鼠的具有27nt的序列见seq id no.22,缺失27nt的序列见seq id no.23。
[0035]
实施例1新生大鼠心肌细胞(neonatal rat ventricular myocytes,nrvms)的分离
[0036]
1、心肌组织消化
[0037]
新生大鼠心肌细胞消毒处死后取出心脏,1x ads缓冲液洗净血液,去除心底大血
管及心耳心房后,剪碎心肌组织至约1mm
2
,加入适量0.1%胶原酶和0.075%胰酶的混合酶消化液消化20分钟后弃上清,再次加入适量的混合酶消化液消化20分钟后收集上清,向上清液中加入少量血清终止混合酶消化反应,重复上述消化收集上清,并向上清中加入少量血清5-6次,后将上述消化液2200rpm x 3min离心后收集细胞,加入适量1x ads吹散细胞备用。
[0038]
2、percoll密度梯度分离系统的配制
[0039]
配制此系统需要三种材料,分别为1x ads、10x ads、和percoll。第一步配制percoll stock,其成分为percoll:10x ads=9:1。第二步配制top液和bottom液,top成分为percoll stock:1x ads=8:12,bottom成分为percoll stock:1x ads=13:7。第三步配制percoll密度梯度分离系统:(1)向15ml离心管中加入5ml top液;(2)用1ml注射器向15ml离心管底部加入2ml bottom液;(3)向15ml离心管中top液表面继续加入1ml top液。
[0040]
3、心肌细胞分离
[0041]
将上述消化收集的细胞加入percoll密度梯度分离系统的上部,3000rpm x 30min离心后收集中层细胞,此层即为心肌细胞,加入适量1x ads吹散细胞,2200rpm x 3min离心后收集细胞,加入适量1x ads吹散细胞后即可种板培养。
[0042]
实施例2 sirna转染方法以及建立苯肾上腺素诱导心肌细胞肥大模型
[0043]
1、心肌细胞培养
[0044]
第一天将心肌细胞计数后种入六孔板中,每孔细胞约0.5x 10
6
个,培养液为10%fbs+1%青霉素-链霉素溶液+高糖dmem培养基。第二天更换培养液为1%its+1%青霉素-链霉素溶液+高糖dmem培养基。
[0045]
2、sirna转染
[0046]
第三天进行sirna转染,转染前更换培养液为1%its+高糖dmem培养基,然后分别配制sirna溶液和转染试剂rnaimax溶液,每孔sirna溶液为4ul sirna+200ul opti-mem培养基,每孔转染试剂溶液为6ul rnaimax+200ul opti-mem培养基,配好后室温静置5分钟,然后将二者混合并上下颠倒混匀,室温静置15分钟后加入细胞培养液中。sirna转染12小时后,更换培养液为1%its+1%青霉素-链霉素溶液+高糖dmem培养基。
[0047]
对sirna可结合ezh2-l的靶点序列进行筛选,结果如表1,其中catgacttctgtgagctcattacgc为筛选出的最佳大鼠sirna结合靶点,对应的sirna序列如下所示(图2a):
[0048]
siezh2-l:sense:5'-caugacuucugugagcucauuacgc-3',seq id no.2
[0049]
antisense:5'-gcguaaugagcucacagaagucaugau-3',seq id no.3
[0050]
siezh2-s:sense:5'-acaucaugacuucuuguucagugac-3',seq id no.4
[0051]
antisense:5'-gucacugaacaagaagucaugaugugc-3',seq id no.5。
[0052]
表1
[0053]
[0054]
[0055][0056]
3、建立苯肾上腺素诱导心肌细胞肥大模型
[0057]
sirna转染12小时后,更换成含血清的dmem培养基,并给予去氧肾上腺素(pe)刺激,在36小时后,收取细胞。
[0058]
实施例3新生大鼠心肌细胞ezh2的两种可变剪切形式ezh2-l和ezh2-s的检测
[0059]
1、rna提取
[0060]
根据实施例1分离大鼠心肌细胞,提取mrna。向收集的心肌细胞中加入1ml的trizol溶液,于冰上反复吹打至心肌细胞充分裂解,静置5分钟,加入0.2ml氯仿,剧烈震荡15-30秒,静置2-3分钟,4℃下离心12000rpm x 15min。吸取水相层至新的ep管中,加入0.5ml异丙醇,将管中液体轻轻混匀,室温静置10分钟,4℃下离心12000rpm x 10min。弃上清,于沉淀中加入预冷的75%乙醇1ml,重悬沉淀并充分洗涤,4℃下离心12000rpm x 5min。弃上清,晾干,加入适量depc水,65℃下促溶rna。取2ul rna行琼脂糖凝胶电泳检测rna是否提取成功,剩余rna不使用时于-80℃条件下保存。
[0061]
2、逆转录pcr(rt-pcr)
[0062]
mrna逆转录为cdna使用thermo fisher scientific的逆转录试剂盒,引物选用random primer。逆转录后的cdna用ddh2o稀释五倍。逆转录pcr(rt-pcr)采用能同时检测ezh2-l和ezh2-s的引物ezh2-ls进行rt-pcr,以β-肌动蛋白(β-actin)作为内参基因,随后进行琼脂糖凝胶电泳。检测引物见表2。所得结果如图2b所示,在新生大鼠心肌细胞中检测到了ezh2的两种可变剪切形式ezh2-l和ezh2-s,且siezh2-l和siezh2-s分别敲低了ezh2-l和ezh2-s的mrna水平。
[0063]
表2 ezh2-ls和β-actin的rt-pcr引物序列
[0064][0065][0066]
采用thermo fisher scientific公司的platinum ii taq热启动dna聚合酶试剂检测mrna水平,rt-pcr反应体系见表3。
[0067]
表3 rt-pcr反应体系
[0068][0069]
反应条件:
[0070]
94℃4min;94℃20sec,60℃20sec,72℃20sec,35cycles,72℃5min。
[0071]
实施例4实时荧光定量pcr(qpcr)验证ezh2-l和ezh2-s敲低效率
[0072]
逆转录后的cdna用ddh2o稀释五倍。ezh2-l和ezh2-s的mrna水平的检测引物见表4。采用thermo fisher scientific公司的sybr
tm
green试剂检测mrna水平。具体反应体系见表5。
[0073]
表4 ezh2-l和ezh2-s的qpcr引物序列
[0074][0075]
表5实时荧光定量pcr反应体系
[0076][0077]
反应条件:
[0078]
95℃10min;95℃10sec,60℃10sec,72℃10sec,40cycles,40℃30sec,绘制溶解曲线,最终数据以2
-△△
ct
进行分析。
[0079]
通过qpcr方法,检测ezh2-l和ezh2-s的mrna的表达水平,验证sirna特异性分别敲低ezh2-l和ezh2-s的敲低效率。结果如图2c所示,新生大鼠心肌细胞中ezh2-l和ezh2-s可以分别被siezh2-l和siezh2-s敲低。
[0080]
实施例5 ezh2-l和ezh2-s敲低后对体外培养新生大鼠心肌细胞肥大的影响
[0081]
分离新生大鼠心肌细胞后,通过细胞转染,分别敲低ezh2-l和ezh2-s的mrna水平。提取将各实验组心肌组织,提取总rna,应用qpcr检测心肌肥厚和心力衰竭分子标志物:心房利钠肽(atrial natriuretic peptide,anp)和b型-利钠肽(b-type natriuretic peptide,bnp)mrna水平,检测引物见表6。以β-肌动蛋白(β-actin)作为内参基因。
[0082]
表6 anp,bnp和β-actin的qpcr引物序列
[0083][0084]
如图3a和b所示,在ezh2-l可变剪切形式敲低后,苯肾上腺素诱导组的心肌细胞肥大标志物anp、bnp的水平显著减低,说明ezh2-l可变剪切形式可显著减轻心肌细胞肥大水平。如图3c和d所示,在ezh2-s可变剪切形式敲低后,苯肾上腺素诱导组的心肌细胞肥大标志物anp、bnp的水平显著增加,说明ezh2-s可变剪切形式可显著加重心肌细胞肥大水平。以上结果表明ezh2的不同剪切形式ezh2-l和ezh2-s在心肌肥厚和心力衰竭病理发生中发挥了重要调控作用。
[0085]
实施例6 ezh2-l和ezh2-s敲低后对体外培养新生大鼠心肌细胞面积的影响
[0086]
分离新生大鼠心肌细胞后,通过细胞转染,分别敲低ezh2-l和ezh2-s的mrna水平。通过wga染色检测心肌细胞肥大的细胞面积。将在六孔板中处理好的心肌细胞用pbs洗一遍,加组织固定液室温固定10min。吸去固定液,加pbs轻柔漂洗三次,5min/次。用0.2%triton x-100室温通透5min,在37℃用fitc标记的麦胚芽凝集素(wheat germ agglutinin,wga)染色15min,并用dapi染核10min。拍照后,利用图像获取数字分析系统(image j),计算心肌细胞横切面积。
[0087]
如图4所示,如图4a和b所示,在ezh2-l可变剪切形式敲低后,苯肾上腺素诱导组的心肌细胞面积显著减低。如图4a和c所示,在ezh2-s可变剪切形式敲低后,苯肾上腺素诱导组的心肌细胞面积显著增加。以上结果表明ezh2-l和ezh2-s敲低后可影响苯肾上腺素诱导新生大鼠心肌细胞肥大的细胞面积。图4a为代表性的wga染色图;图4b和c为细胞面积统计结果。
[0088]
实施例7特异敲低ezh2-l和ezh2-s对主动脉狭窄术诱导心肌肥厚和心力衰竭的影响
[0089]
1.腺相关病毒包装
[0090]
由汉恒生物科技(上海)有限公司参照小鼠的ezh2-l和ezh2-s序列,利用phbaav-cmv-mcs-3flag-t2a-zsgreen质粒载体,构建含ezh2-l和ezh2-s片段的真核表达质粒,并将质粒包装为腺相关病毒aav9-shezh2-l和aav9-shezh2-s,而空载的phbaav-cmv-mcs-3flag-t2a-zsgreen质粒包装为腺相关病毒aav9-shrna作为对照。小鼠8周时,通过尾静脉注射使小鼠感染ezh2-l和ezh2-s特异的aav9-shrna(aav9-shezh2-l/aav9-shezh2-s)。三周后进行主动脉狭窄术诱导心肌肥厚和心力衰竭发生。
[0091]
2.主动脉缩窄术(tac手术)建立小鼠心肌肥厚和心力衰竭模型
[0092]
心脏长期在压力负荷下,最易诱发心室肥厚的形成,出现代偿性心肌肥大。用戊巴比妥钠麻醉小鼠,行气管插管连接小鼠呼吸机,沿第2-3肋间水平切开胸腔,游离胸主动脉,用7-0手术缝线将27号针头连同主动脉一起结扎,之后抽出针头,造成约70%的主动脉狭窄。假手术对照组(sham)不作结扎,其他手术操作相同。术后8周观察心脏形态并测量心脏
重量。
[0093]
如图5a代表性的心脏图片和图5b心重体重比(mg/g)的统计结果所示,敲低ezh2-l可以抑制心肌肥厚和心力衰竭的发生,而敲低ezh2-s可以促进心肌肥厚和心力衰竭的发生。图5c为ezh2-l和ezh2-s分别被aav9-shrna特异敲低的qpcr验证结果。
[0094]
实施例8特异敲低ezh2-l和ezh2-s对肿瘤细胞的影响
[0095]
1、肿瘤细胞培养
[0096]
将三株宫颈癌细胞hela,siha,和caski计数后种入六孔板中,每孔细胞约0.5x 10
6
个,培养液为10%fbs+1%青霉素-链霉素溶液+高糖dmem培养基。
[0097]
2、sirna转染
[0098]
过夜后进行sirna转染,每孔sirna溶液为4ul sirna+200ul opti-mem培养基,每孔转染试剂溶液为6ul rnaimax+200ul opti-mem培养基,配好后室温静置5分钟,然后将二者混合并上下颠倒混匀,室温静置15分钟后加入细胞培养液中。转染8小时后,更换培养基为10%fbs+1%青霉素-链霉素溶液+高糖dmem培养基。将培养板在培养箱孵育24、48、72小时(在37℃,5%co2的条件下)。针对人ezh2序列,筛选出来的sirna序列如下所示:
[0099]
siezh2-l:sense:5'-cugacuucugugagcucauugcgcg-3',seq id no.24
[0100]
antisense:5'-cgcgcaaugagcucacagaagucagga-3',seq id no.25
[0101]
siezh2-s:sense:5'-ccugacuucuuguucggugac-3',seq id no.26
[0102]
antisense:5'-caccgaacaagaagucaggau-3',seq id no.27。
[0103]
3、cck-8检测
[0104]
采用cck-8试剂盒(cck-8cell counting kit,solarbio)对肿瘤细胞的增殖进行检测。在96孔板中配制100μl的sirna转染的细胞悬液。向每孔加入10μl cck8溶液。将培养板在培养箱内孵育2小时。用酶标仪测定在450nm处的吸光度。
[0105]
如图6所示三株宫颈癌细胞hela(a),siha(b),和caski(c)结果,敲低ezh2-l可以显著增加肿瘤细胞的增殖,而敲低ezh2-s对肿瘤细胞增殖的发生无明显作用。
[0106]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



