水稻基因OsHsp40及其在制备具有非生物胁迫抗性转基因植物中的用途的制作方法
 2021-02-02 09:02:04|
2021-02-02 09:02:04| 416|
416| 起点商标网
起点商标网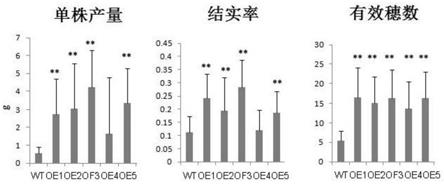
水稻基因oshsp40及其在制备具有非生物胁迫抗性转基因植物中的用途
技术领域
[0001]
本发明涉及基因工程技术领域,具体涉及一种来源于水稻植物的基因及其在提高植物的非生物胁迫抗性中的应用。
背景技术:
[0002]
我国是一个农业大国,农作物丰产稳产对保证我国粮食安全具有重要意义。但我国是一个自然灾害频发的国家,地域辽阔,每年从南到北不同地区均会发生各种自然气候灾害。农作物在生长过程中如果遭遇严重的自然灾害,如干旱、高低温、盐碱、重金属污染和滞涝等,常造成大面积减产。为了实现长期的粮食安全和可持续发展,深入了解植物非生物胁迫生物学是农业科学技术研究的重要目标之一。植物在长期的进化过程中产生了各种应对非生物逆境的机制。水稻栽培历史上既存在水田栽培,也存在旱地播种种植,在人类长期驯化过程中,积累了优良的抗非生物逆境基因,利用这些抗逆基因对农作物进行基因工程改造,也是一种有效的获得抗逆农作物新品种的育种手段。
[0003]
科学研究发现,为抵抗恶劣的环境变化,生物体细胞内能产生大量维持细胞稳定的蛋白,其中热激蛋白(hsp)是其中重要的成员。hsp具有分子伴侣的功能,结构保守,通过辅助蛋白质的折叠、组装、易位和降解,来维持蛋白质和细胞膜的稳定,保护生物正常生长具有积极作用。植物中具有的hsp种类丰富且多样化,在不同胁迫条件下,hsps能帮助故障蛋白质重新折叠,恢复正常的蛋白质构象并维持细胞稳态,对保护植物在恶劣环境下生存具有重要的作用(李广隆等,植物热激蛋白响应非生物胁迫研究进展。广东农业科学,2019,46(3):24-30)。hsps有不同的分类方式,根据其分子量大小主要分为hsp100、hsp90、hsp70、hsp60、小热激蛋白(shsps,12-40kda)[栗振义等.植物热激蛋白研究进展.生物技术通报,2016,32(2):7-13]。hsp60-100的蛋白功能研究相对较多。hsp60和hsp90是需要atp参与的分子伴侣蛋白,对植物抵抗干旱和盐等胁迫引起的活性氧胁迫具有重要作用,缺失该类蛋白对植物的生长发育产生一定影响[李广隆等,植物热激蛋白响应非生物胁迫研究进展。广东农业科学,2019,46(3):24-30]。hsp70家族成员保守性强,部分成员是组成型表达的,这些成员参与辅助多肽的折叠和前体蛋白的运转,引导溶酶体或蛋白酶来促进不稳定蛋白的降解。已有研究发现hsp70基因的过表达与植物有较强的耐热性呈正相关,并能提高植物对盐、水和高温胁迫的耐受性[李广隆等,植物热激蛋白响应非生物胁迫研究进展。广东农业科学,2019,46(3):24-30]。hsp100与其它hsp蛋白功能不同,能溶解聚集的蛋白质,并在hsp70系统的辅助下释放,清除因错误折叠、变性或聚集引起的有害多肽,在蛋白质分解和维持细胞动态平衡过程中发挥重要作用[ s et al.hsp70 displaces small heat shock proteins from aggregates to initiate protein refolding.embo journal,2017,36(6):783-796.]。小热激蛋白是一类低分子量的热激蛋白,高等植物中含有多达20~40种shsps,在序列相似性、细胞定位和生物学功能方面比其他hsps家族更加多样化,尽管shsps研究相对较少,但被认为参与了植物热、冷、干旱、盐和氧化胁迫等逆境反
应[mogka et al.cellular handling ofprotein aggregates by disaggregationmachines.molecular cell,2018,69(2):214-226]。
[0004]
小热激蛋白常与hsp70或hsp100等伴侣一起,结合非折叠蛋白,从而阻止非折叠蛋白的不可逆聚合,使其在特定条件下正确折叠和行使细胞功能。根据蛋白质分子量和胞内定位等特性,被子植物中的shsps也可以分为多种。在分子量40左右的蛋白,常命名为hsp40,但其氨基酸序列和定位常相差很大。例如水稻中发现并命名为oshsp40的蛋白,则是包含3个tpr重复和sti1结构域,该基因的缺失突变体表现出对盐胁迫及其敏感[wang et al,expression and function analysis ofa rice oshsp40 gene under salt stress.genes&genomics,2019,41:175-182]。同时人们也发现一种包含dnaj结构域的hsp40蛋白,常与hsp70蛋白一起,扮演重要的分子伴侣功能[qiu et al,the diversity ofthe dnaj/hsp40family,the crucial partners for hsp70 chaperones.cellular and molecular life sciences,2006,63(22):2560-2570]。dnaj/hsp40是法基尼化靶向蛋白,法基尼化拟南芥hsp40蛋白有利于促进转录因子spl7的活性,从而控制组织大小、aba信号和抗旱能力[barghetti a et al.heat-shock protein 40is the key farnesylation target in meristem size control,abscisic acid signaling,and drought resistance genes&development,2019,31:2282-2295]。dnaj/hsp40在细胞内的定位也多样化,如定位于线粒体,通过调节油菜素内酯信号来参与环境胁迫抗性[bekh-ochir d,et al.a novel mitochondrial dnaj/hsp40 family protein bil2promotes plant growth and resistance against environmental stress in brassinosteroid signaling.planta 2013,237:1509-1525]。也发现有定位于细胞核中,如大豆来源的hsp40超表达造成过敏性细胞死亡[liu j et al,overexpression of a soybean nuclear localized type-iii dnaj domain-containing hsp40 reveals its roles in cell death and disease resistance.plant j.2013,74(1):110-121]。番茄中发现dnaj类的hsp40定位于叶绿体,与sant酶互作参与番茄的耐热抗性[wang x,et al.slsnat interacts with hsp40,a molecular chaperone,to regulate melatonin biosynthesis and promote thermotolerance in tomato.plant cell physiol.2020;61(5):909-921]。但从已发表的文章来看,该类蛋白功能的研究多为拟南芥等双子叶植物,禾本科尤其是重要粮食作物水稻中,dnaj/hsp40类蛋白在逆境胁迫中扮演的角色还不清晰,其在逆境中发挥作用的机制还鲜有报道,在重要粮食作物中克隆和研究该类蛋白,寻找更高效抗非生物逆境基因应用于我国最重要的粮食作物水稻仍具有重要意义。
技术实现要素:
[0005]
本发明是基于一部分来源于水稻的oshsp40基因有利于提高植物抗旱、耐高温等非生物胁迫的发现。从某种方面来说,本发明提供了基因工程植物超表达oshsp40基因增强对非生物胁迫的抗性和构建基因工程植物方法,以拓展当前植物生物技术中的可应用于提高植物抗非生物胁迫能力的基因,获得新型转基因抗逆植物品种。
[0006]
为解决上述技术问题,本发明的第一方面,提供一种用于制备具有非生物胁迫抗性转基因植物的水稻基因oshsp40,其核酸序列如seq id no.1所示。
[0007]
另一方面,本发明提供一种用于制备具有非生物胁迫抗性转基因植物的水稻基因
oshsp40编码的蛋白,其编码氨基酸序列如seq id no.2所示,或编码氨基酸序列与seq id no.2中从1-268序列长度有至少70%、80%、90%或95%的同一性。
[0008]
另一方面,本发明提供一种含有上述水稻基因oshsp40的重组载体。
[0009]
另一方面,本发明还提供一种生产具有非生物胁迫抗性转基因植物的方法,具体包括以下步骤:
[0010]
1)将水稻基因oshsp40可操作地连接于植物表达调控序列,形成植物表达载体,所述水稻基因oshsp40的核酸序列如seq id no.1所示;
[0011]
2)将步骤1)所得的植物表达载体转入植物细胞;
[0012]
3)经筛选获得的转化细胞,再生为植物及其后代。
[0013]
所述植物包括植物细胞、植物组织或植物种子。优选的,所述植物选自水稻、玉米、小麦、大麦、黍、高粱等单子叶植株中任意一种。
[0014]
另一方面,本发明提供上述水稻基因oshsp40在制备具有非生物胁迫抗性转基因植物方面的用途。
[0015]
另一方面,本发明还提供一种含有编码核酸的多核苷酸的分离的dna分子在制备具有非生物胁迫抗性转基因植物品种中的用途,其特征在于:
[0016]
(a)其编码氨基酸序列如seq id no.2所示;或
[0017]
(b)其编码氨基酸序列与seq id no.2中从1-268序列长度有至少70%、80%、90%或95%的同一性;或
[0018]
(c)其多核苷酸序列为编码oshsp40蛋白的多核苷酸。
[0019]
另一方面,本发明还提供一种非生物胁迫诱导的植物表达启动子,通过具有如seq id no.2所示编码氨基酸序列的dna分子连接至植物中组成植物表达单元,其中核酸能在非生物逆境胁迫下过量表达oshsp40基因。
[0020]
进一步的,所述植物表达启动子的编码氨基酸序列与seq id no.2中从1-268序列长度有至少70%、80%、90%或95%的同一性。优选90%以上的同一性。
[0021]
另一方面,本发明公开一种植物包含重组核酸含有启动子可操作地连接至编码oshsp40的多核苷酸,其编码氨基酸序列与seq id no.2中从1-268序列长度有至少70%、80%、90%或95%的同一性。
[0022]
另一方面,本发明公开了一种生产具有非生物胁迫抗性转基因植物的方法,所述方法包含向植物导入核苷酸序列,该核苷酸序列含有启动子操作连接至编码oshsp40的多核苷酸,其中所述编码氨基酸序列与seq id no.2中从1-268序列长度有至少70%、80%、90%或95%的同一性。
[0023]
本发明筛选并鉴定了一种新的水稻基因oshsp40,在抗高温、抗旱等非生物胁迫抗性方面具有明显的作用,因此可将本发明基因与植物中过表达启动子结合后导入合适的表达载体并转化植物宿主,提高植物抗非生物逆境的能力。
附图说明
[0024]
图1是水稻基因oshsp40的蛋白结构图。采用smart软件(http://smart.embl-heidelberg.de/smart/)对seq id no.2蛋白序列进行蛋白结构分析,预测位点75-132为dnaj结构域,如图中方形按钮标示。图中用小方框标示为低复杂性结构域。
[0025]
图2为表达载体pub06-oshsp40示意图。
[0026]
图3为oshsp40基因编辑载体示意图。
[0027]
图4是转基因水稻叶片中oshsp40基因相对表达量水平图。其中横轴的编号oe1-oe11表示不同转oshsp40基因水稻株系,ck为非转基因对照;纵轴表示转基因株系oshsp40基因与参照基因actin1表达量比值。
[0028]
图5是oshsp40基因编辑单株在编辑位点序列比对图。其中ko表示基因编辑后突变单株,wt表示野生型植株。
[0029]
图6为苗期转oshsp40基因水稻高温胁迫处理试验结果图。其中a,高温处理前、后和恢复生长时期植株生长状况;b,恢复生长7天后单株鲜重;c,恢复生长7天后成活率。wt表示非转基因野生型水稻;oe表示转oshsp40基因水稻株系,ko表示oshsp40基因敲除突变株系。
[0030]
图7为苗期转oshsp40基因水稻抗旱处理试验结果图。wt表示非转基因野生型水稻;oe表示转oshsp40基因水稻株系,ko表示oshsp40基因敲除突变株系。
[0031]
图8为成株期转超表达oshsp40基因水稻干旱处理试验结果图。水稻成熟后取穗统计结实率、分蘖和产量等性状。wt表示非转基因野生型水稻;oe表示转超表达oshsp40基因水稻株系。**表示oe单株与wt显著性差异分析p<0.01。
具体实施方式
[0032]
在本文中,术语“分离的”、“纯化的”dna是指,该dna或片段已从天然状态下位于其两侧的序列中分离出来,还指该dna或片段已经与天然状态下伴随核酸的组分分开,而且已经与在细胞中伴随其蛋白质分开。
[0033]
本发明还包括能编码具有oshsp40相同功能的蛋白的seq id no.1中开放阅读框序列的变异形式。这些变异形式包括(但并不限于):若干个(通常为1-90个,较佳地1-60个,更佳地1-20个,最佳地1-10个)核苷酸的缺失、插入和/或取代,以及在5和/或3端添加数个(通常为60个以内,较佳地为30个以内,更佳地为10个以内,最佳地为5个以内)核苷酸。
[0034]
在本发明中,还包括具有与oshsp40相同功能的、seq id no.2序列的变异形式。这些变异形式包括(但并不限于):若干个(通常为1-50个,较佳地1-30个,更佳地1-20个,最佳地1-10个)氨基酸的缺失、插入和/或取代,以及在c末端和/或n末端添加一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。又比如,在c末端和/或n末端添加一个或数个氨基酸通常也不会改变蛋白质的功能。
[0035]
蛋白的同源性百分比由gap(needleman和wunsh,1970)分析(gcg程序)确定,其中参数gap creationpenalty=5,gap extension penalty=0.3。被分析的序列长度至少为15个氨基酸时,gap分析就在参与测试的两个序列的至少为15个氨基酸的区域进行测试。更优选地,被分析的序列长度至少为50个氨基酸时,gap分析就在参与测试的两个序列的至少为50个氨基酸的区域进行测试。更优选地,被分析的序列长度至少为100个氨基酸时,gap分析就在参与测试的两个序列的至少为100个氨基酸的区域进行测试。更优选地,被分析的序列长度至少为250个氨基酸时,gap分析就在参与测试的两个序列的至少为250个氨基酸的区域进行测试。甚至更优选地,被分析的序列长度至少为500个氨基酸时,gap分析就在参与
测试的两个序列的至少为500个氨基酸的区域进行测试。
[0036]
通过本领域已知的方法可以分离和纯化多核苷酸(dna或rna)、载体、转化体和生物体。
[0037]
本发明所分离出的多核苷酸,包括但不限于:seq id no.1编码oshsp40基因的核苷酸序列;或者该核苷酸序列能与seq id no.1核苷酸序列杂交;或者其功能相当于seq id no.1所示序列的亚片段。
[0038]
可以采用已经克隆的oshsp40基因作为探针,从cdna和基因组文库中筛选得到本发明的基因或同源基因,也可以直接采用基因合成的方法合成。同样也可以采用pcr(polymerase chain reaction)技术,从基因组、cdna中扩增得到本方面的oshsp40基因以及任何一段dna或其同源的一段dna。
[0039]
用于本发明的载体可以是如噬菌体、质粒、粘粒、微型染色体、病毒或逆转录病毒载体。可用于克隆和/或表达本发明的多核苷酸的载体是能在需复制和/或表达多核苷酸的宿主细胞中复制和/或表达多核苷酸的载体。一般说来,携带本发明的核酸序列的重组表达载体可以使用ti质粒、植物病毒载体,直接dna转化、微注射、电穿孔等常规生物技术方法导入植物细胞(weissbach,1998,method for plant molecular biology viii,academy press,new york,pp.411-463;geiserson and corey,1998,plantmolecularbiology(2nd edition)。
[0040]
已开发出多种方法用于经由互补的粘性末端使多核苷酸与载体可操作相连。例如,可在欲插入载体dna内的dna区段添加互补的同聚体序列片段。然后通过互补同聚体尾之间的氢键连接载体和dna区段以形成重组dna分子。
[0041]
含有一或多种限制性位点的合成接头提供了另一种连接dna区段与载体的方法。用噬菌体t4 dna聚合酶或大肠杆菌dna聚合酶i处理通过内切核酸酶限制性消化产生的dna区段,所述的两种聚合酶用其3',5
’-
核酸外切活性除去突出的γ-单链末端,并用其聚合活性补平3
’-
凹端。因此,这些活性的联合产生了平端dna区段,然后在能催化平端dna分子连接的酶,如噬菌体t4 dna连接酶的存在下将平端区段与摩尔过量的接头分子一起保温。因此,反应产物是末端携有聚合接头序列的dna区段,然后用适当的限制性酶裂解这些dna区段,并连接至已用酶裂解的表达载体中,所述酶能产生与所述dna区段相容的末端。从多个商家可以买到含有多个限制性内切核酸酶位点的合成接头。
[0042]
其它新发展的技术利用同源重组方法,将携带有特定序列接头或同源序列接头的多核苷酸与载体进行同源重组,将欲插入载体dna内的dna区段与同样携带有特定序列或同源序列的载体通过重组酶的作用形成重组dna分子。
[0043]
多核苷酸插入物应该可操作地连接于同表达多核苷酸的宿主细胞相容的适当启动子上,启动子可以是强启动子和/或诱导型启动子。在植物中常用的强启动子有烟草花叶病毒camv35s启动子、玉米或水稻泛素ubiquitin启动子等适当启动子是本领域技术人员已知的。表达重组载体进一步含有转录起始、终止位点,并在转录区含有用于翻译的核糖体结合位点。重组载体表达的转录物的编码部分可包括位于起点处的翻译起始密码子和适当地位于被翻译多肽的末端的终止密码子(uaa,uga或uag)。
[0044]
如上所述,表达载体可包括至少一个选择标记。所述标记包括编码抗生素的抗性基因,例如:新霉素磷酸转移酶(neomycinphosphotransferase)基因npt-、潮霉素磷酸转
移酶(hygromycin phosphotransferase)基因hpt和二氢叶酸还原酶(dihydrofolate reductase)基因dhfr;另一类是编码除草剂抗性基因,例如,草丁膦乙酰转移酶(phosphinothricin acetyltransferase)基因bar、5-烯醇丙酮酰草酸-3-磷酸合成酶(5-enoylpyruvate shikimatr-3-phosphate)基因epsps。适当宿主的代表性例子包括但不限于:原生质体细胞和植物细胞。上述宿主细胞的适当培养基和培养条件是本领域已知的。
[0045]
目的基因或目的多核苷酸的转化方法:一类是载体介导的转化方法,即将目的基因插入到农杆菌的质粒或病毒的dna等载体分子上,随着载体dna的转移而将目的基因导入到植物基因组中;农杆菌介导和病毒介导法就属于这种方法。第二类为基因直接导入法,是指通过物理或化学的方法直接将外源目的基因导入植物的基因组中。物理方法包括基因枪转化法、电激转化法、超声波法、显微注射法和激光微束法等;化学方法有peg介导转化方法和脂质体法等。第三类为种质系统法,这包括花粉管通道法、生殖细胞浸染法、胚囊和子房注射法等。
[0046]
本发明中,使用的术语“转化体”(transformant),即带有异源dna分子的宿主细胞或生物体。
[0047]
本发明还包括含有本发明的核苷酸序列的宿主细胞,所述核苷酸序列经本领域已知的技术与一或多种异源控制区(如启动子和/或增强子)可操作相连。可以选择能调节插入的基因序列的表达,或能按照所需的特殊方式修饰和加工基因产物的宿主菌株。在某些诱导物的存在下,某些启动子启动的表达会升高。
[0048]
通过众所周知的技术可以鉴定出被成功转化的细胞,即含有本发明所述核苷酸序列的重组载体的细胞或生物体。
[0049]
以下结合具体实施例,进一步阐明本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
[0050]
实施例1:分离克隆oshsp40基因
[0051]
户外挖取生长旺盛的水稻,采用trizol试剂(gibco brl,usa)抽提水稻总rna。利用反转录酶mlv(tiangen,china)将其反转录成cdna。用引物f(5
’-
atggcgctgcagcttcaggcc-3
’
)和引物r(5
’-
gctgagcccaagttcc ttcttcag-3
’
),扩增出基因的全长编码cdna(810bp)。pcr反应条件为:94℃预变性3min;94℃30sec,60℃30sec,72℃60sec共35个循环;72℃延伸5min。将扩增获得的pcr产物连入pgem-t载体(promega,usa),筛选阳性克隆并测序,获得oshsp40基因的cdna序列(seq id no.1)。oshsp40推测的蛋白序列进行同源基因的比对分析,发现该基因编码蛋白为包含dnaj domain的家族蛋白,在第75-132氨基酸为保守的dnaj区域(见图1)。
[0052]
实施例2:oshsp40基因超表达载体和crispr/cas9敲除载体的构建和遗传转化
[0053]
1)含目的基因表达载体的构建:
[0054]
根据oshsp40基因的全长序列(seq id no.1),设计扩增出完整编码阅读框的引物,并在上游引物和下游引物上分别添加接头引物,以便构建表达载体。以实施例1中获得的扩增产物为模板,经高保真扩增酶pfu酶(tiangen,china)进行pcr扩增后,将添加有接头的oshsp40基因cdna片段与植物表达载体载体pub06进行重组反应,构成了一个在玉米泛素启动子驱动下表达的植物表达单元(见图2),转化农杆菌eha105,最后进行水稻愈伤组织转
化实验。
[0055]
2)靶基因编辑表达载体的构建:
[0056]
对于利用crispr/cas9系统进行基因编辑的oshsp40载体的构建,根据oshsp40的基因组信息,结合crispr-p 2.0(http://crispr.hzau.edu.cn/crispr2/)设计靶点。对目的基因组dna进行sgrna的选择,主要根据脱靶效率低、特异性好、位于外显子。最终将sgrna:5
’-
tattattcgtccaggacatacgg-3
’
作为靶点,然后参照已发表的crispr/cas9基因编辑系统提供的方法进行基因编辑载体的构建。该系统中包含两个载体pylsgrna-osu6a/lacz和pylcrispr/cas9pubi-h,前者主要用于构建u6启动子和sgrna表达盒,通过overlap pcr将u6启动子和sgrna盒融合在一起;后者载体主要为植物表达用,利用bsai酶切线性化该植物表达载体,然后通过exnase ii重组酶,将u6启动子和sgrna表达盒重组整合到含有cas9蛋白的pylcrispr/cas9pubi-h编辑载体中,具体操作流程详见参考文献(ma x,zhang q,zhu q,liu w,cheny,qiu r,wang b,yang z,li h,liny,xiey,shen r,chen s,wang z,cheny,liuy.arobust crispr/cas9 system for convenient,high-efficiency multiplex genome editing in monocot and dicot plants.mol plant,2015,8(8):1274
–
1284.)。最后载体构建结果如图3所示。构建好的质粒转化农杆菌eha105,进行水稻愈伤组织转化实验。
[0057]
3)水稻遗传转化
[0058]
3.1种子消毒
[0059]
成熟的日本晴水稻种子去壳后放入无菌三角瓶中,用75%酒精浸泡1-2min,无菌水冲洗2次;再用30%naclo消毒30min,其间需经常摇动,再用无菌水洗3-4次,用无菌滤纸吸干多余的水分,将种子接种到愈伤组织诱导培养基(ms+2,4-d 2.0mg/l)上,每皿约30粒,于28℃暗培养。
[0060]
3.2继代培养
[0061]
经过近1月的诱导,水稻长出黄色膨大的愈伤组织,去其盾片,将愈伤转至新鲜的愈伤组织诱导培养基(ms+2,4-d 2.0mg/l)上进行继代。每2周继代一次,一般继代2-4次即可获得适合转基因的嫩黄色、颗粒状的胚性愈伤组织。在继代培养2周后,挑选胚性颗粒用于遗传转化。
[0062]
3.3农杆菌的培养
[0063]
在转化平板上挑取单菌落在1ml农杆菌培养基中培养。在50ml农杆菌培养基(含相应抗生素)中加入1ml上述培养物,200rpm,28℃培养5-6hr至od600为0.6-1.0,培养结束前2hr加入乙酰丁香酮(as,终浓度100um)。取上述菌液在室温下,4000rpm,10min,弃上清,加入ms液体培养基(含as 100um)重悬菌体,在与上相同的条件下培养2hr,使菌液的od600=0.5-1,此时可用来转化愈伤组织。as=acetosringone
[0064]
3.4共培养
[0065]
将水稻胚性愈伤组织浸入农杆菌菌液20-30min,再用无菌吸水纸吸干水分,将侵染的愈伤组织置于共培养培养基(ms+2,4-d 2.0mg/l+as 100um)上,28℃暗培养三天。
[0066]
3.5洗菌
[0067]
共培养的愈伤组织先用无菌水冲洗3遍,再浸泡在含cef/cn 400mg/l的ms液体培养基中20-30min后,将愈伤组织转入无菌滤纸上吸干。
[0068]
3.6选择培养
[0069]
将吸干水分的愈伤组织接种于选择培养基(ms+2,4-d 2.0mg/l+hyg 30mg/l+cef400 mg/l)上。3周后,挑选新长出的愈伤接种于选择培养基(ms+2,4-d 2.0mg/l+hyg 50mg/l+cef250 mg/l)上,再选择2周。
[0070]
3.7分化培养
[0071]
将经过2次选择得到的抗性愈伤组织转入到预分化培养基(n6+kt 2.0mg/l+naa 0.2mg/l+6-ba 2.0mg/l+hyg 30mg/l+cef 200mg/l+琼脂9g/l+蔗糖45g/l)上暗培养10天左右,再转到分化培养基(n6+kt 2.0mg/l+naa 0.2mg/l+6-ba 2.0mg/l+hyg 30mg/l+琼脂4.5g/l+蔗糖30g/l)上光照培养。
[0072]
3.8生根培养
[0073]
约1-2个月,将2cm左右高的幼苗转到生根培养基(1/2ms+hyg 15mg/l+琼脂4.5g/l+蔗糖20g/l)上诱导不定根的发生。
[0074]
3.9转基因苗的移栽
[0075]
当幼苗长至10cm高时,将幼苗取出,用无菌水洗净附着的固体培养基,移入泥土中,刚开始用玻璃罩罩几天,待植株健壮后再取下玻璃罩,温室中培养。
[0076]
实施例3:超表达oshsp40转基因植株的鉴定与分析
[0077]
1)材料准备
[0078]
转基因t1代水稻种子发芽后,移植于液体培养基(自来水配制成1/5ms大量元素)。幼苗生长15d后,剪取叶片快速投入液氮保存,用于rna的抽提。
[0079]
2)无dna的总rna制备
[0080]
按上海全式金生物技术有限公司提供的植物叶rna小量抽提试剂盒使用说明书抽提。使用beckman coultertmdu640紫外分光光度计测定rna浓度。为除去残留在rna中的dna,每个总rna样品取5μg,加入1μl dnaase i(美国invitrogen公司)和1μl10
×
反应缓冲液,补足体积至10μl,常温反应30min,然后每管加入1μl 2mmol l-1edta终止反应,最后在70℃加热10min使dnaase i失活。
[0081]
3)第一链cdna的合成
[0082]
将上述rna样品各取2μl,按美国promega公司反转录试剂盒提供的试剂依次添加4μl 25mmol l-1mgcl2,2μl10
×
rt缓冲液,2μl dntp混和液和1μl oligo(dt)15,加水补足体积到18.5μl,在70℃加热变性10min,快速在冰上冷却。然后加0.5μl rnase inhibitor和1μlamvrtase,在42℃水浴60min,70℃下加热10min终止反应。
[0083]
4)定量pcr
[0084]
根据基因oshsp40的序列设计特异性引物qf:5
’-
ctcaagatcgatgactcaagtg-3
’
,qr:5
’-
ccttcttcagcttctccaaagc-3
’
用于荧光定量pcr,根据水稻actin基因(genbank accession no.ay212324)的cdna序列设计特异性引物af:5
’-
cttcctcatgccatcctgc-3
’
,ar:5
’-
gcaagcttctccttgatgtcc-3
’
用于参照基因的荧光定量pcr。pcr使用bio-rad cfx定量pcr仪,每一个pcr设置3次重复。反应体系包含sybr premix ex taq
tm
(2
×
)10μl,正反向引物各0.5μl,各种处理的cdna模板1μl,加水补足体积至25μl。反应程序为:95℃30s,然后在95℃10s,61℃34s下循环40次,设定在每个循环中60℃34s时读取荧光值,同时进行rox值校正,最后添加荧光pcr产物融解曲线分析,其他操作详见仪器使用说明书。为了检测rna样
品中是否存在dna的污染,随机选取3个样品,各取1μl rna作为模板进行pcr,方法同上。
[0085]
5)分析方法
[0086]
ct是通过bio-rad cfx manager2.1软件在pcr的荧光域值缺省产生的,将数据输入到excel进行计算分析。数据分析采用方法为2-δδct
,然后利用excel表作表达差异柱状图。
[0087]
6)分析结果
[0088]
采用实时rt-real-time pcr方法检测oshsp40基因在转基因水稻叶片中表达量。以空白非转基因日本晴品种为参照,分别检测了11个独立的转基因株系oe1-oe11,与空白对照相比,所有转基因株系表达量都显著增强,表达量增强了8-2000倍(见图4),说明该基因导入到水稻后在多个转基因植株叶片中得到明显的异位高表达,可应用于进一步的转基因水稻研究。
[0089]
实施例4:oshsp40基因编辑突变体的筛选鉴定
[0090]
对于crispr/cas9编辑的oshsp40基因t
1
代单株利用一代测序进行鉴定。利用快速提取dna方法对t
1
代单株基因组dna进行抽提,针对sgrna编辑位点两侧设计引物,扩增片段覆盖编辑位点区域,对pcr产物进行测序。以日本晴靶位点序列为参考序列与所有的扩增编辑位点区域进行多序列比对,确定发生基因组编辑的纯合单株。根据测序结果,如图5所示多序列比对结果,突变类型ko植株分别为sgrna作用的靶位点处插入1个碱基a、缺失5个碱基ggaca和插入1个碱基c。其推导的氨基酸水平上,图中所表示的突变单株ko1-3分别由于插入或缺失碱基,导致发生移码突变,引起转录本的提前终止,分别形成158个、156个和158个氨基酸多肽,而全长oshsp40蛋白序列269个氨基酸。推测基因编辑后oshsp40基因可能由于移码突变提前终止而使该基因丧失功能,故该试验中所产生的ko突变体植株均可为候选植株进行下一步研究工作。
[0091]
实施例5:oshsp40基因相关转基因株系在高温胁迫条件下的生长试验
[0092]
选取了2个实施例2中oshsp40基因超量表达转基因t2代家系植株和1个敲除突变体植株进行了苗期高温胁迫实验。具体步骤如下:在96孔pcr板上每份材料种植约45株左右,当植株长至4叶期时,将幼苗移置到光照培养箱中45℃生长1天后,移植到室温(25℃)生长7天,观察转基因植株的生长状况,并进行成活率和鲜重统计。结果表明,本发明克隆的oshsp40基因超表达转基因株系的生长在正常条件下与对照无显著差异,但在高温胁迫处理恢复生长后,对照非转基因植株和敲除株系几乎全部死亡,而超表达株系仍有部分植株保持绿色(图6a)。最后将这些植株分别统计鲜重和成活率数据(见图6b和图6c),也说明了过表达该基因可以加强水稻抵御高温胁迫,提高了植株的抗高温能力。
[0093]
实施例6:苗期oshsp40基因相关转基因植株在干旱胁迫条件下的生长试验
[0094]
选取了实施例2中oshsp40基因超量表达转基因t2代家系和敲除突变植株进行了苗期干旱胁迫实验。具体步骤如下:在幼苗植株长移栽至小塑料桶中生长至4叶期时,开始断水使土壤干旱,大部分幼苗叶片卷曲枯萎并出现黄色枯死叶,进行复水处理,在正常水分灌溉下生长7天,观察转基因植株的生长状况,并统计植株的存活率。结果表明,本发明克隆的oshsp40基因超表达的转基因植株株系的生长在正常生长情况下,除了超表达植株oe2稍比对照植株矮一些外,其它性状无明显差异。但在干旱透迫处理后,对照非转基因植株和敲除突变植株叶片卷曲明显地早于超表达转基因植株,复水后超表达转基因植株能成活率明
显高于非转基因植株(见图7),与对照相比,该基因敲除对干旱胁迫更加敏感。说明了过表达该基因可以提高水稻的抗旱能力,而敲除该基因则损伤水稻的抗旱能力。
[0095]
实施例7:成株期oshsp40基因相关转基因植株在干旱胁迫条件下的生长状况
[0096]
选取了实施例2中oshsp40基因超量表达转基因t2代家系植株进行了成株期干旱胁迫实验。在防雨大棚中分别种植转基因和对照水稻,当植株生长发育到孕穗期时,开始停止灌溉1个月后,然后使用自来水灌溉,水稻结实成熟后进行拷种分析。结果表明,在干旱胁迫处理下,结实率都发生了明显下降,除了oe4与对照差异不明显,超表达转基因植株结实率都明显高于对照,有效穗数目也高于对照,最后导致单株产量明显高于野生型植株(见图8),这说明了过表达该基因可以在大田干旱条件下增强强水稻抗旱能力,对水稻的抗旱育种具有重要意义。
[0097]
以上显示和描述了本发明的基本原理、主要特征及本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。上文提及的每篇参考文献皆全文列入本文作为参考。
[0098]
[0099]
[0100]
[0101]
[0102]
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



