一种检测柯萨奇病毒A5型的荧光检测试剂盒的制作方法
 2021-02-02 09:02:25|
2021-02-02 09:02:25| 384|
384| 起点商标网
起点商标网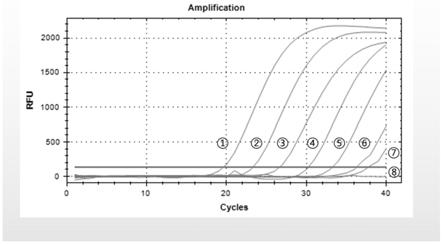
一种检测柯萨奇病毒a5型的荧光检测试剂盒
技术领域
[0001]
本发明属于病毒检测技术领域,具体涉及一种检测柯萨奇病毒a5型的荧光检测试剂盒。
背景技术:
[0002]
手足口病(hand-foot-mouth disease,hfmd)是由多种人类肠道病毒引起的一种儿童常见传染病,世界上大部分地区均有此病的流行报道,以发热和手、足、口等部位的皮疹和疱疹为主要临床症状。
[0003]
人类肠道病毒为单股正链小rna病毒,目前已知的血清型有100种以上,分为ev-a、ev-b、ev-c和ev-d 4类,其中常见hfmd病原体有人肠道病毒71型(humanenterovirus 71, ev71)、柯萨奇病毒(coxasckievirus,cox)a组(2型、4型、5型、6型、10型、16型)和b组 (1型~5型)、埃可病毒(echovirus)等,过去以ev71和coxa16最为常见。但是近年来在欧洲以及我国沿海地区的手足口病原学调查中发现,柯萨奇病毒a6型已经替代ev71和 cva16被作为主要治病病原体检出。2010年中国台湾地区柯萨奇病毒a5型有一定比例发现,另外,在近年来我国广东深圳以及山东临沂等地区的手足口病原中也有柯萨奇病毒a5型检出的报道。遵义市2019年3-7月手足口病病原分子分型的结果中显示柯萨奇病毒a5型检出率为9.2%,仅次于柯萨奇病毒a2及a6型。目前临床对于手足口病病原检测仍然以肠道病毒通用型或肠道病毒71型和柯萨奇a16型为主,导致手足口病病原体检测不明确或漏检等,造成患者治疗的延误及诊断试剂的浪费。因而开发一种针对柯萨奇病毒a5型病原检测的诊断试剂对明确致病病原有极大的帮助。
[0004]
有鉴于此,中国专利cn103789450b公开了一种检测柯萨奇病毒a2、a5型的荧光定量试剂盒,提供了一种检测柯萨奇病毒a5型的荧光定量试剂盒,由定量rt-pcr反应液、酶混合液、引物探针混合液、cva5标准品、cva5强阳性对照品、cva5弱阳性对照品、阴性对照品组成,其中定量rt-pcr反应液包含pcr反应缓冲液、氯化镁和三磷酸脱氧核糖核苷酸混合物,酶混合液含耐热taq dna聚合酶、rna酶抑制剂和mmlv逆转录酶,引物探针混合液包含cva5特异性引物和cva5荧光标记的特异性探针,阴性对照为高温高压灭菌的焦碳酸二乙酯处理水,cva5强阳性对照品和cva5弱阳性对照品为包含cva5的基因序列的阳性质粒样品;强阳性对照品质粒浓度为10
6
copies/ml,弱阳性对照品质粒浓度为 10
3
copies/ml;
[0005]
cva5特异性引物和cva5荧光标记的特异性探针序列如下:
[0006]
上游引物cva5-f:5
’-
caccgatgagagcatgattgaa-3
’
,
[0007]
下游引物cva5-r:5
’-
cagagtcctcaattatcaagatccc-3
’
,
[0008]
特异性探针cva5-p:5
’-
vic-ggtcaacaggcatggggtta-bhq1-3
’
。
[0009]
柯萨奇病毒a5型是一种rna病毒,rna单链不稳定性,易发生变异,且经研究发现,该检测试剂盒针对遵义地区流行的手足口病检测的准确率较低,基于此,现有技术需要提供一种准确率更高的检测试剂盒。
技术实现要素:
[0010]
本发明针对现有技术的不足,提供一种准确率更高的检测试剂盒。
[0011]
本发明的一种检测柯萨奇病毒a5型的荧光检测试剂盒,其中,cva5特异性引物和荧光标记的特异性探针序列如下:
[0012]
上游引物cva5-f:5
’-
caccgatgagagcatgattgaa-3
’
,
[0013]
下游引物cva5-r:5
’-
cagagtcctcaattatcaagatccc-3
’
,
[0014]
特异性探针cva5-p:5
’-
vic-ggtcaacaggcatggggtta-bhq1-3
’
。
[0015]
进一步的,所述荧光检测试剂盒由rt-pcr反应液、酶混合液、引物探针混合液、cva5 标准品、cva5强阳性对照品、cva5弱阳性对照品、阴性对照品组成,其中rt-pcr反应液包含pcr反应缓冲液、氯化镁和三磷酸脱氧核糖核苷酸混合物,酶混合液含taq dna聚合酶、rna酶抑制剂和mmlv逆转录酶,引物探针混合液包含cva5特异性引物和相应的 cva5荧光标记的特异性探针,阴性对照为高压灭菌的焦碳酸二乙酯处理水,cva5强阳性对照品和cva5弱阳性对照品为包含cva5的基因序列的阳性质粒样品。
[0016]
进一步,cva5强阳性对照品质粒浓度为10
7
copies/ml,cva5弱阳性对照品质粒浓度为 10
4
copies/ml。
[0017]
进一步,特异性探针采用vic荧光标记。
[0018]
进一步,所述cva5标准品的基因序列如下:
[0019]
tccagcactgacagcagtagagacaggagcaacttcaaacgccaccgatgagag catgattgaaaccaggtgtgtggtcaacaggcatggggttatggaaacaagtgttga gcacttcttctctcgttcgggtctggcggggatcttgataattgaggactctggagcct ctacaaagggttacgccacttgggaaattgatgtgatgggatttgttcagttgagacg caaactggaaatgttcacatacatgcgatttgacgcagagttcaccttcatcactgca gaaaggaacggtaacaccagcccgatacccgttcaatacatgtatgtaccgcaggtg gtccagtaa。
[0020]
进一步,引物探针混合液保存于棕色管中。
[0021]
进一步,荧光检测试剂盒于-20℃储存,减少反复冻融。
[0022]
本发明的另一个目的是将检测试剂盒应用于柯萨奇病毒a5型的核酸检测。
[0023]
本发明试剂盒的使用方法:在每次标本检测中均应设立阳性对照和阴性对照,标准品用 takara公司的easy dilution(货号:9160)稀释为1
×
10
4-1
×
10
8
copies/ml。
[0024]
咽拭子样本核酸的提取:咽拭子取样后与生理盐水彻底颠倒或漩涡震荡混匀后取140ul 加入离心管中进行病毒核酸提取。核酸提取采用tiangen公司的tianamp rna kit forvirus detection按照试剂盒说明书进行提取,取5ul已抽提的待测样品核酸作为模板。
[0025]
核酸的检测:取5ul已抽提的待测样品核酸作为模板。反应总体积为25ul,其中rt-pcr 反应液12.5ul,酶混合液1ul,引物探针混合液(10μmol/l,包含特异性引物和相应的荧光探针)共3ul,模板5ul,加水补足至25ul。在cfx96荧光定量pcr仪上进行检测,反应参数为:反转录42℃,15min;95℃5min热启动,然后95℃15s,55℃45s,在55℃进行荧光检测,共进行40个循环。
[0026]
荧光定量结果报告:
①
柯萨奇病毒a5型检测的各自ct值对应的荧光标记的病毒,检测样本ct值为40、0和无数值时,报告为阴性。
②
如果检测通道出现s型扩增曲线,ct 值≤40,则对应的柯萨奇病毒型别判定为阳性。
[0027]
本发明针对柯萨奇病毒高度保守且型间存在较大差异的vp1蛋白分别设计柯萨奇病毒 a5型高特异性的引物探针,采用单管一步法实时荧光rt-pcr,能够单管内一次反应检测出柯萨奇病毒a5型,不仅极大的节省了试剂耗材,缩短了检测时间,并且依然具有极高的特异性和灵敏性。
[0028]
本发明运用一步法实时荧光定量rt-pcr技术,针对遵义市柯萨奇病毒a5流行株序列以及genebank数据库中的柯萨奇病毒a5序列设计特异性引物和探针,研制用于柯萨奇病毒a5型检测的荧光定量rt-pcr检测试剂盒。该发明是通过一个rt-pcr反应,可以从咽拭子标本中检测出是否有柯萨奇病毒a5型的存在,为临床上患者提供早期诊断,为临床治疗方案的制定提供参考依据;可应用于柯萨奇病毒a5型引起暴发疫情的实验室应急诊断、快速筛查、临床诊断及手足口病的流行病学的研究。同时,针对遵义地区流行的柯萨奇病毒 a5流行株具有更高的精确度。
附图说明
[0029]
图1为柯萨奇病毒a5型基因组保守区。
[0030]
图2为柯萨奇病毒a5型特异性反应图。
[0031]
图3为本试剂盒检测柯萨奇病毒a5型的灵敏度,从左到右(1-8)依次为10
9
、10
8
、10
7
、 10
6
、10
5
、10
4
、10
3
copies/ml及阴性对照。
[0032]
图4为本试剂盒柯萨奇病毒a5型标准品实时荧光定量rt-pcr产物凝胶电泳示意图,电泳条带大小122bp,其中lane m为dl2000 marker,lane 1-7分别为柯萨奇病毒a5型标准品(10
9
copies/ml)十倍梯度稀释后实时荧光定量rt-pcr产物,lane8为阴性对照。
[0033]
图5为本试剂盒柯萨奇病毒a5型标准品实时荧光定量rt-pcr标准曲线。
具体实施方式
[0034]
下面具体实施例结合附图对本发明进行进一步阐述本发明,但这些实施例仅限于说明本发明而不限制本发明的范围。
[0035]
本发明一种检测柯萨奇病毒a5型的荧光定量试剂盒,包含:rt-pcr反应液、酶混合液、引物探针混合液、cva5标准品、cva5强阳性对照品、cva5弱阳性对照品、阴性对照品。其中rt-pcr反应液包含pcr反应缓冲液、氯化镁和三磷酸脱氧核糖核苷酸混合物,酶混合液含taq dna聚合酶、rna酶抑制剂和mmlv逆转录酶,引物探针混合液包含cva5 特异性引物和相应的cva5荧光标记的特异性探针,阴性对照为高压灭菌的焦碳酸二乙酯处理水,cva5强阳性对照品和弱阳性对照品为包含cva5的保守区基因序列的阳性质粒样品。其中强阳性对照品质粒浓度为10
8
copies/ml,弱阳性对照品质粒浓度为10
4
copies/ml。引物探针混合液需保存于棕色管。
[0036]
荧光rt-pcr检测用上游引物和下游引物以及相应的特异性探针序列如下:
[0037]
上游引物cva5-f:5
’-
caccgatgagagcatgattgaa-3
’
,
[0038]
下游引物cva5-r:5
’-
cagagtcctcaattatcaagatcccc-3
’
,
[0039]
特异性探针cva5-p:5
’-
vic-ggtcaacaggcatggggtta-bhq1-3
’
。
[0040]
cva5特异性探针采用vic荧光标记。
[0041]
上述cva5标准品的保守区基因序列如下:
[0042]
tccagcactgacagcagtagagacaggagcaacttcaaacgccaccgatgagag catgattgaaaccaggtgtgtggtcaacaggcatggggttatggaaacaagtgttga gcacttcttctctcgttcgggtctggcggggatcttgataattgaggactctggagcct ctacaaagggttacgccacttgggaaattgatgtgatgggatttgttcagttgagacg caaactggaaatgttcacatacatgcgatttgacgcagagttcaccttcatcactgca gaaaggaacggtaacaccagcccgatacccgttcaatacatgtatgtaccgcaggtg gtccagtaa。
[0043]
提供的荧光定量试剂盒需于-20℃储存,尽量减少反复冻融;引物探针混合液需避光条件保存。
[0044]
实施例1
[0045]
1材料
[0046]
1.1临床标本与病毒核酸:
[0047]
柯萨奇病毒a5型:遵义医科大学第三附属医院咽拭子标本中分离,经测序鉴定。
[0048]
柯萨奇病毒a2型:遵义医科大学第三附属医院咽拭子标本中分离,经测序鉴定。
[0049]
柯萨奇病毒a6型:遵义医科大学第三附属医院咽拭子标本中分离,经测序鉴定。
[0050]
柯萨奇病毒a4型:遵义医科大学第三附属医院咽拭子标本中分离,经测序鉴定。
[0051]
丙型肝炎病毒:遵义医科大学第三附属医院咽拭子标本中分离,经测序鉴定。
[0052]
呼吸道合胞病毒:遵义医科大学第三附属医院咽拭子标本中分离,经测序鉴定。
[0053]
鼻病毒:遵义医科大学第三附属医院咽拭子标本中分离,经测序鉴定。
[0054]
1.2引物与探针
[0055]
在前期研究的基础上选取了遵义市当地流行的6株cva5病毒株序列以及从ncbi基因库下载了柯萨奇病毒a5型的2条基因序列,利用mega7软件对其进行同源性比较,确定以上病毒基因组的保守区(图1)。使用geneious prime软件在其保守区设计高度特异性的引物与taqman探针,引物和探针序列均通过blast验证,具有较好特异性。引物和探针序列如下:
[0056]
上游引物cva5-f:5
’-
caccgatgagagcatgattgaa-3
’
,
[0057]
下游引物cva5-r:5
’-
cagagtcctcaattatcaagatccc-3
’
,
[0058]
特异性探针cva5-p:5
’-
vic-ggtcaacaggcatggggtta-bhq1-3
’
。
[0059]
以上引物和探针委托六合华大基因科技有限公司合成。
[0060]
1.3病毒核酸的提取与标准品定量标准:
[0061]
咽拭子取样后与生理盐水彻底颠倒或漩涡震荡混匀后取140ul加入离心管中进行病毒核酸提取。核酸提取采用tiangen公司tianamp rna kit for virus detection按照试剂盒说明书进行提取,取5ul已抽提的待测样品核酸作为模板。
[0062]
标准品是由六合华大基因科技有限公司直接合成的含有保守序列的dna片段,将其连接到质粒载体pmv-ampr simple vector(六合华大)。转化后培养。鉴定后提取质粒dna,利用thermo nanodrop lite测量质粒dna的浓度,确定dna的拷贝数作为标准品定量母液。根据实验需要,将标准品定量母液稀释至所需最高浓度,并做十倍稀释至最低浓度,低温保存备用。
[0063]
实施例2
[0064]
1方法
[0065]
1.1荧光rt-pcr特异性、敏感性和重复性试验
[0066]
选择柯萨奇病毒a5型的阳性核酸和其他肠道病毒如柯萨奇病毒a2型、柯萨奇病毒a4 型、柯萨奇病毒a6型,及丙型肝炎病毒、呼吸道合胞病毒、鼻病毒的阳性核酸,用实时荧光定量rt-pcr验证本方法的特异性;对已标定拷贝数(copies/ml)的柯萨奇病毒a5型合成片段(10
9
copies/ml)进行10倍梯度稀释后,平行进行荧光pcr反应,比较其灵敏度。此外,对每一个指定浓度的阳性核酸稀释液作3次重复检测,得到的ct值计算其标准差和变异系数,验证该方法的重复性。
[0067]
1.2实时荧光定量rt-pcr标准曲线的建立
[0068]
将已标定拷贝数(copies/ml)的柯萨奇病毒a5型标准品(10
8
copies/ml)、分别十倍梯度稀释至10
4
copies/ml。分别以此为模板用本试剂盒进行实时荧光定量pcr扩增后,以标准品浓度的对数值为x轴,循环数为y轴,绘制标准曲线。
[0069]
1.3反应参数为:反转录42℃,15min;95℃5min热启动,然后95℃15s,55℃45s,在55℃进行荧光检测,共进行40个循环。
[0070]
2结果
[0071]
2.1特异性试验
[0072]
本发明建立的一步法双重荧光定量rt-pcr方法对柯萨奇病毒a5型具有极好的特异性,能完全检出近期采集的临床阳性标本,准确率高。另外,本发明中的引物探针与其他肠道病毒如柯萨奇病毒a2型、柯萨奇病毒a4型、柯萨奇病毒a6型,及丙型肝炎病毒、呼吸道合胞病毒、鼻病毒的阳性核酸均无交叉反应(图2)。
[0073]
2.3敏感性试验
[0074]
对柯萨奇病毒a5型敏感性检测试验,将已标定拷贝数(copies/ml)的柯萨奇病毒a5 型合成片段(10
9
copies/ml)分别十倍梯度稀释后,用本试剂盒进行检测,结果该方法检测敏感性分别达到10
3
copies/ml。结果参见图3。取实时荧光定量rt-pcr产物3ul,120v恒压电泳20min,凝胶成像系统拍照。结果参见图4。其中lane m为dl2000 marker,lane 1-7分别为片段(10
9
copies/ml)十倍梯度稀释后实时荧光定量rt-pcr产物,lane 8为阴性对照。从图中可以看出,电泳条带单一,亮度梯度分明,说明本试剂盒特异性好,定量结果相对准确。
[0075]
2.4重复性试验
[0076]
取柯萨奇病毒a5型合成片段(10
7
copies/ml)按10倍梯度稀释成4个不同的浓度,对每一个浓度的样本作3个重复检测,结果不同核酸浓度各自的检测ct值标准差在0.19~0.44 之间,变异系数均低于1.5%,具有较好的重复性(结果见表1)。
[0077]
表1柯萨奇病毒a5型重复性实验
[0078][0079][0080]
2.5标准曲线的建立
[0081]
实时荧光定量pcr扩增后,以标准品浓度的对数值为x轴,循环数为y轴,绘制标准曲线。柯萨奇病毒a5型标准品实时荧光定量rt-pcr标准曲线如图5所示,其中斜率为 3.261,截距为49.461,相关系数为0.999。由此可见,标准品浓度的对数值与循环数具有较好的线性关系。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



