一种枇杷原生质体的分离方法与流程
 2021-02-02 09:02:08|
2021-02-02 09:02:08| 363|
363| 起点商标网
起点商标网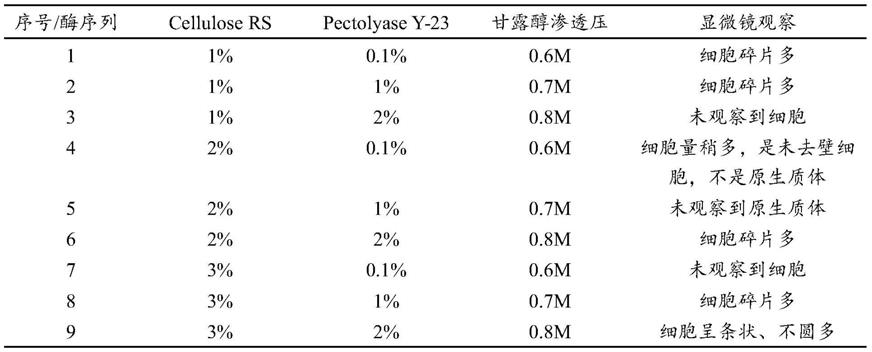
[0001]
本发明属于生物技术领域,涉及酶解制备枇杷原生质体的研究,具体涉及一种枇杷原生质体的分离方法。
背景技术:
[0002]
枇杷(eriobotrya japonica lindl.)是蔷薇科、枇杷属植物,是多年生木本常绿小乔木,高可达10米;小枝粗壮,黄褐色,密生锈色或灰棕色绒毛。枇杷起源于我国,已有上千年的栽培历史。它的果实成熟于春末夏初的水果淡季,是我国重要的经济果树。当前枇杷主要通过自然选种及有性杂交筛选后代等传统方法进行育种,这种方式耗时长且成功率较低。随着生物技术的日益成熟,结合基因组学、分子生物学的生物技术育种逐渐打破一些常规育种的局限而成为新的育种方式。然而枇杷目前仍没有建立高效稳定的遗传体系,这直接阻碍了生物技术育种及功能基因组学等的发展。
[0003]
原生质体是细胞壁以内各种结构的总称,也是组成细胞的一个形态结构单位,细胞中各种代谢活动均在此进行。原生质体包括细胞膜、细胞质、细胞核和细胞器等。原生质体化学成分十分复杂,其组分也随着细胞新陈代谢活动在不断变化,相对成分比例为水85%~90%,蛋白质7%~10%,脂类物1%~2%,其他有机物(包括核酸)1%~1.5%,无机物1%-1.5%。其中蛋白质与核酸为主的复合物,是与生命活动相关最主要的成分。原生质体相比于含有细胞壁的细胞而言,不仅可以保持细胞的全能性,而且更容易接受外源的遗传物质,使外源dna在植物原生质体中快速表达。枇杷原生质体的成功分离,是枇杷进一步利用遗传转化进行功能基因研究、细胞融合进行种质资源创制和细胞无性系选育等方面的研究及应用迈出的第一步。
[0004]
现有的原生质体分离方法主要包括机械分离法和酶解法。机械分离法是指将细胞放进高渗糖溶液中进行处理,使细胞发生一定程度的质壁分离,研磨或切割相应的植物组织,从而使原生质体从伤口处释放。其操作费时费力,原生质体产量低下,并且其分离材料只局限于高度液泡化的细胞,因而使用受到很大的限制。酶解法是通过生物酶分解细胞壁的纤维素及细胞间隙的果胶等成分,从而释放出原生质体。在现有技术披露的枇杷原生质体的研究中,多采用愈伤组织或悬浮培养物为起始原料培养原生质体(参见林顺权等人的文章“枇杷原生质体培养形成愈伤组织”,福建农学院学报,20(2):179-184,1991;林庆良等人的文章“栋叶枇杷原生质体的分离与培养”,福建农业大学学报,23(l):26-29,1994)。这些方法对材料要进行特殊处理,先获得愈伤组织或悬浮培养物,然后通过酶解分离得到枇杷原生质体,方法取材不够便捷,且工艺较为复杂。
技术实现要素:
[0005]
为了解决现有技术中的问题,本发明提供一种枇杷原生质体的分离方法,该方法以枇杷叶片为材料,样品取材方便,不需要对材料进行特殊处理;同时酶解过程只需要纤维素酶和离析酶两种酶制剂,酶液配制简单;不需要繁琐的试验步骤,一步即可获取数量可观
的原生质体。
[0006]
除特殊说明外,本发明所述百分比均为质量百分比。
[0007]
为实现上述目的,本发明的技术方案为:
[0008]
由于现有技术多采用愈伤组织或悬浮培养物为起始原料培养原生质体,对于本领域普通技术人员而言,使用枇杷叶片为材料,能否成功制备原生质体并不知晓。同时,本发明以枇杷叶片为材料,通过酶解法分离制备枇杷原生质体,常规酶解法使用的酶如纤维素酶、离析酶、果胶酶、崩溃酶、蜗牛酶、半纤维素酶等酶能否成功制备原生质体并不知晓。因此,发明人进行了一系列包括酶的种类与浓度的探索。研究发现,酶的种类与浓度选择不合适时,容易出现诸如得到的是细胞碎片、得到的细胞形状不规则、观察到的细胞未去掉细胞壁、无法得到细胞、无法得到枇杷原生质体等等一系列情形。令人惊喜的是,使用纤维素酶和离析酶两种酶组成的混合酶液能够成功从枇杷(早钟6号、贵妃、华白1号)叶片中分离得到原生质体。
[0009]
根据本发明的一个实施方案,一种枇杷原生质体的分离方法,使用枇杷叶片为材料,通过酶解法分离制备枇杷原生质体,其特征在于:所述酶为纤维素酶和离析酶组成的混合酶。
[0010]
为了增加枇杷原生质体的产量,根据本发明的一个实施方案,上述纤维素酶为纤维素酶rs,离析酶为离析酶r-10。
[0011]
进一步,上述纤维素酶rs的浓度为1-5.4%,离析酶r-10的浓度为1.8-4.7%,以质量百分比计。更进一步,上述纤维素酶rs的浓度为5.0%,离析酶r-10的浓度为3.6-4.0%,以质量百分比计。
[0012]
根据本发明的一个实施方案,上述枇杷选自枇杷早钟6号、贵妃、华白1号中的一种。
[0013]
根据本发明的一个实施方案,上述方法中,枇杷叶片在酶解之前先进行预处理,所述预处理为用流水冲洗干净枇杷叶片内外表皮表面绒毛,将叶片用刀切成条,置于0.6-1.0m甘露醇高渗溶液中浸泡处理2-4h。
[0014]
根据本发明的一个实施方案,上述方法中,枇杷叶片在酶解之后再进行结果观察,所述结果观察为加入酶解液等体积的原生质体清洗液以停止酶解,过300目网筛,液体离心,弃去上清液,沉淀中再加入原生质体清洗液,重悬观察原生质体。
[0015]
根据本发明的一个实施方案,上述枇杷原生质体的分离方法,采用以下步骤:
[0016]
(1)预处理:取枇杷幼嫩叶片,流水冲洗干净叶片内外表皮表面绒毛,将叶片用刀切成约0.5mm大小细条,置于0.6-1.0m甘露醇高渗溶液中浸泡处理2-4h左右;
[0017]
(2)酶解:移出甘露醇溶液,加入酶解液,置于50-100rpm/min摇床上,在黑暗中酶解振荡10-12h;所述酶解液中的酶为纤维素酶rs和离析酶r-10组成的混合酶,纤维素酶rs的浓度为5.0%,离析酶r-10的浓度为3.6-4.0%,以质量百分比计;
[0018]
(3)结果观察:加入酶解液等体积的原生质体清洗液,停止酶解,将原生质体-酶混合液过300目网筛,离心,弃去上清液,沉淀中再加入原生质体清洗液,重悬观察原生质体。
[0019]
根据本发明的一个实施方案,上述枇杷原生质体的分离方法,包括以下步骤:
[0020]
(1)预处理:取枇杷嫩叶片于烧杯中,流水冲洗干净叶片内外表皮表面绒毛,将叶片用锋利刀片切成约0.5mm大小细条,置于0.6-1.0m甘露醇高渗溶液中浸泡处理3h;
[0021]
(2)酶解:移出甘露醇溶液,加入酶解液,置于50-100rpm/min摇床上,在黑暗中酶解振荡10-12h;所述酶解液的制备方法为:每10ml酶解液中加入10mm mes、0.6m甘露醇、5.0%纤维素酶rs、3.6-4.0%离析酶r-10,搅拌均匀,50-60℃加热10min,待自然冷却后,依次加入0.01-1%bsa、1mm cacl
2
,用一级水定容至10ml;
[0022]
(3)观察:加入酶解液等体积的原生质体清洗液以停止酶解,过300目网筛,转移至离心管中,700r/min离心12分钟,弃去上清液,沉淀中加入原生质体清洗液,重悬观察原生质体。
[0023]
有益效果:
[0024]
不意图为任何理论所束缚,认为尽管可以以愈伤组织或悬浮培养物为起始原料培养某些枇杷的原生质体,但是这些方法取材不够便捷,且工艺较为复杂(参见林顺权等人的文章“枇杷原生质体培养形成愈伤组织”,福建农学院学报,20(2):179-184,1991;林庆良等人的文章“栋叶枇杷原生质体的分离与培养”,福建农业大学学报,23(l):26-29,1994)。
[0025]
本发明人进行了以枇杷(早钟6号、贵妃、华白1号)叶片为起始原料经酶解分离制备原生质体的实验,并且出人意料地发现,当酶解液中酶为纤维素酶rs和离析酶r-10两种混合时,且以浓度为5.0%纤维素酶rs、3.6-4.0%离析酶r-10(以质量百分比计)时,能较好的从枇杷叶片中分离出原生质体,该技术的突破,为后续体细胞融合种植创制及遗传转化进行基因功能验证提供了可能,将大大推进基因组学及生物技术创制新种质等研究的进展。本发明室外取枇杷叶片材料,样品取材方便,不需要对材料进行特殊处理;酶解过程只需要纤维素酶和离析酶两种酶制剂,酶液配制简单;不需要繁琐的试验步骤,一步即可获取数量可观的原生质体。本发明节约成本及劳力,无需特殊仪器:酶解液成分简单、成本较低;原生质体制取过程中只需要摇床、离心机等常规仪器,无需特殊仪器。
附图说明
[0026]
图1是取材的枇杷叶片,品种为“早钟6号”枇杷;
[0027]
图2是取材的枇杷叶片,品种为“贵妃”枇杷;
[0028]
图3是取材的枇杷叶片,品种为“华白1号”枇杷;
[0029]
图4是枇杷早钟6号的原生质体显微观察结果图,可明显观察到大量原生质体,放大倍数:4
×
10;
[0030]
图5是枇杷贵妃的原生质体显微观察结果图,可明显观察到大量原生质体,放大倍数:4
×
10;
[0031]
图6是枇杷华白1号的原生质体显微观察结果图,可明显观察到大量原生质体,放大倍数:4
×
10;
[0032]
图7是枇杷早钟6号的原生质体fda染色结果图,可观察到高活力原生质体,放大倍数:2
×
10;
[0033]
图8是枇杷贵妃的原生质体fda染色结果图,可观察到高活力原生质体,放大倍数:2
×
10;
[0034]
图9是枇杷华白1号的原生质体fda染色结果图,可观察到高活力原生质体,放大倍数:2
×
10。
具体实施方式
[0035]
下面通过具体实施例对本发明进行具体描述,在此指出以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,本领域的技术熟练人员可以根据上述发明内容对本发明作出一些非本质的改进和调整。本发明mes(2-n-吗啉已磺酸)购自西格玛奥德里奇(上海)贸易有限公司,品牌:sigma,货号为:m3671-50g;甘露醇购自天津希恩思奥普德科技有限公司,品牌:希恩思折扣,货号:a100122-0500;cellulose rs(纤维素酶rs),购自上海浩晔生物科技有限公司,品牌:yault,货号:aov0108;macerozyme r-10(离析酶r-10),购自上海浩晔生物科技有限公司,品牌:yault,货号:l0021-10g;pectolyase(果胶酶y-23),购自上海浩晔生物科技有限公司,品牌:yault,货号:aov0095;bsa(牛血清蛋白),购自重庆市叶脉生物技术有限责任公司,品牌:elabscienc,货号:e-ir-r108;崩溃酶,购自重庆佰研生物科技有限公司,品牌:鼎国;货号:dh115-2;cacl
2
(氯化钙),购自上海源叶生物科技有限公司,货号:s24109-500g。
[0036]
实施例1
[0037]
1、种子萌发
[0038]
(1)“早钟6号”枇杷品种种子播种于含有蛭石的土壤之中;
[0039]
(2)约40天,待种子萌发出幼嫩叶片(如图1所示),即可选用。
[0040]
2、试验流程
[0041]
(1)预处理:取植物幼嫩叶片于烧杯中,流水冲洗干净叶片内外表皮表面绒毛,将叶片用锋利刀片切成约0.5mm大小细条,立即置于0.6-1.0m甘露醇高渗溶液中浸泡2-4h。
[0042]
(2)酶解:移出甘露醇溶液,加入事先配置好的混合酶制液,置于50-100rpm/min摇床上,在黑暗中酶解振荡过夜(约12h)。本发明所述混合酶制液(10ml)为:首先加入10mm mes、0.6m甘露醇、5.0%纤维素酶rs、3.6%离析酶r-10,搅拌均匀,55℃加热10min,待自然冷却后,依次加入:0.01-1%bsa、1mm cacl
2
,用一级水定容至10ml。
[0043]
(3)观察:加入等体积的w5溶液(现用现配),停止酶解,过300目网筛,转移至15ml离心管中,700r/min,离心12分钟,移出上清液(弃去),沉淀中加入1ml w5溶液,重悬观察原生质体。
[0044]
本发明w5溶液即原生质体清洗液,可用于终止酶解反应或者清洗原生质体。
[0045]
本发明的w5溶液(50ml):5ml 1.54m nacl,6.25ml 1m cacl
2
,1.25ml 0.2m kcl,1mlmes-koh(ph=5.7)。
[0046]
参照上述实施例1,发明人进行了酶的探索。
[0047]
(1)首先酶制剂中以:纤维素酶1%、2%、3%,果胶酶0.1%、1%、2%为浓度,设置三因素三水平方差表,如下表1所示,显微镜可观察到有未去细胞壁的植物细胞,细胞碎片多,均未得到枇杷原生质体。
[0048]
表1低浓度的纤维素酶+果胶酶分离枇杷叶片中的原生质体
[0049][0050]
(2)发明人增大纤维素酶、果胶酶的浓度,纤维素酶浓度改为3.6%、4.2%、4.8%、果胶酶浓度改为1.8%、2.1%、2.4%,设置三因素三水平方差表,如下表2所示,显微镜观察不到细胞或可观察到的几乎都是细胞碎片,均未得到枇杷原生质体。
[0051]
表2高浓度的纤维素酶+果胶酶分离枇杷叶片中的原生质体
[0052][0053]
(3)发明人在纤维素浓度不变的情况下,将(2)组中果胶酶改为离析酶,设置三因素三水平方差表,如下表3所示,通过显微镜观察,个别组未观察到细胞或细胞碎片多,其余组次可以看到较少数量的原生质体。
[0054]
表3纤维素酶+离析酶分离枇杷叶片中的原生质体
[0055][0056]
(4)将酶制剂改为三种酶:第(3)组的基础上加入与离析酶相同浓度的果胶酶,如下表4所示,通过显微镜观察,同样观察到的几乎都是未去掉细胞壁的植物细胞,细胞碎片
多,未获得枇杷原生质体。
[0057]
表4纤维素酶+离析酶+果胶酶分离枇杷叶片中的原生质体
[0058][0059]
(5)在第(3)组的基础上加入崩溃酶,如下表5所示,通过显微镜观察,显微镜下未观察到细胞,未获得枇杷原生质体。
[0060]
表5纤维素酶+离析酶+崩溃酶分离枇杷叶片中的原生质体
[0061][0062]
(6)以第(3)组为基础,以纤维素酶浓度不变的情况下,设制离析酶的浓度为1.8%-4.7%的范围,如下表6所示,通过显微镜观察,显微镜下均可观察到枇杷原生质体。
[0063]
表6纤维素酶+离析酶分离枇杷叶片中的原生质体
[0064][0065]
(7)以第(6)组为基础,得出离析酶浓度为3.6%,以离析酶不变的情况下,设制纤维素酶的浓度为4%-5.4%的范围,设置三因素三水平方差表,如下表7所示,通过显微镜观察,显微镜下均可观察到枇杷原生质体。
[0066]
表7纤维素酶+离析酶分离枇杷叶片中的原生质体
[0067]
[0068][0069]
实验发现,以叶片为材料,经酶解法制备原生质体过程中,以纤维素酶+果胶酶形成的混合酶,要么得到的是细胞碎片,要么得到的是未去掉细胞壁的植物细胞,均未得到枇杷原生质体;以纤维素酶+离析酶形成的混合酶,可以看到较少数量的原生质体;以纤维素酶+果胶酶+离析酶形成的混合酶,得到的是未去掉细胞壁的植物细胞;以纤维素酶+离析酶+崩溃酶形成的混合酶,显微镜下几乎未观察到细胞。经过大量的试验发现,以叶片为材料,经酶解法制备原生质体过程中,酶制剂只需要用纤维素酶rs和离析酶r-10两种酶即可,相比于选用纤维素、离析酶及果胶酶的组合或者纤维素、离析酶及崩溃酶三种酶的组合,纤维素酶+离析酶两种酶组合明显好于三种酶的组合。进一步研究发现,分离枇杷叶片原生质体最适的酶浓度范围是:5.0%纤维素酶rs、3.6-4.0%离析酶r-10。5.0%纤维素酶rs、3.6%离析酶r-10组显微观察结果如图4(显微镜倍数4
×
10)所示,可明显观察到大量原生质体。
[0070]
fda染色:取适量原生质体,加入5mg/ml fda(荧光双醋酸酯)染液,在荧光显微镜下统计一个视野中发绿色荧光的细胞个数与总细胞个数的比值如图7所示(显微镜倍数2
×
10),染色结果表明,枇杷早钟6号的原生质体fda染色结果图,可观察到高活力原生质体。
[0071]
参照上述实施例1,以5.0%纤维素酶rs、3.6%离析酶r-10组成的混合酶用于贵妃枇杷和华白1号枇杷的叶片原生质体分离。枇杷贵妃幼嫩叶片如图2所示;枇杷贵妃的原生质体显微观察结果图5(显微镜倍数4
×
10),可明显观察到大量原生质体;枇杷贵妃的原生质体fda染色结果图8所示(显微镜倍数2
×
10),可观察到高活力原生质体。枇杷华白1号幼嫩叶片如图3所示;枇杷华白1号的原生质体显微观察结果图6(显微镜倍数4
×
10),可明显观察到大量原生质体;枇杷华白1号的原生质体fda染色结果图9所示(显微镜倍数2
×
10),可观察到高活力原生质体。综上,本发明方法适合早钟6号、贵妃、华白1号三种枇杷的原生质体分离,分离后的枇杷原生质体的活力均高。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



