靶向癌细胞的近红外光免疫疗法与宿主免疫激活的联合使用的制作方法
 2021-02-02 08:02:14|
2021-02-02 08:02:14| 335|
335| 起点商标网
起点商标网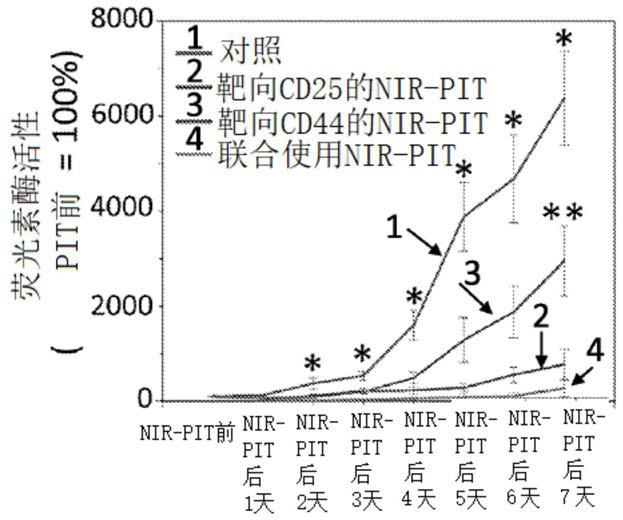
pit治疗大多未能诱导已形成肿瘤的持久消退。
技术实现要素:
[0010]
目前可用的癌症疗法旨在直接靶向癌细胞或激活宿主免疫系统。目前尚无能够同时杀伤癌细胞并激活对癌细胞的宿主免疫系统的可用癌症疗法。此外,目前的癌症免疫疗法尚未成功产生彻底治疗癌症所必需而无需担心复发的长期有效记忆t细胞—即所谓的“疫苗”效应。本文公开的方法可以有效地产生长时间发挥作用的记忆t细胞,其显著减少或甚至防止癌症的局部或全身性复发。
[0011]
本文提供了联合使用抗体-ir700分子和nir-光免疫疗法(pit)及免疫调节剂治疗癌症受试者的方法。在具体实例中,所述方法包括向癌症受试者施用治疗有效量的一种或多种抗体-ir700分子,其中,所述抗体与癌细胞表面分子(诸如肿瘤特异性抗原)特异性结合。所述方法还包括向受试者施用治疗有效量的一种或多种免疫调节剂(诸如免疫系统激活剂和/或是免疫抑制细胞的抑制剂),其与一种或多种抗体-ir700分子同时或基本上同时施用,或者序贯施用(例如,在彼此间隔约0至24小时内)。然后,在660至740nm波长(诸如660至710nm(例如,680nm))下以至少1j/cm2剂量(诸如至少50j/cm2或至少100j/cm2)照射所述受试者和/或照射所述受试者体内的癌细胞(例如,肿瘤,或血液中的癌细胞)。在一些实例中,所述方法可进一步包括选择具有肿瘤的癌症受试者或表达可与抗体-ir700分子特异性结合的癌细胞表面蛋白的癌症受试者。
[0012]
在一些实例中,抗体-ir700分子包括与癌细胞表面(诸如受体)的一种或多种蛋白结合的抗体,其中,癌细胞表面的蛋白在非癌细胞(诸如正常健康细胞)上未明显发现,因此抗体将不会与非癌细胞明显结合。在一个实例中,癌细胞表面蛋白是肿瘤特异性蛋白,诸如cd44、her1、her2或psma。本文提供了另外的示例性肿瘤特异性蛋白和抗体(包括下表1)。
[0013]
在具体实施方式中,免疫调节剂包括一种或多种免疫系统激活剂和/或免疫抑制细胞的抑制剂,诸如拮抗性pd-1抗体、拮抗性pd-l1抗体或cd25抗体-ir700分子。在一些实例中,免疫抑制细胞的抑制剂抑制调节性t(treg)细胞的活性和/或杀伤调节性t(treg)细胞。在其他实例中,免疫系统激活剂包括一种或多种白介素(诸如il-2和/或il-15)。在一些实例中,免疫调节剂可以增加对癌细胞表达的一种或多种蛋白具有特异性的记忆t细胞的产生。
[0014]
还提供了产生对靶细胞特异性的记忆t细胞的方法。在具体实例中,所述方法包括向受试者施用治疗有效量的一种或多种抗体-ir700分子,其中,所述抗体与靶细胞上的细胞表面分子(诸如肿瘤特异性蛋白)特异性结合。所述方法还包括向受试者施用治疗有效量的一种或多种免疫调节剂(诸如免疫系统激活剂或免疫抑制细胞的抑制剂),其与抗体-ir700分子同时或基本上同时施用,或者序贯施用(例如,在约0至24小时内)。然后,在660至740nm波长(诸如660至710nm(例如,680nm))下以至少1j/cm2剂量(诸如至少50j/cm2或至少100j/cm2)照射所述受试者和/或照射所述受试者体内的癌细胞,从而产生记忆t细胞。
[0015]
根据参考附图进行的几个实施方式的详细描述,本公开的前述和其他特征将变得更加显而易见。
附图说明
[0016]
图1a-1e是显示nir-pit联合抗cd44-ir700对mc38-luc细胞的体外作用的系列图。图1a显示了通过facs检测的cd44在mc38-luc细胞中的表达。图1b是数字图像,显示了对照和抗cd44-ir700处理的mc38-luc细胞的微分干涉差(dic)和荧光显微镜图像。处理的细胞经nir光激发后观察到坏死细胞死亡。图1c是10cm培养皿的生物发光成像(bli)的数字图像,显示了mc38-luc细胞中nir剂量依赖性荧光素酶活性。图1d是显示在经nir联合或不联合10μg/ml cd44-ir700处理的mc38-luc细胞中荧光素酶活性的图。图1e是显示在经nir联合或不联合10μg/ml cd44-ir700处理的mc38-luc细胞中细胞死亡百分比的图,使用碘化丙锭(pi)染色以死细胞计数进行测量。通过student t检验,*,p<0.05,相对于未处理的对照;**,p<0.01,相对于未处理的对照。
[0017]
图1f和1g是显示在经nir联合或不联合10μg/ml cd44-ir700处理的(f)llc细胞或(g)moc1细胞中细胞死亡百分比的图,使用碘化丙锭(pi)染色以死细胞计数测量。通过student t检验,*,p<0.05相对于未处理的对照;**,p<0.01相对于未处理的对照。
[0018]
图2a-2c moc1、llc和mc38-luc肿瘤区室中的基线cd44表达。(a)收集大小相当的moc1(第24天)、llc(第10天)和mc38-luc(第10天)肿瘤,消化成单细胞悬液,并通过流式细胞术评估单一细胞类型上cd44的表达(n=3/组)。显示肿瘤消化的代表性点图和门控策略。柱状图上方显示每种细胞类型的细胞表面表型。**p<0.01,***p<0.001,使用anova进行t检验。(b)荷瘤小鼠的体内cd44-ir700荧光实时成像。cd44-ir700 i.v.注射后24小时获得moc1(第18天)、llc(第4天)和mc38-luc(第4天)肿瘤的图像。与其他两种肿瘤相比,mc38肿瘤中cd44ir-700的荧光强度更高。(c)moc1、llc和mc38-luc肿瘤中ir700强度的定量分析。与其他肿瘤相比,mc38-luc肿瘤的荧光强度显著更高(n≥10,***p<0.001相对于moc1和llc肿瘤,tukey检验结合anova)。
[0019]
图3a-3g是显示在单侧肿瘤模型中靶向pit(抗cd44-ir700)与检查点抑制剂(抗pd1)的肿瘤联合疗法对mc38-luc肿瘤的体内作用的一系列图。(a)在指定时间点进行单侧肿瘤/nir-pit的处理方案以及荧光和生物发光成像;(b)荷瘤小鼠对nir-pit响应的体内ir700荧光实时成像;(c)荷瘤小鼠对体内bli。pd-1mab组的小鼠还接受cd44-ir700,但未经nir处理。(d)四个处理组的荧光素酶活性定量(n≥10,**p<0.01相对于对照,tukey t检验结合anova;#p<0.05相对于pd-1mab和nir-pit组,tukey t检验结合anova)。(e)切除的肿瘤(第10天)用h&e染色并评估坏死和白细胞浸润。白色标尺=100μm。黑色标尺=20μm。(f)肿瘤生长曲线(n≥10,**p<0.01相对于对照,tukey t检验结合anova;##p<0.01相对于pd-1mab和nir-pit组,tukey t检验结合anova)和(g)在nir-pit处理联合和不联合pd-1mab后的kaplan-meier生存分析(**p<0.01相对于对照,对数秩检验;##p<0.01相对于pd-1mab和nir-pit组,对数秩检验)。
[0020]
图4a-4d显示了nir-pit与pd-1mab在单侧llc荷瘤小鼠中的体内作用。(a)nir-pit方案。在每个指定时间点获得生物发光和荧光图像。(b)荷瘤小鼠对nir-pit单独使用或与pd-1mab联合使用响应的体内ir700荧光实时成像。pd-1mab组的小鼠还接受cd44-ir700,但未经nir处理。(c)在经nir-pit联合和不联合pd-1mab处理后的llc肿瘤生长曲线(n≥10,**p<0.01相对于对照,##p<0.01相对于pd-1mab和nir-pit组,tukey t检验结合anova)。(d)kaplan-meier生存分析(n≥10,*p<0.05,**p<0.01相对于对照,##p<0.01相对于pd-1mab和
nir-pit组,对数秩检验)。
[0021]
图5a-5d显示了nir-pit和pd-1mab在单侧moc1荷瘤小鼠中的体内作用。(a)nir-pit方案。在每个指定时间点获得生物发光和荧光图像。(b)荷瘤小鼠对nir-pit单独使用或与pd-1mab联合使用的体内ir700荧光实时成像。pd-1mab组的小鼠还接受cd44-ir700,但未经nir处理。(c)在经nir-pit联合和不联合pd-1mab处理后的moc1肿瘤生长曲线(n≥10,**p<0.01相对于对照,tukey t检验结合anova)。(d)kaplan-meier生存分析(n≥10,*p<0.05,**p<0.01相对于对照,对数秩检验)。
[0022]
图6a-6f nir-pit和pd-1mab在单侧mc38-luc荷瘤小鼠中的免疫相关和功能作用。(a)收集经nir-pit联合和不联合pd-1mab处理的mc38-luc肿瘤(第10天,n=5只/组)和对照组,消化成单细胞悬液,并通过流式细胞术分析肿瘤浸润淋巴细胞(til)。表示为所分析的每1.5
×
104个活细胞中浸润细胞的绝对数量。pd-1表达显示为插图(mfi,平均荧光强度)。*p<0.05,**p<0.01,***p<0.001,t检验结合anova。(b)多重免疫荧光用于验证流式细胞术的数据。显示代表性400
×
图像。til浸润的定量来自每个肿瘤的5个高倍视野(hpf),n=3只/组。**p<0.01,***p<0.001,t检验结合anova。(c)通过il-2梯度从按上述方法处理的肿瘤(n=5只/组)中提取til,通过负磁选择进行富集,并用经照射的脾细胞刺激,该脾细胞用代表选定的肿瘤相关抗原的已知mhc i类限制性表位的肽脉冲化。通过elisa从刺激后24小时收集的上清液中测定ifnγ水平。单独使用脾细胞(apc)、单独使用til(t)以及来自卵白蛋白(ova,siinfekl)的mhc i类限制性表位的上清液用作对照。*p<0.05,**p<0.01,***p<0.001,t检验结合anova。(d)肿瘤浸润树突细胞(dc)和巨噬细胞的流式细胞术分析,以及基于mhc ii类表达定量巨噬细胞极化。**p<0.01,***p<0.001,t检验结合anova。(e)肿瘤浸润的中性粒细胞(pmn-髓样)和调节性t细胞(t
regs
)的流式细胞术分析。*p<0.05,**p<0.01,t检验结合anova。(f)在cd45.2-cd31-pdgfr-肿瘤细胞和cd45.2
+
cd31-免疫细胞上pd-l1表达的流式细胞术分析。**p<0.01与对照相比,t检验结合anova。n=5只/组。
[0023]
图7a-7e nir-pit和pd-1mab在单侧llc荷瘤小鼠中的免疫相关和功能作用。(a)收集经nir-pit联合和不联合pd-1mab处理的llc肿瘤(第10天,n=5只/组)和对照组,消化成单细胞悬液,并通过流式细胞术分析肿瘤浸润淋巴细胞(til)。表示为所分析的每1.5
×
104个活细胞中浸润细胞的绝对数量。pd-1表达显示为插图(mfi,平均荧光强度)。*p<0.05,**p<0.01,***p<0.001,t检验结合anova。(b)通过il-2梯度从按上述方法处理的肿瘤(n=5只/组)中提取til,通过负磁选择进行富集,并用经照射的脾细胞刺激,该脾细胞用代表选定的肿瘤相关抗原的已知mhc i类限制性表位的肽脉冲化。通过elisa从刺激后24小时收集的上清液中测定ifnγ水平。单独使用脾细胞(apc)、单独使用til(t)以及来自卵白蛋白(ova,siinfekl)的mhc i类限制性表位的上清液用作对照。*p<0.05,**p<0.01,t检验结合anova。(c)肿瘤浸润树突细胞(dc)和巨噬细胞的流式细胞术分析,以及基于mhc ii类表达定量巨噬细胞极化。**p<0.01,***p<0.001,t检验结合anova。(d)肿瘤浸润的粒细胞髓样来源的抑制细胞pmn-髓样和t
regs
的流式细胞术分析。**p<0.01,***p<0.001,t检验结合anova。(e)在cd45.2-cd31-pdgfr-肿瘤细胞和cd45.2+cd31-免疫细胞上pd-l1表达的流式细胞术分析。*p<0.05,***p<0.001,t检验结合anova。
[0024]
图8a-8e nir-pit和pd-1mab在moc1荷瘤小鼠中的免疫相关和功能作用。(a)收集经nir-pit联合和不联合pd-1mab处理的moc1肿瘤(第10天,n=5只/组)和对照组,消化成单
pit方案。在每个指定时间点获得生物发光和荧光图像。(b)仅对荷有四处肿瘤的小鼠的尾部右侧肿瘤施用nir光。所有其他肿瘤避nir光。(c)荷瘤小鼠对仅尾部右侧肿瘤进行nir-pit响应的体内ir700荧光实时成像。(d)荷瘤小鼠对仅尾部右侧肿瘤进行nir-pit响应的体内bli。(e)对照小鼠和经nir-pit与pd-1mab联合处理的小鼠的所有肿瘤的荧光素酶活性定量。仅尾部右侧肿瘤经nir-pit处理(n=10,**p<0.01,tukey检验结合anova)。(f)切除的肿瘤(第10天)用h&e染色并评估坏死和白细胞浸润。白色标尺=100μm。黑色标尺=20μm。(g)对照小鼠和经nir-pit与pd-1mab联合处理的小鼠的右侧和左侧肿瘤的生长曲线。(h)对照小鼠和接受nir-pit与pd-1mab联合处理小鼠的处理肿瘤和未处理肿瘤的kaplan-meier生存分析(n=10,**p<0.01,对于生长曲线采用tukey检验结合anova;**p<0.01,对于生存率采用对数秩检验)。
[0029]
图13a-13c nir-pit和pd-1mab联合处理产生完全肿瘤排斥后,对mc38-luc细胞再激发的抗性。(a)对联合处理产生肿瘤完全排斥(cr)的小鼠的肿瘤再激发方案。首次接种后30天,在对侧接种肿瘤。小鼠接受mc38-luc细胞重新接种。(b)对照小鼠和对侧腋下接受mc38-luc细胞激发的cr小鼠的生长曲线。(c)kaplan-meier生存分析(n=9,***p<0.001,对于生长曲线采用tukey检验结合anova;***p<0.001,对于生存率采用对数秩检验)。
[0030]
图14a-14c注射抗cd25-mab-ir700后,mc38-luc、ll/2和moc1肿瘤的体内ir700荧光成像。(a)荷瘤小鼠的体内抗cd25-mab-ir700荧光实时成像。在mc38-luc、ll/2和moc1肿瘤中,注射抗体-光吸收剂偶联物(apc)后肿瘤显示高荧光强度,并且强度在注射后直至24小时逐渐增加,在48小时后逐渐稳定,然后下降。(b)对mc38-luc、ll/2和moc1肿瘤(每组n=5)中的平均荧光强度(mfi)进行定量分析。在apc注射后24小时内,mc38-luc、ll/2和moc1肿瘤中ir700的mfi表现出高摄取,随后在48小时后降低。在所有时间点,与moc1肿瘤相比,mc38-luc肿瘤随时间的总体mfi均显著较高(*p<0.05,mc38-luc相对于moc1肿瘤,tukey-kramer检验),并且与moc1肿瘤相比,ll/2肿瘤在24和48小时的mfi显著较高(**p<0.05,ll/2相对于moc1肿瘤,tukey-kramer检验)。(c)mc38-luc、ll/2和moc1肿瘤(每组n=5)中靶标与背景比(tbr)的定量分析。在apc注射后24小时内,tbr逐渐升高,然后在48小时后tbr下降。与moc1肿瘤相比,mc38-luc和ll/2肿瘤在24小时后的tbr显著较高(*p<0.05,mc38-luc相对于moc1肿瘤,tukey-kramer检验),并且与moc1肿瘤相比,ll/2肿瘤在48小时后的tbr较高(**p<0.05,ll/2肿瘤相对于moc1肿瘤,tukey-kramer检验)。
[0031]
图15a-15f靶向cd25和/或cd44的nir-pit对mc38-luc肿瘤模型的体内作用。(a)nir-pit方案。在每个指定时间点获得生物发光和荧光图像。(b)荷瘤小鼠对nir-pit响应的体内ir700荧光实时成像。nir-pit处理的肿瘤在nir-pit后立即显示ir700荧光强度降低。(c)荷瘤小鼠对nir-pit响应的体内生物发光成像。在nir-pit前,肿瘤的大小大致相同,并且表现出相似的生物发光。nir-pit处理的肿瘤在nir-pit后显示荧光素酶活性降低,随之逐渐增加(再生长)或消失(治愈)。(d)荷瘤小鼠nir-pit前后荧光素酶活性的定量分析。与对照组相比,所有nir-pit处理组的荧光素酶活性均在nir-pit处理后第2、3、4、5、6和7天显著降低(每组n=13-14只小鼠,*p<0.05相对于其他组,tukey-kramer检验)。与仅靶向cd44的nir-pit相比,靶向cd25与cd44的nir-pit联合使用的荧光素酶活性在nir-pit后7天显著降低(每组n=13-14只小鼠,**p<0.05相对于nir-pit联合使用组,tukey-kramer检验)。(e)与对照组相比,所有nir-pit处理组在nir-pit处理后2、5、7和10天的肿瘤生长受到显著抑
制(每组n=13-14只小鼠,*p<0.05相对于其他组,tukey-kramer检验)。与单独使用靶向cd44的nir-pit相比,联合使用靶向cd25和cd44的nir-pit在nir-pit后7天和10天显示出显著肿瘤减少(每组n=13-14只小鼠,**p<0.05相对于nir-pit联合使用组,tukey-kramer检验)。(f)与对照组相比,在所有nir-pit处理组中均观察到生存率显著增加(每组n=13-14只小鼠,**p<0.01,对数秩检验)。与单独使用靶向cd25的nir-pit和单独使用靶向cd44的nir-pit相比,联合使用靶向cd25和cd44的nir-pit表现出生存率显著增加(每组n=13-14只小鼠,*p<0.05,**p<0.01,对数秩检验)。
[0032]
图16a-16d靶向cd25和/或cd44的nir-pit对ll/2肿瘤模型的体内作用。(a)nir-pit方案。在每个指定时间点获得生物发光和荧光图像。(b)荷瘤小鼠对nir-pit响应的体内ir700荧光实时成像。nir-pit处理的肿瘤在nir-pit后立即显示ir700荧光强度降低。(c)与对照组相比,所有nir-pit处理组在nir-pit处理后5、7、10和12天的肿瘤生长受到显著抑制(每组n=9-10只小鼠,*p<0.05相对于其他组,tukey-kramer检验)。在所有nir-pit处理组中,与单独使用靶向cd44的nir-pit相比,联合使用靶向cd25和cd44的nir-pit在nir-pit后17天显示出显著肿瘤减少(每组n=9只小鼠,**p<0.05相对于联合使用nir-pit组,tukey-kramer检验)。(d)与对照组相比,在所有nir-pit处理组中均观察到生存率显著增加(每组n=9-10只小鼠,**p<0.01,对数秩检验)。与单独使用靶向cd25的nir-pit和单独使用靶向cd44的nir-pit相比,联合使用靶向cd25和cd44的nir-pit表现出生存率显著增加(每组n=9只小鼠,*p<0.05,**p<0.01,对数秩检验)。
[0033]
图17a-17d靶向cd25和/或cd44的nir-pit对moc1肿瘤模型的体内作用。(a)nir-pit方案。在每个指定时间点获得生物发光和荧光图像。(b)荷瘤小鼠对nir-pit响应的体内ir700荧光实时成像。nir-pit处理的肿瘤在nir-pit后立即显示ir700荧光强度降低。(c)与对照组相比,所有nir-pit处理组在nir-pit处理后4、7、10、14、17、21、24和28天的肿瘤生长受到显著抑制(每组n=9-10只小鼠,*p<0.05相对于其他组,tukey-kramer检验)。与单独使用靶向cd44的nir-pit相比,联合使用靶向cd25和cd44的nir-pit在nir-pit后28天显示出显著肿瘤减少(每组n=9-10只小鼠,**p<0.05相对于联合使用nir-pit组,tukey-kramer检验)。(d)与对照组相比,在所有nir-pit处理组中均观察到生存率显著增加(每组n=9-10只小鼠,**p<0.01,对数秩检验)。与单独使用靶向cd44的nir-pit相比,联合使用靶向cd25和cd44的nir-pit表现出生存率显著增加(每组n=9-10只小鼠,**p<0.01,对数秩检验)。
[0034]
图18解释联合使用靶向cd25和cd44的nir-pit诱导免疫疗法的拟定机制的方案。treg细胞通过抑制性细胞因子和细胞溶解,以及通过il-2消耗导致的代谢破坏和通过树突细胞(dc)成熟或功能的调节而抑制效应t细胞和nk细胞来限制抗肿瘤免疫力。联合使用靶向cd25和cd44的nir-pit在cd44+肿瘤中诱导免疫原性细胞死亡,并选择性耗竭高表达cd25的treg细胞。首先,在免疫原性细胞死亡的过程中,表面钙网蛋白的暴露、热休克蛋白(hsp)70/90以及濒死肿瘤细胞释放atp和高迁移率族蛋白1(hmgb1)诱导dc成熟。其次,treg细胞耗竭诱导效应t细胞和nk细胞激活和扩增,并同时分化为肿瘤特异性t细胞。总之,这种联合使用的nir-pit可以有效杀伤肿瘤并促进持久的抗肿瘤免疫力。
具体实施方式
[0035]
除非另有说明,否则本文中使用的所有技术和科学术语具有与所公开的发明所属
services,1991,通过引用将其合并于此)。kabat数据库目前保持在线。不同轻链或重链的框架区的序列在种属(诸如人)内相对保守。抗体的构架区,即组成轻链和重链的组合构架区,用于在三维空间中定位和排列cdr。
[0044]
cdr主要负责与抗原表位的结合。每条链的cdr通常称为cdr1、cdr2和cdr3,从n端开始依次编号,通常还由特定cdr所在的链标识。因此,v
h cdr3位于发现它的抗体的重链的可变区中,而v
l cdr1是来自发现它的抗体的轻链的可变区的cdr1。具有不同特异性的抗体(即不同抗原的不同结合位点)具有不同的cdr。尽管不同的抗体之间是不同的cdr,但cdr中仅有限数量的氨基酸位置直接参与抗原结合。cdr中的这些位置称为特异性决定残基(sdr)。
[0045]
提及“v
h”或“vh”是指免疫球蛋白重链的可变区,包括fv、scfv、dsfv或fab的可变区。提及“v
l”或“vl”是指免疫球蛋白轻链的可变区,包括fv、scfv、dsfv或fab的可变区。
[0046]“单克隆抗体”(mab)是由b淋巴细胞的单一克隆或由已转染单一抗体的轻链和重链基因的细胞产生的抗体。单克隆抗体例如通过由骨髓瘤细胞与免疫脾细胞的融合制备杂交抗体形成细胞产生。单克隆抗体包括人源化单克隆抗体。在一些实例中,抗体-ir700分子中的抗体是mab,诸如人源化mab。
[0047]“嵌合抗体”具有来自一个种属(诸如人)的框架残基,以及来自另一种属的cdr(通常赋予抗原结合),诸如特异性结合间皮素的鼠抗体。
[0048]“人源化”免疫球蛋白是包括人构架区和来自非人(例如,小鼠、大鼠或合成的)免疫球蛋白的一个或多个cdr的免疫球蛋白。提供cdr的非人免疫球蛋白称为“供体”,而提供框架的人免疫球蛋白称为“受体”。在一个实施方式中,所有cdr均来自人源化免疫球蛋白中的供体免疫球蛋白。恒定区不是必须存在,但如果存在,则它们必须与人免疫球蛋白恒定区基本上具有同一性,例如,至少约85-90%,诸如约95%或更多同一性。因此,除可能的cdr外,人源化免疫球蛋白的所有部分与天然人免疫球蛋白序列的相应部分基本上具有同一性。“人源化抗体”是包括人源化轻链和人源化重链免疫球蛋白的抗体。人源化抗体与提供cdr的供体抗体结合相同的抗原。人源化免疫球蛋白或抗体的受体构架可以被来自供体构架的氨基酸进行有限数量的置换。人源化抗体或其他单克隆抗体可具有其他保守氨基酸置换,这些置换对抗原结合或其他免疫球蛋白功能基本上没有影响。可以通过基因工程构建人源化免疫球蛋白(参见,例如,美国专利号5,585,089)。
[0049]“人”抗体(也称为“完全人”抗体)是包括人框架区和来自人免疫球蛋白的所有cdr的抗体。在一个实例中,框架和cdr来自相同来源的人重链和/或轻链氨基酸序列。然而,来自一种人抗体的框架可以经工程改造以包括来自不同人抗体的cdr。人免疫球蛋白的所有部分与天然人免疫球蛋白序列的相应部分基本上具有同一性。
[0050]“特异性结合”是指相对于与无关蛋白(诸如非肿瘤蛋白,例如β-肌动蛋白)的结合,个别抗体与抗原(诸如肿瘤特异性抗原)发生特异性免疫反应的能力。例如,her2特异性结合剂在体外或体内基本上仅结合her-2蛋白。如本文所用,术语“肿瘤特异性结合剂”包括在该制剂中基本上仅与肿瘤特异性蛋白结合的肿瘤特异性抗体(及其片段)和其他试剂。
[0051]
结合是抗体分子和t细胞表面分子的抗原决定簇之间的非随机结合反应。通常从抗体差异结合t细胞表面分子和无关抗原的能力的参考点确定目标结合特异性,并因此区分两种不同的抗原,特别是在两种抗原具有独特表位的情况下。特异性结合特定表位的抗
体称为“特异性抗体”。
[0052]
在一些实例中,抗体(诸如抗体-ir700分子中的一种)以比样本或受试者中其他分子的结合常数至少高103m-1
、高104m-1
或高105m-1
的结合常数与靶标(诸如细胞表面蛋白,诸如肿瘤特异性蛋白)特异性结合。在一些实例中,抗体(例如,mab)或其片段具有1nm或更小的平衡常数(kd)。例如,抗体以至少约0.1
×
10-8
m、至少约0.3
×
10-8
m、至少约0.5
×
10-8
m、至少约0.75
×
10-8
m、至少约1.0
×
10-8
m、至少约1.3
×
10-8
m、至少约1.5
×
10-8
m或至少约2.0
×
10-8
m的结合亲和力与靶标(诸如肿瘤特异性蛋白)结合。可以例如,通过竞争性elisa(酶联免疫吸附测定)或使用表面等离振子共振装置(诸如biacore t100,可从biacore,inc.,piscataway,nj获得)测定kd值。
[0053]
抗体-ir700分子或抗体-ir700偶联物:包括偶联至ir700的抗体(诸如肿瘤特异性抗体)的分子。在一些实例中,抗体是与癌细胞表面蛋白(诸如肿瘤特异性抗原)特异性结合的人源化抗体(诸如人源化mab)。
[0054]
抗原(ag):可以刺激动物体内产生抗体或t细胞应答的化合物、组合物或物质,包括注射或吸收至动物体内的组合物(诸如包括肿瘤特异性蛋白的组合物)。抗原与特定体液或细胞免疫的产物反应,包括由异源抗原,诸如所公开的抗原诱导的那些。“表位”或“抗原决定簇”是指b和/或t细胞对其应答的抗原区域。在一个实施方式中,当表位与mhc分子结合存在时,t细胞对表位产生应答。表位可以由蛋白的三级折叠并列的连续氨基酸或非连续氨基酸形成。由连续氨基酸形成的表位通常在暴露于变性溶剂时保留,而由三级折叠形成的表位通常在用变性溶剂处理时丢失。表位通常以独特的空间构象包括至少3个、更通常至少5个、约9个或约8-10个氨基酸。确定表位的空间构象的方法包括例如x射线晶体学和核磁共振。
[0055]
抗原的实例包括但不限于肽、脂质、多糖和含抗原决定簇的核酸,诸如被免疫细胞识别的那些。在一些实例中,抗原包括肿瘤特异性蛋白或肽(诸如在细胞表面如癌细胞上发现的一种)或其免疫原性片段。
[0056]
癌症:具有细胞生长异常或不受控制特征的恶性肿瘤。通常与癌症相关的其他特征包括转移、干扰邻近细胞的正常功能、以异常水平释放细胞因子或其他分泌产物以及抑制或加重炎症或免疫应答、侵袭周围或远距离的组织或器官(诸如淋巴节)等。“转移性疾病”是指已离开原始肿瘤部位并例如通过血流或淋巴系统迁移到身体其他部位的癌细胞。在一个实例中,通过所公开的方法杀伤的细胞是癌细胞。
[0057]
cd25(il-2受体α链):(例如,omim 147730)存在于激活的t细胞、激活的b细胞、一些胸腺细胞、髓样前体细胞和少突胶质细胞上的一种i型跨膜蛋白。cd25已被用作识别小鼠cd4+foxp3+调节性t细胞的标志物。cd25存在于一些癌细胞的表面,包括b细胞肿瘤、一些急性非淋巴细胞白血病、神经母细胞瘤、肥大细胞增多症和肿瘤浸润淋巴细胞。它起htlv-1受体的作用,因此在成人t细胞淋巴瘤/白血病的肿瘤细胞上表达。示例性cd25序列可见数据库(例如,登录号caa44297.1、np_000408.1和np_001295171.1)。对cd25特异的示例性mab是达利珠单抗(daclizumab)和巴利昔单抗,它们可以连接ir700,形成达利珠单抗-ir700或巴利昔单抗-ir700,其可以在公开的方法中使用以靶向表达cd25的癌细胞或用作免疫调节分子(例如,以减少肿瘤内的肿瘤浸润性treg细胞)。
[0058]
cd44:(例如,omim 107269)一种参与细胞间相互作用、细胞粘附和迁移的细胞表
面糖蛋白。cd44存在于某些癌细胞的表面,包括癌细胞干细胞、头颈癌细胞、乳腺癌细胞和前列腺癌细胞。示例性cd44序列可见数据库(例如,登录号caj18532.1、aci46596.1和aab20016.1)。对cd44特异的示例性mab是比伐珠单抗(bivatuzumab),它可以连接ir700,形成比伐珠单抗-ir700,可以在公开的方法中使用以靶向表达cd44的癌细胞。
[0059]
接触:以直接物理联系的方式放置,包括固体和液体形式。接触可以在体外发生,例如,与分离的细胞,诸如肿瘤细胞,或通过向受试者(诸如患有肿瘤的受试者,诸如癌症)施用而在体内发生。
[0060]
降低:减少某物的质量、数量或强度。在一个实例中,例如,与不存在抗体-ir700分子时的应答相比,在经nir(例如,在约680nm的波长下)以至少1j/cm2剂量照射细胞后,包括一种或多种抗体-ir700分子的治疗组合物降低抗体-ir700分子特异性结合的细胞的活力。在一些实例中,这种降低通过杀伤细胞来证明。在一些实例中,相对于用不包括抗体-ir700分子的组合物观察到的活力,细胞活力降低至少20%、至少50%、至少75%或甚至至少90%。在其他实例中,降低表示为倍数变化,诸如相对于不包括抗体-ir700分子的组合物观察到的活力,细胞活力降低至少2倍、至少3倍、至少4倍、至少5倍、至少8倍、至少约10倍、甚至至少15或20倍。可以使用本文公开的方法测量这种降低。
[0061]
免疫调节剂:免疫调节剂是改变(例如,增加或降低)免疫系统的一种或多种功能的物质。在一些实例中,免疫调节剂激活免疫系统。在其他实例中,免疫调节剂抑制(或杀伤)免疫抑制剂细胞的活性。
[0062]
ir700(700dx):具有下式的染料:
[0063][0064]
可从li-cor(lincoln,ne)商购获得。氨基反应性ir700是一种相对亲水的染料,可以使用ir700的nhs酯与抗生物素共价偶联。与传统的光敏剂诸如血卟啉衍生物(在630nm下1.2
×
103m-1
cm-1
)、间四羟基苯氯;(在652nm下2.2
×
104m-1
cm-1
)和单-l-天冬氨酰氯e6;npe6/(在654nm下4.0
×
104m-1
cm-1
)相比,ir700的消光系数高出5倍以上(在689nm的最大吸收下2.1
×
105m-1
cm-1
)。
[0065]
药物组合物:当适当地施用于受试者时能够诱导目标治疗或预防作用的化学化合物或组合物。药物组合物可以包括治疗剂,诸如一种或多种抗体-ir700分子和/或一种或多种免疫调节剂。治疗剂或试剂是单独或与另外的化合物一起诱导目标应答(诸如当施用于受试者时诱导治疗或预防作用)的药物。在具体实例中,药物组合物包括治疗有效量的至少一种抗体-ir700分子。
[0066]
药学上可接受的溶媒:可用于本发明的药学上可接受的载体(溶媒)是常规的。
remington:the science and practice of pharmacy,the university of the sciences in philadelphia,editor,lippincott,williams,&wilkins,philadelphia,pa,21
st edition(2005),描述了适用于药物递送一种或多种治疗化合物(诸如一种或多种抗体-ir700分子和/或一种或多种免疫调节剂)的组合物和制剂。
[0067]
通常,载体的性质将取决于所采用的特定施用方式。例如,肠胃外制剂通常包括注射液,其包括药学上和生理学上可接受的流体,诸如水、生理盐水、平衡盐溶液、右旋糖水溶液、甘油等作为溶媒。对于固体组合物(例如,粉末、丸剂、片剂或胶囊剂形式),常规的无毒固体载体可以包括例如药用级的甘露醇、乳糖、淀粉或硬脂酸镁。除生物中性载体外,待施用的药物组合物可以包含少量的无毒辅助物质,诸如润湿剂或乳化剂、防腐剂和ph缓冲剂等,例如乙酸钠或脱水山梨糖醇单月桂酸酯。
[0068]
光免疫疗法(pit):一种分子靶向治疗,其利用与靶向细胞表面蛋白的单克隆抗体(mab)偶联的基于近红外(nir)酞菁染料ir700的靶标特异性光敏剂。在一个实例中,细胞表面蛋白是一种在癌细胞上特异性发现的蛋白,因此pit可用于杀伤此类细胞。当抗体-ir700分子与细胞结合并经nir照射细胞时,发生细胞死亡,而不表达被抗体-ir700分子识别的细胞表面蛋白的细胞不会大量死亡。
[0069]
程序性死亡1(pd-1):(例如,omim 600244)细胞表面的一种1型膜蛋白,其通过下调免疫系统调节免疫系统对人体细胞的应答,并通过抑制t细胞的炎症活动促进自身耐受性。pd-1与两个配体pd-l1和pd-l2结合。示例性pd-1序列可见数据库(例如,登录号caa48113.1、np_005009.2和np_001076975.1)。
[0070]
拮抗pd-1活性的抗体可以在本文提供的方法中用作免疫调节剂,例如与肿瘤特异性抗原ab-ir700分子联合使用。示例性pd-1特异的拮抗性mab包括纳武利尤单抗、帕博利珠单抗、pidilizumab、西米普利单抗、pdr001、amp-224和amp-514。
[0071]
程序性死亡配体1(pd-l1):(例如,omim 605402)细胞表面的一种1型膜蛋白,其在人身、同种异体移植、自身免疫性疾病和肝炎等特定事件中抑制免疫系统的适应能力。pd-l1与抑制性检查点分子pd-1的结合通过基于免疫受体酪氨酸的开关基序(itsm)基序与磷酸酶(shp-1或shp-2)相互作用传递抑制信号。pd-l1与激活的t细胞、b细胞和髓样细胞上发现的pd-1结合,以调节激活或抑制作用。示例性pd-l1序列可见数据库(例如,登录号adk70950.1、np_054862.1和np_001156884.1)。
[0072]
可以使用拮抗pd-l1活性的抗体用作本文提供的方法中的免疫调节剂,例如与肿瘤特异性抗原ab-ir700分子联合使用。示例性pd-l1特异的拮抗性单克隆抗体包括阿替利珠单抗、阿维鲁单抗、度伐利尤单抗、ck-301和bms-936559。
[0073]
受试者或患者:包括人和非人哺乳动物的术语。在一个实例中,受试者是人或兽医受试者,诸如小鼠、大鼠、犬、猫或非人灵长类动物。在一些实例中,受试者是患有癌症或正在接受癌症治疗的哺乳动物(诸如人)。
[0074]
治疗有效量:单独或与另外的治疗剂(诸如化学治疗剂)一起足以在受治疗者或受试者的细胞或细胞中获得目标作用的组合物的量。试剂(诸如抗体-ir700分子,单独或与免疫调节剂联合使用)的有效量可取决于多种因素,包括但不限于待治疗的受试者或细胞、特定的治疗剂和治疗组合物的施用方式。在一个实例中,治疗有效量或浓度是足以预防疾病进展(诸如转移)、延迟进展或引起疾病消退的量或浓度,或能够减轻由疾病引起的症状(诸
如癌症)的量或浓度。在一个实例中,治疗有效量或浓度是足以增加患有肿瘤的患者的生存时间的量。
[0075]
在一个实例中,所希望的应答是减轻或抑制与癌症有关的一种或多种症状。对于组合物有效,不必完全消除一种或多种症状。例如,将含抗体-ir700分子的组合物和含免疫调节剂的组合物(和/或含两者的单一组合物)与照射联合使用可以减小肿瘤的大小(诸如肿瘤的体积或重量或肿瘤的转移),例如,与不存在治疗的情况下的肿瘤大小相比,减小至少20%、至少50%、至少80%、至少90%、至少95%、至少98%或甚至至少100%。在一个具体实例中,所希望的应答是杀伤所希望数量的细胞(诸如癌细胞),例如,与不存在抗体-ir700分子、免疫调节剂和照射的情况下杀伤细胞相比,杀伤至少20%、至少50%、至少60%、至少70%、至少有80%、至少90%、至少95%、至少98%、甚至至少100%的细胞。在一个具体实例中,所希望的应答是使患有肿瘤的患者(或最近已切除肿瘤的患者)的生存时间增加所希望的量,例如,与不存在抗体-ir700分子、免疫调节剂和照射的情况下的生存时间相比,生存时间增加至少20%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少100%、至少200%或至少500%。在一些实例中,所希望的反应是增加受试者中的记忆t细胞的量,例如与不存在抗体-ir700分子、免疫调节剂和照射的情况相比,记忆t细胞的量增加至少20%,至少50%,至少60%,至少70%,至少80%,至少90%,至少95%,至少98%,至少100%,至少200%或至少500%。在一些实例中,所希望的应答是增加受试者对mhc i型限制性肿瘤特异性抗原的多克隆抗原特异性tic应答的量,例如,与不存在抗体-ir700分子、免疫调节剂和照射的情况下对mhc i型限制性肿瘤特异性抗原的多克隆抗原特异性tic应答的量相比,增加至少20%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少100%、至少200%或至少500%。在一些实例中,所希望的应答是降低靶向肿瘤中tregs(诸如foxp3
+
cd25
+
cd4
+
treg细胞)的量,例如,与不存在抗体-ir700分子、免疫调节剂和照射的情况下靶向肿瘤中的treg的量相比,降低至少20%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少100%。在一些实例中,这些作用的组合通过所公开的方法实现。
[0076]
施用于人或兽医受试者的包括一种或多种所公开的抗体-ir700分子(单独或与一种或多种免疫调节剂联合使用)的试剂的有效量将根据与该受试者相关的许多因素而变化,例如受试者的整体健康状况。试剂的有效量可以通过改变组合物的剂量并测量所产生的治疗应答,诸如肿瘤消退来确定。有效量还可以通过多种体外、体内或原位免疫测定来确定。所公开的试剂可以根据需要以单次给药或多次给药以获得所希望的应答。然而,有效量可以取决于待应用的治疗、待治疗的受试者、待治疗病症的严重程度和类型以及施用方式。
[0077]
在具体实例中,抗体-ir700分子的治疗有效剂量例如i.v.施用时是每60千克至少0.5毫克(mg/kg)、至少5mg/60kg、至少10mg/60kg、至少20mg/60kg、至少30mg/60kg、至少50mg/60kg,例如0.5至50mg/60kg,诸如1mg/60kg、2mg/60kg、5mg/60kg、20mg/60kg或50mg/60kg。在另一个实例中,抗体-ir700分子的治疗有效剂量例如在瘤内或i.p.施用时是至少10μg/kg,诸如至少100μg/kg、至少500μg/kg或至少500μg/kg,例如10μg/kg至1000μg/kg,诸如100μg/kg、250μg/kg、约500μg/kg、750μg/kg或1000μg/kg。在一个实例中,治疗有效剂量以外用溶液施用时是至少1μg/ml,诸如至少500μg/ml,诸如20μg/ml至100μg/ml之间,诸如10μg/ml、20μg/ml、30μg/ml、40μg/ml、50μg/ml、60μg/ml、70μg/ml、80μg/ml、90μg/ml或100μ
g/ml。然而,本领域技术人员将认识到,例如,取决于特定的抗体-ir700分子,也可以使用更高或更低的剂量。在具体实例中,这种日剂量以单次或多次分开给药(诸如2、3或4次给药)或以单一制剂的形式施用。公开的抗体-ir700分子可以在药学上可接受的载体存在下,在其他治疗剂(诸如其他抗肿瘤剂)存在下单独施用。
[0078]
通常,在施用一种或多种抗体-ir700分子和一种或多种免疫调节剂后,合适的照射剂量在660-740nm波长下为至少1j/cm2,例如,在660-740nm波长下为至少10j/cm2,在660-740nm波长下为至少50j/cm2,或在660-740nm波长下为至少100j/cm2,例如在660-740nm波长下为1至500j/cm2。在一些实例中,波长为660-710nm。在特定实例中,在施用抗体-ir700分子后,合适的照射剂量在680nm波长下为至少1.0j/cm2,例如,在680nm波长下为至少10j/cm2,在680nm波长下为至少50j/cm2,或在680nm波长下为至少100j/cm2,例如在680nm波长下为1至500j/cm2。在特定实例中,在施用抗体-ir700分子和/或免疫调节剂后进行多次照射(诸如至少2次、至少3次或至少4次照射,诸如2次、3次、4次、5次、6次、7次、8次、9次或10次分开施用)。
[0079]
处理/治疗(treating):该术语用于指用治疗剂对细胞或组织进行处理,包括将一种或多种试剂(诸如一种或多种抗体-ir700分子和一种或多种免疫调节剂)与细胞或组织接触或孵育和/或将一种或多种试剂施用于受试者,例如患有癌症的受试者。处理的细胞是已经与目标组合物接触的细胞,其数量和条件足以满足所希望的应答。在一个实例中,处理的细胞是在足以使抗体结合细胞表面蛋白的条件下暴露于抗体-ir700分子的细胞,与免疫调节剂接触,并经nir光照射,直至达到杀伤足够的细胞。在其他实例中,治疗的受试者是在足以使抗体结合细胞表面蛋白的条件下施用一种或多种抗体-ir700分子,施用一种或多种免疫调节剂并用nir光照射,直至达到杀伤足够的细胞的受试者。
[0080]
肿瘤、赘生物、恶性肿瘤或癌症:赘生物是由于过度细胞分裂而导致的组织或细胞的异常生长。赘生物生长可产生肿瘤。个体中肿瘤的量即“肿瘤负荷”,可以用肿瘤的数量、体积或重量测量。不转移的肿瘤称为“良性”。侵入周围组织和/或可以转移的肿瘤被称为“恶性”。“非癌组织”是来自其中形成了恶性肿瘤的同一器官,但是不具有该肿瘤的特征性病理的组织。通常,非癌组织在组织学上看起来是正常的。“正常组织”是来自器官的组织,其中该器官不受癌症或该器官的另一疾病或病症的影响。“无癌”受试者尚未被诊断患有该器官的癌症,也没有可检测的癌症。
[0081]
肿瘤包括原始(原发性)肿瘤、复发性肿瘤和转移性(继发性)肿瘤。肿瘤复发是指与原始(原发性)肿瘤位于同一部位的肿瘤的复发,例如,在通过外科手术、药物或其他方法切除肿瘤或以其他方式消失之后。转移是肿瘤从身体的一部分扩散到另一部分。由扩散的细胞形成的肿瘤称为继发性肿瘤,其包含的细胞类似于原始(原发性)肿瘤中的细胞。原发性肿瘤或转移瘤均可复发。
[0082]
可以用所公开的方法治疗的示例性肿瘤(诸如癌症)包括实体瘤,诸如乳腺癌(例如,小叶癌和导管癌)、肉瘤、肺癌(例如,非小细胞癌、大细胞癌、鳞状癌和腺癌)、肺间皮瘤、结肠直肠腺癌、头颈癌(例如,腺癌、鳞状细胞癌、转移性鳞状细胞癌,诸如由hpv或epstein-barr病毒(诸如hpv16)引起的癌症;可以包括口腔癌、舌癌、鼻咽癌、咽喉癌、下咽癌、喉癌和气管癌)、胃癌、前列腺腺癌、卵巢癌(诸如浆液性囊腺癌和粘液性囊腺癌)、卵巢生殖细胞瘤、睾丸癌和生殖细胞瘤、胰腺腺癌、胆道腺癌、肝细胞癌、膀胱癌(包括例如移行细胞癌、腺
癌和鳞状癌)、肾细胞腺癌、子宫内膜癌(包括例如腺癌和mullerian混合瘤(癌肉瘤))、子宫颈内膜癌、子宫颈癌和阴道癌(诸如腺癌和鳞状上皮癌)、皮肤肿瘤(例如,鳞状细胞癌、基底细胞癌、恶性黑色素瘤、皮肤附属肿瘤、kaposi肉瘤、皮肤淋巴瘤、皮肤附带肿瘤和多种类型的肉瘤和merkel细胞癌)、食道癌、鼻咽和口咽癌(包括鳞状癌和腺癌)、唾液腺癌、脑和中枢神经系统肿瘤(包括例如神经胶质、神经元和脑膜来源的肿瘤)、周围神经肿瘤、软组织肉瘤以及骨骼和软骨肉瘤,以及淋巴瘤(包括b细胞和t细胞恶性淋巴瘤)。在一个实例中,该肿瘤是腺癌。
[0083]
该方法还可用于治疗液体肿瘤(例如,血液系统恶性肿瘤),诸如淋巴、白细胞或其他类型的白血病。在特定实例中,待治疗的肿瘤是血液肿瘤,诸如白血病(例如急性淋巴细胞白血病(all)、慢性淋巴细胞白血病(cll)、急性骨髓性白血病(aml)、慢性骨髓性白血病(cml)、毛细胞白血病(hcl)、t细胞淋巴细胞白血病(t-pll)、大颗粒性淋巴细胞白血病和成人t细胞白血病)、淋巴瘤(诸如霍奇金淋巴瘤和非霍奇金淋巴瘤)和骨髓瘤。
[0084]
在充分的条件下:用于描述实现所希望的活性的任何环境的短语。在一个实例中,“在充分的条件下”包括向受试者施用足以实现抗体-ir700分子结合其靶细胞表面蛋白(诸如肿瘤特异性抗原)的抗体-ir700分子。在具体实例中,所希望的活性是在治疗性照射细胞后杀伤与抗体-ir700分子结合的细胞。
[0085]
未处理的/未治疗的(untreated):未处理的细胞是尚未与治疗剂(诸如抗体-ir700分子、免疫调节剂和/或照射)接触的细胞。在一个实例中,未处理的细胞是接受其中递送治疗剂的溶媒的细胞。类似地,未治疗的受试者是未施用治疗剂(诸如抗体-ir700分子和免疫调节剂和/或照射)的受试者。在一个实例中,未治疗的受试者是接受其中递送治疗剂的溶媒的受试者。
[0086]
某些特定实例的公开并不表示排除其他实施方式。另外,本文描述的任何治疗不一定排除其他治疗,而是可以与其他生物活性剂或治疗方式组合。
[0087]
技术概述
[0088]
近红外光免疫疗法(nir-pit)是一种高选择性的癌症治疗方法,它利用与光吸收剂ir700dx和nir光结合的单克隆抗体(mab)诱导坏死/免疫原性细胞死亡。cd44与对癌症治疗的抗性有关,但是本文显示使用抗cd44-mab-ir700偶联物的nir-pit抑制多种肿瘤类型中的细胞生长并延长存活。cd44 mab-ir700 nir-pit靶向癌症抗原并引发坏死/免疫原性细胞死亡,这与大多数其他癌症疗法所诱导的凋亡性细胞死亡不同。用免疫调节剂(诸如免疫检查点抑制剂,例如抗pd1抗体)进行的其他处理可协同抗cd44-mab-ir700偶联物的抗癌作用。
[0089]
此外,这些方法成功地诱导了未经pit治疗的远距离肿瘤(例如转移瘤)的减少,并在随后用相同类型的肿瘤细胞攻击后抑制了肿瘤的复发。因此,所公开的方法还可以通过引发宿主免疫来治疗复发或转移(例如,在一些实例中,该方法减少或消除肿瘤复发)。pd-1免疫检查点封锁(icb)在近红外光免疫疗法后逆转适应性免疫抵抗,以增强多克隆t细胞反应并诱导已治疗和远距离未治疗肿瘤中已建立的同基因肿瘤的排斥。这些多克隆应答还可增强抑制复发的免疫记忆的形成。这项工作是第一个明确证明靶向肿瘤的溶细胞疗法后从头产生的多克隆t细胞应答(例如,对由树突细胞处理的多种肿瘤相关抗原)的发展。在一些实例中,所公开的方法引起treg的选择性耗竭、增加记忆t细胞(诸如肿瘤抗原特异性t细
胞)的数量、增加树突细胞肿瘤浸润或其组合。
[0090]
在某些同系小鼠模型中,foxp3
+
cd25
+
cd4
+
treg细胞可抑制宿主的抗肿瘤免疫力,该免疫力是通过抑制ctla4轴的dc功能或效应t或nk细胞激活介导的。在存在treg细胞的情况下,在肿瘤微环境(tme)中对肿瘤抗原的暴露增加可能会优先激活抗原特异性treg细胞,而不是抗原特异性效应t细胞。为了克服这个问题,使用联合靶向cd44和cd25的nir-pit同时靶向癌细胞和treg细胞,与单独使用任一靶向的nir-pit相比,它具有出色的抗肿瘤作用和更高生存率。相比之下,在研究的所有三个同基因肿瘤模型中,以单独靶向cd44的nir-pit的效果明显较差。尽管treg细胞使用多种免疫抑制机制介导肿瘤免疫逃逸,但靶向cd25的nir-pit可以通过选择性treg细胞耗竭而使所有这些机制无法发挥作用。这些结果表明,所公开的方法比靶向癌症抗原的nir-pit或仅消除免疫抑制功能具有更高的体内治疗益处(例如,肿瘤生长抑制和增加生存率)。这种联合使用nir-pit实现了一些完全缓解,而单独使用这两种类型的nir-pit并非如此。因此,与常规的靶向癌症抗原的nir-pit相比,联合使用nir-pit方法可使得长期生存,这可能是由于直接杀伤肿瘤,通过免疫原性细胞死亡诱导肿瘤免疫原性和来自于由靶向cd25的nir-pit造成的选择性treg细胞耗竭的宿主抗肿瘤细胞的有效激活的叠加作用所致。这三个事件共同作用可能引起原本具有抗性的肿瘤的长期肿瘤应答。因此,将nir-pit与靶向cd25和cd44的药物联合使用可以消除肿瘤细胞和靶向肿瘤内的foxp3
+
cd25
+
cd4
+
treg细胞。此外,同时靶向癌抗原和tme中免疫抑制细胞的联合使用nir-pit可能比一种单独的可用于诱导肿瘤接种的nir pit更高效。
[0091]
foxp3
+
cd25
+
cd4
+
treg细胞的存在阻碍了肿瘤特异性高亲和力效应t细胞的发展,尽管低亲和力效应t细胞可以发挥功能并扩展。treg细胞耗竭能够从原始t细胞前体中激活和扩增肿瘤特异性高亲和力t细胞,从而使其分化为能够介导有效的抗肿瘤免疫应答的高亲和力效应t细胞。当发生这种情况时,由于激活了肿瘤特异性高亲和力或记忆t细胞,可导致长期的抗肿瘤免疫,因此,联合使用靶向cd25和cd44的nir-pit可以用于肿瘤免疫(图18)。nir-pit可以重复进行,因为它对周围的正常相邻细胞造成的损害最小。抗体-光吸收剂偶联物(apc)和近红外光的重复给药可以提高近红外pit的有效性,从而增加靶向肿瘤中成功接种的频率。
[0092]
基于这些观察,本文提供了使用nir-pit联合免疫调节治疗受试者的方法,其可以局部杀伤癌细胞,而对周围细胞或未被抗体-ir700分子靶向的其他细胞的损害最小,并且还提供了有效的抗肿瘤宿主免疫激活,导致使用受试者自身的免疫系统对多种癌症进行高效治疗,无论是局部治疗,还是远离治疗部位的远距离转移,具有极小的副作用。在一些实例中,用所公开的方法治疗单一局部部位实现全身宿主抵抗癌症的免疫力,导致在治疗部位以及未治疗的远距离转移性病变的肿瘤快速消退,同时产生极小的副作用。
[0093]
治疗癌症的方法
[0094]
本公开提供了用于治疗癌症受试者(诸如患有肿瘤或血液恶性肿瘤的受试者)的方法。该方法包括向受试者施用与染料ir700偶联的抗体(在本文中称为抗体-ir700分子),其中抗体与癌细胞(例如,肿瘤)细胞表面蛋白(在本文中也称为肿瘤特异性抗原或蛋白)特异性结合。在允许抗体与癌细胞表面蛋白特异性结合的条件下,向受试者施用治疗有效量的一种或多种抗体-ir700分子(例如在药学上可接受的载体,诸如药学上和生理上可接受的液体存在下)。例如,抗体-ir700分子可以存在于药学上有效的载体中,诸如水、生理盐
水、平衡盐溶液(诸如pbs/edta)、右旋糖水溶液、芝麻油、甘油、乙醇、其组合等,作为溶媒。载体和组合物可以是无菌的,并且制剂适合于施用方式。在特定实例中,抗体-ir700分子是cd44抗体-ir700。
[0095]
该方法还包括向受试者施用治疗有效量的一种或多种免疫调节剂,诸如一种或多种免疫系统激活剂和/或一种或多种免疫抑制细胞抑制剂(例如在药学上可接受的载体存在下,诸如药学上和生理上可接受的液体)。在特定实例中,免疫调节剂是pd-1或pd-l1抗体。在另一个具体实例中,免疫调节剂是cd25抗体-ir700。在一些实例中,将一种或多种免疫调节剂和与癌细胞表面蛋白结合的一种或多种抗体-ir700分子并行(例如,同时或基本上同时)施用于受试者,例如以相同的组合物,或如果作为单独的组合物施用,则应在彼此间隔约1小时内(例如,在约5分钟、约10分钟、约15分钟、约20分钟、约30分钟、约40分钟、约50分钟或约60分钟内)。在其他实例中,将与癌细胞表面蛋白结合的一种或多种抗体-ir700分子和一种或多种免疫调节剂序贯(以任一顺序)施用于受试者,例如,间隔至少约1小时至1周(例如,间隔约2小时、约12小时、约24小时、约48小时、约3天、约4天、约5天、约6天或约7天)。
[0096]
施用一种或多种抗体-ir700分子后,使一种或多种抗体-ir700分子蓄积在靶肿瘤中。然后在允许杀伤细胞的条件下照射癌细胞(或患有癌症的受试者),例如在660至710nm波长下以至少1j/cm2的剂量照射。在一个实例中,施用抗体-ir700分子与照射之间有至少约10分钟、至少约30分钟、至少约1小时、至少约4小时、至少约8小时、至少约12小时、至少约24小时或至少约48小时(诸如约1至4小时、30分钟至1小时、10分钟至60分钟、30分钟至8小时、2至10小时、12至24小时、18至36小时或24至48小时。在一个实例中,施用(例如,i.v.)一种或多种抗体-ir700分子,并在至少约10分钟、至少约30分钟、至少约1小时、至少约4小时、至少约8小时、至少约12小时、至少约24小时或至少约48小时(诸如约1至4小时、30分钟至1小时、10分钟至60分钟、30分钟至8小时、2至10小时、12至24小时、18至36小时或24至48小时,诸如约24小时)之后,照射肿瘤(或受试者)。可以在一种或多种抗体-ir700分子之前或之后和/或在照射之前或之后施用一种或多种免疫调节剂。在一些实例中,在照射之前和之后施用一种或多种免疫调节剂,例如,在照射之前施用免疫调节剂至少一次,并且在照射之后施用免疫调节剂至少一次(诸如照射之前24小时和照射后24、48、72、96或更多小时中的一个或多个)。在另外的实例中,还可以在至少一次照射治疗的同一天施用一定剂量的免疫调节剂。
[0097]
在一些实例中,向受试者多次施用一种或多种抗体-ir700分子、免疫调节剂和nir照射,诸如至少2次、至少3次、至少4次、至少5次、至少6次、至少7次、至少8次、至少9次或至少10次单独给药(或施用)。在特定实例中,向受试者至少施用一次一种或多种抗体-ir700分子,至少两次一种或多种免疫调节剂,和至少施用两次nir照射。
[0098]
nir激发光波长允许至少几厘米穿透到组织中。例如,通过使用带有扩散器尖端的光纤耦合激光二极管,nir光可以在相对于体表深处无法进入的几厘米的肿瘤内递送。除了治疗实体癌之外,循环肿瘤细胞(包括但不限于血液系统恶性肿瘤)也可以作为靶标,因为它们在穿过浅表血管时可以被激发(例如,使用本文所述的nir led可穿戴装置)。
[0099]
在一个实例中,向受试者施用一种或多种抗体-ir700分子和一种或多种免疫调节剂,联合照射,杀伤表达与抗体特异性结合的细胞表面蛋白(诸如肿瘤特异性抗原)的靶细
胞(诸如癌细胞)。例如,相对于不使用一种或多种抗体-ir700分子和一种或多种免疫调节剂联合照射进行治疗,在一些实例中所公开的方法杀伤至少10%,例如至少20%、至少40%、至少50%、至少80%、至少90%、至少95%、至少98%或更多的治疗的靶细胞(诸如表达肿瘤特异性抗原的癌细胞)。
[0100]
在一个实例中,向患有肿瘤的受试者施用一种或多种抗体-ir700分子并施用一种或多种免疫调节剂,联合照射,选择性地杀伤表达与抗体特异性结合的细胞表面蛋白(诸如肿瘤特异性抗原)的细胞,从而治疗肿瘤。相对于正常细胞的选择性杀伤肿瘤细胞是指相对于正常细胞(例如,不表达与所施用抗体特异性结合的细胞表面蛋白(诸如肿瘤特异性抗原)的细胞),该方法能够更有效地杀伤肿瘤细胞。例如,在一些实例中所公开的方法减小肿瘤的大小或体积、减慢肿瘤生长、减少或减慢肿瘤复发、减少或减慢肿瘤转移(例如通过减少转移数量或减小转移的体积或大小),或它们的组合。例如,相对于未进行施用一种或多种抗体-ir700分子和施用一种或多种免疫调节剂联合照射,在一些实例中所公开的方法减小肿瘤大小(诸如肿瘤的重量或体积)或肿瘤数量和/或减小转移的肿瘤大小或转移的肿瘤数量,诸如减小至少10%,例如至少20%、至少40%、至少50%、至少80%、至少90%、至少95%、至少98%或更多。
[0101]
在一个实例中,向患有肿瘤的受试者施用一种或多种抗体-ir700分子并施用一种或多种免疫调节剂,联合照射,降低treg(诸如foxp3
+
cd25
+
cd4
+
treg细胞)。例如,相对于未进行施用一种或多种抗体-ir700分子和施用一种或多种免疫调节剂联合照射,在一些实例中所公开的方法使循环treg的数量降低至少10%,例如至少20%、至少40%、至少50%、至少80%、至少90%、至少95%、至少98%或更多。在一些实例中,相对于未进行施用一种或多种抗体-ir700分子和施用一种或多种免疫调节剂联合照射,所公开的方法使肿瘤中的treg数量降低至少10%,例如至少20%、至少40%、至少50%、至少80%、至少90%、至少95%、至少98%或更多。
[0102]
在一个实例中,向患有肿瘤的受试者施用一种或多种抗体-ir700分子并施用一种或多种免疫调节剂,联合照射,可增加记忆t细胞。例如,相对于未进行施用一种或多种抗体-ir700分子和施用一种或多种免疫调节剂联合照射,在一些实例中所公开的方法使循环记忆t细胞的数量增加至少10%,例如至少20%、至少40%、至少50%、至少80%、至少90%、至少95%、至少98%、至少100%、至少200%、至少300%、至少400%、至少500%或更多。
[0103]
在一些实例中,所公开的方法减轻与肿瘤、复发和/或转移肿瘤相关的一种或多种症状。在一个实例中,相对于未进行施用一种或多种抗体-ir700分子和施用一种或多种免疫调节剂联合照射,所公开的方法减慢肿瘤生长,诸如至少10%,例如至少20%、至少40%、至少50%、至少80%、至少90%或更多。在一个实例中,相对于未进行施用一种或多种抗体-ir700分子和施用一种或多种免疫调节剂联合照射,所公开的方法降低或消除肿瘤复发,诸如降低至少10%,例如至少20%、至少40%、至少50%、至少80%、至少90%、至少95%、至少98%、至少99%或甚至100%。
[0104]
在一些实例中,相对于未进行施用一种或多种抗体-ir700分子和施用一种或多种免疫调节剂联合照射,所公开的方法可以延长受试者(诸如患有肿瘤或先前已切除肿瘤的受试者)的生存时间,诸如延长至少20%、至少40%、至少50%、至少80%、至少90%或更多。例如,在一些实例中,相对于未进行施用一种或多种抗体-ir700分子和施用一种或多种免
疫调节剂联合照射的平均生存时间,所公开的方法使受试者的总体生存时间和/或无进展生存时间(例如,没有原发肿瘤的复发或没有转移)延长至少1个月、至少2个月、至少3个月、至少6个月、至少12个月、至少18个月、至少24个月、至少36个月、至少48个月、至少60个月或更长时间。
[0105]
在一个实例中,施用含抗体-ir700分子的组合物和施用一种或多种免疫调节剂(并行或序贯)联合原发性肿瘤的nir照射,可以减少远距离未照射肿瘤或肿瘤转移的大小和/或数量(诸如远距离肿瘤或转移的体积、远距离肿瘤或转移的重量、远距离肿瘤或转移的数量或其组合),与在未使用抗体-ir700分子、免疫调节剂和原发肿瘤的nir照射的情况下的远距离肿瘤或转移的体积/重量/数量相比,例如减少至少20%、至少50%、至少80%、至少90%、至少95%、至少98%或甚至至少100%。
[0106]
在一个实例中,所公开的方法增加了受试者中对mhc i型限制性肿瘤特异性抗原的多克隆抗原特异性tic应答的量,与未使用抗体-ir700分子、免疫调节剂和照射的情况下对mhc i型限制性肿瘤特异性抗原的特异性tic应答的量相比,例如增加至少20%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少100%,至少200%或至少500%。
[0107]
在一个实例中,使用所公开的方法实现了这些效果的组合。
[0108]
所公开的方法可用于治疗体内的固定肿瘤以及血液恶性肿瘤和/或循环中的肿瘤(例如,白血病细胞、转移瘤和/或循环中的肿瘤细胞)。然而,在其性质方面,循环细胞不能长时间暴露在光下。因此,如果待杀伤的细胞是遍及全身的细胞,则该方法可以通过使用可穿戴的或覆盖身体的一部分的装置来完成。例如,这种装置可以长时间穿戴。可以使用日常可穿戴物品(诸如手表、珠宝(诸如项链或手镯)、毯子、衣服(例如,内衣、袜子和鞋子内嵌物)以及其他日常可穿戴物品)中装有发射nir的发光二极管(led)和电池组。这种装置长时间在装置下方的皮肤上产生光,从而导致光长时间连续暴露于浅表血管。循环中的肿瘤细胞穿过装置下方的区域时,它们将暴露在光下。例如,此装置的手表或手镯版本可以包括一系列nir led,这些led具有电池电源组,可在一天中的大部分时间佩戴。在施用一种或多种抗体-ir700分子(例如,静脉内)后,循环细胞结合抗体-ir700偶联物并变得易于被pit杀伤。当这些细胞在日常可穿戴物品(例如手镯或手表)中与led相邻的血管内流动时,它们将暴露于nir光下使其易于被细胞杀伤。光的剂量可以根据诊断和细胞类型进行调节。
[0109]
在一些实例中,该方法进一步包括监测治疗,诸如杀伤肿瘤细胞。在这种实例中,如本文所述向受试者施用抗体-ir700偶联物和免疫调节剂,联合照射。但是,可以使用较低剂量的抗体-ir700偶联物和nir光进行监测(因为可能不需要杀伤细胞,只需监测治疗即可)。在一个实例中,为监测而施用的抗体-ir700偶联物的量比治疗剂量低至少2倍(诸如至少3、4、5、6、7、8、9或10倍)。在一个实例中,为监测而施用的抗体-ir700偶联物的量比治疗剂量低至少20%或至少25%。在一个实例中,用于监测的nir光的量为治疗剂量的至少1/1000或至少1/10,000。这允许检测治疗的细胞。例如,通过使用这种方法,可以监测肿瘤和转移的大小。
[0110]
在一些实例中,该方法在外科手术(诸如内窥镜手术)期间是有用的。例如,在向受试者如上所述施用抗体-ir700偶联物和免疫调节剂联合照射细胞后,这不仅导致杀伤细胞,而且还允许外科医生或其他医疗服务提供者可视化肿瘤的边缘,并帮助确保切除肿瘤
(诸如皮肤、乳腺、肺、结肠、头颈或前列腺的肿瘤)是完整的,并且切缘清晰。在一些实例中,较低剂量的抗体-ir700偶联物可用于可视化,诸如比治疗剂量低至少2倍(诸如至少3、4、5、6、7、8、9或10倍)。
[0111]
抗体-ir700分子和免疫调节剂可以局部或全身性施用,例如施用于患有肿瘤(例如癌症)或先前已去除肿瘤(例如通过手术)的受试者。尽管提供了特定实例,但是本领域技术人员将理解,可以使用公开的抗体-ir700分子和免疫调节剂的替代施用方法。这种方法可以包括例如使用导管或可植入的泵在需要治疗的受试者中持续数小时至数天的时间持续输注。
[0112]
在一个实例中,抗体-ir700分子和/或免疫调节剂通过肠胃外方式施用,包括直接注射或输注到肿瘤中(瘤内)。在一些实例中,通过将抗体-ir700分子和/或免疫调节剂应用于肿瘤(例如通过局部注射抗体-ir700分子和/或免疫调节剂),将肿瘤浸于在含抗体-ir700分子和/或免疫调节剂的溶液中,或者通过将抗体-ir700分子和/或免疫调节剂倒在肿瘤上,将抗体-ir700分子和/或免疫调节剂施用于肿瘤。
[0113]
另外地或可选地,所公开的组合物可以全身性地,例如静脉内、肌内、皮下、皮内、腹腔、皮下或口服施用于患有肿瘤(诸如癌症)的受试者。可以通过相同或不同的途径来施用一种或多种抗体-ir700分子和一种或多种免疫调节剂。在一个实例中,抗体-ir700分子可经肿瘤内施用而免疫调节剂可全身性递送(例如,静脉内或腹腔)。在另一个实例中,抗体-ir700分子和免疫调节剂均是全身性施用(例如,静脉内或腹膜内)。在一个实例中,抗体-ir700分子是静脉内施用,而免疫调节剂是腹腔施用。在一个实例中,抗体-ir700分子和免疫调节剂均是静脉内施用。
[0114]
待向受试者施用的抗体-ir700分子和免疫调节剂的剂量不受绝对限制,但将取决于组合物的性质、其活性成分及其潜在的有害副作用(例如,对抗体的免疫应答)、待治疗的受试者和待治疗的病症类型以及施用方式。通常,剂量将是治疗有效量,诸如足以实现所希望的生物学效应的量,例如有效减小肿瘤的大小(例如,体积和/或重量)或减弱肿瘤的进一步生长或减轻肿瘤的不良症状的量。
[0115]
对于静脉注射抗体-ir700分子(包括肿瘤特异性抗体-ir700分子和免疫调节剂抗体-ir700分子),对受试者进行单次治疗的示例性剂量范围为0.5至100mg/60kg体重、1至100mg/60kg体重、1至50mg/60kg体重、1至20mg/60kg体重,例如约1或2mg/60kg体重。在又一个实例中,腹腔或肿瘤内施用的抗体-ir700分子的治疗有效量为每1kg体重10μg至5000μg的抗体-ir700分子,诸如10μg/kg至1000μg/kg、10μg/kg至500μg/kg、或100μg/kg至1000μg/kg。在一个实例中,向人患者施用的抗体-ir700分子的剂量为至少50mg,诸如至少100mg、至少300mg、至少500mg、至少750mg或甚至1g。还可以使用不与ir700偶联的类似量的抗体(诸如免疫调节剂抗体,诸如pd-1或pd-l1特异性抗体)。
[0116]
使用公开的抗体-ir700分子和免疫调节剂进行的治疗可以在一天内完成,也可以使用相同或不同剂量在多天内重复进行。重复治疗可以在同一天进行,在连续几天或每1-3天、每3-7天、每1-2周、每2-4周、每1-2个月或甚至更长时间间隔进行。在一些实例中,抗体-ir700分子和免疫调节剂在同一天施用。在其他实例中,抗体-ir700分子和免疫调节剂在不同天施用。在一个非限制性实例中,一种或多种抗体-ir700分子和一种或多种免疫调节剂在同一天施用于受试者,并且一种或多种免疫调节剂(以相同或不同的剂量水平)在连续几
天,或每1-3天、每3-7天、每1-2周、每2-4周一次每1-2个月或更长时间间隔重复施用于受试者(例如,1、2、3、4、5或更多次免疫调节剂额外给药)。在一些实例中,与初始剂量相比,免疫调节剂的重复剂量的量减少(例如,在某些情况下减少50%)。
[0117]
在另外的实施方式中,该方法还包括向受试者施用一种或多种另外的治疗剂。如国际专利申请公开号wo 2013/009475(通过引用整体结合入本文)中所述,照射(例如在660至710nm波长下以至少10j/cm2、至少20j/cm2、至少30j/cm2、至少40j/cm2、至少50j/cm2、至少70j/cm2、至少80j/cm2或至少100j/cm2,诸如至少10至100j/cm2的剂量)后存在约8小时的时间窗,在此期间通过pit处理的细胞吸收另外试剂(例如,纳米尺寸的药物,诸如直径至少约1nm、直径至少约10nm、直径至少约100nm、或者直径至少约200nm,诸如直径1至500nm的药物)增强。因此,可以将一种或多种另外的治疗剂与pit同时或序贯施用于受试者。在一个实例中,在照射细胞后,例如约0至8小时(诸如在照射后至少10分钟、至少30分钟、至少60分钟、至少2小时、至少3小时、至少4小时、至少5小时、至少6小时或至少7小时,例如不超过10小时、不超过9小时或不超过8小时,诸如1小时至10小时、1小时至9小时、1小时至8小时、2小时至8小时或4小时至8小时)施用另外的治疗剂。在另一个实例中,在照射之前(例如,照射之前约10分钟至120分钟,诸如在照射之前10分钟至60分钟或10分钟至30分钟)施用另外的治疗剂。下文讨论了可以使用的另外的治疗剂。
[0118]
在另外的实施方式中,提供了允许实时检测或监测细胞杀伤的方法。这种方法例如用于确保将足够量的抗体-ir700分子和/或免疫调节剂或足够量的照射递送至细胞或肿瘤以促进细胞杀伤。这些方法允许在形态变化变得明显之前检测细胞杀伤。在一个实例中,该方法包括将具有细胞表面蛋白的细胞与治疗有效量的一种或多种抗体-ir700分子和一种或多种免疫调节剂接触,其中抗体与细胞表面蛋白特异性结合(例如,向受试者施用抗体-ir700分子和免疫调节剂);在660至740nm波长下并以至少20j/cm2的剂量照射细胞;并在照射细胞后约0至48小时(诸如照射细胞后至少1小时、至少2小时、至少4小时、至少6小时、至少12小时、至少18小时、至少24小时、至少36小时、至少48小时或至少72小时,例如1分钟至30分钟、10分钟至30分钟、10分钟至1小时、1小时至8小时、6小时至24小时或6小时至48小时)对细胞进行检测,从而实时检测细胞杀伤情况。缩短flt可作为pit引起的急性膜损伤的指标。因此,在足以使ir700 flt缩短至少25%,诸如至少40%、至少50%、至少60%或至少75%的条件下照射细胞。在一个实例中,在660nm至740nm波长(诸如680nm至700nm)下并以至少20j/cm2或至少30j/cm2,诸如至少40j j/cm2或至少50j/cm2或至少60j/cm2,诸如30至50j/cm2的剂量照射细胞。
[0119]
在一些实例中,实时检测细胞杀伤的方法包括将细胞与一种或多种另外的治疗剂接触,例如在照射细胞后约0至8小时。实时成像可以在细胞与一种或多种另外的治疗剂接触之前或之后发生。例如,如果通过实时成像确定在施用一种或多种抗体-ir700分子和一种或多种免疫调节剂后发生的细胞杀伤作用不足,则可以将细胞与一种或多种其他治疗剂接触。然而,在一些实例中,在实时检测细胞杀伤之前,将细胞与抗体-ir700分子和免疫调节剂以及其他治疗剂接触。
[0120]
示例性细胞
[0121]
靶细胞可以是非目标细胞或其生长是非目标的细胞,诸如癌细胞(例如,肿瘤细胞)。该细胞可以存在于待治疗的哺乳动物中,诸如癌症受试者(例如,人或兽医受试者)。任
何靶细胞均可以用要求保护的方法处理。在一个实例中,靶细胞表达在其他正常(目标)细胞的表面上基本上找不到的细胞表面蛋白,可以选择与该蛋白特异性结合的抗体,以及对该蛋白产生的抗体-ir700分子。在一个实例中,细胞表面蛋白是肿瘤特异性蛋白(例如,抗原)。在一个非限制性实例中,细胞表面蛋白是cd44。
[0122]
在一个实例中,肿瘤细胞是癌细胞,诸如癌症患者中的细胞。可以用所公开的方法杀伤的示例性细胞包括以下肿瘤的细胞:血液系统恶性肿瘤(诸如白血病,包括急性白血病(诸如急性淋巴细胞白血病,急性粒细胞白血病,以及粒细胞、早幼粒细胞、粒细胞性、单核细胞和红血球白血病),慢性白血病(诸如慢性髓细胞(粒细胞)白血病和慢性淋巴细胞白血病)、真性红细胞增多、淋巴瘤、霍奇金病、非霍奇金淋巴瘤、多发性骨髓瘤、waldenstrdm巨球蛋白血症)。在另一个实例中,细胞是实体瘤细胞,诸如来自以下的细胞:肉瘤和癌、纤维肉瘤、粘肉瘤、脂肪肉瘤、软骨肉瘤、成骨肉瘤和其他肉瘤、滑膜瘤、间皮瘤、ewing肿瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、肝细胞癌、肺癌、结肠直肠癌、鳞状细胞癌、头颈癌(诸如头颈鳞状细胞癌)、基底细胞癌、腺癌(例如胰腺、结肠、卵巢、肺、乳腺、胃、前列腺、子宫颈或食道的腺癌)、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、wilms肿瘤、宫颈癌、睾丸肿瘤、膀胱癌和cns癌症(诸如神经胶质瘤、星形细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、血管瘤、黑色素瘤、神经母细胞瘤和视网膜母细胞瘤)。
[0123]
在特定实例中,该细胞是肺癌细胞。
[0124]
在特定实例中,该细胞是乳腺癌细胞。
[0125]
在特定实例中,该细胞是结肠癌细胞。
[0126]
在特定实例中,该细胞是头颈癌细胞。
[0127]
在特定实例中,该细胞是前列腺癌细胞。
[0128]
示例性受试者
[0129]
在一些实例中,所公开的方法用于治疗患有癌症的受试者或患有肿瘤的受试者,诸如本文所述的肿瘤。在一些实例中,肿瘤既往已接受治疗,例如通过外科手术或化学方法去除,并且所公开的方法随后用于杀伤可能残留在患者体内的任何剩余的非目标肿瘤细胞和/或减少肿瘤的复发或转移。
[0130]
所公开的方法可以用于治疗患有肿瘤(诸如癌症)或既往已切除或接受治疗的任何哺乳动物受试者(诸如人或兽医受试者,诸如犬或猫),诸如人。需要使用公开疗法的受试者可以包括患有癌症的人受试者,其中癌细胞在其表面上表达可以与抗体-ir700分子特异性结合的肿瘤特异性蛋白。例如,所公开的方法可以单独用作癌症的初始治疗,或与放疗或其他化疗联合。所公开的方法还可以用于既往放疗或化疗失败的患者。因此,在一些实例中,受试者是已接受其他疗法的受试者,但是那些其他疗法未提供所希望的治疗应答。所公开的方法还可以用于患有局部和/或转移性癌症和/或原发性肿瘤复发的患者。
[0131]
在一些实例中,该方法包括选择将从公开的疗法中受益的受试者,诸如选择具有表达可以特异性结合抗体-ir700分子的细胞表面蛋白(诸如肿瘤特异性蛋白)的肿瘤的受试者。例如,如果确定该受试者患有表达her2的乳腺癌,则可以选择该受试者以抗her2-ir700分子(诸如曲妥珠单抗-ir700)和一种或多种免疫调节剂治疗,并且该受试者随后如
本文所述进行照射。
[0132]
示例性细胞表面蛋白
[0133]
在一个实例中,待杀伤的靶细胞的细胞表面上的蛋白在其他细胞上没有大量存在。例如,细胞表面蛋白可以是仅在靶细胞类型上发现的受体。
[0134]
在特定实例中,细胞表面蛋白是癌症或肿瘤特异性蛋白(在本领域中也称为肿瘤特异性抗原或肿瘤相关抗原),诸如egf受体家族的成员(例如,her1、2、3和4)和细胞因子受体(例如,cd20、cd25、il-13r、cd5、cd52等)。因此,在一些实例中,细胞表面蛋白是在肿瘤细胞的细胞膜上表达的抗原。肿瘤特异性蛋白是癌细胞特有的蛋白,或者与其他细胞(诸如正常细胞)相比,该蛋白更为丰富。例如,her2主要在乳腺癌中发现,而her1主要在腺癌中发现,其可以在许多器官中发现,诸如胰腺、乳腺癌、前列腺癌和结肠癌。
[0135]
可以在靶细胞上发现的示例性肿瘤特异性蛋白(可以使用对该蛋白具有特异性的抗体来配制抗体-ir700分子)包括但不限于:多种mage(黑素瘤-相关抗原e),包括mage1(例如,genbank登录号m77481和aaa03229)、mage 2(例如,genbank登录号l18920和aaa17729)、mage 3(例如,genbank登录号u03735和aaa17446),mage 4(例如,genbank登录号d32075和a06841.1)等;多种酪氨酸酶中的任何一种(例如,genbank登录号u01873和aab60319);突变ras;突变体p53(例如,genbank登录号x54156、caa38095和aa494311);p97黑色素瘤抗原(例如,genbank登录号m12154和aaa59992);与乳腺肿瘤有关的人乳脂肪球(hmfg)(例如,genbank登录号s56151和aab19771);多种bage(人b黑色素瘤相关抗原e)中的任何一种,包括bage1(例如,genbank登录号q13072)和bage2(例如,genbank登录号nm_182482和np_872288);多种gage(g抗原)中的任何一种,包括gage1(例如,genbank登录号q13065)或gage2-6中的任何一种;多种神经节苷脂cd25(例如,genbank登录号np_000408.1和nm_000417.2)。
[0136]
其他肿瘤特异性抗原包括与宫颈癌相关的hpv 16/18和e6/e7抗原(例如,genbank登录号nc_001526、fj952142.1、adb94605、adb94606和u89349)、乳腺癌相关的粘蛋白(muc 1)-klh抗原(例如,genbank登录号j03651和aaa35756)、结肠直肠癌相关的cea(癌胚抗原)(例如,genbank登录号x98311和caa66955)、与例如黑色素瘤相关的gp100(例如,genbank登录号s73003和aac60634)、黑色素瘤相关的mart1抗原(例如,genbank登录号np_005502)、卵巢癌和其他癌症相关的癌症抗原125(ca125,也称为粘蛋白16或muc16)(例如,genbank登录号nm_024690和np_078966);肝癌相关的甲胎蛋白(afp)(例如,genbank登录号nm_001134和np_001125);与结肠直肠癌、胆道癌、乳腺癌、小细胞肺癌和其他癌症相关的lewis y抗原;腺癌肿瘤相关的糖蛋白72(tag72);以及前列腺癌相关的psa抗原(例如,genbank登录号x14810和caa32915)。
[0137]
其他示例性肿瘤特异性蛋白包括但不限于与实体瘤新脉管系统以及前列腺癌相关的pmsa(前列腺膜特异性抗原;例如,genbank登录号aaa60209和aab81971.1);与乳腺癌、卵巢癌、胃癌和子宫癌相关的her-2(人类表皮生长因子受体2,例如,genbank登录号m16789.1、m16790.1、m16791.1、m16792.1和aaa58637),与肺癌、肛门癌和胶质母细胞瘤以及腺癌相关的her-1(例如,genbank登录号nm_005228和np_005219);与黑色素瘤、肉瘤、睾丸癌和其他癌症相关的ny-eso-1(例如,genbank登录号u87459和aab49693),htert(又名端粒酶)(例如,genbank登录号nm_198253和np_937983(变体1),nm_198255和np_937986(变体
2));蛋白酶3(例如,genbank登录号m29142、m75154、m96839、x55668、nm 00277、m96628、x56606、caa39943和aaa36342)和wilms肿瘤1(wt-1,例如,genbank登录号nm_000378和np_000369(变体a),nm_024424和np_077742(变体b),nm_024425和np_077743(变体c)以及nm_024426和np_077744(变体d))。
[0138]
在一个实例中,肿瘤特异性蛋白是慢性淋巴细胞白血病相关的cd52(例如,genbank登录号aah27495.1和cai15846.1);急性骨髓性白血病相关的cd33(例如,genbank登录号nm_023068和cad36509.1);和非霍奇金淋巴瘤相关的cd20(例如,genbank登记号np_068769np_031667)。
[0139]
在特定实例中,肿瘤特异性蛋白是cd44(例如,omim 107269,genbank登录号aci46596.1和np_000601.3)。cd44是癌症干细胞的标志物,与细胞间粘附、细胞迁移、细胞空间方向和基质衍生的存活信号的促进有关。cd44在肿瘤的质膜上的高表达可能与肿瘤的侵袭性和不良的预后有关。
[0140]
因此,所公开的方法可以用于治疗任何表达肿瘤特异性蛋白的癌症。
[0141]
示例性抗体-ir700分子
[0142]
因为细胞表面蛋白序列是公众可获得的(例如,如上所述),所以可以完成对这些蛋白特异的抗体的生产或购买(或可以与ir700偶联的其他小分子)。例如,如果选择肿瘤特异性蛋白her2作为靶标,则可以购买或生成对her2特异的抗体(诸如曲妥珠单抗)并将其附着到ir700染料上。表1中提供了其他具体实例。在一个实例中,抗体是人源化单克隆抗体。可以使用诸如wo 2013/009475中描述的方法(通过引用整体结合入本文)生成抗体-ir700分子。
[0143]
表1.示例性肿瘤特异性抗原和抗体
[0144]
[0145]
[0146]
[0147]
[0148][0149]
可以与ir700偶联的其他抗体包括3f8、阿巴伏单抗(abagovomab)、阿夫土珠单抗(afutuzumab)、培化阿珠单抗(alacizumab)、喷替酸阿妥莫单抗(altumomab pentetate)、马安那莫单抗(anatumomab mafenatox)、阿泊珠单抗(apolizumab)、贝妥莫单抗(bectumomab)、贝利尤单抗、贝索单抗(besilesomab)、卡罗单抗喷地肽(capromab pendetide)、卡妥索单抗(catumaxomab)、泊西他珠单抗(citatuzumab bogatox)、地莫单抗(detumomab)、依美昔单抗(ecromeximab)、依库珠单抗、依决洛单抗(edrecolomab)、依帕珠单抗(epratuzumab)、厄马索单抗(ertumaxomab)、加利昔单抗(galiximab)、吉瑞昔单抗、伊戈伏单抗、英西单抗、鲁昔单抗(lumiliximab)、美泊利单抗(mepolizumab)、迈他珠单抗、米妥莫单抗(mitumomab)、莫罗木单抗(morolimumab)、他那可单抗(nacolomab tafenatox)、naptumomab estafenatox、巯诺莫单抗(nofetumomab merpentan)、品妥莫单抗(pintumomab)、沙妥莫单抗喷地肽(satumomab pendetide)、索普昔单抗(sonepcizumab)、taplitumomab paptox、替妥莫单抗(tenatumomab)、tgn1412、替西木单抗(ticilimumab,曲美目单抗(tremelimumab))、tnx-650或曲美目单抗。
[0150]
在一个实例中,使用至少两种对癌细胞表面抗原具有特异性的不同抗体-ir700分子治疗患者。在一个实例中,两种不同的抗体-ir700分子对同一蛋白(诸如her-2)具有特异性,但是对蛋白的不同表位(诸如her-2的表位1和表位2)具有特异性。在另一个实例中,两种不同的抗体-ir700分子对两种不同的蛋白或抗原具有特异性。例如,可以将抗her1-ir700和抗her2-ir700作为混合物一起注射,以促进杀伤带有her1或her2的细胞。
[0151]
在一个特定实例中,抗体-ir700分子是抗cd44-ir700,诸如rg7356-ir700或比伐妥珠单抗-ir700(bivatuzumab-ir700)。rg7356是igg1-kappa同种型的重组人抗体,可特异性结合cd44标准品以及所有cd44剪接变体上存在的人细胞表面糖蛋白cd44胞外域的恒定区。比伐妥珠单抗是一种对cd44 v6的人源化单克隆抗体。
[0152]
免疫调节剂
[0153]
在所公开的方法中使用的免疫调节剂包括激活免疫系统和/或抑制免疫抑制细胞(在本文中也称为抑制细胞)的试剂或组合物。不受理论的束缚,并且如图18所示,免疫抑制剂细胞的抑制和/或免疫应答的激活增加了肿瘤细胞的杀伤力,并且还导致记忆t细胞的产生,这可以提供对复发和/或远距离肿瘤或转移的“疫苗”作用。
[0154]
在一些实施方式中,免疫调节剂是免疫抑制剂细胞的抑制剂,例如,抑制或降低免疫抑制剂细胞活性的试剂。在某些情况下,免疫调节剂会杀伤免疫抑制细胞。在一些实例中,免疫抑制剂细胞是调节性t(treg)细胞。在一些实例中,并非所有抑制细胞都在体内被杀伤,因为这样可能导致自身免疫的发展。因此,在一些实例中,该方法使受试者区域(例如,肿瘤区域或曾经患有肿瘤的区域)中的免疫抑制细胞的活性或数量降低至少50%、至少60%、至少75%、至少80%、至少90%或至少95%。在一些实例中,该方法使受试者中抑制细胞的总数减少了至少50%、至少60%、至少75%、至少80%、至少90%或至少95%。
[0155]
免疫抑制细胞的抑制剂包括酪氨酸激酶抑制剂(诸如索拉非尼、舒尼替尼和伊马替尼)、化学治疗剂(诸如环磷酰胺或白介素-毒素融合体,例如denileukin difitox(il2-白喉毒素融合体)或抗cd25抗体(例如达利珠单抗或巴利昔单抗)或其他与抑制细胞表面蛋白结合的抗体(例如下文所述)。在其他实例中,免疫抑制细胞的抑制剂包括免疫检查点抑制剂,例如抗pd-1或抗-pd-l1拮抗抗体,从而防止pd-l1与pd-1结合(在本文中称为pd-1/pd-l1 mab介导的免疫检查点封锁(icb))。因此,在一些实例中,免疫调节剂是pd-1或pd-l1拮抗抗体,诸如纳武利尤单抗、帕博利珠单抗、阿替利珠单抗、阿维鲁单抗、度伐利尤单抗、mpdl3280a、pidilizumab、ct011、amp-224、amp-514、medi-0680、bms-936559、bms935559、medi-4736、mpdl-3280a、mga-271、indoximod、艾卡哚司他(epacadostat)、bms-986016、medi-4736、medi-4737、mk-4166、bms-663513、pf-05082566(pf-2566)、lirilumab和msb-0010718c。检查点抑制剂还包括抗ctla-4抗体,包括伊匹单抗(ipilimumab)和tremelimumab。免疫抑制细胞的抑制剂还可以是lag-3或b7-h3拮抗剂,诸如bms-986016和mga271。在一些实例中,可以向受试者使用两种或更多种免疫抑制细胞抑制剂。在一个非限制性实例中,向受试者施用抗pd1和抗lag-3抗体。
[0156]
在一些实例中,抑制或降低抑制细胞活性的试剂包括一种或多种抗体-ir700分子,其中抗体特异性结合抑制细胞表面蛋白(诸如cd25、cd4、cxc趋化因子受体4型(cxcr4)、c-c趋化因子受体4型(ccr4)、细胞毒性t淋巴细胞相关蛋白4(ctla4)、糖皮质激素诱导的tnf受体(gitr)、ox40、叶酸受体4(fr4)、cd16、cd56、cd8、cd122、cd23、cd163、cd206、cd11b、gr-1、cd14、白介素4受体α链(il-4ra)、白介素1受体α(il-1ra)、白介素1诱饵受体、cd103、成纤维细胞激活蛋白(fap)、cxcr2、cd33和cd66b),并且在一些实例中不包括功能性fc区(例如,由一个或多个f(ab
’
)2片段组成)。功能性fc部分的存在可导致自身免疫毒性(诸如抗体依赖性细胞介导的细胞毒性(adcc))。adcc的结果是,可能杀伤过多的抑制细胞,而不仅仅是杀伤那些暴露在nir光下的抑制细胞。因此,抗体的fc部分可以被突变或去除以显著降低其功能(与非突变的fc区相比,诸如与fcγ受体结合的能力,fc功能降低至少50%、至少75%、至少80%、至少90%、至少95%、至少99%或100%)。降低或杀伤抑制细胞的活性的方法和组合物描述于国际专利公开号wo 2017/027247(通过引用整体结合入本文)。
[0157]
在非限制性实例中,免疫调节剂是cd25抗体-ir700分子,诸如达利珠单抗-ir700或巴利昔单抗-ir700。
[0158]
在其他实施方式中,免疫调节剂是免疫系统激活剂。在一些实例中,免疫系统激活剂刺激(激活)一种或多种t细胞和/或自然杀伤(nk)细胞。在一个实例中,免疫系统激活剂包括一种或多种白介素(il),诸如il-2、il-15、il-7、il-12和/或il-21。在非限制性实例中,免疫调节剂包括il-2和il-15。在另一个实例中,免疫系统激活剂包括一种或多种对共
刺激受体的激动剂,诸如4-1bb、ox40或gitr。在非限制性实例中,免疫调节剂包括刺激性抗4-1bb、抗ox40和/或抗gitr抗体。
[0159]
在一些实例中,向受试者施用一次或多次(诸如1、2、3、4、5或更多次)免疫调节剂。因此,免疫调节剂的施用可以在一天之内完成,或者可以以相同或不同的剂量在多天内重复进行(诸如以至少2次不同时间、3次不同时间、4次不同时间、5次不同时间或10次不同时间施用)。在一些实例中,重复施用是相同剂量。在其他实例中,重复施用的剂量不同(诸如高于先前剂量的后续剂量或低于先前剂量的后续剂量)。可以在同一天、连续几天、隔日、每1-3天、每3-7天、每1-2周、每2-4周、每1-2个月重复或甚至间隔更长时间施用免疫调节剂。在一些实例中,在照射之前施用至少一次免疫调节剂,并且在照射之后施用至少一次免疫调节剂。
[0160]
照射
[0161]
在向受试者施用一种或多种抗体-ir700分子之后,以及在向受试者施用一种或多种免疫调节剂之后(或任选地之前),照射受试者(或受试者体内的肿瘤)。由于只有表达细胞表面蛋白的细胞才能被抗体识别,因此只有那些细胞具有与其结合的足够量的抗体-ir700分子才能杀伤细胞。由于照射仅杀伤与抗体-ir700分子结合的细胞,而不是其他细胞,因此降低了诸如杀伤正常细胞等不良副作用的可能性。
[0162]
使用治疗剂量的照射在660-710nm(诸如660-700nm、680-7000nm、670-690nm,例如680nm)波长下照射受试者(例如,受试者体内的肿瘤)。在具体实例中,以至少1j/cm2,例如至少10j/cm2、至少30j/cm2、至少50j/cm2、至少100j/cm2或至少500j/cm2,例如1-1000j/cm2、1-500j/cm2、30-50j/cm2、10-100j/cm2或10-50j/cm2的剂量照射细胞。
[0163]
受试者可以被照射一次或多次。因此,照射可以在一天内完成,也可以以相同或不同的剂量在多天内重复进行(诸如照射至少2次、3次、4次、5次或10次)。在一些实例中,重复照射是相同剂量。在其他实例中,重复照射的剂量不同(例如,高于先前剂量的后续剂量或低于先前剂量的后续剂量)。可以在同一天、连续几天、隔日、每1-3天、每3-7天、每1-2周、每2-4周、每1-2个月或在甚至更长的时间间隔进行重复照射。在一个实例中,第一次照射为50j/cm2,第二次照射为100j/cm2,其中照射在连续数天内进行(例如,相隔约24小时)。
[0164]
在一些实例中,通过装有nir led的可穿戴装置提供照射。在其他实例中,可以与所公开的方法一起使用的另一种类型的装置是具有nir led的类闪光灯的装置。这种装置可用于外科手术过程中病灶的局部治疗,或在施用一种或多种pit剂后并入内窥镜以将nir光施加到体表。医师或合格的卫生人员可以使用此类装置将治疗定向到身体上的特定靶标。
[0165]
使用可穿戴nir led进行治疗
[0166]
如本文所述,所公开的方法对癌细胞具有高特异性。但是,为了杀伤体内循环或存在于皮肤上的细胞,患者可以佩戴装有nir led的装置。在一些实例中,患者使用至少两种装置,例如白天使用的衣服或珠宝,以及夜间使用的毯子。在某些实例中,患者同时使用至少两个设备,例如两件衣服。这些装置可以使用便携式的日常衣服和珠宝将患者暴露在nir光下,从而使治疗保持私密性,并且不会干扰日常活动。在一些实例中,该装置可以在白天谨慎穿戴以进行pit治疗。装有nir led的示例性装置在国际专利申请公开号wo 2013/009475(通过引用结合入本文)中公开。
[0167]
在一个实例中,使用本文所述的方法向患者施用一种或多种抗体-ir700分子和一种或多种免疫调节剂。然后,患者穿戴装有nir led的装置,从而实现长期治疗和治疗血液或淋巴液或皮肤上存在的肿瘤细胞。在一些实例中,剂量为至少1j/cm2、至少10j/cm2、至少20j/cm2、至少30j/cm2、至少40j/cm2或至少50j/cm2,诸如20j/cm2或30j/cm2。在一些实例中,抗体-ir700分子的施用在一段时间(诸如每两周或每月)中重复,以确保体内的治疗水平。
[0168]
在一些实例中,患者穿戴或使用该装置或装置的组合至少1周,诸如至少2周、至少4周、至少8周、至少12周、至少4个月、至少6个月或甚至至少1年。在一些实例中,患者每天至少使用4个小时,诸如每天至少12个小时、每天至少16个小时、每天至少18个小时或每天24个小时穿戴或使用该装置或装置的组合。在治疗期间,同一位患者很可能穿戴多个具有类似“日常”性质的装置(毛毯、手镯、项链、内衣、袜子、鞋垫)。晚上,患者可以使用nir led毯子或其他覆盖物。
[0169]
其他疗法的施用
[0170]
如上所述,在施用一种或多种抗体-ir700分子、免疫调节剂和/或照射之前、期间或之后,受试者可以接受一种或多种其他疗法。在一个实例中,受试者在施用抗体-ir700分子之前接受一种或多种治疗以切除或减少肿瘤。在其他实例中,可以例如在照射之后,例如在照射细胞后约0至8小时(诸如在照射后至少10分钟、至少30分钟、至少60分钟、至少2小时、至少3小时、至少4小时、至少5小时、至少6小时或至少7小时,例如在照射后不超过10小时、不超过9小时或不超过8小时,诸如1小时至10小时、1小时至9小时、1小时至8小时、2小时至8小时或4小时至8小时),向待治疗的受试者施用另外的治疗或治疗剂(诸如抗肿瘤剂)。在另一个实例中,在照射之前(诸如照射之前约10分钟至120分钟,诸如在照射之前10分钟至60分钟或10分钟至30分钟)施用另外的治疗剂。
[0171]
可以与公开的方法联合使用,可在pit后约8小时内增强肿瘤对其他治疗剂的可及性的此类疗法的实例包括但不限于用于切除或减少肿瘤的外科治疗(诸如手术切除、冷冻疗法或化学栓塞),以及抗肿瘤药物治疗,其中可能包括放疗剂、抗肿瘤化疗剂、抗生素、烷化剂和抗氧化剂、激酶抑制剂和其他试剂。在一些实例中,另外的治疗剂与纳米颗粒偶联。可以使用的其他治疗剂的具体实例包括微管结合剂、dna嵌入剂或交联剂、dna合成抑制剂、dna和/或rna转录抑制剂、抗体、酶、酶抑制剂和基因调节剂。这些试剂(以治疗有效量施用)和治疗可以单独使用或联合使用。此类试剂的使用方法和治疗剂量是本领域技术人员已知的,并且可以由熟练的临床医生确定。
[0172]“微管结合剂”是指与微管蛋白相互作用以使微管形成稳定或不稳定,从而抑制细胞分裂的试剂。可以与所公开的方法联合使用的微管结合剂的实例包括但不限于紫杉醇、多西他赛、长春碱、长春地辛、长春瑞滨(诺维本)、埃博霉素、秋水仙碱、多拉司他汀15(dolastatin 15)、诺考达唑(nocodazole)、鬼臼毒素和根瘤菌素。还可以使用此类化合物的类似物和衍生物。例如,合适的埃坡霉素和埃坡霉素类似物在国际公开号wo 2004/018478中描述。可以使用紫杉烷类,例如紫杉醇和多西紫杉醇,以及美国专利号6,610,860;5,530,020;和5,912,264所教导的紫杉醇的类似物。
[0173]
以下类型的化合物可与本文公开的方法联合使用:合适的dna和/或rna转录调节剂,包括但不限于放线菌素d、柔红霉素,阿霉素及其衍生物和类似物,也适合与公开的疗法联合使用。可以施用于受试者的dna嵌入剂和交联剂包括但不限于顺铂、卡铂、奥沙利铂、丝
裂霉素(诸如丝裂霉素c)、博来霉素、苯丁酸氮芥、环磷酰胺及其衍生物和类似物。适合用作治疗剂的dna合成抑制剂包括但不限于甲氨蝶呤、5-氟-5'-脱氧尿苷、5-氟尿嘧啶及其类似物。合适的酶抑制剂的实例包括但不限于喜树碱、依托泊苷、福美坦、曲古抑素及其衍生物和类似物。影响基因调控的合适化合物包括导致一种或多种基因表达增加或降低的试剂,诸如雷洛昔芬、5-氮杂胞苷、5-氮杂-2'-脱氧胞苷、他莫昔芬、4-羟基他莫昔芬、米非司酮及其衍生物和类似物。激酶抑制剂包括(伊马替尼)、(吉非替尼)和(厄洛替尼),它们可防止磷酸化和激活生长因子。
[0174]
抗血管生成剂的非限制性实例包括分子,诸如蛋白、酶、多糖、寡核苷酸、dna、rna和重组载体,以及起到减少甚至抑制血管生长的作用的小分子。合适的血管生成抑制剂的实例包括但不限于血管抑素k1-3、星形孢菌素、金雀异黄素、烟曲霉素、甲羟孕酮、苏拉明、干扰素-α、金属蛋白酶抑制剂、血小板因子4、生长抑素、凝血酶原、内皮抑素、沙利度胺及其衍生物和类似物。例如,在一些实施方式中,抗血管生成剂是与vegf(例如,安维汀,roche)或vegf受体(例如,vegfr2抗体)特异性结合的抗体。在一个实例中,抗血管生成剂包括vegfr2抗体或dmxaa(也称为vadimezan或asa404;可商购,例如,购自sigma corp.,st.louis,mo)或二者。抗血管生成剂可以是贝伐珠单抗、舒尼替尼、抗血管生成酪氨酸激酶抑制剂(tki),诸如舒尼替尼、西替尼和达沙替尼。这些可以单独使用或联合使用。
[0175]
可以属于或可以不属于上述一种或多种分类的其他治疗剂,例如抗肿瘤剂,也适合与所公开的方法联合施用。举例来说,此类试剂包括阿霉素、芹菜素、雷帕霉素、泽布拉林(zebularine)、西咪替丁及其衍生物和类似物。
[0176]
在一些实例中,接受治疗性抗体-ir700分子组合物的受试者还例如通过静脉内施用而施用白介素-2(il-2)。在特定实例中,从施用抗体ir700分子后的第二天开始,每十五个小时以15分钟的周期静脉内推注的剂量至少为500,000iu/kg的il-2(chiron corp.,emeryville,ca)并持续长达5天。可以根据受试者的耐受性跳过剂量。
[0177]
示例性的另外的治疗剂包括抗肿瘤剂,诸如化疗和抗血管生成剂或疗法,诸如放疗。在一个实例中,试剂是化疗免疫抑制剂(诸如利妥昔单抗、类固醇)或细胞因子(诸如gm-csf)。化疗剂是本领域已知的(例如见,slapak and kufe,principles of cancer therapy,chapter 86in harrison's principles of internal medicine,14th edition;perry et al.,chemotherapy,ch.17 in abeloff,clinical oncology 2nd ed.,2000 churchill livingstone,inc;baltzer and berkery.(eds):oncology p℃ket guide to chemotherapy,2nd ed.st.louis,mosby-year book,1995;fischer knobf,and durivage(eds):the cancer chemotherapy handbook,4th ed.st.louis,mosby-year book,1993)。联合化疗是多于一种的试剂用于癌症治疗。
[0178]
可以与本文提供的方法联合使用的示例性化疗剂包括但不限于卡铂、顺铂、紫杉醇、多西他赛、阿霉素、表柔比星、托泊替康、伊立替康、吉西他滨、异唑嘌呤、吉西他滨、依托泊苷、长春瑞滨、环磷酰胺、甲氨蝶呤、氟尿嘧啶、米托蒽醌、doxil(脂质体包裹的多柔比星)和长春瑞滨。可以使用的化疗剂的其他实例包括烷基化剂、抗代谢物、天然产物或激素及其拮抗剂。烷基化剂的实例包括氮芥(诸如甲氧乙胺、环磷酰胺、美法仑、尿嘧啶芥或苯丁酸氮芥)、烷基磺酸盐(诸如白消安)、亚硝基脲(诸如卡莫司汀、洛莫司汀、苏木汀、链脲菌素或达卡巴嗪)。烷基化剂的具体非限制性实例是替莫唑胺和达卡巴嗪。抗代谢物的实例包括叶酸
ozogamicin)、吉瑞昔单抗、glembatumumab vedotin、替伊莫单抗、伊戈伏单抗(igovomab)、英西单抗(imciromab)、英特单抗、奥英妥珠单抗、伊匹单抗(ipilimumab)、伊拉单抗、拉贝珠单抗、来沙木单抗、林妥珠单抗(lintuzumab)、莫星-洛沃妥珠单抗、卢卡珠单抗、鲁昔单抗、马塔单抗、马妥珠单抗、美泊利单抗、迈他珠单抗(metelimumab)、米拉珠单抗、米妥莫单抗、莫罗木单抗、他那可单抗、naptumomab estafenatox、耐昔妥珠单抗、尼妥珠单抗、巯诺莫单抗、奥法木单抗、奥拉单抗、莫奥珠单抗、奥戈伏单抗、帕尼单抗、培马单抗、帕妥珠单抗、品妥莫单抗、普利木单抗、雷莫卢单抗、利妥珠单抗、利妥昔单抗(rituximab)、罗妥木单抗、沙妥莫单抗喷地肽、西罗珠单抗、索普昔单抗、替他珠单抗、taplitumomab paptox、替妥莫单抗、tgn1412、替西木单抗(tremelimumab)、替加妥单抗、tnx-650、曲妥珠单抗、曲美目单抗、西莫白介素单抗、维妥珠单抗、伏罗昔单抗(volociximab)、伏妥莫单抗、扎鲁木单抗,或其组合。
[0183]
记忆t细胞的产生
[0184]
还提供了产生对靶细胞特异的记忆t细胞的方法。在特定实例中,该方法包括向受试者施用治疗有效量的一种或多种抗体-ir700分子,其中抗体与靶细胞表面分子(诸如肿瘤特异性抗原(诸如表1中所列的抗原)特异性结合。该方法还包括与抗体-ir700分子同时或基本上同时向受试者施用治疗有效量的一种或多种免疫调节剂(诸如免疫系统激活剂或免疫抑制细胞的抑制剂,或序贯施用(例如,约在0至24小时内)。在特定实例中,免疫调节剂是pd-1或pd-l1拮抗性抗体。在另一个特定实例中,免疫调节剂是cd25抗体-ir700分子。然后以至少1j/cm2(诸如至少50j/cm2或至少100j/cm2)的剂量在660至740nm波长(诸如660至710nm(例如,680nm))下照射受试者或受试者体内的细胞。
[0185]
记忆t细胞可以是cd4
+
或cd8
+
,通常表达cd45ro。因此,在一些实例中,通过检测表达cd45ro的细胞来鉴定记忆t细胞。记忆t细胞的许多亚型是已知的。例如,中央记忆t细胞(t
cm
细胞)表达cd45ro,7型c-c趋化因子受体(ccr7)和l-选择蛋白(cd62l)。中央记忆t细胞也具有中等至高表达的cd44。这种记忆亚群通常在淋巴结和外周循环中发现。效应记忆t细胞(t
em
细胞和t
emra
细胞)表达cd45ro,但缺乏ccr7和l-选择蛋白的表达。它们还具有中等至高表达的cd44。这些记忆t细胞缺乏淋巴结归巢受体,因此在外周循环和组织中发现。t
emra
细胞还表达cd45ra。组织常驻记忆t细胞(t
rm
)表达整联蛋白αeβ7。trm特有的是参与脂质代谢的基因,具有很高的活性,比其他类型的t细胞的活性高约20至30倍。干细胞记忆细胞(t
scm
细胞)为cd45ro-、ccr7
+
、cd45ra
+
、cd62l
+
(l-选择素)、cd27
+
、cd28
+
和il-7rα
+
,但它们也表达大量cd95、il-2rβ、cxcr3和lfa-1。
[0186]
在一些实例中,与未接受治疗的受试者的记忆t细胞的量相比,所公开的方法使记忆t细胞的量增加至少1%(例如,至少2%、5%、7%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、2倍、3倍、4倍、5倍、10倍或更多)。在一些实例中,总记忆t细胞增加,而在其他实例中,与未治疗的受试者相比,记忆t细胞的一种或多种亚型增加。在其他实例中,与未接受所公开的方法治疗的受试者中记忆t细胞的量相比,该方法使对于特定抗原(诸如肿瘤特异性抗原)的记忆t细胞增加至少1%(例如,至少2%、5%、7%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、2倍、3倍、4倍、5倍、10倍或更多)。在非限制性实例中,记忆t细胞识别p15e、birc5、twist和p53中的一种或多种(见实施例3)。
[0187]
记忆t细胞的数量和/或类型可以在来自受试者(诸如治疗的受试者)的样本中确
定。在一些实例中,免疫测定法和/或遗传分析用于检测来自受试者的血液样本中的记忆t细胞。例如,可以例如通过流式细胞术来测量一种或多种记忆t细胞表面标志物的存在和/或数量。在另一个实例中,肿瘤浸润淋巴细胞(til)可获自治疗的受试者,并检查对抗原例如肿瘤特异性抗原的功能反应性。在以下实施例3中提供了示例性方法。可以将记忆t细胞的数量、类型和/或反应性特征与对照(诸如未治疗的受试者、治疗之前的受试者和/或参考编号(诸如从正常(例如,健康)个体中获得的平均值)进行比较。
[0188]
多克隆抗原特异性tic的产生
[0189]
还提供了增加对mhc i型限制性肿瘤特异性抗原的多克隆抗原特异性tic应答的方法。在特定实例中,该方法包括向受试者施用治疗有效量的一种或多种抗体-ir700分子,其中抗体与靶细胞表面分子(诸如肿瘤特异性抗原(诸如表1中所列的抗原))特异性结合。该方法还包括与抗体-ir700分子同时或基本上同时向受试者施用治疗有效量的一种或多种免疫调节剂(诸如免疫系统激活剂或免疫抑制细胞的抑制剂),或序贯施用(约在0至24小时内)。在特定实例中,免疫调节剂是pd-1或pd-l1拮抗性抗体。在另一个具体的例子中,免疫调节剂是cd25抗体-ir700分子。然后以至少1j/cm2(诸如至少50j/cm2或至少100j/cm2)的剂量在660至740nm波长(诸如660至710nm(例如,680nm))下照射受试者或受试者体内的细胞。
[0190]
实施例1
[0191]
材料和方法
[0192]
本实施例描述了用于获得实施例2-9中的结果的材料和方法(另见nagaya et al.,cancer immunol.res.7:401-13,2019,通过引用整体结合入本文)。
[0193]
试剂
[0194]
水溶性二氧化硅-酞菁衍生物irdye 700dx nhs酯(ir700)购自li-cor biosciences(lincoln,ne,usa)。抗小鼠/人cd44特异性mab(克隆im7)和抗小鼠pd-1(cd279)特异性mab(克隆rmp1-14)来自bioxcell(west lebanon,nh,usa)。所有其他化学品均为试剂级。
[0195]
ir700偶联抗cd44 mab的合成
[0196]
将抗cd44 mab(1.0mg,6.7nmol)与在0.1m na2hpo4(ph 8.6)中的ir700 nhs酯(65.1μg,33.3nmol)在室温下孵育1h,并经sephadex g25柱(pd-10;ge healthcare,piscataway,nj,usa)纯化。使用coomassie plus蛋白测定试剂盒(thermo fisher scientific inc,r℃kford,il,usa)通过使用uv-vis(8453value system;agilent technologies,santa clara,ca,usa)在595nm下测量吸光度来确定蛋白浓度。通过在689nm下的吸光度测量ir700浓度,以确认每mab的荧光团分子的数量。控制cd44-ir700偶联物合成,以使每个cd44抗体平均结合两个ir700分子。使用十二烷基硫酸钠-聚丙烯酰胺(4-20%梯度)凝胶电泳(sds-page)验证700nm的荧光和cd44-ir700偶联物的分子量。
[0197]
细胞培养
[0198]
如先前所述(farsaci et al.,cancer immunol res.2014;2:1090-102;hodge et al.,cancer biother radiopharm.2012;27:12-22;judd et al.,cancer res.2012;72:365-74),培养稳定表达荧光素酶(mc38-luc)的mc38(结肠癌)细胞、llc(lewis肺癌)细胞和moc1(鼠口腔癌)细胞在培养物中维持培养。细胞在培养物中维持不超过30代,并常规检测
荧光素(15mg/ml,200μl),并在bli系统(photon imager)上分析小鼠的荧光素酶活性(光子/min/cm2)。将roi设置为包括整个肿瘤,并以相邻的非肿瘤区域为背景。
[0207]
组织学分析
[0208]
将肿瘤(mc38-luc和llc肿瘤第10天,moc1肿瘤第24天)切除,进行福尔马林固定及石蜡包埋,并切成10μm切片。标准h&e染色后,在olympus bx61显微镜上分析切片。
[0209]
免疫荧光
[0210]
如(18)所述,将福尔马林固定的石蜡包埋的切片染色。简而言之,将切片在乙醇梯度中脱蜡,然后在与bloxall(vector laboratories)、2.5%正常山羊血清(vector laboratories)和renaissance ab稀释剂(biocare medical)单独孵育中封闭。加入在renaissance ab稀释剂中的靶向cd4的一抗(invitrogen,克隆4sm95,1:75稀释),置于摇床上持续45分钟。将载玻片洗涤五次,然后用抗大鼠二抗(vector laboratories)染色。再洗涤四次后,将载玻片用tsa偶联的opal650(perkin elmer,1:150稀释)在amplification加缓冲液(perkin elmer)中染色。用1x tbs-t将载玻片洗涤四次。洗涤载玻片,暴露于抗原剥离缓冲液(0.1m甘氨酸ph10+0.5%吐温20)中,并如上所述再次封闭。加入在reinassance ab稀释剂中的靶向cd8的一抗(invitrogen,克隆4sm15,1:75稀释),持续45分钟。如上所述加入抗大鼠二抗(vector laboratories)。再洗涤四次后,将载玻片用tsa偶联的opal520(perkin elmer,1:150稀释)在amplification加缓冲液(perkin elmer)中染色。使用spectral dapi(perkin elmer,1:500)实现了核反染色。载玻片用ddh2o冲洗一次,覆上vectashield硬质封片剂(vector laboratories)并用指甲油密封。
[0211]
流式细胞术
[0212]
在体外,将mc38-luc、llc或moc1细胞(2
×
105)接种到12孔板中,孵育24h,然后在37℃下暴露于含10μg/ml cd44-ir700的培养基中6h。收获细胞并使用cellquest软件在bd facscalibur(bd biosciences)上进行分析。为了验证cd44-ir700的特异性结合,在与cd44-ir700孵育之前,将细胞与过量的未偶联cd44抗体(100μg)孵育。在体内,收获肿瘤(mc38-luc和llc肿瘤为第10天,moc1肿瘤为第24天),并如先前所述(moore et al.,cancer immunol res.2016;4:1061-71)立即消化。fcγr(cd16/32)阻断后,单细胞悬液用一抗染色。悬液用荧光团偶联的一抗染色,其包含抗小鼠cd45.2克隆104、cd3克隆145-2c11、cd8克隆53-6.7、cd4克隆gk1.5、pd-1克隆29f.1a12、cd11c克隆n418、f4/80克隆bm8、cd11b克隆m1/70、ly-6c克隆hk1.4、ly-6g克隆1a8、ia/ie克隆m5/114.15.2、pd-l1克隆10f.9g2、cd25克隆pc61.5.3、ctla-4克隆uc10-4b9、cd31克隆390、pdgfr克隆apa5和cd44克隆im7(biolegend),在1%bsa/1xpbs缓冲液中静置一小时。洗涤悬液,用活力标志物(7aad或zombie染料;biolegend)染色,并使用bd facs diva软件在bd canto上通过流式细胞术进行分析。同型对照和“荧光减一”方法用于验证染色特异性。根据生产商方案,使用mouse regulatory t cell staining kit#1(ebioscience)对foxp3
+
调节性cd4
+
t淋巴细胞(t
reg
)进行染色。采集后使用flowjo vx10.0.7r2进行分析。
[0213]
抗原特异性til反应性
[0214]
将新鲜肿瘤切碎的片段在补充谷氨酰胺、hepes、非必需氨基酸、丙酮酸钠、β-巯基乙醇、5%fbs和100u/ml重组鼠il-2的rpmi 1640培养基中孵育72小时以提取til。未接触的til富含负磁性分选(automacspro,miltenyi biotec)。将抗原呈递细胞(apc;来自照射
50gy的空白wt b5小鼠的脾细胞)用感兴趣的肽脉冲一小时,其中包括i类限制性抗原p15e
604-611
(h-2k
b
限制性kspwfttl)、survivin/birc5
57-64
(h-2k
b
限制性qcffcfkel)、twist
125-133
(h-2d
b
限制性tqslneafa)和trp53
232-240
(h-2d
b
限制性kymcnsscm)。将抗原脉冲化的apc和til以3:1的apc:til比共孵育24小时。按照生产商的建议,通过elisa(r&d)分析上清液中ifnγ的产生。单独的til、单独的apc和用卵清蛋白
257-264
(h-2k
b
限制性siinfekl)和vsv-n
52-59
(h-2d
b
限制性rgyvyqgl)刺激肽作为对照。
[0215]
rt-pcr
[0216]
使用rneasy mini kit(qiagen)按照生产商的方案纯化来自整个肿瘤裂解液的rna。利用具有rnase抑制剂的高容量cdna逆转录试剂盒(applied biosystems)合成cdna。在viia7 qpcr分析仪(applied biosystems)上,使用taqman universal pcr预混液评估靶基因相对于gapdh的相对表达。对每种肿瘤相关抗原,设计定制的引物以侧翼编码mhc i类限制性表位的核苷酸区域。
[0217]
统计分析
[0218]
除非另外指出,否则数据表示为来自至少五次实验的平均值
±
sem。使用graphpad prism版本7(graphpad software,la jolla,ca,usa)进行统计分析。student t检验用于比较体外处理组与对照组的处理效果。为了在重新接种的mc38-luc肿瘤模型中比较肿瘤生长,使用mann whitney检验。为了进行多重比较,使用单因素方差分析(anova),然后进行tukey检验。使用kaplan-meier生存曲线分析评估每组基于体积(2000mm3)的累积生存概率,并使用对数秩检验将结果进行比较。p值<0.05被认为具有统计学显著性。
[0219]
实施例2
[0220]
nir-pit对癌细胞的体外作用
[0221]
mc38-luc是在cmv启动子控制下表达荧光素酶的小鼠结肠癌细胞系(zabala et al.,mol.cancer 8:2,2009)。还使用了llc(lewis肺癌)细胞和moc1(鼠口腔癌)细胞。抗cd44-ir700使用wo 2013/009475(通过引用结合入本文)中描述的方法产生。简而言之,将抗cd44 mab(1.0mg,6.7nmol,来自bioxcell,west lebanon,nh的克隆im7)与ir700 nhs酯(65.1μg,33.3nmol)在0.1m na2hpo4(ph 8.6)中于室温下孵育1h。并经sephadex g25柱(pd-10;ge healthcare,piscataway,nj,usa)纯化。控制cd44-ir700偶联物的合成,以使每个cd44抗体平均结合两个ir700分子。偶联物显示出很强的荧光强度,在690nm附近具有峰吸收。
[0222]
在体外评估抗cd44-ir700对mc38-luc细胞的作用。为了验证抗cd44
–
ir700的结合,使用流式细胞仪(facs calibur,bd biosciences)和cellquest软件(bd biosciences)测量与抗cd44
–
ir700孵育后来自细胞的荧光。将mc38-luc细胞接种到12孔板中,并孵育24小时。用含10mg/ml抗cd44
–
ir700的新鲜培养基替换培养基,并在37℃下孵育6小时。为了验证偶联抗体的特异性结合,使用过量的抗体(100mg)以阻断10mg的抗cd44
–
ir700(图1a)。
[0223]
为了检测nir-pit的抗原特异性定位和作用,进行荧光显微镜检查(bx61;olympus america,inc.)。将mc38-luc、llc或moc1细胞(1
×
104)接种在底部铺有盖玻片的培养皿中,孵育24小时。然后将抗cd44
–
ir700以10mg/ml的浓度添加到培养基中,并在37℃下孵育6小时。孵育后,将细胞用磷酸盐缓冲液(pbs)洗涤。设置用于检测ir700的滤光片由590至650nm激发滤光片,665至740nm带通发射滤光片组成。还获取了透射光差分干涉对比(dic)图像。
图1b是数字图像,其显示了对照和抗cd44-ir700处理的mc38-luc细胞的微分干涉对比(dic)和荧光显微镜图像。在处理的细胞中用nir光激发后观察到坏死细胞死亡。在存在过量未结合的cd44 mab的情况下,该信号被完全反转,从而验证了结合特异性。在暴露于cd44-ir700的肿瘤细胞的nir照射下,立即引起细胞肿胀、气泡形成和囊泡破裂,这表明所有三种细胞系(mc38-luc、llc和moc1)均发生坏死性细胞死亡。在nir暴露的15分钟内观察到这些形态变化(图1b)。
[0224]
对于生物发光成像(bli),将mc38-luc细胞接种到12孔板(2
×
105个细胞/孔)中,或将10cm培养皿(2
×
107个细胞)接种到10cm培养皿中,并预孵育24小时。用含10mg/ml抗cd44
–
ir700的新鲜培养基替换培养基后,将细胞在37℃的潮湿培养箱中孵育6小时。用pbs洗涤后,加入无酚红的培养基。然后,在无酚红培养基中,将细胞暴露于led或nir激光,该led或nir激光发出685至695nm波长的光(bwf5-690-8-600-0.37;b&w tek inc)。用光功率计(pm 100,thorlabs)测量以mw/cm2为单位的输出功率密度。图1c是10cm培养皿的生物发光成像(bli)的数字图像,显示了mc38-luc细胞中nir光剂量依赖性荧光素酶活性。
[0225]
对于荧光素酶活性(图1d),在nir-pit 1小时后,将150mg/ml含d-荧光素的培养基(gold biotechnology)施用于pbs洗涤的细胞,并在bli系统上获得图像(photon imager;biospace lab)。将感兴趣区域(roi)置于每个整孔中,然后使用m3 vision软件(biospace lab)计算荧光素酶活性(光子/分钟)。
[0226]
通过流式细胞术碘化丙啶(pi;life technologies)染色确定nir-pit联合抗cd44
–
ir700的细胞毒性作用,该染色可以检测受损的细胞膜。将二十万个mc38-luc细胞接种到12孔板中,孵育24小时。用含10mg/ml抗cd44
–
ir700的新鲜培养基替换培养基,并在37℃下孵育6小时。用pbs洗涤后,添加pbs,并用红色发光二极管(led)照射细胞,该发光二极管以670至710nm的波长发射光(l690-66-60;marubeni america co.),用光功率计(pm 100,thorlabs)测得功率密度为50mw/cm2。处理1小时后将细胞刮下。然后将pi添加到细胞悬液中(最终2mg/ml),并在室温下孵育30分钟,随后进行流式细胞术。每个值代表五瓷实验的平均值
±
sem。图1e显示了在使用或不使用10μg/ml cd44-ir700的nir处理的mc38-luc细胞中的细胞死亡百分比,使用碘化丙锭(pi)染色测量死细胞计数。
[0227]
生物发光成像证明mc38-luc细胞中荧光素酶活性以光剂量依赖性方式降低(图1c,1d)。基于掺入碘化丙啶(例如,膜通透性),nir以光剂量依赖性方式在暴露于cd44-ir700的mc38-luc(图1e)、llc(图1f)和moc1(图1g)的细胞中诱导细胞死亡。单独使用nir或cd44-ir700不会诱导细胞活力的显著改变。
[0228]
这些数据证明,靶向cd44的nir-pit在体外可诱导mc38-luc、llc和moc1细胞中的特异性细胞死亡。
[0229]
实施例3
[0230]
moc1、llc和mc38-luc肿瘤区室内的cd44表达
[0231]
为了验证体内cd44的靶向表达,通过流式细胞术评估大小相当的moc1(第24天)、llc(第10天)和mc38(第10天)肿瘤在不同肿瘤区室中的cd44表达(图2a)。观察到肿瘤和基质细胞特异性cd44表达具有显著异质性,与moc1相比,llc和mc38-luc肿瘤细胞表达的cd44水平明显更高。在moc1、llc和mc38-luc肿瘤之间,免疫细胞亚群上cd44的表达更加均一,并且通过平均荧光强度(mfi)进行逐细胞分析,其在肿瘤和基质细胞上的cd44表达更高。与
llc或moc1肿瘤相比,在mc38-luc肿瘤中注射后一天cd44-ir700的整个肿瘤蓄积(取决于多种因素,包括靶抗原表达和血管)明显更大(p<0.001)(图2b、图2c)。
[0232]
实施例4
[0233]
nir-pit和pd-1mab对肿瘤的体内作用
[0234]
在小鼠的单侧、双侧和多处肿瘤模型中检测抗cd44-ir700和抗pd1联合治疗的效果。图3a显示了小鼠(每组10-13只小鼠)中的单侧mc38-luc肿瘤的处理方案。向小鼠腋下单侧注射600万个肿瘤细胞(第0天)。当体积约50mm3(直径4至5mm;mc38-luc和llc肿瘤第4天;moc1肿瘤第18天)时对已建立的肿瘤进行处理。在第4天,小鼠i.v.(尾静脉)单独施用100μg抗cd44-ir700,或与200μg抗pd1 i.p.(彼此间隔1小时之内)(来自bioxcell(west lebanon,nh,usa)的抗小鼠pd-1(cd279)特异性mab(克隆rmp1-14)联合施用,随后在第6、8和10天i.p.施用100μg抗pd1。在第5天(50j/cm2)和第6天(100j/cm2)进行nir-pit。对于荷有多处肿瘤的小鼠,未暴露于nir的肿瘤用铝箔遮挡以免暴露于nir。
[0235]
通过荧光成像和生物发光成像监测肿瘤(图3a)。用具有700nm荧光通道的pearl imager(li-cor biosciences)获得体内ir700荧光图像。将roi置于肿瘤上,并使用pearl cam软件(licor bioscience s)计算每个roi的ir700信号的平均荧光强度。对于体内bli,i.p.注射d-荧光素(15mg/ml,200μl),然后在bli系统(photon imager)上分析小鼠的荧光素酶活性。将roi设置为包括整个肿瘤,以定量bli。还将roi置于相邻的非肿瘤区域中作为背景(光子/min/cm2)。计算每个roi的平均荧光素酶活性。
[0236]
为了检测肿瘤中抗原特异性的微分布,进行荧光显微镜检查。从未处理的右侧腋下切除肿瘤异种移植物(对于mc38-luc和llc肿瘤为第10天,对于moc1肿瘤为第24天)。采用最佳切割温度(oct)化合物(sakura finetek japan co.)冷冻提取的肿瘤,并制备冷冻切片(10μm厚)。使用具有以下滤光片的olympus bx61显微镜进行荧光显微镜检查:ir700荧光的激发波长为590至650nm,发射波长为665至740nm长。还获取了dic图像。为了评估组织学变化,使用olympus bx61进行光学显微镜检查。在注射抗cd44-ir700(i.v.)后24小时和nir-pit后24小时,从未处理的小鼠身上切除肿瘤异种移植物。右侧肿瘤进行nir-pit后24小时,还从双侧腋下荷瘤(右侧肿瘤经处理和左侧肿瘤未经处理)的小鼠中切除肿瘤。提取的肿瘤也置于10%福尔马林中,并将连续的10mm切片固定在载玻片上,进行h&e染色。
[0237]
与对照组或pd-1mab单独使用组相比,nir-pit导致肿瘤荧光信号几乎立即下降,这可能是由于来自濒死细胞中的ir700分散所致(图3b)。与对照组或单独处理组相比,nir-pit和pd-1mab联合处理导致生物发光显著降低(图3c,在图3d中定量)。处理的肿瘤的组织学(h&e)分析显示,在用nir-pit处理的肿瘤中,出现广泛肿瘤坏死和微出血,而pd-1mab处理组表现出更大的白细胞浸润(图3e)。尽管与对照组相比,单独使用nir-pit或pd-1mab后原发肿瘤的生长受到抑制(图3f),但联合治疗可显著控制肿瘤,并在13只小鼠中的9只(70%)中完全排斥已建立的mc38-luc肿瘤。该应答导致接受联合处理的小鼠的生存时间显著延长(图3g)。尽管与对照相比,抗体处理或抗cd44-ir700 nir-pit增加了生存时间,但nir-pit组中没有动物存活到40天,仅抗体组中的动物仅9%(抗cd44-ir700+抗pd1,未进行nir-pit)存活至研究结束(图3g)。相反,联合处理组中80%的动物存活到研究结束。在任何处理组中均未观察到皮肤坏死或全身毒性。
[0238]
使用相似的处理方案和成像方案,在荷有已建立的单侧llc或moc1肿瘤的小鼠中
采用了相似的方法(图4a、图5a)。与mc38-luc肿瘤相似,用nir-pit处理llc或moc1肿瘤导致ir700荧光信号几乎立即消失(图4b,5b),表明具有靶向作用。用nir-pit和pd-1mab联合处理llc荷瘤小鼠,与单独使用对照或单独处理相比,显著增强了原发肿瘤控制(图4c)和生存时间(图4d),并导致12处已建立肿瘤中有1处发生排斥(8%)。用nir-pit和pd-1mab联合处理moc1荷瘤小鼠导致13处肿瘤中有1处(8%)发生排斥反应,与对照组相比,生存时间发生统计学上提高,但是联合处理后累积原发性肿瘤生长并未增强超过任一单独处理(图5c、图5d)。
[0239]
综上所述,这些结果证明了nir-pit对mc38-luc、llc和moc1荷瘤小鼠的cd44靶向作用,并在mc38-luc和llc模型中通过添加pd-1免疫检查点封锁(icb)显著增强了原发肿瘤的控制和生存时间。
[0240]
实施例5
[0241]
pd-1 icb增强nir-pit诱导的抗原特异性免疫
[0242]
处理完成后,将一些mc38-luc肿瘤处理为单细胞悬液,并通过流式细胞仪评估免疫细胞的浸润情况。用nir-pit处理的肿瘤表现出表达更高水平pd-1的cd8和cd4肿瘤浸润淋巴细胞(til)的浸润显著增强(图6a)。用相同的ab克隆(rmp1-14)染色后,通过流式细胞术在til表面可检测到非常低的pd-1水平,因此全身性pd-1mab处理的小鼠表现出pd-1靶标饱和。通过多重免疫荧光(if)验证了这种增强的cd8和cd4 til浸润。在对照或pd-1mab处理的肿瘤中,几乎没有cd8+til沿肿瘤-基质界面嵌套,但没有浸润肿瘤(图6b,左图)。nir-pit之后,更多的cd8+til浸润整个肿瘤,但许多til仍被阻滞在肿瘤-基质界面。通过添加pd-1mab,显著增强了对肿瘤的浸润(图6b,右图)。在另外的实验中,通过il-2从对照或处理的mc38-luc肿瘤中提取til,并评估其对多种h-2k
b
或h-2k
d
限制性taa的抗原特异性ifnγ应答(图6c)。对照肿瘤的til表现出对h-2k
b
限制性p15e
604-611
(kspwfttl)产生可测量的应答,但对其他抗原却无应答。pd-1mab处理可增强基线p15e
604-611
应答,但未诱导对其他抗原的应答。nir-pit处理诱导了从头开始的对h-2k
b
限制性survivin/birc5
57-64
(qcffcfkel)和h-2d
b
限制性trp53
232-240
(kymcnsscm)的从头应答,并增强对p15e
604-611
的基线应答。pd-1mab处理可增强这些nir-pit诱导或增强的抗原特异性应答。nir-pit还增强了对mhc ii类阳性树突细胞(dc)和极化以表达更高水平的mhc ii类的f4/80+巨噬细胞的肿瘤浸润(图6d)。免疫抑制中性粒细胞(pmn-髓样)和调节性cd4+t淋巴细胞(t
reg
)通过联合处理而可变地改变(图6e)。证实了mc38-luc肿瘤细胞特异性pd-l1表达,但未随处理而改变,而浸润的免疫细胞pd-l1显著大于肿瘤细胞表达,并随联合处理而增加(图6f)。
[0243]
在llc和moc1肿瘤中进行了类似的免疫相关实验。单独或联合使用pd-1mab和nir-pit处理的llc肿瘤表现出增强的til浸润(图7a)。抗原特异性llc til对p15e
604-611
和h-2d
b
限制性twist
125-133
(tqslneafa)表现出可测量的基线应答。与mc38-luc肿瘤相似,nir-pit处理可诱导对survivin/birc5
57-64
应答。pd-1mab处理可增强对birc5和twist的应答,但不能增强p15e的应答(图7b)。llc肿瘤的nir-pit处理增强了mhc ii类阳性dc的浸润和在巨噬细胞上mhc ii类的表达(图7c)。处理后pmn-髓样细胞和t
reg
可变地改变。7d),并且llc肿瘤和免疫细胞特异性pd-l1表达随处理而增强(图7e)。
[0244]
与mc38-luc或llc肿瘤相比,nir-pit处理的moc1肿瘤几乎没有免疫相关改变。pd-1mab适度增强了cd8和cd4 til的浸润,但nir-pit没有增强(图8a)。全身性pd-1mab处理可
增强对p15e604-611的基线til抗原特异性应答,但nir-pit处理未诱导对其他共有肿瘤抗原的应答(图8b)。mhc ii类+dc和巨噬细胞的moc1肿瘤浸润得到适度增强,表明该模型中缺乏髓样细胞引发和激活。在pmn-髓样细胞或t
reg
或moc1肿瘤的浸润或免疫细胞特异性pd-l1表达中未观察到显著变化(图8c、图8d)。
[0245]
为了研究moc1中对肿瘤相关抗原缺乏til应答的可能解释,在mc38-luc、llc和moc1细胞中测量了每种抗原的相对表达。使用被设计为在mhc i类限制性表位编码区侧翼的引物,pcr结果表明相对于mc38-luc和llc,birc5、twist1和trp53基因转录本在moc1中的表达较低(图9)。更高的抗原表达通常与基线til应答相关。有意思的是,在联合使用nir-pit和pd-1mab处理后,mc38-luc细胞中较高的相对trp53表达和llc细胞中的twist1表达与这些基因对i类限制性表位的til应答增强相关。因此,处理后增强的til应答可能取决于基线肿瘤抗原表达。
[0246]
这些结果表明,nir-pit可以诱导mc38-luc和llc荷瘤小鼠体内对mhc i类限制性肿瘤抗原的从头开始的多克隆抗原特异性til应答,并且这些应答可以通过全身性pd-1icb而增强。
[0247]
实施例6
[0248]
联合使用nir-pit和pd-1icb在双侧mc38-luc荷瘤小鼠中诱导远距离抗肿瘤作用
[0249]
鉴于有证据表明在mc38-luc荷瘤小鼠中nir-pit后诱导了肿瘤抗原特异性免疫,因此局部nir-pit联合全身性pd-1mab是否可以在未经nir处理的单独的远距离肿瘤中诱导抗肿瘤免疫-pit已确定。如上所述,对于双侧mc38-luc荷瘤小鼠进行类似处理和成像方案(图10a),但是仅右侧腋下肿瘤用nir-pit处理(图10b)。
[0250]
nir-pit在处理的肿瘤中引起ir700荧光信号的近乎立即损失,而在未处理的肿瘤中ir700信号强度的损失被延迟数日(图10c)。相反,在联合处理后,右侧(用nir-pit处理)和左侧(未处理)mc38-luc肿瘤的生物发光同时降低(图10d,在图10e中定量)。右侧和左侧肿瘤的组织学分析显示出相似的坏死和微出血模式,并且白细胞浸润增加(图10f)。联合处理在10只小鼠中的8只中导致明显的原发肿瘤控制和左右肿瘤的完全肿瘤排斥(80%;图10g),与未处理的小鼠相比导致生存率增加(图10h)。
[0251]
实施例7
[0252]
诱导未使用nir-pit处理的远距离肿瘤的抗原特异性免疫
[0253]
来自右侧(nir-pit处理)和左侧(未处理)肿瘤的单细胞悬液的流式细胞术分析显示了相似水平的增强的cd8和cd4 til蓄积(图11a)。抗原特异性反应性的评估表明,来自处理和未处理肿瘤的til均与相同的mhc i类限制性抗原反应(图11b),表明存在全身性抗原特异性免疫。til应答的量级与p15e
604-611
和survivin/birc5
57-64
相似,但是与已处理相比,在未使用nir-pit处理的肿瘤中,对trp53
232-240
的应答有所减少。在处理的肿瘤中观察到mhc ii类阳性dc和巨噬细胞增加(图11c),pmn髓样细胞增加和t
reg
降低(图11d),但未处理的肿瘤中未观察到,表明这些变化是nir-pit的直接结果,而不是全身抗肿瘤免疫力的直接结果。mc38-luc浸润的免疫细胞pd-l1的表达(图11e)在接受联合处理的小鼠的右侧处理肿瘤和左侧未处理肿瘤中均增强,表明免疫细胞pd-l1的表达可能不依赖于nir-pit。
[0254]
因此,nir-pit和pd-1icb联合使用可以使得能够消除已建立的未处理肿瘤的全身性肿瘤抗原特异性免疫力的发展,但先天免疫力的增强和免疫抑制细胞亚群的改变似乎是
局部发生的,具有nir-pit更直接的作用。
[0255]
实施例8
[0256]
联合使用nir-pit和pd-1icb控制高疾病负荷小鼠的多处远距离肿瘤
[0257]
为了证明对单一mc38-luc肿瘤的处理可以使得排斥单一小鼠中多个已建立的远距离肿瘤,使用了以下方法。使用相似的处理(图12a)将nir-pit递送至四个已建立的mc38肿瘤之一(图12b)。nir-pit在单一处理的肿瘤中引起ir700荧光信号的近乎即时的损失,而在三个未处理的肿瘤中ir700信号强度的分辨被延迟数日(图12c)。相反,在联合处理后,单一处理的mc38-luc肿瘤和三个未处理的mc38-luc肿瘤的生物发光同时降低(图12d,在图12e中定量)。组织学分析显示处理小鼠的所有肿瘤发生坏死和白细胞浸润增加,但对照小鼠的肿瘤未发生(图12f)。全身性pd-1mab以及使用nir-pit处理单一mc38-luc肿瘤可显著控制多个mc38-luc肿瘤的生长。15只处理小鼠中的12只(80%)(图12g)完全排斥所有四个肿瘤,与对照组相比,生存时间提高(图12h)。
[0258]
因此,局部nir-pit联合全身性pd-1icb处理肿瘤的单灶足以诱导全身性免疫,能够消除未用nir-pit处理的远距离疾病的多个部位。
[0259]
实施例9
[0260]
联合使用nir-pit和pd-1icb后出现肿瘤排斥的小鼠产生免疫记忆
[0261]
为了评估免疫记忆的存在,如上所述,小鼠用nir-pit联合pd-1mab处理(图13a)。30天后,通过在对侧腋下注射mc38-luc细胞以激发对联合处理表现出完全应答的小鼠(图13a)。对照小鼠容易移植mc38-luc肿瘤,而先前排斥已建立的mc38-luc肿瘤的小鼠抵抗移植并且不生长肿瘤(图13c,生存时间见图13d),表明存在免疫记忆。
[0262]
如图18所示,以上实施例中的结果证明nir-pit诱导cd44特异性肿瘤细胞死亡,导致多种肿瘤抗原的释放。nir-pit还促进炎症性肿瘤微环境,导致多种抗原的交叉引发和多克隆抗原特异性t细胞反应的发展。该效应子应答受pd-1/pd-l1表达和适应性免疫抗性的限制,加入pd-1icb可有效逆转该应答。
[0263]
实施例10
[0264]
材料和方法
[0265]
本实施例提供了用于获得实施例11-14中所述结果的材料和方法。
[0266]
细胞培养
[0267]
在95%空气和5%二氧化碳的气氛下的37℃湿润培养箱中,在组织培养瓶中补充10%胎牛血清和1%青霉素-链霉素的rpmi1640中培养表达cd44和荧光素酶的mc38-luc细胞,稳定表达cd44抗原的ll/2细胞和moc1细胞。
[0268]
试剂
[0269]
水溶性二氧化硅-酞菁衍生物irdye700dx nhs酯购自li-cor bioscience(lincoln,ne,usa)。抗小鼠/人cd44 mab(im7)和抗小鼠cd25 mab(pc-61.5.3)来自bio x cell。所有其他化学品均为试剂级。
[0270]
ir700偶联抗cd25 mab和抗cd44 mab的合成
[0271]
抗cd25 mab(1mg,6.7nmol/l)和抗cd44 mab(1mg,6.7nmol/l)分别与ir700(65.1μg,33.3nmol,10mmol/l dmso)和0.1mol/l na2hpo4孵育(ph 8.5)在室温下放置1小时。经凝胶过滤柱(sephadex g 25柱,pd-10,ge healthcare,piscataway,nj,usa)纯化混合物。用
考马斯加蛋白测定试剂盒(thermo fisher scientific inc,rockford,il,usa)通过光谱仪(8453value system;agilent technologies,santa clara,ca,usa)测量595nm处的吸收来测定蛋白浓度。本文,将偶联ir700的抗cd25mab和抗cd44mab分别简称为抗cd25-mab-ir700和抗cd44-mab-ir700。
[0272]
动物模型
[0273]
六至八周龄的雌性c57bl/6小鼠(品系#000664)购自jackson实验室。将小鼠下半身剃毛以进行照射和图像分析。将肿瘤体积达到约150mm3的小鼠用于实验。使用以下公式根据最大纵向直径(长度)和最大横向直径(宽度)计算肿瘤体积;肿瘤体积=长
×
宽2×
0.5(基于卡尺测量)。每天监测小鼠,每周测量三次mc38-luc和ll/2肿瘤的肿瘤体积,每周两次测量moc1肿瘤的肿瘤体积,直到肿瘤体积达到2,000mm3,然后通过吸入二氧化碳气体对小鼠实施安乐死。
[0274]
体内生物发光成像(bli)和ir700荧光成像
[0275]
为了获得mc38-luc荷瘤小鼠的生物发光图像,将d-荧光素(15mg/ml,150μl)腹腔注射给小鼠。使用相对光单位(rlu),通过bli系统(photon imager;biospace lab,paris,france)分析荧光素酶的活性。感兴趣区域(roi)置于整个肿瘤上。使用m3 vision软件(biospace lab)计算rlu的每分钟计数,并转换为基于nir-pit之前的rlu的百分比(rlu%)。bli在nir-pit之前和之后的第0天到第7天进行。体内的ir700荧光图像使用pearl imager(li-cor biosciences)通过700nm荧光通道获得。
[0276]
体内荧光成像研究
[0277]
将mc38-luc细胞(800万)、ll/2细胞(800万)和moc1细胞(400万)皮下注射到小鼠的背部。在荷瘤小鼠达到约150mm3的体积后对其进行研究。在经由尾静脉注射100μg抗cd25-mab-ir700后的1、4、6、12、24和48小时,使用700-nm荧光通道通过pearl-imager获得ir700的连续背侧荧光图像。将感兴趣区域(roi)置于肿瘤上,并将相邻的非肿瘤区域作为背景。计算每个roi的荧光强度(mfi)平均值。通过以下公式由肿瘤的荧光强度和背景的荧光强度计算靶标与背景比(tbr);(肿瘤的荧光强度)
–
(背景的荧光强度)/(背景的荧光强度)。
[0278]
nir-pit
[0279]
将mc38-luc细胞(800万)、ll/2细胞(800万)和moc1细胞(400万)皮下注射到小鼠的背部。选择肿瘤体积达到约150mm3的小鼠,并随机分为4个实验组以进行以下处理:(1)不处理(对照);(2)静脉注射100μg抗cd25-mab-ir700,然后在第0天以100j/cm2的外部nir光照射(靶向cd25的nir-pit);(3)在第0天静脉注射100μg抗cd44-mab-ir700,然后以100j/cm2的外部nir光照射(靶向cd44的nir-pit);(4)静脉注射100μg抗cd25-mab-ir700和100μg抗cd44-mab-ir700(nir-pit联合使用)。
[0280]
对于在nir-pit处理组中荷有mc38-luc肿瘤、ll/2肿瘤和moc1肿瘤的小鼠,分别在肿瘤接种后第5、5和28天静脉注射apc,然后在apc注射后1天以100j/cm2用外部nir光照射。使用红色发光二极管(led)从荷瘤小鼠的目标肿瘤上方照射nir光,该led发射波长为670至710nm(l690-66-60;marubeni america co.),使用光功率计(pm 100,thorlabs)测得的功率密度为50mw/cm2。ir700在约690nm处吸收光。获得治疗前后ir700荧光图像。
[0281]
统计分析
[0282]
定量数据表示为平均值
±
sem。对于多重比较(≥3组),使用单因素方差分析,然后进行tukey-kramer检验。通过kaplan-meier生存曲线分析来分析生存的累积概率,结果采用对数秩检验进行比较。使用jmp 13软件(sas institute,cary,nc)进行统计分析。p值小于0.05被认为具有显著性。
[0283]
实施例11
[0284]
施用抗cd25-mab-ir700后的体内荧光成像
[0285]
注射抗cd25-mab-ir700(apc)1小时后,在mc38-luc、ll/2和moc1中观察到高荧光mfi,所有细胞类型的荧光均逐渐增加,直到注射后24小时(图14a和14b)。与24小时的荧光相比,apc注射后48小时的荧光下降。在所有细胞类型中,抗cd25-mab-ir700的tbr也逐渐增加直至24小时,随后在注射apc后48小时tbr降低(图14c)。apc注射后24小时观察到最高的mfi和tbr;mc38-luc和ll/2肿瘤在mfi和tbr中显示出比moc1肿瘤更高的值(图14b和14c)。
[0286]
这些数据证明了在以下实施例中,apc注射1天后对靶向cd25和/或cd44的nir-pit递送治疗性nir光照的原理。
[0287]
实施例12
[0288]
联合使用靶向cd25和cd44的nir-pit对mc38-luc肿瘤的有效性
[0289]
foxp3
+
cd25
+
cd4
+
treg细胞经常在肿瘤内发现。在几种类型的癌症中,肿瘤浸润淋巴细胞(til)中cd8
+
t细胞与oxp3
+
cd25
+
cd4
+
treg细胞比率降低可能与不良预后相关。使用靶向cd25的nir-pit来消灭肿瘤中浸润肿瘤的treg细胞,而不会消除其他器官中的局部效应细胞或treg细胞,从而通过去除tme中的免疫抑制细胞和随后的肿瘤杀伤来逆转允许的肿瘤微环境(tme),以增强肿瘤导向的nir-pit(以靶向cd44的nir-pit实现)。
[0290]
nir-pit方案和成像方案如图15a所示。注射抗cd25和/或抗cd44-mab-ir700一天后,通过led光将肿瘤暴露于100j/cm2的nir光下。在所有情况下,ir700肿瘤的荧光信号由于死亡细胞的荧光团分散和部分光漂白而降低(图15b)。
[0291]
为了研究nir-pit后的肿瘤杀伤有效性,在nir-pit之前和之后进行生物发光成像(bli),直到第7天(图15c)。根据预处理的rlu(rlu post/rlu pre
×
100=%rlu)定量评估bli为rlu的百分比。bli是评估nir-pit后肿瘤细胞的高灵敏工具,其强度取决于氧、mg
2+
和atp介导的荧光素酶对荧光素的催化作用。
[0292]
在nir-pit处理组中的大多数小鼠中,在nir-pit之后不久,相对光单位%(rlu%)大大降低,然后逐渐增加(图15c)。rlu%变化的这种模式可能是由于大量的初始细胞杀伤,然后是最初未被杀伤的细胞较慢的再生长。相反,在经历以靶向cd25的nir-pit的一些小鼠中以及在联合nir-pit组中,在nir-pit后不久荧光素酶活性大大降低,然后消失(图15c)。这种rlu%变化的模式可能是由于大量的初始细胞杀伤,随后由于免疫应答增强而使处理的肿瘤完全缓解。
[0293]
所有nir-pit处理组的处理后rlu%在nir-pit后的所有时间点均显著低于对照组(p<0.05,tukey-kramer检验)(图15d)。另外,与单独使用靶向cd44的nir-pit相比,联合使用靶向cd25和cd44的nir-pit在nir-pit后7天显示出显著更低的rlu%(p<0.05,tukey-kramer检验)(图15d)。这些数据表明,与单独使用apc相比,联合使用靶向cd25和cd44的nir-pit可以诱导优异的体内肿瘤杀伤作用。与对照组相比,所有nir-pit处理组的肿瘤体积在nir-pit处理后5、7和10天被显著抑制(p<0.05,tukey-kramer检验)(图15e),但与单独
使用靶向cd44的nir-pit相比,联合使用靶向cd25和cd44的nir-pit在nir-pit后7天和10天显示出显著更大的肿瘤减少(p<0.05,tukey-kramer检验)(图15e)。在其他组中未观察到显著的肿瘤抑制作用。
[0294]
这些数据表明,与其他nir光照组相比,联合使用靶向cd25和cd44的nir-pit导致的肿瘤再生速率最慢。与单独使用靶向cd25的nir-pit(p<0.05,对数秩检验)和单独使用靶向cd44的nir-pit(p<0.01,对数秩检验)相比,联合使用靶向cd25和cd44的nir-pit还与nir-pit术后生存时间显著延长有关(图15f)。此外,在联合使用nir-pit组中的14只小鼠中有8只在单轮nir-pit后实现完全缓解。
[0295]
这些结果表明,对于mc38-luc肿瘤,与其他两种类型的nir-pit相比,联合使用靶向cd25和cd44的nir-pit能够实现优异的体内治疗应答。
[0296]
实施例13
[0297]
联合使用靶向cd25和cd44的nir-pit对ll/2肿瘤的有效性
[0298]
nir-pit方案和成像方案如图16a所示。注射抗cd25和/或抗cd44-mab-ir700一天后,将肿瘤暴露于100j/cm2的nir光下。在所有情况下,ir700肿瘤的荧光信号由于死亡细胞的荧光团分散和部分光漂白而降低(图16b)。与对照组相比,在所有nir-pit处理组中,在nir-pit处理后5、7、10和12天的肿瘤体积均被显著抑制(p<0.05,tukey-kramer检验)(图16c)。在三个nir-pit处理组中,与单独使用靶向cd44的nir-pit相比,在nir-pit处理后17天,联合使用靶向cd25和cd44的nir-pit表现出明显更大的肿瘤减少率(p<0.05,tukey-kramer检测)(图16c)。在长期随访中,与单独使用靶向cd25的nir-pit或单独使用靶向cd44的nir-pit相比,联合使用靶向cd25和cd44的nir-pit在nir-pit后的生存率显著延长(p<0.05,对数秩检验)(图16d)。仅在nir-pit单轮处理后,在联合使用nir-pit组中的9只小鼠中有3只实现了肿瘤的完全缓解。
[0299]
因此,在ll/2肿瘤中,联合靶向cd25和cd44的nir-pit在治疗上优于其他2种类型nir-pit。
[0300]
实施例14
[0301]
联合使用靶向cd25和cd44的nir-pit对moc1肿瘤的有效性
[0302]
nir-pit方案和成像方案如图17a所示。注射抗cd25和/或抗cd44-mab-ir700一天后,将肿瘤暴露于100j/cm2的nir光下。ir700肿瘤的荧光信号由于死亡细胞的荧光团分散和部分光漂白而降低(图17b)。与对照组相比,在所有nir-pit处理组中,肿瘤体积在nir-pit后的所有时间点均被显著抑制(p<0.05,tukey-kramer检验)(图17c)。与靶向cd44的nir-pit相比,联合使用靶向cd25和cd44的nir-pit在nir-pit后28天显示出明显更大的肿瘤减少率(p<0.05,tukey-kramer检验)。
[0303]
在长期随访中,与靶向cd44的nir-pit相比,联合使用靶向cd25和cd44的nir-pit表现出显著生存率增加(p<0.05,对数秩检验)(图17d)。另一方面,单独使用靶向cd25的nir-pit与单独使用靶向cd44的nir-pit之间,以及单独使用靶向cd25的nir-pit与联合使用nir-pit之间的肿瘤体积和生存率无显著差异(p>0.05,tukey-kramer检验)(图17d)。联合使用nir-pit组中的9只小鼠中的一只在单轮nir-pit后实现完全缓解。因此,在moc1肿瘤中,联合使用靶向cd25和cd44的nir-pit在治疗上优于其他两种nir-pit。
[0304]
实施例15
[0305]
治疗肿瘤的方法
[0306]
在一个实施例中,将抗体-ir700分子(诸如抗cd44-ir700)和免疫调节剂(诸如抗pd1抗体、抗pd-l1抗体或抗cd25-ir700)施用给患有肿瘤的受试者(第1天),诸如患有癌症的受试者。然后在约24小时后用50j/cm
2 nir光照射受试者(第2天),并任选在第一次照射后24小时(第3天)以100j/cm
2 nir光照射。还在第3、5和7天以相同或不同(例如,较低)剂量向受试者施用免疫调节剂。
[0307]
定期监测受试者的肿瘤大小(诸如肿瘤重量或体积)减小、转移瘤的大小或数量减少和/或生存率(诸如总体生存率、无进展生存率和/或无疾病生存率)。
[0308]
鉴于可以将本公开的原理应用于其的许多可能的实施方式,应当认识到,示出的实施方式仅是本公开的实施例,不应被视为对本发明范围的限制。相反,本发明的范围由所附权利要求书限定。因此,我们要求保护落入这些权利要求的范围和精神内的所有内容作为我们的发明。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签:
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



