葡萄糖醛酸甘露寡糖的关键二糖重复单元及其制备方法与流程
 2021-02-02 08:02:39|
2021-02-02 08:02:39| 374|
374| 起点商标网
起点商标网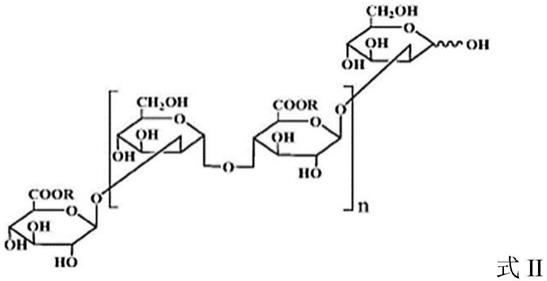
[0001]
本发明属于糖合成领域,涉及一种葡萄糖醛酸甘露寡糖的关键二糖重复单元的结构式及其制备方法。
技术背景
[0002]
葡萄糖醛酸甘露寡糖是由4-连接的葡萄糖醛酸和2-连接的甘露糖或其盐交替连接形成的,不仅对老年痴呆和帕金森病具有显著的神经保护作用,可以用于制备预防和治疗神经退行性疾病的药物和保健品(授权号:cn103800348b),也可以用于制备预防和治疗急性肾衰、慢性肾衰、糖尿病肾病、肾小球肾炎等肾脏疾病的药物和保健品(授权号: cn105125566b)。
[0003]
葡萄糖醛酸甘露寡糖为如下结构式:
[0004][0005]
式中,r为h、na或k中的一种或两种以上,n为0-8之间的整数。
[0006]
目前,如式ii所述的葡萄糖醛酸甘露寡糖依靠实验室从海带中分离得到,操作步骤繁琐产率极低,不能满足实际生产需要,是制约其开展成药性评价的技术瓶颈。因此,发展高效、可控、简便的化学合成方法对葡萄糖醛酸甘露寡糖候选药物的研究开发具有重要的意义和实际需求。
技术实现要素:
[0007]
本发明就是针对上述问题,提供葡萄糖醛酸甘露寡糖的关键二糖重复单元的骨架结构及其制备方法,其在化学合成法合成葡萄糖醛酸甘露寡糖中起关键作用。
[0008]
为了实现本发明的上述目的,本发明采用如下技术方案:
[0009]
一种由d-葡萄糖和d-甘露糖合成的葡萄糖醛酸甘露寡糖的关键二糖重复单元的骨架结构,其结构式如下:
[0010][0011]
结构式(i)中r1为硫苷、氧苷或卤素原子中的一种;r2为乙酰基(ac)、2-萘基甲基 (nap)、苄基(bn)、苯甲酰基(bz)、烯丙基(all)、乙酰丙基(lev)或对甲氧苄基 (pmb)中的一种或两种以上;r3为乙酰基(ac)、苄基(bn)、苯甲酰基(bz)、苯亚甲基、对甲氧基中的一种或两种以上;r4为苄基(bn)、苯甲酰基(bz)、乙酰基(ac) 中的一种或两种以上;r5为氢、硅基、对甲氧苄基(pmb)中的一种;r6为烷基、芳基或杂环中的一种或两种以上。其中,r5应与其他保护基不同。所述的杂环指的是分子中含有杂环结构的化合物,因为凡是可以在有机合成中使用的杂环都适用本发明,因此无需规定杂环的类别。
[0012]
结构式(i)所述的葡萄糖醛酸甘露寡糖的关键二糖重复单元的骨架结构的制备方法,其为下述任一方法(1)或(2)的一种:
[0013]
方法(1)包括的步骤:
①
以d-葡萄糖为原料,经保护基操作空出4位、6位羟基,选择性氧化6位伯羟基成羧酸后,对羧酸进行保护基操作;
②
对4位羟基以硅基保护后,异头位羟基以三氯乙酰亚胺酯或三氟乙酰亚胺酯活化成为糖基给体1;
③
以d-甘露糖为原料,经保护基操作空出2位羟基成为糖基受体2;
④
在溶剂和脱水剂的存在下,添加促进剂使糖基给体和糖基受体在-40~0℃反应1~48小时,得到葡萄糖醛酸甘露寡糖的关键二糖重复单元的骨架结构(i)。
[0014]
或方法(2)包括的步骤:
①
以d-葡萄糖为原料,经保护基操作空出4位、6位羟基,选择性保护6位伯羟基;
②
对4位羟基以硅基保护,异头位羟基以三氯乙酰亚胺酯或三氟乙酰亚胺酯活化成为糖基给体3;
③
以d-甘露糖为原料,经保护基操作空出2位羟基成为糖基受体2;
④
在溶剂和脱水剂的存在下,添加促进剂使糖基给体3和糖基受体2 在-40~0℃反应1~48小时,得到二糖4;
⑤
将二糖4的6位伯羟基选择性氧化为羧酸,即为葡萄糖醛酸甘露寡糖的关键二糖重复单元的骨架结构(i)。
[0015]
保护基是在糖合成中使用的术语,由于糖分子中有多个羟基及羰基,当需要进行选择性反应时,其他的羟基或羰基就必须进行封锁,即保护和脱保护,这个过程即是保护基操作,是没有特指的合成步骤,只要能实现后面的“空出4位、6位羟基”以及“空出2位羟基”即可。
[0016]
其中,
[0017]
所述的硅基为甲基、乙基、异丙基、叔丁基、苯基等构成的三取代硅基;优选的是叔丁基二甲基硅基(tbs)或三乙基硅基(tes)或叔丁基二苯基硅烷基(tbdps)或二乙基异丙基硅基(deips)。
[0018]
所述的保护基操作为常规保护基操作。
[0019]
所述的溶剂为二氯甲烷、乙腈、乙醚、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、1,4
-ꢀ
二氧六环、吡啶、甲苯、四氢呋喃的一种或多种。
[0020]
所述的脱水剂为分子筛或aw-300分子筛中的一种或多种。
[0021]
所述的促进剂为催化量的路易斯酸或质子酸。优选的是三甲基硅基三氟甲磺酸酯 (tmsotf)或三乙基硅基三氟甲磺酸酯(tesotf)或叔丁基二甲基硅基三氟甲磺酸酯 (tmsotf)或三氟甲磺酸(hotf)。
[0022]
所述的糖苷化反应的反应温度为-20~0℃,反应时间为0.5~48小时。优选的是首先在-20℃反应0.5~3小时,缓慢升温至0℃,升温过程持续1~48小时。
[0023]
所述的糖基给体1或3与糖基受体2的摩尔比为(1.0-5.0):1.0;所述的糖基给体1或3与脱水剂的质量比为1.0:(3.0-10.0)。
[0024]
所述的6位伯羟基选择性氧化,推荐使用tempo氧化,其他条件为常规条件。
[0025]
所述的结构式(i)在葡萄糖醛酸甘露寡糖糖链延伸中的应用,指结构式(i)既可用做葡萄糖醛酸甘露寡糖的二糖给体5,亦可做葡萄糖醛酸甘露寡糖的二糖受体6。
[0026]
所述的结构式(i),当r1为三氯乙酰亚胺酯或三氟乙酰亚胺酯且r2、r3、r4、r5和r6均不为氢时,其为葡萄糖醛酸甘露寡糖的二糖给体5;当仅r5为氢时其为葡萄糖醛酸甘露寡糖的二糖受体6。
[0027]
所述的二糖给体5和二糖受体6通过常规糖苷化反应即可得到葡萄糖醛酸甘露寡四糖7。
[0028]
同样地,葡萄糖醛酸甘露寡四糖7经过相同的改造可成为新的糖基给体和受体。
[0029]
所述糖苷化反应,优选的是给体经三氯乙酰亚胺酯或三氟乙酰亚胺酯活化。
[0030]
本发明中的制备方法推荐在惰性气体保护下进行,如氩气、氮气、氦气等。
[0031]
本发明的优点:
[0032]
1.所述的结构式(i)在葡萄糖醛酸甘露寡糖糖链延伸中具有方便的应用。通过常规保护基操作脱除r5硅基后,结构式(i)即可用作糖基受体,而r6经过活化后,结构式(i)即可用做作糖基给体。
[0033]
2.所述结构式(i)以及通过糖链延伸获得的葡萄糖醛酸甘露寡糖,在常规保护基操作下脱除所有保护基时,已报道其可具有神经保护和肾保护的作用。
具体实施方式
[0034]
下面结合具体实施例,进一步阐述本发明。需要指出的是本发明合成路线对二糖重复单元骨架结构中的羟基进行选择性保护时,选用了比较经典的r1、r2、r3、r4、r5和r6取代基。本领域的普通技术人员在阅读了本说明书后,按照实施例的操作方法很容易获得其他r1(如任意连接臂)、r2、r3、r4、r5和r6(如任意烷基、芳基或杂环)取代的化合物,这些都是本领域技术人员无需付出任何创造性劳动即可实现的,所以本发明的保护范围不仅局限于实施例公开的范围。
[0035]
实施例1葡萄糖醛酸糖基给体的合成:
[0036]
[0037]
试剂和条件:a)tolsh,bf3·
et2o,ch2cl2,0℃ to r.t.,12h,88%;meona,meoh-ch2cl2,1 h,98%;phch(och3)2,ch3cn,r.t.,12h,82%;b)bzcl,dmap,py,r.t.,1h,86%;c)tsoh, ch2cl
2-meoh,r.t.,12h,90%;d)
→
e)tempo,baib,ch2cl
2-h2o,0℃ to 3℃,4 h
→
k2co3,mei,dmf,0℃ to r.t.,12h,63%;f)tbsotf,2,6-lutidine,ch2cl2,0℃ to r.t.,4 h,88%;g)nis,tfa,ch2cl
2-h2o,0℃ to r.t.,2h,86%,then dbu,ccl3cn,ch2cl2,20℃, 2h,93%.
[0038]
具体实验和数据:
[0039]
(1)p-tolyl 4,6-o-benzoylidene-1-thio-β-d-glucopyranoside 2:常规合成方法从d-葡萄糖得到化合物2。1h nmr(500mhz,cdcl3):δ7.47-7.33(m,7h),7.13(d,j=8.0hz, 2h),5.48(s,1h),4.51(d,j=9.6hz,1h),4.35-4.31(m,1h),3.79-3.70(m,2h),3.47-3.27 (m,4h),3.02(s,1h),2.34(s,3h);
13
c nmr(126mhz,cdcl3):δ139.0,137.2,133.8,130.2, 129.6,128.6,127.7,126.6,102.2,88.9,80.5,74.8,72.8,70.3,68.8,53.8,21.5.
[0040]
(2)p-tolyl 2,3-di-o-benzoyl-4,6-o-benzoylidene-1-thio-β-d-glucopyranoside 3:将化合物2 (3.6g,9.61mmol)溶于干燥过的吡啶(50ml)中,冰浴下加入dmap(586mg,0.5当量),然后逐滴加入bzcl(4.5ml,4.0当量)。反应体系在室温下搅拌反应1小时,至tlc显示反应完全,然后蒸干吡啶,二氯甲烷转移后,用1m盐酸萃取,萃取液再用饱和nahco3萃取后,用无水硫酸钠干燥。抽滤旋干后,用乙醇重结晶,得白色固体3(5.0g,89%)。1h nmr(500mhz,cdcl3):δ=7.96-7.07(m,19h),5.72(t,j=9.3hz,1h),5.49(s,1h), 5.37(t,j=9.3hz,1h),4.90(d,j=9.3hz,1h),4.42(dd,j=4.5,10.2hz,1h),3.83(m,2h), 3.71(m,1h),2.35(s,3h)ppm.
13
c nmr(126mhz,cdcl3):δ=165.4,164.9,138.6,136.8, 134.2(2),133.2,133.0,130.0(2),129.7(2),129.6(2),129.5,129.0,128.4(2),128.3(2),128.1 (2),127.9(2),126.2(2),101.6,87.1,78.7,73.4,71.1,71.0,68.6,21.3.
[0041]
(3)p-tolyl 2,3-di-o-benzoyl-1-thio-β-d-glucopyranoside 4:将化合物3(3.35g,5.75mmol) 溶于2:1的二氯甲烷-甲醇溶液(24ml)中,冰浴下加入tsoh
·
h2o(546.8mg,0.5当量),反应体系在室温下搅拌过夜反应。然后加入三乙胺(400μl,0.5当量)淬灭反应,减压浓缩,硅胶柱层析(二氯甲烷/乙酸乙酯=5:1)得到浅黄色固体4(2.6g,90%)。1h nmr(500 mhz,cdc13),δ=7.97(dd,j=1.3,8.2hz,2h),7.94(dd,j=1.5,8.1hz,2h),7.49-7.55(m,2h), 7.34-7.41(m,6h),7.11(d,j=7.8hz,2h),5.37-5.43(m,2h),5.16(t,j=6.8hz,1h),4.89(d, j=9.6hz,1h),4.01(ddd,j=3.3,5.8,11.9hz,1h),3.85-3.94(m,2h),3.60(ddd,j=3.3,4.8, 9.5hz,1h),3.23(d,j=4.8hz,1h),2.34(s,3h);
13
c nmr(126mhz,cdc13),δ=167.80, 165.46,138.94,133.83,133.77,133.56,130.21,130.03,129.52,129.01,128.68,128.63, 128.18,86.44,80.24,78.63,70.42,70.05,62.64,21.39.
[0042]
(4)p-tolyl methyl(2,3-di-o-benzoyl-1-thio-β-d-glucopyranosyluronate)6:将化合物4 (2.6g,5.26mmol)溶于3:1的二氯甲烷-水溶液(44ml)中,冰浴下加入tempo(123mg, 0.15当量)和baib(3.4g,2当量),反应体系在室温下搅拌反应至tlc(石油醚/乙酸乙酯=1:1.6)显示反应完全。反应液用饱和na2s2o3淬灭反应,萃取,收集有机相,经无水硫酸钠干燥抽滤,然后油泵抽干后,加入dmf(35ml)溶解,依次加入mei(982μl,3.0 当量)和k2co3(2.2g,3.0当量),反应液在室温下搅拌过夜反应后,等量的1m nacl和水萃取后,经无
水硫酸钠干燥抽滤,减压浓缩,硅胶柱层析(石油醚/二氯甲烷/乙酸乙酯=4:1:1)得到化合物6(1.7g,63%)。1h nmr(500mhz,cdcl3)δ8.12-7.88(m,4h), 7.68-7.30(m,8h),7.12(d,j=7.9hz,2h),5.54(t,j=9.3hz,1h),5.40(q,j=9.7,8.6hz,1h), 4.90(d,j=10.0hz,1h),4.20-4.01(m,2h),3.88(s,3h),2.34(s,3h).
[0043]
(5)p-tolyl methyl[2,3-di-o-benzoyl-4-o-(tert-butyldimethyl silyl)-1-thio-β-d-glucopyranosyluronate]7:将化合物6(1.7g,5.26mmol)溶于无水二氯甲烷(16ml)中,冰浴下依次加入tbsotf(2.2ml,3.0当量)和2,6-lutidine(2.2ml,6.0当量),室温下反应4小时后,用二氯甲烷稀释,用1m盐酸溶液和3倍体积的水萃取,收集有机相,经无水硫酸钠干燥抽滤,减压浓缩,硅胶柱层析(石油醚/乙酸乙酯=15:1)得到化合物7(1.8g,88%)。1h nmr(500mhz,cdcl3)δ8.12-8.02(m,4h),7.68-7.30(m,8h), 7.13(d,j=7.5hz,2h),5.54(t,j=9.3hz,1h),5.40(q,j=9.7,8.6hz,1h),4.20-4.01(m,2h), 3.23(t,j=10.1hz,1h),3.88(s,3h),2.34(s,3h),1.63(s,3h),0.74(s,9h),0.01(s,3h).
[0044]
(6)methyl[2,3-di-o-benzoyl-4-o-(tert-butyldimethyl silyl)-β-d-glucopyranosyluronate trichloroacetimidate]8:将化合物7(1.8g,2.82mmol)溶于10:1的二氯甲烷-水溶液(46ml) 中,冰浴下依次加入tfa(230μl,1.1当量)和nis(1.6g,2.5当量),室温下反应2小时后,依次用饱和na2s2o3、饱和nahco3溶液洗涤,收集有机相,经无水硫酸钠干燥抽滤,减压浓缩,硅胶柱层析(石油醚/乙酸乙酯=4:1)得到水解产物(1.3g,86%)。向水解产物中加入无水二氯甲烷(36ml)溶解,冰浴下依次加入dbu(2188μl,0.5当量)和 ccl3cn(1.3ml,5.0当量),反应体系在20℃搅拌反应2小时后,tlc检测反应完全。蒸干溶剂,硅胶柱层析(石油醚/乙酸乙酯=8:1)得到化合物8(1.5g,93%)。1h nmr(500 mhz,cdcl3)δ8.62(s,1h),8.12-8.02(m,4h),7.68-7.30(m,6h),6.56(d,j=3.8hz,1h), 5.83(q,j=9.7,8.6hz,1h),4.20-4.01(m,2h),3.23(t,j=10.1hz,1h),3.88(s,3h),1.61(s, 3h),0.74(s,9h),0.01(s,3h).
[0045]
实施例2葡萄糖醛酸甘露二糖11的合成
[0046][0047]
试剂与条件:h)tolsh,bf3·
et2o,ch2cl2,0℃ to r.t.,12h,89%;meona,meoh-ch2cl2, 1h,98%;phch(och3)2,ch3cn,r.t.,12h,83%;i)bu2sno,phme,110℃,3h,then napbr, csf,dmf,100℃,4h,90%;j)tmsotf(0.2eq),ch2cl2,ms,-20℃
→
0℃,64%.
[0048]
(1)p-tolyl 4,6-o-benzoylidene-1-thio-α-d-mannopyranoside 9:常规合成方法从d-甘露糖得到化合物9。1hnmr(500mhz,cdcl3):δ7.48-7.35(m,7h),7.15(d,j=8.0hz,2h), 5.65(s,1h),5.61(d,j=1.5hz,2h),4.35-4.31(m,2h),4.22(dd,j=12.8,5.81hz,
2h),4.03 (dd,j=9.5,3.0hz,1h),3.87(t,j=10.2hz,1h),2.89(s,1h),2.34(s,3h).
[0049]
(2)p-tolyl 3-o-(2-methylnaphthyl)-4,6-o-benzoylidene-1-thio-α-d-mannopyranoside 10:向化合物9(1.2g,3.2mmol)中加入甲苯(20ml)和bu2sno(960mg,1.2当量),110℃回流反应3小时,然后冷却至室温,减压整除甲苯,将得到的固体物质溶于dmf(18ml) 中,加入csf(973mg,2.0当量)和napbr(853mg,1.2当量),100℃反应4小时后,tlc 检测但应完全。油泵抽除dmf,依次用饱和nahco3、饱和nacl洗涤,收集有机相用无水硫酸钠干燥抽滤,减压浓缩,硅胶柱层析(石油醚/乙酸乙酯=4:1)得到化合物10 (1.48g,90%)。1h nmr(500mhz,cdcl3)δ7.89-7.71(m,4h),7.58-7.19(m,12h),5.65(s, 1h),5.60(d,j=1.5hz,1h),5.03(d,j=12.1hz,1h),4.94(d,j=12.1hz,1h),4.39-4.32(m, 2h),4.22(dd,j=12.6,5.8hz,1h),4.03(dd,j=9.5,3.0hz,1h),3.87(t,j=10.3hz,1h),2.34 (s,3h),2.89(s,1h).
[0050]
(3)p-tolyl 2-o-{methyl[2,3-di-o-benzoyl-4-o-(tert-butyldimethyl silyl)-β-d-glucopyranosyluronate]}-3-o-(2-methylnaphthyl)-4,6-o-benzoylidene-1-thio-α-d
-ꢀ
mannopyranoside 11:向装有火焰干燥的新活化分子筛的两口反应瓶中加入糖基给体 8(1.5g,2.22mmol,1.2当量)与受体10(960mg,1.85mmol,1.0当量),氩气置换,加入新蒸二氯甲烷(30ml)溶解,室温搅拌30分钟后转至-20℃中预冷30分钟,滴加tmsotf (35μl,1.0当量),低温搅拌30分钟后,缓慢升温至0℃,滴加三乙胺淬灭反应,用硅藻土抽滤,滤液经减压浓缩旋干,硅胶柱层析(石油醚/乙酸乙酯=7:1)得到化合物11(1.48g, 90%)。1h nmr(500mhz,cdcl3)δ7.97-7.91(m,2h),7.86-7.76(m,6h),7.55-7.44(m, 8h),7.40-7.34(m,5h),7.32-7.24(m,3h),7.08-6.99(m,4h),5.60(dd,j=9.7,8.8hz,1h), 5.56-5.45(m,2h),4.94-4.83(m,3h),4.45-4.36(m,2h),4.19-4.01(m,3h),3.92(dd,j=9.8, 3.1hz,1h),3.86(dd,j=10.3,4.6hz,1h),3.74(s,3h),3.47(t,j=10.1hz,1h),2.34(s,3h), 1.61(s,3h),0.74(s,10h).
13
c nmr(126mhz,cdcl3)δ170.06,164.92(2),138.20,137.67, 135.58,134.95,133.67,133.40,133.07,133.05,130.08,130.02,129.77,129.41,129.19, 129.01,128.62,128.46,128.28,128.19,128.12,127.75,126.78,126.42,126.34,126.07, 125.88,125.68,101.71,98.57,88.62,78.65,77.41,77.16,76.91,74.77,73.33,72.96,72.50, 72.14,71.79,69.61,68.60,65.72,52.38,25.62,21.25,17.86,2.0.
[0051]
实施例3“先糖苷化后氧化”策略合成葡萄糖醛酸甘露二糖11
[0052]
糖基给体的合成路线如下所示:
[0053][0054]
试剂与条件:
[0055]
(1)p-tolyl 2,3-di-o-benzoyl-4,6-o-p-methoxybenzylidene-1-thio-β-d-glucopyranoside 34: 向化合物3(2.5g,4.2mmol)加入新鲜活化的分子筛(6.0g)及干燥的二氯甲烷(85ml) 中,冰浴下加入三乙基硅烷(2.04ml,3.0当量)和三氟乙酸(942μl,3.0当量),反应体系在室温下搅拌过夜反应。反应液经硅藻土过滤,所得滤液依次用饱和nahco3、饱和 nacl洗涤。收集有机相经无水硫酸钠干燥抽滤,减压浓缩,硅胶柱层析(甲苯/
乙酸乙酯=4:1)得到化合物34(2.2g,90%)。1h nmr(400mhz,cdc13),δ7.97(dd,j=1.3,8.2hz, 2h),7.94(dd,j=1.5,8.1hz,2h),7.55-7.49(m,2h),7.46-7.32(m,11h),7.11(d,j=7.8hz, 2h),5.37-5.43(m,2h),5.16(t,j=6.8hz,1h),4.86-4.75(m,2h),3.85-3.94(m,2h),3.62(t, 1h),3.23(d,j=4.7hz,1h),2.34(s,3h);
13
c nmr(126mhz,cdc13),δ167.80,165.46, 138.94,138.93,133.83,133.77,133.56,130.21,130.03,129.52(4),129.01(2),128.68(2), 128.65(2),128.63(2),128.18(2),127.8,127.4(2),86.44,80.24,78.63,73.3,70.42,70.05, 62.64,21.39.
[0056]
(2)p-tolyl 2,3-di-o-benzoyl-4-o-(tert-butyldimethyl silyl)-6-o-p-methoxybenzyl-1-thio-β-d-glucopyranoside 35:将化合物34(2.2g,3.76mmol) 溶于无水二氯甲烷(20ml)中,冰浴下依次加入tbsotf(2.6ml,3.0当量)和 2,6-lutidine(2.6ml,6.0当量),室温下反应4小时后,用二氯甲烷稀释,用1m盐酸溶液和3倍体积的水萃取,收集有机相,经无水硫酸钠干燥抽滤,减压浓缩,硅胶柱层析 (石油醚/乙酸乙酯=13:1)得到化合物35(2.34g,89%)。1h-nmr(500mhz,cdc13),δ 7.97(dd,j=1.3,8.2hz,2h),7.94(dd,j=1.5,8.1hz,2h),7.55-7.49(m,2h),7.46-7.32(m, 11h),7.11(d,j=7.8hz,2h),5.37-5.43(m,2h),5.16(t,j=6.8hz,1h),4.82(m,1h), 3.85-3.94(m,2h),3.62(t,1h),3.23(d,j=4.7hz,1h),2.34(s,3h),1.63(m,4h),0.74(s, 9h),0.01(s,3h).
[0057]
(3)2,3-di-o-benzoyl-4-o-(tert-butyldimethyl silyl)-6-o-p-methoxybenzyl-1-thio-β-d-glucopyranosyl trichloroacetimidate 36:将化合物35 (2.3g,3.3mmol)溶于10:1的二氯甲烷-水溶液(53ml)中,冰浴下依次加入tfa(270μl, 1.1当量)和nis(1.9g,2.5当量),室温下反应2小时后,依次用饱和na2s2o3、饱和nahco3溶液洗涤,收集有机相,经无水硫酸钠干燥抽滤,减压浓缩,硅胶柱层析(石油醚/乙酸乙酯=4:1)得到水解产物(1.73g,88%)。向水解产物中加入无水二氯甲烷(42ml)溶解,冰浴下依次加入dbu(2605μl,0.5当量)和ccl3cn(1.5ml,5.0当量),反应体系在20℃搅拌反应2小时后,tlc检测反应完全。蒸干溶剂,硅胶柱层析(石油醚/乙酸乙酯=8:1) 得到化合物36(2.15g,93%)。1h-nmr(500mhz,cdc13),δ8.56(s,1h),7.96-7.93(m, 4h),7.55-7.49(m,2h),7.47-7.35(m,9h),5.37-5.43(m,2h),5.16(t,j=6.8hz,1h),4.82(m, 1h),3.85-3.94(m,2h),3.62(t,1h),3.23(d,j=4.7hz,1h),2.34(s,3h),1.63(m,4h),0.74 (s,9h),0.01(s,3h).
[0058]
葡萄糖醛酸甘露二糖11的合成路线如下所示:
[0059][0060]
(1)p-tolyl 2-o-[2,3-di-o-benzoyl-4-o-(tert-butyldimethyl silyl) 6-o-p-methoxybenzyl-1-thio-β-d-glucopyranoside]-3-o-(2-methylnaphthyl)-4,6-o-benzoylid ene-1-thio-α-d-mannopyranoside 106:向装有火焰干燥的新活化分子筛的两口反应瓶中加入糖基给体36(1.5g,2.0mmol,1.0当量)与受体10(1.0g,2.0mmol,1.0当量),氩气保护下加入新蒸二氯甲烷(32ml)溶解,室温搅拌30分钟后转至0℃中预冷30分钟,
滴加 bf3·
et2o(50μl,0.2当量),低温搅拌30分钟后,tlc检测受体反应完全。滴加三乙胺淬灭反应,用硅藻土抽滤,滤液经减压浓缩旋干,硅胶柱层析(石油醚/乙酸乙酯=5:1) 得到化合物106(1.78g,82%)。1h nmr(500mhz,cdcl3)δ7.97-7.91(m,2h),7.86-7.76(m, 6h),7.55-7.44(m,8h),7.40-7.34(m,5h),7.32-7.24(m,5h),7.08-6.99(m,4h),6.93-6.89 (m,2h),5.60(dd,j=9.7,8.8hz,1h),5.56-5.45(m,2h),4.94-4.83(m,3h),4.45-4.36(m, 3h),4.19-4.01(m,3h),3.92(dd,j=9.8,3.1hz,1h),3.86-3.80(m,2h),3.74(s,3h),3.47(t, j=10.1hz,1h),2.34(s,3h),2.25(s,3h),1.60(s,2h),0.73(s,10h).
[0061]
(2)p-tolyl 2-o-[2,3-di-o-benzoyl-4-o-(tert-butyldimethyl silyl)-1-thio-β-d-glucopyranoside]-3-o-(2-methylnaphthyl)-4,6-o-benzoylidene-1-thio-α-d
-ꢀ
mannopyranoside 107:向化合物106(1.78g,1.63mmol)中加入tfa(1.8ml,17.0当量) 和乙酸酐(7.0ml,50.0当量),室温下反应1.5小时后,用二氯甲烷稀释,依次用水、饱和nahco3、饱和nacl洗涤,收集有机相,经无水硫酸钠干燥抽滤,减压浓缩,硅胶柱层析(石油醚/二氯甲烷/乙酸乙酯=6:1:1)得到化合物107(1.45g,89%)。1h nmr(500 mhz,cdcl3)δ8.03-7.99(m,4h),7.86-7.76(m,6h),7.45-7.38(m,6h),7.40-7.34(m,3h), 7.32-7.24(m,3h),7.23-6.99(m,4h),5.60(dd,j=9.7,8.8hz,1h),5.56-5.45(m,2h), 4.94-4.83(m,3h),4.45-4.36(m,4h),4.19-4.01(m,3h),3.92(dd,j=9.8,7.5hz,1h),3.86 (dd,j=10.3,4.6hz,1h),3.57-3.51(m,2h),2.32(s,3h),1.58(s,3h),0.72(s,10h).
[0062]
(3)p-tolyl 2-o-{methyl[2,3-di-o-benzoyl-4-o-(tert-butyldimethylsilyl)-β-d-glucopyranosyluronate]}-3-o-(2-methylnaphthyl)-4,6-o-benzoylidene-1-thio-α-d
-ꢀ
mannopyranoside 11:将化合物107(1.45g,1.45mmol)溶于4:1的乙腈-水溶液(12ml)中,冰浴下加入tempo(45mg,0.2当量)和baib(1.17g,2.5当量),反应体系在室温下搅拌反应至tlc(石油醚/二氯甲烷/乙酸乙酯=6:1:1)显示反应完全。反应液用饱和na2s2o3淬灭反应,萃取,收集有机相,经无水硫酸钠干燥抽滤,然后油泵抽干后,加入dmf(10 ml)溶解,依次加入mei(270μl,3.0当量)和k2co3(601mg,3.0当量),反应液在室温下搅拌过夜反应后,等量的1m nacl和水萃取后,经无水硫酸钠干燥抽滤,减压浓缩,硅胶柱层析(石油醚/乙酸乙酯=6:1)得到化合物11(1.04g,70%)。
[0063]
实施例4葡萄糖醛酸甘露二糖11的放大化制备
[0064]
将新活化后的分子筛加入四口瓶中火焰干燥后,冷却至室温备用。向其中加入三氟乙酰亚胺酯活化后的糖基给体(5g)和糖基受体10(4.4g),加毕真空干燥,氮气置换,加入二氯甲烷(80ml),室温搅拌30分钟后降温至-20℃搅拌30分钟备用。向其中加入 tmsotf(258μl),反应两小时后后-20℃慢慢回温至0℃搅拌过夜,次日用三乙胺淬灭反应,硅胶柱层析(石油醚/乙酸乙酯=6:1)得到化合物11(3.5g,64%)
[0065]
实施例5葡萄糖醛酸甘露四糖的合成
[0066]
化合物11经简单保护基操作,即可用于葡萄糖醛酸甘露四糖的合成,具体步骤如下:
[0067][0068]
试剂与条件:k)tbaf,hoac,thf,70℃,12h,85%;l)nis,tfa,ch2cl
2-h2o,0℃ to r.t., 3h,85%,then dbu,ccl3cn,ch2cl2,20℃,3h,90%.m)bf3·
oet2(0.2eq),ch2cl2,ms, 0℃,78%.
[0069]
(1)p-tolyl 2-o-[methyl (2,3-di-o-benzoyl-β-d-glucopyranosyluronate)]3-o-(2-methylnaphthyl)-4,6-o-benzoylidene
ꢀ-
1-thio-α-d-mannopyranoside 13:向化合物11(1g,1.0mmol)中加入四氢呋喃(65ml) 溶解,冰浴下加入乙酸(345μl,6.0当量)搅拌10分钟后,加入tbaf(946mg,3.0当量),升温至70℃回流反应12小时。蒸干四氢呋喃后用二氯甲烷稀释,水萃取反应液,收集有机相用无水硫酸钠干燥抽滤,减压浓缩,硅胶柱层析(石油醚/乙酸乙酯=2:1)得到化合物13(772mg,85%)。1h nmr(500mhz,cdc13)δ8.06-7.96(m,2h),7.94-7.73(m,6h), 7.61-7.27(m,14h),7.02(d,j=1.8hz,4h),5.64-5.51(m,3h),5.03-4.88(m,2h),4.84(d, j=6.9hz,1h),4.41(dd,j=3.1,1.6hz,1h),4.35-4.23(m,1h),4.21-4.02(m,3h),3.90(ddd, j=34.0,10.1,3.8hz,2h),3.75(s,3h),3.51(t,j=10.2hz,1h),2.34(s,3h),1.57-1.17(m, 5h).
[0070]
(2)2-o-{methyl[2,3-di-o-benzoyl-4-o-(tert-butyldimethyl silyl)-β-d-glucopyranosyluronate]}3-o-(2-methylnaphthyl)-4,6-o-benzoylidene-α-d-mannop yransyl trichloroacetimidate 14:化合物11(1g,1.0mmol)的三氯乙酰亚胺酯活化反应与前述操作相同,两步反应得化合物14(820mg,77%)。1h nmr(500mhz,cdcl3)δ8.43(s, 1h),8.02-7.94(m,2h),7.93-7.46(m,14h),7.40-7.28(m,8h),5.60(dd,j=9.7,8.8hz,1h), 5.56-5.45(m,2h),4.95-4.83(m,3h),4.45-4.36(m,2h),4.19-4.01(m,3h),3.92(dd,j=9.8, 3.1hz,1h),3.86(dd,j=10.3,4.6hz,1h),3.74(s,3h),3.47(t,j=10.1hz,1h),1.62(s,3h), 0.73(s,10h).
[0071]
(3)p-tolyl 2-o-{methyl(2,3-di-o-benzoyl-4-o-[2-o-(methyl (2,3-di-o-benzoyl-β-d-glucopyranosyluronate)]-3-o-(2-methylnaphthyl)-4,6-o-benzoyliden e-α-d-mannopyransyl]-β-d-glucopyranosyluronate)}3-o-(2-methylnaphthyl)-4,6-o-benzoyli dene-1-thio-α-d-mannopyranoside 15:向装有火焰干燥的新活化分子筛的两口反应瓶中加入糖基给体14(800mg,0.75mmol,1.0当量)与受体13(684mg,0.75mmol,1.0当量),氩气置换后,加入新蒸二氯甲烷(12ml)溶解,室温搅拌30分钟后转至0℃中,滴加bf3·
oet
2 (19μl,0.2当量),继续搅拌1小时后,tlc显示反应完全,滴加三乙胺淬灭反应,用硅藻土抽滤,滤液经减压浓缩旋干,硅胶柱层析(石油醚/乙酸乙酯=4:1)得到化合物15
(1.0g, 78%)。1h nmr(500mhz,cdcl3)δ8.04-7.97(m,8h),7.99-7.90(m,6h),7.89-7.85(m, 2h),7.82-7.65(m,16h),7.55-7.44(m,2h),7.40-7.34(m,10h),7.23-7.09(m,4h),6.02(m, 2h),5.60(dd,j=9.7,8.9hz,1h),5.56-5.45(m,4h),4.94-4.83(m,5h),4.72(m,4h),4.62 (dd,j=7.5,7.9hz,1h),4.45-4.32(m,5h),4.19-4.01(m,4h),3.9(m,2h),3.92(dd,j=9.8, 3.1hz,1h),3.86(dd,j=10.3,4.6hz,1h),3.78(s,3h),3.74(s,3h),2.28(s,3h),1.62(s, 6h),0.74(s,9h).
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



