一种在苯胺衍生物对位引入吩噁嗪/吩噻嗪官能团的方法与流程
 2021-02-02 07:02:45|
2021-02-02 07:02:45| 322|
322| 起点商标网
起点商标网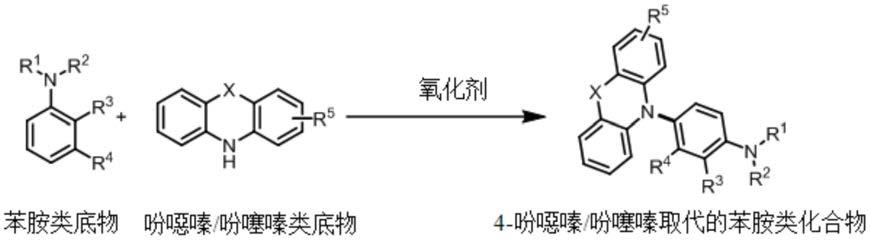
[0001]
本发明属于有机合成技术领域,具体涉及一种在苯胺衍生物对位引入吩噁嗪/吩噻嗪官能团的方法。
背景技术:
[0002]
芳香化合物的直接胺化在有机合成中具有很重要的合成意义,因为c(sp2)-n键在很多天然产物、药物分子以及功能材料中广泛的存在。过渡金属催化的碳卤键或者碳硼键的胺化反应经过多年的发展,已经成为了比较有效的构建c(sp2)-n键的方法(j.f.hartwig et al.acc.chem.res.2008,41,1534;p.c.mcgowan et al.chem.soc.rev.2014,43,3525.)。近几年来,利用氧化偶联的策略,直接实现c(sp2)-h/n-h之间的脱氢交叉偶联反应受到关注。因为这种方式无需预官能团化,更加直接而且具有更好地原子经济性。
[0003]
三芳胺类化合物在有机光电材料中是一种重要的功能材料前体,其在有机发光二极管材料(m.-x.yu et al.adv.funct.mater.2007,17,369
–
378)、有机电致变色材料(dong zhili et al.adv.eng.mater.2020,2000082)的构建中是一类重要的骨架分子,并且这两者是oled屏幕、电致变色玻璃生产中的重要原料。常见的构建三芳胺骨架方法主要有两种。第一种是以卤代芳烃和二芳基胺为原料,经由buchwald-hartwig反应得到三芳胺,但是该过程需要先将芳烃卤代,且反应中需要加入铜和贵金属钯作为催化剂,并且再额外加入配体和碱。第二种是直接以三芳胺为原料,卤代之后,再利用交叉偶联反应引入各种官能团。
技术实现要素:
[0004]
本发明的目的在于提供一种简单、便捷、高效地在苯胺衍生物对位引入吩噁嗪/吩噻嗪官能团的方法。本发明方法反应条件温和,且能够得到较高的产率,并且克服了现有合成方法中的底物限制,能够实现三苯胺底物和吩噻嗪之间的直接氧化偶联。
[0005]
本发明的目的通过下述技术方案实现:
[0006]
一种在苯胺衍生物对位引入吩噁嗪/吩噻嗪官能团的方法,包括如下步骤:将苯胺类底物、吩噁嗪/吩噻嗪类底物、氧化剂和溶剂混合后,在空气氛围下反应,得到4-吩噁嗪/吩噻嗪取代的苯胺类化合物,反应方程式如下:
[0007][0008]
其中:x为氧或硫;r1、r2为氢、烷基、苯基或取代苯基;r3、r4为氢、烷基、烷氧基、腈基、三氟甲基、卤素、硝基、烷酰基、羟基、酯基或酰胺;r5为氢、烷基、烷氧基、腈基、三氟甲
nmr(101mhz,cdcl3)δ150.12,144.04,135.20,131.12,127.01,123.22,120.80,115.15,114.04,113.28,40.57.
[0021]
实施例2
[0022]
采用实施例1中条件,将溶剂乙腈替换为甲醇,以83%的产率得到目标产物3a。
[0023]
采用实施例1中条件,将吩噁嗪2a的用量改为0.2mmol,以76%的产率得到目标产物3a。
[0024]
采用实施例1中条件,分别使用过硫酸铵、过硫酸钠或者过硫酸氢钾作为氧化剂,得到产物3a的产率分别为78%、89%和71%;使用其他氧化剂,如过氧化叔丁基、苯醌或醋酸铜,产率为65%、20%、30%。
[0025]
实施例3
[0026][0027]
在空气氛围下,将0.2mmol n,n-二甲基苯胺1a、0.3mmol吩噻嗪2b、0.4mmol过硫酸钾和3ml乙腈依次加入schlenk反应管中,在磁力搅拌器上室温搅拌一小时。反应结束后,过滤,并用乙酸乙酯冲洗滤渣三次,旋干得到粗产品。粗产品通过柱层析法(石油醚/乙酸乙酯=50/1)分离得到目标产物3b(40.2mg,63%)。1h nmr(400mhz,chloroform-d)δ7.21(d,j=8.9hz,2h),6.96(d,j=7.4hz,2h),6.87(d,j=8.9hz,2h),6.82(t,j=7.7hz,2h),6.75(t,j=7.3hz,2h),6.24(d,j=8.2hz,2h),3.03(s,6h).
13
c nmr(101mhz,cdcl3)δ150.07,145.13,131.71,129.13,126.91,126.59,122.09,119.49,115.77,113.80,40.67.
[0028]
实施例4
[0029][0030]
在空气氛围下,将0.2mmol n,n-二甲基苯胺1a、0.3mmol 2-氰基吩噻嗪2c、0.4mmol过硫酸钾和3ml乙腈依次加入schlenk反应管中,在磁力搅拌器上室温搅拌一小时。反应结束后,过滤,并用乙酸乙酯冲洗滤渣三次,旋干得到粗产品。粗产品通过柱层析法(石油醚/乙酸乙酯=50/1)分离得到目标产物3c(38.3mg,54%)。1h nmr(400mhz,chloroform-d)δ7.14(d,j=8.9hz,2h),7.00
–
6.76(m,7h),6.34(s,1h),6.22(d,j=8.0hz,1h),3.07(s,6h).
13
c nmr(101mhz,cdcl3)δ150.45,145.63,143.84,131.11,127.57,126.77,126.68,126.55,125.43,122.96,119.28,117.89,117.78,116.24,114.14,110.13,40.59.
[0031]
实施例5
[0032][0033]
在空气氛围下,将0.2mmol 4,4
’-
二甲基三苯胺2a、0.3mmol 2-氰基吩噻嗪2c、0.4mmol过硫酸钾和3ml乙腈依次加入schlenk反应管中,在磁力搅拌器上室温搅拌24h。反应结束后,过滤,并用乙酸乙酯冲洗滤渣三次,旋干得到粗产品。粗产品通过柱层析法(石油醚/乙酸乙酯=50/1)分离得到目标产物3d(50.1mg,51%)。1h nmr(400mhz,chloroform-d)δ7.14(s,10h),7.09
–
7.04(m,2h),7.01
–
6.94(m,2h),6.92
–
6.85(m,2h),6.80(m,1h),6.43(d,j=1.4hz,1h),6.28
–
6.22(m,1h),2.34(s,6h).
13
c nmr(101mhz,cdcl3)δ148.81,145.18,144.55,143.50,133.94,131.11,131.06,130.33,127.59,126.94,126.88,126.65,125.86,125.66,123.14,122.17,119.25,118.10,117.73,116.23,110.14,21.04.
[0034]
实施例6
[0035]
采用实施例1中条件,仅改变苯胺类底物,反应结果如下:
[0036][0037]
实施例7
[0038]
采用实施例3中条件,仅改变吩噻嗪类底物,反应结果如下:
[0039][0040]
实施例8
[0041]
采用实施例5中条件,改变吩噻嗪类底物或三苯胺底物,反应结果如下:
[0042][0043]
需要说明的是,在上述所有实施例中,吩噁嗪/吩噻嗪原料均能反应完全,收率的差异在于反应过程中还存在一定量其它副产物。
[0044]
以上实施例描述了本发明的基本原理、主要特征及优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明原理的范围下,本发明还会有各种变化和改进,这些变化和改进均落入本发明保护的范围内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



