一种重组肌肽水解酶突变体及其应用的制作方法
 2021-02-02 06:02:46|
2021-02-02 06:02:46| 438|
438| 起点商标网
起点商标网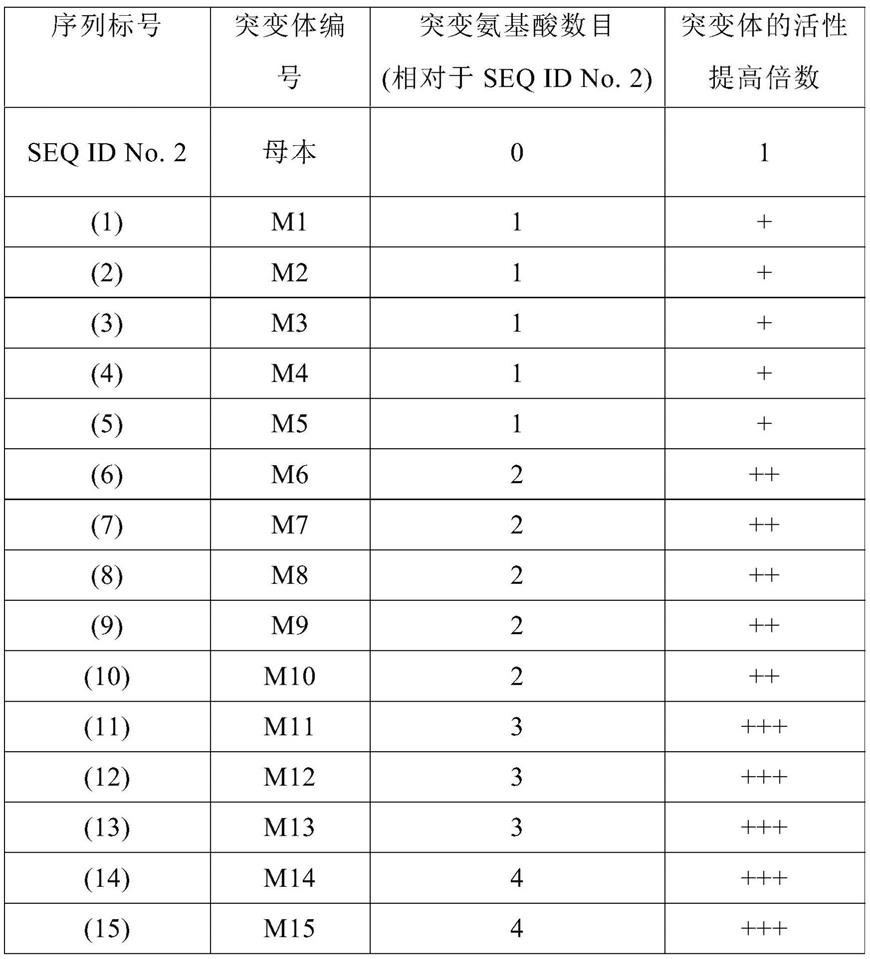
[0001]
本发明属于生物工程技术领域,具体涉及一种重组肌肽水解酶突变体,含有该重组肌肽水解酶突变体基因的重组表达载体及重组表达转化体,以及该重组肌肽水解酶突变体应用于l-肌肽合成的方法。
背景技术:
[0002]
l-肌肽又名β-丙氨酰-l-组氨酸,是由β-丙氨酸和l-组氨酸两种氨基酸缩合得到的二肽,是一种白色的结晶状固体,是生物体内存在的一种天然抗氧化剂。左旋肌肽作为一种天然二肽,在动物的肌肉、脑组织、眼部晶状体组织中大量存在,浓度可高达20mm。在生物体内,肌肽具有ph缓冲,抗氧化、抗自由基以及抗衰老等作用。在临床上,应用于减轻视觉疲劳、治疗白内障;含锌肌肽可用于治疗胃溃疡。此外肌肽及其衍生产品在食品添加剂、化妆品、保健品等领域也具有广阔的应用前景。
[0003]
l-肌肽的生产有多种方法。由于肌肽在动物肌肉中含量较高,早期直接从动物组织中进行肌肽的提取,这种方式产量低,纯度差,早已被淘汰。目前通常采用的方法是化学合成法,使用邻苯二甲酸酐对丙氨酸进行氨基保护,使用二氯亚砜进行羧基活化,然后与三甲基硅烷保护的l-组氨酸反应,得到基团保护的肌肽衍生物,随后脱保护获得游离的l-肌肽。这种方法收率较高,但是反应步骤较多,反应条件比较苛刻,反应过程中需要计量消耗和生成大量对环境有害的试剂,并且邻苯二甲酰基的脱保护需要使用剧毒的试剂肼,而产品l-肌肽中不允许有肼的残留,因此对产品的提取、精制有很高的要求。总的来说,虽然化学合成法发展较早,但普遍需要复杂的保护-去保护步骤,存在着合成步骤繁琐,反应条件苛刻,产品收率低,污染大,存在有毒试剂残留等问题。
[0004]
与之相比,生物合成法具有合成路线短、反应条件温和、环境友好、产物光学纯度高等优点,更适合于工业应用,将逐渐取代传统的化学合成方法。肌肽水解酶可以催化β-丙氨酸和l-组氨酸缩合生成l-肌肽,反应过程中无需对底物进行活化和保护,反应步骤少,工艺简单,效率高,唯一的副产物是水,整个过程绿色环保,因此具有很好的工业应用前景。
[0005]
ueda课题组以人脑cdna文库为模板,克隆获得的肌肽水解酶hcn1,在酵母中进行表面展示表达,并在两相体系中使用酵母整细胞作为催化剂,催化β-丙氨酸和l-组氨酸的逆水解反应合成l-肌肽,反应体系中l-组氨酸浓度为100mm,β-丙氨酸浓度为500mm,产物l-肌肽的浓度仅为4.5mm(appl microbiol,2010,86(6):1895-1902)。许建和等利用沙雷氏菌株来源的重组肌肽水解酶smpepd,催化合成l-肌肽,产物浓度最高达到62.5mm(catal sci technol,2019,9,5971
–
5978),尽管如此,由于该酶的活性相对较低,反应液中需要加入重金属锰离子,对酶进行激活,提高酶的活性。
[0006]
现有报道中,肌肽水解酶品种少,催化剂活性相对较低,反应时间长,产物浓度低,不适合工业化生产要求。因此,需要筛选活性高、稳定性好,能在较短反应时间获得较高浓度产物的酶,以满足工业化生产l-肌肽的需求。
技术实现要素:
[0007]
本发明针对肌肽水解酶催化的酶法逆水解合成l-肌肽中现有技术上的不足,提供一种催化活性高、酸性ph耐受性好,稳定性好的重组肌肽水解酶突变体,含有该重组肌肽水解酶突变体基因的重组表达载体和重组表达转化体,该重组肌肽水解酶突变体的制备方法,以及重组肌肽水解酶突变体用于合成l-肌肽的方法。
[0008]
本发明的目的可以通过以下技术方案来实现:
[0009]
本发明采用的技术方案之一:
[0010]
一种重组肌肽水解酶突变体,其是由seq id no.2所示氨基酸序列的重组肌肽水解酶smpepd经过替换、缺失或添加一个或多个氨基酸而得到的具有l-肌肽合成活性的衍生蛋白质。
[0011]
首先构建含有肌肽水解酶smpepd重组质粒pet28a-smpepd的重组菌,其是以正向引物5'-ccggaattcgtgtctgaattgtctcagcttt-3'和反向引物5'-ctcgagtgcggccgcaagcttaccgaggctcgagatgaa-3'对如序列表seq id no.1所示核酸序列进行pcr扩增,使用限制性内切酶ecori和xhoi酶切后与用相同限制性内切酶酶切的pet28a质粒连接,然后转化到e.coli bl21感受态细胞中获得含有肌肽水解酶smpepd重组质粒pet28a-smpepd的重组菌。所述重组菌表达的重组肌肽水解酶smpepd的氨基酸序列中含有如序列表seq id no.2所示的氨基酸序列。
[0012]
以重组质粒pet28a-smpepd作为模板,采用易错pcr策略对重组肌肽水解酶smpepd进行定向进化改造。含有随机突变的pcr产物片段经限制性内切酶ecor1和xhoi酶切后与具有相同酶切位点的pet28a(+)质粒连接,然后转化到e.coli bl21感受态细胞中,建立突变体库,并在ph 6.0的条件下采用opa衍生化方法对易错突变库中的10,000个克隆子进行了高通量筛选。筛选获得一批酸性环境中活性显著提高的肌肽水解酶突变体,具体的,其序列如下所示:
[0013]
(1)将如序列表中seq id no.2所示氨基酸序列的第56位半胱氨酸替换为苏氨酸;
[0014]
(2)将如序列表中seq id no.2所示氨基酸序列的第74位苏氨酸替换为丙氨酸;
[0015]
(3)将如序列表中seq id no.2所示氨基酸序列的第301位缬氨酸替换为苏氨酸;
[0016]
(4)将如序列表中seq id no.2所示氨基酸序列的第326位谷氨酸替换为天冬氨酸;
[0017]
(5)将如序列表中seq id no.2所示氨基酸序列的第418位亮氨酸替换为天冬氨酸;
[0018]
(6)将如序列表中seq id no.2所示氨基酸序列的第118位谷氨酰胺替换为丙氨酸,第155位甘氨酸替换为天冬酰胺;
[0019]
(7)将如序列表中seq id no.2所示氨基酸序列的第75位色氨酸替换为丙氨酸,280位亮氨酸替换为丝氨酸;
[0020]
(8)将如序列表中seq id no.2所示氨基酸序列的第169位谷氨酸替换为甘氨酸,306位丙氨酸替换为丝氨酸;
[0021]
(9)将如序列表中seq id no.2所示氨基酸序列的第80位天冬酰胺替换为甘氨酸,第104位精氨酸替换为丙氨酸;
[0022]
(10)将如序列表中seq id no.2所示氨基酸序列的第217位丙氨酸替换为谷氨酸,
第352位丝氨酸替换为丙氨酸;
[0023]
(11)将如序列表中seq id no.2所示氨基酸序列的第116位缬氨酸替换为谷氨酸,第295位脯氨酸替换为丙氨酸;第406位丝氨酸替换为亮氨酸;
[0024]
(12)将如序列表中seq id no.2所示氨基酸序列的第134位脯氨酸替换为丙氨酸,第309位丙氨酸替换为异亮氨酸,第360位亮氨酸替换为天冬酰胺;
[0025]
(13)将如序列表中seq id no.2所示氨基酸序列的第97位丙氨酸替换为异亮氨酸,第275位丙氨酸替换为酪氨酸;第301位缬氨酸替换为色氨酸;
[0026]
(14)将如序列表中seq id no.2所示氨基酸序列的第134位脯氨酸替换为丙氨酸,183位丙氨酸替换为缬氨酸,第281位精氨酸替换为半胱氨酸;第479位天冬酰胺替换为丙氨酸;
[0027]
(15)将如序列表中seq id no.2所示氨基酸序列的第217位丙氨酸替换为谷氨酸,第250位甘氨酸替换为天冬氨酸,第352位丝氨酸替换为丙氨酸;第447位缬氨酸替换为精氨酸。
[0028]
本发明采用的技术方案之二:
[0029]
一种编码如技术方案一所述重组肌肽水解酶突变体的核酸。
[0030]
本发明所述核酸的制备方法为本领域常规制备方法,所述制备方法较佳地包括:
[0031]
通过基因克隆技术获得编码重组肌肽水解酶smpepd突变体的核酸分子,或通过人工全序列合成的方法得到编码重组肌肽水解酶smpepd突变体的核酸分子。
[0032]
本发明所述通过基因克隆技术获得编码重组肌肽水解酶smpepd突变体的核酸分子的方法为:以
[0033]
正向引物5'-ccggaattcgtgtctgaattgtctcagcttt-3',
[0034]
反向引物5'-ccgctcgagttacgcgcgctcagggatcgcttt-3',
[0035]
利用pcr技术对技术方案1中获得的重组肌肽水解酶smpepd突变体的基因dna序列进行扩增。
[0036]
pcr体系(50μl):rtaq 25μl,10
×
buffer 5μl,dntp mix 4μl,模板质粒约100ng,上下游引物(10μm)各2μl,mncl2(10mm)1.5μl,dih2o补足至50μl。
[0037]
pcr反应程序:(1)98℃变性3min;(2)98℃变性30s,(3)55℃退火30s,(4)72℃延伸1.5min,步骤(2)-(4)共进行30个循环,最后72℃延伸10min,4℃保存。
[0038]
本发明采用的技术方案之三:
[0039]
一种包含本发明所述重组肌肽水解酶突变体核酸的重组表达载体。其可通过本领域常规方法将本发明的重组肌肽水解酶突变体基因的核酸连接于各种合适的载体上构建而成。所述载体为质粒pet28a。
[0040]
较佳的,作为示例,可通过下述方法制得本发明所述的重组表达载体:将通过pcr扩增所得的重组肌肽水解酶smpepd突变体m13的基因dna片段用限制性内切酶ecori和xhoi双酶切,同时将空载质粒pet28a用限制性内切酶ecori和xhoi双酶切,回收上述酶切后的基因dna片段以及pet28a质粒,利用t4 dna连接酶连接,构建获得包含所述肌肽水解酶smpepd
m13
基因的重组表达载体pet28a-smpepd
m13
。
[0041]
本发明采用的技术方案之四:
[0042]
一种包含本发明所述重组肌肽水解酶突变体基因或其重组表达载体的重组表达
转化体。其可通过将本发明所述重组表达载体转化至宿主细胞中来制得所述重组表达转化体。所述的宿主细胞可以是本领域的各种常规宿主细胞,前提是能使所述重组表达载体稳定地自行复制,且其所携带的肌肽水解酶突变体基因可被有效表达。本发明优选宿主细胞是大肠杆菌,更优选大肠杆菌e.coli dh5α或大肠杆菌e.coli bl21(de3)。
[0043]
本发明采用的技术方案之五:
[0044]
一种重组肌肽水解酶突变体的制备方法,包括如下步骤:培养本发明所述的重组表达转化体,获得重组肌肽水解酶突变体。其中,培养所述重组表达转化体所用的培养基可选自本领域的常规培养基,前提是可使转化体生长并产生本发明的肌肽水解酶突变体。培养转化体的具体操作可按本领域常规操作进行。
[0045]
本发明采用的技术方案之六:
[0046]
提供一种重组肌肽水解酶突变体催化剂,所述的重组肌肽水解酶突变体催化剂是以下形式中的任意一种:
[0047]
(1)培养本发明所述的重组表达转化体,分离含有所述重组肌肽水解酶突变体的转化体细胞(静息细胞);
[0048]
(2)培养本发明所述的重组表达转化体,分离含有所述重组肌肽水解酶突变体的粗酶液;
[0049]
(3)培养本发明所述的重组表达转化体,分离含有所述重组肌肽水解酶突变体的粗酶液,将粗酶液冷冻干燥得到的粗酶粉。
[0050]
本发明提供一种粗酶液与粗酶粉的获得方式:将由上述技术方案构建的重组大肠杆菌,接种至含50μg/ml卡那霉素的lb培养基(蛋白胨10g/l,酵母膏5g/l,nacl 10g/l,ph 7.0)中,37℃振荡培养过夜,按1%(v/v)的接种量接入装有100ml lb培养基的500ml三角烧瓶中,置于37℃、180rpm摇床振荡培养,当培养液的od
600
达到0.6时,加入终浓度为0.1mmol/l的异丙基-β-d-硫代半乳糖苷(iptg)作为诱导剂,16℃诱导24h后,将培养液离心,收集细胞,并用生理盐水洗涤两次,得到静息细胞。将所得的静息细胞悬浮于10ml tris-hcl(100mm,ph 8.0)的缓冲液中,在冰水浴中超声破碎,离心收集上清液,即为重组酶的粗酶液。将粗酶液冷冻干燥,获得重组酶的粗酶粉。
[0051]
本发明采用的技术方案之七:
[0052]
提供本发明所述重组肌肽水解酶突变体或所述重组肌肽水解酶突变体催化剂在催化β-丙氨酸和l-组氨酸缩合制备l-肌肽中的应用。
[0053]
所述的应用是将本发明所述重组肌肽水解酶突变体或所述重组肌肽水解酶突变体催化剂加入到含有β-丙氨酸和l-组氨酸的缓冲溶液中,催化β-丙氨酸和l-组氨酸的逆水解反应合成l-肌肽。其中所述的缓冲溶液的缓冲盐体系不限,只要其ph范围为6.0-9.0即可;优选的缓冲液体系为磷酸盐缓冲液,ph范围为5.0~7.5,更优选反应介质ph为6.0。其他反应条件如底物浓度、酶用量等可按本领域此类反应的常规条件进行选择。
[0054]
反应过程中间歇取样,采用液相色谱法进行转化率分析。使用的色谱柱为手性冠醚柱(cr(+),φ40mm
×
150mm),具体分析条件为:以0.1m的高氯酸溶液为流动相,流动相流速0.3ml/min,柱温25℃,检测波长220nm。
[0055]
反应结束后,分离反应液,浓缩,β-氨基丙酸优先结晶,分离除去结晶的β-氨基丙酸,母液继续浓缩,加入l-肌肽作为晶种,即可获得具有较高纯度的l-肌肽。对产物反复进
行重结晶,即可获得高纯度的l-肌肽。
[0056]
与现有技术相比,本发明的积极进步效果在于:
[0057]
与母本酶smpepd相比,本发明所述的重组肌肽水解酶突变体的活性提高,稳定性提高,并且最适ph向酸性方向移动,在酸性环境中,l-组氨酸的溶解度显著增长,因此产物l-肌肽的浓度也大幅度提高。并且可以直接使用相对廉价的l-组氨酸盐酸盐作为底物,降低工业化应用的成本。
具体实施方式
[0058]
下面结合具体实施例对本发明进行详细说明。
[0059]
实施例1.重组肌肽水解酶的分子改造
[0060]
采用易错pcr技术建立肌肽水解酶smpepd的随机突变体库,利用opa衍生化进行突变库的高通量筛选,筛选低ph环境中活性提高的突变体。
[0061]
设计两端引物:
[0062]
正向引物5'-ccggaattcgtgtctgaattgtctcagcttt-3',
[0063]
反向引物5
[0064]
'-ctcgagtgcggccgcaagcttaccgaggctcgagatgaa-3'
[0065]
以重组质粒pet28a-smpepd作为模板进行扩增。聚合酶链式反应pcr体系(50μl):rtaq 0.25μl,10
×
buffer 5μl,dntp mix 4μl,模板质粒约100ng,primer f 2μl,primer r 2μl,mncl2(10mm)0.5μl,dih2o补足至50μl。pcr程序为:98℃ 3min,98℃ 30s,55℃ 30s,72℃ 10min,循环30次,72℃ 10min。pcr产物在4℃保存备用。
[0066]
含有随机突变的pcr产物片段经ecor1和xhoi酶切后与具有相同酶切位点的pet28a(+)质粒连接后转化到e.coli bl21感受态细胞中,并均匀涂布于含有50μg/ml卡那霉素的lb琼脂平板上。37℃过夜培养后,挑取单克隆接种到加有300μl的lb培养基(含有50μg/ml卡那霉素)的深孔板中,37℃振荡培养过夜,随后转接50μl至加有600μl的lb培养基(含有50μg/ml卡那霉素)的二级深孔板,37℃振荡培养3h后加入终浓度为0.2mmol/l的iptg,16℃诱导24h。取40μl菌液加入到160μl含有180mmol/lβ-丙氨酸和20mmol/l l-肌肽的磷酸盐缓冲液(50mm,ph 6.0)中,37℃振荡反应1h,加入终浓度为50mg/ml的邻苯二甲醛(opa),继续振荡反应30min,通过荧光酶标仪进行荧光检测,激发波长355nm,发射波长460nm,根据荧光强弱判断酶活性高低,如此筛选得到活性提高的突变体,送赛音生物技术(上海)有限公司进行序列测定。测序结果用ape软件与肌肽水解酶smpepd基因序列进行比对,筛选获得的一些高活性的突变体列于表1中。在表1中,序列标号分别对应于表1后面的一系列序列。在活性列中,与母本smpepd相比,一个加号“+”表示ph 6.0的条件下突变体蛋白的活力提升至1-5倍;两个加号“++”表示ph 6.0的条件下突变体蛋白活力提升至5-10倍;三个加号“+++”表示ph 6.0的条件下突变体蛋白的合成活力提升至超过10倍。
[0067]
表1.肌肽水解酶突变体序列和相应的活性改进列表
[0068][0069]
表中对应标号的肌肽水解酶突变体的氨基酸序列分别如下:
[0070]
(1)将如序列表中seq id no.2所示氨基酸序列的第56位半胱氨酸替换为苏氨酸;
[0071]
(2)将如序列表中seq id no.2所示氨基酸序列的第74位苏氨酸替换为丙氨酸;
[0072]
(3)将如序列表中seq id no.2所示氨基酸序列的第301位缬氨酸替换为苏氨酸;
[0073]
(4)将如序列表中seq id no.2所示氨基酸序列的第326位谷氨酸替换为天冬氨酸;
[0074]
(5)将如序列表中seq id no.2所示氨基酸序列的第418位亮氨酸替换为天冬氨酸;
[0075]
(6)将如序列表中seq id no.2所示氨基酸序列的第118位谷氨酰胺替换为丙氨酸,第155位甘氨酸替换为天冬酰胺;
[0076]
(7)将如序列表中seq id no.2所示氨基酸序列的第75位色氨酸替换为丙氨酸,280位亮氨酸替换为丝氨酸;
[0077]
(8)将如序列表中seq id no.2所示氨基酸序列的第169位谷氨酸替换为甘氨酸,
306位丙氨酸替换为丝氨酸;
[0078]
(9)将如序列表中seq id no.2所示氨基酸序列的第80位天冬酰胺替换为甘氨酸,第104位精氨酸替换为丙氨酸;
[0079]
(10)将如序列表中seq id no.2所示氨基酸序列的第217位丙氨酸替换为谷氨酸,第352位丝氨酸替换为丙氨酸;
[0080]
(11)将如序列表中seq id no.2所示氨基酸序列的第116位缬氨酸替换为谷氨酸,第295位脯氨酸替换为丙氨酸;第406位丝氨酸替换为亮氨酸;
[0081]
振荡反应20min;取10μl反应液,加入990μl高氯酸(ph 1.0)充分混合,振荡5min,12000
×
g高速离心3min,膜过滤除蛋白,滤液进行液相色谱分析。每分钟催化生成1μmol l-肌肽需要的酶量,定义为1个酶活力单位(u)。
[0082]
实施例3不同ph对重组smpepd m13
合成活性的影响
[0083]
将20μl smpepd
m13
的粗酶溶液(冻干酶粉浓度5mg/ml)加入到180μl含有20mmol/l l-肌肽的不同ph的缓冲液中,37℃振荡反应5-20min,考察肌肽水解酶smpepd
m13
在不同ph缓冲液中的活性。所用的缓冲液体系分别为磷酸盐缓冲液(ph 5.5-7.5)和tris-hcl(ph 7.5-9.0)。结果如表2所示,在ph为7.5的tris-hcl缓冲液中,酶的相对活性最高,定义为100%。与母本酶smpepd相比,突变体smpepd
m13
的最适ph由8.0迁移到7.5,并且ph 6.0时的活性有非常显著的提高。
[0084]
表2.肌肽水解酶smpepd
m13
在不同ph缓冲液中的活性
[0085][0086]
实施例4不同ph对重组smpepd m13
催化合成肌肽浓度的影响
[0087]
(12)将如序列表中seq id no.2所示氨基酸序列的第134位脯氨酸替换为丙氨酸,第309位丙氨酸替换为异亮氨酸,第360位亮氨酸替换为天冬酰胺;
[0088]
(13)将如序列表中seq id no.2所示氨基酸序列的第97位丙氨酸替换为异亮氨酸,第275位丙氨酸替换为酪氨酸;第301位缬氨酸替换为色氨酸;
[0089]
(14)将如序列表中seq id no.2所示氨基酸序列的第134位脯氨酸替换为丙氨酸,
183位丙氨酸替换为缬氨酸,第281位精氨酸替换为半胱氨酸;第479位天冬酰胺替换为丙氨酸;
[0090]
(15)将如序列表中seq id no.2所示氨基酸序列的第217位丙氨酸替换为谷氨酸,第250位甘氨酸替换为天冬氨酸,第352位丝氨酸替换为丙氨酸;第447位缬氨酸替换为精氨酸。
[0091]
实施例2肌肽水解酶突变体smpepd
m13
的制备
[0092]
提取如实施例1中所获得的重组质粒pet28a-smpepd
m13
,将其转化到大肠杆菌e.coli bl21中,接种至含50μg/ml卡那霉素的lb培养基(蛋白胨10g/l,酵母膏5g/l,nac1 10g/l,ph 7.0)中,37℃振荡培养过夜,按1%(v/v)的接种量转接到装有600ml lb培养基的2l三角烧瓶中,置于37℃、180rpm摇床振荡培养,当培养液的od
600
达到1.2时,加入终浓度为0.1mmol/l的iptg作为诱导剂,16℃诱导24h后,将培养液离心,收集细胞,并用生理盐水洗涤两次,得到静息细胞。将所得的静息细胞悬浮于tris-hcl缓冲液(20mm,ph8.0)中,使用高压匀浆破碎,破碎液冷冻干燥,即得到肌肽水解酶突变体smpepd
m13
的冻干酶粉,冻干酶粉活力为11.8u/g冻干酶粉。
[0093]
酶活力测定方法:反应体系0.2ml,含tris-hcl缓冲液(50mm,ph 8.0),1.9mβ-丙氨酸,100mm l-组氨酸和0.5mg/ml酶粉,30℃条件下,1000rpm
[0094]
将10mg重组肌肽水解酶突变体smpepd
m13
的粗酶粉加入到200μl含有饱和β-丙氨酸、饱和l-组氨酸的不同ph的缓冲液中,37℃振荡反应24h,考察肌肽水解酶smpepd
m13
在不同ph缓冲液中的催化合成肌肽浓度。所用的缓冲液体系分别为磷酸盐缓冲液(ph 5.5-7.5)和tris-hcl(ph 7.5-9.0)。结果如表3所示,在ph为6.0的磷酸盐缓冲液中,酶促合成产物的浓度最高。
[0095]
表3.不同ph缓冲液中肌肽水解酶smpepd
m13
催化合成肌肽浓度
[0096][0097]
实施例5重组smpepd m13
催化合成肌肽
[0098]
反应在2l三口烧瓶中进行,依次加入550ml水,580g的β-丙氨酸和40g的l-组氨酸,
10g如实施例5制备的重组肌肽水解酶smpepd
m13
的粗酶粉,30℃、200rpm机械搅拌反应,反应24h,水相中肌肽浓度达到62mm。
[0099]
实施例6重组smpepd m13
催化合成肌肽
[0100]
反应在2l三口烧瓶中进行,依次加入500ml水,580g的β-丙氨酸和100g的l-组氨酸盐酸盐,ph调节至6.0,10g如实施例5制备的重组肌肽水解酶smpepd
m13
的粗酶粉,30℃、200rpm机械搅拌反应,反应24h,水相中肌肽浓度达到92mm。
[0101]
实施例7重组smpepd m13催化合成肌肽
[0102]
反应在2l三口烧瓶中进行,依次加入500ml水,580g的β-丙氨酸和100g的l-组氨酸盐酸盐,ph调节至6.0,5g如实施例5制备的重组肌肽水解酶smpepd
m13
的粗酶粉,30℃、200rpm机械搅拌反应,反应60h,水相中肌肽浓度达到89mm。
[0103]
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



