一个参与甘蓝型油菜叶绿素合成相关基因BnaC08-CYP705a12及其应用的制作方法
 2021-02-02 06:02:02|
2021-02-02 06:02:02| 258|
258| 起点商标网
起点商标网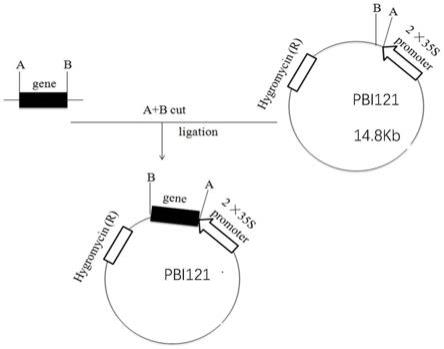
一个参与甘蓝型油菜叶绿素合成相关基因bnac08-cyp705a12及其应用
技术领域
[0001]
本发明属于植物基因工程技术领域,具体涉及一种参与甘蓝型油菜叶绿素合成相关的dna片段(基因)的分离克隆、功能验证及其应用。
背景技术:
[0002]
叶是高等植物进行光合作用的主要场所,植物叶色的变化会引起叶片光合效率的改变,对植物叶色突变体的研究可以阐明叶色对于光合作用影响的调控机理,可以为植物高光效研究提供良好的理论基础和研究材料。
[0003]
叶绿素合成和血红素生物合成是四吡咯合成代谢的两个重要分支。高等植物叶绿素的生物合成以谷氨酸与a-酮戊二酸为原料合成ala。2分子ala经ala脱水酶alad催化生成1分子胆色素原,其具有毗咯环。4分子胆色素原经脱氨基催化形成尿卟琳原ⅲ,尿卟啉原ⅲ的4个乙酸侧链经过尿卟啉原ⅲ脱羧酶生成具有4个甲基的粪卟啉原ⅲ。粪卟啉原ⅲ在粪卟啉原ⅲ氧化酶和原卟啉原氧化酶再脱梭、脱氢、氧化形成原卟啉ⅳ,原卟啉ix是形成叶绿素或亚铁血红素的分水岭。如果与镁结合,则形成mg-原卟啉ⅳ,再经mg-原卟啉ⅳ甲基转移酶、mg-原卟啉ⅳ单甲基酯环化酶和二乙烯还原酶形成原叶绿酸酯。原叶绿酸酯经光还原生成叶绿酸酯a,然后在叶绿素合酶下催化形成叶绿素a,叶绿素b由叶绿素a转化而成。叶绿素合成的过程涉及多个酶的参与。叶绿素合成过程中任何一个基因的突变都可能造成叶绿素合成受阻,进而改变叶绿体中各类色素的含量,引起植株叶色变异。如果原卟啉ⅳ与铁结合形成fe
2+
螯合物,接着生成血红素b,植物体内血红素b经过一系列氧化还原最终形成光敏色素生色团。若血红素代谢反应相关基因突变,四吡咯代谢的平衡很可能会打破,导致细胞内血红素含量上升,血红素的积累通过反馈抑制glu-trna还原酶的活性来影响ala和原叶绿素酸值含量,从而抑制叶绿素的合成,突变体由于缺乏叶绿素使得叶色产生变异。血红素反馈抑制是叶绿素合成过程中关键的调控步骤。在番茄aurea和yenow-green-2突变体中,编码血红素氧化酶和光敏色素生色团合酶的基因变异,导致细胞内血红素积累过量,其反馈抑制叶绿素前体氨基酮戊酸的合成,致使突变体表现为叶片黄化。
[0004]
细胞色素p450单加氧酶(p450s)是一个保守的血红素硫蛋白基因超家族,在多种多样的基质代谢中起着很重要的作用,包括内源性和外源性化合物的代谢。细胞色素p450的三维结构非常保守,在所有已知结构的cyp450中都含有一个保守的特征性亚铁血红素结合域fxxgxrxcxg位于其催化中心部位,而且序列非常保守,此区域也是鉴定细胞色素p450的关键依据。此结构域部位中的半胱氨酸(c)在所有的p450中完全保守,是亚铁血红素结合位点的第5个轴配体。细胞色素p450催化的反应过程是将电子从nadph/nadp传至黄素蛋白和铁硫蛋白,然后再传递给细胞色素p450氧化酶。由于大多数p450在植物体内的含量很低且不稳定,直接分离纯化p450酶非常困难,因此克隆p450基因,研究p450基因的表达与调控,通过异源表达、缺失突变和突变体互补等方法研究p450的功能就成为一条重要途径。
技术实现要素:
[0005]
本发明的目的在于提供一个参与甘蓝型油菜叶绿素合成相关的基因,本发明所述的bnac08-cyp705a12基因能够参与叶绿素的合成,从而控制油菜叶片性状。
[0006]
本发明所提供的参与甘蓝型油菜叶绿素合成相关的基因,名称为bnac08-cyp705a12(brassica napus cytochrome p450,family 705,subfamily a,polypeptide 12),从一个甘蓝型油菜黄化突变体材料“cde1”中克隆得到的基因片段,与野生型zs11中克隆的序列有1个碱基的替换。
[0007]
一个参与甘蓝型油菜叶绿素合成相关的基因bnac08-cyp705a12,是下述氨基酸残基序列之一,与野生型zs11有1个氨基酸残基的替换,位于aa-320:
[0008]
(1)序列表中的seq id no:1;
[0009]
(2)将序列表中seq id no:1的氨基酸残基序列经过一个至十个氨基酸残基的取代和/或缺失和/或添加且具有参与甘蓝型油菜叶绿素合成功能的蛋白质。
[0010]
序列表中的seq id no:1由492个氨基酸残基组成,自氨基端(n端)第15-491位氨基酸残基为保守序列。
[0011]
所述取代和/或缺失和/或添加的一至十个氨基酸残基为非结构域中的氨基酸残基,其改变不会对该蛋白的功能产生影响。
[0012]
编码本发明参与甘蓝型油菜叶绿素合成相关基因bnac08-cyp705a12(brassica napus cytochrome p450,family 705,subfamily a,polypeptide 12),其cdna是下述核苷酸序列之一,与野生型zs11中克隆的序列有1个碱基的替换,位于自5
’
端第959位碱基:
[0013]
(1)序列表中seq id no:2的dna序列;
[0014]
(2)编码序列表中seq id no:1的dna序列;
[0015]
(3)与序列表中seq id no:2限定的dna序列具有90%以上同源性且具有参与甘蓝型油菜叶绿素合成的核苷酸序列;
[0016]
(4)在高严谨条件下可与序列表中seq id no:2限定的dna序列杂交的核苷酸序列。
[0017]
所述高严谨条件为在0.1
×
sspe(或0.1
×
ssc)、0.1%sds的溶液中,65℃条件下杂交并洗膜。
[0018]
序列表中的seq id no:2由1479个碱基组成,其编码序列为5
’
端第1-1479位碱基,编码具有序列表中seq id no:1的氨基酸残基序列的蛋白质,自5
’
端第43-1473位碱基编码保守序列。
[0019]
其基因组基因,是下述核苷酸序列之一:
[0020]
(1)序列表中seq id no:3的dna序列;
[0021]
(2)与序列表中seq id no:3限定的dna序列具有90%以上同源性且具有参与甘蓝型油菜叶绿素合成的核苷酸序列;
[0022]
(3)在高严谨条件下可与序列表中seq id no:3限定的dna序列杂交的核苷酸序列。
[0023]
所述高严谨条件为在0.1
×
sspe(或0.1
×
ssc)、0.1%sds的溶液中,65℃条件下杂交并洗膜。
[0024]
序列表中的seq id no:3由1896个碱基组成,自5
’
端第1-672位碱基为该基因组基
因的第一个外显子,自5
’
端第673-699位碱基为该基因组基因的第一个内含子,自5
’
端第700-907位碱基为该基因组基因的第二个外显子,自5
’
端第908-1297位碱基为该基因组基因的第二个内含子,自5
’
端第1298-1896位碱基为该基因组基因的第三个外显子。
[0025]
所述的bnac08-cyp705a12基因与甘蓝型油菜叶绿素合成相关。将该基因的完整编码序列(coding sequence)与过表达载体pbi121融合后,构建成pbi121-bnac08-cyp705a12载体并转化到甘蓝型油菜常规优良品种中双11(zs11)中,转基因植株叶片明显比对照植株的叶片黄化;将构建好的该基因rnai-bnac08-cyp705a12表达载体转化到纯合甘蓝型油菜黄化突变体cde1中,转基因植株的叶片可恢复成绿叶表型。表明本发明bnac08-cyp705a12基因能够参与叶绿素的合成,从而控制油菜叶片性状。
[0026]
所述的bnac08-cyp705a12蛋白被亚细胞定位细胞膜中。将该基因不含终止子的编码序列与亚细胞定位载体pa7-gfp结合后直接转入到烟草中,在激光共聚焦显微镜下观察荧光,结果表明bnac08-cyp705a12蛋白被定位于细胞膜中,在细胞膜中发挥功能。
[0027]
含有本发明基因的表达载体、转基因细胞系、宿主菌及其编码的蛋白均属于本发明的保护范围。
[0028]
扩增bnac08-cyp705a12基因中任一片段的引物及引物对也在本发明的保护范围之内。
[0029]
本发明所克隆的基因bnac08-cyp705a12可以为植物高光合效率研究提供良好的理论基础和研究材料。
[0030]
具体操作步骤如下:
[0031]
(1)利用农杆菌介导的转基因方法将所述的基因bnac08-cyp705a12导入甘蓝型油菜受体,获得转化植株;
[0032]
(2)借助pcr方法分析鉴定阳性转基因植株;
[0033]
(3)将步骤(2)的转基因植株进行种植并观察其性状;
[0034]
(4)借助qrt-pcr分析转基因植株和野生型植株中参与甘蓝型油菜叶绿素合成相关基因bnac08-cyp705a12的表达。
[0035]
有益效果:
[0036]
本发明找到了一个来源于油菜并参与甘蓝型油菜叶绿素合成相关的基因bnac08-cyp705a12,这个基因在过表达以后能够降低植株叶片内叶绿素的合成,从而降低叶片内叶绿素的含量,并最终引起植株叶片黄化,当这个基因在表达受到干扰,植株能够恢复其参与的甘蓝型油菜叶绿素的合成,从而恢复植株叶片内叶绿素的含量,并使黄化材料叶片恢复绿叶表型。
[0037]
所述的基因bnac08-cyp705a12与甘蓝型油菜叶绿素合成相关。将该基因的完整编码序列(coding sequence)与过表达载体pbi121融合后,构建成pbi121-bnac08-cyp705a12载体并转化到甘蓝型油菜常规优良品种中双11(zs11)中,转基因植株叶片明显比对照植株的叶片黄化;将构建好的该基因rnai-bnac08-cyp705a12表达载体转化到纯合甘蓝型油菜黄化突变体cde1中,转基因植株的叶片可恢复成绿叶表型。表明本发明bnac08-cyp705a12基因能够参与叶绿素的合成,从而控制油菜叶片性状。
附图说明
[0038]
图1为bnac08-cyp705a12基因组基因的框架结构;
[0039]
图2为bnac08-cyp705a12的蛋白质序列分析图;
[0040]
图3为植物过表达载体pbi121构建示意图;
[0041]
图4为植物pfgc5941载体构建示意图;
[0042]
图5为bnac08-cyp705a12基因过表达和rnai表达载体转基因植株表型;其中左1为野生型zs11单株,左2为pbi121-bnac08-cyp705a12转基因植株表型,左3为cde1植株,左4为rnai-bnac08-cyp705a12转基因植株表型;
[0043]
图6为烟草叶片细胞中bnac08-cyp705a12蛋白的亚细胞定位。
具体实施方式
[0044]
下述实施例中所用方法如无特别说明均为常规方法。
[0045]
实施例1
[0046]
参与甘蓝型油菜叶绿素合成相关基因bnac08-cyp705a12的克隆
[0047]
本研究采用本实验室改良后的ctab方法进行总dna的提取。用trizal试剂并参照试剂盒说明书提取甘蓝型油菜(brassica napus)新鲜叶片的总rna,然后用takara公司的reverse transcription试剂盒并按照试剂盒说明书反转合成cdna,以所合成的cdna为模板,再以已公开的法国甘蓝型油菜基因组为参考设计引物,在引物p1(上游引物):5
’-
atggcagcaatgatagttga-3
’
和p2(下游引物):5
’-
ttaaaggctgagtcgagaaa-3
’
的引物下pcr扩增油菜中的参与叶绿素合成相关的基因,反应结束后,对pcr扩增产物进行1%琼脂糖凝胶电泳检测,采用axygen离心柱型胶回收试剂盒,按照说明进行目的条带回收并对其进行纯化,将回收产物连入载体easy blunt simple中,经热激法转化大肠杆菌(e.coli)dh5α感受态细胞。蓝白斑筛选阳性克隆,将其接种于含卡那霉素lb液体培养基中,37℃、200rpm下培养,提取质粒,对其进行测序,测序结果表明扩增片段具有序列表中的seq id no:2的核苷酸序列,由1479个碱基组成,其编码序列位点位为自5
’
端第1-1479位碱基,编码具有序列表中seq id no:1的氨基酸残基序列的蛋白质,其中,自5
’
端第43-1473位碱基编码保守序列。其基因组基因具有序列表中seq id no:3的核苷酸序列,由1896个碱基组成,自5
’
端第1-672位碱基为该基因组基因的第一个外显子,自5
’
端第673-699位碱基为该基因组基因的第一个内含子,自5
’
端第700-907位碱基为该基因组基因的第二个外显子,自5
’
端第908-1297位碱基为该基因组基因的第二个内含子,自5
’
端第1298-1479位碱基为该基因组基因的第三个外显子。该基因的框架结构件图1。
[0048]
实施例2
[0049]
bnac08-cyp705a12过表达转基因植株的获得
[0050]
一、含bnac08-cyp705a12基因的植物过表达载体的构建
[0051]
在bnac08-cyp705a12基因的cds序列上游加上xba i限制性内切酶位点,上游引物p3:5
’-
gctctagaatggcagcaatgatag-3
’
,在bnac08-cyp705a12基因的cds序列下游加上sma i限制性内切酶位点下游引物p4:5
’-
tcccccgggttaaaggctgagtcga-3
’
。用引物p3和p4对实施例1克隆得到的序列表中seq id no:2的核苷酸序列进行pcr扩增,反应结束后,对pcr扩增产物进行1%琼脂糖凝胶电泳检测,采用axygen离心柱型胶回收试剂盒,按照说明进行目
的条带回收并对其进行纯化,将回收产物连入载体easy blunt simple中,经热激法转化大肠杆菌(e.coli)dh5α感受态细胞。蓝白斑筛选阳性克隆,将其接种于含卡那霉素lb液体培养基中,37℃、200rpm下培养,提取质粒,对其进行测序,测序结果表明扩增片段具有序列表中的seq id no:2加限制性内切酶xba i和sma i位点的核苷酸序列,并用限制性内切酶xba i和sma i对构建好的含有bnac08-cyp705a12基因的质粒进行酶切,对酶切产物进行1%琼脂糖凝胶电泳检测,回收长度约1496bp(加酶切位点)的bnac08-cyp705a12基因片段并对其进行纯化,将回收片段用t4 dna连接酶(takara)与经相同酶切的载体pbi121连接,再将连接产物用热激法转化大肠杆菌(e.coli)dh5α感受态细胞,筛选阳性克隆,将其接种于含卡那霉素的lb液体培养基中,在37℃、200rpm下培养,提取质粒,对重组质粒用限制性内切酶xba i和sma i进行酶切鉴定,与预期结果相符,再用引物p3和p4做进一步的pcr鉴定,结果经pcr扩增得到了1496bp的dna片段,与预期结果一致,表明得到了插入序列及位置正确的含有bnac08-cyp705a12植物表达载体,命名为pbi121-bnac08-cyp705a12。
[0052]
二、pbi121-bnac08-cyp705a12转基因油菜的获得
[0053]
将步骤一构建的植物表达载体pbi121-bnac08-cyp705a12用热激法转化农杆菌eha105感受态细胞,将其涂布于含卡那霉素和利福平的lb抗性平板上,在28℃、150rpm下培养,挑取长出的农杆菌单菌落再接种于含卡那霉素和利福平的20ml lb液体培养基中,在28℃、150rpm下培养2天,然后,再按2%的接种量菌将菌液接种于含卡那霉素和利福平的300ml lb液体培养基中,在28℃、150rpm下培养16-18小时。培养结束后,5000rpm离心20分钟后收集菌体,再将菌体悬浮于250ml含有5%蔗糖,0.1%silwetl-77的溶液中。最后,将菌液转于250ml烧杯中,将已授粉结束的甘蓝型油菜花去掉,再将植株倒置于烧杯中,使其花序完全侵入菌液中,为提高转化效率,一周后再重复一次。将转化植株进行常规培养,收获种子,所得种子经卡那霉素和pcr鉴定筛选后得到bnac08-cyp705a12转基因植株。
[0054]
三、pbi121-bnac08-cyp705a12转基因植株表型观察
[0055]
将步骤三获得的过表达bnac08-cyp705a12的阳性转基因植株的种子收集并与野生型种植在同一条件下,以甘蓝型油菜野生型作为对照。观察bnac08-cyp705a12过表达植株和野生型植株的生长情况,bnac08-cyp705a12过表达植株在自然条件下生长的表型如图5所示,bnac08-cyp705a12过表达植株叶片黄化。
[0056]
实施例3
[0057]
rnai-bnac08-cyp705a12转基因植株的获得
[0058]
一、含bnac08-cyp705a12基因的植物pfgc5941载体的构建
[0059]
根据bnac08-cyp705a12基因的保守序列选取干扰片段170bp(seq id no:4),在seq id no:4序列的上游加上asc i限制性内切酶位点,上游引物p5:5
’-
ttacaattaccatggggcgcgccatccctcatcacaccata-3
’
,在seq id no:4序列的下游加上swa i限制性内切酶位点,下游引物p6:5
’-
ttaaatcatcgattgggcgcgcatctaccaaacctccctt-3
’
。用引物p5和p6对实施例1克隆得到的序列表中seq id no:2的核苷酸序列进行pcr扩增,扩增产物为bnac08-cyp705a12基因的正义链。在seq id no:4序列的上游加上sma i限制性内切酶位点,上游引物p7:5
’-
ggactctagaggatccccgggatccctcatcacaccata-3
’
,在seq id no:4序列的下游加上bamh i限制性内切酶位点,下游引物p8:5
’-
ataagggactgaccacccgggatctaccaaacctccctt-3
’
。用引物p7和p8对实施例1克隆得到的序列表中seq id no:2的核苷酸序列进行pcr扩
增,扩增产物为bnac08-cyp705a12基因的反义链。pcr反应结束后,分别对pcr扩增产物进行1%琼脂糖凝胶电泳检测,采用axygen离心柱型胶回收试剂盒,按照说明进行目的条带回收并对其进行纯化,将回收产物连入载体easy blunt simple中,经热激法转化大肠杆菌(e.coli)dh5α感受态细胞。蓝白斑筛选阳性克隆,将其接种于含卡那霉素lb液体培养基中,37℃、200rpm下培养,提取质粒,分别对其进行测序,测序结果表明p5核p6扩增片段具有序列表中的seq id no:4加限制性内切酶asc i和swa i位点的正义链序列,p7和p8扩增的片段具有序列表中的seq id no:4加限制性内切酶sma i和bamh i位点的反义链序列。为构建基因沉默载体,需先将干扰正义链与pfgc5941表达载体连接,用限制性内切酶asc i和swa i对含有seq id no:4序列的正义链质粒进行酶切,对酶切产物进行1%琼脂糖凝胶电泳检测,回收长度约170bp含有seq id no:4的正义链片段并对其进行纯化,将回收片段用t4 dna连接酶(takara)与经相同酶切的载体pfgc5941连接。再用限制性内切酶sma i和bamh i对含有seq id no:4序列的反义链质粒进行酶切,对酶切产物进行1%琼脂糖凝胶电泳检测,回收长度约170bp含有seq id no:4的反义链片段并对其进行纯化,将回收片段用t4 dna连接酶(takara)与经相同酶切并且已经连接正义链的载体pfgc5941连接。再将连接产物用热激法转化大肠杆菌(e.coli)dh5α感受态细胞,筛选阳性克隆,将其接种于含卡那霉素的lb液体培养基中,在37℃、200rpm下培养,提取质粒,用引物p5/p6和p7/p8进行pcr鉴定,与预期结果一致,表明得到了插入正义链和反义链序列及位置正确的含有seq id no:4序列的植物表达载体,命名为rnai-bnac08-cyp705a12。
[0060]
二、rnai-bnac08-cyp705a12转基因油菜的获得
[0061]
将步骤一构建的植物rnai-bnac08-cyp705a12载体用热激法转化农杆菌eha105感受态细胞,将其涂布于含卡那霉素和利福平的lb抗性平板上,在28℃、150rpm下培养,挑取长出的农杆菌单菌落再接种于含卡那霉素和利福平的20ml lb液体培养基中,在28℃、150rpm下培养2天,然后,再按2%的接种量菌将菌液接种于含卡那霉素和利福平的300ml lb液体培养基中,在28℃、150rpm下培养16-18小时。培养结束后,5000rpm离心20分钟后收集菌体,再将菌体悬浮于250ml含有5%蔗糖,0.1%silwetl-77的溶液中。最后,将菌液转于250ml烧杯中,将cde1材料已授粉结束的甘蓝型油菜花去掉,再将植株倒置于烧杯中,使其花序完全侵入菌液中,为提高转化效率,一周后再重复一次。将转化植株进行常规培养,收获种子,所得种子经卡那霉素和pcr鉴定筛选后得到rnai-bnac08-cyp705a12转基因植株。
[0062]
三、rnai-bnac08-cyp705a12转基因植株表型观察
[0063]
将步骤二获得的rnai-bnac08-cyp705a12载体阳性转基因植株的种子收集并与黄化突变体种植在同一条件下,以甘蓝型油菜黄化突变体为对照。观察rnai-bnac08-cyp705a12转基因植株和对照组的生长情况,rnai-bnac08-cyp705a12转基因植株在自然条件下生长的表型如图5所示,黄化突变体cde1植株恢复叶片绿叶的表型。
[0064]
实施例4
[0065]
bnac08-cyp705a12亚细胞定位
[0066]
一、含bnac08-cyp705a12基因的融合表达载体的构建
[0067]
本实验室用以亚细胞定位的融合载体为pa7-gfp,选用xho i和sal i两个酶切位点进行载体酶切,载体酶切体系(50μl体系):两种酶各1μl,1
×
h buffer,载体16μl,ddh2o补齐至50μl体系,37℃水浴酶切3h,酶切后立刻60℃水浴15分钟失活,之后-20℃或4℃保
存。以克隆得到的cds为模板,利用一对添加相应酶切位点(xho i和sal i)的引物,上游引物为载体序列15bp+酶切位点+19bp基因序列(从orf前面数19bp),序列为catttacgaacgata+ctcgag+atggcagcaatgatag,下游引物为19bp基因序列(从基因后面数19bp)+酶切位点+载体序列15bp,序列为+gtcgac+ttctcgactcagcctt,然后反向互补。以上述引物进行pcr扩增,之后进行胶回收。目的片段与酶切载体的连接。连接体系(10μl):1μl同源重组酶+2μl buffer+3μl酶切载体+4μl目的片段,37℃水浴连接30分钟,之后冰上放置5分钟终止反应。将连接产物用热激法转化大肠杆菌(e.coli)dh5α感受态细胞,筛选阳性克隆,将其接种于氨苄霉素的lb液体培养基中,在37℃、200rpm下培养,提取质粒,对重组质粒用限制性内切酶xho i和sal i进行酶切鉴定,与预期结果相符,表明得到了插入序列及位置正确的含有bnac08-cyp705a12的亚细胞融合载体,命名为bnac08-cyp705a12-gfp。
[0068]
二、农杆菌介导的烟草瞬时转化
[0069]
将步骤一构建的融合表达载体bnac08-cyp705a12-gfp用热激法转化农杆菌eha105感受态细胞,将其涂布于含氨苄霉素和利福平的lb抗性平板上,将活化的农杆菌单克隆接种到50ml含有相应抗生素的培养液中,28℃,200rpm过夜。当菌液od
600
值介于0.6~1.0之间时,5000rpm,5min离心收集农杆菌。用重悬液(mgcl2·
6h2o,10mm;mes,10μm,ph=0.7;as,100μm)洗涤两次,每次10ml。重悬液稀释至od
600
值介于0.6~0.8。25℃放置3小时,注射,暗培养12-16小时,转为光照培养,3天后观察。在激光共聚焦显微镜下观察荧光,结果显示bnac08-cyp705a12-gfp表达的gfp蛋白荧光在细胞膜上有清晰的信号(图6),表明bnac08-cyp705a12蛋白被共定位于细胞膜中,在细胞膜中发挥功能。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



