用于表达Agrin蛋白的重组质粒及其构建方法和应用与流程
 2021-02-02 06:02:36|
2021-02-02 06:02:36| 375|
375| 起点商标网
起点商标网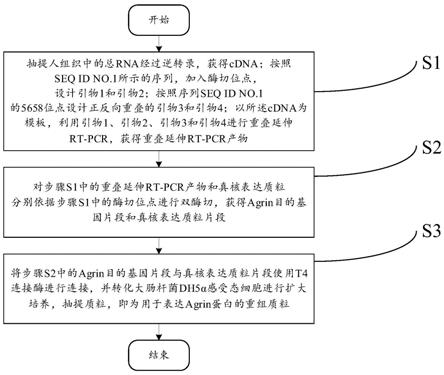
用于表达agrin蛋白的重组质粒及其构建方法和应用
技术领域
[0001]
本发明属于基因工程技术领域,具体涉及用于表达agrin蛋白的重组质粒及其构建方法和应用。
背景技术:
[0002]
聚集蛋白(agrin)是神经元衍生的肝素-硫酸盐蛋白聚糖,为运动神经末梢合成和释放的细胞外基质蛋白,同时也是lrp4和musk相互作用的调节者,二者通过其产生结合力,人源基因定位于染色体1p36.33,agrin蛋白分子量为217kda,存在6个转录本和5种蛋白质变体。agrin蛋白含有9个卵泡抑素样结构域,4个表皮细胞生长因子(egf)样结构域,中心含有1个层粘连蛋白β样结构域和3个层粘连蛋白g(lg)样结构域,还含有1个富含丝苏氨酸的结构域。agrin基因通过不同的剪切模式,分为神经型agrin(n-agrin)和肌肉型agrin(m-agrin)这两种具有组织表达特异性的不同亚型。具有4个aa插入片段的同工型(y+)和具有8个aa插入片段的(z+8)同工型都是神经元特异性的agrin基因。
[0003]
重症肌无力(myasthenia gravis,mg)是一种由自身抗体介导的神经-肌肉接头传递功能障碍的获得性自身免疫性疾病,表现为肌无力和易疲劳。从运动神经元末梢释放的n-agrin与跨膜蛋白低密度脂蛋白受体相关蛋白4(lrp4)结合,激活肌肉特异性受体酪氨酸激酶(musk)使其磷酸化,诱导烟碱型乙酰胆碱受体(n-achr)在肌细胞膜上聚集表达,对调节神经肌肉接头(nmj)的形成、维持及再生具有重要作用。少数mg病人agrin抗体的存在可导致神经肌肉传递障碍。作为一种致病性抗体,agrin抗体阳性的mg患者临床特征及治疗预后还不明确,agrin抗体的检测将大幅提高mg实验诊断的灵敏度和特异性,对mg的诊断、治疗以及预后具有重要指导意义。
技术实现要素:
[0004]
针对现有技术的不足,本发明提供了用于表达agrin蛋白的重组质粒及其构建方法和应用,目的是为了解决现有技术中无法准确获取神经型agrin,以及还没有可以在真核细胞中表达agrin蛋白的质粒,因此无法高灵敏度和强特异性与agrin抗体结合,从而无法有效应用于实验诊断中的技术问题。
[0005]
本发明提供的用于表达agrin蛋白的重组质粒,具体技术方案如下:
[0006]
用于表达agrin蛋白的重组质粒,包括载体质粒,所述载体质粒上重组连接有agrin蛋白编码基因,核苷酸序列如seq id no.1所示,所述载体质粒为真核表达质粒,所述载体质粒还携带有荧光报告基因。
[0007]
在某些实施方式中,所述荧光报告基因为gfp标签蛋白基因。
[0008]
本发明还提供了上述用于表达agrin蛋白的重组质粒的构建方法,包括如下步骤:
[0009]
s1,抽提人组织中的总rna经过逆转录,获得cdna;按照seq id no.1所示的序列,加入酶切位点,设计引物1和引物2;按照序列seq id no.1的5658位点设计正反向重叠的引物3和引物4;以所述cdna为模板,利用引物1、引物2、引物3和引物4进行重叠延伸rt-pcr,获
得重叠延伸rt-pcr产物;
[0010]
s2,对步骤s1中的重叠延伸rt-pcr产物和真核表达质粒分别依据步骤s1中的酶切位点进行双酶切,获得agrin目的基因片段和真核表达质粒片段;
[0011]
s3,将步骤s2中的agrin目的基因片段与真核表达质粒片段使用t4连接酶进行连接,并转化大肠杆菌dh5α感受态细胞进行扩大培养,抽提质粒,即为用于表达agrin蛋白的重组质粒。
[0012]
在某些实施方式中,步骤s1中,所述引物1的核苷酸序列为seq id no.2所示,所述引物2的核苷酸序列为seq id no.3,所述引物3的核苷酸序列为seq id no.4所示,所述引物4的核苷酸序列为seq id no.5所示,所述酶切位点为sgfⅰ和mluⅰ。
[0013]
在某些实施方式中,步骤s1中,以所述cdna为模板,利用引物1和引物4进行pcr扩增seq id no.1所示序列上游的5658bp的基因片段,获得第一次pcr产物;
[0014]
以所述cdna为模板,利用引物2和引物3进行pcr扩增seq id no.1所示序列下游的546bp的基因片段,获得第二次pcr产物;
[0015]
以所述第一次pcr产物和所述第二次pcr产物以摩尔比1:1混合作为模板,利用引物1和引物2进行pcr扩增,获得所述重叠延伸rt-pcr产物。
[0016]
在某些实施方式中,步骤s2中,所述真核表达质粒为pcmv-ac-gfp质粒,使用限制性内切酶sgfⅰ和mluⅰ进行双酶切。
[0017]
在某些实施方式中,步骤s3中,所述agrin目的基因片段与所述真核表达质粒片段摩尔比为(3-10):1。
[0018]
本发明还提供了上述用于表达agrin蛋白的重组质粒的应用,利用上述用于表达agrin蛋白的重组质粒检测血清中的agrin抗体。
[0019]
在某些实施方式中,包括如下步骤:
[0020]
1)将用于表达agrin蛋白的重组质粒转染培养好的hek293t细胞,继续培养48-60h后,获得表达agrin蛋白的hek293t细胞;
[0021]
2)将步骤1)中的表达agrin蛋白的hek293t细胞依次进行细胞固定和封闭、通透,获得处理后的表达agrin蛋白的hek293t细胞;
[0022]
3)将待测血清加入步骤2)中的处理后的表达agrin蛋白的hek293t细胞进行第一次孵育,加入荧光二抗进行第二次孵育,然后采用荧光显微镜进行观察,检测出血清中的agrin抗体。
[0023]
在某些实施方式中,步骤1)中,所述用于表达agrin蛋白的重组质粒为pcmv6-ac-agrin-gfp质粒;将所述hek293t细胞以(2.0-3.0)
×
104每孔的数量铺于24孔板,当细胞汇合70-80%时,进行转染;
[0024]
步骤2)中,所述细胞固定是采用4%多聚甲醛在4℃下固定15-30min;所述封闭、通透为利用含有5%牛血清白蛋白和0.5%tritonx-100的pbs溶液在室温下封闭、通透3h,或者在4℃下过夜封闭、通透;
[0025]
步骤3)中,所述第一次孵育的温度为室温,所述第一次孵育的时间为45-60min,所述荧光二抗为alexa fluor
tm 568标记的羊抗人igg,所述第二次孵育的温度为室温,所述第二次孵育的时间为1-2h。
[0026]
在某些实施方式中,步骤3)中,所述荧光显微镜的激发光为蓝色激发光和绿色激
发光。
[0027]
本发明具有以下有益效果:本发明通过重叠延伸rt-pcr获得agrin全长基因片段,重组至真核表达质粒上,从而可以高效地在真核细胞中表达agrin蛋白,并且以上述表达的agrin蛋白作为抗原与血清中的agrin抗体进行高效结合,所使用试剂均为常规试剂,检测成本较低,并且有助于mg致病机制的研究的开展并且具有作为疾病生物标志物的潜在功能,为后续辅助患者的精准诊疗提供指导。
附图说明
[0028]
图1是本发明提供的用于表达agrin蛋白的重组质粒的构建方法的流程图;
[0029]
图2是本发明提供的上述用于表达agrin蛋白的重组质粒的应用的流程图;
[0030]
图3是为真核表达质粒载体pcmv6-ac-gfp质粒的结构图;
[0031]
图4是酶切鉴定结果图;
[0032]
图5是pcmv6-ac-agrin-gfp质粒序列比对图;
[0033]
图6是验证pcmv6-ac-agrin-gfp质粒表达的结果图;
[0034]
图7是免疫荧光测定血清agrin抗体示意图。
具体实施方式
[0035]
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图1-7,对本发明进一步详细说明。
[0036]
实施例1
[0037]
一、重叠延伸rt-pcr产物获取
[0038]
1、总rna提取及cdna合成
[0039]
按trnzol universal总rna提取试剂说明书抽提人组织中的总rna,将其溶于20微升depc水中;总rna提取后以紫外分光光度计测定a260/a280比值,测得该比值稳定于1.8~2.0,检测总rna浓度。反转录操作按primescript
tm
ii 1st strand cdna synthesis kit(takara公司)提供操作说明书进行,所得cdna于-20℃保存。
[0040]
2、重叠延伸rt-pcr法扩增agrin目的基因
[0041]
按照ncbi中agrin转录本1的cds全长基因片段设计特异性的两对引物(ncbi参考序列:nm_001305275.2),核苷酸序列如seq id no.1所示,引物序列为:
[0042]
引物1(核苷酸序列如seq id no.2所示):5
’-
gaggcgatcgccatggccggccggtcc-3
’
[0043]
引物2(核苷酸序列如seq id no.3所示):5
’-
gcgacgcgttggggtggggcagggc-3
’
[0044]
引物1中下划线部位为sgfⅰ酶切位点,引物2下划线部位为mluⅰ酶切位点。
[0045]
按照agrin基因z位点(5658bp)插入的碱基序列,设计正反向重叠的引物为:
[0046]
引物3(核苷酸序列如seq id no.4所示):5
’-
aatgagatccccgtccccgaaactctgg-3
’
[0047]
引物4(核苷酸序列如seq id no.5所示):5
’-
aatccagagtttcggggacggggatctcat-3
’
[0048]
以cdna为模板将引物1和引物4配对扩增agrin基因片段上游与z位点插入序列之间的基因片段(5658bp),反应体系如下:
[0049][0050]
所有操作均在冰上进行,各组分解冻后请充分混匀,用完之后请及时放回-20℃保存。
[0051]
反应程序如下:
[0052][0053]
以cdna为模板将引物2和引物3配对扩增agrin基因片段下游与z位点插入序列之间的基因片段(546bp),反应体系如下:
[0054][0055]
所有操作均在冰上进行,各组分解冻后请充分混匀,用完之后请及时放回-20℃保存。
[0056]
反应程序如下:
[0057][0058]
以上述两个反应的pcr产物(以第一次pcr产物和第二次pcr产物以摩尔比1:1混合作为模板)为模板将引物1和引物2配对扩增编码agrin基因的片段(6204bp),反应体系如下:
[0059][0060]
反应程序如下:
[0061][0062]
将最后一步获得的pcr产物进行1%琼脂糖凝胶电泳,120v,25min,琼脂糖凝胶电泳时使用大孔胶,尽量上样一孔或两孔,以提高回收效率。根据axyprep dna凝胶回收试剂盒提供使用说明书,琼脂糖凝胶电泳结束后在紫外灯下切胶回收,回收时将融化的胶液重复收集于吸附柱,回收目的条带凝胶,得到回收产物,即为重叠延伸rt-pcr产物,其中为带有酶切位点的agrin目的片段。
[0063]
二、双酶切
[0064]
1、agrin目的基因片段
[0065]
带有酶切位点的agrin目的片段(重叠延伸rt-pcr产物)用限制性内切酶sgfⅰ和mluⅰ进行双酶切,酶切质粒的质量根据所选酶切体系,使用1μl的酶量对应3μg的质粒,无论使用快切酶还是普通酶酶切时间应大于3小时。酶切体系如下:
[0066][0067]
2、pcmv6-ac-gfp载体片段获取
[0068]
选用含有gfp标签的pcmv6-ac-gfp质粒作为真核表达质粒,如图3所示。将pcmv6-ac-gfp质粒用限制性内切酶sgfⅰ和mluⅰ进行双酶切,酶切质粒的质量根据所选酶切体系,使用1μl的酶量对应3μg的质粒,无论使用快切酶还是普通酶酶切时间应大于3小时。酶切体系如下:
[0069][0070]
3、酶切产物的回收
[0071]
双酶切产物进行1%琼脂糖凝胶电泳,120v,25min,琼脂糖凝胶电泳时使用大孔胶,尽量上样一孔或两孔,以提高回收效率。琼脂糖凝胶电泳结束后切胶回收,回收时将融化的胶液重复收集于吸附柱,回收目的条带凝胶,胶回收,得到agrin目的基因片段和pcmv6-ac-gfp载体片段。
[0072]
三、获取用于表达agrin蛋白的重组质粒
[0073]
1、t4连接酶连接
[0074]
将agrin目的基因片段和pcmv6-ac-gfp载体片段使用dna t4连接酶在22℃条件下连接20h。agrin目的基因片段与pcmv6-ac-gfp载体片段的摩尔比为3:1。连接体系如下:
[0075][0076]
2、获取pcmv6-ac-agrin-gfp质粒
[0077]
连接产物转化大肠杆菌dh5α感受态细胞,转化产物涂布于含有100mg/l氨苄青霉素的lb固体培养板,37℃生长16h以后挑选单菌落扩大培养,运用质粒提取试剂盒说明书提取质粒,命名为pcmv6-ac-agrin-gfp质粒。
[0078]
3、pcmv6-ac-agrin-gfp质粒酶切鉴定
[0079]
1)对pcmv6-ac-agrin-gfp质粒单酶切及双酶切使其线性化;单酶切体系如下:
[0080][0081]
双酶切体系如下
[0082][0083]
2)对单酶切、双酶切产物进行琼脂糖凝胶电泳鉴定,结果如图4所示,图中a为marker,b为pcmv6-ac-gfp空载质粒,c为含有agrin基因的质粒,d为含有agrin基因的质粒单酶切产物,e为含有agrin基因的质粒双酶切产物。
[0084]
4、pcmv6-ac-agrin-gfp测序鉴定
[0085]
对pcmv6-ac-agrin-gfp质粒进行测序,运用seqman软件对测序结果进行拼接比对,测序比对结果如图5所示。由图5可知测序结果正确。
[0086]
5、验证pcmv6-ac-agrin-gfp质粒表达情况
[0087]
1、细胞转染
[0088]
1)转染前一天将hek293t细胞消化离心,以1
×
105每孔的数量铺于6孔板,并加入2ml含10%胎牛血清的dmem培养基于37℃湿式co2培养箱培养过夜。
[0089]
2)细胞生长至70-80%汇合时进行转染,3μl turbofectin 8.0试剂与200ul dmem混匀放置五分钟,加入1μg pcmv6-ac-agrin-gfp质粒再次混匀,放置25分钟。每孔200μl逐滴加入至6孔板并摇匀。
[0090]
3)收集携带pcmv6-ac-agrin-gfp质粒的hek293t细胞,用ripa裂解液和pmsf蛋白酶抑制剂裂解收集细胞,对其细胞内总蛋白提取,对胞内总蛋白进行sds-page电泳进行蛋白鉴定,结果如图6所示,agrin蛋白的分子量为217kda,绿色荧光标签蛋白gfp为25kda,融合蛋白总分子量为242kda,因此从图中可以看出agrin蛋白正常表达。
[0091]
实施例2
[0092]
将agrin目的基因片段与pcmv6-ac-gfp载体片段使用dna t4连接酶连接时,agrin目的基因片段与pcmv6-ac-gfp载体片段的摩尔比为10:1。其余操作与实施例1均相同。
[0093]
实施例3
[0094]
将agrin目的基因片段与pcmv6-ac-gfp载体片段使用dnat4连接酶连接时,agrin目的基因片段与pcmv6-ac-gfp载体片段的摩尔比为5:1。其余操作与实施例1均相同。
[0095]
实施例4
[0096]
一、细胞转染
[0097]
将hek293t细胞以(2.0-3.0)
×
104每孔的数量铺于24孔板,当细胞汇合70-80%时用构建好的pcmv6-ac-agrin-gfp质粒进行转染,转染试剂turbofectin 8.0与质粒pcmv6-ac-agrin-gfp的比例为3:1,继续培养48-60h后,获得pcmv6-ac-agrin-gfp质粒转染细胞。
[0098]
二、转染细胞的固定
[0099]
弃去pcmv6-ac-agrin-gfp质粒转染细胞中的培养基,用磷酸盐缓冲液(pbs)轻轻洗涤之后,采用用4%多聚甲醛在4℃冰箱中固定15-30min。
[0100]
三、转染细胞的封闭、通透
[0101]
弃去4%多聚甲醛,使用磷酸盐缓冲液(pbs)轻轻洗涤三次,每次5min;含有5%牛血清白蛋白和0.5%tritonx-100的pbs溶液在室温下封闭、通透3h,或者在4℃下过夜封闭、通透,获得处理后的pcmv6-ac-agrin-gfp质粒转染细胞。
[0102]
四、免疫荧光测定
[0103]
取待测血清,以1:10的稀释浓度添加至封闭、通透后的转染细胞中,室温下孵育45min-1h,pbs洗涤之后加入alexa fluor
tm
标记的羊抗人igg(荧光二抗),室温下孵育1-2h,pbs洗涤三次,每次五分钟,使用荧光显微镜的蓝色激发光和绿色激发光激发,观察并拍照记录。
[0104]
如图7所示,转染pcmv6-ac-agrin-gfp质粒的hek293t细胞能够表达绿色荧光蛋白(gfp)和agrin蛋白。agrin蛋白能与待测血清中的抗agrin抗体特异性结合。如果待测血清为阳性,则待测血清中的agrin-ab能与alexa fluor
tm 568标记的羊抗人igg,即alexa fluor
tm 568标记的羊抗人igg结合。在荧光显微镜的激发光下,用蓝色激发光激发gfp发绿色荧光,用绿色激发光激发alexa fluor
tm 568标记的羊抗人igg发红色荧光,当两者merge后呈黄色。如果待测血清为阴性,待测血清中不存在agrin-ab,则只能看到蓝色激发光激发gfp发绿色荧光而不能看到红色荧光。
[0105]
上述仅本发明较佳可行实施例,并非是对本发明的限制,本发明也并不限于上述举例,本技术领域的技术人员,在本发明的实质范围内,所作出的变化、改型、添加或替换,也应属于本发明的保护范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



