一种高效生产琥珀酸的重组大肠杆菌及其构建方法与流程
 2021-02-02 05:02:44|
2021-02-02 05:02:44| 433|
433| 起点商标网
起点商标网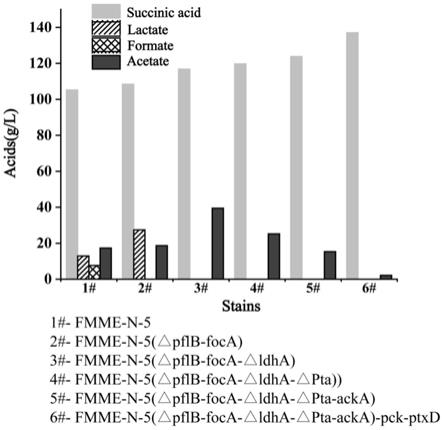
[0001]
本发明涉及一种高效生产琥珀酸的重组大肠杆菌及其构建方法,属于生物工程技术领域。
背景技术:
[0002]
琥珀酸,学名丁二酸,是一种重要的c4平台化合物。作为合成通用化学品的起始原料,琥珀酸在食品、化学、医药以及其他领域有广泛的应用,琥珀酸被美国能源部列为12种最有潜力大宗生物基化学品中的首位。
[0003]
琥珀酸的传统生产方法是化学合成法,主要有石蜡氧化法、氯乙酸甲酯氰化水解法和五氧化二钒催化加氢法等,但由于石油资源的减少和环境污染日益严重等问题,化学合成方法的弊端日益显现。而通过发酵法生产琥珀酸,能够摆脱对不可再生的战略资源石油的依赖,利用可再生资源,固定二氧化碳减轻温室效应,展现出良好的发展前景。目前研究较多的产琥珀酸的菌种有:产琥珀酸放线杆菌、产琥珀酸厌氧螺菌和大肠杆菌。产琥珀酸放线杆菌通常是从自然界中筛选,进行定向改造,能够耐受高浓度的琥珀酸盐,guettler m等人利用突变株产琥珀酸放线杆菌fz53生产琥珀酸产量最高,以葡萄糖为碳源,发酵48h产量可以达到最高产量110g/l,关于产琥珀酸放线杆菌菌种的研究较少,需要进一步的对其生理特性、发酵性能和遗传背景进行研究。产琥珀酸厌氧螺菌可以利用的发酵底物比较广泛,例如葡萄糖、乳糖、甘油等,samuelov等人的研究结果表明,在最适条件下,产琥珀酸厌氧螺菌琥珀酸的产率可以达到1.2mol/1.0mol葡萄糖,最高产量为65.0g/l,但是该菌株发酵需要严格的厌氧环境,工业化应用中很难实现。大肠杆菌作为模式菌株,遗传背景清晰,易操作,能够采用各种分子生物学的技术对菌种进行改造,所以采用大肠杆菌发酵琥珀酸已经成为一个热点,研究也取得了众多进展,vemuri等利用重组大肠杆菌afp111进行两阶段法发酵76h,琥珀酸的最终浓度可达到99.2g/l,得率达到1.1g/g葡萄糖,生产强度达到1.3g/l/h;张学礼等人运用基因工程及适应性进化策略构建得到重组大肠杆菌hx024,采用一步厌氧法发酵96h,最终琥珀酸产量达到95.9g/l,得率达到1g/g葡萄糖,朱丽雯等人组合优化表达ppc和pck基因,强化co2固定路径,重组大肠杆菌afp111菌株发酵96h,琥珀酸产量达到90.7g/l;张建国等人通过优化葡萄糖吸收代谢路径,同时敲除副产物乙酸编码基因,发酵65h,最终琥珀酸产量达到98.92g/l;
[0004]
目前大肠杆菌发酵的生产效率较低,发酵液中通常有乳酸、甲酸、乙酸、乙醇等副产物,发酵过程辅因子代谢不平衡、不能耐受高浓度的产物浓度以及底物葡萄糖浓度、高浓度渗透压和葡萄糖吸收利用速度过快导致代谢失衡、产品得率及生产强度低等问题;为了获得高性能的生产菌株,通常需要利用传统选育手段、各种组学分析与分子生物学改造相结合的方法。
技术实现要素:
[0005]
为解决上述问题,本发明提供一种高效生产琥珀酸的重组大肠杆菌,采用red同源
重组技术对宿主菌fmme-n-5敲除大肠杆菌中编码丙酮酸甲酸裂解酶基因pflb-foca基因、乳酸脱氢酶基因ldha基因、磷酸转乙酰基酶基因pta基因、并过表达琥珀酸合成路径中的关键酶磷酸式烯醇式丙酮酸羧激酶pck和亚磷酸酯脱氢酶ptxd。
[0006]
本发明的第一个目的是提供一种高效生产琥珀酸的重组大肠杆菌,所述重组大肠杆菌敲除了大肠杆菌中丙酮酸甲酸裂解酶编码基因pflb-foca、乳酸脱氢酶编码基因ldha、磷酸转乙酰基酶编码基因pta中的一种或多种,并过量表达了磷酸烯醇式丙酮酸所激酶pck和亚磷酸酯脱氢酶ptxd。
[0007]
进一步地,编码所述的磷酸烯醇式丙酮酸激酶的基因的核苷酸序列如seq id no.1所示,编码所述的亚磷酸酯脱氢酶的基因的核苷酸序列如seq id no.2所示。
[0008]
进一步地,所述磷酸烯醇式丙酮酸羧激酶pck和亚磷酸酯脱氢酶ptxd是通过质粒ptrchisa进行表达。
[0009]
进一步地,所述丙酮酸甲酸裂解酶编码基因pflb-foca的核苷酸序列如seq id no.3所示;乳酸脱氢酶编码基因ldha的核苷酸序列如seq id no.4所示;磷酸转乙酰基酶编码基因pta的核苷酸序列如seq id no.5所示。
[0010]
进一步地,所述重组大肠杆菌的宿主为大肠杆菌fmme-n-5,于2020年8月27日保藏于中国典型培养物保藏中心,保藏地址为中国武汉武汉大学,保藏编号为cctcc no:m 2020454。
[0011]
本发明的第二个目的是提供一种所述重组大肠杆菌的构建方法,所述构建方法的步骤为:
[0012]
(1)构建pflb-foca、ldha、pta基因敲除框片段;依次将基因敲除框片段转入带有pkd46质粒的宿主菌,筛选获得敲除目标基因的菌株;
[0013]
(2)扩增获得磷酸烯醇式丙酮酸羧激酶pck和亚磷酸酯脱氢酶ptxd基因片段;将基因片段连接到表达载体上,然后将连接有基因片段的表达载体转入步骤(1)的菌株中,得到所述的重组大肠杆菌。
[0014]
本发明的第三个目的是提供所述大肠杆菌在生产琥珀酸的应用,所述的应用是采用所述的重组大肠杆菌在发酵培养基中进行有氧-厌氧两阶段发酵,得到含有琥珀酸的发酵液。
[0015]
进一步地,所述的发酵培养基的配方为:葡萄糖30-50g/l,玉米浆15-25g/l,(nh4)2so
4 2-4g/l,k2hpo
4 1.2-2.0g/l,kh2po
4 0.5-1.0g/l,mgso4·
7h2o 0.2-0.5g/l,nacl 1-2g/l。
[0016]
进一步地,所述的有氧-厌氧两阶段发酵是在菌体od
600
=52-60时,将有氧阶段转为厌氧阶段。
[0017]
进一步地,将有氧阶段转为厌氧阶段是通过通入co2气体或者添加10-20g/l碳酸氢盐的方式进行。
[0018]
进一步地,在厌氧阶段,控制葡萄糖浓度为5-15g/l。
[0019]
进一步地,所述的有氧-厌氧两阶段发酵的接种量,按体积百分比计,为6-12%;发酵温度为35-38℃。
[0020]
进一步地,所述的有氧-厌氧两阶段发酵的发酵时间为50-96h。
[0021]
进一步地,在厌氧阶段,添加ph中和剂,所述ph中和剂为na2co3、k2co3、naoh、koh、
caco3、碱式碳酸镁一种或几种混合。
[0022]
进一步地,在有氧-厌氧两阶段发酵48h后,添加渗透压保护剂,所述渗透压保护剂为脯氨酸、甲硫氨酸、半胱氨酸、甜菜碱中的一种或几种混合。
[0023]
在本发明中,亚磷酸酯脱氢酶(ptxd)可以催化盐磷酸盐生成一分子磷酸盐,同时消耗一分子nad
+
生成一分子nadh,该反应产生的磷酸盐对细胞生长和ptxd活性不会产生抑制,且ptxd催化的反应不会直接竞争细胞代谢物,因此表达ptxd增加nadh供应的同时,不会对琥珀酸生成的主要代谢路径产生影响。
[0024]
本发明的有益效果:
[0025]
本发明采用red同源重组策略敲除影响琥珀酸生成的副产物编码的相关酶,包括丙酮酸甲酸裂解酶、乳酸脱氢酶、磷酸转乙酰基酶;在不影响菌体生长速度的同时会减少副产物的积累,同时有利于琥珀酸的积累;同时过量表达路径酶磷酸烯醇式丙酮酸羧激酶和过量表达亚磷酸酯脱氢酶,有效提高了琥珀酸的产量,最终得到的工程菌株e.coli fmme-n-5(δfoca-pflb-δldha-δpta)-pck-ptxd,发酵96h琥珀酸产量达到了137g/l,琥珀酸得率达到1g/g葡萄糖、生产强度为1.43g/l/h,副产物乳酸、甲酸不积累,乙酸低于10g/l;本发明构建菌株有利于琥珀酸的工业化生产。
[0026]
生物材料保藏
[0027]
大肠杆菌(escherichia coli)fmme-n-5,所述大肠杆菌已于2020年8月27日保藏于中国典型培养物保藏中心,保藏编号为cctcc no:m 2020454,保藏地址为中国武汉,武汉大学。
附图说明
[0028]
图1为敲除丙酮酸甲酸裂解酶胶验证图;
[0029]
图2为敲除乳酸脱氢酶胶验证图;
[0030]
图3为敲除磷酸转乙酰基胶验证图;
[0031]
图4为表达磷酸烯醇式丙酮酸羧激酶和亚磷酸酯脱氢酶重组载体结构图;
[0032]
图5为构建工程菌株发酵96h e.coli fmme-n-5(δfoca-pflb-δldha-δpta)-pck-ptxd发酵罐补料分批发酵结果。
具体实施方式
[0033]
下面结合具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
[0034]
序列表中未相关核苷酸序列信息:
[0035]
(1)seq id no.1序列信息为产琥珀酸放线杆菌来源的磷酸烯醇式丙酮酸羧激酶pck核苷酸序列;
[0036]
(2)seq id no.2序列信息为施氏假单胞菌的亚磷酸酯脱氢酶ptxd核苷酸序列;
[0037]
(3)seq id no.3序列信息为丙酮酸甲酸裂解酶编码基因pflb-foca的核苷酸序列;
[0038]
(4)seq id no.4序列信息为乳酸脱氢酶编码基因ldha的核苷酸序列;
[0039]
(5)seq id no.5序列信息为磷酸转乙酰基酶编码基因pta的核苷酸序列;
[0040]
菌体浓度的测定:
[0041]
取适量发酵液用2mol/l的盐酸中和后,菌体密度以分光光度计600nm波长下检测的吸光值来表示。
[0042]
葡萄糖的测定:
[0043]
发酵液预处理:取发酵液12000r/min离心5min取上清。稀释至适宜倍数,用m-100生物传感分析仪检测发酵液葡萄糖浓度。
[0044]
有机酸的测定:
[0045]
高效液相色谱法:发酵液预处理:取发酵液12000r/min离心5min取上清。稀释适宜倍数后,利用高效液相色谱仪(hplc)检测琥珀酸、乳酸、甲酸、乙酸的产量。仪器为waters e2695反相高效液相色谱仪,色谱柱采用bio-rad hpx 87h;流动相为5mmol/l h2so4;流速设定为0.6ml/min;检测器为紫外检测器,检测波长为210nm,柱温为35℃。
[0046]
实施例1:敲除丙酮酸甲酸裂解酶编码基因
[0047]
(1)为了实现编码丙酮酸甲酸裂解酶的基因的敲除以减少副产物加酸的量,借助red同源重组技术构建基因组编辑片段。基因编辑片段包括上下游同源臂区域、抗性筛选盒。以质粒pkd4为模板,设计序列如seq id no.6/seq id no.7引物对pflb-foca-s/pflb-foca-a扩增抗性筛选基因kan获得pflb-foca敲除框片段。
[0048]
(2)将pkd46质粒转化进入表达宿主e.coli fmme-n-5感受态细胞中,通过菌落pcr筛选得到重组菌株e.coli fmme-n-5-pkd46,然后将得到的pflb-foca敲除框片段采用电转的方法转入重组菌株e.coli fmme-n-5-pkd46感受态细胞中,采用50μg/ml的kan抗性平板筛选得到阳性转化子。最后借助温敏型质粒pcp20热诱导flp重组酶表达消除kan抗性基因,42℃培养转接3次,消除温敏型质粒pkd46和pcp20;成功得到了敲除丙酮酸甲酸裂解酶的e.coli fmme-n-5(δfoca-pflb)。
[0049]
引物序列信息:5
’→3’
方向
[0050]
pflb-foca-s:ttactccgtatttgcataaaaaccatgcgagttacgggcctataagtgtaggctggagctgcttc
[0051]
pflb-foca-a:atagattgagtgaaggtacgagtaataacgtcctgctgctgttctcatatgaatatcctccttag
[0052]
实施例2:敲除乳酸脱氢酶表达基因
[0053]
(1)e.coli fmme-n-5(δfoca-pflb)的构建同实施例1
[0054]
(2)为了进一步减少副产物乳酸的量以对编码乳酸脱氢酶的基因进行敲除,借助red同源重组技术构建基因组编辑片段。基因编辑片段包括上下游同源臂区域、抗性筛选盒。以质粒pkd4为模板,设计序列如seq id no.8/seq id no.9引物对ldha-s/ldha-a扩增抗性筛选基因kan获得ldha敲除框片段。
[0055]
(3)将pkd46质粒转化进入表达宿主e.coli fmme-n-5-δfoca-pflb感受态细胞中,通过菌落pcr筛选得到重组菌株e.coli fmme-n-5-δfoca-pflb-pkd46,然后将得到的ldha敲除框片段采用电转的方法转入重组菌株e.coli fmme-n-5-δfoca-pflb-pkd46感受态细胞中,采用50μg/ml的kan抗性平板筛选得到阳性转化子。最后借助温敏型质粒pcp20热诱导flp重组酶表达消除kan抗性基因,42℃培养转接3次,消除温敏型质粒pkd46和pcp20;成功得到了敲除乳酸脱氢酶的e.coli fmme-n-5(δfoca-pflb-δldha)。
[0056]
引物序列信息:5
’→3’
方向
[0057]
ldha-s:atgaactcgccgttttatagcacaaaacagtacgacaagaagtacgtgtaggctggagctgcttc
[0058]
ldha-a:ttaaaccagttcgttcgggcaggtttcgcctttttccagattgctcatatgaatatcctccttag
[0059]
实施例3:敲除磷酸转乙酰基酶表达基因
[0060]
(1)e.coli fmme-n-5(δfoca-pflb-δldha)的构建同实施例2
[0061]
(2)为了进一步减少副产物乙酸的量又保证细胞生长,以对编码磷酸专乙酰基的基因进行敲除,借助red同源重组技术构建基因组编辑片段。基因编辑片段包括上下游同源臂区域、抗性筛选盒。以质粒pkd4为模板,设计序列如seq id no.10/seq id no.11引物对pta-s/pta-a扩增抗性筛选基因kan获得pta敲除框片段。
[0062]
将pkd46质粒转化进入表达宿主e.coli fmme-n-5-δfoca-pflb-δldha感受态细胞中,通过菌落pcr筛选得到重组菌株e.coli fmme-n-5-δfoca-pflb-δldha-pkd46,然后将得到的pta敲除框片段采用电转的方法转入重组菌株e.coli fmme-n-5-δfoca-pflb-δldha-pkd46感受态细胞中,采用50μg/ml的kan抗性平板筛选得到阳性转化子。最后借助温敏型质粒pcp20热诱导flp重组酶表达消除kan抗性基因,42℃培养转接3次,消除温敏型质粒pkd46和pcp20;成功得到了敲除磷酸转乙酰基酶的e.coli fmme-n-5(δfoca-pflb-δldha-δpta)。
[0063]
引物序列信息:5
’→3’
方向
[0064]
pta-s:gtgtcccgtattattatgctgatccctaccggaaccagcgtcggtcgtgtaggctggagctgcttc
[0065]
pta-a:tacaccatcgcgctgactgcgattcagtctgcacagcagcagcagtaacatatgaatatcctccttag
[0066]
实施例4:敲除磷酸转乙酰基-乙酸激酶表达基因
[0067]
(1)e.coli fmme-n-5(δfoca-pflb-δldha-δpta)的构建同实施例3
[0068]
(2)为了进一步减少副产物乙酸的量,借助red同源重组技术构建基因组编辑片段。基因编辑片段包括上下游同源臂区域、抗性筛选盒。以质粒pkd4为模板,设计序列如seq id no.12/seq id no.13引物对pta-acka-s/pta-acka-a扩增抗性筛选基因kan获得pta-acka敲除框片段。
[0069]
将pkd46质粒转化进入表达宿主e.coli fmme-n-5-δfoca-pflb-δldha-δpta感受态细胞中,通过菌落pcr筛选得到重组菌株e.coli fmme-n-5-δfoca-pflb-δldha-pkd46,然后将得到的pta敲除框片段采用电转的方法转入重组菌株e.coli fmme-n-5-δfoca-pflb-δldha-pkd46感受态细胞中,采用50μg/ml的kan抗性平板筛选得到阳性转化子。最后借助温敏型质粒pcp20热诱导flp重组酶表达消除kan抗性基因,42℃培养转接3次,消除温敏型质粒pkd46和pcp20;成功得到了敲除磷酸转乙酰基-乙酸激酶的e.coli fmme-n-5(δfoca-pflb-δldha-δpta-acka)。
[0070]
引物序列信息:5
’→3’
方向
[0071]
pta-acka-s:atgtcgagtaagttagtactggttctgaactgcggtagttcttcagtgtaggctggagctgcttc
[0072]
pta-acka-a:tcaggcagtcaggcggctcgcgtcttgcgcgataaccagttcttccatatgaatatcctccttag
[0073]
实施例5:表达载体ptrchisa-pck的构建
[0074]
本发明所用的磷酸烯醇式丙酮酸羧激酶pck来源于产琥珀酸放线杆菌,提取产琥珀酸放线杆菌的基因组dna;
[0075]
根据已公布的基因组信息序列,分别设计序列如seq id no.14/seq id no.15引物对pck-s/pck-a,以提取的产琥珀酸放线杆菌基因组dna为模板,采用标准的pcr扩增体系和程序,扩增获取pck基因。
[0076]
pck-s:gggatccatgactgacttaaacaaactcgtt
[0077]
pck-a:ccgctcgagaatacgaaaacctggccgcggtt
[0078]
pcr扩增获取的pck,采用琼脂糖凝胶核酸电泳切胶回收,回收产物与表达载体ptrchisa分别利用限制性内切酶bamh i和xhoi进行双酶切3h,酶切产物采用琼脂糖核酸电泳凝胶回收,dna和线性化质粒大小分别为1617、4405bp,然后采用t4 dna连接酶16℃过夜连接,转化至jm109感受态细胞中,挑取单菌落pcr验证,阳性转化子进行测序,比对正确,证明表达载体构建成功,质粒命名为ptrchisa-pck。
[0079]
实施例6:表达载体ptrchisa-pck-ptxd的构建
[0080]
本发明所用的亚磷酸酯脱氢酶ptxd来源于施氏假单胞菌,提取铜绿假单胞菌的基因徐dna;
[0081]
根据已公布的基因组信息序列,分别设计序列如seq id no.16/seq id no.17引物对ptxd-s/ptxd-a,以提取的施氏假单胞菌的基因组dna为模板,采用标准的pcr扩增体系和程序,扩增获取ptxd基因。
[0082]
引物序列信息:5
’→3’
方向:
[0083]
ptxd-s:actcgagatgctgccgaaactggtgatcacg
[0084]
ptxd-a:aagcttaatcgtgcggcgaccaagccgaaa
[0085]
pcr扩增获取的ptxd,采用琼脂糖凝胶核酸电泳切胶回收,回收产物与表达载体ptrchisa-pck分别利用限制性内切酶xhoi和hind iii进行双酶切3h,酶切产物采用琼脂糖核酸电泳凝胶回收,dna和线性化质粒大小分别为1011、4370bp,然后采用t4 dna连接酶16℃过夜连接,转化至jm109感受态细胞中,挑取单菌落pcr验证,阳性转化子进行测序,比对正确,证明表达载体构建成功,质粒命名为ptrchisa-pck-ptxd。将重组质粒电转入表达宿主菌e.coli fmme-n-5(δfoca-pflb-δldha-δpta-acka),得到重组菌株e.coli fmme-n-5(δfoca-pflb-δldha-δpta-acka)-pck-ptxd。
[0086]
实施例7:重组菌株e.coli fmme-n-5(δfoca-pflb-δldha-δpta-acka)-pck-ptxd发酵罐补料分批发酵
[0087]
发酵罐上发酵培养基如下:发酵培养基为:发酵培养基为葡萄糖35g/l,玉米浆20g/l,(nh4)2so
4 3g/l,k2hpo
4 1.4g/l,kh2po
4 0.6g/l,mgso4·
7h2o0.5g/l,nacl 2g/l;补料培养基:葡萄糖800g/l;
[0088]
挑取e.coli fmme-n-5-δfoca-pflb-δldha-δpta-pck-ptxd重组菌株进行7..5l发酵罐两阶段发酵。单克隆接种于25ml(50ml摇瓶)的lb培养基作为一级种子液,置于38℃ 200rpm的条件下培养8.5h。取一级种子液200μl接种至50ml/500ml的种子培养基中;
38℃、200rpm培养7.5h得到二级种子液。发酵罐的初始装液量为4l,种子接种量为10%,有氧阶段发酵条件为:培养温度为38℃,通气量为1vvm,初始搅拌转速为600r/min,氨水控制ph为7.0,整个有氧阶段溶氧控制在20%的水平,当菌体浓度生长至od
600
=55-60时,转为厌氧发酵阶段;厌氧阶段:停止通气,搅拌转速为200r/min,补加800g/l葡萄糖并控制补料速率控制发酵液的ph<10g/l,厌氧阶段使用碱式碳酸镁控制ph=6.5,发酵周期为总共96h;
[0089]
根据琥珀酸的产量测定,结果如图5所示,发酵96h,重组菌株e.coli fmme-n-5-δfoca-pflb-δldha-δpta-pck-ptxd生产琥珀酸产量达到了137g/l,琥珀酸得率达到1g/g葡萄糖、生产强度为1.43g/l/h,副产物乳酸、甲酸不积累,乙酸仅有1-2g/l;
[0090]
以上结果说明,本发明技术采用基因工程技术,敲除相关副产物编码基因:丙酮酸甲酸裂解酶foca-pflb、乳酸脱氢酶ldha、磷酸转乙酰基酶pta、过量表达路径酶磷酸烯醇式丙酮酸羧激酶pck和亚磷酸酯脱氢酶ptxd平衡辅因子代谢能够有效提高琥珀酸的产量。
[0091]
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



