糖化蛋白传感器、测定方法、程序和传感器的制造方法与流程
 2021-02-02 04:02:44|
2021-02-02 04:02:44| 303|
303| 起点商标网
起点商标网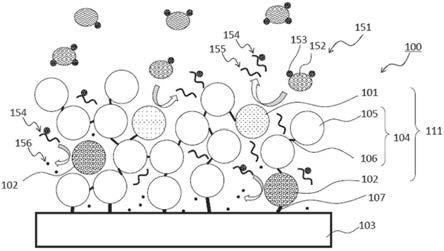
[0001]
本发明涉及糖化蛋白传感器、测定方法、程序和传感器的制造方法。
背景技术:
[0002]
作为糖尿病的诊断和血糖控制的管理指标,进行糖化蛋白的测定。作为一例,在临床现场会频繁地测定糖化血红蛋白和糖化白蛋白。作为糖化蛋白的测定方法,已知电泳法、离子交换色谱法、亲和色谱法、免疫法、酶法,但期望准确、并且简便且迅速的测定,因此,近年来,酶法已成为主流。
[0003]
一般的基于酶法的糖化蛋白的测定方法中,首先,在第一步骤中利用蛋白酶将蛋白质分解为氨基酸,在第二步骤中使酮胺氧化酶仅对这些氨基酸中的糖化氨基酸起作用而产生过氧化氢,在第三步骤中将该过氧化氢转换为显色反应并测定吸光度。
技术实现要素:
[0004]
在以往的糖化蛋白测定方法中,通过使蛋白酶和酮胺氧化酶共存而发生酶彼此的分解反应,因此难以以高精度进行测定。另外,以往的糖化蛋白测定方法中,用于测定的工序数多,因此存在如下问题:难以进行迅速的测定,并且根据检查人员的手法而容易产生测定误差。
[0005]
根据本发明的一个实施方式,糖化蛋白或果糖胺传感器具备固定化的蛋白酶、固定化的酮胺氧化酶和过氧化氢检测部。
[0006]
待测试样可以为溶液。溶液可以为体液,可以为体液来源的溶液,可以为体液的稀释液。溶液可以为并非体液(非体液来源)的溶液,可以为体液或体液来源的溶液与非体液来源的溶液的混合液。溶液可以为样品测定中使用的溶液,可以为用于校正的测定中使用的溶液。例如,溶液可以为标准液或校正液。
[0007]“体液”可以为血液、血清、血浆、淋巴液,可以为组织间液、细胞间液、间质液等组织液,可以为体腔液、浆膜腔液、胸水、腹水、心包液、脑脊液(髓液)、关节液(滑液)、眼房水(房水)。体液可以为唾液、胃液、胆汁、胰液、肠液等消化液,可以为汗液、泪液、鼻涕、尿液、精液、阴道分泌液、羊水、乳汁。体液可以为动物的体液,可以为人的体液。“体液”可以为包含动物来源的蛋白质的食品中的液体(牛奶、乳制品等)。体液可以为植物的体液、植物活体液或植物来源的液体。例如,体液可以为植物的果汁、蜜汁、树液。“体液”可以为溶液。
[0008]
若干实施方式中,溶液可以包含生理缓冲液。溶液可以包含测定对象物。缓冲液可以为所谓的被称为good
’
s缓冲液的缓冲液。缓冲液可以包含磷酸缓冲生理盐水(pbs)、n-三(羟甲基)甲基-2-氨基乙磺酸缓冲液(tes)。缓冲液可以包含2-吗啉代乙磺酸(mes)、3-吗啉代丙磺酸(mops)、2-羟基-3-吗啉代丙磺酸(mopso)、哌嗪-1,4-双(2-羟基-3-丙磺酸)二水合物(popso)、n-(2-乙酰胺)亚氨基二乙酸(ada)、哌嗪-1,4-双(2-乙磺酸)单钠(pipes)、n-(2-乙酰胺)-2-氨基乙磺酸(aces)、胆胺盐酸、n,n-双(2-羟乙基)-2-氨基乙磺酸(bes)、n-三(羟甲基)甲基-2-氨基乙磺酸(tes)、4-(2-羟乙基)-1-哌嗪乙磺酸(hepes)、2-[4-(2-羟
乙基)-1-哌嗪基]乙磺酸钠(hepes-na)、乙酰胺甘氨酸、三(羟甲基)甲基甘氨酸(tricine)、甘氨酸酰胺、n,n-二羟乙基甘氨酸(bicine)、双(2-羟乙基)亚氨基三(羟甲基)甲烷(bis-tris)、n-环己基-3-氨基丙磺酸(caps)、n-环己基-2-羟基-3-氨基丙磺酸(capso)、n-环己基-2-氨基乙磺酸(ches)、3-[n,n-双(2-羟乙基)氨基]-2-羟基丙磺酸(dipso)、3-[4-(2-羟乙基)-1-哌嗪基]丙磺酸(hepps)、2-羟基-3-[4-(2-羟乙基)-1-哌嗪基]丙磺酸一水合物(heppso)、n-三(羟甲基)甲基-3-氨基丙磺酸(taps)和2-羟基-n-三(羟甲基)甲基-3-氨基丙磺酸(tapso)中的任一种或混合液。
[0009]
溶液可以包含测定对象物。例如,可以是溶液为泪液、测定对象物为泪液中所含的糖化白蛋白。或者,测定对象物可以为血液或血清中的白蛋白、糖化白蛋白、血红蛋白、糖化血红蛋白,可以为间质液中的白蛋白、糖化白蛋白,可以为泪液中的白蛋白、糖化白蛋白,可以为尿液中的白蛋白、糖化白蛋白,可以为唾液中的白蛋白、糖化白蛋白。
[0010]
若干实施方式中,要感测的对象可以为果糖胺。若干实施方式中,传感器可以为果糖胺传感器。果糖胺可以为糖化蛋白,可以为糖化肽,可以为糖化氨基酸。糖化蛋白可以为糖化白蛋白,可以为糖化血红蛋白。糖化蛋白可以为age(advanced glycation end products,糖化终产物、晚期糖化终末产物)。若干实施方式中,要感测的对象可以为糖化脂质。
[0011]“固定化”是指:将酶(蛋白酶、酮胺氧化酶)等固定化于基板或基材。这些酶可以固定化于被固定在基板上的基材。若干实施方式中,酶可以直接或间接地固定于器件主体、流路内壁、腔室或收容部的壁面。出于固定化的目的,可以将酶介由构件而固定化于固定对象。酶可以介由并非以固定化为本来目的的一个或两个以上构件而固定化于固定对象。若干实施方式中,固定化有酶的固定对象可以能够实质上相对于器件主体等移动。例如,酶可以被固定于微珠,该微珠可以随着溶液的移动而能够相对于流路移动。
[0012]
作为固定化方法,例示性地,有共价键合法、物理吸附法、离子键合法、交联法、包裹法、生物化学性特异结合法等。可根据使用的酶来选择不会使酶失活的固定化方法,也可以将多种固定化方法组合使用。若干实施方式中,可以使用蛋白质作为基材,向其中混合酶后利用戊二醛等交联剂进行固化。由此,即使使用较昂贵的酶,也能够降低成本。若干实施方式中,可以使用氟系树脂、水硬性树脂、光固化性树脂、固体高分子电解质、聚离子复合物进行固定化,可以使用尼龙、乙基纤维素、醋酸纤维素、聚苯乙烯等水不溶性的半透膜来封闭酶,可以使用磷脂封闭到脂质体、反胶束中。
[0013]
为了将基材固定于基板上,可以使用硅烷偶联剂等粘接剂。粘接剂可以在基板与基材之间形成为层(硅烷偶联层)。过氧化氢检测部与其上的层例如可以介由接合剂而接合。关于接合剂,只要实质上不妨碍本发明的测定原理则可以使用各种接合剂。接合剂例如可以包含接合无机材料和有机材料的材料。接合剂可以为例如硅烷偶联剂。硅烷偶联剂可以例示性地列举以下物质。
[0014]
乙烯基系:乙烯基三甲氧基硅烷、乙烯基三乙氧基硅烷、7-辛烯基三甲氧基硅烷、乙烯基二甲基乙氧基硅烷、乙烯基甲基二甲氧基硅烷、乙烯基甲基二乙氧基硅烷、乙烯基三(2-甲氧基乙氧基)硅烷、乙烯基三(三甲基硅氧基)硅烷、4-乙烯基苯基三甲氧基硅烷、烯丙基三甲氧基硅烷、烯丙基三乙氧基硅烷、5-(三乙氧基甲硅烷基)-2-降冰片烯;
[0015]
苯乙烯基系:对苯乙烯基三甲氧基硅烷;
[0016]
甲基丙烯酸系:3-甲基丙烯酰氧基丙基三甲氧基硅烷、3-甲基丙烯酰氧基丙基甲基二甲氧基硅烷、3-甲基丙烯酰氧基丙基三乙氧基硅烷、3-甲基丙烯酰氧基丙基甲基二乙氧基硅烷、3-甲基丙烯酰氧基丙基三(三甲基硅氧基)硅烷、3-甲基丙烯酰氧基丙基三烯丙基硅烷、8-甲基丙烯酰氧基辛基三甲氧基硅烷;
[0017]
丙烯酸系:3-丙烯酰氧基丙基三甲氧基硅烷、3-丙烯酰氧基丙基二甲基甲氧基硅烷、3-丙烯酰氧基丙基三烯丙基硅烷;
[0018]
环氧系:3-环氧丙氧基丙基三甲氧基硅烷、3-环氧丙氧基丙基甲基二甲氧基硅烷、3-环氧丙氧基丙基甲基二乙氧基硅烷、8-环氧丙氧基辛基三甲氧基硅烷、2-(3,4-环氧环己基)乙基三甲氧基硅烷;
[0019]
氨基系:n-2-(氨基乙基)-3-氨基丙基三甲氧基硅烷、n-2-(氨基乙基)-3-氨基丙基甲基二甲氧基硅烷、n-2-(氨基乙基)-3-氨基丙基三乙氧基硅烷、n-2-(氨基乙基)-8-氨基辛基三甲氧基硅烷、n-6-(氨基己基)-3-氨基丙基三甲氧基硅烷、3-氨基丙基三甲氧基硅烷、3-氨基丙基甲基二甲氧基硅烷、3-氨基丙基三乙氧基硅烷(aptes)、3-氨基丙基甲基二乙氧基硅烷、3-三乙氧基甲硅烷基-n-(1,3-二甲基-亚丁基)丙胺、n-苯基-3-氨基丙基三甲氧基硅烷、n-甲基-3-氨基丙基三甲氧基硅烷、n,n-二甲基-3-氨基丙基三甲氧基硅烷、双[3-(三甲氧基甲硅烷基)-丙基]胺、n-(乙烯基苄基)-2-氨基乙基-3-氨基丙基三甲氧基硅烷盐酸盐;
[0020]
脲系:3-脲丙基三甲氧基硅烷、3-脲丙基三乙氧基硅烷;
[0021]
叠氮系:11-叠氮基十一烷基三甲氧基硅烷;
[0022]
异氰酸酯系:3-异氰酸酯基丙基三甲氧基硅烷、3-异氰酸酯基丙基三乙氧基硅烷;
[0023]
异氰脲酸酯系:三-(三甲氧基甲硅烷基丙基)异氰脲酸酯;
[0024]
巯基系:3-巯基丙基三甲氧基硅烷、3-巯基丙基甲基二甲氧基硅烷、3-巯基丙基三乙氧基硅烷;或者
[0025]
酸酐:3-三甲氧基甲硅烷基丙基琥珀酸酐。
[0026]
基板可以含有sio2作为主要成分,也可以为玻璃基板。基板可以包含高分子或树脂。基板可以包含透明高分子材料。基板例如可以包含聚对苯二甲酸乙二醇酯(pet)、聚萘二甲酸乙二醇酯(pen)、环烯烃聚合物(cop)等树脂材料而构成。基板可以为透明基板,也可以为不透明基板。基板可以为有柔软性(挠性)的基板。基板可以为蓝宝石基板。
[0027]
基材的主要成分可以为高分子。基材的主要成分可以为生物高分子,可以为有机高分子,可以为无机高分子。例如,基材可以为硅胶、玻璃、氧化铝、分子筛、硅藻土、木炭等多孔性无机材料、高岭石、陶瓷、羟基磷灰石等陶磁性物质、膨润土等粘土质、酸性白土、聚丙烯酰胺凝胶、聚乙烯醇树脂、氨基甲酸酯聚合物、有机硅树脂、苯乙烯树脂、全氟磺酸树脂、漆、纤维素、琼脂糖(琼脂)、海藻酸、角叉菜胶等多糖类、胶原蛋白(动物胶、明胶)、壳多糖、壳聚糖、多肽、聚赖氨酸,也可以含有上述物质。
[0028]
基材的主要成分可以为蛋白质。基材的主要成分可以为牛血清白蛋白(bovine serum albumin,bsa)。在由蛋白质构成基材的情况下,通常使用交联剂使酶和基材的蛋白质交联,从而进行固定化。也可以将成为基材的主要成分的蛋白质和交联剂一并称为“基材”。交联剂可以为感光固化性树脂、水固化性树脂或热固化性。交联剂可以为戊二醛等二官能团性的试剂。交联剂可以为甲醛,可以为选自乙二醛、丙二醛、丁二醛和戊二醛中的二
官能团性的试剂。
[0029]
基材的主要成分可以为离子基体,可以为聚离子复合物(以下简称为离子复合物)。通过将聚阴离子和聚阳离子在水溶液中混合,利用强的静电相互作用而形成聚离子复合物。离子基体可以通过静电固定于基板。离子基体可以通过静电将酶封闭到基体内。例如,可以通过混合聚氨基酸等相反电荷(阳离子和阴离子)的高分子而利用静电相互作用形成复合物,将酶等封闭到其中。离子基体不与酶直接结合,因此可以减少或避免酶的活性下降。离子基体可以用于在交联法中会失活的酶。
[0030]
基材可以为微珠。微珠可以为炭微粒(炭微珠),可以为二氧化硅(sio2)微粒(二氧化硅微珠)。微珠可以为高分子微珠。微珠的材料可以为壳多糖、壳聚糖、海藻酸等高分子多糖类。微珠可以为金属微粒、包含可磁化物质的微珠,可以为磁性微珠。关于微珠的尺寸,以其平均粒径计可以为10nm以上,可以为200nm以下。酶可以与微珠交联。微珠既可以直接固定于基板、其它基材,也可以不固定于基板或基材等、而是以收容于规定的容积内的方式配置。微珠可以不固定于器件主体、而是能够随着溶液的流动而移动。微珠可以以即使不直接固定于收容其的收容部、也实质上不会从该收容部离开的方式配置。由此,例如可以用稀释液、洗涤液等进行冲洗或淋洗而除去不要的物质且使微珠维持在其位置。由此,例如能够实现重复使用。
[0031]
基材可以包含多孔性材料。多孔性材料可以为陶瓷,可以为炭材料。基材可以为沸石。基材可以为金属有机结构体。
[0032]“蛋白酶”通常为对蛋白质、多肽进行水解、异化的肽键水解酶的总称。蛋白酶可以为将蛋白质分解为肽片段的酶。在蛋白质包含被糖化后的氨基酸残基的情况下,通过蛋白酶的作用而生成的肽片段中可能存在包含被糖化后的氨基酸残基的肽片段和完全未被糖化的肽片段。
[0033]“蛋白酶”可以为动物来源的蛋白酶,可以为植物来源的蛋白酶,可以为微生物来源的蛋白酶。蛋白酶可以为外肽酶,可以为内肽酶。蛋白酶可以为天冬氨酸蛋白酶、金属蛋白酶、丝氨酸蛋白酶或硫醇蛋白酶。
[0034]“蛋白酶”可以包含两个以上类型或种类的蛋白酶,也可以包含一个类型或种类的蛋白酶。例如,蛋白酶可以包含蛋白水解酶和肽酶中的一者,也可以包含两者。有时通过将两种以上蛋白酶混合来提高分解效率。蛋白酶可以包含修饰型蛋白酶或经修饰的蛋白酶。蛋白酶也可以与添加剂一起使用。添加剂可以为例如表面活性剂、尿素。添加剂例如可以使蛋白质变得不稳定或变性,但不限于此。通过使用修饰型蛋白酶、添加剂,例如可以提高蛋白质的分解效率、底物的选择性,但不限于此。
[0035]
动物来源的蛋白酶可以为胰蛋白酶、胰凝乳蛋白酶、胃蛋白酶、弹性蛋白酶、牛胰蛋白酶、组织蛋白酶、钙蛋白酶、蛋白酶-i型、蛋白酶-xx型、氨肽酶n、羧肽酶、胰酶(蛋白酶、淀粉酶等多种酶的混合物)等。
[0036]
植物来源的蛋白酶可以为木瓜蛋白酶、菠萝蛋白酶、生姜蛋白酶、激肽释放酶、无花果蛋白酶、木瓜凝乳蛋白酶、猕猴桃蛋白酶、羧肽酶w等。
[0037]
微生物来源的蛋白酶可以为芽孢杆菌属(bacillus)(或来源,以下同样)、土芽孢杆菌属(geobacillus)和类芽孢杆菌属(paenibacillus)、曲霉属(aspergillus)、青霉属(penicillium)、链霉菌属(streptomyces)、溶杆菌属(lysobacter)、酵母(yeast)来源、麦
轴梗霉属(tritirachium)、栖热菌属(thermus)、假单胞菌属(pseudomonas)、无色杆菌属(achromobacter)、根霉菌属(rhizopus)、葡萄球菌属(staphylococcus)等的蛋白酶。
[0038]
例如,可以基于通过测定吸光度而得到的蛋白质的消化或分解效率来选择蛋白酶。若干实施方式中,使用白蛋白(hsa)的分解前后的吸光度之差为100mabs以上的蛋白酶。白蛋白(hsa)的分解前后的吸光度之差可以为90mabs以上。白蛋白(hsa)的分解前后的吸光度之差可以为110mabs以上。
[0039]
蛋白酶可以从由蛋白酶-xxiv型、orientase(
オリエンターぜ
)22bf、orientase 90n、toyozyme nep-160和嗜碱性蛋白酶组成的组中选择。蛋白酶可以从由蛋白酶-xxiv型、orientase 22bf、orientase 90n、toyozyme nep-160和嗜碱性蛋白酶组成的组中选择。蛋白酶可以从由链霉蛋白酶、蛋白酶-xiv型组成的组中选择。
[0040]
蛋白酶可以为中性蛋白酶、酸性蛋白酶、碱性蛋白酶中的任一种。例如,在对泪液进行测定的情况下,可以采用中性或弱碱性蛋白酶。蛋白酶可以为在高温范围(例如60℃以上)也保持活性的耐热性蛋白酶(例如嗜热菌蛋白酶)。蛋白酶可以为在低温范围(例如30℃以下)也保持活性的低温活性蛋白酶。
[0041]
若干实施方式中,蛋白酶可以以干燥状态配置在传感器内。例如可以通过自然干燥、冷冻干燥法或喷雾干燥法来形成蛋白酶,但不限于此。若干实施方式中,可以以溶解于溶液中的状态配置。溶解于溶液中的蛋白酶可以冷却保存至使用为止。蛋白酶可以与溶液一起冷冻、并且在使用时溶解后使用。蛋白酶可以不进行干燥而保持于含水分的环境中。例如,蛋白酶可以配置在凝胶中。
[0042]“酮胺氧化酶”为识别糖化氨基酸或包含被糖化后的氨基酸残基的肽或肽片段的酮胺结构、将糖化氨基酸氧化而产生氨基酸、葡糖醛酮(α-酮醛)和过氧化氢的氧化酶。因此,酮胺氧化酶生成与所识别的糖化氨基酸或包含被糖化后的氨基酸残基的肽或肽片段的量成比例地或相关的量的过氧化氢。
[0043]
酮胺氧化酶可以为脱氢酶,可以为激酶,可以为氧化酶。酮胺氧化酶可以为果糖基氨基酸氧化酶(faod)、果糖基肽氧化酶、果糖基缬氨酰基组氨酸氧化酶、果糖基胺氧化酶、阿马多里酶、果糖基胺去糖化酶、这些的修饰型。
[0044]
若干实施方式中,酮胺氧化酶可以为作用于ε-氨基被糖化后的氨基酸或肽的氧化酶。氨基酸可以为赖氨酸。通过使用选择性作用于ε-氨基被糖化后的氨基酸或肽的氧化酶,可以构成糖化白蛋白传感器。
[0045]
若干实施方式中,酮胺氧化酶可以为作用于α-氨基被糖化后的氨基酸或肽的氧化酶。氨基酸可以为缬氨酸。通过使用作用于α-氨基被糖化后的氨基酸或肽的氧化酶,可以构成糖化血红蛋白传感器或糖化血红蛋白a1c(hba1c)传感器。
[0046]
若干实施方式中,传感器可以具备检测部。检测部可以为过氧化氢检测部。“过氧化氢检测部”(过氧化氢传感器)可以为电化学方式的电极,可以为过氧化氢电极。过氧化氢电极可以具有对电极、参比电极和工作电极。若干实施方式中,检测部可以检测氧。例如,可以检测因酶反应而减少的氧的量或浓度。一般认为,氧检测的灵敏度相对于成为噪声源的分子、离子而言比较低、干扰较强。通过氧检测,可以计测氧的消耗量。泪液在采集时已达到大气饱和,因此检测部可以用于泪液中的酶的感测。检测部可以按照能够选择性进行或组合进行多种检测方法的方式来构成。
[0047]
过氧化氢的检测可以为光学式检测。光学式检测可以包括吸光度或发光的测定。例如,可以从例如透明基板的背面测定通过加入过氧化物酶、4-氨基安替比林和显色剂而利用氧化缩合产生的醌染料的颜色变化。若干实施方式中,检测部可以包含发光试剂和光检测器。例如,作为发光试剂,可以使用鲁米诺。鲁米诺可以以粉末状来配置。可以使过氧化氢与鲁米诺反应,测定由鲁米诺反应引起的发光(波长460nm)的强度。试剂可以还包含六氰合铁酸钾、氢氧化钠等。鲁米诺反应中,可以使用金电极、铂电极、氧化铟锡透明电极(ito电极),通过进行交流驱动的电化学发光法进行测定。此外,在检测荧光反应的情况下,可以使用草酸酯与荧光物质的组合,可以使用光泽精(吖啶双(n-甲基吖啶))。检测部可以为上述以外的过氧化氢传感器。
[0048]“检测部上”可以为检测部的表面的一部分的上部,可以以覆盖检测部整体的方式配置。另外,可以为形成在基板上的检测部上。可以覆盖基板的整个表面,可以覆盖检测部上且覆盖基板的一部分。
[0049]
传感器可以具有液体收容部。液体收容部可以包含固定化的蛋白酶、固定化的酮胺氧化酶和检测部中的一者、两者或全部。液体收容部可以沿着长度方向延展。液体收容部的容积可以为1ml、500μl、300μl、200μl、100μl、50μl、30μl、20μl、10μl、5μl、4μl、3μl、2μl、1μl、0.9μl、0.8μl、0.7μl、0.6μl、0.5μl、0.4μl、0.3μl、0.2μl、0.1μl的值以下或小于上述的值。液体收容部可以具有液体导入口。液体收容部可以具有液体出口。液体收容部可以具有气孔。气孔可以具有如下功能:在将液体导入液体收容部时,将液体收容部中存在的气体排出到传感器外部。
[0050]
对本发明的糖化蛋白传感器等所带来的、例示性的或潜在的作用效果进行说明。
[0051]
蛋白酶能够分解其它蛋白酶。另外,蛋白酶还能分解(酮胺)氧化酶。未被固定的蛋白酶通过扩散等而在液体内移动,与其它蛋白酶、酮胺氧化酶相遇,可能将这些分解。蛋白酶的溶液不适合保存,需要每次称量固体的蛋白酶。通过预先将蛋白酶在器件内固定化,可以使测定步骤高效化。固定化的蛋白酶可以重复使用。本发明的酮胺氧化酶和蛋白酶通过进行固定化而能够实现重复测定,可以大幅降低每次测定的运行成本。可以在测定之间对器件内进行洗涤。本发明的糖化蛋白传感器能够实现小型化。另外,过氧化氢检测部与酮胺氧化酶固定化层靠近时,过氧化氢的扩散距离变短,变得不易受到与过氧化氢反应的体液中的干扰物质的影响。酮胺氧化酶、蛋白酶的固定化层分别以例如1微米(μm)以下的薄膜形成且形成在过氧化氢检测部上时,由于彼此靠近,因此能够实现高灵敏度的测定。而且,作为试剂来说较昂贵的酶的量即使少,也能够得到规定的灵敏度,能够降低制造成本。
[0052]
需要说明的是,将上述列举的本发明的一个或两个以上特征任意组合而成的实施方式也包含在本发明的范围内。
附图说明
[0053]
图1为本发明的一个实施方式的传感器的截面示意图。
[0054]
图2为本发明的一个实施方式的传感器的截面示意图。
[0055]
图3为本发明的一个实施方式的传感器的截面示意图。
[0056]
图4为本发明的一个实施方式的传感器的截面示意图。
[0057]
图5为本发明的一个实施方式的传感器的截面示意图。
[0058]
图6为本发明的一个实施方式的传感器的截面示意图。
[0059]
图7为本发明的一个实施方式的传感器的截面示意图。
[0060]
图8为本发明的一个实施方式的传感器的截面示意图。
[0061]
图9为本发明的一个实施方式的传感器的截面示意图。
[0062]
图10为本发明的一个实施方式的传感器的截面示意图。
[0063]
图11为本发明的一个实施方式的传感器的截面示意图。
[0064]
图12为本发明的一个实施方式的传感器的截面示意图。
[0065]
图13为示出本发明的一个实施方式的传感器的构成的示意图。
[0066]
图14为示出本发明的一个实施方式的传感器的构成的示意图。
[0067]
图15为示出本发明的一个实施方式的传感器的构成的示意图。
[0068]
图16为本发明的一个实施方式的传感器的平面示意图。
[0069]
图17为示出本发明的一个实施方式的传感器的构成的示意图。
[0070]
图18为本发明的一个实施方式的传感器芯片的平面示意图。
[0071]
图19为本发明的一个实施方式的传感器芯片的平面示意图。
[0072]
图20为本发明的一个实施方式的传感器芯片的平面示意图。
[0073]
图21为本发明的一个实施方式的传感器芯片的平面示意图。
[0074]
图22为本发明的一个实施方式的传感器芯片的平面示意图。
[0075]
图23a为示出本发明的一个实施方式的传感器的制造工序的截面示意图。
[0076]
图23b为示出本发明的一个实施方式的传感器的制造工序的截面示意图。
[0077]
图23c为示出本发明的一个实施方式的传感器的制造工序的截面示意图。
[0078]
图23d为示出本发明的一个实施方式的传感器的制造工序的截面示意图。
[0079]
图23e为示出本发明的一个实施方式的传感器的制造工序的截面示意图。
[0080]
图23f为示出本发明的一个实施方式的传感器的制造工序的截面示意图。
[0081]
图23g为示出本发明的一个实施方式的传感器的制造工序的截面示意图。
[0082]
图23h为示出本发明的一个实施方式的传感器的制造工序的截面示意图。
[0083]
图23i为示出本发明的一个实施方式的传感器的制造工序的截面示意图。
[0084]
图24为示出本发明的一个实施方式的传感器的局部构成的示意图。
[0085]
图25为示出本发明的一个实施方式的传感器的局部构成的示意图。
[0086]
图26为示出各蛋白酶的消化率的图。
[0087]
图27为示出各蛋白酶时的传感器输出的图。
[0088]
图28为示出蛋白酶和酮胺氧化酶对工作温度的依赖性的图。
[0089]
图29为示出传感器输出对糖化白蛋白浓度的依赖性的图。
具体实施方式
[0090]
1.传感器的结构
[0091]
使用图1来说明本发明的一个实施方式的糖化蛋白传感器的构成。图1所示的传感器100具有蛋白酶101、酮胺氧化酶102和过氧化氢检测部103。蛋白酶101和酮胺氧化酶102通过作为交联剂的戊二醛106而与作为基材的牛血清白蛋白105交联。牛血清白蛋白105也相互交联。这些形成了固定化层104。固定化层104通过硅烷偶联剂107与过氧化氢检测部
103连接。由此,蛋白酶101和酮胺氧化酶102相对于过氧化氢检测部103或传感器100整体被固定化。固定化层104以及该层所固定的蛋白酶101和酮胺氧化酶102一起形成酶层111。
[0092]
向传感器100导入糖化蛋白151。糖化蛋白151具有在蛋白质152上结合有糖153的结构。糖化蛋白151被蛋白酶101分解而产生肽片段。
[0093]
肽片段中,有被糖化后的肽片段154和未被糖化的肽片段155。认为这些肽片段会在固定化膜104内扩散开。若被糖化后的肽片段154与酮胺氧化酶102反应,则产生葡糖醛酮(未图示)和过氧化氢156。
[0094]
认为该过氧化氢156也会在固定化膜104内扩散开。过氧化氢检测部103检测该过氧化氢156,输出与其浓度相关的信号。
[0095]
在过氧化氢检测部103为过氧化氢电极的情况下,过氧化氢156在过氧化氢电极被分解,所释放的电子以电流的形式被检测。该反应可以记载如下。
[0096]
h2o2→
2h
+
+o2+2e-[0097]
过氧化氢156在过氧化氢电极103被消耗。因此,固定化膜104中的过氧化氢156的浓度在过氧化氢检测部103附近最低、随着远离过氧化氢检测部103而上升。即,在固定化膜104内存在过氧化氢156的浓度梯度。该浓度梯度在测定开始后立即变化,在规定的时间后基本稳定。在该稳定的时刻,过氧化氢电极103所检测到的过氧化氢156的浓度与导入到传感器100中的糖化蛋白151的浓度相关。预先求出糖化蛋白151的浓度与过氧化氢电极103中产生的电流值的相关性。在进行实际测定时,可以基于该校正,由过氧化氢电极103中产生的电流值计算待测体溶液中的糖化蛋白151的浓度。
[0098]
根据若干实施方式的传感器,蛋白酶和酮胺氧化酶可以被固定于同一基材(一体型)。
[0099]
图2示出若干实施方式(第二实施方式)的一体型的传感器的结构。传感器200具有蛋白酶201、酮胺氧化酶202、基材204和过氧化氢检测部203。蛋白酶201和酮胺氧化酶202被固定化于基材204,基材204被固定化于过氧化氢检测部203。图2所示的传感器200中,同一基材204以层或膜形成在过氧化氢检测部203上,在过氧化氢检测部203上形成有使蛋白酶201和酮胺氧化酶202固定化于基材204而成的酶层211。蛋白酶201和酮胺氧化酶202被固定化于该同一基材204中。
[0100]
图3示出若干实施方式(第三实施方式)的传感器的结构。传感器300具有蛋白酶301、酮胺氧化酶302、固定化有这些的基材304和固定化有基材304的过氧化氢检测部303。图3所示的传感器300中,同一基材304以层或膜形成在过氧化氢检测部303上,在过氧化氢检测部303上形成有使蛋白酶301和酮胺氧化酶302固定化于基材304而成的酶层311。图3所示的传感器300进一步在基材304与过氧化氢检测部303之间具有将两者粘接的粘接剂或接合剂305。该接合剂305可以为硅烷偶联剂。在过氧化氢检测部303在其表面具有电极之类的金属(未图示)的情况下,硅烷偶联剂可以将该金属与由有机材料形成的基材304比较牢固地接合。
[0101]
图4示出若干实施方式的传感器(第四实施方式)的结构。传感器400具有蛋白酶401、酮胺氧化酶402、固定化有这些的基材404、414、和固定化有基材414的过氧化氢检测部403。更详细而言,在过氧化氢检测部403上形成有包含酮胺氧化酶402的基材414的层(酮胺氧化酶层412)。在该酮胺氧化酶层412上、即与过氧化氢检测部403相反一侧的表面上形成
有包含蛋白酶401的基材404的层(蛋白酶层411)。即,在过氧化氢检测部403上依次层叠有酮胺氧化酶层412和蛋白酶层411。
[0102]
本发明的传感器中,蛋白酶和酮胺氧化酶可以层叠于检测部上,也可以不层叠。若干实施方式中,蛋白酶和酮胺氧化酶可以靠近检测部地配置,也可以配置在检测部的附近。
[0103]
若干实施方式中,蛋白酶层、酮胺氧化酶层或酶层的厚度可以为100μm、50μm、20μm、10μm、1μm、500nm、300nm、250nm、200nm、100nm、50nm等的值以下或小于上述的值。若干实施方式中,蛋白酶层、酮胺氧化酶层或酶层的厚度可以为10nm、20nm、25nm、30nm、50nm、100nm等的值以上或大于上述的值。
[0104]
根据若干实施方式的传感器,酮胺氧化酶部可以以包围蛋白酶部的方式配置(包围型)。
[0105]
图5示出若干实施方式的传感器(第五实施方式)的结构。传感器500具有蛋白酶501、酮胺氧化酶502、固定化有这些的基材504、514、固定化有基材514的过氧化氢检测部503和基板506。更详细而言,在基板506上设有过氧化氢检测部503。在过氧化氢检测部503上形成有固定化有酮胺氧化酶502的基材514(固定化酮胺氧化酶部512)。以包围固定化酮胺氧化酶部512的方式形成有固定化有蛋白酶501的基材504(固定化蛋白酶部511)。换言之,在基板506上,在实质上配置有过氧化氢检测部503的部分配置有固定化酮胺氧化酶部512,以覆盖固定化酮胺氧化酶部512和无过氧化氢检测部503的基板506的表面的方式配置有固定化蛋白酶部511。根据这样的结构,与酮胺氧化酶的固定化量相比,可以使蛋白酶的固定化量相对增加。由此,例如在作为大分子的蛋白质的基于蛋白酶的分解或消化成为限速等时,可以提高传感器的应答速度、检测灵敏度等。
[0106]
酶可以被固定化于基材内,也可以被固定化于基材的外表面(直接接合型)。
[0107]
图6所示的传感器600为直接接合型,具有蛋白酶601、酮胺氧化酶602和固定化有这些的过氧化氢检测部603。更详细而言,在过氧化氢检测部603上形成有固定有酮胺氧化酶602的基材614(酮胺氧化酶层612)。蛋白酶601通过交联剂604而固定于该酮胺氧化酶层612的上部表面。图6的蛋白酶601被固定于基材614。蛋白酶601可以与酮胺氧化酶602交联。
[0108]
图7示出具有过氧化氢电极的传感器结构的一例。图7中,作为蛋白酶与酮胺氧化酶的固定化的一例,示出图4那样的层叠结构。但是,蛋白酶与酮胺氧化酶的固定化的方式不限于此,如上述例示性地说明那样,即使是层叠结构也可以为图7以外的结构,可以为非层叠结构。
[0109]
图7所示的传感器700具有:形成在绝缘基板706上的过氧化氢电极730、配置在过氧化氢电极730上的酮胺氧化酶702及固定其的基材714(酮胺氧化酶层712)、以及配置在酮胺氧化酶层712上的蛋白酶701及固定其的基材704(蛋白酶层711)。在过氧化氢电极730与酮胺氧化酶层712之间涂布有粘接电极730的表面与基材714的硅烷偶联剂705。
[0110]
图7所示的过氧化氢电极730为三电极法用的电极,具有对电极731、参比电极732和工作电极733而构成。图7所示的传感器700还具有连接于过氧化氢电极730的电路770。该电路770具备运算放大器771、电压产生电路772和电流测定电路773。运算放大器的输出(out)连接于对电极731,反相输入(-in)连接于参比电极732,非反相输入(+in)连接于电压产生电路772。
[0111]
三电极法为如下方法:以与溶液或体液接触的方式设置对电极、参比电极和工作
电极,使对电极与工作电极之间具有规定的电位差,测定从对电极流入工作电极的电流。通常,若金属、金属氧化物等物质进入电解液,则在该物质与电解液之间产生称为界面电位的电位差。若在也考虑该电位差的基础上在对电极与工作电极之间施加电压,则电流从对电极流出,对电极与溶液之间的电位差可能发生变化。有时由于该电位差的变化而不能对溶液准确地施加期望的电压。三电极法中,为了避免这种情况,参比电极可以测定对电极所施加的电位,以使该电位固定为期望值的方式控制施加于对电极的电压。另外,存在反馈电路,其将参比电极所测定出的电位返回(反馈)给控制对电极的电路。
[0112]
2.起因于夹杂物的噪声的降低
[0113]
溶液中可能包含夹杂物。例如,测定体液中的蛋白质的情况下,会由于作为测定对象的蛋白质以外的蛋白质、肽片段、核酸、离子等各种夹杂物而产生测定噪声。这些夹杂物所引起的噪声会成为测定错误、测定误差的原因。因此,本发明的若干实施方式的传感器可以具有降低夹杂物给测定信号造成的影响的构成。
[0114]
<使用离子交换树脂的噪声降低>
[0115]
若干实施方式的传感器可以在检测器上具有离子交换树脂。
[0116]
图8所示的传感器800具有过氧化氢电极803、配置在过氧化氢电极803上的酮胺氧化酶802及固定其的基材814(酮胺氧化酶层812)、以及配置在酮胺氧化酶层814上的蛋白酶801及固定其的基材804(蛋白酶层811)。图8所示的传感器800还在酮胺氧化酶层812与过氧化氢电极803之间具有离子交换树脂807。
[0117]
例如,使用以nafion(注册商标)为代表的阳离子交换树脂,可以抑制或妨碍体液中存在的抗坏血酸、尿酸、特别是负离子等透过并到达检测部。例如,使用聚吡咯等阴离子交换树脂,可以抑制或妨碍多巴胺等、特别是正离子等透过并到达检测部。
[0118]
离子交换树脂可以包含一种、多种或至少一种离子交换树脂。离子交换树脂可以具有一种、多种或至少一种的层而构成。
[0119]
图8示出图4那样的层叠结构作为蛋白酶和酮胺氧化酶的固定化的一例。但是,蛋白酶和酮胺氧化酶的固定化的方式不限于此,如上述例示性地说明那样,即使是层叠结构也可以为图8以外的结构,可以为非层叠结构。
[0120]
<利用差分传感器的噪声降低>
[0121]
若干实施方式的传感器可以为一对或一组差动或差分传感器。传感器可以包含多对或多组差动或差分传感器。该差分型的传感器所具有的一组差分传感器可以具有主传感器和副传感器而构成。主传感器具备固定化的蛋白酶、固定化的酮胺氧化酶和检测部。副传感器对主传感器所检测到的主要测定对象物(待测物质)的灵敏度低,但是对成为噪声原因的分子具有与主传感器实质上相同或同样的灵敏度。
[0122]
作为一例,作为传感器,考虑了用于测定体液中的糖化蛋白的传感器。体液中包含作为待测物质的蛋白质以外的蛋白质、肽、维生素c、离子等。例如,肽片段由于被酮胺氧化酶识别而成为产生过氧化氢的原因。另外,体液中的离子可能被过氧化氢检测部检测到。
[0123]
因此,副传感器可以为以与主传感器基本相同的程度或具有某种相关性的方式检测包括上述在内的噪声原因的传感器。副传感器例如可以相对于主传感器而言不包含蛋白酶(蛋白酶非含有),其他结构基本相同。例如,对于副传感器而言,包含基材和酶的部分的表面积和高度尺寸、基材的种类、制造方法等与主传感器的对应项目可以基本相同。主传感
器与副传感器的、蛋白酶以外的材料、结构、制法等也可以不同。这种情况下,通过校正等求出彼此的相关性即可。
[0124]
若干实施方式中,差分传感器的主传感器和副传感器两者或其中一者的过氧化氢检测器可以被离子交换树脂覆盖,可以在过氧化氢检测器的表面配置离子交换树脂的层或膜。
[0125]
若干实施方式中,主传感器的构成例如可以为图3那样的酶层一体型。
[0126]
图9的传感器1000具有酶层一体型的主传感器1000a和副传感器1000b。
[0127]
图9所示的主传感器1000a为图2或图3那样的酶层一体型。具体而言,主传感器1000a具有蛋白酶1001、酮胺氧化酶1002、固定化有这些的基材1004、和固定化有基材1004的过氧化氢检测部1003a。图9所示的主传感器1000a中,同一基材1004以层或膜形成在过氧化氢检测部1003a上,在过氧化氢检测部1003a上形成有使蛋白酶1001和酮胺氧化酶1002固定化于基材1004而成的酶层1011a。蛋白酶1001和酮胺氧化酶1002的酶分子被固定化于该同一基材1004中。
[0128]
另一方面,图9所示的副传感器1000b可以为与主传感器1000a基本相同的构成、且不包含(非含有)蛋白酶1001。具体而言,副传感器1000b具有与主传感器1000a相同的酮胺氧化酶1002、基材1014和过氧化氢检测部1003b。具有酮胺氧化酶1002和基材1014的副传感器1000b的酶层1011b可以为与主传感器的酶层1011a基本相同的尺寸。
[0129]
主传感器1000a和副传感器1000b的过氧化氢检测器1003a、1003b分别连接于测定用电路1070a、1070b。这些电路1070a、1070b接收来自各过氧化氢检测器1003a、1003b的电流等输出信号,将其值转化为数字并送至cpu等运算部1030。若干实施方式中,从电路1070a、1070b向运算部1030的送信可以为利用电或光的有线方式,也可以为无线方式。
[0130]
运算部1030可以对来自主传感器1000a和副传感器1000b的信号进行差分等运算。通过基于来自副传感器1000b的信号从主传感器1000a的输出信号中除去相当于夹杂物等噪声的输出,可以以更高的精度检测关于测定对象物的信号。运算部1030可以还具备送信部(未图示),另外可以连接于外部的送信部。送信部可以通过光、电或电磁方式以有线或无线将信号送出。送出的信号可以为在运算部1030中进行差分运算后的信号。另一个实施方式中,送信部可以将来自主传感器1000a和副传感器1000b的信号分别送出。也可以在送达位置进行差分等运算。这些运算部的构成或功能不限于本实施方式,也可以用于其它实施方式。运算部可以在内部具备存储介质,也可以按照连接或连接于配置在运算部的外部的存储介质的方式构成。
[0131]
在差分型传感器中,主传感器的构成例如可以为图4那样的层叠型。
[0132]
图10所示的传感器1100具有层叠型的主传感器1100a和副传感器1100b。
[0133]
图10所示的主传感器1100a为图4那样的层叠型。图10所示的主传感器1100a具有蛋白酶1101、酮胺氧化酶1102、固定化有这些的基材1104、1114、和固定化有基材1114的过氧化氢检测部1103a。更详细而言,在过氧化氢检测部1103a上形成有包含酮胺氧化酶1102的基材1114的层(酮胺氧化酶层1112a)。在该酮胺氧化酶层1112a上、即与过氧化氢检测部1103a相反一侧的表面上形成有包含蛋白酶1101的基材1104的层(蛋白酶层1111a)。即,在过氧化氢检测部1103a上依次层叠有酮胺氧化酶层1112a和蛋白酶层1111a。
[0134]
若干实施方式中,各层中的基材可以使用不同的材料。例如,酮胺氧化酶层中可以
使用以蛋白质为主要成分的基材,蛋白酶层中可以使用以光交联性树脂为主要成分的基材。
[0135]
另一方面,图10所示的副传感器1100b为与主传感器1100a基本相同的构成、且不包含或非含有蛋白酶1101、其基材1104。具体而言,副传感器1100b具有与传感器1100a相同的酮胺氧化酶1102、基材1124和过氧化氢检测部1103b。具有酮胺氧化酶1102和基材1124的副传感器1100b的酶层1112b可以为与主传感器的酶层1111a、1112b整体基本相同的尺寸。
[0136]
在主传感器与副传感器之间,酶层的厚度可以不同。若干实施方式中,副传感器的酮胺氧化酶层的厚度可以与主传感器的酮胺氧化酶层的厚度相同。可以基于使用相同或不同的校正溶液得到的信号强度等的相关性而调节各传感器的膜厚。酶的浓度、总量在主传感器与副传感器之间可以相同也可以不同,可根据传感器来调整。基材的材质在主传感器与副传感器间之间也可以相同也可以不同。
[0137]
主传感器1100a和副传感器1100b的过氧化氢检测器1103a、1103b分别连接于测定用电路1170a、1170b。这些电路1170a、1170b接受来自各过氧化氢检测器1103a、1103b的电流等输出信号,将其值以数字形式送至cpu等运算部1130。
[0138]
若干实施方式中,差分型传感器中,主传感器的构成可以为例如图5那样的包围型。
[0139]
若干实施方式中,差分型传感器中,主传感器的构成可以为例如图6那样的直接接合型。
[0140]
图11所示的传感器1200具有直接接合型的主传感器1200a和副传感器1200b。
[0141]
图11所示的主传感器1200a为图4那样的直接接合型传感器,具有蛋白酶1201、酮胺氧化酶1202、和固定化有这些的过氧化氢检测部1203a。更详细而言,在过氧化氢检测部1203a上形成有固定有酮胺氧化酶1202的基材1214(酮胺氧化酶层1212a)。蛋白酶1201通过交联剂1204被固定于该酮胺氧化酶层1212a的上部表面。图11的蛋白酶1201固定于基材1214。蛋白酶1201与酮胺氧化酶1202交联。
[0142]
另一方面,图11所示的副传感器1200b不包含或非含有蛋白酶1201。具体而言,副传感器1200b具有与主传感器1200a相同的酮胺氧化酶1202、基材1224和过氧化氢检测部1203b。换言之,在过氧化氢检测部1203b上构成有包含酮胺氧化酶1202和基材1224的酶层1212b。
[0143]
主传感器1200a中,蛋白酶1201直接接合于酮胺氧化酶层1212a上。与此相对地,副传感器1200b的最表面可以实质上由基材1224构成。由此可认为,主传感器1200a和副传感器1200b中,最表面的分子、离子向基材内部的透过性等特性并不一定相同或有可能不同。因此,可以按照使主传感器1200a与副传感器1200b的特性实质上相同或具有相关性的方式,来相对地调节副传感器1200b的酶层1212b的构成、例如厚度、基材1224的种类、酮胺氧化酶1202的浓度、制造方法等。
[0144]
主传感器1200a和副传感器1200b的过氧化氢检测器1203a、1203b分别连接于测定用电路1270a、1270b。这些电路1270a、1270b接受来自各过氧化氢检测器1203a、1203b的电流等输出信号,将其值以数字形式送至cpu等运算部1230。
[0145]
差分传感器的主传感器和副传感器分别可以在过氧化氢检测部包含过氧化氢电极。例如,可以将图7所示的过氧化氢电极730和电路770配置在主传感器、将构成相同或者
相对而言不同的过氧化氢电极和电路配置在副传感器。
[0146]
在差分传感器的主传感器和副传感器中,可以共用过氧化氢检测部的局部构成。例如,在过氧化氢检测部配置过氧化氢电极的情况下,可以将工作电极配置在各个传感器、将对电极和参比电极配置在任一传感器而共用。
[0147]
图12所示的差分传感器1300中,在基板1306上配置有主传感器1300a和副传感器1300b。
[0148]
图12所示的主传感器1300a中,在过氧化氢电极1330a上介由硅烷偶联剂1305a而配置有酶层1311a。酶层1311a在基材1304内含有蛋白酶1301和酮胺氧化酶1302。图12所示的副传感器1300b中,在过氧化氢电极1330b上介由硅烷偶联剂1305b配置有酶层1311b。酶层1311b不含蛋白酶1301,在基材1324内含有酮胺氧化酶1302。
[0149]
主传感器1300a的过氧化氢电极1330a包含主传感器用工作电极1333a和对电极1331。另一方面,副传感器1300b的过氧化氢电极1330b包含副传感器用工作电极1333b和参比电极1332。这些电极连接于电路1370。
[0150]
换言之,图12所示的过氧化氢电极1330a、1330b为三电极法用电极,工作电极1333a、1333b分别配置在主传感器1300a和副传感器1300b。另一方面,对电极1331和参比电极1332仅配置在主传感器1300a和副传感器1300b中的任一者。
[0151]
图12所示的传感器1300还具有连接于过氧化氢电极1330a、1330b的电路1370。该电路1370具备分别连接于运算放大器1371与电压产生电路1372、和主传感器1300a与副传感器1300b的电流测定电路1373a、1373b。运算放大器的输出(out)连接于对电极1331,反相输入(-in)连接于参比电极1332,非反相输入(+in)连接于电压产生电路1372。
[0152]
测定时,包含待测物质(测定对象物、被测定物质)的溶液(未图示)与主传感器1300a和副传感器1300b两者接触。因此,对电极1331可以相对于参比电极1332的电位产生恒定的电位差、并且对主传感器用工作电极1333a和副传感器用工作电极1333b两者施加期望的电压。电流测定电路1373a、1373b分别检测来自主传感器1300a和副传感器1300b的输出信号,向外部(未图示)提供输出信号。通过这样的构成,可以减小电极的面积、使传感器和器件小型化。
[0153]
图12的主传感器1300a的酶层具有图2那样的一体型的构成,但不限于此。图12的副传感器1300b也同样地不限于此。主传感器1300a和副传感器1300b可以由任一其它方式构成。
[0154]
图12中,主传感器1300a和副传感器1300b中分别配置有电流测定电路1373a、1373b,但不限于该构成。可以配置一个电流测定电路和开关电路,将来自主传感器用工作电极1333a和副传感器用工作电极1333b的信号用开关电路交互地或在规定时机提供给电流测定电路,进行检测或测定。
[0155]
蛋白酶、酮胺氧化酶和检测部可以进行层叠等配置在同一部位或靠近地配置。若干实施方式中,可以是酮胺氧化酶与检测部层叠或靠近地配置、蛋白酶与这些分开地配置。另一个实施方式中,可以是蛋白酶、酮胺氧化酶和检测部彼此分开地配置。通过将蛋白酶与其它构成分开并固定地配置,可以使基于蛋白酶的分解反应的包括时间、温度在内的各种条件高效化或最佳化。在使基于蛋白酶的分解反应充分进行后,可以将作为反应产物的肽片段送至酮胺氧化酶。
[0156]
若干实施方式中,蛋白酶、酮胺氧化酶和检测部可以从溶液的上游起、或者从上游侧向下游侧、换言之沿着溶液的导入方向或反应顺序的方向,按照蛋白酶、酮胺氧化酶和检测部的顺序进行配置。由此,可以将各反应中的反应产物高效地输送到下一个反应。
[0157]
若干实施方式中,蛋白酶、酮胺氧化酶和检测部可以分别收容在划定的收容部(腔室)内。可以使各反应在对应的收容部内发生,另外可以使某一反应与其它反应分开进行。由此,可以降低由于其它反应的条件、制备条件而造成的限制、影响,使期望的反应高效地进行。例如,可以充分获得利用蛋白酶将糖化蛋白分解为肽片段的时间,在期望的时间后将肽片段送至酮胺氧化酶。
[0158]
图13所示的传感器1400中,蛋白酶、酮胺氧化酶和检测部彼此分开地配置。另外,蛋白酶、酮胺氧化酶和检测部沿着溶液的导入方向或反应顺序的方向从上游侧向下游侧按照蛋白酶、酮胺氧化酶和检测部的顺序进行配置。而且,蛋白酶、酮胺氧化酶和检测部分别收容在划定的收容部(腔室)内,彼此进行流体连接。
[0159]
对图13更详细地进行说明。从液体导入口1452进来的液体进入蛋白酶收容部1455。液体可以经由流路而进入至液体导入口1452。也可以利用毛细管现象将液体送至溶液导入口1452。蛋白酶收容部1455中,以固定于微珠1404的状态收容有蛋白酶1401。若干实施方式中,微珠1404可以固定于收容部1455的内壁。另一个实施方式中,微珠1404可以不直接固定于收容部1455。例如,通过相对于足够大的微珠1404收窄流路,从而形成微珠1404实质上被固定于收容部1455内的状态。
[0160]
图13所示的蛋白酶收容部1455中配置有加热器1460。加热器1460可以加热蛋白酶收容部1455内的溶液或蛋白酶1401或控制其温度、提高基于蛋白酶的分解反应的速度等,使反应高效化或最佳化。图13中记载了利用电流的加热器,但不限于此。加热器可以采用电以外的加热方式。另一个实施方式中,可以配置有温度调节器。
[0161]
若干实施方式中,可以控制蛋白酶的温度。若干实施方式中,可以统一或分别控制蛋白酶、酮胺氧化酶的温度。若干实施方式中,可以控制传感器或传感器芯片的一部分或整体的温度。若干实施方式中,可以控制蛋白酶收容部的温度。可以控制蛋白酶等的加热时间、温度分布。
[0162]
若干实施方式中,蛋白酶的温度可以为20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃和60℃中的任一温度以上或高于上述任一温度。若干实施方式中,蛋白酶的温度可以为80℃、75℃、70℃、65℃、60℃、55℃、50℃、45℃、40℃和35℃中的任一温度以下或低于上述任一温度。若干实施方式中,蛋白酶的温度可以为该蛋白酶的最适温度范围。若干实施方式中,蛋白酶的温度可以低于发生失活的温度。
[0163]
在蛋白酶收容部1455内,生成的肽片段被输送至在基材1414固定有酮胺氧化酶1402的酮胺氧化酶收容部1456。
[0164]
若干实施方式中,可以利用毛细管现象进行溶液状态的蛋白酶从蛋白酶收容部1455向酮胺氧化酶收容部1456的输送。例如,可以对各收容部与其之间的流路的截面积和距离等形状、内壁的亲水性或疏水性等材质等进行选择或调节,来调节溶液状态的蛋白酶在蛋白酶收容部1455内的停留时间、向酮胺氧化酶收容部1456的送液的时机等。
[0165]
若干实施方式中,可以用有机硅等柔软性或弹性物质以容积可变的方式构成蛋白酶收容部1455,在规定的时机从外部施加压力而使其变形,从而使液体从蛋白酶收容部
1455排出。可按照此时液体导入口1452关闭、使得液体不会逆流到液体导入口1452的方式构成。
[0166]
酮胺氧化酶收容部1456中,酮胺氧化酶1402固定于基材1414。图13中,基材1414和酮胺氧化酶1402以固定化层的形式形成在酮胺氧化酶收容部1456内。被输送到酮胺氧化酶收容部1456内的肽片段与酮胺氧化酶1402反应,其结果是产生过氧化氢。
[0167]
若干实施方式中,可以控制酮胺氧化酶的温度。若干实施方式中,可以控制酮胺氧化酶收容部的温度。若干实施方式中,可以以使蛋白酶的温度与酮胺氧化酶的温度不同的方式控制各自的温度。若干实施方式中,可以以使蛋白酶的温度高于酮胺氧化酶的温度的方式控制各自的温度,或者,可以以使酮胺氧化酶的温度低于蛋白酶的温度的方式控制各自的温度。若干实施方式中,对于蛋白酶的温度控制和酮胺氧化酶的温度控制而言,可以同时进行,可以在不同的时间范围进行,或者以部分时间范围重叠的方式进行。若干实施方式中,可以控制酮胺氧化酶等的加热时间、温度分布。
[0168]
若干实施方式中,酮胺氧化酶的控制温度可以为10℃、12℃、15℃、20℃、25℃、30℃、35℃和37℃中的任一温度以上或高于上述任一温度。若干实施方式中,酮胺氧化酶的控制温度可以为70℃、60℃、55℃、50℃、45℃、40℃、37℃和35℃中的任一温度以下或低于上述任一温度。酮胺氧化酶的温度控制可以通过加热、冷却、或加热与冷却的组合来进行。
[0169]
若干实施方式中,测定时酮胺氧化酶可以保持在室温下。若干实施方式中,可以对测定时的酮胺氧化酶的温度进行测定、并且对检测器得到的结果进行温度校正。例如,可以在使酮胺氧化酶保持在室温下的同时进行测定,对测定结果进行温度校正。若干实施方式中,可以对测定时或肽片段化时的蛋白酶的温度进行测定,对检测器得到的结果进行温度校正。若干实施方式中,可以基于测定时或肽片段化时的蛋白酶的温度以及测定时的酮胺氧化酶的温度,对测定结果进行温度校正。作为例子,可以通过进行温度校正而简化酮胺氧化酶和蛋白酶中的至少一者的温度控制。由此,例如可以将电源设为电池、使传感器构成小型化。
[0170]
过氧化氢被输送至检测反应器1457,利用检测器1431来进行检测。图13中,在检测反应器1457内部配置有包含鲁米诺的试剂1431,在外部配置有光检测器(光电二极管)1432,从而检测基于鲁米诺反应的发光。
[0171]
酮胺氧化酶在固定化层内可以不固定于基材。酮胺氧化酶可以固定于微珠。
[0172]
图14所示的传感器1500与图13所示的传感器1400的构成局部相似,但是,酮胺氧化酶1502固定于微珠1504并被收容于酮胺氧化酶收容部1556内。
[0173]
图13所示的传感器1400、图14所示的传感器1500中,检测器具有用于鲁米诺反应的试剂和检测发光的光检测器而构成。但是,在同样的构成中,可以将检测器设为其它检测器。作为检测器,可以使用其它光检测器,也可以使用过氧化氢电极。
[0174]
若干实施方式中,可以使酮胺氧化酶与过氧化氢检测器接触或靠近、使蛋白酶与这些分开地进行配置。使酮胺氧化酶与过氧化氢检测器靠近地配置的方法为降低过氧化氢检测器进行检测的噪声因素的影响或提高过氧化氢的检测灵敏度的一种方法。
[0175]
图15所示的传感器1600中,酮胺氧化酶1602靠近过氧化氢检测器1603且被固定、蛋白酶1601与这些分开地配置。
[0176]
从液体导入口1652进来的液体进入蛋白酶收容部1655中。蛋白酶收容部1655中,
以固定于微珠1604的状态收容有蛋白酶1601。
[0177]
图15所示的蛋白酶收容部1655中配置有加热器1660。加热器1660可以加热蛋白酶收容部1655内的溶液或蛋白酶1601或控制其温度,使基于蛋白酶的分解反应高效化或最佳化。图15中记载了利用电流的加热器,但不限于此。加热器也可以采用电以外的加热方式。另一个实施方式中,可以配置有温度调节器。
[0178]
在蛋白酶收容部1655内,生成的肽片段被输送到收容有固定的酮胺氧化酶1602和过氧化氢检测器1603的酮胺氧化酶收容部1656。
[0179]
酮胺氧化酶收容部1656中,酮胺氧化酶1602固定于基材1614而形成酶层1611。图15中,基材1614和酮胺氧化酶1602以固定化层的形式形成在酮胺氧化酶收容部1656内。被输送到酮胺氧化酶收容部1656内的肽片段与酮胺氧化酶1602反应,其结果是产生过氧化氢。所产生的过氧化氢被靠近配置的过氧化氢检测器1603检测。
[0180]
在将蛋白酶和酮胺氧化酶分开配置的构成中,可能存在处于溶液中的物质等中的噪声原因。本发明的传感器可以还具有用于降低这样的噪声的机构,可以按照与该机构连接的方式构成。
[0181]
若干实施方式中,可以将过氧化氢检测器用离子交换树脂覆盖,可以在过氧化氢检测器的表面配置离子交换树脂的层或膜。
[0182]
若干实施方式的传感器可以为具有将蛋白酶和酮胺氧化酶分开配置的构成的、一对或一组差动或差分传感器。
[0183]
若干实施方式的差分传感器中,可以将过氧化氢检测器用离子交换树脂覆盖,可以在过氧化氢检测器的表面配置离子交换树脂的层或膜。
[0184]
图16所示的传感器1700中,蛋白酶与酮胺氧化酶分开、配置在另外的收容部内。
[0185]
从导入口1752导入的溶液被分流到主传感器1700a和副传感器1700b中。溶液在主传感器1700a中被导入蛋白酶收容部1755a中。在蛋白酶收容部1755a中配置有固定化有蛋白酶的酶层1711a。蛋白酶收容部1755a中产生的肽片段通过流路而被输送到酮胺氧化酶收容容器1756a中。在图16所示的酮胺氧化酶收容容器1756a内配置有固定化有酮胺氧化酶的酮胺氧化酶层1712a和过氧化氢检测器1703a。通过酮胺氧化酶收容容器1756a的反应,被糖化后的肽片段最终形成过氧化氢而被检测到。
[0186]
另一方面,副传感器1700b的流路、收容部与主传感器1700a同样地构成,但未配置蛋白酶。即,溶液首先被导入的腔室1755b采取与主传感器1700a的蛋白酶收容部1755a同样的结构,但未收容蛋白酶。作为无蛋白酶的腔室1755b之后的腔室(收容部),配置有酮胺氧化酶收容容器1756b。在副传感器1700b的酮胺氧化酶收容容器1756b内,与主传感器1700a的酮胺氧化酶收容容器1756a同样地配置有固定化有酮胺氧化酶的酮胺氧化酶层1712b和过氧化氢检测器1703b。
[0187]
在主传感器1700a的蛋白酶收容部1755a和副传感器1700b的对应腔室1755b中,设置有加热器1760。由此,可以提高蛋白酶收容部1755a内的基于蛋白酶的分解反应的速度、使该反应高效化或最佳化。而且,可以使副传感器1700b的流路的构成、条件除了无蛋白酶以外均与主传感器1700a的流路的构成、条件尽量相同或同样。
[0188]
可以计算来自主传感器1700a的过氧化氢检测器1703a的输出信号与来自副传感器1700b的过氧化氢检测器1703b的输出信号的差分信号。由该差分运算,可以求出过氧化
氢检测器1712a中的作为对象的过氧化氢的浓度,然后可以求出与其相关的最初的溶液内的作为待测物质的糖化蛋白的浓度。
[0189]
若干实施方式中,可以分别对蛋白酶和酮胺氧化酶进行温度控制。若干实施方式中,可以配置分别针对蛋白酶和酮胺氧化酶的温度控制器件。温度控制器件可以为加热器件,可以为冷却器件,可以具有这两者,可以为能够进行冷热控制的器件。
[0190]
若干实施方式中,传感器可以在蛋白酶收容部和酮胺氧化酶收容部之间具有温度控制用收容部。若干实施方式中,在蛋白酶与酮胺氧化酶的工作温度不同的情况下,温度控制用收容部可以改变或控制从蛋白酶收容部送来的溶液的温度,从而使其接近酮胺氧化酶的工作温度。若干实施方式中,可以对蛋白酶配置加热器件并在温度控制用收容部中配置冷却器件。若干实施方式中,可以对酮胺氧化酶配置加热器件。
[0191]
图17所示的传感器1800具有串行地进行了流体连接的蛋白酶收容部1855、冷却用溶液收容部(冷却部)1858和酮胺氧化酶收容部1856。蛋白酶收容部1855具备液体导入口1852,可以从其中向蛋白酶收容部1855内导入溶液。蛋白酶收容部1855中,以固定于微珠1804的状态收容有蛋白酶1801。
[0192]
图17所示的蛋白酶收容部1855中配置有加热器1860。加热器1860加热蛋白酶收容部1855内的溶液或蛋白酶1801或者控制其温度,可以提高蛋白酶反应的速度等,使反应高效化或最佳化。
[0193]
在蛋白酶收容部1855内生成的肽片段经由冷却用溶液收容部1858而被送至经流体连接的酮胺氧化酶收容部1856。酮胺氧化酶收容部1856中,收容有固定的酮胺氧化酶1802和过氧化氢检测器1803。过氧化氢检测器1803连接于测定器(未图示),可以对其发送电信号。
[0194]
酮胺氧化酶收容部1856中,酮胺氧化酶1802被固定于基材1814而形成酶层1811。图17中,在酮胺氧化酶收容部1856内以固定化层的形式形成有基材1814和酮胺氧化酶1802。被输送到酮胺氧化酶收容部1856内的肽片段与酮胺氧化酶1802反应,其结果是产生过氧化氢。所产生的过氧化氢被靠近配置的过氧化氢检测器1803检测。
[0195]
酮胺氧化酶收容部1856中,配置有加热器1861。加热器1861加热酮胺氧化酶收容部1856内的溶液或酮胺氧化酶1802或控制其温度,可以提高酶反应的速度等,使反应高效化或最佳化。
[0196]
图17中,在蛋白酶收容部1855和酮胺氧化酶收容部1856中分别配置有各自的加热器1860、1861。由此,可以对蛋白酶1801和酮胺氧化酶1802分别进行温度控制或加热。由此,例如可以在时间上或温度上、或这两方面进行独立的温度控制。若干实施方式中,可以将蛋白酶收容部1855或蛋白酶1801的温度控制得比酮胺氧化酶收容部1856或酮胺氧化酶1802的温度高。若干实施方式中,可以将蛋白酶收容部1855或蛋白酶1801的温度控制得比酮胺氧化酶收容部1856或酮胺氧化酶1802的温度低。
[0197]
若蛋白酶收容部1855中加热后的溶液被送至酮胺氧化酶收容部1856,则该溶液需要花费时间才能达到对于酮胺氧化酶1802而言合适的温度,效率低,或者有时不能准确地测定。因此,可以在导入酮胺氧化酶收容部1856之前将溶液暂时冷却。图17所示那样的传感器1800可以使在经加热的蛋白酶收容部1855中被加热的溶液停留在冷却用溶液收容部1858内。将溶液用冷却器件(电路/元件)1862(例如珀耳帖元件)冷却,使其接近酮胺氧化酶
1802的最适温度或使用温度。此后,可以将溶液送至酮胺氧化酶收容部1856。由此,例如可以高效或准确地进行测定。
[0198]
作为一例,图17所示的传感器1800可以如下使用。即,首先将包含测定对象物的溶液导入蛋白酶收容部1855中。蛋白酶收容部1855既可以在溶液导入前开始加热,也可以在溶液导入后开始加热。在蛋白酶收容部1855中进行肽片段化后,将溶液送至冷却用溶液收容部1858。冷却用溶液收容部1858既可以在溶液导入前开始冷却,也可以在溶液导入后开始冷却。在冷却用溶液收容部1858中充分进行冷却或冷却到合适的温度后,可以将溶液送至酮胺氧化酶收容部1856。酮胺氧化酶收容部1856可以在溶液导入后开始加热。
[0199]
若干实施方式中,送液可以通过从溶液导入口1852施加压力来进行。若干实施方式中,送液可以通过改变各收容部1855、1856、1858的容积或对各收容部施加压力来进行。蛋白酶收容部1855可以具有气孔(未图示)。若干实施方式中,送液时的压力可以为正压。若干实施方式中,送液时的压力可以为负压。若干实施方式中,可以在各收容部的入口和出口附近分别配置阀门、或在两者的附近配置阀门。阀门可以发挥下述功能:将可能由于各收容部的温度差异等而产生的气泡从流路中去除。
[0200]
若干实施方式中,在溶液离开蛋白酶收容部时,蛋白酶和微珠也可以从蛋白酶收容部离开。例如,蛋白酶和微珠可以进入冷却用收容部,可以进入酮胺氧化酶收容部。若干实施方式中,可以按照蛋白酶和微珠在送液时实质上留在蛋白酶收容部的方式构成传感器。
[0201]
图17中记载了利用电流的加热器1860、1861和冷却器件1862,但不限于此。加热器1860、1861可以采用电以外的加热方式。冷却器件1862可以采用珀耳帖元件以外的冷却方式。另一个实施方式中,可以配置其它温度调节器。
[0202]
若干实施方式中,溶液导入口1852、蛋白酶收容部1855、冷却用溶液收容部1858和酮胺氧化酶收容部1856可以为一个部件,例如套盒、一次性的流体器件。若干实施方式中,加热器1860、1861和冷却器件1862可以固定于主体。可以按照上述流体器件插入或固定于该主体的方式构成传感器1800。在加热器1860、1861与冷却器件1862之间,可配置有绝热材料。由此,例如可以提高温度控制的效率。
[0203]
3.过氧化氢电极的配置
[0204]
过氧化氢电极的布局或配置可以有各种构成。以下例示性地说明过氧化氢电极的构成。
[0205]
<电极配置例1>
[0206]
本发明中所示的过氧化氢电极不限于糖化蛋白或果糖胺的测定用途,也可以用于包括溶液的电化学测定在内的其它用途。即,本发明的一个实施方式的传感器或传感器芯片包括过氧化氢电极。过氧化氢电极的参比电极可以夹在对电极和工作电极之间。传感器芯片可以具有液体收容部。液体收容部可以沿着长度方向延展。液体收容部的容积可以为10μl、5μl、4μl、3μl、2μl、1μl、0.9μl、0.8μl、0.7μl、0.6μl、0.5μl、0.4μl、0.3μl、0.2μl、0.1μl的值以下或小于该值。液体收容部可以具有液体导入口。液体收容部可以具有液体出口。液体收容部可以具有气孔。气孔可以具有下述功能:在将液体导入液体收容部时,将液体收容部中存在的气体排出到传感器芯片外部。传感器芯片可以具有电路,可以以连接于电路的方式构成。传感器芯片可以具有用于与电路连接的输出端子。
[0207]
图18为示意性地示出作为一个实施方式的传感器芯片的电极构成的俯视图。图18的传感器芯片2000中,在基板2006上按照与导入的溶液接触的方式配置对电极2031、参比电极2032、工作电极2033,按照覆盖这些电极的方式配置酶层2011。
[0208]
传感器芯片2000可以还具有将流路或液体收容部分区的构件、例如芯片罩,也可以形成为无这样的芯片罩的传感器芯片。图18中,规定流路和液体收容部的传感器芯片罩(未图示)盖在传感器芯片的上表面。规定出与液体收容部对应的传感器芯片上的部分2051,液体从导入口2052被导入液体收容部2051中。针对液体收容部2051,芯片罩在液体导入口2052的相反侧具有气孔2053。
[0209]
过氧化氢电极2031、2032、2033按照彼此平行、且沿着液体收容部2051在长度方向上延展的方式地配置。在液体导入口2052侧,工作电极2033的端部相对于其它电极即对电极2031、参比电极2032的端部较短地构成。从导入口2052导入的液体在液体收容部2051内沿着其长度方向前进。若液体首先或者与其它电极同时地接触工作电极2033,则有可能会流过大电流而对电极造成损伤。通过采取这样的构成,可以避免电极的损伤。
[0210]
图18所示的传感器芯片2000进一步在液体收容部内具有液体检测电极2034。图18中,在当液体进入液体收容部2051中时液体最后接触的位置处配置电极2034。通过检测液体检测电极2034处有无液体,可以确认液体收容部2051或过氧化氢电极2031、2032、2033已被液体充分填满。在液体检测电极2034处检测到液体的情况下,可以向用户通知液体的收集已完成。或者,在即使等待规定的时间以上也未在液体检测电极2034检测到液体的情况下,可以通知未能充分收集液体而不能开始测定,或者通知用户重新收集液体、使用其它芯片等。
[0211]
图18所示的传感器芯片2000具有与对电极2031、参比电极2032、工作电极2033、液体检测电极2034对应且与其电连接的输出端子2041、2042、2043、2044。传感器芯片可以按照插入式或能够拆装的方式连接于电路或具有电路的其它器件(均未图示)而构成。图18所示的传感器芯片2000中,在其拆装部配置上述输出端子。
[0212]
图18中仅记载了1个检测电极。但是,若干实施方式中,可以配置两个以上检测电极。可以在流路内沿着液体的前进方向设置两个以上电极。例如,检测电极可以配置在检测部与液体最先接触的位置、检测部与液体完全接触的位置、以及这两者中间。例如,第一个检测电极可以检测液体开始进入检测部、流路或液体收容部这一点。中间的电极可以检测液体是否已进入这一点。在液体未进入至中间的电极的情况下,仅使用了检测部的一部分,因此可用于通知无法测定或用于通知测定误差大这一点。
[0213]
以下,例示性地说明其它的配置、变形例。有时会省略部分配置、说明。各实施方式、例示中,可以应用其它构成。
[0214]
<两个以上电极配置>
[0215]
传感器芯片的液体收容部中,可以配置两个以上或两种以上的传感器或过氧化氢电极。两个以上传感器可以为同种传感器,可以为上述那样的用于差分测定的、主传感器与副传感器的组合。
[0216]
<电极配置例2>
[0217]
图19所示的传感器芯片2100在液体收容部2151内沿着其长度方向彼此平行地配置有两个以上传感器2100a、2100b。需要说明的是,对于两个以上传感器2100a、2100b的参
比电极和对电极而言,在电路中参比电极彼此、工作电极彼此连接而连通。液体从流体导入口2152被导入,利用毛细管现象和也作为亲水性的含水性聚合物起作用的固定化膜的作用等而在液体收容部2151中前进,将内部的空气从气孔2153挤出且充满液体收容部2151,最终到达检测电极2134。
[0218]
<电极配置例3>
[0219]
图20所示的传感器芯片2200中,在两个以上传感器中共用图12所示那样的过氧化氢电极的一部分。即,图20所示的传感器芯片2200具有主传感器2220a和副传感器2220b。主传感器2220a中,在基板2206上配置有工作电极2233a和对电极2131,在这些电极上配置有主传感器用的酶层2221a。副传感器2220b中,在基板2206上配置有工作电极2233b和参比电极2232,在这些电极上配置有副传感器用的酶层2221b。参比电极2232在基板2206上被配置或夹在对电极2231与工作电极2233b之间。
[0220]
<两个以上传感器的装配型>
[0221]
在同一传感器芯片中配置两个以上传感器的情况下,可以不在传感器芯片的主体基板上直接形成全部传感器。例如,可以使制作的各传感器接合在主体基板上。
[0222]
图21所示的传感器芯片2300中,在主体基板2360上接合有两个已制成的传感器2300a、2300b。
[0223]
传感器2300a、2300b的酶层2311a、2311b或过氧化氢电极2330a、2330b按照沿着液体收容部2351的、从液体导入口2352向气孔2353延伸的长度方向延展的方式形成。
[0224]
图21的传感器芯片2300中,在主体基板2360上和各传感器上分别形成有对应的接合垫2340a、2340b、2341a、2341b。在传感器2300a、2300b接合于主体基板2360上之后或进行接合时,这些接合垫进行电接合。例如,可以通过引线接合将接合垫间连接。
[0225]
图21的传感器芯片2300中,在主体基板2360上配置有能够与电路(未图示)等连接的输出端子2340。这些输出端子2340通过布线与对应的接合垫2341a、2341b连接。对电极和参比电极可以介由传感器芯片2300或电路而短路。根据这样的构成,例如,在由于酶层的耐久性、其它层的构成而难以同时在1个芯片内制造2个传感器、或2个传感器的成品率显著不同的情况下,可以通过分别制造并将合格品组合来抑制总的制造成本。
[0226]
<其它电极方向>
[0227]
过氧化氢电极可以沿着细长的液体收容部的长度方向以外的方向来形成。
[0228]
例如,如图22所示的传感器芯片2400那样,可以在基板2406上配置沿着与液体收容部2451的长度方向垂直的方向延伸的各电极。更具体而言,图22的过氧化氢电极中,在液体收容部2451内沿着与从液体导入口2452向气孔2453的长度方向垂直的方向配置对电极2431、参比电极2432、工作电极2433。参比电极2432被夹在对电极2431和工作电极2433之间。在液体导入时的液体前进方向上,在过氧化氢电极的3个电极中最后的位置配置工作电极2433。在这些过氧化氢电极之后配置液体检测电极2434。在过氧化氢电极上形成有酶层2411。通过如该电极构成这样使参比电极2432夹在对电极2431与工作电极2433之间,从而例如降低外部噪声、在液体进入液体收容部2451时最后与工作电极2433接触,由此能够避免过大的电流流过而安全地测定。
[0229]
4.传感器的制造方法
[0230]
以下使用图23a至图23i的截面示意图说明作为本发明的一个实施方式的双重糖
化蛋白传感器的制造方法。
[0231]
<过氧化氢电极的形成>
[0232]
如图23a所示,在绝缘基板3006上形成2组电极,即第一过氧化氢电极3030a和第二过氧化氢电极3030b。绝缘基板3006可以是以玻璃、石英、陶瓷为主要成分的基板。绝缘基板3006可以为聚对苯二甲酸乙二醇酯(pet)、聚萘二甲酸乙二醇酯(pen)、环烯烃聚合物(cop)树脂等。已知这些作为耐水性、耐热性、耐化学品性以及与上述电极的密合性优良的材料。
[0233]
就各组的过氧化氢电极3030a、3030b而言,形成了层叠ti/pt而成的工作电极、层叠ti/pt/ag/agcl而成的参比电极、和层叠ti/pt而成的对电极。图中未示出这些层叠结构。作为例示,这些电极可以使用溅射法、离子镀法、真空蒸镀法、化学气相沉积(cvd)法、电解法、丝网印刷等来形成。溅射法可以在较短时间内高精度地形成薄的铂膜。例如,首先按照钛(ti)、铂(pt)的顺序成膜、图案化。接着,覆盖工作电极和对电极,在参比电极上形成银(ag)膜。最后,对银的表面进行氯化处理。由此,可以形成上述那样的层叠电极结构。需要说明的是,多数情况下为了提高基板与pt的粘接力而将ti成膜。因此,根据基板、成膜条件,可以省略过氧化氢电极的ti层。例如,在使用pet树脂、cop树脂等挠性片状绝缘基板的情况下,可以省略过氧化氢电极的ti层。
[0234]
<副传感器用酶层的形成>
[0235]
首先如图23b所示那样,将半导体制造等的光刻工序中使用的正型光致抗蚀剂3009旋转涂布于绝缘基板3006上,盖住2组过氧化氢电极3030a、3030b。
[0236]
接着,如图23c所示,通过曝光、显影、蚀刻对抗蚀剂3009进行图案化,使第二过氧化氢电极3030b上形成开口。
[0237]
如图23d所示,以转速3000rpm旋转涂布作为硅烷偶联剂3005b的3-氨基丙基三乙氧基硅烷(aptes)溶液30秒,干燥。然后,将包含成为基材3014的bsa和酮胺氧化酶3002的溶液与戊二醛混合。然后将该混合液旋转涂布于基板上。通过戊二醛的交联反应而使酮胺氧化酶3002固化。
[0238]
在丙酮中对抗蚀剂3009进行超声波处理而进行剥离(lift-off)。介由硅烷偶联剂3005b,仅在第二过氧化氢电极3030b上残留包含成为基材3014的bsa和包含酮胺氧化酶3002的酶膜3011b。由此,在绝缘基板3006上形成副传感器3000b,主传感器用的第一过氧化氢电极3030a露出(图23e)。
[0239]
与图23b中说明的工序同样地,再次将抗蚀剂3091旋转涂布于绝缘基板3006整体上。涂布后,在不使酶失活的条件下使抗蚀剂3091固化(图23f)。
[0240]
<主传感器用酶层的形成>
[0241]
首先通过曝光、显影、蚀刻对抗蚀剂3091进行图案化,使第一过氧化氢电极上形成开口(图23g)。
[0242]
在第一过氧化氢电极3030a上存在开口部的状态下,与图23d同样地以转速3000rpm旋转涂布作为硅烷偶联剂3005a的3-氨基丙基三乙氧基硅烷(aptes)溶液30秒,干燥。此后将包含成为基材3004的bsa及酮胺氧化酶3002和蛋白酶3001的溶液与戊二醛混合。然后将该混合液旋转涂布于基板上。通过戊二醛的交联反应而使酮胺氧化酶3002和蛋白酶3001固化(图23h)。
[0243]
在丙酮中对抗蚀剂3091进行超声波处理而进行剥离。由此制备出在绝缘基板3006
上的第一和第二过氧化氢电极3330a、3330b上分别介由硅烷偶联剂3005a、3005b而分别残留有酶层3011a和酶层3011b的传感器,所述酶层3011a包含被固定于作为基材的bsa3004的蛋白酶3001和酮胺氧化酶3002,所述酶层3011b仅包含酮胺氧化酶3002作为酶且被固定于作为基材的bsa3014。即,在绝缘基板3006上形成有主传感器3000a和副传感器3000b。通过如上操作,可以制备具有差别仅在于有无蛋白酶3001的、差动型双重糖化白蛋白传感器酶层的传感器3000(图23i)。
[0244]
需要说明的是,本实施例中示出了利用抗蚀剂来图案化的制造方法,但也可以使用在第一过氧化氢电极上具有开口部的金属掩模和在第二过氧化氢电极上具有开口部的金属掩模。
[0245]
若干实施方式中,糖化蛋白传感器(检测部、检测器)可以具备白蛋白传感器(检测部、检测器)。可以将糖化蛋白传感器和白蛋白传感器统称为传感器,可以将按照能测定糖化蛋白和白蛋白两者的方式构成的系统称为糖化蛋白传感器。可以按照由同一次采样得到的体液、液体被用于糖化蛋白传感器和白蛋白传感器两者的方式来构成传感器。另一个实施方式中,可以按照在不同时机时采集的体液、液体被供于糖化蛋白传感器和白蛋白传感器的方式来构成传感器。若干实施方式中,可以按照连接于白蛋白传感器的方式来构成糖化蛋白传感器。通过与白蛋白传感器联动,可以更简便、高效地测定糖化白蛋白(ga)值。
[0246]
作为白蛋白传感器,例如能够通过染料结合法、电化学方法进行测定,所述染料结合法利用白蛋白与溴甲酚氯(bcg)、溴甲酚紫(bcp)等染料结合时的吸收波长或吸收光谱的变化。另外,可以为基于使用抗体的免疫法等的器件、装置。
[0247]
若干实施方式中,酶(酮胺氧化酶和/或蛋白酶)可以被保护剂覆盖。保护剂可以为保护层、保护膜或保护涂层。
[0248]
如图24所示,保护剂可以按照覆盖酶层的方式配置。图24中示出了酮胺氧化酶部,省略了蛋白酶和此外的元件、构成。在基板4006上配置有过氧化氢检测器4003,在其上,在基材4014内包含酮胺氧化酶4002而形成酮胺氧化酶层4012。按照覆盖酮胺氧化酶4002或酮胺氧化酶层4012的方式配置保护膜4008。保护膜4008可以按照还覆盖过氧化氢检测器4003的方式来配置。
[0249]
如图25所示,保护剂可以按照覆盖各酶分子的方式配置,或者可以按照覆盖酶的部分或酶分子的聚集体的方式来配置。图25中示出了酮胺氧化酶部,省略了蛋白酶和此外的元件、构成。在基板4106上配置有过氧化氢检测器4103,在其上,在基材4114内包含酮胺氧化酶4102而形成酮胺氧化酶层4112。保护涂层可以按照逐个或逐一分子的方式覆盖酮胺氧化酶4102。可以按照覆盖两个以上酮胺氧化酶4102的方式来形成。
[0250]
若干实施方式中,酶的保护剂可以从基材的材料中选择。若干实施方式中,酶的保护剂可以为与酶的基材相同的材料。由相同材料来形成酶的基材和保护剂时,例如可以避免由测定中的加热或室温的温度变化等导致的、由热膨胀系数差异引起的热应力所致的剥离、破损。保护剂例如可以避免酶劣化或延长寿命,但不限于此。例如,由于未固定化于器件主体的蛋白酶、或固定化的蛋白酶的一部分发生脱离并流出而接触到酮胺氧化酶时,可能将其分解或使其变性。保护剂例如可以避免或抑制这样的酮胺氧化酶的分解。若干实施方式中,酮胺氧化酶的保护剂可以由不易被蛋白酶分解的材料形成。
[0251]
作为保护剂的形成方法,在涂布(例如旋转涂布、棒涂)foad膜后使其交联(放置、
交联时间)、干燥后,可以形成保护膜。保护膜可以按照具有均匀的膜厚的方式来形成。根据所使用的溶液的性质,可以通过旋转涂布法、棒涂法、刮涂法、喷涂法、或浸涂法来涂布保护膜。可以将涂布的保护膜保持于规定时间、规定温度。通过涂布后的处理,可以得到所需的膜厚。
[0252]
保护剂例如可以为氟系树脂、光固化树脂、水固化树脂、纤维素(乙基纤维素、醋酸纤维素等)、尼龙、聚苯乙烯、非蛋白系树脂、聚离子复合物、络合物、无机高分子、固体高分子电解质、多孔性高分子金属络合物(例如zif-8)、金属有机结构体、或磷脂,但不限于此。若干实施方式中,酮胺氧化酶的保护剂可以包含白蛋白,可以实质上由白蛋白形成。若干实施方式中,作为保护剂的白蛋白可以为bsa。已确认,对于无保护剂时酮胺氧化酶的寿命为1周的体系,通过利用由bsa形成的保护剂覆盖,酮胺氧化酶的寿命延长到1个月之久,输出变为一半的时间延长一倍。
[0253]
作为非限定性的例示,保护剂可以降低由液体引起的热振动等对寿命的影响。酶可以被基材包裹固定,可以部分地固定,可以被基材包覆。作为一个解释,保护剂可以保护露出到基材表面的酶分子的部分。作为一个解释,还可以认为酶受到保护剂保护时寿命得以延长。例如,可以降低夹杂物对酶的活性、酶反应效率等的影响,但不限于此。例如,保护膜等可以避免或减少酶从基材脱落或脱离,但不限于此。例如,保护膜可以避免由送液等时承受的外压、ph、盐浓度等参数的剧烈变化所致的变性(蛋白质变性),但不限于此。
[0254]
以下使用几个实施例对蛋白酶和酮胺氧化酶进行说明。
[0255]
<实施例1>
[0256]
对各种蛋白酶的工作特性进行比较。
[0257]
将作为蛋白酶的orientase 22bf(hbi株式会社制)16mg、nucleicin(
ヌクレイシン
)(hbi株式会社制)133mg、orientase ay(hbi株式会社制)12.8mg、orientase op(hbi株式会社制)8.0mg、sumizyme(
スミチーム
)mp(新日本化学工业株式会社制)16mg、蛋白酶xiv(西格玛奥德里奇日本合同会社)4mg分别溶解于tes缓冲液400μl,透析一晚,将所得溶液作为蛋白酶溶液使用。将嗜热菌蛋白酶(富士胶片和光纯药株式会社制)4mg、胰蛋白酶(富士胶片和光纯药株式会社制)4mg、α-胰凝乳蛋白酶(东京化成工业株式会社制)4mg、木瓜蛋白酶(
ナカライテスク
株式会社制)4mg、菠萝蛋白酶(富士胶片和光纯药株式会社制)4mg也分别溶解于tes缓冲液400μl,直接使用。
[0258]
将糖化白蛋白试剂盒lucica ga-l(旭化成制药株式会社)的ga-l校准品(ga浓度:14.9mg/ml、白蛋白浓度:47.9mg/ml)12μl和tes缓冲液93μl混合,向其中加入蛋白酶溶液15μl。将该混合溶液用铝块保温箱在37℃或60℃下加热10分钟。使该混合溶液离开铝块,为了避免在余热、室温下进行消化而立即放入冰箱,此后在低温下保管。将其称为ga消化样品。另一方面,将蛋白酶溶液和tes缓冲液混合。对该混合溶液同样地进行加热处理。将其称为蛋白酶自消化样品。
[0259]
使用市售的糖化白蛋白试剂盒lucica的alb r-2液和酶标仪进行吸光度测定。由ga消化样品的消化前后的吸光度变化求出各蛋白酶的白蛋白的消化率。
[0260]
图26示出加热温度37℃和60℃下的消化率。37℃下,orientase22bf和蛋白酶xiv显示出比较高的消化率。60℃下,orientase 22bf、蛋白酶xiv、sumizyme mp、嗜热菌蛋白酶显示出比较高的消化率。orientase 22bf、蛋白酶xiv、sumizyme mp、嗜热菌蛋白酶均为细
菌来源的蛋白酶。作为一种解释,可以说细菌来源的蛋白酶的消化率高于动物来源、植物来源的蛋白酶,或者动物来源、植物来源的蛋白酶的消化率低于细菌来源的蛋白酶。该解释示出了一种想法,也可以为其它理论或实验结果。基于本实验结果,若干实施方式中,作为用于消化白蛋白的蛋白酶,可以使用选自由orientase 22bf、蛋白酶xiv、sumizyme mp、和嗜热菌蛋白酶组成的组中的蛋白酶。或者,可以将这些中的两种以上蛋白酶组合使用。
[0261]
图27中,使用faod电极测定ga消化样品的电流值。由消化ga样品的输出与蛋白酶自消化样品的输出之差表示消化后的ga的净输出。
[0262]
如图27所示,orientase 22bf、蛋白酶xiv和sumizyme mp提供了比较高的输出。作为一种解释,也可以说orientase 22bf、蛋白酶xiv和sumizyme mp为对于将白蛋白消化至faod能够反应的大小的糖化肽片段而言理想的蛋白酶。该解释示出了一种想法,也可以有其它理论或实验结果。
[0263]
<实施例2>
[0264]
研究了蛋白酶的工作温度。
[0265]
将orientase 22bf(hbi株式会社制)16mg溶解于tes缓冲液400μl,透析一晩,将所得溶液作为蛋白酶溶液。
[0266]
将糖化白蛋白试剂盒lucica ga-l(旭化成制药株式会社)的ga-l校准品(ga浓度:14.8mg/ml、白蛋白浓度:47.5mg/ml)12μl和tes缓冲液93μl混合,向其中加入蛋白酶溶液15μl。同时,还制备仅包含蛋白酶的样品溶液、仅包含校准品的样品溶液。将这些使用铝块保温箱在20℃、30℃、40℃、50℃、60℃、70℃的各温度下保持2.5分钟或10分钟。然后使各溶液离开铝块,为了避免在余热、室温下进行消化而立即放入冰箱,此后在低温下保管。
[0267]
测定导入ga消化样品时的faod电极的输出电流值。根据该ga消化样品的输出电流值,将仅蛋白酶的样品溶液(蛋白酶自消化样品)的输出电流值与仅ga的样品溶液(ga消化样品)的输出电流值之差、即[ga消化样品的输出电流值]-[仅蛋白酶的样品溶液的输出电流值]-[仅ga的样品溶液的输出电流值]作为净剩的消化后的ga的输出电流值。图28中,以消化处理的温度(消化温度)的函数形式绘制了净剩的消化后的ga的输出电流值(a)。
[0268]
如图28所示,来自faod电极的输出电流值在60℃左右或60℃至70℃之间最高。若干实施方式中,可以将蛋白酶的消化温度设在来自faod电极的输出电流值高的范围内。例如,蛋白酶的消化温度可以设在图28中来自faod电极的输出电流值高的60℃左右或60℃至70℃之间。蛋白酶的消化温度可以为50℃、55℃、或高于60、或者更高。蛋白酶的消化温度可以为蛋白酶的失活温度以下或低于失活温度。若干实施方式中,蛋白酶的消化温度可以与faod的最适温度范围不同。
[0269]
<实施例3>
[0270]
研究了酮胺氧化酶(faod)的工作温度。
[0271]
将n-ε-(1-脱氧果糖基)-l-赖氨酸(fk)的三氟乙酸盐(株式会社肽研究所)溶解于tes缓冲液,制备12.8μm的fk溶液。在10℃、20℃、30℃、40℃、50℃、60℃的各温度下,测定导入该fk溶液时的来自faod电极的输出电流值(图28的(b))。
[0272]
如图28所示,来自faod电极的输出电流值在40℃左右最高。作为一种解释,可以说faod电极的最适温度范围在40℃左右。可以将faod电极或其附近的温度设为40℃左右。若干实施方式中,faod电极或其附近的温度可以与蛋白酶的最适温度或温度范围不同。
[0273]
<实施例4>
[0274]
研究了faod电极的输出电流对ga浓度的依赖性。
[0275]
准备了将ga值不同的白蛋白粉末溶解于tes缓冲液而成的各溶液,作为ga样品溶液。
[0276]
将蛋白酶xiv(西格玛奥德里奇日本合同会社)4mg、orientase22bf(hbi株式会社制)16mg分别溶解于tes缓冲液400μl,透析一晩,将所得溶液准备为蛋白酶溶液。
[0277]
将胶乳微珠(immutex p0113、cosmo bio株式会社)分散溶液40μl与tes缓冲液400μl混合,向其中加入50mg的4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基吗啉盐酸盐(dmt-mm、东京化成工业株式会社),使其溶解,将该溶液在室温下搅拌2小时。离心分离(12,000rpm、20分钟),除去上清液。追加tes缓冲液400μl,对该溶液进行搅拌。将该操作重复3次而洗涤微珠、除去多余的dmt-mm。在第3次除去上清液后,加入透析后的蛋白酶溶液400μl,将该溶液在冰箱内搅拌4小时。追加tes缓冲液400μl,离心分离(12,000rpm、20分钟)后,除去上清液。加入tes缓冲液800μl,搅拌该溶液。将该操作重复3次而洗涤微珠、除去多余的蛋白酶。在第3次除去上清液后,加入200μl的tes缓冲液,将该溶液在冰箱内保存。
[0278]
将1.67mg/ml的ga样品溶液60μl和蛋白酶固定化微珠溶液20μl充分混合。将该混合溶液用铝块保温箱在37℃下加热30分钟。30分钟后加入tes缓冲液40μl,离心分离(12,000rpm、30分钟)后取出其上清液。将该溶液作为消化ga样品。
[0279]
导入消化ga样品液,测定来自faod电极的输出电流值。图29中,以ga浓度的函数形式示出该输出电流值。如图29所示,虽然截距的值根据蛋白酶而不同,但是ga浓度与消化ga样品液的来自faod电极的输出电流值之间存在线性关系。而且获知,使用将ga溶液固定化于微珠而成的蛋白酶进行消化,该消化液的来自faod电极的输出电流值会依赖体系的ga浓度而变化。由此表明,能够使用固定化的蛋白酶和faod电极进行ga浓度测定。
[0280]
6.测定方法
[0281]
以下对本发明的测定方法的若干实施方式进行说明。
[0282]
将包含糖化蛋白的测定溶液导入到传感器中。固定化的蛋白酶与包含糖化蛋白的测定溶液接触,使该糖化蛋白片段化而生成肽片段。生成后,肽片段会扩散并到达固定化的酮胺氧化酶处。固定化的酮胺氧化酶会由肽片段中包含被糖化后的氨基酸残基的肽片段而产生过氧化氢。过氧化氢检测器检测通过上述酮胺氧化酶而产生的过氧化氢。
[0283]
若干实施方式中,测定的糖化蛋白可以为糖化白蛋白。
[0284]
若干实施方式中,首先准备具备固定化的蛋白酶、固定化的酮胺氧化酶和过氧化氢检测部的糖化蛋白传感器。另外,准备包含糖化蛋白的测定溶液。接着,将测定溶液导入到糖化蛋白传感器中。使用糖化蛋白传感器检测测定溶液中的糖化蛋白。
[0285]
若干实施方式中,可以由过氧化氢检测器的输出信号求出糖化蛋白的浓度。检测测定溶液中的糖化蛋白的步骤可以包含求出或算出测定溶液中的糖化蛋白的浓度的步骤。
[0286]
可以求出与来自过氧化氢检测部的输出信号建立了关联的糖化蛋白的浓度。可以预先或在目标测定之前求出校正用溶液中的糖化蛋白的浓度与过氧化氢检测器的输出信号的相关性、相关关系、函数等。可以使用或参照由此得到的参照数据、参照表、相关性、相关关系、函数等,由从测定溶液得到的过氧化氢检测器的输出信号求出测定溶液中的糖化蛋白的浓度。例如,在检测器测定电流的情况下,可以基于使该电流值与糖化蛋白的浓度建
立关联而成的表(标准曲线),参照该表,由在电路中测定的电流值进行求出糖化蛋白的浓度的运算。相关性等可以为求出基于来自主(第一)传感器的电流值的浓度换算值与基于来自副(第二)传感器的电流值的浓度换算值之差的运算。
[0287]
若干实施方式中,可以检测糖化蛋白,可以检测存在某阈值以上或更高时的糖化蛋白,可以求出糖化蛋白的浓度,可以定量糖化蛋白,可以求出蛋白质的糖化度。
[0288]
若干实施方式中,可以求出将测定溶液中的作为测定对象的糖化蛋白(糖化蛋白)和与其对应的非糖化蛋白相加得到的总蛋白质的量或其溶液中浓度。糖化蛋白可以为糖化白蛋白。
[0289]
若干实施方式中,可以求出糖化蛋白(对象蛋白质中被糖化后的蛋白质)的浓度相对于对象蛋白质的总量的浓度的比率或比例。若干实施方式中,可以进一步由该比率换算求出前次测定至此次测定的期间的平均血糖值。若干实施方式中,可以由从连续的两次测定求出的该比率换算求出对应期间的平均血糖值。若干实施方式中,可以由从多次测定得到的该比率求出对应期间的平均血糖值。若干实施方式中,可以将从多次测定得到的该比率之和除以该次数而求出平均血糖值。若干实施方式中,可以以对各次得到的该比率加权而得到的函数形式求出平均血糖值,作为该函数的一例,可以以设定成权重随着更近期的测定中得到的该比率而更大的函数形式求出。
[0290]
若干实施方式中,可以对用户进行糖化蛋白浓度的测定的提醒等通知。
[0291]
用户可以为实际使用糖化蛋白传感器的人,是指进行自己或他人的糖化蛋白的测定的人、预定进行测定的人、规定必须进行测定或被建议进行测定的人等。用户可以为个人,可以为一人或多人,可以为至少一人。用户可以为一个、多个或至少一个法人、公司等组织。
[0292]
对用户的通知可以在规定或合适的时机进行。对于第一次以后的测定,可以以固定或不固定的间隔进行通知。任意两次测定的间隔可以为3天、5天、6天、7天、10天、15天、20天、30天、40天、50天、60天、1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、1个月、2个月、3个月、4个月、5个月、6个月,可以为其他期间。对于糖化白蛋白的测定,可以以7天、10天、15天、20天、1周、2周、3周等期间进行通知。
[0293]
若干实施方式中,可以在多次测定之间进行洗涤。洗涤可以包括:对于固定化的蛋白酶和固定化的酮胺氧化酶和检测部的整体或局部,用纯水、生理盐水、tes等缓冲液进行冲洗。
[0294]
本发明的若干实施方式的程序或计算机程序可以使计算机执行本申请中记载的测定方法中包括的各步骤,可以使计算机读取并执行。本发明的若干实施方式的计算机可读存储介质可以存储有程序或计算机程序,所述程序或计算机程序用于使计算机执行本申请中记载的测定方法中包括的各步骤。
[0295]
a01
[0296]
一种糖化蛋白传感器,其具备固定化的蛋白酶、固定化的酮胺氧化酶和过氧化氢检测部。
[0297]
a01a
[0298]
根据实施方式a01所述的糖化蛋白传感器,其中,上述固定化的酮胺氧化酶靠近上述过氧化氢检测部地配置。
[0299]
a01b
[0300]
根据实施方式a01a所述的糖化蛋白传感器,其中,上述固定化的蛋白酶靠近上述固定化的酮胺氧化酶地配置。
[0301]
a01c
[0302]
根据实施方式a01至a01b中任一项所述的糖化蛋白传感器,其中,还具备收容作为测定对象的液体的液体收容部。
[0303]
a01d
[0304]
根据实施方式a01c所述的糖化蛋白传感器,其中,上述液体收容部的容积为100μl以下。
[0305]
a02
[0306]
一种糖化蛋白传感器,其具备:
[0307]
过氧化氢检测部;以及
[0308]
配置在上述过氧化氢检测部上且包含固定化的蛋白酶和固定化的酮胺氧化酶的酶层。
[0309]
a03
[0310]
根据实施方式a02所述的糖化蛋白传感器,其中,上述酶层以层叠的方式具有包含固定化的蛋白酶的蛋白酶层和包含固定化的酮胺氧化酶的酮胺氧化酶层。
[0311]
a04
[0312]
根据实施方式a03所述的糖化蛋白传感器,其中,上述酮胺氧化酶层和上述蛋白酶层从靠近上述过氧化氢检测部的一侧起按照上述酮胺氧化酶层、上述蛋白酶层的顺序层叠。
[0313]
a05
[0314]
根据实施方式a03所述的糖化蛋白传感器,其中,
[0315]
上述酮胺氧化酶层包含第一酮胺氧化酶层和第二酮胺氧化酶层,
[0316]
上述第一酮胺氧化酶层、上述蛋白酶层和第二酮胺氧化酶层依次地层叠。
[0317]
a06
[0318]
根据实施方式a02所述的糖化蛋白传感器,其中,上述酶层具备包含固定化的酮胺氧化酶的酮胺氧化酶层和固定化于上述酮胺氧化酶层的与上述过氧化氢检测部相反的一侧的表面上的蛋白酶。
[0319]
a07
[0320]
根据实施方式a02至a06中任一项所述的糖化蛋白传感器,其中,还具备配置在上述过氧化氢检测部与上述酶层之间的离子交换树脂。
[0321]
a08
[0322]
根据实施方式a01所述的糖化蛋白传感器,其中,上述固定化的蛋白酶与上述固定化的酮胺氧化酶分开地配置。
[0323]
a09
[0324]
根据实施方式a08所述的糖化蛋白传感器,其中,具备:
[0325]
收容上述固定化的蛋白酶的蛋白酶收容部;
[0326]
收容上述固定化的酮胺氧化酶且与上述蛋白酶收容部进行了流体连接的酮胺氧
化酶收容部;以及
[0327]
从上述蛋白酶收容部向上述酮胺氧化酶收容部输送液体的送液机构。
[0328]
a10
[0329]
根据实施方式a08或a09所述的糖化蛋白传感器,其中,还具备对上述蛋白酶和/或上述酮胺氧化酶进行加热的加热器。
[0330]
a11
[0331]
根据实施方式a08或a09所述的糖化蛋白传感器,其中,还具备对上述蛋白酶收容部进行加热的蛋白酶用加热器。
[0332]
a12
[0333]
根据实施方式a11所述的糖化蛋白传感器,其中,上述蛋白酶用加热器以将上述蛋白酶收容部加热到40℃以上或50℃以上的方式构成。
[0334]
a13
[0335]
根据实施方式a11或a12所述的糖化蛋白传感器,其中,还具备测定上述蛋白酶收容部或蛋白酶的温度的蛋白酶用温度传感器。
[0336]
a14
[0337]
根据实施方式a11至a13中任一项所述的糖化蛋白传感器,其中,还具备温度控制机构,所述温度控制机构基于来自上述蛋白酶用温度传感器的信息控制上述蛋白酶用加热器的发热量。
[0338]
a15
[0339]
根据实施方式11至a14中任一项所述的糖化蛋白传感器,其中,还具备对上述酮胺氧化酶收容部进行加热的酮胺氧化酶用加热器。
[0340]
a16
[0341]
根据实施方式a15所述的糖化蛋白传感器,其中,上述酮胺氧化酶用加热器以在室温以上且50℃以下的温度下对上述酮胺氧化酶收容部进行加热的方式构成。
[0342]
a17
[0343]
根据实施方式a15或a16所述的糖化蛋白传感器,其中,还具备测定上述酮胺氧化酶收容部或酮胺氧化酶的温度的酮胺氧化酶用温度传感器。
[0344]
a18
[0345]
根据实施方式a15至a17中任一项所述的糖化蛋白传感器,其中,还具备温度控制机构,所述温度控制机构基于来自上述酮胺氧化酶用温度传感器的信息控制上述酮胺氧化酶用加热器的发热量。
[0346]
a19
[0347]
根据实施方式a11至a18中任一项所述的糖化蛋白传感器,其中,还具备在上述蛋白酶收容部与上述酮胺氧化酶收容部之间以与两者流体连接的方式配置且具有冷却机构的冷却部。
[0348]
a21
[0349]
根据实施方式1所述的糖化蛋白传感器,其中,从包含待测物质的溶液的上游方向起依次配置有上述固定化的蛋白酶、上述固定化的酮胺氧化酶、上述过氧化氢检测部。
[0350]
a22
[0351]
根据实施方式a01至a21中任一项所述的糖化蛋白传感器,其中,上述蛋白酶被固定于基材。
[0352]
a23
[0353]
根据实施方式a22所述的糖化蛋白传感器,其中,上述蛋白酶被固定于微珠。
[0354]
a24
[0355]
根据实施方式a01至a23中任一项所述的糖化蛋白传感器,其中,上述过氧化氢检测部包含过氧化氢电极。
[0356]
a25
[0357]
根据实施方式a01至a23中任一项所述的糖化蛋白传感器,其中,过氧化氢检测器包含光检测器。
[0358]
a26
[0359]
根据实施方式a01至a23中任一项所述的糖化蛋白传感器,其中,过氧化氢检测器包含与过氧化氢反应的发光试剂和光检测器。
[0360]
a27
[0361]
一种糖化蛋白传感器,其具备:
[0362]
具有第一固定化的蛋白酶、第一固定化的酮胺氧化酶和第一过氧化氢检测部的第一传感器;以及
[0363]
具有第二固定化的酮胺氧化酶和第二过氧化氢检测部的第二传感器。
[0364]
a28
[0365]
一种糖化蛋白传感器,其具备:
[0366]
第一过氧化氢检测部;
[0367]
配置在上述第一过氧化氢检测部上且包含固定化的蛋白酶和固定化的酮胺氧化酶的第一酶层;
[0368]
第二过氧化氢检测部;以及
[0369]
配置在上述第二过氧化氢检测部上且包含实质上由上述固定化的酮胺氧化酶构成的酶的第二酶层。
[0370]
a29
[0371]
根据实施方式a28所述的糖化蛋白传感器,其中,上述第一过氧化氢检测部和上述第二过氧化氢检测部包含过氧化氢电极。
[0372]
a30
[0373]
根据实施方式a29所述的糖化蛋白传感器,其中,
[0374]
上述第一过氧化氢检测部具备对电极和参比电极中的一者以及第一工作电极,
[0375]
上述第二过氧化氢检测部具备对电极和参比电极中的另一者以及第二工作电极。
[0376]
a31
[0377]
根据实施方式a29或a30所述的糖化蛋白传感器,其中,还具备电流测定电路,所述电流测定电路对上述对电极施加电位并测定流经上述第一工作电极的电流和流经上述第二工作电极的电流。
[0378]
a32
[0379]
根据实施方式a01至a31中任一项所述的糖化蛋白传感器,其中,上述糖化蛋白包
含糖化白蛋白。
[0380]
a33
[0381]
根据实施方式a32所述的糖化蛋白传感器,其中,还具备白蛋白传感器。
[0382]
b01
[0383]
一种糖化蛋白的测定方法,其具备:
[0384]
准备(provide)包含糖化蛋白的测定溶液的步骤;
[0385]
将上述测定溶液导入(direct)到固定化的蛋白酶中的步骤;
[0386]
使用上述固定化的蛋白酶将上述糖化蛋白片段化而生成肽片段的步骤;
[0387]
使用固定化的酮胺氧化酶由上述肽片段中包含被糖化后的氨基酸残基的肽片段产生过氧化氢的步骤;以及
[0388]
使用过氧化氢检测器对利用上述酮胺氧化酶产生的过氧化氢进行检测的步骤。
[0389]
b02
[0390]
一种糖化蛋白的测定方法,其具备:
[0391]
准备糖化蛋白传感器的步骤,所述糖化蛋白传感器具备固定化的蛋白酶、固定化的酮胺氧化酶和过氧化氢检测部;
[0392]
准备(provide)包含糖化蛋白的测定溶液的步骤;
[0393]
将上述测定溶液导入到上述糖化蛋白传感器中的步骤;以及
[0394]
使用上述糖化蛋白传感器对上述测定溶液中的上述糖化蛋白进行检测的步骤。
[0395]
b03
[0396]
根据实施方式b02所述的糖化蛋白的测定方法,其中,还具备:求出与来自上述过氧化氢检测部的输出信号建立了关联的糖化蛋白的浓度的步骤。
[0397]
b04
[0398]
根据实施方式b02或b03所述的糖化蛋白的测定方法,其中,
[0399]
上述糖化蛋白为糖化白蛋白或糖化血红蛋白,
[0400]
上述方法还具备:
[0401]
求出白蛋白的浓度或血红蛋白的浓度的步骤;以及
[0402]
求出糖化白蛋白值或糖化血红蛋白值的步骤,所述糖化白蛋白值或糖化血红蛋白值为上述糖化白蛋白的浓度或上述糖化血红蛋白的浓度与上述白蛋白的浓度或上述血红蛋白的浓度的比率。
[0403]
b05
[0404]
根据实施方式b02至b04中任一项所述的糖化蛋白的测定方法,其中,还具备:每1周、每2周、每3周、每4周或每1月通知用户应进行糖化蛋白浓度的测定的步骤。
[0405]
b06
[0406]
根据实施方式b02至b05中任一项所述的糖化蛋白的测定方法,其中,上述糖化蛋白包含糖化白蛋白。
[0407]
b07
[0408]
根据实施方式b06所述的糖化蛋白的测定方法,其中,还具备:由多次的与上述白蛋白的浓度或上述血红蛋白的浓度的比率换算求出平均血糖值的步骤。
[0409]
b08
[0410]
一种用于使计算机执行实施方式b02至b07中任一项所述的测定方法中包括的各步骤的程序。
[0411]
b09
[0412]
一种计算机可读存储介质,其存储有实施方式b07所述的程序。
[0413]
b10
[0414]
一种糖化蛋白的测定方法,其具备:
[0415]
准备糖化蛋白传感器的步骤,所述糖化蛋白传感器具备第一过氧化氢检测部、配置在上述第一过氧化氢检测部上且包含固定化的蛋白酶和固定化的酮胺氧化酶的第一酶层、以及配置在上述第二过氧化氢检测部上且包含实质上由上述固定化的蛋白酶构成的酶的第二酶层的;
[0416]
将包含糖化蛋白的测定溶液导入到上述糖化蛋白传感器中的步骤;以及
[0417]
由来自上述第一过氧化氢检测部的输出信号和来自上述第二过氧化氢检测部的输出信号求出与这些输出信号建立了关联的糖化蛋白的浓度。
[0418]
c01
[0419]
一种糖化蛋白传感器的制造方法,其具备:
[0420]
准备基板的步骤;
[0421]
在上述基板上配置过氧化氢检测部的步骤;
[0422]
在上述基板上使酮胺氧化酶固定化的步骤;以及
[0423]
在上述基板上使蛋白酶固定化的步骤。
[0424]
c02
[0425]
根据实施方式c01所述的糖化蛋白传感器的制造方法,其中,
[0426]
在上述基板上使酮胺氧化酶固定化的步骤包括:在上述过氧化氢检测部上使酮胺氧化酶固定化的步骤,
[0427]
在上述基板上使蛋白酶固定化的步骤包括:在上述过氧化氢检测部上使蛋白酶固定化的步骤。
[0428]
c03
[0429]
根据实施方式c02所述的制造方法,其中,在上述过氧化氢检测部上使酮胺氧化酶固定化的步骤包括:形成使酮胺氧化酶固定于第一基材而成的酮胺氧化酶层,
[0430]
在上述过氧化氢检测部上使蛋白酶固定化的步骤包括:在上述酮胺氧化酶层上形成使蛋白酶固定于第二基材而成的蛋白酶层。
[0431]
c04
[0432]
根据实施方式c03所述的制造方法,其中,在上述过氧化氢检测部上使酮胺氧化酶固定化的步骤还包括:在上述蛋白酶层上形成使酮胺氧化酶固定于第三基材而成的第二酮胺氧化酶层的步骤。
[0433]
c05
[0434]
根据实施方式c02所述的制造方法,其中,在上述过氧化氢检测部上使酮胺氧化酶固定化的步骤和在上述过氧化氢部上使蛋白酶固定化的步骤包括:将上述酮胺氧化酶和上述蛋白酶与共用基材混合而在上述过氧化氢部上形成同一酶层的步骤。
[0435]
c06
[0436]
一种糖化蛋白传感器的制造方法,其具备:
[0437]
准备基板的步骤;
[0438]
在上述基板上形成第一过氧化氢检测部和第二过氧化氢检测部的步骤;
[0439]
在上述第一过氧化氢检测部上固定第一酮胺氧化酶和蛋白酶的步骤;以及
[0440]
在上述第二过氧化氢检测部上固定第二酮胺氧化酶的步骤。
[0441]
c07
[0442]
根据实施方式c06所述的制造方法,其中,
[0443]
准备上述基板的步骤具备:准备第一基板和第二基板的步骤,
[0444]
在上述基板上形成第一过氧化氢检测部和第二过氧化氢检测部的步骤具备:在上述第一基板上形成第一过氧化氢检测部且在上述第二基板上形成第二过氧化氢检测部的步骤,
[0445]
所述制造方法还具备:
[0446]
准备主体基板的步骤;以及
[0447]
在上述主体基板上接合上述第一基板和上述第二基板的步骤。
[0448]
以上对本发明的几个实施方式和实施例进行了说明,但这些实施方式和实施例是对本发明进行例示性说明的。例如,上述各实施方式是为了易于理解地说明本发明而进行详细说明的,但也可以根据需要追加改变尺寸、构成、材质、电路。权利要求书以不脱离本发明的技术构思的范围包括针对实施方式的多数变形方式。因此,本说明书中公开的实施方式和实施例是为了例示而示出的,不应认为是对本发明的范围进行限定。
[0449]
符号说明
[0450]
100 传感器
[0451]
101 蛋白酶
[0452]
102 酮胺氧化酶
[0453]
103 过氧化氢检测部
[0454]
104 固定化层
[0455]
105 基材
[0456]
106 交联剂
[0457]
107 硅烷偶联剂
[0458]
111 酶层
[0459]
151 糖化蛋白
[0460]
152 蛋白质
[0461]
153 糖
[0462]
154 被糖化后的肽片段
[0463]
155 未被糖化的肽片段
[0464]
156 过氧化氢
[0465]
200 传感器
[0466]
201 蛋白酶
[0467]
202 酮胺氧化酶
[0468]
203 过氧化氢检测部
[0469]
204 基材
[0470]
211 酶层
[0471]
300 传感器
[0472]
301 蛋白酶
[0473]
302 酮胺氧化酶
[0474]
303 过氧化氢检测部
[0475]
304 基材
[0476]
305 接合剂
[0477]
311 酶层
[0478]
400 传感器
[0479]
401 蛋白酶
[0480]
402 酮胺氧化酶
[0481]
403 过氧化氢检测部
[0482]
404、414 基材
[0483]
411 蛋白酶层
[0484]
412 酮胺氧化酶层
[0485]
500 传感器
[0486]
501 蛋白酶
[0487]
502 酮胺氧化酶
[0488]
503 过氧化氢检测部
[0489]
506 基板
[0490]
504、514 基材
[0491]
511 固定化蛋白酶部
[0492]
512 固定化酮胺氧化酶部
[0493]
600 传感器
[0494]
601 蛋白酶
[0495]
602 酮胺氧化酶
[0496]
603 过氧化氢检测部
[0497]
604 交联剂
[0498]
612 酮胺氧化酶层
[0499]
614 基材
[0500]
700 传感器
[0501]
701 蛋白酶
[0502]
702 酮胺氧化酶
[0503]
704、714 基材
[0504]
705 硅烷偶联剂
[0505]
706 绝缘基板
[0506]
711 蛋白酶层
[0507]
712 酮胺氧化酶层
[0508]
730 过氧化氢电极
[0509]
731 对电极
[0510]
732 参比电极
[0511]
733 工作电极
[0512]
770 电路
[0513]
771 运算放大器
[0514]
772 电压产生电路
[0515]
773 电流测定电路
[0516]
800 传感器
[0517]
801 蛋白酶
[0518]
802 酮胺氧化酶
[0519]
804、814 基材
[0520]
807 离子交换树脂
[0521]
811 蛋白酶层
[0522]
812 酮胺氧化酶层
[0523]
1000 传感器
[0524]
1000a 主传感器
[0525]
1000b 副传感器
[0526]
1001 蛋白酶
[0527]
1002 酮胺氧化酶
[0528]
1003a、1003b 过氧化氢检测部
[0529]
1004、1014 基材
[0530]
1011a、1011b 酶层
[0531]
1030 运算部
[0532]
1070a、1070b 电路
[0533]
1100 传感器
[0534]
1100a 主传感器
[0535]
1100b 副传感器
[0536]
1101 蛋白酶
[0537]
1102 酮胺氧化酶
[0538]
1103a、1103b 过氧化氢检测部
[0539]
1104、1114、1124 基材
[0540]
1111a、1111b 蛋白酶层
[0541]
1112a 酮胺氧化酶层
[0542]
1011a、1011b 酶层
[0543]
1130 运算部
[0544]
1170a、1170b 电路
[0545]
1200 传感器
[0546]
1200a 主传感器
[0547]
1200b 副传感器
[0548]
1201 蛋白酶
[0549]
1202 酮胺氧化酶
[0550]
1203a、1203b 过氧化氢检测部
[0551]
1204 交联剂
[0552]
1214、1224 基材
[0553]
1212a 酮胺氧化酶层
[0554]
1212b 酶层
[0555]
1230 运算部
[0556]
1270a、1270b 电路
[0557]
1300 传感器
[0558]
1300a 主传感器
[0559]
1300b 副传感器
[0560]
1301 蛋白酶
[0561]
1302 酮胺氧化酶
[0562]
1304、1324 基材
[0563]
1305a、1305b 硅烷偶联剂
[0564]
1306 基板
[0565]
1311a、1311b 酶层
[0566]
1330a、1330b 过氧化氢电极
[0567]
1331 对电极
[0568]
1332 参比电极
[0569]
1333a、1333b 工作电极
[0570]
1370 电路
[0571]
1371 运算放大器
[0572]
1372 电压产生电路
[0573]
1373a、1373b 电流测定电路
[0574]
1400 传感器
[0575]
1401 蛋白酶
[0576]
1402 酮胺氧化酶
[0577]
1404 微珠
[0578]
1414 基材
[0579]
1431 试剂
[0580]
1432 光检测器
[0581]
1452 液体导入口
[0582]
1455 蛋白酶收容部
[0583]
1456 酮胺氧化酶收容部
[0584]
1457 检测反应器
[0585]
1460 加热器
[0586]
1500 传感器
[0587]
1502 酮胺氧化酶
[0588]
1504 微珠
[0589]
1600 传感器
[0590]
1601 蛋白酶
[0591]
1602 酮胺氧化酶
[0592]
1603 过氧化氢检测器
[0593]
1604 微珠
[0594]
1611 酶层
[0595]
1614 基材
[0596]
1652 液体导入口
[0597]
1655 蛋白酶收容部
[0598]
1656 酮胺氧化酶收容部
[0599]
1660 加热器
[0600]
1700 传感器
[0601]
1700a 主传感器
[0602]
1700b 副传感器
[0603]
1703a、1703b 过氧化氢检测器
[0604]
1711a 酶层
[0605]
1712a、1712b 酮胺氧化酶层
[0606]
1752 液体导入口
[0607]
1755a 蛋白酶收容部
[0608]
1755b 无蛋白酶的腔室
[0609]
1756a、1756b 酮胺氧化酶收容容器
[0610]
1760 加热器
[0611]
1800 传感器
[0612]
1801 蛋白酶
[0613]
1802 酮胺氧化酶
[0614]
1803 过氧化氢检测器
[0615]
1804 微珠
[0616]
1811 酶层
[0617]
1814 基材
[0618]
1852 液体导入口
[0619]
1855 蛋白酶收容部
[0620]
1856 酮胺氧化酶收容部
[0621]
1858 冷却部/冷却用溶液收容部
[0622]
1860、1861 加热器
[0623]
1862 冷却电路/元件
[0624]
2000 传感器芯片
[0625]
2006 基板
[0626]
2011 酶层
[0627]
2031 对电极
[0628]
2032 参比电极
[0629]
2033 工作电极
[0630]
2034 液体检测电极
[0631]
2041、2042、2043、2044 输出端子
[0632]
2051 液体收容部
[0633]
2052 流体导入口
[0634]
2053 气孔
[0635]
2100 传感器芯片
[0636]
2100a、2100b 传感器
[0637]
2134 液体检测电极
[0638]
2151 液体收容部
[0639]
2152 流体导入口
[0640]
2153 气孔
[0641]
2200 传感器芯片
[0642]
2200a 主传感器
[0643]
2200b 副传感器
[0644]
2206 基板
[0645]
2221a、2221b 酶层
[0646]
2231 对电极
[0647]
2232 参比电极
[0648]
2233a、2233b 工作电极
[0649]
2300 传感器芯片
[0650]
2300a、2300b 传感器
[0651]
2311a、2311b 酶层
[0652]
2330a、2330b 过氧化氢电极
[0653]
2340 输出端子
[0654]
2340a、2340b、2341a、2341b 接合垫
[0655]
2351 液体收容部
[0656]
2352 流体导入口
[0657]
2353 气孔
[0658]
2360 基板
[0659]
2400 传感器芯片
[0660]
2406 基板
[0661]
2411 酶层
[0662]
2431 对电极
[0663]
2432 参比电极
[0664]
2433 工作电极
[0665]
2434 液体检测电极
[0666]
2451 液体收容部
[0667]
2452 流体导入口
[0668]
2453 气孔
[0669]
3000 传感器
[0670]
3000a 主传感器
[0671]
3000b 副传感器
[0672]
3001 蛋白酶
[0673]
3002 酮胺氧化酶
[0674]
3004、3014 基材(bsa)
[0675]
3005a、3005b 硅烷偶联剂
[0676]
3006 绝缘基板
[0677]
3009、3091 抗蚀剂
[0678]
3011a、3011b 酶层
[0679]
3030a、3030b 过氧化氢电极
[0680]
4002、4102 酮胺氧化酶
[0681]
4003、4103 过氧化氢检测器
[0682]
4006、4106 基板
[0683]
4008、4108 保护
[0684]
4012、4112 酮胺氧化酶层
[0685]
4014、4114 基材
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签:
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



