调节性T细胞表位、组合物及其用途的制作方法
 2021-02-02 04:02:32|
2021-02-02 04:02:32| 308|
308| 起点商标网
起点商标网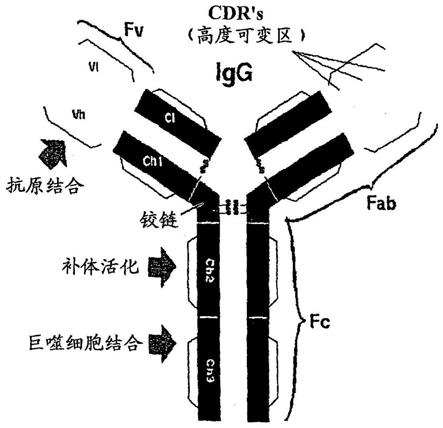
调节性t细胞表位、组合物及其用途
[0001]
本申请为分案申请,原申请的申请日为2008年1月29日,申请号为200880011016.5(国际申请号:pct/us2008/001148,针对的分案申请号:201610958012.4),发明名称为“调节性t细胞表位、组合物及其用途”。
发明领域
[0002]
本发明广泛涉及新颖种类的t细胞表位组合物(称作“tregitopes”)。本发明提供tregitope组合物、其制备方法和用途。
[0003]
发明背景
[0004]
人工诱导对自身或外源抗原的耐受是治疗自身免疫、移植变态反应和其他疾病的目标,并且在用自体蛋白和非-自体蛋白的疗法中也是需要的。直至最近,治疗性耐受诱导依赖于可引起细胞排除(cell depletion)和细胞因子特性改变的基础广泛的方法。这些基础广泛的方法一般会减弱免疫系统并使许多受试者易于患机会感染、自身免疫攻击和癌症。本领域需要侵袭性较低并且更具靶向性的方法诱导免疫耐受。
[0005]
免疫耐受由t细胞、b细胞、细胞因子和表面受体之间的复杂相互作用调节。最早的自我/非我辨别发生在新生儿发育过程中的胸腺,其髓质上皮细胞表达对未成熟t细胞的特异自身蛋白表位。以高亲和性识别自身抗原的t细胞被清除,但是具有中等亲和性的自身反应性t细胞可免于被清除并且可转化成所谓的“天然”调节性t细胞(t
reg
)。这些天然t
reg
细胞被运输至外周并提供对自身免疫的长久抑制。
[0006]
第二种形式的耐受发生在外周,其中成熟t细胞在il-10和tgf-β存在下经它们的t细胞受体活化转化成“适应性”t
reg
表型。这些适应性t
reg
细胞的可能作用包括成功清除入侵病原体后缓冲免疫应答作为控制变态反应或低水平慢性感染可能引起的过度炎症反应的方法,或可能辅助有益的共生细菌和病毒的共存。“适应性”t
reg
也可在控制经历了体细胞超突变的人抗体的生存周期中发挥作用。
[0007]
天然调节性t细胞是外周免疫调节的重要组分。经它们的tcr活化后,天然tregs可经接触依赖型和非依赖型机制抑制对不相关抗原的旁观者效应t细胞应答。此外这些细胞释放的细胞因子包括il-10和tgf-β可诱导抗原特异性适应性tregs。尽管已做出了大量努力,除少数例外,天然tregs并且更重要的在具有临床意义的体积中循环的天然tregs的特异性仍是未知。
[0008]
本领域需要鉴别包含在普通自体蛋白例如igg(“tregitopes”)中的调节性t细胞表位以及与它们制备相关的方法和用途。
[0009]
概述
[0010]
本发明利用调节性t细胞(t
reg
)尤其是已在外周调节对外源和自身蛋白的免疫应答的那些细胞(预存或天然t
reg
)的功能。在一方面本发明提供t-细胞表位多肽组合物。
[0011]
通过使用tregitopes和tregitope-抗原融合物选择性黏附和活化预存天然t
reg
作为治疗以不想要的免疫应答存在为标志的任何疾病或症状的手段具有治疗价值。实例包括以下:自身免疫疾病例如i型糖尿病、ms、狼疮和ra;移植相关病症例如移植物抗宿主疾病
(gvhd);变态反应;生物药物例如单克隆抗体,替代蛋白例如fviii或胰岛素,治疗性毒素例如肉毒杆菌毒素的应用引起的免疫排斥;以及对急性或慢性传染病免疫应答的控制。
[0012]
在一个实施方案中,本发明涉及t-细胞表位多肽组合物,其包括至少一种选自seq id nos:4-58的多肽。在具体的实施方案中,本发明涉及包括本发明多肽和药学可接受载体的药用组合物。
[0013]
在一个实施方案中本发明涉及编码至少一种选自seq id nos:4-58的t-细胞表位多肽的核酸。在具体的实施方案中,本发明涉及包括本发明核酸的载体。在另一实施方案中,本发明涉及包括本发明载体的细胞。
[0014]
在一个实施方案中本发明涉及治疗或预防有需要的受试者中医学病症的方法,其包括给予治疗有效量的选自seq id nos:4-58的t-细胞表位多肽。在具体的实施方案中,该医学病症选自:变态反应、自身免疫疾病、移植相关疾病、移植物抗宿主疾病、酶或蛋白质缺乏症、凝血障碍、癌症、不育;以及病毒、细菌或寄生虫感染。
[0015]
在一个实施方案中本发明涉及预防或治疗受试者医学病症的试剂盒,其中该试剂盒包括至少一种选自seq id nos:4-58的t-细胞表位多肽。
[0016]
在一个实施方案中,本发明涉及扩增调节性t细胞群的方法,其包括:(a)提供受试者的生物样品;(b)从生物样品中分离调节性t-细胞;以及将分离的调节性t-细胞与有效量的本发明tregitope组合物在t-调节性细胞数量增加形成扩增的调节性t-细胞组合物的条件下接触,藉此扩增生物样品中的调节性t-细胞。
[0017]
在一个实施方案中,本发明涉及刺激生物样品中调节性t-细胞的方法,其包括:(a)提供受试者的生物样品;(b)从生物样品中分离调节性t-细胞;以及将分离的调节性t-细胞与有效量的本发明tregitope组合物在t-调节性细胞被刺激以改变一种或多种生物学功能的条件下接触,藉此刺激生物样品中的调节性t-细胞。
[0018]
在一个实施方案中本发明涉及抑制受试者中免疫应答的方法,其包括给予受试者包括治疗有效量的包括tregitope的肽的组合物,其中该肽抑制免疫应答。在具体的实施方案中,该肽抑制效应t细胞应答。在具体的实施方案中,该肽抑制辅助t细胞应答。在另一实施方案中,该肽抑制b细胞应答。
[0019]
在一个实施方案中,本发明涉及通过给予治疗有效量的包括一种或多种tregitopes的组合物抑制受试者中抗原特异性免疫应答的方法,其中一种或多种tregitopes与特异目标抗原或共价结合、或非共价结合或混合,引起对该目标抗原的免疫应答降低。在具体的实施方案中,抑制作用由天然treg介导。在另一实施方案中,该抑制作用由适应性treg介导。在另一实施方案中,该肽抑制效应t细胞应答。在另一实施方案中,该肽抑制辅助t细胞应答。在另一实施方案中,该肽抑制b细胞应答。在具体的实施方案中,该肽包括选自seq id nos:4-58的序列。
[0020]
在一个实施方案中。本发明涉及增强疫苗递送载体免疫原性的方法,其包括鉴别和去除调节性t细胞表位。在具体的实施方案中该t细胞表位选自seq id nos:4-58。
[0021]
附图简述
[0022]
图1为免疫球蛋白g(igg)的示意图。
[0023]
图2为比较加帽和不加帽肽的一系列图解表示。用单独(上图)的cef(阳性对照肽库)、cef+tregitope 289-酰胺(中图)或cef+tregitope-289-不加帽(下图)在培养基中刺
激pbmc 8天。与单独cef温育相比,cef与tregitope-289-酰胺共温育1)得到更高的具有调节性表型的细胞百分比(左图)和2)导致响应cef再刺激的γ干扰素分泌的相关显著性(p<0.0005)降低(右图)。相反,与单独cef温育(上图)相比,与tregitope 289-不加帽(下图)共温育未引起显著性差异。
[0024]
图3显示了tregitope存在下天然tregs的活化。在破伤风毒素肽(tt
830-844
)、tregitope或无刺激物存在下体外直接刺激人pbmcs四天。用抗-cd4和抗-cd25胞外染色细胞并接着用foxp3胞内染色,用流式细胞仪分析。与tt
830-844
(745个细胞的12.5%)或无刺激物相比(497个细胞的19.5%),用tregitope温育增加了cd4+cd25+foxp3+ t细胞的百分比(644个细胞的53.6%)。
[0025]
图4为显示tregitope诱导t-调节性细胞因子和趋化因子上调和t-效应细胞因子和趋化因子下调的一系列柱形图。用a)衍生自c3d蛋白的免疫原性肽库(黑色柱形);b)c3d肽+tregitope-167(浅灰色柱形)或c)c3d肽+tregitope 134(中度灰色柱形)初始刺激后对c3d再刺激的应答。第二次温育中,应答显示为高于背景的倍数增加,其中背景为无刺激物(对照)。以pg/ml表示的各自的基线(背景)值在x-轴标注中指出。il-4、tnfα或tgfβ1水平没有显著性差异。
[0026]
图5为显示用a)衍生自c3d蛋白的免疫原性肽库(黑色柱形)或b)c3d肽+tregitope-167(浅灰色柱形)初始刺激后对c3d肽再刺激的应答的一系列柱形图。第二次温育中,应答显示为高于背景的倍数增加,其中背景为无刺激物(对照)。对于各细胞因子,基线(无刺激物,背景)值显示于x-轴标注中。
[0027]
图6为显示用衍生自tshr的表位协同刺激的柱形图,tshr为格雷夫斯病的靶抗原,抑制对格雷夫斯病患者pbmc表位的免疫应答。来自格雷夫斯病患者的pbmc首先与1)单独tshr肽库或2)tshr肽库和tregitope-134、tregitope-167和tregitope-289库温育8天。然后收获细胞、洗涤并与1)单个的tshr肽和tregitope库或2)tshr肽库和tregitope库温育(在所描述的il-4elispot板中)。也有“无刺激物”的对照板。相对于未用抗原再刺激显示应答。黑色柱形对应于单独用抗原的温育和再刺激,灰色柱形对应于用抗原+tregitope库的温育和再刺激。在本实验中tregitope共温育将对单独tshr肽的应答抑制了35%至67%并将对tshr肽库的应答抑制了65%。显示成对比较的p值。
[0028]
图7为显示与以下:单独的cef、cef+tregitope-289、cef+tregitope 294、cef+tregitope-029、cef+tregitope-074或cef+tregitope-009之一温育八天后三个受试者对商业购买的阳性对照肽(cef)库的平均应答的柱形图。对cef的应答被抑制了29%至48%,取决于所使用的单个tregitope。对cef(在之前与单独的cef温育的样品中)的基线应答高于背景范围为1404至10139ifn-γsfc/百万pbmc(背景为无刺激物)。显示成对比较的p值。
[0029]
图8为显示与tregitope共温育抑制对衍生自肉毒杆菌神经毒素肽表位的免疫应答的柱形图。取有证据证明存在抗-bont/a抗体的受试者的外周血。pbmc首先与单独的bont/a肽库或bont/a肽库+tregitopes(tregitope-134、tregitope-167和tregitope-289)库温育八天。接着收集细胞、洗涤并接着与一式三份的单个bont/a肽或一式三份的bont/a肽库温育(在ifn-γelispot板中)。相对于未用抗原的再刺激显示应答。黑色柱形对应于与单独抗原的温育,灰色柱形对应于与抗原+tregitopes库的温育。对bont/a的应答被抑制了26%至73%;对bont/a肽库的应答被抑制了59%。显示成对比较的p值。
289(鼠同源物)。最后一次剂量后一周,处死小鼠并在48hr il-4elispot测定中用免疫原性肽药物刺激脾细胞。联合给予免疫原性蛋白质药物和fc或tregitope-289导致il-4斑点形成细胞的显著减少。参见实施例5c。
[0038]
发明详述
[0039]
综述
[0040]
当可溶性蛋白质抗原被抗原递呈细胞(apcs)摄取并经ii类抗原递呈途径加工时适应性免疫级联开始。ii类递呈途径中的蛋白质抗原被存在于内质网中的各种蛋白酶降解。一些形成的蛋白质片段与mhc ii类分子结合。荷载肽的mhc分子被运输至细胞表面,在那里被cd4+ t细胞识别。可结合至mhc分子并介导apc和循环t细胞之间细胞-细胞相互作用的肽片段被称作t细胞表位。cd4+ t细胞对这些肽-mhc复合物的识别根据应答t细胞的表型和局部的细胞因子/趋化因子环境可引起免疫活化或免疫抑制应答。一般而言,mhc/肽复合物和t效应细胞的t细胞受体(tcr)之间的黏附导致促炎性细胞因子例如il-4和ifn-γ的活化和分泌。另一方面天然t调节性细胞(treg)的活化导致免疫抑制细胞因子中il-10和tgf-β的表达(shevach,e.,nat.rev.immunol.,2:389-400,2002)。这些细胞因子直接作用于附近的效应t细胞在一些情况下引起无反应性或凋亡。在其他情况下调节性细胞因子和趋化因子将效应t细胞转换成t调节性表型;这一过程在本文中称作“诱导性”或“适应性”耐受。可结合至mhc分子并黏附和活化循环treg的t细胞表位称作tregitopes。
[0041]
最早的自我/非我辨别发生在新生儿发育过程中的胸腺,其髓质上皮细胞表达对未成熟t细胞的特异自身蛋白表位。以高亲和性识别自身抗原的t细胞被清除但是具有中等亲和性的自身反应性t细胞可免于被清除并且可转化成所谓的“天然”调节性t细胞(t
reg
)。这些天然t
reg
细胞被运输至外周并提供对自身免疫的长久抑制。天然调节性t细胞是免疫调节和自身耐受的重要组分。
[0042]
自身耐受由t细胞、b细胞、细胞因子和表面受体之间的复杂相互作用调节。t调节性免疫应答平衡对蛋白质抗原(不论自身的或外源的)的t效应细胞免疫应答。通过增加自身反应性t效应细胞的数量功能或通过减少t调节性细胞的数量或功能使该平衡向自身反应性一边的倾斜表现为自身免疫。
[0043]
第二种形式的耐受发生在外周,其中成熟t细胞在il-10和tgf-β(通常由旁观者t调节性细胞提供)存在下经它们的t细胞受体活化转化成“适应性”t
reg
表型。这些适应性t
reg
细胞的可能作用包括成功清除入侵病原体后缓冲免疫应答作为控制变态反应或低水平慢性感染可能引起的过度炎症反应的手段,或可能辅助有益的共生细菌和病毒的共存。“适应性”t
reg
也可在控制经历了体细胞超突变的人抗体的生存周期中发挥作用。
[0044]
据信免疫球蛋白的恒定区包含数种重要的tregitopes,其主要功能是抑制对超突变cdrs的免疫应答。由于循环igg的高容量,可能也存在对应于包含于igg的tregitopes的高容量t调节性细胞。这一推断的部分证据认为包括免疫球蛋白fc部分的嵌合蛋白赋予嵌合蛋白若干期望性质,包括稳定性增强、血浆半衰期增加、与fc受体结合以及免疫原性降低(lei,t.等,cell.immunol.,235:12-20,2005,baxevanis,c.et al.,eur.j.immunol.,16:1013-1016,1986)。
[0045]
treg细胞也在b细胞耐受中发挥作用。b细胞在它们的细胞表面表达单个低亲和性fc受体fcyriib(ravetch,j.等,science,234:718-725,1986)。这一受体在其胞质结构域中
或“移植物”并将它们置于(通常)不同的受试者中。提供移植物的受试者称作“供体”,接受该移植物的受试者称作“受体”。在两个相同种但基因不同的受试者之间移植的器官或移植物称作“同种异体移植物”。在不同种受试者之间移植的移植物称作“异种移植物”。
[0055]
如本文所使用,术语“医学病症”包括但不限于表现为一种或多种身体和/或心理症状(需要对其进行治疗和/或预防)的任何病症或疾病,并包括之前和新鉴定的疾病和其他病症。
[0056]
如本文所使用,术语“免疫应答”指淋巴细胞、抗原递呈细胞、吞噬细胞、粒细胞和上述细胞或肝脏产生的可溶性大分子(包括抗体、细胞因子和补体)的协同作用,其可选择性损伤、破坏或从人体清除癌性细胞、转移的肿瘤细胞、恶性黑色素瘤、侵入病原体、病原体感染的细胞或组织或自身免疫或病理性炎症的情况下的正常的人体细胞或组织。
[0057]
如本文所使用,术语组合物的“有效量”为足以达到预期治疗和/或预防作用的量,例如可引起被治疗疾病相关症状的预防或减少的量。给予受试者的本发明组合物的量取决于疾病的类型和严重性以及个体的特征,例如总体健康、年龄、性别、体重和对药物的耐受。也取决于疾病的程度、严重性和类型。技术人员可根据这些和其他因素确定适当的剂量。本发明组合物也可相互之间或与一种或多种其他治疗性化合物联合给药。
[0058]
如本文所使用术语“t细胞表位”指蛋白决定簇,长度为7至30个氨基酸并可特异结合hla分子并与特异tcrs相互作用。一般而言,t细胞表位是线性的并且不表达特异的三维特征。t细胞表位不受变性溶剂的影响。
[0059]
如本文所使用,术语“b细胞表位”指可特异结合抗体的蛋白决定簇。表位通常由分子例如氨基酸或糖侧链的化学活性表面基团组成并通常具有特异的三维结构特性以及特异的电荷特性。构象和非构象表位的区别为在变性溶剂存在下丧失与前者而不是与后者的结合。
[0060]
如本文所使用,术语“受试者”指可在其中引起免疫应答的任何活的生物体。术语受试者包括但不限于人、非人灵长类例如猩猩和其他猿猴和猴子种;农场动物例如牛、羊、猪、山羊和马;家养哺乳动物例如狗和猫;实验室动物包括啮齿类例如小鼠、大鼠和豚鼠。该术语不表示具体的年龄或性别。因此成年或新生儿受试者以及胎儿不论雄性或雌性均被涵盖。
[0061]
如本文所使用,术语mhc复合物指可与被称作hla配体的特异性全部多肽(repertoire)结合并将所述配体运输至细胞表面的蛋白质复合物。
[0062]
如本文所使用,术语“mhc配体”指可结合一个或多个特异mhc等位基因的多肽。术语“hla配体”可与术语mhc配体互换。在其表面表达mhc/配体复合物的细胞被称作“抗原递呈细胞”(apcs)。
[0063]
如本文所使用,术语t细胞受体或tcr指由可与递呈于apcs表面的特异的全部mhc/配体复合物黏附的t细胞表达的蛋白质复合物。
[0064]
如本文所使用,术语“t细胞表位”指可与特异t细胞受体(tcrs)相互作用的mhc配体。可通过计算机(in silico)法(de groot,a.等,aids res.hum.retroviruses,13:539-541,1997;schafer,j.等,vaccine,16:1880-1884,1998;de groot,a.等,vaccine,19:4385-95,2001;de groot,a.等,vaccine,21:4486-504,2003)预测t细胞表位。
[0065]
如本文所使用,术语“mhc结合基序”指预测可与具体mhc等位基因结合的蛋白质序
列中的氨基酸模式。
[0066]
如本文所使用,术语“t细胞表位簇”指包含约4个至约40个mhc结合基序的多肽。在具体的实施方案中,t细胞表位簇包含约5个至约35个mhc结合基序,约8个至约30个mhc结合基序;以及约10个至约20个mhc结合基序。
[0067]
如本文所使用术语“epibar”指经预测与至少四种不同hla等位基因具有反应性的单个9-mer框架。包含epibars的已知免疫原的序列包括流感病毒血凝素307-319、破伤风毒素825-850和gad65557-567。包含epibar的免疫原性肽的实例显示于下文。
[0068]
实例epibar
[0069]
登录号:流感-序列:ha306-318
[0070][0071]
前5%中的所有评分被认为“命中”。方便起见遮蔽10%以下的无命中*
[0072]
表1.epibar实例:混合性流感表位的epibar分析。考虑流感ha肽,一个已知具有混合免疫原性的表位。其对于epimatrix中的所有八个等位基因的评分都非常高。其集簇评分为18。集簇评分大于10被认为具有意义。带状epibar模式是混合性表位的特点。显示了pryvkqntl(seq id no:59)、ryvkqntlk(seq id no:60)、yvkqntlkl(seq id no:61)、vkqntlkla(seq id no:62)和kqntlklat(seq id no:63)的结果。
[0073]
如本文所使用,术语“免疫突触”指给定t细胞表位与细胞表面mhc复合物和tcr二者同时粘附形成的蛋白质复合物。
[0074]
如本文所使用,术语“调节性t细胞”指以某些细胞表面标记包括但不限于cd4、cd25、和foxp3的存在为特征的天然t细胞亚群。活化时调节性t细胞分泌免疫抑制细胞因子和趋化因子包括但不限于il-10、tgf-β和tnf-α。
[0075]
术语“多肽”指氨基酸聚合物并不限定具体长度;因此,肽、寡肽和蛋白质均包含在多肽的定义中。如本文所使用,当多肽从重组和非重组细胞中分离而基本不含细胞物质时或当其为化学合成而基本不含化学前体或其他化学物质时多肽被称作是“分离的”或“纯化的”。然而,多肽可与另一种在细胞中通常与其不相关的多肽结合而仍然是“分离的”或“纯化的”。当重组生产多肽时,它也可基本不含培养基,例如培养基相当于多肽制剂体积的小于约20%、小于约10%或小于约5%。
[0076]
变异体多肽的氨基酸差异可为一个或多个替换、缺失、插入、倒位、融合和截短或这些的任意组合。
[0077]
本发明也包括本发明多肽的多肽片段。本发明也涵盖本文所述多肽变异体的片段。本发明也提供嵌合或融合多肽。这些包括与具有与该多肽不实质同源的氨基酸序列的异源蛋白或多肽可操作地连接的本发明多肽。“可操作地连接”表示该多肽和异源蛋白质为框架内融合。
[0078]
分离的多肽可纯化自天然表达该多肽的细胞,纯化自经改变可表达该多肽(重组)的细胞,或使用已知的蛋白质合成方法合成。在一个实施方案中,通过重组dna技术生产多肽。举例而言,将编码该多肽的核酸分子克隆至表达载体,将表达载体引入宿主细胞,该多肽表达于该宿主细胞中。接着可通过适当的纯化方案使用标准蛋白质纯化技术从细胞中分离该多肽。
[0079]
对于本发明目的,多肽可包括例如天然氨基酸经修饰的形式例如d-立体异构体、非天然氨基酸;氨基酸类似物以及模拟体。
[0080]
尽管与本文所述相似或等同的方法和材料可用于实施或检测本发明,本文描述了优选的方法和材料。本发明的其他特征、目标和优点从描述和权利要求中显而易见。在说明书和附加权利要求中,单数形式包括复数指代物除非文章另外指明。除非另外定义,本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员理解的相同含义。本文引用的所有参考文献均以其完整内容并于本文作为参考并用于所有目的,其引用程度如同明确并独立指明各单独的出版物、专利或专利申请以其完整内容并于本文作为参考用于所有目的。
[0081]
组合物
[0082]
一方面本发明提供新颖种类的t细胞表位组合物,称作“tregitopes”,其包括具有一个或多个下文所列特性的肽或多肽。即本发明tregitopes包括但不限于具有一个或多个下列特性:
[0083]
(1)本发明tregitopes衍生自普通的人蛋白。
[0084]
(2)本发明tregitopes在他们来源蛋白的已知变异体中高度保守(例如,存在于多于50%的已知变异体中)。
[0085]
(3)本发明tregitopes包括至少一个经epimatrix分析鉴定的推定t细胞表位。epimatrix是epivax开发的专有计算机算法,其可用于筛选蛋白质序列以确定是否存在推定的t细胞表位。输入序列被解析成重叠的9-mer框架,其中各框架与上一个重叠8个氨基酸。就与一组八个普通ii类hla等位基因(drb1*0101、drb1*0301、drb1*0401、drb1*0701、drb1*0801、drb1*1101、drb1*1301和drb1*1501)的预测结合亲和力给各所得框架评分。根据随机生成肽的较大样本的分数标准化初始分数。报告所得“z”分数。任何等位基因特异性epimatrix z-分数超过1.64的任何9-mer肽,理论上为任何给定样品的前5%,被认为是推定的t细胞表位。
[0086]
在优选的实施方案中本发明tregitopes包含若干推定t细胞表位,形成已知为t细胞表位簇的模式。推定的t细胞表位并不是随机分布在整个蛋白质序列中,而是“集簇”在特定区域中。此外,包含推定t细胞表位簇的肽在体外和体内的验证检测中更可能检测为阳性。从初始epimatrix分析的结果使用第二种称作clustimer的专有算法筛选推定t细胞表位“集簇”的存在。clustimer算法可鉴定包含于任何包含统计学显著高数量的推定t细胞表位的氨基酸序列中的亚区。典型的t-细胞表位“集簇”的长度约9至约30个氨基酸,考虑到它们与多个等位基因的亲和力以及跨越多个9-mer框架,其可在任何位置包含约4至约40个推定t细胞表位。对于各鉴定的表位簇,通过总和推定t细胞表位分数并减去基于候选表位簇长度的矫正因子和随机生成的相同长度集簇的预期分数计算聚集epimatrix分数。大于+10的epimatrix集簇评分被认为是显著性的。
[0087]
许多最具有反应性的t细胞表位簇包含被称作“epibar”的特征。epibar为预期与至少四个不同hla等位基因具有反应性的单个9-mer框架。包含epibar的序列包括流感血凝素307-319(集簇评分18)、破伤风毒素825-850(集簇评分16)和gad65 557-567(集簇评分19)。在另一实施方案中,本发明肽可包括一个或多个epibar。
[0088]
(4)本发明tregitopes可以至少中等亲和力(例如,在基于可溶hla分子的hla结合测定法中ic
50
<200μm)结合至少一个并优选两个或更多普通hla ii类分子。
[0089]
(5)本发明tregitopes可在至少一个并在优选的实施方案中为两个或多个hla等位基因的情况下被apcs递呈至细胞表面。
[0090]
(6)在这一情况下,tregitope-hla复合物可被具有特异于tregitope-hla复合物的tcrs并在正常对照受试者中循环的预存调节性t细胞群识别。tregitope-hla复合物的识别可引起匹配调节性t细胞的活化并分泌调节性细胞因子和趋化因子。
[0091]
(7)具有本发明tregitope的刺激调节性t细胞引起一种或多种以下细胞因子和趋化因子的分泌增加:l-10、tgf-β、tnf-α和mcp1。调节性细胞因子和趋化因子分泌的增加是调节性t细胞的标志。
[0092]
(8)被本发明tregitope活化的调节性t细胞表达cd4+cd25+foxp3表型。
[0093]
(9)被tregitope活化的调节性t细胞直接抑制离体t-效应细胞免疫应答,如通过抗原特异性th1-或th2-相关细胞因子(主要是inf-γ、il-4和il-5)水平降低以及通过抗原-特异性t效应细胞增殖降低(如通过cfse稀释测定)所测定。
[0094]
(10)被tregitope活化的调节性t细胞直接抑制体内t-效应细胞免疫应答,如通过抗原特异性th1-或th2-相关细胞因子(如elisa测定法测定)水平降低、抗原-特异性t效应细胞水平(如elispot测定法测定)降低和蛋白质抗原的抗体滴度降低所测定。
[0095]
(11)被本发明tregitopes活化的天然调节性t细胞刺激适应性t
reg
细胞的发育。将外周t细胞与本发明tregitopes在抗原存在下共温育引起抗原特异性cd4+/cd25+ t细胞的扩增、上调这些细胞上foxp3+的表达并抑制抗原-特异性t效应细胞的体外活化。
[0096]
本发明tregitopes可用于调节对单克隆抗体、蛋白质药物、促进自身免疫应答的自身抗原、变应原、移植组织的免疫应答和其他应用中,其中耐受为期望结果。本发明tregitopes的选择性实施方案总结于实施例1的表2中。
[0097]
在一个实施方案中本发明tregitopes为如表2所述分离的t细胞表位。表2的tregitopes(seq id nos:4至58)可结合mhc ii类分子,在mhc ii类分子情况下黏附tcr并活化天然调节性t细胞。
[0098]
本发明多肽可纯化至均质或部分纯化。然而应理解的是其中的多肽未纯化至均质的制剂也可用。关键特征为制剂可实现多肽的期望功能,甚至在大量其他组分存在的情况下。因此,本发明涵盖各种等级的纯度。在一个实施方案中,“基本不含细胞物质”包括含有少于约30%(干重)其他蛋白质(例如,污染蛋白)、少于约20%其他蛋白质、少于约10%其他蛋白质或少于约5%其他蛋白质的多肽制剂。
[0099]
当重组生产一种多肽时,它也可以基本不含培养基,例如培养基占多肽制剂体积的少于约20%、少于约10%或少于约5%。“基本不含化学前体或其他化学物质”包括分离自与其合成相关的化学前体或其他化学物质的多肽制剂。“基本不含化学前体或其他化学物质”可包括例如含有少于约30%(干重)化学前体或其他化学物质、少于约20%化学前体或
其他化学物质、少于约10%化学前体或其他化学物质或少于约5%化学前体或其他化学物质的多肽制剂。
[0100]
如本文所使用,当氨基酸序列至少约45-55%、通常至少约70-75%、更通常至少约80-85%并更通常大于约90%或更同源或相同时两个多肽(或多肽的一个区域)为基本同源或相同。为了测定两个氨基酸序列或两个核酸序列的同源性或一致性百分比,将序列比对用于最佳比较目的(例如,可在一个多肽或核酸分子中引入空位用于和另一多肽或核酸分子的最佳比对)。接着比较对应氨基酸位置或核苷酸位置的氨基酸残基或核苷酸。当一个序列上的一个位点被与另一序列上对应位置的相同氨基酸残基或核苷酸占据时,那么这些分子在这一位点是同源的。如本文所使用,氨基酸或核酸“同源性”等同于氨基酸或核酸“一致性”。两个序列之间的同源性百分比是这些序列共有相同位点数量的函数(例如,同源性百分比等于相同位点数量/总位点数量
×
100)。
[0101]
本发明也涵盖具有较低程度一致性但具有足够的相似性以执行本发明核酸分子编码的多肽所执行的一种或多种相同功能的多肽。相似度由保守氨基酸替换测定。这些替换为用另一性质相似的氨基酸替换多肽中的给定氨基酸。保守替换很可能是表型沉默的。通常被看做保守替换的为在脂肪族氨基酸ala、val、leu和ile中的相互替换;羟基残基ser和thr互换,酸性残基asp和glu交换,酰胺残基asn和gln之间的替换,碱性残基lys和arg之间的交换以及芳香残基phe和tyr之间的替换。对于哪些氨基酸变化可能是表型沉默的指导参见例如bowie,j.等,science,247:1306-1310,1990。
[0102]
变异体多肽的氨基酸差异可为一个或多个替换、缺失、插入、倒位、融合和截短或这些的任意组合。变异体多肽可具有完整的功能或缺少一个或多个活性的功能。具有完全功能的变异体通常仅包含保守变异或非关键残基或非关键区域中的变异。功能性变异体也可包含相似氨基酸的替换,其不引起或引起不显著的功能变化。或者,这些替换可在一定程度上正向或反向影响功能。非功能性变异体通常包含一个或多个非保守氨基酸替换、缺失、插入、倒位或截短或关键残基或关键区域的替换、插入、倒位或缺失。变异体多肽的若干实例包括于表2中。
[0103]
本发明也包括本发明多肽的多肽片段。本发明也涵盖本文所述多肽变异体的片段。如本文所使用,片段包括至少约5个连续的氨基酸。可用片段包括保留了多肽的一种或多种生物学活性的片段以及可用作免疫原生成多肽-特异性抗体的片段。生物学活性片段的长度例如约6、9、12、15、16、20或30个氨基酸。片段可为离散的(不与其他氨基酸或多肽融合)或可在更大的多肽内。数个片段可包括在单个较大的多肽内。在一个实施方案中经设计用于在宿主细胞中表达的片段可具有与多肽片段的氨基端融合的前多肽和多肽原(pre-and pro-polypeptide)区以及与片段羧基端融合的附加区域。
[0104]
本发明也提供嵌合或融合多肽。这些包括与具有与该多肽不实质同源的氨基酸序列的异源蛋白或多肽可操作地连接的本发明多肽。“可操作地连接”表示该多肽和异源蛋白质为框架内融合。异源蛋白可与该多肽的n-端或c-端融合。在一个实施方案中融合多肽不影响该多肽自身的功能。举例而言,融合多肽可为gst-融合多肽,其中该多肽序列与gst序列的c-端融合。融合多肽的其他类型包括但是不限于酶融合多肽例如β-半乳糖苷酶融合、酵母双杂交gal融合、多聚-组氨酸融合和ig融合。这些融合多肽尤其是多聚-组氨酸融合或亲和标签融合可辅助重组多肽的纯化。在一些宿主细胞(例如哺乳动物宿主细胞)中,可通
过使用异源信号序列增加多肽的表达和/或分泌。因此,在另一实施方案中,融合多肽在其n-端包含异源信号序列。
[0105]
可通过标准重组dna技术生产嵌合或融合多肽。举例而言,根据常规技术将编码不同多肽序列的dna片段在框架内连接在一起。在另一实施方案中,可通过常规技术包括自动化dna合成仪合成融合基因。或者,可使用锚定引物进行核酸片段的pcr扩增,锚定引物可在两个保守核酸片段之间生成互补的突出端,其随后可复性并再次扩增生成嵌合核酸序列(ausubel等.,current protocols in molecular biology,1992)。此外,可商业购买许多已编码融合部分(例如gst蛋白)的表达载体。编码本发明多肽的核酸分子可克隆至表达载体中,这样该融合部分与多肽框架内相连。
[0106]
分离的多肽可纯化自天然表达该多肽的细胞,纯化自经改变可表达该多肽(重组)的细胞,或使用已知的蛋白质合成方法合成。在一个实施方案中,通过重组dna技术生产多肽。举例而言,将编码该多肽的核酸分子克隆至表达载体,将表达载体引入宿主细胞,该多肽表达于该宿主细胞中。接着可通过适当的纯化方案使用标准蛋白质纯化技术从细胞中分离该多肽。
[0107]
本发明也提供编码本发明完整或部分多肽的核酸。本发明核酸分子可插入载体中并用作例如表达载体或基因疗法载体。可通过例如静脉注射、局部给药(美国专利号5328470)或通过立体定位注射(chen等,proc.natl.acad.sci.usa,91:3054-3057,1994)给予受试者基因疗法载体。基因疗法载体的药物制剂可包括可接受稀释剂中的基因疗法载体或可包括包埋了基因递送载体的缓释基质。或者,当可从重组细胞中生产完整的基因递送载体例如逆转录病毒载体时,该药物制剂可包括一个或多个生产该基因递送系统的细胞。药物组合物可连同使用说明包含在容器、包装或给药器中。
[0108]
本发明tregitopes可包括等位或序列变异体(“突变体”)或其类似物,或可包括化学修饰(例如peg化、糖基化)。在一个例子中,突变体可提供与mhc分子更强的结合。在另一实例中,突变体可导致与tcrs更强的结合。在另一实例中,突变体可导致与mhc分子和/或tcrs结合的降低。也包括可以结合但是不允许经tcrs的信号传导的突变体。
[0109]
本发明提供tregitope组合物,其为嵌合蛋白组合物。在一个实施方案中,tregitope组合物包括连接在一起的第一和第二多肽链,其中第一链包括序列编号4至58或其任意组合,并且所述第二链包括生物活性分子。在一个实施方案中,生物活性分子选自:免疫原性分子、t细胞表位、病毒蛋白、细菌蛋白。在一个实施方案中,本发明tregitope组合物包括连接在一起的第一和第二多肽链,其中第一链包括fc区,其中289-309区的氨基酸已被改变从而不与mhc ii类分子结合,并且所述第二链包括免疫原性分子。
[0110]
一方面本发明提供生产识别至少一部分seq id nos:4-58的调节性t细胞系的方法。在一个实施方案中,一个或多个选自seq id nos:4-58的肽与适当的辅料混合。这些组合物可用于预防或治疗有需要的受试者中的炎症,其中和适当的辅料一起局部给予该混合物可减少受试者的炎症。
[0111]
在一个实施方案中,一个或多个选自seq id nos:4-58的肽与抗原或变应原混合。这些组合物可用于在有需要的受试者中诱导对该抗原或变应原的耐受的方法中,其中局部给予与抗原或变应原的混合物可增强受试者对该抗原或变应原的耐受,并且与适当的辅料一起给予可诱导对该抗原或变应原的耐受。
[0112]
在一个实施方案中,本发明提供编码包括一个或多个选自seq id nos:4-58的tregitope多肽的核酸。在一个实施方案中,本发明提供包括编码一个或多个选自seq id nos:4-58的tregitope多肽的核酸的载体。在一个实施方案中,本发明提供包括本发明载体的细胞。该细胞可为哺乳动物细胞、细菌细胞、昆虫细胞或酵母细胞。
[0113]
克隆tregitope特异t细胞
[0114]
可根据本领域技术人员已知的技术进行tregitope特异t细胞的克隆。举例而言,用包含20%hsa的rpmi培养基中10μg/ml tregitopes刺激分离的pbmcs。从第5天开始每隔一天加入il-2(终浓度为10u/ml)。在第11或12天用四聚体库染色t细胞。对于每一库,将2-3
×
105个细胞与0.5mg pe-标记的四聚体在50ml培养基(10mg/ml)中于37℃温育1至2小时,然后用抗-cd4-fitc(bd pharmingen,san diego,ca)于室温下染色15分钟。在becton dickinson facscalibur流式细胞仪(becton dickinson,san jose,ca)上洗涤并分析细胞。产生载有对应的单个肽的四聚体用于给出阳性染色的库,并在第14或15天进行分析。对特定四聚体是阳性的细胞为在同一天或第二天用becton dickinson facsvantage(san jose,ca)分拣至96-孔u-形底培养板的单个细胞。用每孔1.5-3
×
105个不匹配的、经辐射(5000rad)的pbmc作为饲养细胞并在24小时后加入2.5mg/ml pha和10u/ml il-2扩增已分拣的细胞。通过用四聚体染色(载有同源肽或对照肽,ha307
–
319)和用10mg/ml特异肽进行t细胞增殖测定(novak,e.等,j.immunol.,166:6665-6670,2001)验证已克隆t细胞的特异性。
[0115]
tregitope组合物的应用方法
[0116]
一方面本发明提供使用tregitope用于设计小分子的方法。在本发明一个方法中,用小分子混合物库以1μg/ml的浓度刺激tregitope特异t细胞三次并用自体树突状细胞(dc)以两周间隔刺激,接着用异源dc和抗原刺激。在圆底96-孔板的每孔中加入t细胞(1.25
×
105)和dc(0.25
×
105)。通过添加含有50ml fcs(hyclone)、青霉素和链霉素(gibco)的500ml rpmi培养基1640;20mm hepes(gibco);和4ml 1n naoh溶液制备t细胞培养基。il-2浓度起始为0.1nm并在之后的几轮刺激中逐渐增加至1nm。通过用0.6
×
105个epstein
–
barr病毒转化的b细胞(100gray)和1.3
×
105个异源外周血单核细胞(33gray)作为饲养细胞以及包含2nm il-2培养基中的1μg/ml植物凝集素(difco)有限稀释而衍生t细胞克隆。接着以单个分子检测刺激tregitope特异t细胞的小分子库。
[0117]
一方面本发明提供使用tregitopes用于克隆t细胞受体的方法。用rneasy mini kit(qiagene)从如上所述生成的tregitopes特异t细胞系中萃取总rna。通过cdna末端快速扩增(race)法(generacer kit,invitrogen)将一毫克的总rna用于克隆tcr cdnas。在合成单链cdna之前,rna为脱磷酸化的、脱帽的并根据5'race generacer kit的使用说明与rna寡聚核苷酸连接。用superscript ii rt和generacer oligo-dt逆转录rna寡聚核苷酸连接的mrna至单链cdnas。使用generacer 5'(generacer kit)作为5'引物和基因-特异引物tcrcar(5'-gtt aac tag ttc agc tgg acc aca gcc gca gc-3';seq id no:64)或tcrcb1r(5'-cgg gtt aac tag ttc aga aat cct ttc tct tga cca tgg c-3';seq id no:65),或tcrcbr2(5'-cta gcc tct gga atc ctt tct ctt g-3';seq id no:66)分别作为tcrα、β1或β2链的3'引物进行5'race。将聚合酶链式反应(pcr)产物克隆至pcr2.1 topo载体(invitrogen)并接着转化至one shot top10感受态大肠杆菌(invitrogen)。从tcrα、β
1和β2链的各构建体的96个单个克隆制备质粒dnas。测序所有质粒的全长插入物以确定vα/vβ应用(zhao,y.等,j.immunother.,29:398-406,2006)。
[0118]
药物制剂
[0119]
本发明提供治疗患有医学病症的受试者的方法,其包括与药学可接受载体或辅料一起给予治疗有效量的tregitope。本发明tregitope可并入适于给药的药物组合物中。该药物组合物通常包括至少一种tregitope和适于给予受试者的形式的药学可接受载体。药学可接受载体部分取决于所给予的具体组合物以及用于给予该组合物的具体方法。因此,许多适当的药用组合物制剂可用于给予tregitope组合物(参见,例如remington
’
s pharmaceutical sciences,mack publishing co.,easton,pa第18版,1990)。药用组合物通常配制成无菌的,基本等渗的并完全符合美国食品药品监督管理局的所有优良操作规范(gmp)章程。
[0120]
当指组合物、载体、稀释剂和试剂时,术语“药学可接受的”、“生理耐受的”及其语法变体可互换使用并表示可给予受试者而不产生禁止给予该组合物程度的不良生理学作用的材料。“药学可接受的辅料”指例如可用于制备基本安全、无毒并有利的药用组合物的辅料,并且包括可用于兽用和人用药物用途的辅料。这些辅料可为固体、液体、半固体或如果是气雾剂组合物时为气体。本领域普通技术人员可确定给予具体药物和本发明组合物的适当时间、顺序和剂量。
[0121]
这些载体或稀释剂的优选实例包括但不限于水、盐水、林格氏溶液、右旋糖溶液和5%人血清白蛋白。也可使用脂质体和非水溶媒例如非挥发油。将这些介质和化合物用于药学活性物质为本领域熟知。除非任何常规介质或化合物均与tregitope不相容,可考虑其在组合物中的用途。也可将附加活性物质并入该组合物中。
[0122]
本发明组合物配制成与其预期给药途径相容。本发明tregitope组合物可经肠胃外、局部、静脉内、口腔、皮下、动脉内、皮内、经皮、直肠、颅内、腹膜内、鼻内;阴道;肌肉内途径或作为吸入剂给药。在本发明的一些实施方案中,直接将药物注入沉积物可聚积的特定组织中,例如颅内注射。肌肉内注射或静脉内输注为tregitope的优选给药方式。在一些方法中将本发明特定tregitope直接注入颅内。在一些方法中本发明tregitope作为缓释组合物或装置例如medipad
tm
装置给药。
[0123]
本发明tregitope可任选与至少部分有效地治疗本文所述各种医学病症的其他药剂联合给药。在给药至受试者的中枢神经系统时,本发明tregitope也可与可增强本发明药剂通过血脑屏障的其他药剂联合给药。
[0124]
用于肠胃外、皮内或皮下应用的溶液或混悬液包括以下组分:无菌稀释剂例如注射用水、盐水溶液、非挥发油、聚乙二醇、甘油、丙二醇或其他合成溶剂;抗菌化合物例如苯甲醇或尼泊金甲酯;抗氧化剂例如抗坏血酸或亚硫酸氢钠;螯合化合物例如乙二胺四乙酸(edta);缓冲剂例如乙酸盐、柠檬酸盐或磷酸盐,以及用于调节张力的化合物例如氯化钠或右旋糖。可用酸或碱调ph,例如盐酸或氢氧化钠。辅料的实例可包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、米粉、面粉、白垩、硅胶、水、乙醇、dmso、甘油、丙烯、脱脂奶粉等。该组合物也可包含ph缓冲剂和润湿或乳化剂。
[0125]
肠胃外制剂可包含于玻璃或塑料制成的安瓿、一次性注射器或多剂量管形瓶中。
[0126]
适用于注射的药用组合物包括无菌水溶液(当为水溶性时)或分散剂和无菌粉末
用于临时制备无菌注射液或分散体。对于静脉内给药,适当的载体包括生理盐水、抑菌水、cremophor eltm(basf,parsippany,n.j.)或磷酸盐缓冲液(pbs)。在所有情况下,该组合物为无菌的并且流动性应达到通针性良好的程度。它在生产和保存条件下是稳定的并经防腐处理以避免微生物例如细菌和真菌的污染作用。载体可为溶剂或分散介质,包含例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)及其适当的混合物。例如可通过使用包衣例如卵磷脂,通过在分散体中维持所要求的粒径并通过使用表面活性剂维持适当的流动性。防止微生物的作用可通过许多抗菌和抗真菌化合物达成,例如尼泊金、三氯叔丁醇、酚、抗坏血酸、硫柳汞等。在许多情况下优选在组合物中包括等渗化合物例如糖类、多元醇类例如甘露醇、山梨醇、氯化钠。可通过在组合物中包括延迟吸收的化合物例如单硬脂酸铝和明胶达到可注射组合物的长效吸收。
[0127]
可将适当溶剂中的要求量的tregitope与一种或多种上文所列成分按需要合并,接着过滤除菌制备无菌注射液。通常将粘合剂并入包含基础分散介质和要求的上文所列其他成分的无菌溶媒中制备分散体。对于制备无菌注射液的无菌粉末,制备方法为真空干燥和冷冻干燥,其可得到活性成分和之前无菌过滤溶液的任何其他要求成分的粉末。本发明药剂可以配制成允许活性成分缓释或脉动释放方式的储库注射剂(depot injection)或植入物制剂形式给药。
[0128]
口服组合物通常包括惰性稀释剂或可食用载体。它们可包被于明胶胶囊中或压制成片。对于口服治疗给药目的,可将粘合剂与辅料合并并用于片剂、糖锭或胶囊形式中。也可使用用于漱口剂的流体载体制备口服组合物,其中将流体载体中的化合物应用于口腔,漱口并吐出或吞咽。也可包括药学相容性粘合化合物和/或辅料作为组合物的一部分。片剂、药丸、胶囊、糖锭等可包含任何以下成分或具有相似性质的化合物:粘合剂例如微晶纤维素、西黄蓍胶或明胶;辅料例如淀粉或乳糖,崩解化合物例如褐藻酸、primogel或玉米淀粉;润滑剂例如硬脂酸镁或sterotes;助流剂例如胶体二氧化硅;甜味化合物例如蔗糖或糖精;或芳香化合物例如薄荷、水杨酸甲酯或柑桔香精。
[0129]
对于吸入给药,可从加压容器或包含适当抛射剂例如气体如二氧化碳的给药器或喷雾器以气雾剂形式给予tregitope(s)。
[0130]
全身给药也可为经粘膜或经皮方式。对于经粘膜或经皮方式给药,在制剂中使用适用于待渗透屏障的渗透剂。这些渗透剂通常为本领域已知并包括例如用于经粘膜给药的去污剂、胆盐和夫西地酸衍生物。可通过使用鼻喷雾剂或栓剂完成经粘膜给药。对于经皮给药,将tregitope配制于软膏、油膏、凝胶或乳膏中并应用于局部或经本领域一般熟知的经皮贴剂技术应用。
[0131]
tregitope也可制备为用于直肠给药的栓剂(例如用常规的栓剂基质例如可可脂和其他甘油酯)或保留灌肠剂形式的药用组合物。
[0132]
在一个实施方案中,用可防止tregitope被人体快速清除的载体制备tregitope,例如控释制剂,包括植入物和微囊化给药系统。可使用可生物降解的、生物相容性聚合物,例如乙烯醋酸乙烯酯、聚酐、聚乙醇酸、胶原、多正酯类和聚乳酸。制备这些制剂的方法对本领域技术人员是显而易见的。也可从alza corporation和nova pharmaceuticals,inc商业购买这些材料。脂质体混悬剂(包括用抗病毒抗原的单克隆抗体靶向受感染细胞的脂质体)也可用作药物可接受载体。这些可通过本领域技术人员已知的方法制备(美国专利号
4522811)。tregitopes或嵌合蛋白可植入生物聚合物固相载体或与其连接,其允许tregitopes或嵌合蛋白缓慢释放至期望位点。
[0133]
将口服或肠胃外组合物以剂量单位形式配制以便于给药和计量均一性是尤其有利的。如本文所使用剂量单位形式指适用做被治疗受试者单一剂量的物理不连续单位;各单位包含经计算可与所要求药物载体一起产生期望疗效的预定量的粘合剂。本发明剂量单位形式的规格取决并直接依赖于粘合剂的独特特性和要达到的具体疗效以及配制该tregitope用于治疗受试者的技术固有的限制。
[0134]
预防和治疗医学病症的方法
[0135]
本发明涉及例如治疗一种或多种医学病症的方法,其包括给予本发明tregitope或嵌合蛋白,藉此治疗医学病症。医学病症可为例如原发性免疫缺陷;免疫介导的血小板减少症、川崎病、20岁以上患者中的造血干细胞移植、慢性b-细胞淋巴细胞性白血病和儿童i型hiv感染。具体实例包括:(血液学)再生障碍性贫血、单纯红细胞再生障碍、戴-布二氏贫血、自身免疫性溶血性贫血、新生儿溶血、获得性因子viii抑制剂、获得性冯
·
威利布兰德病、免疫介导中性粒细胞减少症、血小板输注无效、新生儿同种免疫/自身免疫血小板减少症、输血后紫癜、血栓性血小板减少性紫癜/溶血尿毒综合征;(感染性疾病)其中患有感染性疾病的是有害的病症包括低出生体重(例如,<1500g)、实体器官移植、手术、创伤、烧伤和hiv感染;(神经学)癫痫和儿童顽固性格林-巴利综合征、慢性炎性脱髓鞘性多发性神经病、重症肌无力、lambert-eaton肌无力综合症、多灶性运动神经病、多发性硬化症;(产科学)反复妊娠丢失;(肺病学)哮喘、慢性胸症状(chronic chest symptoms);风湿病学,类风湿性关节炎(成人和青少年)、全身性红斑狼疮、全身血管炎、皮肌炎、多发性肌炎、包涵体肌炎、韦格纳肉芽肿病;(混合性)脑白质肾上腺萎缩症、肌萎缩性脊髓侧索硬化症、白塞综合征、急性心肌病、慢性疲乏综合征、阻塞型心脏传导阻滞、囊性纤维病、自身免疫脓疱性皮病、糖尿病、急性特发性家族性自主神经机能异常、急性播散性脑脊髓炎、内毒素血症、溶血性输血反应、噬血细胞综合征、急性成淋巴细胞性白血病、下位运动神经元综合症、多发性骨髓瘤、人t细胞淋巴营养性病毒-1-相关脊髓病、肾炎综合征、膜性肾病、肾病综合征、甲状腺功能正常型眼病、眼阵挛-肌阵挛、复发性中耳炎、副肿瘤性小脑变性、副蛋白血症性神经病、细小病毒感染(全身)、多发性神经病,器官巨大症,内分泌病,m-蛋白质和皮肤改变(poems)综合症、进行性腰骶神经丛病、lyme神经根神经炎、rasmussen综合症、莱特尔综合征、急性肾功能衰竭、血小板减少症(非免疫的)、链球菌中毒性休克综合征、眼色素层炎和伏格特-小柳-原田三氏综合征。
[0136]
在具体的实施方案中,本发明涉及例如治疗变态反应、自身免疫疾病、移植相关疾病例如移植物抗宿主病、酶或蛋白质缺乏症、凝血障碍、癌症、不育或感染(病毒、细菌或寄生虫)的方法。本发明tregitopes或嵌合蛋白可与其他用于治疗患有医学病症的受试者的蛋白质化合物联合使用以减少不良事件或增加联合给予化合物的药效。
[0137]
应用于变态反应。变应原-特异性调节性t细胞在控制变态反应和哮喘的发展中发挥重要作用。天然cd4/cd25调节性t细胞和第二t
regs
(抗原特异性调节性t细胞),二者均表达转录因子foxp3,已显示可抑制变应性疾病中的不适当免疫应答。一些近期的研究表明调节性t细胞在控制易感个体(不仅是动物模型而且在人体中)中t-辅助细胞2型为主的免疫应答的过度发展。近期研究表明t调节性细胞也通过分泌tgf-β和il-10抑制t细胞协同刺
激,表明t调节性细胞在调节变应性疾病中的重要作用。天然或适应性调节性t细胞扩增受损可导致变态反应的发生,诱导变应原-特异性调节性t细胞的治疗可提供变态反应和哮喘的治愈性治疗。
[0138]
用于预防和治疗哮喘的一种策略为诱导调节性t细胞。可通过免疫刺激引起th1或tr应答防止动物产生哮喘。
[0139]
应用于移植。本发明tregitopes可用于诱导移植过程中的耐受,其方式为促进特异下调对供体细胞免疫应答的细胞的发育。诱导抗原-特异性t
reg
细胞用于治疗器官特异性自身免疫是重要的治疗学发展,避免了全身免疫抑制。在骨髓移植的鼠类模型中,t
regs
促进供体骨髓移植物并降低移植物抗宿主病的发病率和严重性而不取消有益的移植物抗肿瘤免疫作用。这些发现,与小鼠和人类中的t
regs
共享表型和功能特性的观察一致,已引起对使用这些细胞减少与人造血细胞移植相关并发症的积极研究。t
regs
和效应t细胞的失调促进移植物抗宿主病的发展。然而,免疫调节的机制,尤其是t
regs
的同种识别性质,它们对其他免疫细胞的作用和相互作用以及它们抑制活性的位点还是未知。
[0140]
来自人和实验动物模型的累积证据已表明t
regs
参与移植物抗宿主病(gvhd)的发展。t
regs
可将gvhd从移植物抗肿瘤(gvt)活性分离的例证表明可操控它们的免疫抑制潜能以减少gvhd而对gvt作用无有害影响。尽管已报导了多种具有免疫抑制能力的t淋巴细胞,但是两个研究最充分的亚群为天然存在的、胸腺内生成的t
regs
(天然t
regs
)和外周生成的可诱导t
regs
(可诱导t
regs
)。
[0141]
应用于自身免疫。tregitopes可用作免疫原性化合物(蛋白质药物)的耐受剂。这一发现对蛋白质药物的设计具有意义。因此,与tregitopes联合给予单克隆抗体、自体细胞因子或外源蛋白可抑制不良t效应细胞免疫应答。在体内,t
regs
通过树突状细胞限制自身反应性t细胞活化,因此防止它们分化和获得效应细胞功能。通过限制提供活化的致病细胞,t
regs
防止或减缓自身免疫疾病的进展。然而这一保护性机制对自身免疫个体而言是不足的,很可能因为缺少t
regs
细胞和/或t
regs-抗性致病t细胞在长期疾病进程中的发展和积累。因此,这些患者中自身耐受的恢复需要清除致病t细胞并同时输注控制现行组织损伤能力增强的t
regs
。器官特异性自身免疫疾病例如甲状腺炎和胰岛素依赖型糖尿病已归因于这一耐受机制的瓦解。
[0142]
应用于糖尿病。i型(少年)糖尿病为器官特异性自身免疫疾病,由产生胰岛素的胰岛β细胞破坏引起。在非糖尿病患者中,胰岛细胞抗原-特异性t细胞或在胸腺发育中被清除或被转化成可积极抑制对胰岛细胞抗原的效应细胞应答的t调节性细胞。在少年糖尿病患者中中和少年糖尿病的nod小鼠模型中,缺失这些耐受机制。在它们缺失的情况下,胰岛细胞抗原由人白细胞抗原i和ii类分子递呈并被cd8(+)和cd4(+)自身反应性t细胞识别。这些自身反应性细胞对胰岛细胞的破坏最终导致葡萄糖耐受不良。同时给予tregitopes和胰岛细胞抗原导致天然t调节性细胞的活化和现有的抗原特异效应t细胞转化至调节性表型。这样改变了有害的自身免疫应答导致对抗原特异性适应性耐受的诱导。通过诱导抗原-特异性耐受调节对自体表位的自身免疫应答可预防现行的β-细胞破坏。因此,本发明tregitope可用于预防或治疗糖尿病的方法中。
[0143]
应用于乙肝病毒(hbv)感染。慢性hbv通常为获得性(由母体胎儿传播)或在罕见情况下为成人急性hbv感染的结果。慢性乙肝(ch-b)急剧加重通常伴随着对乙肝核心抗原和e
抗原(hbcag/hbeag)细胞毒性t细胞应答的增强。在近期的研究中,syfpeithi t细胞表位定位系统可用于预测hbcag和hbeag的mhc ii类-限制性表位肽。使用高评分肽构建mhc ii类四聚体并用于测定t
reg
和ctl频率。结果显示在加重过程中特异于hbcag的t
reg
细胞减少,伴随着hbcag肽-特异细胞毒性t细胞的增加。在耐受期,鉴定foxp3-表达t
reg
细胞克隆。这些数据表明hbcag t
reg t细胞的减少解释了慢性乙肝病毒感染自然进程上的自发加重。因此,本发明tregitope可用于预防或治疗病毒感染例如hbv感染的方法中。
[0144]
应用于sle。已确定了在系统性红斑狼疮(sle)或干燥综合征(syndrome)中发挥重要作用的treg表位。该肽包括剪接体蛋白的残基131-151(rihmvyskrsgkprgyafiey;seq id no:67)。可溶性hla ii类分子的结合测定法和分子建模实验表明该表位表现为混合表位并结合至一大组人dr分子。与普通t细胞和来自非-狼疮自身免疫患者的t细胞相反,来自40%随机筛选的狼疮患者的pbmcs包含响应肽131-151而增殖的t细胞。配体的改变修饰了t细胞应答,表明存在响应该肽的数个t细胞种群,其中有treg细胞。也确定了干燥综合症中的t调节性表位。因此,与上述表位联合给予的本发明tregitope可用于预防和治疗sle的方法中。
[0145]
应用于格雷夫斯病(graves
’
disease)。格雷夫斯病是以自身促甲状腺激素受体(tshr)的抗体为特点的自身免疫疾病,导致甲状腺功能亢进或从甲状腺非正常地强烈释放激素。若干遗传因素可影响对格雷夫斯病的易感性。女性比男性更容易感染该疾病;白人和亚洲人比黑人的风险更高并且hla drb1-0301与该疾病密切相关。因此,联合给予本发明tregitope(s)和tshr或其他格雷夫斯病的抗原或其部分可用于预防和治疗格雷夫斯病的方法中。
[0146]
应用于自身免疫性甲状腺炎。自身免疫性甲状腺炎为对自身甲状腺过氧化酶和/或甲状腺球蛋白产生抗体时发生的疾病,其引起甲状腺滤泡的逐渐破坏。hla dr5与该疾病紧密相关。因此,联合给予本发明tregitope和甲状腺过氧化酶和/或甲状腺球蛋白tshr或其部分可用于预防和治疗自身免疫性甲状腺炎的方法中。
[0147]
应用于疫苗载体的设计。靶向树突状细胞表面受体dec-205的单克隆抗体已显示作为可靶向疫苗抗原至树突状细胞的疫苗载体的潜能。然而抗-dec-205可成功作为强炎性免疫应答的刺激剂依赖于联合给予非特异树突状细胞成熟因子。当它们不存在时,抗-dec-205诱导抗原-特异性耐受而不是免疫。因此,包含于抗-dec-205的调节性t细胞表位可促进致耐受性反应,其只有通过联合给予非特异性免疫刺激剂才可克服。这一点已被试验验证,也就是说包含于抗-dec-205载体中的tregitopes引起调节性t细胞的抗原特异性扩增并抑制炎性免疫应答。修饰这些tregitopes这样它们不再结合mhc分子将显著降低致耐受性,使得可将抗-dec-205用作消除免疫系统非特异性活化相关危险的有效的独一无二的抗原递送系统。
[0148]
试剂盒
[0149]
例如可通过使用包括至少一种本发明tregitopes组合物的预包装试剂盒实施本文所述方法,其可方便地用于例如临床环境治疗显示本文所述医学病症症状或家族史的受试者。在一个实施方案中,该试剂盒进一步包括至少一种本发明tregitopes组合物的使用说明以治疗显示本文所述医学病症症状或家族史的受试者。
[0150]
用tregitopes离体扩增t-调节性细胞
[0151]
在另一方面,本发明提供离体扩增调节性t细胞的方法。在一个实施方案中,本发明提供扩增生物样品中调节性t细胞的方法,该方法包括:(a)提供来自受试者的生物样品;(b)从生物样品中分离调节性t细胞;以及将分离的调节性t细胞与有效量的本发明tregitope组合物在t-调节性细胞数量增加得到扩增的调节性t细胞组合物的条件下接触,藉此扩增生物样品中的调节性t细胞。在一个实施方案中,该方法进一步包括给予受试者扩增的调节性t细胞组合物的步骤。在一个实施方案中,给予了扩增的调节性t细胞组合物的受试者(例如通过自体移植扩增的调节性t细胞组合物)为获得原始生物样品的相同个体(ruitenberg,j.等,bmc immunol.,7:11,2006)。
[0152]
tregitope组合物的体外应用
[0153]
在另一方面,本发明提供使用本发明tregitope组合物作为在体外实验模型中研究调节性t细胞功能的试剂。在一个实施方案中,本发明提供刺激生物样品中调节性t细胞的体外方法,该方法包括:(a)提供来自受试者的生物样品;(b)从生物样品中分离调节性t细胞;以及将分离的调节性t细胞与有效量的本发明tregitope组合物在t调节性细胞被刺激而改变一种或多种生物功能的条件下接触,藉此刺激生物样品中的调节性t细胞。在一个实施方案中,本发明提供测定tregitope与调节性t细胞或其片段结合的体外方法。
[0154]
下文的实施例不应理解为以何方式限制本发明范畴。就本公开而言,本文权利要求范围内的许多实施方案对于本领域普通技术人员而言是显而易见的。
[0155]
例证
[0156]
将tregitopes(1)用t细胞表位定位算法epimatrix鉴定,(2)验证其结合至可溶性hla,(3)证明其与天然调节性t细胞黏附,(4)证明其离体(在人pbmc中)抑制对联合给予抗原的免疫应答和(5)证明其体内(在小鼠中)抑制对联合给予抗原的免疫应答。这些发现的方法列于下文,后面为对应的结果。
[0157]
(1)鉴定t细胞表位和t细胞表位集簇的方法
[0158]
t细胞特异识别由抗原递呈细胞(apcs)在mhc(主要组织相容性复合物)ii类分子情况下递呈的表位。可以包括7至30个连续氨基酸并适合mhc ii类分子结合沟槽的线性序列递呈这些t-辅助细胞表位。已开发一些计算机算法并用于检测各种来源蛋白质分子中的ii类表位(de groot,a.等,aids res.hum.retroviruses,13:539-541,1997;schafer,j.等,vaccine,16:1880-1884,1998;de groot,a.等,vaccine,19:4385-95,2001;de groot,a.等,vaccine,21:4486-504,2003)。这些对t-辅助细胞表位的“计算机算法(in silico)”预测已成功应用于疫苗设计和治疗性蛋白的去免疫性。
[0159]
epimatrix系统为预测i类和ii类表位的工具。该算法使用预测结合hla分子的9-和10-mer肽的矩阵。各矩阵以与氨基酸结合亲和力(由与口袋谱型法(pocket profile method)(sturniolo,t.等,nat.biotechnol.,17:555-561,1999)相似但是不相同的方法阐明)相关的位置特异性系数为基础。epimatrix系统已用于前瞻性预测大量的已在体外或体内经过验证的表位。首先将任何给定序列的完整氨基酸分割成重叠的9-mer框架,其中各框架与上一个重叠八个氨基酸。就其与八个普通ii类hla单倍型(drb1*0101、drb1*0301、drb1*0401、drb1*0701、drb1*0801、drb1*1101、drb1*1301和drb1*1501)的预测亲和力给各框架评分。由于它们的普遍性和它们之间的差异,这些8个等位基因涵盖了约97%的世界人群。然后相对于衍生自大量随机生成肽序列的分数分布标准化epimatrix初始分数。所得
“
z”分数通常正态分布并可在等位基因之间直接比较。
[0160]
epimatrix肽评分。已测定在epimatrix“z”范围中的评分高于1.64(约任何给定肽组的前5%)的任何肽具有显著的机会与被预测的mhc分子结合。在该范围内评分高于2.32(前1%)的肽极有可能结合;大多数已发表的t细胞表位在这一评分范围内。之前研究已证明epimatrix可准确预测已公开的mhc配体和t细胞表位。
[0161]
鉴定混合t细胞表位簇。表位定位后,筛选epimatrix算法生成的结果组判断t细胞表位簇和epibars的存在。潜在的t细胞表位并不是随机分布在整个蛋白质序列中而是易于“集簇”。t细胞表位“(集)簇(cluster)”的长度为9至约30个氨基酸并且,考虑到它们与多个等位基因的亲和力以及跨越多个基因,其在任何位置包含4至40个结合基序。使用已知为clustimer的适当算法鉴定推定的t细胞表位簇。简略而言,聚集所分析的各9-mer肽的epimatrix分数并根据统计学获得的阈值检查。接着将高分数9-mer一次延伸一个氨基酸。再次聚集已延伸序列的分数并与修改的阈值比较。重复该过程直至预定的延伸不再提高集簇的整体分数。在本研究中鉴定的tregitope(s)由clustimer算法鉴定为t细胞表位簇。它们包含显著数量的推定t细胞表位和epibars,表明mhc结合和t细胞反应性的巨大潜力。
[0162]
(2)评价肽合成和结合可溶性mhc的方法
[0163]
肽合成。可通过直接化学合成或重组方法(sambrook等,molecular cloning:a laboratory manual,第2版,cold spring harbor laboratory press,(1989))生产tregitopes。通过new england peptide的9-芴甲氧羰基(fmoc)合成法在自动化rainen symphony/蛋白质技术合成仪(synpep,dublin,ca)上制备对应于本发明tregitopes的肽。经hplc、质谱和uv扫描(分别确证纯度、质量和光谱)验证该肽以纯度>80%递送。
[0164]
所生产肽的结合。将非生物素化的待检测肽重悬于96-孔聚丙烯板中至终浓度在0.1μm
–
400μm的范围内,一式三孔。接着在这些孔中加入已纯化重组hla ii类分子的在150mm柠檬酸盐-磷酸盐缓冲液(ph 5.4)中包含1mm pefabloc、0.75%正-辛基-b-d-吡喃葡萄糖苷的溶液至终浓度200ng/孔。将96孔板于37℃在6%co2中温育45分钟。温育后,将生物素化flu ha肽307-319(或另一适当的对照肽)加入至终浓度0.1μm/孔并37℃温育20小时。接着将各孔的内容物加入预先包被了抗-人hla-dr l243捕获抗体(becton dickenson)的96-孔高结合elis板中并于4℃温育20小时。接着向各孔中加入100μl(10μg/ml)铕-标记链霉亲和素(perkin-elmer)和100μl富集缓冲液(perkin-elmer)显色。在室温下于暗处使反应进行15-30分钟并接着在wallac victor 3-v时间分辨荧光免疫分析仪上测定荧光。通过使用sigmaplot分析程序用非线性回归分析计算ic
50
值。基于与已知肽的比较,250μm或更大的ic
50
指示弱结合并且400μm或更大的ic
50
指示无结合相互作用。
[0165]
(3)评价肽黏附天然调节性t细胞能力的方法
[0166]
t细胞分离。本研究方案涉及从rhode island blood bank,providence获得的捐赠血液,来自clinical partners,johnston,rhode island招募的志愿者的血液,从stallergenes,paris,france招募的志愿者获得的血液以及从供应商获得的样品。遵循联邦指南以及stallergenes和epivax机构政策获得供体血液。获得供体血液的方案经各自机构审查委员会的批准。根据accuspin方案(sigma-aldrich,st.louis,mo)分离外周血单核细胞。尘螨过敏性个体的冷藏pbmc获自cellular technologies ltd.(cleveland,ohio)。
[0167]
天然t reg测定法。在单独破伤风毒素肽tt
830-844
、单独tregitope、单独植物凝血
permutation test)(hudgens,m.等,j.immunol.methods,288:19-34,2004)进行统计学检测。如果肽检测孔中的斑点数量与对照孔具有统计学差异(p<0.01)则认为是阳性应答。一般而言,如果斑点数量至少为背景的四倍并且每一百万细胞超过背景大于50个斑点(每20000个脾细胞有1次应答超过背景)则认为是阳性应答。结果记录为高于背景的平均斑点数并调节至每一百万接种细胞的斑点数。当测定为统计学显著时,10%或更大的抑制率被认为是显著的。
[0173]
人ifn-γelisaspot。以10μg/ml将目标肽加入包含添加了10%人血清的rpmi1640中人外周血单核细胞的培养物中并于37℃5%co2气氛下温育十八至二十二小时。用10μg/ml pha刺激或未用肽刺激的培养物作为对照。使用r&d systems quantikine elisa试剂盒进行人ifn-γ定量夹心elisas。将特异于ifn-γ的多克隆抗体预包被至96-孔微量滴定板上。将试剂盒提供的标准品和包括pha的细胞上清样品和无肽对照(100μl)加入孔中并且任何存在的ifn-γ被固定化抗体在室温下经2小时结合。洗去未结合物质之后,在孔中加入特异于ifn-γ的酶联多克隆抗体并于室温下温育2小时。洗去任何未结合抗体酶试剂后,在孔中加入底物溶液30分钟,与结合ifn-γ的量成正比显色。停止显色并在wallac victor3上于450nm测定颜色强度。通过从450nm值减去540nm的强度进行板子光学缺陷的修正。通过t-检验评价不同试验组之间细胞因子水平的差异。如果在试验和对照孔之间所观察到的细胞因子表达差异有统计学差异(p<0.01)则该应答被认为是阳性的。
[0174]
多路人细胞因子/趋化因子elisa。用searchlight multiplex elisa技术评价pbmc培养物上清的细胞因子和趋化因子水平。所测定的人细胞因子包括il-1β、il-2、il-4、il-5、il-6、il-10、il-12p40、il-12p70、tnfα和tgfβ。所测定的人趋化因子包括mcp-1、mip-1α和mip-1β。searchlight proteomic arrays为定量多路夹心elisa,其包含点样于96孔聚苯乙烯微量滴定板底部的多至16种不同的捕获抗体。各抗体捕获由生物素化抗体检测的特异蛋白质,然后加入链霉亲和素-hrp,最后用电荷耦合装置(ccd)照相机检测supersignal elisa femto化学发光底物。通过t-检验评价不同试验组之间细胞因子水平的差异。如果所观察到的试验和对照孔之间的细胞因子表达差异有统计学差异(p<0.01)则该应答被认为是阳性的。
[0175]
细胞分离/排除方法。使用invitrogen dynabeads系统(用于人cd4和cd25)根据使用说明(invitrogen,carlsbad,california)从pbmc中排除或阳性分离人treg细胞群。
[0176]
(5)体内抑制对联合给予抗原的应答的方法
[0177]
为了测定在生命体系中tregitopes对蛋白质-诱导的效应细胞应答的免疫抑制作用,使用鼠类模型进行试验。用单独的抗原、抗原和tregitope的混合物或与tregitope融合的抗原免疫数组小鼠。也评价阴性对照组(溶剂组)。最后一次注射后一周,根据所有的机构和联邦指南处死小鼠并收获脾。使用新鲜分离的小鼠脾细胞测定体内细胞免疫应答。制备单个脾细胞混悬液并用于下文的测定法中。心脏穿刺获得全血并收集血清用于定量对联合给予抗原的抗体应答。
[0178]
鼠ifn-γelispot.用购自mabtech的鼠ifn-γelispot试剂盒进行ifn-γelispot测定。以10μg/ml将目标肽加入包含300000个鼠脾细胞(含10%fcs的rpmi1640中)的一式三份重复孔中并于37℃5%co2气氛下温育十八至二十二小时。在一式三份重复孔中加入10μg/ml的cona。六个不含肽的孔用于背景测定。如果经mann-whitney u检测肽检测孔中的斑
点数量与对照孔具有统计学差异(p<0.05)则认为是阳性应答。一般而言,如果斑点数量至少为背景的四倍并且每一百万细胞超过背景大于50个斑点(每20000个脾细胞有1次应答超过背景)则认为是阳性应答。结果记录为高于背景的平均斑点数并调节至每一百万接种细胞的斑点数。
[0179]
鼠il-4elispot。用购自mabtech的鼠il-4elispot试剂盒进行il-4elispot测定。以10μg/ml将目标肽加入包含300000个鼠脾细胞(含10%fcs的rpmi1640中)的一式三份重复孔中并于37℃5%co2气氛下温育十八至二十二小时。在一式三份重复孔中加入10μg/ml的cona。六个不含肽的孔用于背景测定。用变体排列测试(variant permutation test)(hudgens,m.等,j.immunol.methods,288:19-34,2004)进行统计学检测。如果肽检测孔中的斑点数量与对照孔具有统计学差异(p<0.01)则认为是阳性应答。一般而言,如果斑点数量至少为背景的四倍并且每一百万细胞超过背景大于50个斑点(每20000个脾细胞有1次应答超过背景)则认为是阳性应答。结果记录为背景上的平均斑点数并调节至每一百万接种细胞的斑点数。
[0180]
鼠ifn-γelisa。将目标肽以10μg/ml加入包含人外周血单核细胞(添加了10%人血清的rpmi1640中)的培养物中并于37℃5%co2气氛下温育十八至二十二小时。用10μg/ml pha刺激的或未用肽刺激的培养物作为对照。使用r&d systems quantikine elisa试剂盒进行鼠ifn-γ定量夹心elisas。将特异于ifn-γ的多克隆抗体预包被至96-孔微量滴定板上。将试剂盒提供的标准品和包括pha的细胞上清样品和无肽对照(100μl)加入孔中并且任何存在的ifn-γ被固定化抗体在室温下经2小时结合。洗去未结合物质之后,在孔中加入特异于ifn-γ的酶联多克隆抗体并于室温下温育2小时。洗去任何未结合抗体酶试剂后,在孔中加入底物溶液30分钟,与结合ifn-γ的量成正比显色。停止显色并在wallac victor3上于450nm测定颜色强度。通过从450nm值减去540nm的强度进行板子光学缺陷的修正。通过t-检验评价不同试验组之间细胞因子水平的差异。如果所观察到的试验和对照孔之间的细胞因子表达差异有统计学差异(p<0.01)则该应答被认为是阳性的。
[0181]
流式细胞计量法。将脾细胞以2
×
106细胞/孔加入含添加10%fcs、100u/ml青霉素、100μg/ml硫酸链霉素的rpmi 1640的96-孔组织培养板中。各测定中包括未刺激对照和阳性对照(cona)。将细胞于37℃5%co2温育过夜。温育后,在包含1%牛血清白蛋白的pbs中洗涤并用表面抗体(例如,cd4、cd25)染色。接着用cytofix/cytoperm试剂盒(bd pharmingen)根据使用说明将细胞洗涤并固定。固定后,在cytoperm缓冲液中洗涤细胞两次并用抗胞内标记(例如,foxp3、il-10)的抗体染色。染色后用为流式细胞计量法制备的包含1%多聚甲醛的pbs洗涤并固定。在bd facscalibur仪器上分析细胞。每样品收集20000个事件。使用flojo软件进行数据分析。所有数据均减去背景。基于wilcoxon等级和检验进行组之间比较。成对比较应用显著性p<0.05,多重比较应用p<0.01。
[0182]
细胞分离/排除方法。使用invitrogen dynabeads系统(用于鼠cd4和cd25)根据使用说明(invitrogen,carlsbad,california)从pbmc中排除或阳性分离鼠treg细胞群。
[0183]
定量联合给予抗原的抗体
[0184]
通过抗体-捕获elisa定量抗原的igg抗体。将抗原(10μg/ml)溶解于碳酸盐缓冲液中并置于96-孔微量滴定板中4℃过夜。接着用包含0.05%tween 20(pbst)的经磷酸盐缓冲的盐水洗涤板子并用5%胎牛血清(fbs;gibco)的pbs溶液于室温下封闭三小时。将0.5%
fbs/pbs中系列稀释的血清加入板子中并于室温下温育两个小时。接着用pbst洗涤微量滴定板并在各孔中加入以1:10000稀释于0.5%fbs/pbs中的与辣根过氧化酶(southern biotechnology associates)偶联的100μl山羊抗-小鼠igg(γ链特异)。用pbst洗涤微量滴定板并接着用3,3
’
,5,5
’-
四甲基联苯胺(tmb;moss)显色。在wallac victor3上于450nm波长处读取吸光度。通过从450nm值减去540nm的强度修正板子的光学缺陷。
[0185]
实施例1.鉴定tregitope组合物
[0186]
鉴定人igg蛋白表位为调节性。评价大量抗体的免疫原性潜能后,观察到一种重复出现模式。某些表位簇出现在多个抗体中。不愿受到理论的束缚,据推断高度保守的表位簇不太可能促进抗-抗体免疫应答。进一步推断这些重复出现模式可被免疫系统被动耐受或主动地黏附负责抑制抗-抗体免疫应答的调节性t细胞。将重复出现表位簇的序列与genbank的蛋白数据库比较确定了包含于igg抗体序列中既保守又可潜在刺激调节性t细胞的19个区域(见表2)。
[0187]
根据epimatrix系统,所有这些19个区域具有显著的免疫刺激潜能,各包含至少一个至多14个结合基序并且在epivax免疫原性等级上的评分在1至25之间。此外,若干这些序列包含一个或多个“epibars”。epibars为预期结合至少4种不同ii类hla的单个9mer框架。epibars是免疫刺激潜能增加的标志。
[0188]
表2:本发明tregitopes及其epimatrix分值
[0189][0190][0191]
保守。将所有igg衍生的推定tregitope序列与igg1、igg2、igg3、igg4、iga、ige、igd和igm的种系序列经视觉检查比较。发现igg-衍生的tregitopes在igg1、igg2、igg3和igg4的种系序列中高度保守。在iga、ige、igd或igm的种系序列中未发现同源性。其他tregitopes序列也高度保守(在人蛋白质变异体中)并通常大量存在于循环中。
[0192]
种。进行igg-衍生的tregitopes与非人物种的同源性分析。将序列经ncbi网站(ncbi.nlm.nih.gov/blast)上传至basic local alignment search tool(blast)。blast
程序将蛋白质序列与序列数据库比对并计算匹配的统计学显著性以发现序列之间局部相似性区域。发现igg-衍生的tregitopes在非人物种例如小鼠、大鼠、猫、骆驼、奶牛和非人灵长类中是保守的。表3显示了tregitope-289(seq no:4)的blast报告。
[0193][0194]
在普通循环人蛋白质中鉴定调节性表位。在后续的分析中epivax鉴定出一组可能也包含tregitopes的普通循环蛋白。被分析的蛋白质组包括人体分离物:肌动蛋白、白蛋白、胶原、纤维蛋白原、触珠蛋白、角蛋白、肌球蛋白、骨钙素、前列腺素、超氧化物歧化酶、肌联蛋白和转铁蛋白。如上所述用epimatrix和clustimer分析各蛋白质的普通分离物并筛选一组高评分并且高度保守的推定t细胞表位用于进一步分析。见表2,seq id nos:38-58。
[0195]
实施例2.通过与hla ii类分子的结合合成和鉴定tregitope组合物
[0196]
根据上文所述方法在合成igg tregitope上进行可溶性mhc结合测定。从强结合对照肽的六点抑制曲线得到ic
50
值(μm)。计算机(in silico)分析鉴定的tregitopes与人mhc分子结合。见下文的表4。
[0197][0198]
与氨基和羧基端的结构修饰相关的附加测定。对肽的氨基和羧基端的修饰已显示可改变mhc结合、蛋白水解降解和t细胞活化(maill
è
re,b.等,mol.immunol.,32:1377-85,1995;allen,p.等,int.immunol.,1:141-50,1989)。如果所观察到的ntregs活化确实由tregitope-特异tcr识别,那么对tregitope肽羧基端的细微改变应导致不同的抑制作用。合成包含和不包含c-端酰胺帽的相同tregitope肽序列。在hla结合测定法中评价不加帽肽与drb1*0101和drb1*1501的亲和力并显示以比加帽肽更高的亲和力与两个等位基因结合。使用来自drb1*0101受试者的pbmc研究tregitope肽(加帽和不加帽)抑制对联合温育的cef、mhc i类免疫原性肽库的免疫应答的能力。在第1天刺激细胞并培养6天。在第7天收集细胞并将其一半用cd4、cd25和cd127染色并用流式细胞仪分析。剩余的细胞加入ifn-γelispot板中并用cef再刺激。与不加帽tregitope-289相比,与c-端酰胺加帽tregitope的共培养导致cd4+cd25+cd127low tregs增加(图2,左图)。与之前显示cd4+cd25+cd127low tregs是高度抑制性的研究一致,加帽tregiotpe-289而不是不加帽tregiotpe-289可抑制cef-特异ifn-γ分泌(图2,右图)。
[0199]
后续分析显示加帽和不加帽tregitope-289(seq no:4)之间小1道尔顿的改变。经质谱分析tregitope-289酰胺化肽小1道尔顿。本文例证tregitope-289c-端酰胺化改变了其结合和功能特性。由于加帽tregitope-289肽显示更好的功能性,在所有的后续测定中使用加帽(酰胺化)肽。在进一步的报告中,本文显示的tregitope-289结果指加帽形式。本文描述的tregitopes的加帽和不加帽形式均涵盖于本发明中。
[0200]
实施例3.通过天然调节性t细胞刺激鉴定tregitope组合物
[0201]
在单独破伤风毒素肽tt
830-844
、单独tregitope、单独植物凝血素(促有丝分裂阳性对照)存在下或无刺激物条件下离体直接刺激人pbmcs 4天。用抗-cd4-fitc(克隆rpa-t4;ebioscience)和抗-cd25-apc(克隆bc96;ebioscience)抗体在冰上在流式染色缓冲液(ebioscience)中将1
×
106个细胞染色30分钟并用缓冲液洗涤两次。细胞表面染色后,根据使用手册将细胞固定并透化处理(ebioscience),并对foxp3胞内染色(克隆pch101;ebioscience)。在不同培养条件下foxp3阳性cd4+/cd25+ t细胞的频率由flowjo分析软件
列出。破伤风毒素-和tregitope-刺激样品中cd25表达相似的增加表明两种肽对t细胞的活化(图3;显示了tregitope-289的结果)。然而cd4+cd25+亚群中foxp3的表达存在显著差异,取决于所使用的刺激物。破伤风毒素刺激导致foxp3表达降低7%,而tregitope刺激导致表达增加大于两倍,分别表明th和ntreg活化。
[0202]
实施例4.通过体外抑制联合给予抗原鉴定tregitope组合物
[0203]
4a:tregitope-167和tregitope-134在体外下调对联合给予抗原的效应细胞应答并上调其调节性应答
[0204]
将pbmcs与a)单独免疫原性肽库,或b)含htregitope-167免疫原性肽的库,或c)含htregitope-134的免疫原性肽库一起培养8天。收获细胞并用pbs洗涤。将细胞(2
×
105细胞/孔)加入96-孔板中并用单独免疫原性肽库、免疫原性肽库和tregitope或无肽(阴性对照)再刺激65小时。根据如上所述的多路elisa分析法分析上清。在初始刺激中与tregitope共温育导致调节性细胞因子和趋化因子(il-10和mcp-1)的分泌增加以及辅助t细胞细胞因子和趋化因子(il-5、il-6、ifn-γ和mip-1α)分泌减少,证明了tregitopes黏附并活化调节性t细胞的能力(图4)。
[0205]
4b:tregitope-289在体外下调对联合给予抗原的效应细胞应答并上调其调节性应答。
[0206]
将pbmcs与a)单独免疫原性肽库,或b)含tregitope-289的免疫原性肽库,或c)含tregitope-289的免疫原性肽库一起培养8天。免疫原性肽库中的肽衍生自c3d,一种免疫原性自体蛋白(knopf,p.等,immunol.cell biol.,2008 jan 8;doi:10.1038/sj.icb.7100147)。收获细胞并用pbs洗涤。如上所述,将细胞(2
×
105细胞/孔)加入96-孔板中并在一式三份重复孔中在各条件下再刺激65小时:单独c3d库、c3d库+tregitope、pha对照或无肽(阴性对照)。用多路elisa分析法分析上清。两种培养条件之后对阳性对照pha的应答是强效的。在初始刺激中与tregitope共温育导致调节性细胞因子il-10的分泌增加、调节性趋化因子tgfβ略微增加以及辅助t细胞细胞因子和趋化因子ifnγ和mip 1α分泌增加,进一步证明了tregitopes黏附并活化调节性t细胞的能力(图5)。
[0207]
4c:tregitopes库体外下调对联合给予抗原的效应细胞自身免疫应答
[0208]
与衍生自tshr(格雷夫斯病的目标抗原)的表位共温育抑制对格雷夫斯病患者pbmc表位的免疫应答。将prmcs与含有或不含tregitope肽库(tregitope-134、tregitope-167、tregitope-289)的tshr肽库一起培养8天。收获细胞并用pbs洗涤。如上所述,在il-4elispot板中用1)个体tshr表位+tregitope-134、tregitope-167和tregitope-289的库,2)tshr表位库+tregitope-134、tregitope-167和tregitope-289的库,或3)无刺激物对照再刺激2.5
×
105个细胞。两种培养条件后对阳性对照pha的应答是强效的。
[0209]
在再刺激中抗原(tshr肽)与tregitope共温育导致il-4斑点形成细胞的显著减少。这一数据显示tregitopes抑制效应t细胞的细胞因子分泌(图6)。
[0210]
4d:个体tregitopes体外下调对cef(免疫显性联合给予肽抗原的库)的效应细胞应答。
[0211]
与tregitope共温育抑制对cef(衍生自普通病原体的免疫显性肽表位库)的免疫应答。将pbmcs与或不与单个的tregitope肽(tregitope-289、tregitope 294、tregitope-029、tregitope-074、tregitope-009)一起培养8天。收获细胞并用pbs洗涤。如上文所述,在
ifn-γelispot板中用单独cef、pha阳性对照(未显示)或无刺激物对照再刺激2.5
×
105个细胞。两种培养条件后对阳性对照pha的应答均是强效的。
[0212]
在温育期间将tregitope与抗原(cef)共温育导致响应cef再刺激ifn-γ斑点形成细胞的显著减少。这些数据显示tregitopes抑制效应t细胞的细胞因子的分泌。
[0213]
4e:tregitopes库下调对联合给与治疗性蛋白质抗原的体外效应细胞应答
[0214]
与tregitope共温育抑制对衍生自肉毒杆菌神经毒素(用于治疗张力障碍(运动失调)的蛋白质)的肽表位的免疫应答。在有证据证明抑制剂(抗-bont抗体)存在下将受试者的pbmcs与或不与tregitope肽库(tregitope-167、tregitope-134和tregitope-289)一起培养8天。收获细胞并用pbs洗涤。如上文所述,在ifn-γelispot板中用单个bont肽、bont肽库、阳性pha对照(未显示)或无刺激物对照再刺激2.5
×
105个细胞。未显示不具有显著基线应答的肽。两种培养条件后对阳性对照pha的应答均是强效的。
[0215]
在温育期间将抗原(cef)与tregitope共温育导致响应cef再刺激ifn-γ斑点形成细胞显著减少。这些数据显示tregitopes响应免疫原性治疗性蛋白质抑制效应t细胞的细胞因子分泌(图8和表5)。
[0216][0217]
4f:tregitope-289和tregitope-134响应联合给予的免疫显性抗原体外下调增殖
[0218]
cef是可商业购买的来自普通病原体的免疫显性肽表位。将pbmcs与单独cef、cef+tregitope-134或cef+tregitope-289一起培养8天。收获细胞并用pbs洗涤。根据标准方案将2
×
106个细胞用cfse染料(invitrogen)预标记并用cef库或无肽(阴性对照)或pha分裂素对照再刺激65小时;收集上清并如上所述进行hifn-γelisas。两种培养条件后对阳性对照pha的应答均是强效的。再刺激期间与tregitope共温育导致ifn-γ形成显著减少(左图),其与效应t细胞增殖减少相关(图9,右图)。
[0219]
4g:tregitope-289响应联合给与抗原体外下调增殖
[0220]
将之前用牛痘免疫的受试者的pbmcs与单独的免疫原性牛痘肽或含如上所述tregitope-289的免疫原性牛痘肽一起培养8天。收获细胞并用pbs洗涤。根据标准方案将2
×
106个细胞用cfse染料(invitrogen)预标记并用牛痘肽、牛痘肽和tregitope-289或无肽(阴性对照)再刺激65小时。温育期间与tregitope共温育导致效应t细胞增殖显著降低,进一步证明了由tregitope活化的调节性t细胞降低效应t细胞增殖的能力(图10)。
[0221]
4h:tregitope抑制由具有调节性表型的细胞(cd4+cd25hi t细胞)和il-10上调介导。
[0222]
制备来自单个尘螨-过敏性个体的两个pbmc样品。一个样品用抗-cd4和抗-cd25抗体染色并用流式细胞仪分析。在这一样品中通过上文所述方法从剩余的pbmc中排除cd4+cd25hi细胞亚群。另一样品保持不动。接着用含有或不含tregitope-289的hdm裂解物协同刺激两个样品。排除cd4+cd25hi的pbmc抑制ifn-γ的能力小于未排除pbmc,表明tregitope的抑制作用由cd4+cd25hi细胞介导。在(完整)pbmcs的辅助分析中,与单独hdm裂解物温育相比,与hdm裂解物和tregitope-289共温育之后对hdm裂解物的cd4+增殖性应答被抑制。
[0223]
图11证明了初始共温育中对cd4+/cd25hi t细胞的要求。在cd4+/cd25hi t细胞存在下,与tregitope-289和hdm协同刺激引起单独hdm再刺激后γ-干扰素释放的抑制;在cd4+/cd25hi t细胞不存在下(温育之前已分拣),与用单独hdm再刺激后更大量的抑制(65%:33.5至11.8pg/ml)相比,tregitope-289和hdm协同刺激与更低量的抑制(16%:16.5至12.4pg/ml)相关。图11显示包含tregs的细胞亚群对于诱导对抗原的耐受是必需的。
[0224]
4i:tregitope共温育引起具有调节性表型细胞(cd4+cd25hi t细胞)的增殖和响应变应原的调节性细胞因子il-10的上调。
[0225]
适应性耐受的诱导:为了测定tregitope ntreg活化是否可导致变应原特异-atreg的生成,分析首先与单独尘螨(dm)抗原、尘螨抗原+tregitope-289或尘螨抗原+tregitope-167温育8天的pbmc(来自尘螨敏感性个体)。如上图显示(图12),与dm抗原和tregitope-289共温育pbmc导致cd4+cd25hi细胞扩增近四倍;与dm抗原和tregitope-167共温育pbmc也具有相同的结果(1.6至7.5%)。在两种tregitope共温育中,也发现il-10分泌增加了五倍(图12,下图);这一发现与增加的cd4+cd25hi细胞可为hdm-特异性适应性treg的可能性一致。本领域技术人员可在这一体内测定法中验证扩增的cd4+cd25hi群分泌il-10。在扩增的cd4+cd25hi调节性细胞群存在下,响应联合给与抗原的il-10分泌,表明在与抗原的共温育中诱导了适应性tregs。
[0226]
这些数据显示了在相同的患者和相同的实验中与tregitope-289和dm抗原共温育后和与tregitope-167和dm抗原共温育后的cd4cd25hi t细胞扩增;以及用单独hdm再刺激后由共温育细胞分泌的il-10的量。
[0227]
4j:tregitope共温育引起抗原特异变应性th2应答的抑制
[0228]
tregitope共温育也可导致ccr4、cd30、crth2和ccr6表达的显著减少,其已显示与th2应答相关。接着评价在延长tregitope协同刺激后变应原-特异性cd4+ t细胞对细胞因子应答的调节。培养30天后,tregitope协同刺激促进bet v 1
1141-1155-特异性cd4+ t细胞混合群的产生。用抗原和tregitope延长刺激后,42%的这些表位-特异性细胞既不是il5阳性也不是ifn-γ阳性,并且44%在这一延长的温育中显示出转换至th-1-样增加的干扰素应
答(图13)。
[0229]
众所周知,筛选研究受试者是否存在hla dr*1 1501以增加四聚体结合机会;tregitope-167(treg诱导增加五倍)的作用比tregitope-289(三倍增加)更显著。在hlb结合测定法中tregitope-289未显示与dr1501结合。相反tregitope-167可高亲和力地地结合至hla 1501(50μm时结合抑制为87%)。
[0230]
实施例5.通过体内抑制联合给予抗原鉴定tregitope组合物
[0231]
5a:联合给予tregitope引起对联合给与蛋白质药物的效应细胞应答的体内抑制
[0232]
本文显示tregitope抑制对细菌来源的治疗性蛋白质(称作“antigen-xx”)的应答(图14)。在未公开的研究中antigen-xx已引起人体中显著的免疫原性。研究本发明tregitope是否可以体内抑制对蛋白质的效应细胞免疫应答。给hla dr4转基因小鼠(4-6周,雌性)每周三次皮下(颈背)注射1)单独的50μg antigen-xx,2)50μg antigen-xx+25μg鼠tregitope-167和25μg鼠tregitope 106或3)pbs假对照。收获脾细胞并如上所述加入鼠il-4 elispot板子中。
[0233]
通过如上文所述的抗体-捕获elisa测定antigen-xx的igg抗体定量。将antigen-xx(10μg/ml)溶于碳酸盐缓冲液中(10mm na2co3和35mm nahco3[ph 9])并置于96-孔微量滴定板中4℃过夜。接着用包含0.05%tween 20(pbst)的经磷酸盐缓冲的盐水洗涤板子并用pbs中5%胎牛血清(fbs;gibco)于室温下封闭3小时。将0.5%fbs/pbs中系列稀释的血清加入板子中并于室温下温育两个小时。接着用pbst洗涤微量滴定板并在各孔中加入以1:10000稀释于0.5%fbs/pbs中的与辣根过氧化酶(southern biotechnology associates)偶联的100μl山羊抗-小鼠igg(γ链特异)。用pbst洗涤微量滴定板并接着用3,3
’
,5,5
’-
四甲基联苯胺(tmb;moss)显色。在wallac victor3上于450nm波长处读取吸光度。通过从450nm值减去540nm的强度修正板子的光学缺陷。两种免疫条件后对阳性对照pha的应答均为强效的,并且两个测定法均可读出。
[0234]
该研究验证了与抗原联合给予的人tregitopes的鼠同源物的体内抑制作用。
[0235]
5b:tregitopes联合给予引起对联合给予变应原的效应细胞应答的体内抑制。
[0236]
尘螨在人体中引起显著的变应性应答,使用屋尘螨裂解物(hdml)的小鼠模型可作为与人类相似的模型。研究本发明tregitope是否可以体内抑制对hdml的效应细胞免疫应答。给hla dr4转基因小鼠(4-6周,雌性)每周三次皮下(颈背)注射1)50μg单独hdml,2)50μg hdml+50μg tregitope-289鼠同源物或3)pbs假对照。在第四臂,通过每周三次注射50μg使小鼠首先对hdml预致敏,接着同时注射hdml(50μg)和tregitope-289处理小鼠。最后一次注射后一周将小鼠处死。
[0237]
收获脾细胞并如上所述加入鼠il-4elispot板中;向加入板中的细胞加入(一式三份):pbs(无刺激物对照)、hdm裂解物、纯化的hdm抗原derp2和pha。hdm derp2为hdm裂解物的组分。
[0238]
心脏穿刺获得血清。通过上文所述的抗体捕获elisa测定hdm抗原的igg抗体定量。将hdm抗原derp2(10μg/ml)置于96-孔微量滴定板中于4℃过夜。接着用包含0.05%tween 20(pbst)的经磷酸盐缓冲的盐水洗涤板子并用pbs中5%胎牛血清(fbs;gibco)于室温下封闭3小时。将0.5%fbs/pbs中系列稀释的血清加入板子中并于室温下温育两个小时。接着用pbst洗涤微量滴定板并在各孔中加入以1:10000稀释于0.5%fbs/pbs中的与辣根过氧化酶
(southern biotechnology associates)偶联的100μl山羊抗-小鼠igg(γ链特异)。用pbst洗涤微量滴定板并接着用3,3
’
,5,5
’-
四甲基联苯胺(tmb;moss)显色。在wallac victor3上于450nm波长处读取吸光度。通过从450nm值减去540nm的强度修正板子的光学缺陷。两种免疫条件后对阳性对照pha的应答均为强效的,并且两个测定法均可读出(图15)。
[0239]
该研究验证了与dm抗原联合给予的人tregitopes的鼠等价物的体内抑制作用。
[0240]
5c:tregitopes共给予引起对联合给与药物的效应细胞应答的体内抑制。
[0241]
为了检测体内联合给予tregitopes是否能够抑制对免疫原性治疗性蛋白质的免疫应答,给小鼠每周三次注射hla drb1*0401,用单独的50μg免疫原性蛋白药物制剂(“ipt”)或与50μg的tregitope-289联用的制剂或ipt与鼠fc联用的制剂。与鼠fc区联合给予ipt可降低il-4应答,然而体内联合给予“ipt”和鼠同源物tregitope-289导致il-4减少更多(由elispot测定)(图16)。
[0242]
实施例6.fviii-tregitope构建体的生成
[0243]
tregitope与免疫原性蛋白的融合可引起对免疫原性蛋白外周耐受的诱导。凝血因子viii在患有严重a型血友病的患者中具有免疫原性。生产由凝血因子viii和tregitope的编码序列组成的嵌合构建体(sambrook等,molecular cloning:a laboratory manual,第2版,cold spring harbor laboratory press,(1989))。简略而言,通过复性重叠寡聚核苷酸生成融合于tregitope羧基端的凝血因子viii的编码区并亚克隆至表达质粒中。将质粒转染至dg44 cho细胞并筛选稳定的转化子。经免疫亲和柱纯化嵌合蛋白并评价致耐受性。表6显示了该嵌合蛋白的一个实施方案。
[0244]
[0245][0246]
实施例7.fviii-多个-tregitope构建体的生成
[0247]
多个tregitope可存在于高免疫原性蛋白质中以促进适应性耐受。制备由凝血因子viii和多个tregitope(s)的编码序列组成的嵌合构建体(sambrook等,molecular cloning:a laboratory manual,第2版,cold spring harbor laboratory press,(1989))。简略而言,通过复性重叠寡聚核苷酸tregitope生成融合于tregitope羧基端的凝血因子viii编码区并亚克隆至表达质粒中。将质粒转染至dg44 cho细胞并筛选稳定的转化子。经免疫亲和柱纯化嵌合蛋白并评价致耐受性。表7显示了该嵌合蛋白的一个实施方案。
[0248]
[0249][0250]
实施例8.强化疫苗递送载体的产生
[0251]
fc结合至fc受体增强抗原递呈细胞递呈至t和b淋巴细胞的摄取。位于igg分子fc结构域的tregitope-289可作为递送抑制信号。修饰fc以致tregitope-289不再结合mhc分子和调节性t细胞使得可以有效靶向候选疫苗而避免抑制作用。降低tregitopes与mhc分子结合的修饰是可用的。表8显示了这种修饰。设计由各种蛋白或所关注的表位假蛋白和tregitope修饰的migg fc组成的嵌合构建体(sambrook等.,molecular cloning:a laboratory manual,第2版,cold spring harbor laboratory press,(1989))。简略而言,通过复性重叠寡聚核苷酸生成蛋白质或所关注的表位假蛋白并亚克隆至tregitope修饰的fc融合表达质粒中。将质粒转染至dg44 cho细胞并筛选稳定的转化子。经蛋白a柱纯化嵌合蛋白同聚物并评价其免疫原性。表8显示了该嵌合蛋白的一个实例,其中所关注的假蛋白为衍生自与经修饰的fc蛋白融合的epstein barr病毒(ebv)的一串免疫原性t细胞表位,其中tregitope已被修饰而不再结合mhcii类分子并不能刺激天然调节性t细胞。表8中ebv-tregitope修饰的fc sequence(kb signal sequence)由下划线文本表示。tregitope以粗体文本表示。tregitope修饰的氨基酸以阴影文本表示。人fc区以斜体文本指明。
[0252][0253]
参考文献
[0254]
ahlers,j.等,j.clin.invest.,108:1677-1685,2001.
[0255]
bischof,f.等,proc.natl.acad.sci.usa,98:12168-73,2001.epub.2001 oct 2.
[0256]
cobbold,s.等,immunol rev.,213:239-55,2006.
[0257]
d
’
ambrosio,d.等,j.immunol.,161:5111-5,1998.
[0258]
de groot,a.和berzofsky,j.,methods,34:425-428,2004.
[0259]
de groot,a.等,immunol.cell biol.,80:255
–
269,2002.
[0260]
durinovic-bello,i.等,proc.natl.acad.sci.usa,103:11683-11688,2006.
[0261]
el-amine,m.等,j.immunol.,165:5631-5636,2000.
[0262]
el-amine,m.等.,int.immunol.,14:761-766,2002.
[0263]
feng,i.等,j biomed sci.,14:43-57,2006.
[0264]
hjelm,f.等.,scand.j.immunol.,64:177-184,2006.
[0265]
hochweller,k.等,curr.mol.med.,6:631-43,2006.
[0266]
huang,x.等,j.immunol.,175:4283-4291,2005.
[0267]
jordan,s.等,am.j.transplant.,6:459-66,2006.
[0268]
karlsson m.等,proc.natl.acad.sci.usa,96:2244-2249,1999.
[0269]
klee,l.和zand,r.,neuroinformatics,2:59-70,2004.
[0270]
monneaux,f.等,j.immunol.,175:5839-5847,2005.
[0271]
mudd,p.等,scand.j.immunol.,64:211-8,2006.
[0272]
nagata,k.等,j.immunol.,162:1278
–
86,1999.
[0273]
nguyen,v.等,biol.blood marrow transplant,12:995-1009,2006.
[0274]
phillips,w.等,int.rev.immunol.,24:501-17,2005.
[0275]
reijonen,h.和kwok w.,methods,29:282
–
288,2003.
[0276]
reitan,s.和hannestad,k.,proc.natl.acad.sci.usa,99:7588-7593,2002.
[0277]
shevach,e.等,immunol.rev.,212:60-73,2006.
[0278]
shioji,k.等,circ.res.,89:540-546,2001.
[0279]
southwood,s.等,j.immunol.,160:3363-3373,1998.
[0280]
st.clair,e.等,annu.rev.med.,58:329-346,2006.
[0281]
stock,p.等,curr.opin.allergy clin.immunol.,6:12-16,2006.
[0282]
sumida,t.等,arthritis rheum.,40:2271-2273,1997.
[0283]
tang,q.和bluestone,j.immunol.rev.,212:217-37,2006.
[0284]
wing,k.和sakaguchi,s.,curr.opin.allergy clin.immunol.,6:482-488,2006.
[0285]
wohlleben,g.和erb,k.,curr.pharm.des.,12:3281-92,2006.
[0286]
zambidis,e.和scott,d.,proc.natl.acad.sci.usa,93:5019-5024,1996.
[0287]
等同方案
[0288]
尽管已联系其具体的实施方案描述了本发明,但应理解的是其可进一步修改。此外,本申请预期涵盖本发明的任何变化、应用或调整,包括本发明所属领域已知或常规实践之内以及属于本发明附加权利要求范围的与本公开的偏离。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签:
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



