检测转基因大豆品系MON87708的制作方法
 2021-02-02 04:02:39|
2021-02-02 04:02:39| 288|
288| 起点商标网
起点商标网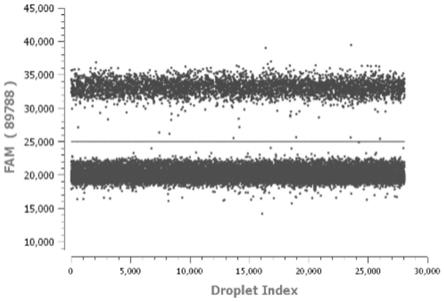
检测转基因大豆品系mon87708
×
mon89788的pcr引物组合物及方法
技术领域
[0001]
本发明属于生物技术领域,具体涉及一种检测转基因大豆品系mon87708
×
mon89788的pcr引物组合物及方法。
背景技术:
[0002]
转基因生物(gmos)商业化已经历时24年,转基因生物的数量以及在世界范围内种植转基因作物的面积持续稳定增长,累计达到25亿公顷,使生物技术成为全球应用最为迅速的作物技术。随着农业发展需求的日益提高,仅依靠单性状转基因作物无法满足现代农业的发展需求,复合性状转基因作物不断涌现。复合性状转基因作物把传统育种方法和现代基因育种结合起来开发多性状作物,展示了其广阔的应用前景。然而,作为一项新兴技术,对环境和人类健康也存在着潜在的风险,转基因作物的安全性始终是大众关注的焦点。相比单性状转基因作物,复合性状转基因作物涉及了多个基因,所以应具有更高的安全性评价标准,对其进行定量检测成为安全管理转基因作物的基础。
[0003]
在过去的20年中,已经开发了几种用于gmo检测和定量的方法,聚合酶链反应(pcr)是gmo检测的主要方法。数字pcr(dpcr)技术作为第三代pcr技术出现,与其他基于pcr的方法相比具有许多优势:最大的优势是dpcr无需参考标准/校准曲线即可对靶标进行绝对定量,这样可以最大程度地减少标准物质和测试样品之间基质差异的影响;基于高水平样品分配的原理,dpcr可在目标拷贝数很低的情况下,获得高精确度的检测结果,可以保证在非靶标dna的高浓度背景中可靠地检测出目标基因;dpcr对pcr抑制剂的敏感性较低。
[0004]
stilla公司的naica系统提供了基于液滴和芯片的技术平台组合,称为crystal digital pcr。它使用微流体蓝宝石芯片,将液滴形成,扩增和读数集成在单个消耗品中。该平台具有三色检测功能,可实现多重pcr反应。三色荧光通道允许用户同时检测三个不同的目标dna,而不会产生其他数字pcr平台在进行多重检测方法时的负面影响,如同一通道中不同目标dna存在时的竞争作用,或扩增效率不同导致某些靶点的优先扩增等影响。
[0005]
应用naica的这一技术,使我们对转基因复合品系的数字pcr定量检测成为可能。由于复合性状转基因生物的侧翼序列和相应单一性状的转基因生物一致,还没有合适的方法来准确地检测它们。因此,对复合性状转基因大豆品系mon87708
×
mon89788的特异性鉴定仍然是转基因作物检测技术的一项挑战。
技术实现要素:
[0006]
本发明的目的在于克服现有技术中存在的上述不足,提供一种检测转基因大豆品系mon87708
×
mon89788的pcr引物组合物及方法,所述引物组合物具有检测特异性好、灵敏度高等优点,对外源基因成分的定性和定量检测具有十分重要的应用价值。
[0007]
为实现上述发明目的,本发明采用的技术方案如下:
[0008]
第一方面,本发明提供了一种用于检测转基因大豆品系mon87708
×
mon89788外源
基因的pcr引物组合物,包括特异检测mon87708事件的引物对、特异检测mon89788事件的引物对和特异检测内源对照基因lectin的引物对;其中,所述特异检测mon87708事件的引物对包括seq id no.1所示的87708-f12和seq id no.2所示的87708-r12;所述特异检测mon89788事件的引物对包括seq id no.4所示的89788-f1和seq id no.5所示的89788-r1;所述特异检测内源对照基因lectin的引物对包括seq id no.7所示的lectin-f和seq id no.8所示的lectin-r。
[0009]
本发明提供的引物组合物具有检测特异性好、灵敏度高等优点,对外源基因成分的定性和定量检测具有十分重要的应用价值。
[0010]
优选的是,所述引物组合物还包括特异检测mon87708事件的taqman水解探针、特异检测mon89788事件的taqman水解探针和特异检测内源对照基因lectin的taqman水解探针;其中,所述特异检测mon87708事件的taqman水解探针为seq id no.3所示的87708-p1;所述特异检测mon89788事件的taqman水解探针为seq id no.6所示的89788-p1;所述特异检测内源对照基因lectin的taqman水解探针为seq id no.9所示的lectin-p;所述特异检测mon87708事件的taqman水解探针的5
’
端使用报告荧光基团cy5进行修饰,3
’
端使用淬灭基团bhq2进行修饰;所述特异检测mon89788事件的taqman水解探针的5
’
端使用报告荧光基团fam进行修饰,3
’
端使用淬灭基团bhq1进行修饰;所述特异检测内源对照基因lectin的taqman水解探针的5
’
端使用报告荧光基团vic进行修饰,3
’
端使用淬灭基团bhq2进行修饰。
[0011]
第二方面,本发明提供了一种根据第一方面所述的引物组合物在检测转基因大豆品系mon87708
×
mon89788外源基因中的应用。
[0012]
第三方面,本发明提供了一种用于检测转基因大豆品系mon87708
×
mon89788外源基因的数字pcr试剂盒,所述试剂盒包括第一方面所述的引物组合物。
[0013]
第四方面,本发明提供了一种检测转基因大豆品系mon87708
×
mon89788外源基因的方法,包括如下步骤:
[0014]
(1)采集待测样品的基因组dna;
[0015]
(2)以步骤(1)的dna为模板,使用第一方面所述引物组合物或第三方面所述试剂盒进行pcr扩增;
[0016]
(3)根据步骤(2)的结果,判断待测样品中是否含有转基因大豆品系mon87708
×
mon89788外源基因或确定待测样品中转基因大豆品系mon87708
×
mon89788外源基因的拷贝数。
[0017]
本发明提供的检测转基因大豆品系mon87708
×
mon89788外源基因的方法,可为定性检测,即检测样品中是否存在转基因大豆品系mon87708
×
mon89788外源基因;也可为定量检测,即检测待测样品中转基因大豆品系mon87708
×
mon89788外源基因的绝对拷贝数,特异性好,灵敏度高。
[0018]
优选的是,在步骤(2)中,所述pcr扩增的反应体系中dna模板的浓度为0.012~6ng/μl。
[0019]
上述任一方案优选的是,在步骤(2)中,所述pcr扩增的反应体系中,
[0020]
所述seq id no.1所示的87708-f12和seq id no.2所示的87708-r12的浓度分别为1000nm;
[0021]
所述seq id no.4所示的89788-f1和seq id no.5所示的89788-r1的浓度分别为
800nm;
[0022]
所述seq id no.7所示的lectin-f和seq id no.8所示的lectin-r的浓度分别为800nm;
[0023]
所述seq id no.3所示的87708-p1浓度为400nm;所述seq id no.6所示的89788-p1浓度为200nm;所述seq id no.9所示的lectin-p浓度为200nm。
[0024]
上述任一方案优选的是,在步骤(2)中,所述pcr扩增的程序为:95℃预变性5min;95℃变性15s,58℃退火30s,共45个循环。
附图说明
[0025]
图1非转基因大豆三重数字pcr检测一维图-a。
[0026]
图2非转基因大豆三重数字pcr检测一维图-b。
[0027]
图3非转基因大豆三重数字pcr检测一维图-c。
[0028]
图4转基因大豆品系mon87708三重数字pcr检测一维图-a。
[0029]
图5转基因大豆品系mon87708三重数字pcr检测一维图-b。
[0030]
图6转基因大豆品系mon87708三重数字pcr检测一维图-c。
[0031]
图7转基因大豆品系mon89788三重数字pcr检测一维图-a。
[0032]
图8转基因大豆品系mon89788三重数字pcr检测一维图-b。
[0033]
图9转基因大豆品系mon89788三重数字pcr检测一维图-c。
[0034]
图10转基因大豆品系mon87708
×
mon89788三重数字pcr检测一维图-a。
[0035]
图11转基因大豆品系mon87708
×
mon89788三重数字pcr检测一维图-b。
[0036]
图12转基因大豆品系mon87708
×
mon89788三重数字pcr检测一维图-c。
[0037]
图13转基因大豆品系mon87708
×
mon89788三重数字pcr灵敏度检测一维图-a,其中blue通道为mon89788基因。
[0038]
图14转基因大豆品系mon87708
×
mon89788三重数字pcr灵敏度检测一维图-b,其中red通道为mon87708基因。
[0039]
图15转基因大豆品系mon87708
×
mon89788三重数字pcr灵敏度检测一维图-c,其中green通道为内源lectin基因。
[0040]
图16转基因大豆品系mon87708
×
mon89788三重数字pcr检测的线性范围拟合曲线-a。
[0041]
图17转基因大豆品系mon87708
×
mon89788三重数字pcr检测的线性范围拟合曲线-b。
[0042]
图18转基因大豆品系mon87708
×
mon89788三重数字pcr检测的线性范围拟合曲线-c。
[0043]
图19转基因大豆品系mon87708
×
mon89788三重数字pcr检测的线性范围拟合曲线-a。
[0044]
图20转基因大豆品系mon87708
×
mon89788三重数字pcr检测的线性范围拟合曲线-b。
[0045]
图21转基因大豆品系mon87708
×
mon89788三重数字pcr检测的线性范围拟合曲线-c。
具体实施方式
[0046]
为了使本发明要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0047]
除有定义外,以下实施例中所用的技术术语具有与本发明所属领域技术人员普遍理解的相同含义。以下实施例中所用的试剂,如无特殊说明,均为常规生化试剂;以下实施例中所用的原材料、仪器和设备等,均可通过市场购买获得或者可通过现有方法获得;所述试剂用量,如无特殊说明,均为常规实验操作中试剂用量;所述实验方法,如无特殊说明,均为常规方法。
[0048]
第一方面,本发明实施例提供了一种用于检测转基因大豆品系mon87708
×
mon89788外源基因的pcr引物组合物,包括特异检测mon87708事件的引物对、特异检测mon89788事件的引物对和特异检测内源对照基因lectin的引物对;其中,所述特异检测mon87708事件的引物对包括seq id no.1所示的87708-f12和seq id no.2所示的87708-r12;所述特异检测mon89788事件的引物对包括seq id no.4所示的89788-f1和seq id no.5所示的89788-r1;所述特异检测内源对照基因lectin的引物对包括seq id no.7所示的lectin-f和seq id no.8所示的lectin-r。
[0049]
本发明提供的引物组合物具有检测特异性好、灵敏度高等优点,对外源基因成分的定性和定量检测具有十分重要的应用价值。
[0050]
进一步地,所述引物组合物还包括特异检测mon87708事件的taqman水解探针、特异检测mon89788事件的taqman水解探针和特异检测内源对照基因lectin的taqman水解探针;其中,所述特异检测mon87708事件的taqman水解探针为seq id no.3所示的87708-p1;所述特异检测mon89788事件的taqman水解探针为seq id no.6所示的89788-p1;所述特异检测内源对照基因lectin的taqman水解探针为seq id no.9所示的lectin-p;所述特异检测mon87708事件的taqman水解探针的5
’
端使用报告荧光基团cy5进行修饰,3
’
端使用淬灭基团bhq2进行修饰;所述特异检测mon89788事件的taqman水解探针的5
’
端使用报告荧光基团fam进行修饰,3
’
端使用淬灭基团bhq1进行修饰;所述特异检测内源对照基因lectin的taqman水解探针的5
’
端使用报告荧光基团vic进行修饰,3
’
端使用淬灭基团bhq2进行修饰。
[0051]
第二方面,本发明实施例提供了一种根据第一方面所述的引物组合物在检测转基因大豆品系mon87708
×
mon89788外源基因中的应用。
[0052]
第三方面,本发明实施例提供了一种用于检测转基因大豆品系mon87708
×
mon89788外源基因的数字pcr试剂盒,所述试剂盒包括第一方面所述的引物组合物。
[0053]
第四方面,本发明实施例提供了一种检测转基因大豆品系mon87708
×
mon89788外源基因的方法,包括如下步骤:
[0054]
(1)采集待测样品的基因组dna;
[0055]
(2)以步骤(1)的dna为模板,使用第一方面所述引物组合物或第三方面所述试剂盒进行pcr扩增;
[0056]
(3)根据步骤(2)的结果,判断待测样品中是否含有转基因大豆品系mon87708
×
mon89788外源基因或确定待测样品中转基因大豆品系mon87708
×
mon89788外源基因的拷贝数。
[0057]
本发明提供的检测转基因大豆品系mon87708
×
mon89788外源基因的方法,可为定性检测,即检测样品中是否存在转基因大豆品系mon87708
×
mon89788外源基因;也可为定量检测,即检测待测样品中转基因大豆品系mon87708
×
mon89788外源基因的绝对拷贝数,特异性好,灵敏度高。
[0058]
进一步地,在步骤(2)中,所述pcr扩增的反应体系中dna模板的浓度为0.012~6ng/μl。
[0059]
进一步地,在步骤(2)中,所述pcr扩增的反应体系中,
[0060]
所述seq id no.1所示的87708-f12和seq id no.2所示的87708-r12的浓度分别为1000nm;
[0061]
所述seq id no.4所示的89788-f1和seq id no.5所示的89788-r1的浓度分别为800nm;
[0062]
所述seq id no.7所示的lectin-f和seq id no.8所示的lectin-r的浓度分别为800nm;
[0063]
所述seq id no.3所示的87708-p1浓度为400nm;
[0064]
所述seq id no.6所示的89788-p1浓度为200nm;
[0065]
所述seq id no.9所示的lectin-p浓度为200nm。
[0066]
进一步地,在步骤(2)中,所述pcr扩增的程序为:95℃预变性5min;95℃变性15s,58℃退火30s,共45个循环。
[0067]
进一步地,在步骤(2)中,所述pcr扩增采用全自动微滴芯片数字pcr系统(crystal digital pcr)。数字pcr最大的优势是无需参考标准/校准曲线即可对靶标进行绝对定量。“crystal液滴”数字pcr具有三色检测功能,可实现多重pcr反应。本实施例采用crystal digital pcr方法,建立了转基因大豆品系mon87708
×
mon89788三重数字pcr检测方法,对转基因大豆品系mon87708
×
mon89788同源种子基因组提取物(genomic dna extracted from homogenised seeds of gm stack mon87708
×
mon89788 soybean)进行特异性绝对定量检测,这是本领域首次采用三重数字pcr的方法对转基因大豆复合品系进行绝对定量检测,为复合品系转基因作物的绝对定量检测提供了参考方法。
[0068]
本发明先后进行过多次试验,现举一部分试验结果作为参考对发明进行进一步详细描述,下面结合具体实施例进行详细说明。
[0069]
下述实施例中转基因大豆品系mon87708
×
mon89788标准品收集自已经确认为转基因大豆品系mon87708
×
mon89788的样品,其他转基因植物标准品来自美国油脂化学协会(american oil chemists society,aocs)或欧洲标准物质(european reference materials,erm),具体来源见表1。
[0070]
表1样品及其来源
[0071]
[0072][0073]
下述实施例所用的基因组dna提取方法:采用tianamp feedstuff animal dna kit动物源性植物饲料基因组dna提取试剂盒(tiangen,中国),每个样品磨粉后取100mg提取基因组dna,dna样品于-20℃保存备用。
[0074]
下述实施例所用的perfecta multiplex qpcr toughmix(5
×
)预混液(quantabio,usa)购自艾普拜生物科技(苏州)有限公司。
[0075]
下述实施例使用实验仪器:全自动微滴芯片数字pcr系统(型号:naica,厂家:法国stilla technologies,包括sapphire芯片、naica geode热循环仪、naica prism3读取器和crystal miner software version 2.3.0(stilla technologies,france)软件)。
[0076]
实施例1三重数字pcr定量检测
[0077]
一、引物和探针的设计
[0078]
选择lectin基因用作大豆内源对照基因。根据转基因大豆品系mon87708
×
mon89788基因组序列的特殊性,分别选择单拷贝dna整合边界区域和插入序列元件区域设计引物和taqman水解探针,用于mon87708事件和mon98788事件的特异性检测和定量,引物和探针使用软件beacon designer 7(version 7.9)设计。taqman水解探针5
’
端分别选用fam、cy5和vic荧光染料标记,3
’
端分别选用淬灭基团bhq1和bhq2,各引物及探针的序列信息见表2,上述引物和探针由生工生物工程(上海)股份有限公司合成。
[0079]
表2三重数字pcr检测复合性状转基因大豆特异性引物和探针序列
[0080]
名称序列(5'to3')荧光标记seq id no87708-f12gatctccatgagcatcca/seq id no.187708-r12tttcccgccttcagttta/seq id no.2
87708-p1tatccacgagcatccacgagc5
’
cy5,3
’
bhq2seq id no.389788-f1aacgctcagactctagtg/seq id no.489788-r1cagctatcacatatggttgaa/seq id no.589788-p1ccaccttcactctcctcaagca5
’
fam,3
’
bhq1seq id no.6lectin-fccagcttcgccgcttccttc/seq id no.7lectin-rgaaggcaagcccatctgcaagcc/seq id no.8lectin-pcctcaccttctatgcccctgacac5
’
vic,3
’
bhq2seq id no.9
[0081]
cy5:菁类染料;fam:羧基荧光素;bhq1和bhq2:淬灭基团
[0082]
二、三重数字pcr定量检测方法
[0083]
以大豆转基因mon87708
×
mon89788复合品系、转基因mon87708纯合品系、转基因mon89788纯合品系以及非转基因大豆样本的dna为模板,使用表2中的不同引物对和探针,分别按照如下反应体系与条件进行三重数字pcr定量检测:
[0084]
pcr反应体系为25μl,包含:5μl perfecta multiplex qpcr toughmix(5
×
)预混液(quantabio,usa);内源对照基因与外源基因的引物(共6条引物)各1μl,seq id no.1所示的87708-f12和seq id no.2所示的87708-r12的终浓度分别为1000nm,seq id no.4所示的89788-f1和seq id no.5所示的89788-r1的终浓度分别为800nm,所述seq id no.7所示的lectin-f和seq id no.8所示的lectin-r的终浓度分别为800nm;探针(87708-p1、89788-p1和lectin-p)各1μl,seq id no.3所示的87708-p1终浓度为400nm,seq id no.6所示的89788-p1终浓度为200nm,seq id no.9所示的lectin-p终浓度为200nm;2μldna模板,用超纯水将反应体系补足25μl。
[0085]
定量检测方法包括四步:制备pcr反应体系、液滴生成、pcr扩增和信号读取并分析结果。
[0086]
将25μlpcr反应体系加载到sapphire芯片中(stilla technologies,france),在naica geode热循环仪中以分隔液滴并进行pcr反应。pcr扩增程序:95℃预变性5min;95℃变性15s,58℃退火30s,共45个循环。
[0087]
扩增结束后,使用naica prism3读取器对芯片进行信息采集。使用crystal miner software version 2.3.0(stilla technologies,france)软件,利用泊松分布原理进行统计与分析。
[0088]
结果如图1-12所示,四个样本中内源基因lectin均被检出,mon87708
×
mon89788复合品系中检测出87708基因和89788基因,mon87708纯合品系只检测出87708基因,mon89788纯合品系只检测出89788基因,非转基因阴性对照样本中只检测到内源基因(fam为89788,cy5为87708,vic为lectin),并且在复合品系、转基因纯合品系中内源基因lectin与外源基因拷贝数之比均约为1:1,拷贝数浓度见表3。对mon87708
×
mon89788复合品系进行5次重复性验证,内源基因与外源基因之比分别为1.07和0.94(cv值分别为1.82%和2.27%),表明该转基因mon87708
×
mon89788复合品系为纯合子,见表4。拷贝数浓度指每μl pcr扩增的反应体系中该基因的绝对拷贝数。
[0089]
表3三重数字pcr检测样本拷贝数浓度结果
[0090][0091]
表4 mon87708
×
mon89788复合品系5次重复性验证结果
[0092][0093]
实施例2三重数字pcr特异性检测
[0094]
本实施例使用实施例1表2中的不同引物对和探针,按照实施例1的pcr反应体系与三重数字pcr定量检测方法(mon87708/mon89788/lectin)分析测试转基因大豆mon87708、mon89788、mon87708
×
mon89788杂交品系、非转基因大豆、其它转基因大豆品系、转基因玉米和油菜、非转基因玉米等dna提取物。
[0095]
结果如表5所示,大豆样品中lectin基因均被检测到。转基因大豆mon87708
×
mon89788为双阳性,mon87708,mon89788均为单阳性。其余对照样本均为阴性。本研究建立的三重数字pcr检测体系对转基因大豆品系mon87708
×
mon89788具有高特异性。三重数字pcr检测31个样品的拷贝数浓度结果如表6所示。拷贝数浓度指每μlpcr扩增的反应体系中该基因的绝对拷贝数。
[0096]
表5三重数字pcr检测31个样品的结果
[0097]
[0098][0099]
表6三重数字pcr检测31个样品的拷贝数浓度结果
[0100]
[0101][0102]
实施例3三重数字pcr灵敏度检测
[0103]
对于转基因成分(即外源基因)检测来说,低百分含量下的转基因成分的检测是转基因成分检测的重点和难点。本实施例对三重数字pcr检测的下限进行了研究。
[0104]
将转基因大豆品系mon87708
×
mon89788基因组dna(300ng/μl)分别用双蒸水依次以10倍(30ng/μl)、10倍(3ng/μl)、5倍(0.6ng/μl)、5倍(0.12ng/μl)、2倍(0.06ng/μl)、2倍(0.03ng/μl)、2倍(0.015ng/μl)的稀释倍数进行浓度稀释。
[0105]
pcr反应体系为25μl包含:5μl perfecta multiplex qpcr toughmix(5
×
)预混液(quantabio,usa);内源对照基因与外源基因的引物(共6条引物)各1μl,seq id no.1所示的87708-f12和seq id no.2所示的87708-r12的终浓度分别为1000nm,seq id no.4所示的89788-f1和seq id no.5所示的89788-r1的终浓度分别为800nm,所述seq id no.7所示的lectin-f和seq id no.8所示的lectin-r的终浓度分别为800nm;探针(87708-p1、89788-p1和lectin-p)各1μl,seq id no.3所示的87708-p1终浓度为400nm,seq id no.6所示的
89788-p1终浓度为200nm,seq id no.9所示的lectin-p终浓度为200nm;5μl dna模板,用超纯水将反应体系补足25μl。
[0106]
本实施例使用实施例1表2中的不同引物对和探针,按照实施例1中三重数字pcr定量检测方法以5μl上述各稀释度的dna作为模板进行dpcr反应,每个浓度设置3个重复,进行三重数字pcr灵敏度检测。
[0107]
计算各稀释浓度dna的3次检测基因拷贝数平均值和rsd值,实验结果见表7-表9,由表可知,数字pcr检测mon89788的绝对定量检测低限为每25μl反应体系5.42个拷贝,rsd为18.97%,即dna模板质量浓度0.06ng/μl,反应体系中dna模板浓度(即终浓度)0.012ng/μl;检测lectin的绝对定量检测低限为每25μl反应体系4.83个拷贝,rsd为8.79%,即dna模板质量浓度0.06ng/μl,反应体系中dna模板浓度(即终浓度)0.012ng/μl;检测mon87708的绝对定量检测低限为每25μl反应体系6.08个拷贝,rsd为12.70%,即dna模板质量浓度0.06ng/μl,反应体系中dna模板浓度(即终浓度)0.012ng/μl。在绝对定量检测低限以上时,rsd(相对标准偏差)值小于25%,结果稳定性和重复性较好。
[0108]
从以上结果可以看出,本实施例检测方法在dna模板质量浓度为0.06ng/μl的样品中可以实现稳定扩增,在dna模板质量浓度为0.03ng/μl的样品中可以出现阳性结果,但是所有平行不全为阳性,因此,本实施例的灵敏度或检测限为dna模板质量浓度0.06ng/μl,反应体系中dna模板浓度0.012ng/μl。
[0109]
表7.三重数字pcr检测转基因大豆品系mon87708
×
mon89788中mon89788的绝对定量(绝对拷贝数)结果
[0110][0111]
表8.三重数字pcr检测转基因大豆品系mon87708
×
mon89788中lectin的的绝对定量(绝对拷贝数)结果
[0112][0113]
表9.三重数字pcr检测转基因大豆品系mon87708
×
mon89788中mon87708的绝对定量(绝对拷贝数)结果
[0114][0115]
三重数字pcr检测灵敏度一维图如图13-15,结果显示,本申请三重数字pcr检测方法的阳性点与阴性点的区分非常明显,实验结果不受荧光阈值限变化的影响。
[0116]
以dna模板浓度倍数负对数值为横坐标,以每25μl反应体系基因拷贝数rsd值不超过25%的有效定量数据的平行检测的平均值的对数值为纵坐标绘制线性范围拟合曲线,如图16-18所示,mon89788、mon87708和lectin的拷贝数的对数值均与dna模板浓度倍数的负对数值呈现高度的线性相关,相关系数达到0.99以上。说明本实验建立的数字pcr法具有良好的定量线性相关性,适用于mon89788、mon87708和lectin的拷贝数浓度定量检测。
[0117]
另外,使用全部测得的平行检测拷贝数的平均值的对数值为纵坐标绘制线性范围拟合曲线,如图19-21所示,拷贝数的对数值均与dna模板浓度倍数的负对数值呈现线性相关,相关系数达到0.98以上。
[0118]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



