用于栝楼苗期雌雄株基因表达研究的内参基因及其应用的制作方法
 2021-02-02 03:02:47|
2021-02-02 03:02:47| 331|
331| 起点商标网
起点商标网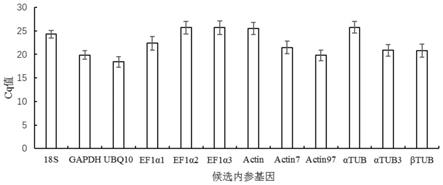
[0001]
本发明属于分子生物学技术领域,具体涉及用于栝楼苗期雌雄株基因表达研究的内参基因及其应用。
背景技术:
[0002]
在植物研究中,为了解基因功能,基因表达模式的分析是重要研究途径之一。实时荧光定量pcr是基因表达模式研究中最常用的核酸定量技术,它具有更高的灵敏度,更好的特异性和更宽的检测范围。但是不同样品的rna浓度、rna质量、cdna合成效率等均可能存在一些差异,这会影响实时荧光定量pcr结果的准确性。在荧光定量pcr实验中,内参基因的使用能够有效地校正这些差异,从而得到目标基因特异性表达的真正差异。目前,已在大量物种中筛选出适宜的内参基因,该类基因一般为拷贝数高,表达较为稳定的基因,通常是构成细胞器骨架的基本组分蛋白,还有参与生物体生化代谢过程的蛋白。但近年来大量的研究结果表明,并没有表达绝对稳定的基因,任何一种内参基因的所谓恒定表达都只是在一定类型的细胞或试验因素作用下的恒定。因此,在一个新的研究材料或新的试验条件下,有必要首先筛选出稳定的内参基因。
[0003]
栝楼(trichosanthes kirilowii maxim.)是葫芦科栝楼属多年生宿根攀援草本植物。栝楼属是葫芦科中一个较大的属,全世界有80余种。栝楼除了作为中药材外,其种子被开发为休闲保健食物。食用栝楼雌雄异株,雌株以收栝楼籽为主,雄株以收获根为主。因此在生产中种植目的不同,栝楼雌雄株种植比例存在差异。为提高栝楼种植面积和效益,用种子繁殖是一种经济实用的方法,但研究认为种子繁殖时雌株只占10-30%,雌雄株比例严重失调且无法控制。前人通过形态学、生理学及分子标记等方法均未能找到鉴定栝楼苗期雌雄株的稳定指标。因此笔者拟通过转录组测序挖掘栝楼苗期雌雄株差异基因,差异基因的表达水平需要通过荧光定量pcr验证,这就需要稳定的内参基因。目前尚无用于栝楼苗期雌雄株基因表达研究的内参基因的报道。
技术实现要素:
[0004]
针对现有技术中存在的问题,本发明的目的在于提供在栝楼苗期雌雄株间最稳定表达的内参基因,为挖掘栝楼苗期雌雄株差异标记基因奠定基础。
[0005]
为了达到上述目的,本发明采用如下技术方案:
[0006]
用于栝楼苗期雌雄株基因表达研究的内参基因,为actin基因和/或gapdh基因;所述actin基因的核酸序列如seq id no.1所示;gapdh基因的核酸序列如seq id no.2所示。
[0007]
上述用于栝楼苗期雌雄株基因表达研究的内参基因的荧光定量pcr特异性引物,所述actin基因的引物序列如下:
[0008]
正向引物:tcaatcctaaagccaacagag;
[0009]
反向引物:accatcaccagagtcaagca。
[0010]
上述用于栝楼苗期雌雄株基因表达研究的内参基因的荧光定量pcr特异性引物,
所述gapdh基因的引物序列如下:
[0011]
正向引物:tgttcactcaatgactgccacc;
[0012]
反向引物:gcactttgccgacagcctta。
[0013]
上述用于栝楼苗期雌雄株基因表达研究的内参基因在栝楼荧光定量pcr中的应用。
[0014]
上述的actin基因的荧光定量pcr引物序列在栝楼荧光定量pcr中的应用。
[0015]
上述的gapdh基因的荧光定量pcr引物序列在栝楼荧光定量pcr中的应用。
[0016]
上述的内参基因在制备栝楼荧光定量pcr试剂盒中的应用。
[0017]
上述的特异性引物在制备栝楼荧光定量pcr试剂盒中的应用。
[0018]
一种分析栝楼苗期雌雄株基因表达差异的荧光定量pcr试剂盒,包含上述的特异性引物中的至少一种。
[0019]
在上述方案的基础上,所述荧光定量pcr试剂盒中还包含荧光定量pcr技术常用试剂。
[0020]
actin基因和/或gapdh基因作为栝楼苗期雌雄株基因表达研究的荧光定量pcr内参基因的应用。
[0021]
本发明用于栝楼苗期雌雄株基因表达研究的内参基因的筛选过程为:
[0022]
(1)利用3个品种栝楼苗期雌雄株叶片的转录组测序数据,挑选12个栝楼候选内参基因,并以挑选的12个候选内参基因序列为模板设计了12对实时荧光定量pcr的内参基因引物。12个候选内参基因的核苷酸序列分别为seq id no.1~seq id no.12所示,设计的12对实时荧光定量pcr引物序列分别为seq id no.13~seq id no.36所示;
[0023]
(2)分别选取3个品种栝楼苗期雄性植株和雌性植株的叶片为实验材料,进行实时荧光定量pcr实验。荧光定量pcr扩增体系如下:2
×
tb green premix ex taq 10μl,10μm正向引物和10μm方向引物各0.4μl,模板cdna 2μl,rox参考染料ii 0.4μl和ddh2o 6.8μl。荧光定量pcr扩增程序:95℃预变性10min;95℃变性10s,60℃退火30s,72℃延伸30s,反应40个循环;
[0024]
(3)将实时荧光定量pcr得到的数据导入genorm,normfinder和bestkeeper软件进行分析,并进行综合排序,筛选出最优内参基因和内参基因组合;
[0025]
具体综合排序的方法如下:genorm软件和normfinder软件对候选内参基因的稳定性评价结果中,12个候选内参基因的稳定性指数m值或sv值由小到大进行排序,m值或sv值最小的候选内参基因记为12分,第二最小m值或sv值的候选内参基因记为11分,第三最小m值或sv值的候选内参基因记为10分,依次类推,最大m值或sv值的候选内参基因记为1分。
[0026]
bestkeeper软件对候选内参基因的稳定性评价结果中,12个候选内参基因的标准差(sd值)由小到大进行排序,sd值最小的候选内参基因记为12分,第二小sd值的候选内参基因记为11分,依次类推,最大sd值的候选内参基因记为1分。
[0027]
将三个软件得到的每个候选基因的得分相加,根据各候选内参基因的分值加和由大到小进行排序。以综合分值最高的2个候选内参基因为最优内参基因。
[0028]
本发明技术方案的优点:
[0029]
本发明从12个候选内参基因中,筛选出在栝楼苗期雌雄株间最稳定表达的内参基因actin和gapdh;弥补了用于栝楼基因表达研究的内参基因的空白;采用本发明的内参基
因可以提高研究苗期雌雄株基因表达的准确性和可靠性;为挖掘栝楼苗期雌雄株差异标记基因奠定基础。
附图说明
[0030]
图1为12个候选内参基因的所有检测样本ct值的几何平均值(cq值);
[0031]
图2为genorm软件分析的最优内参基因排序图,其中左边为最不稳定的内参基因,右边为最稳定的内参基因;
[0032]
图3为genorm软件分析的最优内参基因数目结果图;
[0033]
图4为normfinder软件分析的最优内参基因排序图,其中左边为最稳定的内参基因,右边为最不稳定的内参基因;
[0034]
图5为bestkeeper软件分析的最优内参基因排序图,其中左边为最稳定的内参基因,右边为最不稳定的内参基因。
具体实施方式
[0035]
在本发明中所使用的术语,除非有另外说明,一般具有本领域普通技术人员通常理解的含义。
[0036]
下面结合具体实施例,并参照数据进一步详细的描述本发明。以下实施例只是为了举例说明本发明,而非以任何方式限制本发明的范围。
[0037]
在以下的实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。所用到的引物,均在首次出现时标明,其后所用相同引物,均以首次标明的内容相同。
[0038]
实施例1候选内参基因的荧光定量pcr引物设计
[0039]
本发明从已有的三个品种栝楼(皖蒌9号,皖蒌13号,皖蒌17号)苗期雌雄株叶片的转录组数据中挑选12个候选内参基因,所述的内参基因为18s核糖体rna(18srrna),甘油醛-3-磷酸脱氢酶(gapdh),泛素蛋白(ubq10),延伸蛋白(ef1α1,ef1α2,ef1α3),肌动蛋白(actin,actin 7,actin 97),微管蛋白(α-tubulin,α-tubulin3,β-tubulin),各基因序列按照actin、gapdh、18srrna(图中标为18s)、ubq10、ef1α1、ef1α2、ef1α3、actin7、actin97、αtub、αtub3、βtub顺序依次如seq id no.1~seq id no.12所示。以上述12个候选内参基因序列为模板,用primer 5设计各内参基因的荧光定量pcr特异引物,依次如seq id no.13~seq id no.36所示。
[0040]
分别以三个不同品种栝楼(皖蒌9号,皖蒌13号,皖蒌17号)苗期雌雄株的叶片为实验材料,提取rna,反转录成cdna为模板,以上述设计的荧光定量pcr特异引物进行实时荧光定量pcr实验。用实时荧光定量pcr生成的溶解曲线来判断引物的特异性,并做标准曲线来判断12个候选内参基因引物的扩增效率。标准曲线的制作以rna反转录得到的cdna经梯度稀释后为模板(包括101、102、103、104、105五个模板梯度),通过荧光定量pcr ct值计算得到。
[0041]
表1候选内参基因荧光定量pcr引物的扩增效率
[0042][0043]
如表1所示,各候选内参基因pcr产物的长度均在80-150bp范围内,且退火温度在58~62℃范围内。各候选内参基因的溶解曲线只有明显的单一峰,且pcr产物电泳检测均只有单一条带,同时各候选内参基因引物扩增效率均在90%-110%(表1),说明各候选内参基因荧光定量pcr引物的特异性良好。以上数据证明了本发明设计的内参基因荧光定量pcr引物符合要求,可继续后续荧光定量pcr实验。
[0044]
实施例2实时荧光定量pcr实验
[0045]
实验材料为三个栝楼品种(皖蒌9号,皖蒌13号,皖蒌17号)苗期雌雄株的叶片。所有样品均在取样后立即置于液氮中速冻,随后保存于-80℃冰箱。
[0046]
使用takara的minibest plant rna extraction kit试剂盒提取各样本的rna,反转录采用的是takara的primerscript反转录酶试剂盒。以反转录得到的cdna 10倍稀释液为模板,用各候选内参基因的荧光定量pcr特异引物进行实时荧光定量pcr实验。
[0047]
利用各候选内参基因的荧光定量pcr引物扩增三个品种栝楼(皖蒌9号,皖蒌13号,皖蒌17号的雌雄株)苗期雌雄株叶片样品的cdna:荧光定量pcr的仪器为applied biosystems quantstudio 5实时荧光定量pcr仪,荧光定量pcr采用的是takara的tb green试剂盒,反应体系如下:2
×
tb green premix ex taq 10μl;cdna 2μl;10μm上游引物0.4μl;10μm下游引物0.4μl;rox参考染料ii 0.4μl和ddh2o 6.8μl。反应程序:95℃预变性10min,95℃解链15s,60℃退火30s,72℃延伸30s,反应40个循环:60-95℃温度(30s逐步升至95℃),每0.5℃收集一次荧光信号,实时荧光定量pcr得到所有内参基因在不同样品中的ct值。
[0048]
图1为12个候选内参基因的所有检测样本ct值的几何平均值(cq值),可以看出12个候选内参基因的表达量存在差异,ubq10基因表达丰度最高(cq平均值最小),ef1α3基因表达丰度最低(cq平均值最大)。不同样品中12个候选内参基因表达量的变化幅度也存在差异,ef1α1基因的cq值在20.20到24.40之间,变化幅度最大;而18srrna基因的cq值在23.00到25.29之间,变化幅度最小。
[0049]
实施例3全部样本下内参基因的软件评价
[0050]
genorm软件
[0051]
本发明中,所述的genorm软件为genorm_3.4,其步骤和标准如下:
[0052]
首先计算δct值:找出每个候选内参基因在所有样品中的最小ct值,再用各个样品的ct值减去最小ct值,从而得到δct值。再利用excel中的函数计算出相应样品相应基因的2-δct
值,该值就是每个候选内参基因的相对定量数据,也是genorm软件分析时要用到的数据。本发明中,genorm首先通过计算表达稳定度平均值(m)实现12个候选内参基因表达稳定度排序(图2),结果显示全部样本下,最稳定两个内参基因是ef1α1和ef1α2,最不稳定的是actin7,各候选内参基因的稳定性排序如下:
[0053]
ef1α1>ef1α2>ef1α3>actin>gapdh>actin 97>αtub>18srrna>βtub>αtub3>ubq10>actin7;然后用genorm计算出配对变异系数v(图3),得到的结果都低于0.15。因此,在栝楼基因表达研究中,2个内参基因完全满足实验需求。
[0054]
normfinder软件
[0055]
本发明中,所述normfinder软件步骤和标准如下:
[0056]
normfinder软件所要用到的数据也是2-δct
值。normfinder分析的内参基因稳定性结果显示,全部样本下,最稳定的内参基因是actin,最不稳定的是actin7,各候选内参基因的稳定性排序如下(图4):
[0057]
actin>ef1α2>actin97>gapdh>18srrna>αtub>ef1α1>ef1α3>αtub3>ubq10>βtub>actin7。
[0058]
bestkeeper软件
[0059]
本发明中,所述bestkeeper软件的步骤和标准如下:
[0060]
直接将各样品各基因的cq值输入excel表格中,导入bestkeeper软件中进行内参稳定性分析。根据bestkeeper结果,各候选内参基因的稳定性排序如下(图5):18srrna>gapdh>αtub>ubq10>actin>actin7>actin97>ef1α2>ef1α1>ef1α3>βtub>αtub3。
[0061]
三个软件结果的综合分析
[0062]
从三个软件的结果可以看出,每个软件得到的最稳定内参基因有所差异。因此,需要综合3个软件的结果。具体综合排序的方法如下:genorm软件和normfinder软件对候选内参基因的稳定性评价结果中,12个候选内参基因的稳定性指数m值或sv值由小到大进行排序,m值或sv值最小的候选内参基因记为12分,第二最小m值或sv值的候选内参基因记为11分,依次类推,最大m值或sv值的候选内参基因记为1分。
[0063]
bestkeeper软件对候选内参基因的稳定性评价结果中,12个候选内参基因的标准差(sd值)由小到大进行排序,sd值最小的候选内参基因记为12分,第二小sd值的候选内参基因记为11分,依次类推,最大sd值的候选内参基因记为1分。
[0064]
将三个软件得到的每个候选内参基因的得分相加,根据各候选内参基因的分值加和(表2)确定最优内参基因。可以看出,12个候选内参基因中,actin和gapdh这两个内参基因在所有检测样本中最为稳定。因此,actin和gapdh这2个基因可作为栝楼苗期雌雄株基因表达研究的内参基因。
[0065]
表2为genorm、normfinder、bestkeeper软件分析的候选内参基因稳定性排序
[0066][0067]
以上所述,仅是本发明的较佳实施例而已,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



