一种海洋源I型胶原亚基的规模化制备方法与流程
 2021-02-02 03:02:21|
2021-02-02 03:02:21| 281|
281| 起点商标网
起点商标网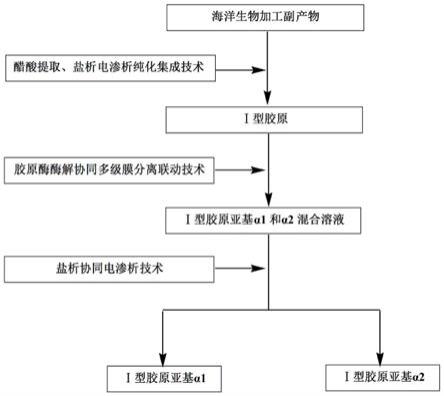
一种海洋源i型胶原亚基的规模化制备方法
技术领域
[0001]
本发明属于生物提取技术领域,具体涉及一种海洋源i型胶原亚基的规模化制备方法。
背景技术:
[0002]
胶原是脊椎动物中含量最丰富的蛋白质,是动物皮肤和骨结缔组织中的最主要结构蛋白质,约占总蛋白质的30%。目前确定的胶原的类型有29种,包括胶原i-xxix型,每种类型的胶原都具有独特的氨基酸序列、结构和功能。在所有胶原类型中,i型胶原具有良好的生物相容性、生物降解性和弱抗原性,能为食品、药品、生物功能材料和组织工程等产业提供良好的原料来源。
[0003]
近年来由于由于禽流感、疯牛病、口蹄疫等传染性疾病的发生,导致陆源生物来源i型胶原的全球需求量逐年下降。以此同时,海洋生物来源i型胶原特别是鱼类副产物(主要是鱼鳞、鱼皮、鱼鳔)i型胶原的需求量迅速上升,已成为全球胶原产品最主要的原料来源之一。
[0004]
i型胶原分子具有由三条胶原α亚基肽链通过右手螺旋形成的稳定的三螺旋四级结构,该结构导致胶原无法被人体吸收,无法开发成药品、保健品、食品。食品科学家利用酶法水解i型胶原,获得i型胶原蛋白肽,可以应用到食品中,但这类型产品含有大量的多肽,现有技术无法确定所有肽的氨基酸序列,产品质量不稳定,无法成为高附加值的胶原药品、保健品。因此,开发氨基酸序列明确的海洋源i型胶原亚基成为研究的热点。
[0005]
目前i型胶原亚基制备方法有:(1)色谱法:如:weng等以金鲳鱼鱼皮为原料制备鱼皮胶原,该技术方案将所制备的鱼皮胶原溶解在硼酸盐缓冲液中,45℃加热30min后,利用cm-52羧甲基纤维素色谱柱分离纯化,得到胶原亚基α1和α2;(2)电泳法:如:deyl等提出将胶原溶解在ph为9.2的硼酸缓冲液中降解15min后,利用毛细管电泳分离纯化,得到胶原亚基。然而这些制备方法只能得到毫克级、微克级的胶原亚基样品,不能实现工业化生产。
技术实现要素:
[0006]
本发明的目的在于克服现有技术缺陷,提供一种海洋源i型胶原亚基的规模化制备方法。
[0007]
本发明的技术方案如下:
[0008]
一种海洋源i型胶原亚基的规模化制备方法,包括如下步骤:
[0009]
(1)将预处理后的海洋生物加工副产物用醋酸溶液提取,再经离心去除固体杂质后,将所获得的清液经氯化钠盐析和电渗析纯化,得到i型胶原溶液;
[0010]
(2)在上述i型胶原溶液中加入胶原酶进行常温酶解,再经离心除杂;将所获得的清液用截留相对分子质量200kd的纳滤膜去除未酶解的i型胶原,得到透过液;将该透过液用截留相对分子质量50kd的纳滤膜去除无机盐,获得i型胶原亚基α1和α2混合溶液;
[0011]
(3)将上述i型胶原亚基α1和α2混合溶液经氯化钠盐析后离心获得清液和沉淀;将
该清液经电渗析脱盐后进行冷冻干燥,获得如seq id no.01所示的i型胶原亚基α1;将该沉淀用醋酸溶液溶解后,再依次经电渗析脱盐和冷冻干燥,获得如seq id no.02所示的i型胶原亚基α2。
[0012]
在本发明的一个优选实施方案中,所述海洋生物加工副产物包括鱼鳞、鱼皮和鱼鳔。
[0013]
进一步优选的,所述预处理为:将所述海洋生物加工副产物投入清洗罐中,加入质量体积浓度为2-4%碳酸氢钠溶液,室温搅拌4-6h,然后进行水洗,碳酸氢钠溶液与海洋生物加工副产物的比例为8-12l∶1kg。
[0014]
在本发明的一个优选实施方案中,所述步骤(1)中的醋酸溶液的浓度为0.4-0.6m。
[0015]
在本发明的一个优选实施方案中,所述步骤(1)中的盐析包括在所述清液中加入质量体积百分比为2-4%的氯化钠。
[0016]
在本发明的一个优选实施方案中,所述步骤(1)中的电渗析的极水为质量体积百分比为4-6%的氯化钠溶液。
[0017]
在本发明的一个优选实施方案中,所述步骤(1)中的电渗析的流量≤1m3/h。
[0018]
在本发明的一个优选实施方案中,所述步骤(3)中的电渗析的极水为质量体积百分比为1.5-2.5%的氯化钠溶液。
[0019]
在本发明的一个优选实施方案中,所述步骤(3)中的电渗析的流量≤1m3/h。
[0020]
在本发明的一个优选实施方案中,所述步骤(1)和(3)中的电渗析所用的电渗析膜为聚乙烯异相离子交换膜,且步骤(1)中的电渗析的电流为14-16a,步骤(3)中的电渗析的电流为10-12a。
[0021]
本发明的有益效果是:
[0022]
1、针对目前胶原亚基的制备工艺,只能制备毫克级、微克级样品,无法实现规模化生产的技术瓶颈,本发明构建胶原酶酶解协同多级膜分离联动技术、盐析协同电渗析技术集成的技术体系,规模化制备i型胶原亚基α1和α2。
[0023]
2、本发明以低值海洋生物加工副产物为原料,生产成本低,工艺易于控制,适合规模化生产。
[0024]
3、本发明生产的i型胶原亚基α1和α2,氨基酸序列明确,纯度大于90%,可应用在药品、保健食品领域。
附图说明
[0025]
图1为本发明的工艺流程图。
[0026]
图2为本发明实施例1的标样的高效凝胶色谱图。
[0027]
图3为本发明实施例1的标样高效凝胶色谱的标准曲线。
[0028]
图4为本发明实施例1的i型胶原亚基α1凝胶色谱图。
[0029]
图5为本发明实施例1的i型胶原亚基α2凝胶色谱图。
[0030]
图6为本发明实施例1的i型胶原亚基α1的肽指纹图谱。
[0031]
图7为本发明实施例1的i型胶原亚基α2的肽指纹图谱。
具体实施方式
[0032]
以下通过具体实施方式对本发明的技术方案进行进一步的说明和描述。
[0033]
实施例1
[0034]
如图1所示,一种海洋源i型胶原亚基的规模化制备方法,,包括以下步骤:
[0035]
(1)将100kg罗非鱼鱼鳞/鱼皮/鱼鳔投入清洗罐中,加入1000l的碳酸氢钠溶液,溶液的质量体积浓度为3%,室温搅拌5h,水洗净后,加入反应釜中,加入0.5m的醋酸溶液搅拌提取,提取液利用10000rpm的离心机除杂后,所得清液即为i型胶原粗提物溶液。在i型胶原粗提物溶液加入3%(w/v)氯化钠盐析,转速为10000rpm离心机离心后,得到沉淀物。加入0.5m的醋酸溶液溶解沉淀物后,利用电渗析技术去除酸和无机盐,电渗析膜为聚乙烯异相离子交换膜,电流为15a,极水箱为5%(w/v)的氯化钠溶液,电渗析流量≤1m3/h,,得到i型胶原溶液。
[0036]
(2)将i型胶原溶液加入反应釜中,加入100g胶原酶,常温下酶解4h。酶解液10000rpm离心机除杂,清液利用截留相对分子质量为200kd的纳滤膜去除未酶解的i型胶原,得到透过液。透过液利用截留相对分子质量为50kd的纳滤膜,去除溶液中的无机盐,压力为2mpa,温度为25℃,得到i型胶原亚基α1和α2混合溶液。
[0037]
(3)往i型胶原亚基α1和α2混合溶液中加入5%(w/v)氯化钠盐析。10000rpm离心机离心后,清液利用电渗析技术脱盐,电渗析膜为聚乙烯异相离子交换膜,电流为11a,极水箱为2%(w/v)的氯化钠溶液,电渗析流量≤1m3/h,冷冻干燥电渗析后的物料溶液,得到i型胶原亚基α1冻干样。此外,利用0.1m醋酸溶液溶解离心机离心后的沉淀物,利用电渗析技术脱盐,电渗析膜为聚乙烯异相离子交换膜,电流为13a,极水箱为3%的氯化钠溶液,电渗析流量≤1m3/h,冷冻干燥电渗析后的物料溶液,得到i型胶原亚基α2冻干样。
[0038]
利用高效凝胶色谱法检测本发明得到的i型胶原亚基α1和i型胶原亚基α2的纯度和分子量。检测条件为:superdextm peptide 10/300gl色谱柱,流动相:50mmol/l磷酸盐、0.15mpl/l氯化钠、ph7.0缓冲液;流速为0.5ml/min,检测波长为210nm,进样量:50ul。标样mark分别为:
①
甲状腺球蛋白,分子量669000da,保留时间8.04;
②
铁蛋白,分子量440000da,保留时间14.30;
③
牛血清蛋白,分子量67000da,保留时间16.02;
④
β-乳球蛋白,分子量35000da,保留时间16.02;
⑤
细胞色素,分子量13600da,保留时间18.06;
⑥
抑肽酶,分子量6512da,保留时间19.37(图2)。得到标样的标准曲线为lgmw=-0.1726x+7.2402(r2=0.9951)(图3)。由图4、图5可见,本实施例制备的胶原亚基α1和α2。α1纯度为93.2%,α2纯度为90.3%。经标准曲线(图2)对照计算,胶原亚基α1的分子量为131kd,胶原亚基α2的分子量为125kd。
[0039]
利用高效液相色谱-质谱联用技术鉴定本发明得到的i型胶原亚基α1和i型胶原亚基α2。胶原亚基α1的肽指纹图谱鉴定(图6)结果表明,胶原亚基α1的mascot分数为1137,覆盖率为32%。胶原亚基α1为collagen,type i,alpha 1 os=oreochromis niloticus gn=col1a1 pe=2 sv=1,蛋白编码为tr|g9m6i5|g9m6i5_oreni,分子量为137283da,等电点(pi)值为5.64。胶原胶原亚基α1的氨基酸序列如seq id no.01所示。胶原亚基α2的肽指纹图谱鉴定(图7)结果表明,胶原亚基α2的mascot分数为1344,覆盖率为36%。胶原亚基α2为collagen type i alpha 2 os=oreochromis niloticus gn=col1a2pe=2 sv=1,蛋白编码为tr|g9m616|g9m6i6_oreni,分子量为126477da,等电点(pi)值为9.18。胶原胶原亚基
α2的氨基酸序列如seq id no.02所示。
[0040]
以上所述,仅为本发明的较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



