一种重组转氨酶和所述重组转氨酶的突变体及其应用的制作方法
 2021-02-02 01:02:51|
2021-02-02 01:02:51| 259|
259| 起点商标网
起点商标网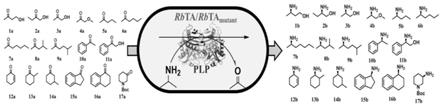
[0001]
本发明涉及酶工程和基因工程领域,具体涉及一种重组转氨酶和所述重组转氨酶的突变体及其应用。
背景技术:
[0002]
手性氨基醇是一类由α-氨基酸经过手性源还原得到的具有光学活性的氨基醇,其作为一类重要的生物活性分子,被广泛地应用于制药、精细化工、材料和不对称催化有机合成等领域。以手性氨基醇为砌块可以合成多种手性药物,包括抗癌药、抗艾滋病药及心血管药物,在手性医药合成领域具有非常重要的作用(erlanson,d.a.et al.,《bioorg.med.chem.lett.》,2011(21),3078-3083.ekegren,j.k.et al.,《j.med.chem.》,2006(49),1828-1832)。鉴于手性氨基醇在药物分子合成中的巨大价值,其合成技术的研发已成为新药开发领域的研究热点。
[0003]
在手性氨基醇的合成步骤中,手性氨基的引入最为关键。目前该类化合物的合成方法包括化学合成法和生物催化法。其中传统的化学合成法以手性试剂的拆分和手性原料的从头合成为主,最高收率为60%~70%,但化学合成法的合成步骤繁琐,条件苛刻,不够绿色、安全,对环境污染较为严重(us20110275855a1;achmatowicz,m.et al.,《tetrahedron》,2005,61(38):9031-9041)。生物催化法是利用细胞或酶蛋白为催化剂,以廉价的化合物为出发底物合成目标产物,具有步骤简单、操作安全、选择性高、绿色环保等优点。如借助胺脱氢酶(amdhs)在辅酶参与下可实现手性氨基醇的不对称合成,但是天然来源的胺脱氢酶源较少,且催化活性普遍偏低,还无法满足工业化应用指标(wang,h.et al.,《catal.sci.technol.》,2020)。
[0004]
转氨酶(transaminase,简称ta),又称氨基转移酶,是一类磷酸吡哆醛(pyridoxal-5
’-
phosphate,plp)依赖性的转移酶,在氨基供体存在下可以特异性将氨基转移到底物酮上,得到相应的手性胺(mathew,s.et al.,《acs catal.》,2012,2(6),993-1001)。转氨反应过程中无需添加辅酶和金属离子,反应简单易操作,作为一种绿色催化剂,转氨酶来源广泛,广泛存在于动物、植物和微生物中。早在2010年merck和codexis公司利用酶工程改造技术,创制了能够高效转化大位阻底物西他列汀酮的ω-转氨酶,实现了糖尿病治疗药物西他列汀的工业化制备的先例(savile,c.k.et al.,《science》,2010(329),305-309),因此转氨酶在未来手性胺的合成中更具有应用前景。
[0005]
目前利用转氨酶催化合成手性氨基醇的研究报道较少,已报到的转氨酶仅包括asta,bm-xta,mvta(cn104131048a;cn108823179a;zhang j.d.et al.,《j.biotechnol.》,2019(290),24-32;c.s.fuchs et al.,《bioorg.med.chem.》,2014((22),5558
–
5562),且此类转氨酶的底物催化范围较窄,催化活力偏低。如来源于放线菌(actinobacteria sp.)的转氨酶可催化4-羟基-2-丁酮生成(r)-3-氨基丁醇,湿细胞的催化活力仅为596u/g,因此还无法应用于大规模的工业化生产。
[0006]
利用转氨酶为催化剂合成手性氨基醇作为一条绿色环保的合成路线,应用前景非
常广阔,也受到了越来越多的关注。此外,采用理性设计对生物催化剂进行分子改造,提高天然酶的催化性能、对推动其工业化应用进程具有重要意义。但是目前已知转氨酶催化活力偏低、底物谱较窄。因此,需要开发更加高效酶催化剂,以降低反应成本,提升工业化应用潜力。
技术实现要素:
[0007]
发明要解决的问题
[0008]
本发明的目的是提供一种源自光合菌的转氨酶催化剂,将其应用于催化合成多种高附加值的手性氨基醇和手性胺,并利用分子改造技术构建酶突变体库,进一步提高酶的催化活力。
[0009]
用于解决问题的方案
[0010]
本发明的第一方面提供编码转氨酶的基因序列。具体来说,本发明选择来源于红杆菌属(rhodobacter sp.)的光合细菌的原始蛋白序列(genbank accession no:rbp85366.1),通过人工设计和密码子优化,利用基因合成技术获得编码转氨酶的核苷酸序列,其核苷酸序列如seq id no:1所示。
[0011]
本发明的第二方面提供一种来源于光合细菌的转氨酶及其突变体,所述突变体是将野生型转氨酶的氨基酸序列(即seq id no:2)的第70位、第72位和第125位氨基酸进行单点突变和/或组合突变获得。
[0012]
进一步,其中一个关键突变体是将seq id no:2所示的氨基酸序列中的第70位酪氨酸突变为苏氨酸、将第72位的缬氨酸突变为丙氨酸,同时将第125位的酪氨酸突变为丙氨酸获得;突变后的氨基酸序如seq id no:3所示。本发明还提供了该转氨酶突变体的编码基因,所述编码基因的核苷酸序列为seq id no:4所示。
[0013]
本发明的第三方面提供一系列包含本发明第一方面和第二方面中所述核苷酸序列的重组表达载体。本发明选择的表达载体可以在原核或真核细胞的各种宿主中稳定存在并可自主复制,如本领域中的常规质粒(pet系列)、穿梭载体pnv 18.1、噬菌体或病毒载体等,优选为pet-28a。在优选载体上通过酶切、连接等分子生物学操作,将本发明第一方面中所述核苷酸序列插入到pet-28a中,构建得到重组表达质粒,命名为pet28a-rbta;将本发明第二方面中所述核苷酸序列插入到pet-28a中,构建得到重组表达质粒,命名为pet28a-rbtamutant。
[0014]
本发明的第四方面提供一系列包含本发明第三方面中所述重组表达载体的重组宿主细胞,所述宿主细胞选自大肠杆菌、赤红球菌(rhodococcus.ruber)、枯草芽孢杆菌、酵母菌。本发明优选大肠杆菌e.coli bl21(de3)。将本发明第三方面中所述的重组表达质粒pet28a-rbta转化至e.coli bl21(de3)中,获得相应的基因工程菌e.coli bl21(de3)pet28a-rbta;将本发明第三方面中所述的含有突变基因的重组表达质粒转化至e.coli bl21(de3)中,获得包含相应突变体的基因工程菌e.coli bl21(de3)pet28a-rbtamutant。
[0015]
本发明的第五方面提供包含本发明第二方面所述的转氨酶及其突变体的催化剂的制备方法。所述催化剂包括全细胞催化剂和游离蛋白催化剂两种形式。全细胞催化剂是指经本发明第四方面构建的基因工程菌经富集培养和目标蛋白的诱导表达后所获的全细胞;游离蛋白催化剂是将全细胞经超声破碎或高压匀浆破碎并通过离心后获得的粗酶液,
亦包括通过蛋白纯化手段获得的纯酶。
[0016]
本发明的第六方面提供本发明第二方面中所述的转氨酶在制备手性氨基醇及手性胺中的应用。化合物的结构式如说明书附图4所示,所述应用包括用于(r)-3-氨基丁醇、(r)-2-氨基丁醇、(r)-丙氨醇、(r)-1-甲氧基-2-丙胺、(r)-2-戊胺、(r)-2-己胺、(r)-2-庚胺、(r)-1,3-二甲基丁胺、(r)-1,4-二甲基戊胺、(r)-苯乙胺、(s)-苯甘氨醇等关键医药中间体及其类似物的生物催化合成。
[0017]
本发明的第七方面提供本发明第二方面中所述的转氨酶突变体在制备手性胺中的应用。化合物的结构式如附图4所示,所述应用包括用于(r)-2-环己烯-1-胺、trans-2-甲基环已胺、trans-3-甲基环已胺、(r)-(-)-1-氨基茚满、(r)-(+)-1,2,3,4-四氢萘胺和(r)-1-叔丁氧羰基-3-氨基哌啶等关键医药中间体及其类似物的生物催化合成。
[0018]
具体的,本发明如下所述:
[0019]
(1)一种来源于红杆菌属(rhodobacter sp.)的光合细菌的转氨酶,其特征在于,所述转氨酶的编码基因如seq id no:1所示。
[0020]
(2)一种编码转氨酶的基因,其特征在于,所述基因的核苷酸序列如seq id no:1所示或者为与所述seq id no:1具有80%、85%、90%、95%、98%或99%以上同源性的核苷酸序列。
[0021]
所述编码转氨酶的基因还可以是在严格条件下与seq id no:1所示的基因序列杂交且编码具有转氨酶活性的蛋白质的dna分子。
[0022]
(3)一种转氨酶突变体,其特征在于,所述转氨酶的氨基酸序列是由seq id no:2所示的野生型氨基酸序列发生突变得到的氨基酸序列,所述突变的氨基酸位点包括seq id no:2中的第70位氨基酸位点、第72位氨基酸位点和第125位氨基酸位点中的至少一个;优选的,所述突变方式为v72t、y70f、y125a、v72a、y70t、y125t、v72a/y125t、y70f/y125a、y70v/y125a、y70t/y125a、y70a/y125v、v72t/y125a、v72t/y125g、y70t/v72a/y125f、y70a/v72t/y125v、y70v/v72t/y125v、y70f/v72t/y125v、y70f/v72a/y125v、y70t/v72a/y125v或y70t/v72a/y125a中的任意一种;更优选的,所述突变方式为y70t/v72a/y125a。
[0023]
(4)根据(3)所述的转氨酶突变体,其特征在于,所述转氨酶的氨基酸序列与seq id no:2所示的氨基酸序列具有80%、85%、90%、95%、98%或99%以上的同源性;优选的,所述转氨酶的氨基酸序列如seq id no:3所示。
[0024]
所述转氨酶的突变体还可以是在seq id no:2所示序列的基础上经过取代、缺失或添加一个或几个氨基酸并且具有转氨酶活性的由seq id no:2衍生的蛋白质。
[0025]
(5)一种编码(3)或(4)中所述转氨酶突变体的基因,其特征在于,所述基因的核苷酸序列如seq id no:4所示或者为与所述seq id no:4具有80%、85%、90%、95%、98%或99%以上同源性的核苷酸序列。
[0026]
所述编码转氨酶突变体的基因还可以是在严格条件下与seq id no:4所示的基因序列杂交且编码具有转氨酶活性的蛋白质的dna分子。
[0027]
根据本发明,“杂交”意指多核苷酸或寡核苷酸在严格条件下与大体互补的序列结合的能力,而在这些条件下不发生与非互补对象之间的非特异性结合。对此,所述序列优选为90~100%互补的。将能够互相特异性结合的互补序列的特性应用于例如northern或southern印迹技术中,或是pcr或rt-pcr的引物结合中。
[0028]
根据本发明,杂交在严格条件下发生。此类杂交条件描述于sambrook,j.,fritsch,e.f.,maniatis,t.,in:molecular cloning(a laboratory manual),第2版,cold spring harbor laboratory press,1989,第9.31-9.57页中,或描述于current protocols in molecular biology,john wiley&sons,n.y.(1989),6.3.1-6.3.6中。
[0029]
严格杂交条件意指具体为:在溶液中42℃过夜温育,所述溶液由50%甲酰胺、5
×
ssc(750mm nacl,75mm柠檬酸三钠)、50mm磷酸钠(ph 7.6)、5
×
登哈特溶液(denhardt
’
s solution)、10%右旋糖酐硫酸酯和20g/ml变性的、剪切的(sheared)鲑鱼精子dna组成,然后用0.1
×
ssc在65℃洗涤滤器。
[0030]
本文使用的术语“同源性”具有本领域通常已知的含义,本领域技术人员也熟知测定不同序列间同源性的规则、标准。本发明用不同程度同源性限定的序列还必须要同时具有改进的转氨酶活性。
[0031]
(6)一种重组表达载体,其特征在于,所述重组表达载体包含权利要求2或5所述的基因;优选的,所述重组表达载体包括pet系列载体、穿梭载体、噬菌体或病毒载体;更优选的,所述重组表达载体为pet-28a。其中,所述pet系列载体包括pet-22b、pet-3a、pet-3d、pet-11a、pet-12a、pet-14b、pet-15b、pet-16b、pet-17b、pet-19b、pet-20b、pet-21a、pet-23a、pet-23b、pet-24a、pet-25b、pet-26b、pet-27b、pet-28a、pet-29a、pet-30a、pet-31b、pet-32a、pet-35b、pet-38b、pet-39b、pet-40b、pet-41a、pet-41b、pet-42a、pet-43a、pet-43b、pet-44a和pet-49b。
[0032]
(7)一种重组宿主细胞,其特征在于,所述宿主细胞包含(6)中所述的重组表达载体;优选的,所述宿主细胞为原核细胞、酵母或真核细胞;更优选的,所述宿主细胞为大肠杆菌bl21(de3)。
[0033]
(8)一种酶制剂,其特征在于,包括(1)中所述的转氨酶或者(3)中所述的转氨酶突变体。
[0034]
(9)一种如(1)中所述的转氨酶在催化羟基酮和潜手性酮类化合物发生转氨反应制备手性氨基醇及手性胺中的用途,其特征在于,所述羟基酮和潜手性酮类化合物为:4-羟基-2-丁酮、1-羟基-2-丁酮、羟基丙酮、1-甲氧基-2-丙酮、2-戊酮、2-己酮、2-庚酮、4-甲基-2-戊酮、5-甲基-2-己酮、苯乙酮、2-羟基苯乙酮、2-环己烯-1-酮、2-甲基环己酮、3-甲基环己酮、1-茚酮、1-四氢萘酮和n-叔丁氧羰基-3-哌啶酮;所述手性氨基醇及手性胺为:(r)-3-氨基丁醇、(r)-2-氨基丁醇、(r)-丙氨醇、(r)-1-甲氧基-2-丙胺、(r)-2-戊胺、(r)-2-己胺、(r)-2-庚胺、(r)-1,3-二甲基丁胺、(r)-1,4-二甲基戊胺、(r)-苯乙胺、(s)-苯甘氨醇、(r)-2-环己烯-1-胺、trans-2-甲基环已胺、trans-3-甲基环已胺、(r)-(-)-1-氨基茚满、(r)-(+)-1,2,3,4-四氢萘胺、(r)-1-叔丁氧羰基-3-氨基哌啶;
[0035]
优选的,所述羟基酮和潜手性酮类化合物为4-羟基-2-丁酮、1-羟基-2-丁酮、羟基丙酮、1-甲氧基-2-丙酮、2-戊酮、2-己酮、2-庚酮、4-甲基-2-戊酮、5-甲基-2-己酮、苯乙酮、2-羟基苯乙酮;所述手性氨基醇及手性胺为:(r)-3-氨基丁醇、(r)-2-氨基丁醇、(r)-丙氨醇、(r)-1-甲氧基-2-丙胺、(r)-2-戊胺、(r)-2-己胺、(r)-2-庚胺、(r)-1,3-二甲基丁胺、(r)-1,4-二甲基戊胺、(r)-苯乙胺、(s)-苯甘氨醇。
[0036]
(10)一种如(3)中所述的转氨酶突变体在催化羟基酮和潜手性酮类化合物发生转氨反应制备手性氨基醇及手性胺中的用途,其特征在于,所述羟基酮和潜手性酮类化合物
为:4-羟基-2-丁酮、1-羟基-2-丁酮、羟基丙酮、1-甲氧基-2-丙酮、2-戊酮、2-己酮、2-庚酮、4-甲基-2-戊酮、5-甲基-2-己酮、苯乙酮、2-羟基苯乙酮、2-环己烯-1-酮、2-甲基环己酮、3-甲基环己酮、1-茚酮、1-四氢萘酮和n-叔丁氧羰基-3-哌啶酮;所述手性氨基醇及手性胺为:(r)-3-氨基丁醇、(r)-2-氨基丁醇、(r)-丙氨醇、(r)-1-甲氧基-2-丙胺、(r)-2-戊胺、(r)-2-己胺、(r)-2-庚胺、(r)-1,3-二甲基丁胺、(r)-1,4-二甲基戊胺、(r)-苯乙胺、(s)-苯甘氨醇、(r)-2-环己烯-1-胺、trans-2-甲基环已胺、trans-3-甲基环已胺、(r)-(-)-1-氨基茚满、(r)-(+)-1,2,3,4-四氢萘胺、(r)-1-叔丁氧羰基-3-氨基哌啶;
[0037]
优选的,所述羟基酮和潜手性酮类化合物为2-环己烯-1-酮、2-甲基环己酮、3-甲基环己酮、1-茚酮、1-四氢萘酮和n-叔丁氧羰基-3-哌啶酮;所述手性氨基醇及手性胺为(r)-2-环己烯-1-胺、trans-2-甲基环已胺、trans-3-甲基环已胺、(r)-(-)-1-氨基茚满、(r)-(+)-1,2,3,4-四氢萘胺和(r)-1-叔丁氧羰基-3-氨基哌啶。
[0038]
发明的效果
[0039]
由本发明的技术方案可见,本发明的技术方案与现有技术相比,具有以下有益效果:
[0040]
本发明所获得的重组转氨酶催化剂能够不对称催化合成17种高附加值的手性氨基醇及手性胺,反应转化率最高可达99%,产物光学纯度可达99%以上。且通过蛋白质工程改造获取的转氨酶突变体相比野生型母本活力提高明显,其中,最优突变体的活力相比野生型母本的活力提升105倍,且产物ee在99%以上。
[0041]
为了让本发明的上述和其他目的、特征和优点能更明显易懂,下面特举较佳实施例,并配合说明书附图,作详细说明如下:
附图说明
[0042]
图1a和图1b分别示出了转氨酶rbta及其突变体的重组质粒图谱。
[0043]
图2示出了重组转氨酶rbta的蛋白表达及纯化电泳图。条带1:标准蛋白;条带2:破碎上清液;条带3-10:不同体积百分比的缓冲液b洗脱后的蛋白电泳图;m:标准蛋白;s:上清。
[0044]
图3示出了重组转氨酶rbta转氨酶催化底物谱;其中1a-17a代表的物质分别为:4-羟基-2-丁酮、1-羟基-2-丁酮、羟基丙酮、1-甲氧基-2-丙酮、2-戊酮、2-己酮、2-庚酮、4-甲基-2-戊酮、5-甲基-2-己酮、苯乙酮、2-羟基苯乙酮、2-环己烯-1-酮、2-甲基环己酮、3-甲基环己酮、1-茚酮、1-四氢萘酮和n-叔丁氧羰基-3-哌啶酮。
[0045]
图4示出了酶法催化合成手性氨基醇及手性胺;其中1b-17b代表的物质分别为:(r)-3-氨基丁醇、(r)-2-氨基丁醇、(r)-丙氨醇、(r)-1-甲氧基-2-丙胺、(r)-2-戊胺、(r)-2-己胺、(r)-2-庚胺、(r)-1,3-二甲基丁胺、(r)-1,4-二甲基戊胺、(r)-苯乙胺、(s)-苯甘氨醇、(r)-2-环己烯-1-胺、trans-2-甲基环已胺、trans-3-甲基环已胺、(r)-(-)-1-氨基茚满、(r)-(+)-1,2,3,4-四氢萘胺、(r)-1-叔丁氧羰基-3-氨基哌啶。
[0046]
图5示出了重组转氨酶催化底物合成手性氨基醇及手性胺的示意图。
[0047]
图6示出了在不同温度条件下,重组转氨酶的相对活力。
[0048]
图7示出了在不同ph和不同种类的缓冲液中,重组转氨酶的相对活力。
[0049]
图8示出了不同的底物/氨基供体摩尔比条件下,重组转氨酶的转化率。
具体实施方式
[0050]
本发明所列举的具体实施例只作为本发明的范例,本发明并不限制于下文所描述的具体实施例。对于本领域技术人员而言,任何对下文所述的实施例进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所有试剂或仪器未注明生产厂商者,均为可以通过市购的常规产品。为了更好地说明本发明,在下文的具体实施方式中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本发明同样可以实施。在另外一些实施例中,对于本领域技术人员熟知的方法、手段、器材和步骤未作详细描述,以便凸显本发明的主旨。
[0051]
除非另有定义,否则本文中使用的所有技术和科学术语均具有与本领域一般技术人员通常所理解的含义相同的含义。如无特殊说明,本说明书中所使用的单位均为国际标准单位,并且本发明中出现的数值和数值范围,均应当理解为包含了工业生产中所不可避免的系统性误差。
[0052]
实施例1转氨酶编码基因的改造、克隆及重组表达载体的构建
[0053]
通过分析来源于红杆菌属(rhodobacter sp.)的光合细菌的转氨酶(rbta)的蛋白序列,对其编码基因进行人工设计。
[0054]
1.1首先在来源于红杆菌属(rhodobacter sp.)的光合细菌的原始蛋白序列(genbank accession no:rbp85366.1)的起始编码位置添加his-tag标签,用于后续的蛋白纯化。此外,在上述原始基因序列的两端设计bamh i和ecor i酶切位点,并以大肠杆菌为宿主进行密码子优化,获取能够表达转氨酶的核苷酸序列seq id no:1,根据序列信息通过商业公司进行基因合成。
[0055]
1.2以质粒pet-28a为表达载体,使用内切酶bamh i和ecor i对该质粒和本实施例第1.1节中合成的基因进行双酶切,利用核酸电泳(1.0%琼脂糖)和试剂盒回收酶切后的基因片段,然后将酶切后的目的基因片段连接到酶切后的质粒载体中。
[0056]
20μl连接体系包括:2μl 10
×
t4 dna连接酶buffer(takara公司),5μl目的基因片段,5μl质粒片段,2μl t4 dna连接酶,8μl ddh2o,在16℃连接过夜,转化至dh5α感受态细胞内,挑取单克隆子测序验证,提取测序正确的重组质粒,获得包含转氨酶编码基因的重组表达载体,命名为pet28a-rbta。
[0057]
实施例2转氨酶突变体库的构建
[0058]
我们利用x-ray衍射解析了实施例1中所述基因编码的转氨酶的晶体结构,在分析所述转氨酶蛋白结构的基础上,锁定底物口袋周围的非保守性氨基酸为第72位的缬氨酸、第70位的酪氨酸和第125位的酪氨酸(分别简称为val72、tyr70和try125),设计简并氨基酸字母表(v-f-a-t),对这些非保守性氨基酸位点进行组合饱和突变,构建小巧型突变体库(参照li,f.l.et al.,《acs catalysis》,2018,8(9),8314-8317中公开的方法)。
[0059]
选择实施例1中构建的重组表达载体pet28a-rbta为模板,设计含有突变位点的正向引物和反向引物(具体参见表1),使用primestar hs dna polymerase(takara公司)进行全质粒扩增。
[0060]
20μl的pcr反应体系包括:
[0061]
1μl pet28a-rbta质粒模板(约100ng/μl);
[0062]
10μl 2
×
primestar hs dna polymerase;
[0063]
1.5μl正向引物(10μm);
[0064]
1.5μl反向引物(10μm);
[0065]
6μl ddh2o。
[0066]
所述正向引物为针对不同突变体构建过程中所使用的特定引物,如表1所示。以构建y70v为例,该扩增体系中的正向引物即为y70v-up。所述反向引物为针对不同突变体构建过程中所使用的特定引物,如表1所示。以构建y70v为例,该扩增体系中的反向引物即为y70v-down。
[0067]
pcr反应的条件如下:
[0068]
(1)98℃预变性1min;
[0069]
(2)98℃变性30s;
[0070]
(3)(引物的tm-5)℃退火10s;
[0071]
(4)72℃延伸7min;
[0072]
上述步骤(2)-(4)共进行30个循环,最后72℃延伸10min。
[0073]
pcr扩增得到的重组质粒经dpn i酶消化后,转化到e.coli dh5α感受态细胞中,并涂布于含有卡那霉素(50μg/ml)的lb平板中,置于37℃培养箱中倒置培养约12h。挑取单克隆子进行测序验证,测序正确后用20%的甘油进行保菌,置于-70℃冰箱内保存。将包含突变的重组表达载体命名为pet28a-rbtamutant。
[0074]
表1:构建突变体库使用的正向引物(up)和反应引物(down)序列
[0075]
引物名称引物序列seq id no:y70v-up5'-ggacgtcaccgtcaccgtggcccacg-3'5y70v-down5'-cgtgggccacggtgacggtgacgtcc-3'6v72f-up5'-gtcacctacaccttcgcccacgtctggc-3'7v72f-down5'-gccagacgtgggcgaaggtgtaggtgac-3'8y125v-up5'-ccgggaggccgtcgtcaacgtgtg-3'9y125v-down5'-cacacgttgacgacggcctcccgg-3'10y70f-up5'-ggacgtcaccttcaccgtggcccacg-3'11y70f-down5'-cgtgggccacggtgaaggtgacgtcc-3'12v72a-up5'-gtcacctacaccgccgcccacgtctggc-3'13v72a-down5'-gccagacgtgggcggcggtgtaggtgac-3'14y125f-up5'-ccgggaggccttcgtcaacgtgtg-3'15y125f-down5'-cacacgttgacgaaggcctcccgg-3'16y70a-up5'-ggacgtcaccggcaccgtggcccacg-3'17y70a-down5'-cgtgggccacggtgccggtgacgtcc-3'18v72t-up5'-gtcacctacaccaccgcccacgtctggc-3'19v72t-down5'-gccagacgtgggcggtggtgtaggtgac-3'20y125a-up5'-ccgggaggccgccgtcaacgtgtg-3'21y125a-down5'-cacacgttgacggcggcctcccgg-3'22y70t-up5'-ggacgtcaccaccaccgtggcccacg-3'23
y70t-down5'-cgtgggccacggtggtggtgacgtcc-3'24y125t-up5'-ccgggaggccaccgtcaacgtgtg-3'25y125t-down5'-cacacgttgacggtggcctcccgg-3'26
[0076]
实施例3转氨酶及其突变体的基因工程菌构建及细胞催化剂的制备
[0077]
3.1将实施例1中制备的重组表达载体pet28a-rbta和实施例2中制备的重组表达载体pet28a-rbtamutant利用热激法转化至感受态细胞e.coli bl21(de3)中,涂布含卡那霉素(50μg/ml)的lb平板,37℃培养过夜后,挑取单菌落转接含50μg/ml卡那霉素的lb液体培养中,37℃培养12h,送样进行测序,将正确的克隆子保存-70℃冰箱,以此获得大肠杆菌为宿主的基因工程菌。将所述包含重组表达载体pet28a-rbta和pet28a-rbtamutant的基因工程菌分别命名为e.coli bl21(de3)pet28a-rbta和e.coli bl21(de3)pet28a-rbtamutant。
[0078]
3.2将包含转氨酶及其突变体的编码序列的基因工程菌接种到含有卡那霉素抗性的lb液体培养基(蛋白胨10g/l,酵母膏5g/l,氯化钠10g/l,溶剂为去离子水,ph=7.0)中,在含有lb培养基的试管(4ml,含终浓度50μg/ml卡那霉素)中,置于37℃摇床内,200rpm转速下培养10~12h,得到种子液。
[0079]
在超净工作台中将试管内的种子液转接到含有lb培养基的摇瓶(100ml,含终浓度50μg/ml卡那霉素)中。将含有种子液的lb培养基置于37℃摇床内,200rpm转速下培养2~3h。待培养液的od
600
值达到0.6~0.8时,添加终浓度为0.1~0.8mm的iptg进行诱导表达,诱导温度为16~37℃。优选的iptg浓度为0.2mm,优选的诱导温度为16℃。在优选条件下诱导24h后,离心收集细胞,获得转氨酶的细胞催化剂。用20%的甘油进行保菌,置于-70℃冰箱内保存。
[0080]
实施例4转氨酶及其突变体的蛋白纯化
[0081]
称取10g实施例3中冻存的转氨酶或其突变体的湿细胞,加入到100ml的缓冲液a(25mm tris-hcl,ph 8.0;300mm nacl,10mm咪唑,375μl/l巯基乙醇)中,放置在室温融解,过滤去除未完全溶解的块状菌体。
[0082]
然后使用高压匀浆机进行破碎,压力控制在700-800bar,破碎过程中利用低温循环设备进行降温,循环破碎2-3次即可。将收集到的破碎液离心,收集上清液。
[0083]
组装蛋白纯化装置,包括蠕动泵、自装镍柱(10ml sepharose 6fast flow,ge)和收集装置,并使用硅胶管进行连接。使用蠕动泵将粗酶液上样至镍柱中,流速控制在5ml/min。
[0084]
将缓冲液a和缓冲液b(25mm tris-hcl,ph 8.0;300mm nacl,500mm咪唑,375μl/l巯基乙醇)按照体积比配制成含不同咪唑浓度(10~500mm)的洗脱液,然后对目标蛋白进行洗脱,并收集不同梯度下的洗脱液。通过sds-page确定目标蛋白的纯度,结果如说明书附图2所示。
[0085]
根据图2的结果可以看出:在低浓度咪唑溶液下(对应于缓冲液b的体积百分比分别为0%-15%),杂蛋白被清洗脱,仅有少量目标蛋白被洗脱,说明通过人工添加的his标签可很好地与镍柱结合,可通过亲和层析实现目标蛋白的分离纯化。随着咪唑浓度的提高(对应于缓冲液b的体积百分比分别为20-60%),目标蛋白可被洗脱下来,且最终获得蛋白条带单一,纯度较高。因此通过his标签设计和镍柱亲和层析法可获得高纯度的转氨酶rbta。
[0086]
将含有目标蛋白洗脱液合并,使用10-30kda的超滤管在4℃,4000rpm下离心浓缩。当浓缩体积低于1ml时,用缓冲液c(25mm tris-hcl,ph 8.0;150mm nacl,1mm dtt)进行置换,重复2-3次除去溶液中的咪唑,待浓缩至低于1ml时,收集蛋白。使用nandrop2000测定蛋白浓度,液氮速冻后置于-70℃冰箱内。
[0087]
实施例5转氨酶活力的测定
[0088]
取实施例4中所述保存于-70℃冰箱内的纯酶,置于冰上溶解后,利用c液(25mm tris-hcl,ph 7.5)进行稀释,终浓度为3mg/ml,取50μl稀释液加入到300μl tris-hcl缓冲液中(ph 8.0,0.1m),然后依次加入50μl磷酸吡哆醛plp(10mm),50μl异丙胺(2m,ph 8.0),在震荡器(30℃,1000rpm)上预热2min后,加入50μl表2中1a~17a所示的底物(100mm,v/v)反应2h后,添加100μl naoh(10m)进行淬灭,然后加入等体积的正丁醇或乙酸乙酯萃取,离心取有机相进行干燥。通过气相检测底物的减少量,检测条件为:恒压进样,分流比1/30,进样量1μl,进样口和检测器温度为250℃,色谱柱hp-5(30m,3200.25μm,agilent j&w scientific,usa),升温程序:50℃,2min;30℃/min升温至230℃,保持3min。根据底物的减少量计算转化率,并根据反应时间和酶的添加量计算转氨酶的比活力。
[0089]
所述转化率的计算方式如下:
[0090]
转化率其中a1为反应后的底物峰面积,a2为反应前的底物峰面积。
[0091]
所述转氨酶的比活力计算方式如下:
[0092]
比活力
[0093]
产物选择性测定需要进行衍生化反应,反应体系为:10μl反应液,40μl marfey衍生化试剂(20mm),40μl nahco3(1m),200μl dmso,40℃,1000rpm反应1h后,添加40μl hcl(1m)进行淬灭,过滤后利用液相检测产物的选择性(c18,5μm
×
250mm
×
4.6)。
[0094]
测定结果如表2所示,本发明提供的经过密码子优化的seq id no:1编码的转氨酶(即rbta)对1a~17a所示底物均具有活力,催化底物谱广,且转化得到的产物e.e.(对映体过量值)均大于99%,立体选择性较高。与已报到的转氨酶(参见zhang j.d.et al.;《j.biotechnol》,2019,290,24-32,具体为596u/g)相比,本发明提供的rbta对4-羟基-2-丁酮的活力达到786u/g(具体参见表2底物1a的结果)。所述酶活力(u)定义为:在上述反应条件下,每小时催化1μmol底物所需要的酶量为一个酶活单位,用u表示。
[0095]
表2重组转氨酶rbta比活力测定结果
[0096][0097]
实施例6重组转氨酶突变体库活力的筛选
[0098]
通过定点组合突变,我们总共获得144种重组转氨酶突变体,以2-甲基环己酮为底物,对上述突变体进行活力筛选。
[0099]
利用气相色谱检测产物的生成或底物的减少计算转氨酶突变体的酶活力,具体测定方法按照实施例5记载的方法进行。表3提供了本发明具有活性的特定序列的转氨酶突变体的活力测定结果。
[0100]
表3重组转氨酶突变体活力测定结果
[0101]
突变体突变位点数活力(提升倍数)v72t1+y70f1+
y125a1+v72a1+y70t1+y125t1+v72a/y125t2+y70f/y125a2+y70v/y125a2+y70t/y125a2+y70a/y125v2+v72t/y125a2+v72t/y125g2+y70t/v72a/y125f3+y70a/v72t/y125v3++y70v/v72t/y125v3++y70f/v72t/y125v3++y70f/v72a/y125v3+++y70t/v72a/y125v3++++y70t/v72a/y125a3++++++++++
[0102]
在表3中,第一列所示的各突变体代表在seq id no:2所示的氨基酸序列中相应的氨基酸位点中发生了特定的突变后得到的突变体。例如,表3中所述v72t表示在seq id no:2所示的氨基酸列中的第72位缬氨酸突变为苏氨酸得到的突变体。在活力列中,一个加号"+"表示突变体蛋白比野生型活力提高了1~10倍;两个加号"++"表示突变体比由野生型活力提高了10~20倍;3个加号"+++"表示突变体比野生型活力提高了20~30倍,四个加号"++++"表示突变体比野生型活力提高了30~40倍;10个加号"++++++++++"表示突变体比野生型活力提高90~100倍。
[0103]
结论:经过活力测定,共获得20株活力提升的突变体,它们相比野生型活力提高了1~105倍。其中突变体y70t/v72a/y125a活力提升最高达到105倍,为最优突变体。
[0104]
实施例7重组转氨酶最适反应条件的测定
[0105]
最适反应温度的测定:将野生型重组转氨酶rbta的纯酶稀释至0.3mg/ml,以图3中的1a为底物,按照实施例5所述的方法在不同反应温度(具体为25℃、30℃、35℃、40℃、45℃和50℃)下测定重组转氨酶的活力,其他条件保持不变,经测定反应温度为30℃时,重组转氨酶的催化活力最高(具体参见图6),并以该温度条件下的活力为100%,计算其他温度条件下的活力相对值。
[0106]
所述活力相对值的计算方式如下:
[0107]
活力相对值=(不同温度下活力/活力最高值)*100%
[0108]
最适反应ph的测定:将野生型重组转氨酶rbta的纯酶稀释至0.3mg/ml,按照实施例5所述的方法在不同种类和不同ph下的缓冲液(具体包括ph=6.0、ph=7.0的pbs缓冲液;ph=7.0、ph=7.5、ph=8.0、ph=8.5、ph=9.0的tris-hcl缓冲液;ph=9.5、ph=10.5的gly-naoh缓冲液)进行活力的测定,其他条件保持不变。经测定,在ph为7.5和8.0tris-hcl
的缓冲液中,rbta的活力最高(具体参见图7),并以该ph条件下的活力为100%,计算其他温度条件下的活力相对值。
[0109]
所述活力相对的计算方式如下:
[0110]
活力相对值=(不同ph下活力/活力最高值)*100%
[0111]
氨基供体浓度的优选:将图3中底物1a与异丙胺的摩尔比分别设置为1:1、1:2、1:4、1:6、1:8和1:10,其他反应条件保持不变,按照实施例5所述方法测定其催化活力。
[0112]
根据图8的结果可以看出:随着氨基供体比例的提升,反应转化率也随之提高,当底物与氨基供体的摩尔比为1:10时,转化率达到最高(具体参见图8)。所述转化率的计算方式与实施例5相同。
[0113]
实施例8重组转氨酶rbta催化合成(r)-3-氨基丁醇(1b)
[0114]
在反应体系中依次加入的底物(终浓度为100mm)、辅基(1mm)、氨基供体(1m)、细胞催化剂(30g/l)。置于恒温振荡器进行反应,温度设置为30℃、转速1000rpm,反应时间为48h。反应结束后,按照实施例5中的方法计算反应转化率和产物的选择性,经测定反应转化率可达93.2%,产物ee值大于99%(具体参见图4)。
[0115]
上述优选反应缓冲液为tris-hcl(ph 8.0)缓冲液,底物为4-羟基-2-丁酮,辅基为磷酸吡哆醛,氨基供体为异丙胺,细胞催化剂为实施例3中所制备的经诱导表达后的基因工程菌e.coli bl21(de3)pet28a-rbta。
[0116]
实施例9重组转氨酶rbta催化合成(r)-2-氨基丁醇(2b)
[0117]
在反应体系中依次加入的底物(终浓度为100mm)、辅基(1mm)、氨基供体(1m)、细胞催化剂(30g/l)。置于恒温振荡器进行反应,温度设置为30℃、转速1000rpm,反应时间为48h。反应结束后,按照实施例5中的方法计算反应转化率和产物的选择性,经测定反应转化率可达94.5%,产物ee值大于99%(具体参见图4)。
[0118]
上述优选反应缓冲液为tris-hcl(ph 8.0)缓冲液,底物为1-羟基-2-丁酮,辅基为磷酸吡哆醛,氨基供体为异丙胺,细胞催化剂为实施例3中所制备的经诱导表达后的基因工程菌e.coli bl21(de3)pet28a-rbta。
[0119]
实施例10重组转氨酶rbta催化合成(r)-丙氨醇(3b)
[0120]
在反应体系中依次加入的底物(终浓度为100mm)、辅基(1mm)、氨基供体(1m)、细胞催化剂(30g/l)。置于恒温振荡器进行反应,温度设置为30℃、转速1000rpm,反应时间为48h。反应结束后,按照实施例5中的方法计算反应转化率和产物的选择性,经测定反应转化率可达93.8%,产物ee值大于99%(具体参见图4)。
[0121]
上述优选反应缓冲液为tris-hcl(ph 8.0)缓冲液,底物为羟基丙酮,辅基为磷酸吡哆醛,氨基供体为异丙胺,细胞催化剂为实施例3中所制备的经诱导表达后的基因工程菌e.coli bl21(de3)pet28a-rbta。
[0122]
实施例11重组转氨酶rbta催化合成(s)-苯甘氨醇(11b)
[0123]
在反应体系中依次加入的底物(终浓度为100mm)、辅基(1mm)、氨基供体(1m)、细胞催化剂(30g/l)。置于恒温振荡器进行反应,温度设置为30℃、转速1000rpm,反应时间为48h。反应结束后,按照实施例5中的方法计算反应转化率和产物的选择性,经测定反应转化率可达96.4%,产物ee值大于99%(具体参见图4)。
[0124]
上述优选反应缓冲液为tris-hcl(ph 8.0)缓冲液,底物为2-羟基苯乙酮,辅基为
磷酸吡哆醛,氨基供体为异丙胺,细胞催化剂为实施例3中所制备的经诱导表达后的基因工程菌e.coli bl21(de3)pet28a-rbta。
[0125]
实施例12重组转氨酶rbta催化合成(r)-1-甲氧基-2-丙胺(4b)
[0126]
在反应体系中依次加入的底物(终浓度为100mm)、辅基(1mm)、氨基供体(1m)、细胞催化剂(30g/l)。置于恒温振荡器进行反应,温度设置为30℃、转速1000rpm,反应时间为48h。反应结束后,按照实施例5中的方法计算反应转化率和产物的选择性,经测定反应转化率可达98.0%,产物ee值大于99%(具体参见图4)。
[0127]
上述优选反应缓冲液为tris-hcl(ph 8.0)缓冲液,底物为1-甲氧基-2-丙酮,辅基为磷酸吡哆醛,氨基供体为异丙胺,细胞催化剂为实施例3中所制备的经诱导表达后的基因工程菌e.coli bl21(de3)pet28a-rbta。
[0128]
实施例13重组转氨酶rbta催化合成(r)-2-戊胺(5b)
[0129]
在反应体系中依次加入的底物(终浓度为100mm)、辅基(1mm)、氨基供体(1m)、细胞催化剂(30g/l)。置于恒温振荡器进行反应,温度设置为30℃、转速1000rpm,反应时间为48h。反应结束后,按照实施例5中的方法计算反应转化率和产物的选择性,经测定反应转化率可达97.2%产物ee值大于99%(具体参见图4)。
[0130]
上述优选反应缓冲液为tris-hcl(ph 8.0)缓冲液,底物为2-戊酮,辅基为磷酸吡哆醛,氨基供体为异丙胺,细胞催化剂为实施例3中所制备的经诱导表达后的基因工程菌e.coli bl21(de3)pet28a-rbta。
[0131]
实施例14重组转氨酶rbta催化合成(r)-2-己胺(6b)
[0132]
在反应体系中依次加入的底物(终浓度为100mm)、辅基(1mm)、氨基供体(1m)、细胞催化剂(30g/l)。置于恒温振荡器进行反应,温度设置为30℃、转速1000rpm,反应时间为48h。反应结束后,按照实施例5中的方法计算反应转化率和产物的选择性,经测定反应转化率可达91.9%,产物ee值大于99%(具体参见图4)。
[0133]
上述优选反应缓冲液为tris-hcl(ph 8.0)缓冲液,底物为2-己酮,辅基为磷酸吡哆醛,氨基供体为异丙胺,细胞催化剂为实施例3中所制备的经诱导表达后的基因工程菌e.coli bl21(de3)pet28a-rbta。
[0134]
实施例15重组转氨酶rbta催化合成(r)-2-庚胺(7b)
[0135]
在反应体系中依次加入的底物(终浓度为100mm)、辅基(1mm)、氨基供体(1m)、细胞催化剂(30g/l)。置于恒温振荡器进行反应,温度设置为30℃、转速1000rpm,反应时间为48h。反应结束后,按照实施例5中的方法计算反应转化率和产物的选择性,经测定反应转化率可达94.5%,产物ee值大于99%(具体参见图4)。
[0136]
上述优选反应缓冲液为tris-hcl(ph 8.0)缓冲液,底物为2-庚酮,辅基为磷酸吡哆醛,氨基供体为异丙胺,细胞催化剂为实施例3中所制备的经诱导表达后的基因工程菌e.coli bl21(de3)pet28a-rbta。
[0137]
实施例16重组转氨酶rbta催化合成(r)-1,3-二甲基丁胺(8b)
[0138]
在反应体系中依次加入的底物(终浓度为100mm)、辅基(1mm)、氨基供体(1m)、细胞催化剂(30g/l)。置于恒温振荡器进行反应,温度设置为30℃、转速1000rpm,反应时间为48h。反应结束后,按照实施例5中的方法计算反应转化率和产物的选择性,经测定反应转化率可达96.2%,产物ee值大于99%(具体参见图4)。
[0139]
上述优选反应缓冲液为tris-hcl(ph 8.0)缓冲液,底物为4-甲基-2-戊酮,辅基为磷酸吡哆醛,氨基供体为异丙胺,细胞催化剂为实施例3中所制备的经诱导表达后的基因工程菌e.coli bl21(de3)pet28a-rbta。
[0140]
实施例17重组转氨酶rbta催化合成(r)-1,4-二甲基戊胺(9b)
[0141]
在反应体系中依次加入的底物(终浓度为100mm)、辅基(1mm)、氨基供体(1m)、细胞催化剂(30g/l)。置于恒温振荡器进行反应,温度设置为30℃、转速1000rpm,反应时间为48h。反应结束后,按照实施例5中的方法计算反应转化率和产物的选择性,经测定反应转化率可达95.3%,产物ee值大于99%(具体参见图4)。
[0142]
上述优选反应缓冲液为tris-hcl(ph 8.0)缓冲液,底物为5-甲基-2-己酮,辅基为磷酸吡哆醛,氨基供体为异丙胺,细胞催化剂为实施例3中所制备的经诱导表达后的基因工程菌e.coli bl21(de3)pet28a-rbta。
[0143]
实施例18重组转氨酶rbta催化合成(r)-苯乙胺(10b)
[0144]
在反应体系中依次加入的底物(终浓度为100mm)、辅基(1mm)、氨基供体(1m)、细胞催化剂(30g/l)。置于恒温振荡器进行反应,温度设置为30℃、转速1000rpm,反应时间为48h。反应结束后,按照实施例5中的方法计算反应转化率和产物的选择性,经测定反应转化率可达53.0%,产物ee值大于99%(具体参见图4)。
[0145]
由于转氨反应为可逆反应,且苯乙胺为多数转氨酶的氨基供体之一,因此,重组转氨酶rbta在催化合成(r)-苯乙胺时,存在可逆反应使得最终转化率偏低仅为53.0%。
[0146]
上述优选反应缓冲液为tris-hcl(ph 8.0)缓冲液,底物为苯乙酮,辅基为磷酸吡哆醛,氨基供体为异丙胺,细胞催化剂为实施例3中所制备的经诱导表达后的基因工程菌e.coli bl21(de3)pet28a-rbta。
[0147]
实施例19重组转氨酶突变体催化合成(r)-2-环己烯-1-胺(12b)
[0148]
在反应体系中依次加入的底物(终浓度为100mm)、辅基(1mm)、氨基供体(1m)、细胞催化剂(30g/l)。置于恒温振荡器进行反应,温度设置为30℃、转速1000rpm,反应时间为48h。反应结束后,按照实施例5中的方法计算反应转化率和产物的选择性,经测定反应转化率可达93.4%,产物ee值大于99%(具体参见图4)。
[0149]
上述优选反应缓冲液为tris-hcl(ph 8.0)缓冲液,底物为2-环己烯-1-酮,辅基为磷酸吡哆醛,氨基供体为异丙胺,细胞催化剂为按照实施例3中所述方法制备的经诱导表达后的基因工程菌e.coli bl21(de3)pet28a-rbtamutant中的同时包含y70t/v72a/y125a突变的突变体,即表3中所述最优突变体y70t/v72a/y125a。
[0150]
实施例20重组转氨酶突变体催化合成trans-2-甲基环已胺(13b)
[0151]
在反应体系中依次加入的底物(终浓度为100mm)、辅基(1mm)、氨基供体(1m)、细胞催化剂(30g/l)。置于恒温振荡器进行反应,温度设置为30℃、转速1000rpm,反应时间为48h。反应结束后,按照实施例5中的方法计算反应转化率和产物的选择性,经测定反应转化率可达96.4%,产物ee值大于99%(具体参见图4)。
[0152]
上述优选反应缓冲液为tris-hcl(ph 8.0)缓冲液,底物为2-甲基环己酮,辅基为磷酸吡哆醛,氨基供体为异丙胺,细胞催化剂为按照实施例3中所述方法制备的经诱导表达后的基因工程菌e.coli bl21(de3)pet28a-rbtamutant中的同时包含y70t/v72a/y125a突变的突变体,即表3中所述最优突变体y70t/v72a/y125a。
[0153]
实施例21重组转氨酶突变体催化合成trans-3-甲基环已胺(14b)
[0154]
在反应体系中依次加入的底物(终浓度为100mm)、辅基(1mm)、氨基供体(1m)、细胞催化剂(30g/l)。置于恒温振荡器进行反应,温度设置为30℃、转速1000rpm,反应时间为48h。反应结束后,按照实施例5中的方法计算反应转化率和产物的选择性,经测定反应转化率可达99.0%,产物ee值大于99%(具体参见图4)。
[0155]
上述优选反应缓冲液为tris-hcl(ph 8.0)缓冲液,底物为3-甲基环己酮,辅基为磷酸吡哆醛,氨基供体为异丙胺,细胞催化剂为按照实施例3中所述方法制备的经诱导表达后的基因工程菌e.coli bl21(de3)pet28a-rbtamutant中的同时包含y70t/v72a/y125a突变的突变体,即表3中所述最优突变体y70t/v72a/y125a。
[0156]
实施例22重组转氨酶突变体催化合成(r)-(-)-1-氨基茚满(15b)
[0157]
在反应体系中依次加入的底物(终浓度为100mm)、辅基(1mm)、氨基供体(1m)、细胞催化剂(30g/l)。置于恒温振荡器进行反应,温度设置为30℃、转速1000rpm,反应时间为48h。反应结束后,按照实施例5中的方法计算反应转化率和产物的选择性,经测定反应转化率可达98.4%,产物ee值大于99%(具体参见图4)。
[0158]
上述优选反应缓冲液为tris-hcl(ph 8.0)缓冲液,底物为1-茚酮,辅基为磷酸吡哆醛,氨基供体为异丙胺,细胞催化剂为按照实施例3中所述方法制备的经诱导表达后的基因工程菌e.coli bl21(de3)pet28a-rbtamutant中的同时包含y70t/v72a/y125a突变的突变体,即表3中所述最优突变体y70t/v72a/y125a。
[0159]
实施例23重组转氨酶突变体催化合成(r)-(+)-1,2,3,4-四氢萘胺(16b)
[0160]
在反应体系中依次加入的底物(终浓度为100mm)、辅基(1mm)、氨基供体(1m)、细胞催化剂(30g/l)。置于恒温振荡器进行反应,温度设置为30℃、转速1000rpm,反应时间为48h。反应结束后,按照实施例5中的方法计算反应转化率和产物的选择性,经测定反应转化率可达96.4%,产物ee值大于99%(具体参见图4)。
[0161]
上述优选反应缓冲液为tris-hcl(ph 8.0)缓冲液,底物为1-四氢萘酮,辅基为磷酸吡哆醛,氨基供体为异丙胺,细胞催化剂为按照实施例3中所述方法制备的经诱导表达后的基因工程菌e.coli bl21(de3)pet28a-rbtamutant中的同时包含y70t/v72a/y125a突变的突变体,即表3中所述最优突变体y70t/v72a/y125a。
[0162]
实施例24重组转氨酶突变体催化合成(r)-1-叔丁氧羰基-3-氨基哌啶(17b)
[0163]
在反应体系中依次加入的底物(终浓度为100mm)、辅基(1mm)、氨基供体(1m)、细胞催化剂(30g/l)。置于恒温振荡器进行反应,温度设置为30℃、转速1000rpm,反应时间为48h。反应结束后,按照实施例5中的方法计算反应转化率和产物的选择性,经测定反应转化率可达99.0%,产物ee值大于99%(具体参见图4)。
[0164]
上述优选反应缓冲液为tris-hcl(ph 8.0)缓冲液,底物为n-叔丁氧羰基-3-哌啶酮,辅基为磷酸吡哆醛,氨基供体为异丙胺,细胞催化剂为按照实施例3中所述方法制备的经诱导表达后的基因工程菌e.coli bl21(de3)pet28a-rbtamutant中的同时包含y70t/v72a/y125a突变的突变体,即表3中所述最优突变体y70t/v72a/y125a。
[0165]
此外,本发明人通过具体的试验还验证了在实施例6的表3中所示的其余19种转氨酶突变体也均能催化合成(r)-1-叔丁氧羰基-3-氨基哌啶,具体反应结果如表4所示,所述突变体的反应转化率均高于90%,且产物ee值大于99%,说明所获得的其余19种转氨酶突
变体同样可以用于制备手性胺。
[0166]
表4重组转氨酶突变体催化合成(r)-1-叔丁氧羰基-3-氨基哌啶
[0167]
突变体转化率产物ee值v72t90%>99%y70f93%>99%y125a99%>99%v72a95%>99%y70t91%>99%y125t99%>99%v72a/y125t97%>99%y70f/y125a99%>99%y70v/y125a99%>99%y70t/y125a99%>99%y70a/y125v99%>99%v72t/y125a92%>99%v72t/y125g94%>99%y70t/v72a/y125f93%>99%y70a/v72t/y125v99%>99%y70v/v72t/y125v99%>99%y70f/v72t/y125v99%>99%y70f/v72a/y125v99%>99%y70t/v72a/y125v99%>99%
[0168]
在上述实施例8-24所示结果的基础上,本领域技术人员能够合理预期本发明在实施例6表3中所示的其余19种转氨酶突变体也均能够用于催化其它种类的羟基酮和潜手性酮类化合物发生转氨反应制备手性氨基醇及手性胺,并达到和实施例8-24相同或相近的技术效果。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



