一种用于南芥菜花叶病毒及菜豆荚斑驳病毒检测的DPO-PCR引物对及其应用的制作方法
 2021-02-02 01:02:07|
2021-02-02 01:02:07| 366|
366| 起点商标网
起点商标网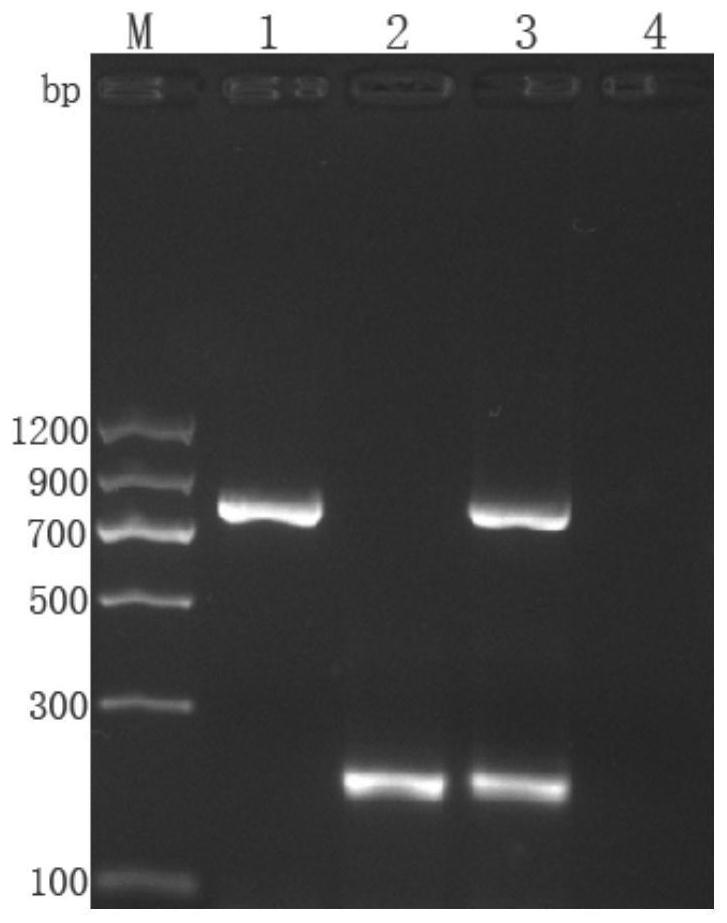
一种用于南芥菜花叶病毒及菜豆荚斑驳病毒检测的dpo-pcr引物对及其应用
技术领域
[0001]
本发明涉及病毒检测领域,尤其涉及一种用于南芥菜花叶病毒及菜豆荚斑驳病毒检测的dpo-pcr引物对及其应用。
背景技术:
[0002]
我国是大豆主要进口国,具海关数据显示,2017年我国大豆进口量实现6 连涨,达到9553万吨,创历史新高。2018年3月中美贸易摩擦开始以后,大豆进口量才相对降低,2019年全年共进口大豆8551.1万吨,创历史第二高峰。进口大豆虽能满足油脂市场的需求,但携带大量外来有害生物。南芥菜花叶病毒 (arabis mosaic virus,armv)及菜豆荚斑驳病毒(bean pod mottle virus,bpmv) 属于我国进境植物检疫性有害生物,是植物种传病毒,可随带毒种子远距离传播,均存在通过染病大豆传入我国的风险。目前口岸主要使用das-elisa和 rt-pcr方法对两种病毒进行检测,时间长,通量低,因此建立高通量的病毒检测方法对提高口岸检测效率有重要意义。
[0003]
多重pcr(multiplex pcr)技术首先被chamberlain等(1988)用于检测杜氏营养不良症,现在已经在病原微生物的鉴别、遗传病诊断及法医学等方面广泛应用。多重pcr同时扩增多个目的基因片段,提高了扩增效率,具有高效性、特异性强及操作简便等优点,但多重pcr反应体系需设计两对及两对以上引物,所以引物设计是该技术的关键。双启动寡核苷酸引物(dual-priming oligonucleotide,dpo)是一种新型pcr引物设计方法,具有特异性高,引物自身及引物间难形成二级结构,引物设计简单等优点,目前已经广泛的应用于如大丽轮枝菌、黑白轮枝菌、向日葵白锈病菌,向日葵黑茎病菌、油菜茎基溃疡病菌、番茄斑萎病毒等植物病害的检测中。
技术实现要素:
[0004]
本发明的目的在于克服现有技术的不足,提供一种用于南芥菜花叶病毒及菜豆荚斑驳病毒检测的dpo-pcr引物对及其应用。本发明在多重pcr中引入 dpo引物技术,可以大大提高多重pcr技术的灵敏度及特异性。本发明建立的南芥菜花叶病毒及菜豆荚斑驳病毒双重dpo-pcr检测方法,为口岸实验室对其的快速筛查提供参考提供参考。
[0005]
为实现上述目的,本发明采取的技术方案为:提供一种用于南芥菜花叶病毒和/或菜豆荚斑驳病毒检测的dpo-pcr引物对,所述dpo-pcr引物对的序列如下:
[0006]
armv-dpof:cccacctactgaaaaggtiiiiiagcctacc;
[0007]
armv-dpor:cctctttgcgccctcagaiiiiicgacttt;
[0008]
或:
[0009]
bpmv-dpof:aggttgccgcaccttaaaaccggiiiiiaaagcaatcgt;
[0010]
bpmv-dpor:acatgtttttcaaattcatgagciiiiittgcaagaac;
[0011]
其中,“i”表示次黄嘌呤。
[0012]
本发明同时提供所述的dpo-pcr引物对在制备南芥菜花叶病毒和/或菜豆荚斑驳病毒检测试剂盒中的应用。
[0013]
本发明还提供一种用于南芥菜花叶病毒和/或菜豆荚斑驳病毒检测的试剂盒,包括所述dpo-pcr引物对、阳性标准品、阴性对照品、pcr预混液和无核酸酶水。
[0014]
作为本发明所述试剂盒的优选实施方式,所述dpo-pcr引物对在体系中的浓度为0.1~0.6μmol/l。
[0015]
作为本发明所述试剂盒的优选实施方式,所述dpo-pcr引物对在体系中的浓度为0.2μmol/l。
[0016]
本发明还提供所述的试剂盒在检测南芥菜花叶病毒和/或菜豆荚斑驳病毒中的应用。
[0017]
作为本发明所述应用的优选实施方式,所述检测过程中退火温度为 45~65℃。
[0018]
作为本发明所述应用的优选实施方式,所述检测反应条件为42℃30min; 95℃3min;94℃30s,60℃45s,72℃1min,35个循环;72℃5min。。
[0019]
作为本发明所述应用的优选实施方式,所述检测包括将pcr扩增产物经2%琼脂糖凝胶电泳后在凝胶成像系统中成像分析的步骤。
[0020]
本发明的有益效果:
[0021]
(1)本发明建立了armv及bpmv的一步法双重dpo-rt-pcr检测方法,该方法具有特异性强、适用范围广的优点,适用南芥菜花叶病毒及菜豆荚斑驳病毒的快速筛检,具有较强的实用价值。
[0022]
(2)dpo引物因其特殊结构,引物间以及引物本身较少形成二级结构,同时其具有对退火温度的不敏感的优点。相较于普通pcr引物设计,dpo引物设计更为简便,同时构建反应体系时也无需对退火温度进行摸索,大大的降低了多重pcr引物设计难度。但应注意的是,dpo引物特异性较强,一旦有3个以上碱基错配就会导致扩增失败,同时,相对于普通引物,dpo引物长度更长,因此在进行引物设计时应通过genebank验证,确保选用目标基因的高度保守序列。
[0023]
(3)本发明实验过程中,进行cdna合成时,无论oligo dt primer、randomprimers还是dpo特异性引物,均难以获得满意的检测结果,这可能与本研究使用的阳性样本提取浓度不高或与dpo引物自身特性有关,有待进一步研究。因此,建议使用一步法进行相应病毒的dpo-rt-pcr检测,这也能有效降低在病毒筛查过程中的工作量,提高工作效率。
附图说明
[0024]
图1:一步法dpo-rt-pcr扩增结果图;注:m.marker ii dna marker; 1.bpmv;2.armv;3.bpmv+armv;4.空白对照。
[0025]
图2:dpo-pcr特异性实验结果图;注:m.marker ii dna marker;1. bpmv+armv;2.空白对照;3.bpmv;4.armv;5.torsv;6.sbmv;7. psv;8.trsv;9.mcmv;10.wsmv;11.mdmv;12.smv。
[0026]
图3:dpo-pcr灵敏度评价结果图;注:m.marker ii dna marker;1.空白对照;2~6.dna模板量依次为2、0.2、0.02、0.002、0.0002ng/μl。
[0027]
图4:dpo-pcr退火温度敏感性试验结果图;注:m.marker ii dna marker, 1~5退
火温度分别为45、50、55、60、65℃。
具体实施方式
[0028]
为更清楚地表述本发明的技术方案,下面结合具体实施例进一步说明,但不能用于限制本发明,此仅是本发明的部分实施例。
[0029]
实施例1材料与方法
[0030]
1.1材料及设备
[0031]
检测试剂:植物总rna提取试剂盒(dp432)、fastking一步法rt-pcr试剂盒(kr123)、marker ii dna marker(md102)购自tiangen公司;引物由生工生物工程(上海)股份有限公司合成;实验样品来源详见表1。
[0032]
主要设备:veriti pcr仪、nanodrop 2000核酸蛋白分析仪,美国thermofisher 公司;电泳仪、geldoc xr+凝胶成像系统,美国bio-rad公司。
[0033]
表1样品来源
[0034][0035][0036]
1.2实验方法
[0037]
1.2.1总rna的提取
[0038]
按照植物总rna提取试剂盒dp432的要求对表1中样品进行总rna提取,置于超低温冰箱中备用。
[0039]
1.2.2引物设计
[0040]
参考dpo引物设计方法和要求,根据南芥菜花叶病毒及菜豆荚斑驳病毒保守序列分别设计dpo-pcr引物(引物序列中的i代表次黄嘌呤)(表2)。
[0041]
表2引物序列
[0042][0043]
1.2.3一步法双重dpo-rt-pcr反应体系优化
[0044]
参照fastking一步法rt-pcr试剂盒(kr123)说明书建立反应体系。 2
×
fastking one step rt-pcr mastermix溶液25μl、25
×
rt-pcr enzyme mix 2 μl、引物(10μm)各1.25μl、rna模板各2μl,rnase-free ddh2o调节最终体积至50μl。
[0045]
反应条件为42℃30min;95℃3min;94℃30s,60℃45s,72℃1min,35个循环;72℃5min。pcr扩增产物经2%琼脂糖凝胶电泳后在凝胶成像系统中成像分析。
[0046]
1.2.4一步法双重dpo-rt-pcr特异性评价
[0047]
按照1.2.3中一步法dpo-rt-pcr反应体系,以1.2.1中提取的8个非目标样品总rna为模板,以南芥菜花叶病毒及菜豆荚斑驳病毒总rna为模板做阳性对照,以水为模板做阴性对照,对所建立的一步法dpo-rt-pcr反应体系的特异性进行评价。
[0048]
1.2.5一步法双重dpo-rt-pcr灵敏度评价
[0049]
以1.2.1方法提取的南芥菜花叶病毒及菜豆荚斑驳病毒总rna,分别用核酸蛋白分析仪标定浓度为20ng/μl,再按10倍梯度稀释为2ng/μl、0.2ng/μl、0.02 ng/μl、0.002ng/μl、0.0002ng/μl的模板浓度,共5个模板浓度,分别取1μl 作为模板按照1.2.3的方法进行灵敏度实验。
[0050]
1.2.6一步法双重dpo-rt-pcr体系退火温度敏感性实验
[0051]
按照1.2.3中dpo-pcr反应体系,将反应条件中的退火温度设定为45℃~65℃, 5℃为1个梯度共5个梯度,进行dpo-pcr扩增实验,产物经2%琼脂糖凝胶电泳后在成像系统中成像分析。
[0052]
1.2.7一步法双重dpo-rt-pcr体系对模拟样品的检测
[0053]
为验证样品基质对所建立的方法是否存在影响,利用本发明建立的方法对 10份实际样品及10份模拟样品进行检测,并与相应国家标准中rt-pcr检测方法进行比对,其中bpmv的rt-pcr检测选择gb/t 28063-2011附录d引物按 tiangen fastking一步法rt-pcr试剂盒要求进行、armv的rt-pcr检测选择 gb/t 28073-2011附录c引物按tiangen fastking一步法rt-pcr试剂盒要求进行。
[0054]
模拟样品的制备:将1瓶armv及bpmv阳性对照掺入2g已粉碎的阴性大豆样品中,充分混匀,取0.1g作为模拟样品。
[0055]
实际样本为挑选的皱缩、带病斑的大豆种子,经粉碎均匀后取0.1g作为待测样品。
[0056]
实施例2结果分析
[0057]
2.1一步法双重dpo-rt-pcr检测方法建立
[0058]
通过调整优化一步法dpo-rt-pcr反应体系,确定引物终浓度为0.2μmol/l 的时候扩增效果最佳,结果如图1所示,经琼脂糖凝胶电泳检测在217bp及800 bp处有特异性条带,与目的条带一致,表明本发明建立的一步法双重 dpo-rt-pcr可以运用于armv及bpmv两种病毒的检测。
[0059]
2.2一步法双重dpo-rt-pcr特异性评价
[0060]
如图2,仅含bpmv及armv的样品扩增获得目的条带,其余8个样品及空白对照未发生特异性扩增,表明所建立的一步法双重dpo-rt-pcr检测方法具有良好的特异性,可用于armv及bpmv两种病毒的检测。
[0061]
2.3一步法双重dpo-rt-pcr灵敏度评价
[0062]
如图3所示,当dna模板量在2ng/μl以上时,能得到较好的扩增效果,当dna模板量在0.02ng/μl时虽有扩增条带但是条带十分微弱,当dna模板量为0.002ng/μl及0.0002ng/μl未能获得扩增条带。表明本发明建立的一步法双重dpo-rt-pcr灵敏度可达0.02ng/μl。
[0063]
2.4一步法双重dpo-rt-pcr退火温度敏感性试验
[0064]
由图4可知,在本发明dpo-rt-pcr退火温度敏感性实验中,退火温度设定在45~65℃五个梯度,利用一步法双重dpo-rt-pcr检测体系均能高效扩增出目的基因,退火温度对扩增结果影响不明显。表明所建立的一步法双重 dpo-rt-pcr检测方法退火温度范围较宽并且对退火温度不敏感。
[0065]
2.5一步法双重dpo-rt-pcr对模拟样品检测结果
[0066]
如表3所示,分别利用一步法双重dpo-rt-pcr及rt-pcr对10份模拟样品及10份实际样品进行检测,两者检测结果一致,表明本发明建立的检测方法可以应用于实际样品的检测中。
[0067]
表3实际样品及模拟样品检测结果
[0068][0069]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



