生产戊基二羟基苯酸的方法与流程
 2021-02-02 01:02:15|
2021-02-02 01:02:15| 372|
372| 起点商标网
起点商标网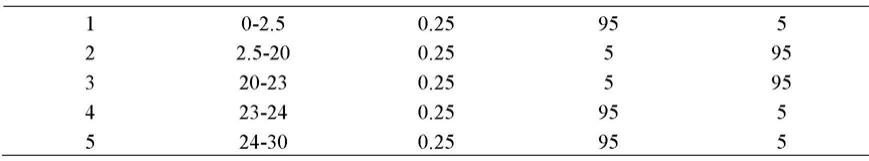
[0001]
本发明属于合成生物学领域,涉及生产戊基二羟基苯酸的方法,具体地是涉及重 组酿酒酵母生产戊基二羟基苯酸的方法。
背景技术:
[0002]
几千年来大麻由于其药用特性而在全球范围内种植和使用。一些大麻素——大麻 的标志性成分,及其类似物针对其潜在的医学应用已被广泛研究。在一些国家,某些 大麻素制剂已被批准作为处方药用于治疗各种人类疾病。然而,大麻素的结构复杂性 限制了大麻素的批量化学合成。戊基二羟基苯酸(olivetolic acid,oa)是大麻素生物 合成途径的初始中间体,当前提高大麻素的方法也包括提高oa的产量,但是现有技 术中一般用化学合成法合成oa,化学合成oa成本较高,有机试剂及强酸强碱使用量 大,对研究人员造成较大危害,且容易造成环境污染,不利于环境的可持续发展;同 时大麻的结构复杂性也限制了oa的批量化学合成。所以,如何产生高产量的大麻素 依旧是本领域当前的一大难题。
技术实现要素:
[0003]
据报道,有两种大麻酶,四酮化合物合酶(ols(cannabis sativa tks,cstks)) 和戊基二羟基苯酸环化酶(oac(cannabis sativa oac,csoac)),可以催化己酰基
ꢀ-
coa和丙二酰-coa产生戊基二羟基苯酸。
[0004]
所以,经过多年的研究,发明人发现通过将aae、ols和oac蛋白的编码基因 针对宿主(例如酿酒酵母(saccharomyces cerevisiae))进行密码子优化后,导入宿主 可以实现oa(戊基二羟基苯酸,olivetolic acid)的生物合成。
[0005]
具体地,本发明提供以下方面:
[0006]
[1].重组酿酒酵母,其由将aae、ols和oac蛋白的编码基因导入酿酒酵母 (saccharomyces cerevisiae)而制备。其中所述aae全称为endogenous acyl activating enzyme,是内源性酰基活化酶,ols为四酮化合物合酶,oac为戊基二羟基苯酸环化 酶,其中
[0007]
所述aae蛋白的编码基因优选来源于烟草(nicotiana tabacum)、荷花(nelumbo nucifera)、胡萝卜(daucus carota subsp.sativus)、大麻(cannabis sativa)、蓖麻(aae-ricinus communis)、苜蓿(medicago truncatula)或苹果(malus domestica),或是人工合成的, 优选地,其来源于烟草;
[0008]
所述ols蛋白的编码基因来源于大麻(cannabis sativa)、玫瑰木属(rhodamnia argentea)、蜜柑(citrus unshiu)、黄瓜(cucumis sativus)、蛇麻籽(humulus lupulus)或落 花生(arachis hypogaea),或是人工合成的,优选地,其来源于玫瑰木属;
[0009]
所述oac蛋白的编码基因来源于大麻(cannabis sativa)、三叶草(trifolium pratense)、 羽扇豆(lupinus albus)、大豆(glycine max)或木槿(hibiscus syriacus),或是人工合成的, 优选地,其来源于大麻。
[0010]
[2].项[1]所述的重组酿酒酵母,其中
[0011]
来源于烟草的所述aae蛋白的氨基酸序列如seq id no:1所示,优选地其编码 基因如seq id no:2所示;
[0012]
来源于荷花的所述aae蛋白的氨基酸序列如seq id no:3所示,优选地其编码 基因如seq id no:4所示;
[0013]
来源于胡萝卜的所述aae蛋白的氨基酸序列如seq id no:5所示,优选地其编 码基因如seq id no:6所示;
[0014]
来源于大麻的所述aae蛋白的氨基酸序列如seq id no:27所示,优选地其编码 基因如seq id no:28所示;
[0015]
来源于蓖麻的所述aae蛋白的氨基酸序列如seq id no:29所示,优选地其编码 基因如seq id no:30所示;
[0016]
来源于苜蓿的所述aae蛋白的氨基酸序列如seq id no:31所示,优选地其编码 基因如seq id no:32所示;
[0017]
来源于苹果的所述aae蛋白的氨基酸序列如seq id no:33所示,优选地其编码 基因如seq id no:34所示;
[0018]
来源于玫瑰木属的所述ols蛋白的氨基酸序列如seq id no:7所示,优选地其 编码基因如seq id no:8所示;
[0019]
来源于蜜柑的所述ols蛋白的氨基酸序列如seq id no:9所示,优选地其编码 基因如seq id no:10所示;
[0020]
来源于黄瓜的所述ols蛋白的氨基酸序列如seq id no:11所示,优选地其编码 基因如seq id no:12所示;
[0021]
来源于大麻的所述ols蛋白的氨基酸序列如seq id no:35所示,优选地其编码 基因如seq id no:36所示;
[0022]
来源于蛇麻籽的所述ols蛋白的氨基酸序列如seq id no:37所示,优选地其编 码基因如seq id no:38所示;
[0023]
来源于落花生的所述ols蛋白的氨基酸序列如seq id no:39所示,优选地其编 码基因如seq id no:40所示;
[0024]
来源于大麻的所述oac蛋白的氨基酸序列如seq id no:13、seq id no:15或 seq id no:17所示(分别对应oac1、oac2、oac1蛋白),优选地其编码基因分别 如seq id no:14、seq id no:16或seq id no:18所示;
[0025]
来源于三叶草的所述oac蛋白的氨基酸序列如seq id no:41所示,优选地其编 码基因如seq id no:42所示;
[0026]
来源于羽扇豆的所述oac蛋白的氨基酸序列如seq id no:43所示,优选地其编 码基因如seq id no:44所示;
[0027]
来源于大豆的所述oac蛋白的氨基酸序列如seq id no:35所示,优选地其编码 基因如seq id no:46所示;
[0028]
来源于木槿的所述oac蛋白的氨基酸序列如seq id no:47所示,优选地其编码 基因如seq id no:48所示。
[0029]
[3].项[1]-[2]中任一项所述的重组酿酒酵母,其中所述aae、ols和oac的编码 基因分别独立存在于一个表达盒上,或aae、ols和oac的编码基因中的两个编码 基因存在于
一个表达盒上并且第三个编码基因存在于另一个表达盒上,或三个全部存 在于一个表达盒上。
[0030]
[4].项[3]所述的重组酿酒酵母,其中所述表达盒包含启动子或含启动子的5
′-
utr 元件、增强子、3
′-
utr元件和/或终止子。
[0031]
[5].项[1]-[4]中任一项所述的重组酿酒酵母,其中所述酿酒酵母选自酿酒酵母 s288c、酿酒酵母w303、酿酒酵母by4742或酿酒酵母by4741。
[0032]
本发明中的酿酒酵母均可商购,例如购自中国普通微生物菌种保藏管理中心。
[0033]
在一个实施方案中,所述己酰基-coa也可以通过异源生物合成途径产生。在一个 实施方案中,可以在所述重组酿酒酵母基因组中进一步导入富养罗尔斯通氏菌的 rebktb编码基因、贪铜菌吊钩虫的cnpaah1编码基因、丙酮丁醇梭状芽胞杆菌的cacrt 编码基因和密闭螺旋体的tdter编码基因。
[0034]
[6].项[1]-[5]中任一项所述的重组酿酒酵母,其中所述酿酒酵母的基因组被整合了 分别来自富养罗尔斯通氏菌(ralstonia eutropha)、贪铜菌吊钩虫(cupriavidus necator)、 丙酮丁醇梭状芽胞杆菌(clostridium acetobutylicum)和密闭螺旋体(treponema denticola) 的β-酮硫解酶(beta-ketothiolase,bktb)、3羟基己二酰基辅酶a脱氢酶 (3-hydroxyadipyl-coa dehydrogenase,paah1)、钙网蛋白(calreticulin,crt)、反烯酰辅 酶a还原酶(trans-enoyl-coa reductase,ter)、蛋白的编码基因,优选地所述β-酮硫解 酶、3羟基己二酰基辅酶a脱氢酶、钙网蛋白、反烯酰辅酶a还原酶蛋白的编码基因 分别如seq id no:20、seq id no:22、seq id no:24、seq id no:26所示。优选 地上述编码基因通过同源重组于酿酒酵母yorcdelta15整合位点,催化乙酰基coa, 经过四步酶的催化产生己酰基coa。优选地所述β-酮硫解酶、3羟基己二酰基辅酶a 脱氢酶、钙网蛋白、反烯酰辅酶a还原酶蛋白的氨基酸序列分别如seq id no:19、 seq id no:21、seq id no:23、seq id no:25所示。
[0035]
[7].生产戊基二羟基苯酸(oa)的方法,其包括将如项[1]-[5]中任意一项所述的 重组酿酒酵母菌进行发酵。
[0036]
在对所述重组酿酒酵母发酵的过程中,可以增加己酰基-coa的供应量来提高oa 的产量,其中增加己酰基-coa的供应量也可以通过额外添加己酸(作为aae(来自大 麻的csaae1)的底物)来增加己酰基-coa的供应量。己酸可通过aae转化为己酰基
ꢀ-
coa。
[0037]
[8].项[7]所述的方法,其包括在发酵初始在发酵培养基中添加己酸,其中己酸的 终浓度为1mm-10mm,优选5mm。
[0038]
[9].生产戊基二羟基苯酸(oa)的方法,其包括将如项[6]所述的重组酿酒酵母菌进 行发酵。
[0039]
在一个实施方案中,发酵过程中所用的培养基为本领域对酿酒酵母发酵常用的培 养基,例如由下列物质组成:无氨基氮源、葡萄糖、核苷酸和l型氨基酸。
[0040]
在一个实施方案中,使用本发明的方法后,酿酒酵母中由本身不产生oa转变为 产生oa,oa产量约为20-999mg/l。
[0041]
在一个实施方案中,本发明的方法能够稳定地进行oa的生物合成,反应条件温 和,不污染环境,特异性好,能够实现结构复杂性大麻素类物质的合成。
[0042]
在一个实施方案中,本发明的重组酿酒酵母具有生长速度快、oa稳定合成且表 达
量高的优点,可以通过相对简单的方法条件发酵培养,易于实现并控制,成本低。 并可通过额外的途径增加己酸作为底物,增加了己酰基coa的产量,进一步增加了 oa的产量。
[0043]
在一个实施方案中,本发明提供的重组酿酒酵母还可以促进工业规模oa的生产, 用于生物制药以及医药化工领域,一般发酵厂的设备和条件均可实现,生产投资较少, 具有广阔的实际应用价值及前景。
[0044]
[10].来源于烟草(nicotiana tabacum)、荷花(nelumbo nucifera)、胡萝卜(daucus carota subsp.sahvus)、大麻(cannabis sativa)、蓖麻(aae-ricinus communis)、苜蓿 (medicago truncatula)或苹果(malus domestica),优选地,来源于烟草的内源性酰基 活化酶,
[0045]
来源于大麻(cannabis sativa)、玫瑰木属(rhodamnia argentea)、蜜柑(citrus unshiu)、 黄瓜(cucumis sativus)、蛇麻籽(humulus lupulus)或落花生(arachis hypogaea),优选地, 其来源于玫瑰木属的四酮化合物合酶,和
[0046]
来源于大麻(cannabis sativa)三叶草(trifolium pratense)、羽扇豆(lupinus albus)、 大豆(glycine max)或木槿(hibiscus syriacus)的戊基二羟基苯酸环化酶
[0047]
在制备戊基二羟基苯酸中的用途,优选地在酿酒酵母中制备戊基二羟基苯酸中的 用途。
[0048]
[11].项[10]所述的用途,其中
[0049]
来源于烟草的所述内源性酰基活化酶蛋白的氨基酸序列如seq id no:1所示,优 选地其编码基因如seq id no:2所示;
[0050]
来源于荷花的所述内源性酰基活化酶蛋白的氨基酸序列如seq id no:3所示,优 选地其编码基因如seq id no:4所示;
[0051]
来源于胡萝卜的所述内源性酰基活化酶蛋白的氨基酸序列如seq id no:5所示, 优选地其编码基因如seq id no:6所示;
[0052]
来源于大麻的所述aae蛋白的氨基酸序列如seq id no:27所示,优选地其编码 基因如seq id no:28所示;
[0053]
来源于蓖麻的所述aae蛋白的氨基酸序列如seq id no:29所示,优选地其编码 基因如seq id no:30所示;
[0054]
来源于苜蓿的所述aae蛋白的氨基酸序列如seq id no:31所示,优选地其编码 基因如seq id no:32所示;
[0055]
来源于苹果的所述aae蛋白的氨基酸序列如seq id no:33所示,优选地其编码 基因如seq id no:34所示;
[0056]
来源于玫瑰木属的所述四酮化合物合酶蛋白的氨基酸序列如seq id no:7所示, 优选地其编码基因如seq id no:8所示;
[0057]
来源于蜜柑的所述四酮化合物合酶蛋白的氨基酸序列如seq id no:9所示,优选 地其编码基因如seq id no:10所示;
[0058]
来源于黄瓜的所述四酮化合物合酶蛋白的氨基酸序列如seq id no:11所示,优 选地其编码基因如seq id no:12所示;
[0059]
来源于大麻的所述ols蛋白的氨基酸序列如seq id no:35所示,优选地其编码 基因如seq id no:36所示;
[0060]
来源于蛇麻籽的所述ols蛋白的氨基酸序列如seq id no:37所示,优选地其编 码基因如seq id no:38所示;
[0061]
来源于落花生的所述ols蛋白的氨基酸序列如seq id no:39所示,优选地其编 码基因如seq id no:40所示;
[0062]
来源于大麻的所述戊基二羟基苯酸环化酶蛋白的氨基酸序列如seq id no:13、 seq id no:15或seq id no:17所示,优选地其编码基因分别如seq id no:14、seq id no:16或seq id no:18所示;
[0063]
来源于三叶草的所述oac蛋白的氨基酸序列如seq id no:41所示,优选地其编 码基因如seq id no:42所示;
[0064]
来源于羽扇豆的所述oac蛋白的氨基酸序列如seq id no:43所示,优选地其编 码基因如seq id no:44所示;
[0065]
来源于大豆的所述oac蛋白的氨基酸序列如seq id no:35所示,优选地其编码 基因如seq id no:46所示;
[0066]
来源于木槿的所述oac蛋白的氨基酸序列如seq id no:47所示,优选地其编码 基因如seq id no:48所示。
[0067]
[12].如项[10]或[11]所述的用途,其中所述酿酒酵母选自酿酒酵母s288c、酿酒 酵母w303、酿酒酵母by4742或酿酒酵母by4741。
[0068]
本发明为生产天然和非天然大麻素提供了一个平台,这将允许对这些化合物进行 更严格的研究,并可用于开发各种人类健康问题的治疗方法。
附图说明
[0069]
图1显示了现有技术中预测的合成戊基二羟基苯酸的生物合成途径。
[0070]
图2显示实施例1所构建的重组酿酒酵母a的菌株形态照片。
[0071]
图3显示液相检测图。其中
[0072]
图3a显示oa对照品溶液的色谱图,对照品为1000mg/l、100mg/l、50mg/l 的oa对照品溶液,出峰时间为2.68min;
[0073]
图3b显示1000mg/l oa对照品溶液、样品1及样品2的拟合色谱图。
[0074]
图4显示实施例3所构建的重组酿酒酵母b的菌株形态照片。
[0075]
图5显示1000mg/l oa对照品溶液、样品3及样品4的拟合色谱图。
[0076]
图6显示1000mg/l oa对照品溶液、样品5及样品6的拟合色谱图。
[0077]
图7显示100mg/l oa对照品溶液、样品7及样品8的拟合色谱图。
[0078]
图8显示不同物种来源的aae基因活性比较,以大麻物种中ols和oac1基因 作为固定因素,比较不同来源aae基因催化产生oa的产量差异来表征aae基因催 化活性。
[0079]
图9显示不同物种来源的ols基因活性比较,以大麻物种中aae和oac1基因 作为固定因素,比较不同ols基因催化产生oa的产量差异来表征ols基因催化活 性。
[0080]
图10显示不同物种来源的oac基因活性比较,以大麻物种中aae和ols基因 作为固定因素,比较不同oac基因催化产生oa的产量差异来表征oac基因催化活 性。
[0081]
图11显示bktb、paah1、crt、ter基因在酿酒酵母by4741中的整合位点图谱。
具体实施方式
[0082]
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参 照附图,对本发明作进一步的详细说明。
[0083]
实施例1:构建重组酿酒酵母a
[0084]
将aae基因构建于ycplac22酵母表达载体(购自biovector中国质粒基因库), ols和oac基因构建于ycplac33载体(购自biovector中国质粒基因库),形成载体 y22-aae-leu和y33-ols(cstks)-oac-ura,将这两个载体共转染至酿酒酵母 s288c(购自中国普通微生物菌种保藏管理中心)中,得到重组酿酒酵母a。
[0085]
所述重组酿酒酵母a在ypd平板上为椭圆形,菌落形态特征是菌落凸起、光滑、 乳白色、边缘整齐,如图2(包含正面和背面),最适生长温度为30℃,ph为6.5。
[0086]
所述aae、ols和oac基因的核苷酸序列依次如源自烟草的seq id no:2、源 自玫瑰木属的seq id no:8、源自大麻的seq id no:14所示。
[0087]
实施例2:oa产量检测
[0088]
1、菌种活化扩大培养
[0089]
将实施例1得到的重组酿酒酵母a试管斜面保存,使用前需要将试管内保存的菌 种接种到cm-his-leu-ura平板培养基中活化,扩大培养。
[0090]
2、液体发酵培养
[0091]
液体发酵培养基配方为:(液体1l)6.7g ynb(yeast nitrogen base without aminoacids),20g葡萄糖,0.84g dropout powder,0.05g腺嘌呤,0.1g色氨酸,余量为水的 体积,ph调至5.6。250ml三角瓶,每瓶装100ml液体培养基,121℃,0.12-0.17mpa。 30min灭菌备用,以重量百分比计。
[0092]
挑取平板培养基中单菌落,接种到三角瓶液体培养基中,再额外添加己酸,至终 浓度5mm,置于摇床,30℃,220rpm培养(此处的培养等同于发酵,在小瓶中称为 培养,在发酵罐中则称为发酵)120h,同时以相同的条件发酵未添加外源基因的酿酒 酵母s288c。
[0093]
3、oa液相检测,包括如下步骤:
[0094]
1)对照品溶液的制备:精密称取oa 5mg(购自上海源叶生物科技有限公司),用 加色谱级甲醇溶解并稀释,即得1000mg/l、100mg/l、50mg/l的oa对照品溶液。
[0095]
2)样品溶液的制备:准确量取10ml od600约为7-8的液体发酵后的的重组酿酒 酵母a的培养基,加入2ml乙酸乙酯,振荡10min。静置待液体分层后,吸取1ml上 层溶液,在真空旋转蒸发仪中,60℃蒸干。使用100μl甲醇溶解获得的干物质,12000rpm, 离心20min,取上清,即得样品1,针对未添加外源基因的酿酒酵母s288c,以与获得 样品1相同的过程处理,得到样品2。
[0096]
3)将样品1、2以及oa对照品溶液分别进行色谱层析。色谱条件:使用c18柱, 流动相为a:1
‰
甲酸、b:甲醇,进样量10μl,流速0.25ml/min,检测波长280nm,柱 温30℃。
[0097]
4)梯度洗脱样品组方法如表1:(a为1
‰
甲酸、b为甲醇)
[0098]
表1oa液相梯度洗脱样品组方法
[0099]
[0100][0101]
5)检测结果如图3所示:
[0102]
由图3a-图3b可知,样品1和对照品出峰时间均为2.68min,一致,说明样品1 确实产出了oa;
[0103]
由图3b可知,在其他条件均相同时,未添加外源基因的s288c酿酒酵母的样品2 在2.68min处未出峰,说明没有产出oa,添加了外源基因的s288c酿酒酵母的样品1 峰面积为9225,约为850mg/l,说明外源基因的导入是s288c酿酒酵母酵母产oa的 原因。
[0104]
实施例3:重组酿酒酵母b的构建和oa产量检测
[0105]
将aae基因构建于ycplac22酵母表达载体,ols基因构建于ycplac33酵母表达 载体,oac基因构建于prs427-lys酵母表达载体(购自biovector ntcc典型培养物保 藏中心),形成载体y22-aae-leu和y33-ols(cstks)-ura,prs427-lys-oac将这 三个载体共转染至酿酒酵母w303(购自中国普通微生物菌种保藏管理中心)中,得到重 组酿酒酵母b。
[0106]
所述重组酿酒酵母b在ypd平板上为椭圆形,菌落形态特征是菌落凸起、光滑、 乳白色、边缘整齐,如图4(包含正面和背面),最适生长温度为30℃,ph为6.5。
[0107]
所述aae、ols和oac基因的核苷酸序列依次如源自胡萝卜的seq id no:6、 源自黄瓜的seq id no:12、源自大麻的seq id no:16所示。
[0108]
以实施例2相同的方法培养(本实施例中获得的重组酿酒酵母b的培养上清为样品 3,未添加外源基因的酿酒酵母w303的培养上清为样品4并测定oa产量,不同之处 仅在于,添加己酸至终浓度1mm。检测结果如图5所示。
[0109]
由图5可知,样品3和对照品oa出峰时间均为2.68min,一致,说明样品3与样 品4相比,确实产出了oa;
[0110]
由图5可知,在其他条件均相同时,未添加外源基因的样品4在2.68min处没有 出峰,说明没有产出oa,添加了外源基因的样品3峰面积为217,约为20mg/l,说 明外源基因的导入是酿酒酵母w303产oa的原因。
[0111]
实施例4:重组酿酒酵母c的构建及其oa产量检测
[0112]
将aae基因、ols基因和oac基因均构建于ycplac22酵母表达载体,形成载体 ycplac22-aae-ols-oac将这个载体共转染至酿酒酵母by4742(购自中国普通微生物 菌种保藏管理中心)中,得到重组酿酒酵母c。
[0113]
所述aae、ols和oac基因的核苷酸序列依次如源自荷花物种的seq id no:4、 源自蜜柑物种的seq id no:10、源自大麻物种的seq id no:18所示。
[0114]
所述重组酿酒酵母c在ypd平板上为椭圆形,菌落形态特征是菌落凸起、光滑、 乳白色、边缘整齐,最适生长温度为30℃,ph为6.5。
[0115]
以实施例2相同的方法培养(本实施例中获得的重组酿酒酵母c的培养上清为样品 5,未添加外源基因的酿酒酵母by4742的培养上清为样品6)并测定oa产量,不同之 处仅在于,添加己酸至终浓度10mm。
[0116]
检测结果如图6所示,样品5和对照品出峰时间一致,说明样品5确实产出了oa。
[0117]
在其他条件均相同时,未添加外源基因的样品6在对照品出峰的位置没有出峰, 说明没有产出oa,添加了外源基因的样品5峰面积为379,约为35mg/l,说明外源 基因的导入是酿酒酵母w303产oa的原因,同时,不同己酸浓度会对酵母的oa产 量有影响。
[0118]
实施例5重组酿酒酵母d的构建及其oa产量检测
[0119]
重组酿酒酵母的构建过程与实施例1相同,不同之处在于,上述重组酿酒酵母为 by4741(购自上海唯地生物技术有限公司),另外在菌株构建时候,在酿酒酵母by4741 整合位点yorcdelta15,以yorcdelta15为同源臂,用同源重组和醋酸锂转化的方法, 整合分别来自富养罗尔斯通氏菌、贪铜菌吊钩虫、丙酮丁醇梭状芽胞杆菌和密闭螺旋 体的bktb、paah1、crt、ter基因(如图11),这四个基因的编码序列分别如序列seq idno:20、seq id no:22、seq id no:24、seq id no:26所示。此四个基因可以通过 催化乙酰基coa,产生己酰基coa。得到重组酿酒酵母d。
[0120]
所述重组酿酒酵母d在ypd平板上为椭圆形,菌落形态特征是菌落凸起、光滑、 乳白色、边缘整齐,最适生长温度为30℃,ph为6.5。
[0121]
以实施例2相同的方法培养(本实施例中获得的酿酒酵母d的培养上清为样品7, 未添加外源基因的酿酒酵母by4741的培养上清为样品8)并测定oa产量。
[0122]
检测结果见图7,样品7和对照品出峰时间均为2.68min,一致,说明样品7确实 产出了oa。
[0123]
在其他条件均相同时,未添加外源基因的样品8在对照品出峰的位置没有出峰, 添加了外源基因的样品7峰面积为10842,约为999mg/l,说明外源基因的导入是酿 酒酵母by4741产oa的原因,并且整合四个基因之后的菌株的oa产量会更高。
[0124]
实施例6aae基因不同物种来源的功能比较
[0125]
生产aae的主要物种有大麻、烟草、荷花、胡萝卜、蓖麻(aae-ricinus communis)、 苜蓿(medicago truncatula)、苹果(malus domestica),各物种对应的aee的氨基酸序 列分别为
[0126]
seq id no:27、seq id no:1、seq id no:3、seq id no:5、seq id no:29、 seq id no:31、seq id no:33,将其编码核酸序列分别针对酿酒酵母进行密码子优 化,得到各自的优化后的编码核酸序列分别为
[0127]
seq id no:28、seq id no:2、seq id no:4、seq id no:6、seq id no:30、 seq id no:32、seq id no:34。
[0128]
重组酿酒酵母的构建过程与实施例3相同,不同之处在于,以大麻中ols和oac1 基因作为固定因子,将上述不同来源的aae基因插入ycplac22酵母表达载体,在酵 母by4741中表达,来比较不同aae基因催化作用下,产出oa的产量的区别,见图 8。可见催化产生oa的优选的aae基因来源为烟草。
[0129]
实施例7ols基因不同物种来源的功能比较
[0130]
生产ols的主要物种有大麻、玫瑰木属、蜜桔、黄瓜、蛇麻籽(humulus lupulus)、 落花生(arachis hypogaea),的氨基酸序列分别为各物种对应的ols的氨基酸序列分别 为seq id no:35、seq id no:7、seq id no:9、seq id no:11、seq id no:37、 seq id no:39,将其编码核酸序列分别针对酿酒酵母进行密码子优化,得到各自的优 化后的编码核酸序
列分别为seq id no:36、seq id no:8、seq id no:10、seq idno:12、seq id no:38、seq id no:40。
[0131]
重组酿酒酵母的构建过程与实施例3相同,不同之处在于,以大麻中aae和oac1 基因作为固定因子,将上述不同来源的ols基因插入ycplac33酵母表达载体,在酿 酒酵母by4741中表达,来比较不同ols基因催化作用下,产出oa的产量的区别, 见图9,可见催化产生oa的优选的ols基因来源为玫瑰木属。
[0132]
实施例8oac基因不同物种来源的功能比较
[0133]
生产oac的主要物种有大麻(大麻中有三个oac1,oac2,oac3,在图中对 应指示为大麻1、大麻2、大麻3)、三叶草(trifoliium pratense)、羽扇豆(lupinus albus)、 大豆(glycine max)、木槿(hibiscus syriacus),各物种对应的ols的氨基酸序列分别为 seq id no:13、seq id no:15、seq id no:17、seq id no:41、seq id no:43、 seq id no:45、seq id no:47,将其编码核酸序列分别针对酿酒酵母进行密码子优 化,得到各自的优化后的编码核酸序列分别为seq id no:14、seq id no:16、seq idno:18、seq id no:42、seq id no:44、seq id no:46、seq id no:48。
[0134]
重组酿酒酵母的构建过程与实施例3相同,不同之处在于,以大麻中ols和aae 基因作为固定因子,将上述不同来源的oac基因插入prs427-lys酵母表达载体,在 酵母by4741中表达,来比较不同oac基因催化作用下,产出oa的产量的区别,见 图10,可见催化产生oa的优选的oac基因来源为大麻。
[0135]
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详 细说明,应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明, 凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本 发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



