6-氧代-5,6-二氢菲啶-4-甲酰胺类化合物、制备方法、药物组合物及应用与流程
 2021-02-02 01:02:09|
2021-02-02 01:02:09| 266|
266| 起点商标网
起点商标网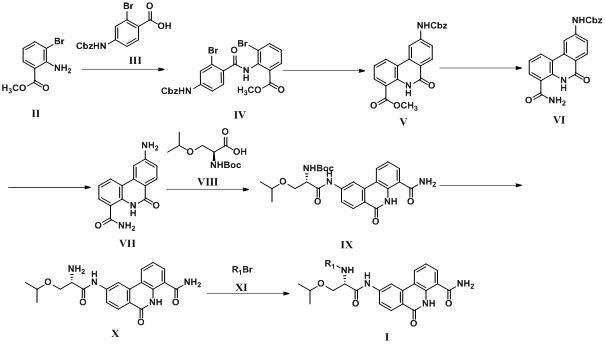
[0001]
本发明涉及6-氧代-5,6-二氢菲啶-4-甲酰胺类化合物、制备方法、药物组合物及应用,属于化学药物技术领域。
背景技术:
[0002]
丝氨酸/苏氨酸蛋白激酶akt是pi3k信号的关键传递者。akt在哺乳动物中有akt1、akt2和akt3三个亚型,分别由pkbα、pkbβ和pkbγ编码。akt由氨基末端ph部分、中央激酶cat部分和带有疏水基团的羧基末端三部分组成。多层磷酸化作用调控着akt的活化和稳定性。除了磷酸化的最佳活化位点thr308和ser473,akt1已经被实验确定的还有31个磷酸化位点,包括11个丝氨酸残基,14个苏氨酸残基和6个酪氨酸残基。akt2和akt3分别被确定有22个和18个磷酸化位点。磷酸化的akt会激活许多下游蛋白质,如mtor,gsk3,irs-1等。这些蛋白质控制着细胞生理和病理状态下的功能,包括细胞存活、生长、代谢、肿瘤发生和转移。哺乳动物雷帕霉素靶蛋白(mtor)是akt的一个关键下游信号分支,在细胞生长、增殖、运动、生存、蛋白质合成和转录中扮演着重要的角色,对肿瘤生成发挥了重要的作用。
[0003]
因此,发现一种结构新颖、活性高的akt抑制剂用于癌症靶向治疗具有重要意义。
技术实现要素:
[0004]
本发明提供了6-氧代-5,6-二氢菲啶-4-甲酰胺类化合物、制备方法、药物组合物及应用,所述6-氧代-5,6-二氢菲啶-4-甲酰胺类化合物通过抑制akt活性用于癌症靶向治疗,具体技术方案如下:所述6-氧代-5,6-二氢菲啶-4-甲酰胺类化合物具有如式ι所示的结构:其中,r1为取代或者不取代的苯环或芳杂环。
[0005]
所述6-氧代-5,6-二氢菲啶-4-甲酰胺类化合物选自下述式1-式20中的任一化合物,结构式如下:
式1式2式3式4
式5式6式7式8式9
式10式11式12式13式14
式15式16式17式18
式19式20。
[0006]
所述6-氧代-5,6-二氢菲啶-4-甲酰胺类化合物或其药学上可接受的盐的制备方法,包括如下步骤:步骤1)、式ii所示化合物与式iii所示化合物在碱和缩合剂的作用下于反应溶剂中进行反应,得到式iv所示化合物;反应温度为20℃-100℃,所述碱选自三乙胺、二异丙基乙胺(英文简称diea)、n-甲基吗啉中的至少一种,所述缩合剂选自1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐与1-羟基苯并三唑的混合溶液、2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(英文简称hatu)、o-苯并三氮唑-四甲基脲六氟磷酸酯中的至少一种,所述反应溶剂选自二氯甲烷、n,n-二甲基甲酰胺(英文简称dmf)、n,n-二甲基苯胺中的至少一种。
[0007]
步骤2)、式iv所示化合物、频哪醇硼酸酯(英文名称:pinacol borate)、催化剂、碱于反应溶剂中进行反应,得到式v所示化合物;反应温度为40℃-120℃,所述碱选自三乙胺、二异丙基乙胺、碳酸钾、碳酸铯、叔丁醇钠、叔丁醇钾、磷酸钾、醋酸钠中的至少一种,所述催化剂选自双(三苯基膦)二氯化钯(ii)、四(三苯基膦)钯、双(二亚芐基丙酮)钯、醋酸钯、1,1'-[双(二苯基膦基)二茂铁]二氯化钯(英文简称pd(dppf)cl2)中的至少一种,所述反应溶剂为甲苯、乙腈、二氧六环(英文名称:dioxane)、二甲基亚砜、二甲基甲酰胺、二甲基乙酰胺中的至少一种。
[0008]
在步骤2)的反应中,为了提高催化剂的活性,在反应体系中还可添加配体,所述配体选自三苯基膦、三丁基膦、2-双环己基膦-2',4',6'-三异丙基联苯、2-双环己基膦-2',6'-二甲氧基联苯、4,5-双二苯基膦-9,9-二甲基氧杂蒽中的至少一种。
[0009]
步骤3)、式v所示化合物、甲醇钠、甲酰胺于反应溶剂中进行反应,得到式vi所示化合物;反应温度为40℃-100℃,所述反应溶剂为n,n-二甲基甲酰胺。
[0010]
步骤4)、式vi所示化合物在钯碳(英文简称:pd-c)的作用下于反应溶剂中进行氢化反应,得到式vii所示化合物;反应温度为40℃-100℃,所述反应溶剂为甲醇、乙醇、四氢呋喃、二氧六环中的至少一种。
[0011]
步骤5)、式vii所示化合物、式viii所示化合物、缩合剂、碱于反应溶剂中进行反应,得到式ix所示化合物;反应温度为20℃-100℃,所述碱选自三乙胺、二异丙基乙胺、n-甲基吗啉中的至少一种,所述缩合剂选自1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐与1-羟基苯并三唑的混合溶液、2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯、o-苯并三氮唑-四甲基脲六氟磷酸酯中的至少一种,所述反应溶剂选自二氯甲烷、n,n-二甲基甲酰胺、n,n-二甲基苯胺中的至少一种。
[0012]
步骤6)、式ix所示化合物在酸作用下于反应溶剂中进行反应,得到式x所示化合物;反应温度为20-80℃,所述酸为三氟乙酸、氯化氢的乙酸乙酯溶液、氯化氢的乙醇溶液中的至少一种,所述反应溶剂为二氯甲烷、乙醇、乙酸乙酯中的至少一种。
[0013]
步骤7)、式x所示化合物、式xi所示化合物、催化剂、碱于反应溶剂中进行反应,得到式i所示化合物;反应温度为40℃-120℃,所述碱选自三乙胺、二异丙基乙胺、碳酸钾、碳酸铯、叔丁醇钠、叔丁醇钾、磷酸钾、醋酸钠中的至少一种,所述催化剂选自双(三苯基膦)二氯化钯(ii)、四(三苯基膦)钯、双(二亚芐基丙酮)钯、醋酸钯、1,1'-[双(二苯基膦基)二茂铁]二氯化钯中的至少一种,所述反应溶剂为甲苯、乙腈、二甲基亚砜、二甲基甲酰胺、二甲基乙酰胺中的至少一种。
[0014]
在步骤7)的反应中,为了提高催化剂的活性,在反应体系中还可添加配体,所述配体选自三苯基膦、三丁基膦、2-双环己基膦-2',4',6'-三异丙基联苯、2-双环己基膦-2',6'-二甲氧基联苯、4,5-双二苯基膦-9,9-二甲基氧杂蒽中的至少一种。
[0015]
一种药物组合物,包括:所述6-氧代-5,6-二氢菲啶-4-甲酰胺类化合物或其药学上可接受的盐,以及一种或多种药学上可接受的载体或稀释剂。
[0016]
所述6-氧代-5,6-二氢菲啶-4-甲酰胺类化合物或其药学上可接受的盐在制备治疗或预防肿瘤的药物中的应用。
[0017]
作为上述技术方案的改进,所述肿瘤选自皮肤癌、膀胱癌、卵巢癌、乳腺癌、胃癌、前列腺癌、结肠癌、肺癌、骨癌、脑癌、直肠癌、食管癌、舌癌、肾癌、肾实质癌、宫颈癌、子宫体癌、子宫内膜癌、睾丸癌、泌尿癌、黑素癌、星型细胞癌、脑膜瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、急性淋巴性白血病、慢性淋巴性白血病、急性骨髓性白血病、慢性粒细胞白血病、成人t细胞白血病淋巴瘤、肝细胞癌、支气管癌、小细胞肺癌、非小细胞肺癌、多发性骨髓瘤、基底细胞瘤、精原细胞瘤、软骨肉瘤、肌肉瘤、纤维肉瘤中的任一种。
[0018]
本发明的有益效果:1)、本发明涉及6-氧代-5,6-二氢菲啶-4-甲酰胺类化合物、立体异构体、药学上可接受的盐、水合物、溶剂化物以及含有这些化合物作为活性成分的药物组合物作为akt激酶抑制
剂用于治疗肿瘤;可以通过向需要此种治疗或预防的患者给予治疗有效量的一种或者多种本发明所述6-氧代-5,6-二氢菲啶-4-甲酰胺类化合物达到治疗的目的。
[0019]
2)、本发明所述6-氧代-5,6-二氢菲啶-4-甲酰胺类化合物的合成方法,合成反应过程中,副产物少,收率高,具有极大的应用价值。
具体实施方式
[0020]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0021]
定义“药学上可接受的盐”是指那些保留母体化合物的生物有效性及特性的盐。该盐包括:酸加成盐,其是通过母体化合物的游离碱与无机酸或与有机酸的反应而获得的;所述无机酸诸如盐酸、氢溴酸、氢碘酸、硝酸、磷酸、硫酸及高氯酸等;所述有机酸诸如乙酸、草酸、(d)或(l)苹果酸、马来酸、甲烷磺酸、乙烷磺酸、对甲苯磺酸、水杨酸、酒石酸、苯磺酸(苯磺酸盐)、苯甲酸、樟脑磺酸、柠檬酸、富马酸、葡萄糖酸、谷氨酸、羟乙磺酸、乳酸、马来酸、扁桃酸、黏液酸、双羟萘酸、泛酸、琥珀酸、酒石酸或丙二酸等;优选为盐酸或(l)-苹果酸;或者当母体化合物中存在的酸质子被置换为金属离子或与有机碱配位时,形成盐,所述金属离子例如碱金属离子、碱土金属离子或铝离子;所述有机碱诸如乙醇胺、二乙醇胺、三乙醇胺、缓血酸胺、n-甲基葡糖胺及类似物。
[0022]“取代”是指分子中的1个、2个或多个氢原子被其它不同的原子或分子所替换,包括该分子中同位原子或异位原子上的1个、2个或多个取代。“芳杂环”即“芳香杂环”,是具有平种结构特点的杂环,其环中原子构成一个环闭的共轭体系,分子呈平面型,此平面上下两侧有环状的离域电子云,共轭体系中的p电子数都符合休克尔规则。例如吡啶、呋喃环、噻唑环、嘧啶环等等。
[0023]
本发明的化合物可具有一个或多个不对称中心;该化合物因此可以个别(r)-立体异构体或(s)-立体异构体形式制备或以其混合物形式制备。除非另有说明,否则本说明书及权利要求中的特定化合物的描述或名称意欲包括个别对映异构体与其外消旋混合物或其它混合物。用于测定立体化学构型及分离立体异构体的方法在本领域中是熟知的(参见"advanced organic chemistry"的第4章中的论述,第4版,j. march,john wiley及sons,new york,1992)。因此,本发明亦涵盖具有抑制vegfr活性的任何立体异构形式、其相应对映异构体(d-异构体及l-异构体或(+)异构体及(-)异构体)及其非对映异构体及其混合物且不限于任一种立体异构形式。
[0024]
实施例1如式1所示的化合物:(s)-9-(2-((3-氟苯基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法,反应式如下:
第一步:将化合物1a(68.7g,300.0mmol)、化合物1b(104.7g,300.0mmol)、二异丙基乙胺(58.1g,450.0mmol)、hatu(171.0g,450.0mmol)溶于dmf(600ml)中,室温搅拌反应5小时,tlc监测反应,反应完毕后加入水(400ml)淬灭反应,加入乙酸乙酯(500ml
×
2)提取,合并有机层,干燥、浓缩、柱层析分离得到类白色固体123.4g(化合物1c),收率为73.5%。
[0025]
第二步:将化合物1c(123.0g,219.6mmol)、频哪醇硼酸酯(55.8g,219.6mmol)、pd(dppf)cl2(7.3g,11.0mmol)、碳酸钾(60.7g,440.0mmol)溶于二氧六环(500ml)中,升温至100℃保温反应10小时,tlc监测反应,反应完毕后加水(500ml)淬灭反应,用乙酸乙酯(500ml
×
2)提取,合并有机层,有机层干燥,浓缩,柱层析分离得到淡黄色固体65.7g(化合物1d),收率74.4%。
[0026]
第三步:将化合物1d(65.0g,161.7mmol)、甲酰胺(29.1g,646.8mmol)、甲醇钠(34.9g,646.8mmol)溶于dmf(300ml)中,升温至60℃保温反应8小时,tlc监测反应,反应完毕后加水(500ml)淬灭反应,用乙酸乙酯(500ml
×
2)提取,合并有机层,有机层干燥,浓缩,柱层析分离得到淡黄色固体41.2g(化合物1e),收率65.8%。
[0027]
第四步:将化合物1e(41.0g,105.9mmol)、钯碳(4g)置于甲醇(400ml)中,氢气置换3次后室温下搅拌反应10小时,tlc监测反应,反应结束后过滤,浓缩得到类白色固体20.8g(化合物1f),收率为77.6%(产物未经纯化,直接用于下一步反应)。
[0028]
第五步:将化合物1f(20.0g,79.1mmol)、化合物1g(19.5g,79.1mmol)、二异丙基乙胺(15.3g,118.7mmol)、hatu(45.1g,118.7mmol)溶于dmf(100ml)中,室温搅拌反应5小时,tlc监测反应,反应完毕后加入水(100ml)淬灭反应,加入乙酸乙酯(300ml
×
2)提取,合并有机层,干燥、浓缩、柱层析分离得到类白色固体30.1g(化合物1h),收率为79.0%。
[0029]
第六步:将化合物1h(30.0g,62.2mmol)溶于乙酸乙酯(300ml)中,室温下加入氯化氢的乙酸乙酯溶液(100ml,3mol/l),搅拌反应过程中析出白色固体,反应6小时后,过滤,滤饼干燥得到类白色固体22.9g(化合物1i),收率为88.0%。
[0030]
第七步:将化合物1i(418mg,1.0mmol)、化合物1j(173mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体212mg(化合物1),收率为44.5%,esi(+) m/z=477.2。
[0031]
实施例2如式2所示的化合物:(s)-9-(2-((3-氯苯基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:式2将化合物1i(418mg,1.0mmol)、3-氯溴苯(190mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体189mg(化合物2),收率为38.4%。esi(+) m/z=493.2。
[0032]
实施例3如式3所示的化合物:(s)-9-(2-((3-甲氧基苯基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:式3将化合物1i(418mg,1.0mmol)、3-甲氧基溴苯(186mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体231mg(化合物3),收率为47.3%。esi(+) m/z=489.2。
[0033]
实施例4如式4所示的化合物:(s)-9-(2-((3-氰基苯基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:
式4将化合物1i(418mg,1.0mmol)、3-氰基溴苯(181mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体245mg(化合物4),收率为50.7%。esi(+) m/z=484.2。
[0034]
实施例5如式5所示的化合物:(s)-9-(2-((3-氨基羰基苯基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:式5将化合物1i(418mg,1.0mmol)、3-氨基羰基溴苯(199mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体208mg(化合物5),收率为41.5%,esi(+) m/z=502.2。
[0035]
实施例6如式6所示的化合物:(s)-9-(2-((4-氟苯基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:式6
将化合物1i(418mg,1.0mmol)、4-氟溴苯(174mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体228mg(化合物6),收率为47.9%,esi(+) m/z=477.2。
[0036]
实施例7如式7所示的化合物:(s)-9-(2-((4-氯苯基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:式7将化合物1i(418mg,1.0mmol)、4-氯溴苯(190mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体241mg(化合物7),收率为49.0%,esi(+) m/z=493.2。
[0037]
实施例8如式8所示的化合物:(s)-9-(2-((4-甲氧基苯基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:式8将化合物1i(418mg,1.0mmol)、4-甲氧基溴苯(186mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体200mg(化合物8),收率为41.0%,esi(+) m/z=489.2。
[0038]
实施例9如式9所示的化合物:(s)-9-(2-((4-氰基苯基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:
式9将化合物1i(418mg,1.0mmol)、4-氰基溴苯(181mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体238mg(化合物9),收率为49.3%,esi(+) m/z=484.2。
[0039]
实施例10如式10所示的化合物:(s)-9-(2-((4-氨基羰基苯基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:式10将化合物1i(418mg,1.0mmol)、4-溴苯甲酰胺(199mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体260mg(化合物10),收率为51.9%,esi(+) m/z=502.2。
[0040]
实施例11如式11所示的化合物:(s)-9-(2-((3,4-二氟苯基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:式11将化合物1i(418mg,1.0mmol)、3,4-二氟溴苯(192mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测
反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体266mg(化合物11),收率为53.8%,esi(+) m/z=495.2。
[0041]
实施例12如式12所示的化合物:(s)-9-(2-((3-氯-4-氟苯基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:式12将化合物1i(418mg,1.0mmol)、4-溴-2-氯-1-氟苯(208mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体235mg(化合物12),收率为46.1%,esi(+) m/z=511.2。
[0042]
实施例13如式13所示的化合物:(s)-9-(2-((3-甲氧基-4-氟苯基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:式13将化合物1i(418mg,1.0mmol)、4-溴-1-氟-2-甲氧基苯(204mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体255mg(化合物13),收率为50.4%,esi(+) m/z=507.2。
[0043]
实施例14如式14所示的化合物:(s)-9-(2-((3-氰基-4-氟苯基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:
式14将化合物1i(418mg,1.0mmol)、5-溴-2-氟苯甲腈(199mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体244mg(化合物14),收率为48.7%,esi(+) m/z=502.2。
[0044]
实施例15如式15所示的化合物:(s)-9-(2-((3-氨基羰基-4-氟苯基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:式15将化合物1i(418mg,1.0mmol)、5-溴-2-氟苯甲酰胺(217mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体219mg(化合物15),收率为42.2%,esi(+) m/z=520.2。
[0045]
实施例16如式16所示的化合物:(s)-9-(2-((2-氟吡啶-4-基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:式16
将化合物1i(418mg,1.0mmol)、4-溴-2-氟吡啶(175mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体248mg(化合物16),收率为52.0%,esi(+) m/z=478.2。
[0046]
实施例17如式17所示的化合物:(s)-9-(2-((3-乙酰氨基苯基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:式17将化合物1i(418mg,1.0mmol)、n-(3-溴苯基)乙酰胺(213mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体267mg(化合物17),收率为51.8%,esi(+) m/z=516.2。
[0047]
实施例18如式18所示的化合物:(s)-9-(2-((2-甲氧基吡啶-4-基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:式18将化合物1i(418mg,1.0mmol)、4-溴-2-甲氧基吡啶(187mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体255mg(化合物18),收率为52.1%,esi(+) m/z=490.2。
[0048]
实施例19如式19所示的化合物:(s)-9-(2-((3-二甲基氨基苯基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:
式19将化合物1i(418mg,1.0mmol)、3-溴-n,n-二甲基苯胺(199mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体280mg(化合物19),收率为55.9%,esi(+) m/z=502.2。
[0049]
实施例20如式20所示的化合物:(s)-9-(2-((2-氨基羰基吡啶-4-基)氨基)-3-异丙氧基丙酰基氨基)-6-氧代-5,6-二氢菲啶-4-甲酰胺的制备方法如下:式20将化合物1i(418mg,1.0mmol)、4-溴吡啶-2-甲酰胺(200mg,1.0mmol)、pd(dppf)cl2(73mg,0.1mmol),k2co3(276mg,2.0mmol)溶于dmf(20ml)中,升温至80℃搅拌反应10小时,tlc监测反应,反应完毕后,加水(20ml)淬灭反应,用乙酸乙酯(50ml
×
2)提取,有机层干燥、浓缩、柱层析分离得到类白色固体222mg(化合物20),收率为44.2%,esi(+) m/z=503.2。
[0050]
实施例21生物学评价akt激酶体外活性测试的实验方法:在96孔板中先后加入10μl反应溶液、10μl akt激酶、10μl底物、10μl待测化合物溶液、10μl latp溶液,混匀后孵育30分钟;然后在每个孔板中加入10μl激酶反应终止液,接着在每个孔板中加入10μl磷酸-组蛋白h3抗体,在25℃孵育60分钟后加入100μl lhrp-抗体螯合剂溶液,在25℃孵育60分钟,继而加入100μl tmb底物于25℃孵育10分钟,最后在每个孔板中加入100μl elisa终止液,用酶联免疫监测仪记录450nm的读数,以不加药物的溶剂作为空白对照,通过计算得到ic
50
,具体数据如下表所示:a<50nm,50nm≤b≤500nm,500nm<c;实施例ic
50
(akt)实施例ic
50
(akt)
化合物1b化合物11a化合物2a化合物12b化合物3b化合物13a化合物4c化合物14b化合物5a化合物15c化合物6c化合物16c化合物7a化合物17a化合物8c化合物18b化合物9b化合物19b化合物10c化合物20b在上述实施例中,化合物1是指如式1所示化合物,化合物1a是指如式1a所示化合物,以此类推。
[0051]
在该实施例中,含有如式1-20所示化合物作为活性成分的药物组合物作为akt激酶抑制剂用于治疗肿瘤。其中,如式4所示化合物、如式6所示化合物、如式8所示化合物、如式10所示化合物、如式15所示化合物、如式16所示化合物对akt激酶的抑制活性相对较差;剩余的化合物用作akt激酶的抑制剂,活性良好;尤其是如式2所示化合物、如式5所示化合物、如式7所示化合物、如式11所示化合物、如式13所示化合物、如式17所示化合物的活性最高。
[0052]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



