海胆鞘氨醇单胞菌N-LY-1及其用途的制作方法
 2021-02-02 01:02:56|
2021-02-02 01:02:56| 278|
278| 起点商标网
起点商标网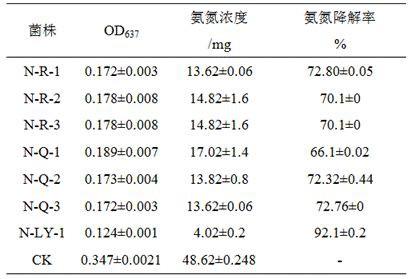
海胆鞘氨醇单胞菌n-ly-1及其用途
技术领域
[0001]
本发明涉及一种菌株,特别是一种海胆鞘氨醇单胞菌(sphingomonas echinoides)n-ly-1。本发明还涉及该菌株的用途。
背景技术:
[0002]
目前,我国水环境的污染状况长期超过其环境容量,水体功能逐渐退化,水富营养化问题引起了广泛关注。排放的生活污水还有大量的氮、磷元素,日积月累导致藻类等生物在水体中大量繁殖生长,湖泊、河流以及水产养殖水质呈现富营养化的趋势,随着经济和工农业的高速发展,人们越发忽视了对环境的保护,导致了现在环境污染越来越多样化,我国畜牧业、渔业等排出未经处理的养殖废水也含有大量的氮磷、亚硝酸盐等影响水体质量的物质,2013年我国畜禽粪便就产生了31.90亿吨在水产养殖中,主要是氮元素的污染,对水产养殖业用水的污染俨然成为亟待解决的问题,水产养殖业受到的污染比起农业,传播速度更快、范围更广,而如何找寻一种能够将氮元素安全、有效地去除或者转化这是水产养殖用水污染问题解决的关键。氮元素的污染主要是氨氮和亚硝酸盐的污染,被污染的水体,影响了养殖水生动物的生长。水产养殖业对水质的关注度越来越高,养殖之前,需了解水质的情况,并采取一定的措施调节水质,使水质更加适应养殖水生生物的需要。目前,有多种方法控制亚硝态氮、氨氮的污染,通过加注新水、曝气、漂白粉或臭氧氧化、使用斜发沸石进行等离子交换等方法调节改善水产养殖用水,但这些较为传统的方法不仅降解速度慢,而且还会带来新污染,局限性太大,脱氮效果不理想。而生物治理方法是一种消除水体内源性污染的长期有效的措施,水生动植物的生命代谢过程中对水体中的氮、亚硝酸盐、磷等加以利用,受到国内外专家的广泛认可,在富营养化水体的众多修复中有着较为广阔的应用前景。这些生物处理法相较于传统的物理处理法更安全、效率更高,但这些传统的生物处理方法稳定性较低,对水质的净化作用并没有如预想的好,随着对生物脱氮技术的深入研究,从传统的生物处理方法找寻到了一种微生物脱氮的方法,利用微生物互生、辅助作用等生理特性,将微生物进行筛选、扩增、放大培养制成相应的微生物菌剂,投放到水体当中,生物脱氮通常用的菌剂是硝化细菌制剂既安全无害又经济实惠,也是近年来,专家们研究的热点。生物脱氮的核心步骤在于硝化作用和反硝化作用,这也是氮元素在水体中循环的关键步骤。
[0003]
早些年的研究表明,自养型硝化细菌在生物脱氮中扮演着及其重要的角色,通过硝化和反硝化2个过程,降解亚硝酸盐和氨氮,但由于自养型的硝化细菌繁殖周期长,生长速度较为缓慢,难以维持稳定性,这些客观存在的因素对硝化作用的效果产生了一定的影响。现如今,异养型硝化细菌和反硝化细菌要比自养型硝化细菌生长速率更快、更稳定,经近年研究表明,硝化杆菌属(nitrobacte)、亚硝化单胞菌属(nitro-somonas communis)、纤维单胞菌属(cellulomonas)、假单胞菌属、亚硝化单胞菌菌属 ( nitrosomonas sp.)等异养微生物也有很强的硝化作用。,陆洪省等利用硝化细菌分离培养基从活性污泥中分离出硝化杆菌属菌株n-2具有高效利用亚硝态氮的能力,为生物脱氮提供了理论依据和实际参考;石笛等从海水样品中分离出1株亚硝化单胞菌属(nitro-somonas communis)菌株
gw201210能够将氨氮氧化为亚硝酸盐,实现亚硝化的作用,对降解海水中的氨氮具有一定参考价值;周冬仁等采用亚硝酸盐氧化细菌(nitrite-oxidizing bacteria)富集、分离技术从湖州某水域活性污泥中分离得到一株纤维单胞菌属(cellulomonas)n3,能够降解亚硝基氮,进一步揭示了硝化细菌族群广泛,是很好的生物脱氮研究对象;赵彭年等从海洋污泥中分离出一株亚硝化细菌鉴定为亚硝化单胞菌菌属 ( nitrosomonas sp.),通过发酵工艺,提高了硝化细菌的硝化速度,为污水处理方面提供了理论依据,对后续工业化处理污水起到了一定的指导作用。
[0004]
所以,研究获得可用于水体污染治理的海洋乳酸菌具有重要的意义。
技术实现要素:
[0005]
本发明所要解决的技术问题是针对现有技术的不足,提供一种新的海胆鞘氨醇单胞菌(sphingomonas echinoides)n-ly-1,该菌株n-ly-1具有很好的降解氨氮、降解亚硝酸盐的作用。
[0006]
本发明所要解决的另一个技术问题是提供了海胆鞘氨醇单胞菌(sphingomonas echinoides)n-ly-1菌株的筛选方法。
[0007]
本发明所要解决的又一个技术问题是提供了海胆鞘氨醇单胞菌(sphingomonas echinoides)n-ly-1菌株的用途。
[0008]
本发明所要解决的技术问题是通过以下的技术方案来实现的。本发明是一种海胆鞘氨醇单胞菌(sphingomonas echinoides)n-ly-1,其特点是:其保藏号为cctcc no: m 2020653。
[0009]
本发明所涉及的海胆鞘氨醇单胞菌(sphingomonas echinoides) n-ly-1菌株,已于2020年10月29日保藏在中 国 典 型 培 养 物 保 藏 中 心cctcc,其保藏号为:cctcc no: m 2020653,电话:027)8768 2319 传真:(027)8788 3833e-mail:cctcc@whu.edu.cn 地址:武汉,武汉大学;邮编:430072。
[0010]
n-ly-1菌株是本发明人通过硝化细菌分离培养基从连云港海域高公岛鲈鱼肠道内中分离获得的一种较稳定的菌株,发明人采用靛酚蓝分光光度法、盐酸萘乙二胺分光光度法测定硝化细菌n-ly-1具有一定降解氨氮、亚硝酸盐的能力,并通过形态学观察、生理生化试验和16srna基因序列分析对菌株进行鉴定,为水产养殖水污染治理提供一定的参考。
[0011]
本发明海胆鞘氨醇单胞菌(sphingomonas echinoides)n-ly-1的筛选方法,其步骤如下:(1)分离培养:从不同海域采集海水、海泥、动物组织28个样品,取水样或泥样10 ml或10g,动物内脏用无菌水清洗后加入无菌生理盐水研磨后取适量,接入装有100 ml硝化细菌富集培养基的250 ml三角瓶中,置于30℃下180 r/min培养4d;28个样品中,在含(nh4)2so4和nano2作氮源或能源的培养基上中7个样品中长出了菌落,能够还原硝酸盐和亚硝酸盐,菌株分别为n-r-1,n-r-2,n-r-3,n-q-1,n-q-2,n-q-3和n-ly-1;(2)硝化细菌的分离纯化:用无菌水将上述的富集培养液依次稀释成10-1
、10-2
、10-3
、10-4
共4个梯度,分别吸取各个稀释度样品100μl,涂布于硝化细菌筛选培养基平板上,每个样品3个平板,28℃,培养72h,长出的菌落进行三区划线纯化至单菌落,接种于牛肉膏蛋白胨斜面低温保藏;
(3)降解氨氮硝化细菌的筛选:将硝化细菌不同菌株在牛肉膏蛋白胨培养基斜面上活化,28℃恒温培养24h,菌体用0.85%生理盐水制备菌悬液,吸取2ml分别接种到装有60ml氨氮测定培养基和亚硝酸盐测定培养基的250ml三角瓶中,28℃、180 r/min摇床培养48h,发酵液于4℃、8000r/min条件下离心10min,采用靛酚蓝分光光度法测定不同菌株上清液的od
637
,根据标准曲线计算不同菌株发酵液中的氨氮浓度,以未接种的筛选培养基作为对照,计算不同菌株的氨氮降解率;每个菌株活化后接种至氨氮降解率测定培养基中为一处理,每处理3重复;筛选出氨氮浓度为50mg/l时降解率为92.1%的硝化细菌n-ly-1;(4)降解亚硝酸盐硝化细菌的筛选:将硝化细菌不同菌株在牛肉膏蛋白胨培养基斜面上活化,28℃恒温培养24h,菌体用0.85%生理盐水制备菌悬液5
×
107cfu / ml,吸取2ml到装有60ml亚硝酸盐测定培养基的三角瓶中,28℃、180 r/min摇床培养48h,为待测发酵液。吸取3ml发酵液于5ml离心管中,4℃、8000r/min条件下离心10min,采用盐酸萘乙二胺分光光度法测定不同菌株上清液的od
637
,根据标准曲线计算不同菌株发酵液中的亚硝酸盐浓度,以未接种的筛选培养基作为对照,计算不同菌株的亚硝酸盐降解率;筛选出亚硝酸盐降解率为14.8%的硝化细菌n-ly-1;(4)菌株鉴定:将菌株n-ly-1的16s rrna基因测序结果与ncbi中同源序列进行比对,其与sphingomonas echinoides海胆鞘氨醇单胞菌的序列同源性为98.53%,确定菌株n-ly-1为海胆鞘氨醇单胞菌。
[0012]
1、本发明还公开了所述的海胆鞘氨醇单胞菌(sphingomonas echinoides)n-ly-1的用途,所述的用途为将海胆鞘氨醇单胞菌(sphingomonas echinoides)n-ly-1菌株或者其发酵液用作降解氨氮与/或降解亚硝酸盐的菌剂。菌株n-ly-1对氨氮和亚硝酸盐的降解作用实现方法如下:将菌株n-ly-1种子液离心后用生理盐水洗涤三次,调节浓度至108cfu/ml,按8%的接种量分别接种到装入300ml氨氮浓度为50mg/l氨氮降解培养基和亚硝酸盐浓度为50mg/l的亚硝酸盐降解培养基500ml三角瓶中,充分混匀,分装到试管中,每管6ml,28℃、180r/min条件下摇床振荡培养,每隔4h取样一次,分别测定不同培养时间发酵液的菌体密度和氨氮浓度及亚硝酸盐浓度,计算氨氮和亚硝酸盐的降解率,每次取样3管,为3次重复;海胆鞘氨醇单胞菌(sphingomonas echinoides)n-ly-1在4-52h期间随着菌体密度增加,氨氮和亚硝酸盐降解率逐渐提高,52h时降解率分别为95.0%和77.3%。
[0013]
与现有技术相比,本发明具有以下有益效果:本发明是利用硝化细菌分离培养基从连云港海域海水中分离获得的n-ly-1菌株,其具有较好的稳定性,菌株采用靛酚蓝分光光度法、盐酸萘乙二胺分光光度法测定硝化细菌n-ly-1具有一定降解氨氮、亚硝酸盐的能力,可以用于水产养殖水的污染治理。
附图说明
[0014]
图1为标准氨氮的工作曲线图;图2为7株硝化细菌对亚硝酸盐降解率;图3为亚硝酸盐氮标准工作曲线(250 mg/l)图;图4为n-ly-1菌落图;图5为n-ly-1菌株显微镜下形态(
×
1000)图;
图6为n-ly-1系统发育树;图7为不同培养时间n-ly-1菌株的生长量及发酵液中氨氮浓度和降解率图;图8为不同培养时间n-ly-1菌株生长量及发酵液中亚硝酸盐浓度及其降解率图。
具体实施方式
[0015]
以下进一步描述本发明的具体技术方案,以便于本领域的技术人员进一步地理解本发明,而不构成对其权利的限制。
[0016]
实施例1,海胆鞘氨醇单胞菌(sphingomonas echinoides)n-ly-1菌株的筛选:1材料与方法1.1 试验材料1.1.1 培养基(1)硝化细菌富集培养基:葡萄糖5.0g,(nh4)2so
4 2.0g,nano
2 2.0g,nacl 1.0 g,feso4·
7h2o 0.4g,k2hpo
4 1.0 g,kh2po
4 0.4g,mgso4·
7h2o 0.5 g,蒸馏水定容至1000ml,调ph 7.2~7.5。
[0017]
(2)硝化细菌筛选培养基:富集培养基加入2%的琼脂。
[0018]
(3)牛肉膏蛋白胨培养基:牛肉膏3.0g,蛋白胨10.0g,nacl 5.0g,琼脂20g,水1000ml,ph 7.0~7.2。
[0019]
(4)氨氮降解培养基:(nh4)2so40.236g,蔗糖5.0g,nacl 1.0 g,feso4·
7h2o 0.4g,k2hpo
4 1.0 g,kh2po
4 0.4g,mgso4·
7h2o 0.5 g,蒸馏水定容至1000ml,调ph 7.2~7.5,初始氨氮含量以50mg/l加入。
[0020]
(5)亚硝酸盐降解培养基:nano
2 1.232g,蔗糖5.0g,feso4·
7h2o 0.4g,k2hpo
4 1.0 g,kh2po
4 0.4g,mgso4·
7h2o 0.5 g,蒸馏水定容至1000ml,调ph 7.2~7.5,初始亚硝酸盐含量以250mg/l加入。
[0021]
1.1.2 试剂及其配制1.1.2主要试剂及其配制1.1.2.1靛酚蓝分光光度法试剂配制溶液a的配制:称取na2fe(cn)5no
·
2h2o0.3622 g,溶于水并定容至25 ml,配制成质量浓度为1.25%na2fe(cn)5no
·
2h2o溶液,用棕色试剂瓶4℃保存。称取5.00 g苯酚,溶于400 ml水,加入2.0 ml配制好的na2fe(cn)5no
·
2h2o溶液,定容至500 ml,为溶液a,用棕色试剂瓶4℃保存。
[0022]
溶液b的配制:称取2.50 g naoh、2.0 g柠檬酸三钠和3.5 ml nacl溶于400 ml水中,定容至500 ml,为溶液b,用棕色试剂瓶4℃保存。
[0023]
1.1.2.2盐酸萘乙二胺分光光度法试剂配制对氨基苯磺酰胺溶液配制:将5.0 g对氨基苯磺酰胺溶解于50 ml浓盐酸中,用水稀释至300 ml,冷却后转移至500 ml容量瓶中,用水稀释至标线,摇匀。本溶液贮藏于棕色瓶中,在2~5℃保存。
[0024] 盐酸萘乙二胺溶液配制:将0.5g盐酸萘乙二胺溶解于100ml水中,转移至500ml容量瓶中,用水稀释至标线,摇匀。本溶液贮藏于棕色瓶中,在2~5℃保存。
[0025]
1.2方法
1.2.1样品的采集与富集培养从南通、连云港不同海域采集海水、海泥、动物组织等28个样品,取水样或泥样10 ml(g),动物内脏用无菌水清洗后加入无菌生理盐水研磨后取适量,接入装有100 ml硝化细菌富集培养基的250 ml三角瓶中(平行3瓶),置于30℃下180 r/min培养4d。
[0026]
1.2.1硝化细菌的分离纯化用无菌水将上述的富集培养液依次稀释成10-1
、10-2
、10-3
、10-4
共4个梯度,分别吸取各个稀释度样品100μl,涂布于硝化细菌筛选培养基平板上,每个样品3个平板,28℃,培养72h,长出的菌落进行三区划线纯化至单菌落,接种于牛肉膏蛋白胨斜面低温保藏。
[0027]
1.2.2降解氨氮和亚硝酸盐硝化细菌的筛选1.2.2.1硝化细菌降解氨氮和亚硝酸盐作用测定将硝化细菌不同菌株在牛肉膏蛋白胨培养基斜面上活化,28℃恒温培养24h,菌体用0.85%生理盐水制备菌悬液,吸取2ml分别接种到装有60ml氨氮测定培养基和亚硝酸盐测定培养基的250ml三角瓶中,28℃、180 r/min摇床培养48h,发酵液于4℃、8000r/min条件下离心10min,采用靛酚蓝分光光度法测定不同菌株上清液的od
637
,根据标准曲线计算不同菌株发酵液中的氨氮浓度,以未接种的筛选培养基作为对照,计算不同菌株的氨氮降解率。每个菌株活化后接种至氨氮降解率测定培养基中为一处理,每处理3重复。
[0028]
氨氮标准曲线的绘制:称取0.236g (nh4)2so4溶于水,定容至100 ml,制成氨氮浓度为500 mg/l的氨氮贮备溶液,取氨氮贮备溶液进行稀释,制成氨氮浓度分别为5、10、15、20、25、30、35、40、45、50 mg/l的氨氮标准溶液,取不同浓度的氨氮标准液100 μl,分别加入溶液a和溶液b各5 ml,充分混合后,放入37℃水浴显色20 min,取出后冷却至室温,在637 nm下测定其吸光值。以氨氮浓度为横坐标,od
637
为纵坐标,计算回归方程,绘制标准曲线。
[0029]
样品的检测:吸取待测菌液3ml于5ml离心管中,5 000 r/min下离心15 min,依次加入a液、b液各5ml,充分混合后,放入37℃水浴显色20 min,取出后用水冷却至室温,在637 nm下测定其吸光值。
[0030]
氨氮降解率/%=[(对照的氨氮浓度-处理的氨氮浓度)/对照的氨氮浓度]
×
100%1.2.2.2硝化细菌降解亚硝酸盐能力测定将硝化细菌不同菌株在牛肉膏蛋白胨培养基斜面上活化,28℃恒温培养24h,菌体用0.85%生理盐水制备菌悬液(5
×
107cfu / ml),吸取2ml到装有60ml亚硝酸盐测定培养基的三角瓶中,28℃、180 r/min摇床培养48h,为待测发酵液。吸取3ml发酵液于5ml离心管中,4℃、8000r/min条件下离心10min,采用盐酸萘乙二胺分光光度法测定不同菌株上清液的od
637
,根据标准曲线计算不同菌株发酵液中的亚硝酸盐浓度,以未接种的筛选培养基作为对照,计算不同菌株的亚硝酸盐降解率。
[0031]
亚硝酸盐标准曲线绘制:称取1.232 g亚硝酸钠,溶于150 ml水中,定量转移至1000 ml容量瓶中,用水稀释至标线,摇匀,配成250mg/l的亚硝酸盐贮存溶液。制成浓度25、50、75、100、125、150、175、200、225、250mg/l的亚硝酸盐标准溶液,每个浓度取100
µ
l,加入4.0 ml对氨基苯环酸溶液,混匀,避光静置5 min,再加入2.0 ml盐酸萘乙二胺溶液,混匀,避光静置15 min,以等量蒸馏水加显色液作空白对照,于波长538 nm处测吸光度值。
[0032]
样品的检测:将菌液装在5ml离心管中于5 000 r/min下离心15 min,取100
ꢀµ
l不同样品上清液于10 ml离心管中,稀释至1 ml,加入4.0 ml对氨基苯环酸溶液,混匀,避光静
置5 min,再加入2.0 ml盐酸萘乙二胺溶液,混匀,避光静置15 min,以等量蒸馏水加显色液作空白对照,于波长538 nm处测吸光度值。
[0033]
亚硝酸盐降解率(%)=[对照亚硝酸盐浓度(mg/l)-处理亚硝酸盐浓度(mg/l)]/对照亚硝酸盐浓度(mg/l)
×
100%。
[0034]
根据氨氮和亚硝酸盐的降解率,筛选高效降解氨氮(降解率90%以上)同时能降解亚硝酸盐的菌株。
[0035]
1.2.3 具有氨氮和亚硝酸盐降解作用硝化细菌的种类鉴定形态学观察:将分离筛选得到的具有降解氨氮和亚硝酸盐作用的硝化细菌28℃培养24h,观察菌落大小、形态及颜色,进行革兰氏染色、荚膜染色。
[0036]
生理生化实验:挑取1-3个菌落至含2ml无菌水的离心管中,漩涡振荡混匀,制成菌悬液,吸取100
µ
l菌悬液接种至不同的生化管中,按照说明书于不同条件下培养相应时间,观察反应管的显色结果,将显色结果与《结果诠释表》比对,确定反应结果。
[0037]
根据形态观察和生理生化反应结果,对照《伯杰细菌鉴定手册》(第九版)及《硝化细菌分类鉴定和试验方法》对菌株进行初步鉴定。
[0038]
16s rdna序列分析:将菌株送至上海生工生物工程有限公司进行16s rdna基因的pcr扩增和测序,所得的基因序列拼接完整后与genbank数据库中的已知序列进行blast比对,采用mega 7.0软件构建16s rdna基因序列系统发育树。
[0039]
1.2.4菌株n-ly-1对氨氮和亚硝酸盐的降解作用时间曲线测定将菌株n-ly-1种子液离心后用生理盐水洗涤三次,调节浓度至108cfu/ml,按8%的接种量分别接种到装入300ml氨氮浓度为50mg/l氨氮降解培养基和亚硝酸盐浓度为50mg/l的亚硝酸盐降解培养基500ml三角瓶中,充分混匀,分装到试管中,每管6ml,28℃、180r/min条件下摇床振荡培养,每隔4h取样一次,分别测定不同培养时间发酵液的菌体密度和氨氮浓度及亚硝酸盐浓度,计算氨氮和亚硝酸盐的降解率,每次取样3管,为3次重复。
[0040]
2 结果与分析2.1 硝化细菌的分离28个海水、海泥、动物组织等样品中,在含(nh4)2so4和nano2作氮源或能源的培养基上中7个样品中长出了菌落,能够还原硝酸盐和亚硝酸盐,符合硝化细菌来自南通如东的三个海泥样品中各分离到1个菌株,菌株分别为编号为n-r-1,n-r-2,n-r-3,取自南通启东县的3个海水中分别得到一个菌株,编号为n-q-1,n-q-2,n-q-3,从取自连云港市高公岛的鲈鱼肠道内分离得到一个菌株,编号为n-ly-1。
[0041]
2.2不同硝化细菌降解氨氮作用的测定2.2.1 氨氮标准工作曲线的绘制将配制好的含有不同氨氮浓度的标准液在od
637
下进行比色,测定吸光值,以氨氮浓度为横坐标,以od
637
为纵坐标,制作氨氮准工作曲线。如图1所示,在设置的浓度范围内,随着氨氮浓度的增加,od
637
逐渐增大,呈正相关,工作曲线方程为y=0.005x+0.1039,r2=0.9938,表明其线性相关性较好,可用于氨氮浓度的计算。
[0042]
表1 各氨量在od
637
处吸光值
2.2.2 不同硝化细菌菌株降解氨氮作用测定分离得到的7株硝化细菌在氨氮氮浓度为50 mg/l的培养基中培养48h,菌株生长正常,od
600
由初始0.594的增加到1.232,发酵液中氨氮浓度均明显下降,氨氮降解率均达60%以上,其中菌株n-ly-1的降解率最高,达92.1% ,其次为菌株n-q,为72.80%,n-q-1的降解率最低,为66.1%。结果见表2,图2。
[0043]
表2 7株硝化菌降解氨氮作用测定结果注:表中字母表示同一列数据的显著差异性,同列不同小写字母表示差异性显著,同列相同小写字母表示差异不显著,p≤0.05.2.3 不同硝化细菌降解亚硝酸盐能力的测定2.3.1亚硝酸盐标准曲线绘制将配制好的含有不同亚硝酸盐浓度的标准液,在538nm处测吸光值,以亚硝酸盐浓度为横坐标,吸光度为纵坐标,建立回归方程。结果表明在设置的浓度范围内,随着亚硝酸盐浓度的增加,od
538
逐渐增大,呈正相关,亚硝酸盐的标准工作曲线方程为y=0.0098x+0.0591,相关系数r
²
=0.9969,表明其线性相关性好,可用于亚硝酸盐氮浓度计算,结果见表3、图3。
[0044]
表3不同浓度亚硝酸盐含量的od
538
2.3.2不同硝化细菌降解亚硝酸盐作用分离得到的7株硝化细菌在含浓度250mg/l亚硝酸盐的培养基中培养48h,菌株生长正常,od
600
由初始的0.470增加到1.376, 不同菌株发酵液中的亚硝酸盐浓度不同,其中n-ly-1菌株发酵液中亚硝酸盐浓度有所下降,对亚硝酸盐具有降解作用,降解率为14.8%,5个菌株降解率低于2%,1个菌株无降解作用。结果见表3。
[0045]
表3 7株硝化菌的降解亚硝酸盐作用测定结果
注:表中字母表示同一列数据的显著差异性,同列不同小写字母表示差异性显著,同列相同小写字母表示差异不显著,p≤0.05.结果表明,硝化细菌n-ly-1具有降解氨氮和亚硝酸盐作用,在含有50mg/l氨氮和250mg/l亚硝酸盐降解率测定培养基中48h,氨氮和亚硝酸盐降解率分别为92.1%和14.8%,进行具有一定的应用前景,进一步进行种类鉴定。
[0046]
2.4具有氨氮和亚硝酸盐降解作用硝化细菌n-ly-1的种类鉴定2.4.1 n-ly-1菌株的形态学观察菌落凸起,灰白色,湿润不透明,边缘不规则,菌体呈为短杆状(图4、图5),革兰氏染色阴性,有荚膜。
[0047]
2.4.2 n-ly-1菌株的生理生化特征生理生化试验结果如表4,n-ly-1菌株能够使明胶液化,尿素酶、精氨酸双水解酶、赖氨酸脱羧酶、苯丙氨酸脱氨酶等为阴性,能够还原硝酸盐和亚硝酸盐,具有分解葡萄糖的能力,吲哚试验为阴性。
[0048]
表4 n-ly-1的生理生化特征注:“+”为阳性,
“-”
阴性 2.4.3 n-ly-1菌株16srna序列分析将n-ly-1的16s rdna基因测序结果与ncbi中同源序列进行比对,结果表明其与海胆鞘氨醇单胞菌(登录号为mg745876.1)(sphingomonas echinoides)的序列相似度为98.53%。
[0049]
选取同属内同源相似性较高的不同菌株的16s rrna序列,采用mega7.0软件构建
系统发育树,结果显示n-ly-1与海胆鞘氨醇单胞菌的3个菌株位于同一分支,亲缘关系最近。结果见图6。
[0050]
结合形态学观察、生理生化反应测定结果,认为n-ly-1菌株为海胆鞘氨醇单胞菌(sphingomonas echinoides)。
[0051]
2.5菌株n-ly-1对氨氮和亚硝酸盐的降解作用时间曲线2.5.1菌株n-ly-1对氨氮的降解作用图7可以看出,从随着培养时间的延长,菌体密度不断增加,发酵液的氨氮浓度逐渐降低,降解率逐渐升高,0-12h之间,菌体密度缓慢增加,为迟滞期,氨氮浓度逐渐下降,12-20h时,菌体密度快速增加,为对数生长期,在氨氮浓度快速下降,降解率明显增加, 20h时,氨氮浓度已由初始的48.52mg/l下降至23.36mg/l,降解率达到了51.8%。20-44h,菌体密度持续增加,但增加速度放缓,发酵液的氨氮浓度继续降低,降低速度也随之缓慢,44h菌体密度达到最高,进入稳定期,48h时菌体密度开始降低,氨氮浓度持续降低,52h时,发酵液的氨氮浓度下降至0.041mg/l,降解率达95%,说明n-ly-1菌株具有较强的氨氮降解能力,并具有降解稳定性。
[0052]
2.5.2菌株n-ly-1对亚硝酸盐的降解作用图8可以看出,从随着培养时间的延长,菌体密度不断增加,发酵液的亚硝酸盐浓度逐渐降低,降解率逐渐升高,0-8h之间,菌体密度缓慢增加,为迟滞期,氨氮浓度逐渐下降,8-24h时,菌体密度快速增加,为对数生长期,亚硝酸盐浓度快速下降,降解率明显增加, 24h时,发酵液中的亚硝酸盐浓度由47.42mg/l下降至29.4mg/l,降解率为43.2%。24-44h,菌体密度持续增加,但增加速度放缓,发酵液的亚硝酸盐浓度继续降低,降低速度也随之缓慢,44h菌体密度达到最高,进入稳定期,48h后菌体密度开始降低,亚硝酸盐浓度持续降低,52h时,亚硝酸盐浓度下降至10.7mg/l,降解率为77.3%,说明n-ly-1菌株具有较强的氨氮降解能力,并具有降解稳定性。
[0053]
3 结论与讨论从江苏连云港海域的鲈鱼肠道内分离出一株能够降解氨氮和亚硝酸盐的菌株n-ly-1,初始氨氮含量为50mg/l和亚硝酸盐含量为250mg/l时,培养48h的降解率分别为92.1%和 14.8%,初始氨氮含量为50mg/l和亚硝酸盐含量为50mg/l时,培养52h的降解率分别为95.0%和 77.3%。通过菌株形态观察、生理生化试验和16s rrna序列分析,鉴定n-ly-1菌株为海胆鞘氨醇单胞菌(sphingomonas echinoides)。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签: 硝化细菌
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



