一种真菌病毒SlMV1、减毒菌株及应用的制作方法
 2021-02-02 00:02:49|
2021-02-02 00:02:49| 306|
306| 起点商标网
起点商标网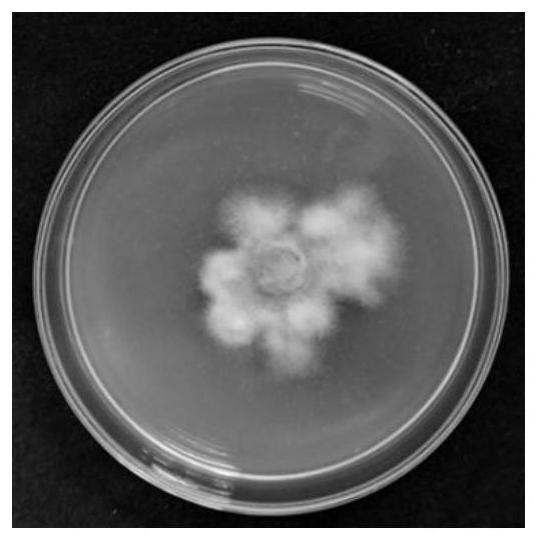
一种真菌病毒slmv1、减毒菌株及应用
技术领域
[0001]
本发明属于生物防治领域,涉及一种减毒菌株,具体涉及该减毒菌株含有的真菌病毒slmv1,同时涉及该真菌病毒或该减毒菌株对链格孢和匍柄霉等真菌引起的植物病害的防治作用。
背景技术:
[0002]
在植物病害中,真菌是最重要的病原之一,约80%左右的植物病害由真菌引起,每年给农业生产造成巨大的经济损失。目前对于真菌病害的防治主要采用化学方法,由于化学药剂长期使用会带来诸如生态平衡破坏、环境污染及病原菌产生抗药性等一系列相关问题,因此,急需挖掘绿色环保的生物防治方法。
[0003]
真菌病毒(mycovirus or fungal virus)是指侵染真菌并能够在其体内进行增殖的病毒的统称,在真菌的各类群中均能发现侵染活动,其中少数能持久侵染并导致寄主致病力显著降低。这类病毒被称为低毒真菌病毒(hypoviruses),是潜在的生防因子,可用于植物真菌病害的防控。然而,真菌病毒在自然环境中的扩散主要依赖于真菌的菌丝融合,不同种真菌,甚至同种真菌不同菌丝融合群之间的菌丝不融合现象限制了低毒真菌病毒在生物防治中的应用。因此,挖掘具有体外传播能力的低毒真菌病毒对利用真菌病毒进行植物真菌病害意义重大。
[0004]
由链格孢(alternaria spp.)和匍柄霉(stemphylium spp.)引起的叶斑病是发生于世界各地多种作物的最重要的植物病害之一,经常造成巨大的经济损失。例如,茄链格孢(a.solani)和链格孢(a.alternata)引起的马铃薯与番茄早疫病在发生严重的地块产量损失高达30%以上。匍柄霉引起的叶斑病仅2013年在我国蔬菜上总发生面积就超过300万亩,直接经济损失近10亿元。目前,生产中该类病害的防治仍主要依靠化学药剂,但病原菌对常用杀菌剂的抗性不断出现,导致大部分药剂田间防效明显降低,病菌抗药性问题日趋严重。
技术实现要素:
[0005]
本发明的主要目的在于,针对现有技术中植物病原真菌对植物、作物的品质和产量等产生重大的影响,但很少发现抑制植物病原真菌的真菌病毒,且使用这样的真菌病毒的植物病害防治的尝试也非常少,而提供一种减毒菌株,该减毒菌株含有能抑制植物病原真菌致病力的真菌病毒slmv1,该病毒slmv1能独立于细胞外存在,并保持侵染活力,感染其他种类的植物病原真菌,通过抑制真菌致病相关毒素的形成降低寄主的致病力,从而达到对植物病害的防治作用。
[0006]
上述提及的减毒菌株,其分类命名为番茄匍柄霉slhn-03(stemphyliumlycopersici)slhn-03,已于2020年6月19日保藏于中国典型培养物保藏中心,地址:中国武汉武汉大学,保藏编号为cctcc no.m2020229。
[0007]
本发明人在鉴定莴苣叶斑病病原的过程中发现1株菌落形态异常的番茄匍柄霉菌株slhn-03,已分离、鉴定并保藏(保藏信息见上段描述),其生长缓慢,且致病力显著降低。
[0008]
进一步研究发现本菌株slhn-03中含有一种具有1.4~3.6kbp的4条双链rna的天然存在的真菌病毒,通过高通量测序技术,获得了该病毒的全基因组序列,并将其命名为stemphyliumlycopersicimycovirus 1(slmv1),该病毒基因具有如seq id no:1~4的4条基因组序列。该真菌病毒slmv1在双链rna的序列中含有rdrp(rna依赖性rna聚合酶)和cp(衣壳蛋白)的保守基序,且编码rdrp和cp的核苷酸序列与已知的链格孢病毒aav-1具有同源性。slmv1基因组的第3条链的5
’
端和aav-1第3条链也具有同源性,但第3条链的3
’
端和第4条链与aav-1没有同源性。第4条核酸链在ncbi数据库中找不到同源序列。因此,推测病毒slmv1是一个新型的真菌病毒。
[0009]
将本菌株slhn-03通过原生质体再生技术脱毒后获得了菌株slhn-03的脱毒菌株,脱毒后的病菌生长速度和致病力都得到恢复。本发明病毒slmv1通过体外传播能感染引起莴苣叶斑病的囊状匍柄霉(s.vesicarium)svhn-02菌株和番茄匍柄霉菌株slhn-10以及引起烟草赤星病的链格孢菌(a.alternata)aa81601菌株,获得病毒的菌株同样表现致病力的显著降低。进一步研究发现slmv1能通过抑制真菌致病相关毒素的形成降低寄主的致病力。
[0010]
因此,本发明涉及的真菌病毒slmv1能体外感染宿主菌,并具有抑制植物病原真菌致病力的作用,能通过例如使该真菌病毒slmv1体外感染宿主菌,使宿主菌内含该真菌病毒,来降低植物病原真菌的致病力,达到生物防治植物真菌病害的目的。
[0011]
本发明人研究发现,本发明的真菌病毒slmv1可以存在于细胞外,并具有侵染能力。因此,可通过例如用液体培养基培养宿主菌,从该培养上清中回收真菌病毒,简单且相对大量地生产真菌病毒。而且,由于slmv1可不依赖菌丝融合,通过体外传播感染宿主菌,因此,很有可能利用slmv1简单且高效率进行植物病原真菌的减毒及植物病害的防治。
[0012]
此外,通过例如将至少含有本发明的真菌病毒slmv1和/或制备的植物病原真菌减毒菌株的植物病害防治剂附加(散布、涂抹等)于植物,有可能防治该植物病害。
附图说明
[0013]
图1是本发明菌株菌落图。
[0014]
图2是本发明检测菌株slhn-01至slhn-12中双链rna的电泳图。
[0015]
其中:m为5000bp marker。
[0016]
图3是本发明菌株slhn-03和菌株slhn-06在pda培养基上的菌落正反面图。
[0017]
其中:上图为菌落正面,下图为菌落反面。
[0018]
图4是从本发明菌株slhn-03中提取的病毒颗粒slmv1的蛋白电泳图。
[0019]
图5是本发明病毒颗粒slmv1的核酸电泳照片。
[0020]
其中:m-5000bp marker,1-菌株slhn-03,2-菌株slhn-06。
[0021]
图6是从本发明菌株slhn-03的培养上清中所得的病毒颗粒的电子显微镜照片。
[0022]
图7是本发明slmv1病毒基因组的结构示意图。
[0023]
图8是病毒slmv1 rdrp序列构建的系统发育树。
[0024]
图9是本发明菌株slhn-03经放线菌酮处理后所得的32株菌株的菌落图。
[0025]
其中:3、6、12、15、20、23、25、29为治愈株,其余为含双链rna的菌株。
[0026]
图10是本发明菌株slhn-03经放线菌酮处理后所得的32株菌株的双链rna提取结果的电泳图。
[0027]
其中:3、6、12、15、20、23、25、29为治愈株,其余为含双链rna的菌株,m为5000bp marker。
[0028]
图11是本发明于同一片莴苣叶上分别接种带毒菌株slhn-03和脱毒菌株3、15的结果图。
[0029]
图12是本病毒slmv1于匍柄霉的菌体外是否具有感染能力的实验结果图。
[0030]
其中:左竖栏的上、中、下图分别表示未感染病毒的菌株slhn-10的正面菌落形态、反面菌落形态及发酵液颜色;中竖栏上、中、下图分别表示感染病毒的菌株slhn-10-v的正面菌落形态、反面菌落形态及发酵液颜色;右竖栏表示感染病毒的菌株slhn-10-v和未感染病毒的菌株slhn-10的接种情况。
[0031]
图13是感染本发明病毒的菌株slhn-10-v发酵液中的真菌毒素检测图(以未感染病毒的菌株slhn-10为对照)。
[0032]
图14是感染本发明病毒的菌株svhn-02-v发酵液中的真菌毒素检测图(以未感染病毒的菌株svhn-02为对照)。
[0033]
图15是感染本发明病毒的菌株aa81601-v发酵液中的真菌毒素检测图(以未感染病毒的菌株aa81601为对照)。
[0034]
图16是含本真菌病毒slmv1的菌株slhn-03的分生孢子数检测结果图(以不含病毒的菌株svhn-02为对照)。
[0035]
图17是本发明病毒slmv1对植物病原真菌的防治研究结果一。
[0036]
其中:左竖栏的上、中、下图分别表示未感染病毒的菌株svhn-02的正面菌落形态、反面菌落形态及发酵液颜色;中竖栏上、中、下图分别表示感染病毒的菌株svhn-02-v的正面菌落形态、反面菌落形态及发酵液颜色;右竖栏表示感染病毒的菌株svhn-02-v和未感染病毒的菌株svhn-02的接种情况。
[0037]
图18是是本发明病毒slmv1对植物病原真菌的防治研究结果二。
[0038]
其中:a左表示感染病毒的菌株aa81601-v,a右表示未感染病毒的菌株aa81601;b i表示同一烟草叶片两边分别接种aa81601-v(左)和aa81601(右)的正面;b ii表示同一烟草叶片两边分别接种aa81601-v(左)和aa81601(右)的背面。
具体实施方式
[0039]
〈关于本发明的病毒〉
[0040]
本发明从菌株slhn-03中提取了具有抑制植物病原真菌致病力的真菌病毒,命名为stemphyliumlycopersicimycovirus 1(slmv1),其具有1.4~3.6kb的4条双链rna。该真菌病毒的各病毒颗粒均具有1.4~3.6kb的4条双链rna,且该4条双链rna包裹在一个病毒颗粒中,同时存在、传代。
[0041]
该真菌病毒在双链rna的序列中含有rdrp(rna依赖性rna聚合酶)的保守基序,且编码该区域的rna的核苷酸序列与alternariaalternata virus 1(aav-1)病毒高度同源,并与产黄青霉病毒科下属病毒基因组中编码rdrp的区域有同源性。
[0042]
本发明对该真菌病毒进行了序列测定,得到了全长的核苷酸序列。因此,本发明包含全部该真菌病毒基因、具有该核苷酸序列或其一部分的核酸、这些核苷酸序列所编码的蛋白质等。
[0043]
将该病毒的4条双链rna的核苷酸序列分别以seqid no:1~4表示。本发明也包含全部具有上述核苷酸序列的全部或一部分的核酸。核酸可以是双链、单链的任意一种,此外,dna、cdna、rna等也全部包括在内。例如,seq id no:1~4的全部或任一序列、在序列中具有规定机能的特定部分的序列、与这些序列具有同等核苷酸序列的cdna、插入了与这些序列有同等核苷酸序列的重组载体(质粒、病毒等)等,均包含在本发明中。
[0044]
序列解析的结果显示,在seq id no:1的序列部分存在rdrp(rna依赖性rna聚合酶)的保守基序,seq id no:2的序列部分存在cp(衣壳蛋白)的保守基序,seq id no:3和seq id no:4编码功能未知的蛋白。因此,依照目的、用途,例如也可制备、使用至少具有作为有规定机能的特定部分的这些序列部分的核酸、重组载体等。
[0045]
需要说明的是,本发明的核酸(或基因)中也包含与上述核苷酸序列具有同源性的核酸,例如,在严格的条件下与和该核苷酸序列互补的核苷酸序列组成的核酸杂交,且具有真菌致病力抑制作用的核酸。
[0046]
而该核苷酸序列seq id no:1~4所编码的蛋白质的氨基酸序列seq id no:5~8中,seq id no:5为seq id no:1记载的核苷酸序列中的可读框的氨基酸序列,seq id no:6为seq id no:2记载的核苷酸序列中的可读框的氨基酸序列,seq id no:7为seq id no:3记载的核苷酸序列中的可读框的氨基酸序列,seq id no:8为seq idno:4记载的核苷酸序列中的可读框的氨基酸序列。
[0047]
需要说明的是,本发明的蛋白质,除了具有seq id no:5~8的任意一种的氨基酸序列的蛋白质之外,还包含全部与这些具有同源性且保持该机能的蛋白质。例如,将上述核酸插入到重组载体中,并使其在宿主中强制表达,由此可大量制备这些蛋白质。宿主可以考虑利用大肠杆菌类、酵母类、培养细胞等公知的宿主。考虑到真菌病毒可以感染真菌,酵母类具有高增殖性且利用也比较方便等,作为宿主可能以酵母类最适合。至于重组载体,也可以利用公知的载体。插入有seq id no:1~4的任一序列的多个载体,通过使该四种类的基因的多个共表达,有可能再构成真菌病毒。在这种情况下,也可考虑利用公知的宿主及公知的重组载体,但是从可以同时导入多个载体的角度考虑,可能以酵母类最为适合。
[0048]
〈关于植物病原真菌的减毒菌株〉
[0049]
本发明的真菌病毒slmv1最初是存在于番茄匍柄霉菌(stemphyliumlycopersici)slhn-03内。该番茄匍柄霉菌株slhn-03已经保藏,保藏号为cctcc no.m2020229。本番茄匍柄霉菌株slhn-03的形态性质、培养的性质、孢子形成、生理学的及化学分类学的性质,基本上与公知/常规的匍柄霉菌相同,但是,与常规的匍柄霉菌相比,本菌株的生长缓慢,产孢能力下降,真菌毒素分泌显著减少,致病力显著降低。
[0050]
但是,本发明的植物病原真菌减毒菌株包含全部含有本发明的真菌病毒slmv1的菌株。即,例如包含已经内含该真菌病毒slmv1的匍柄霉和链格孢等的菌株以及感染了该真菌病毒slmv1的其他植物病原真菌的菌株。
[0051]
作为使真菌病毒感染植物病原真菌等的方法为本领域的常规技术,例如菌丝融合使宿主菌感染的方法。此外,本真菌病毒slmv1能独立存在于细胞外,并保持侵染活力,因此也可以从细胞外直接地感染宿主菌。
[0052]
〈关于植物病原真菌病毒的制备〉
[0053]
本发明的真菌病毒slmv1是存在于规定的匍柄霉菌株内,因此,通过从感染该真菌
病毒的匍柄霉菌株中分离、回收病毒等,可以获得该真菌病毒。
[0054]
作为病毒的分离、回收方法,可采用公知的方法。例如,可以用液氮等冷冻、破碎菌体,用规定的缓冲液中混悬后,通过超离心分离等分离病毒,可回收病毒。
[0055]
但是,本发明的真菌病毒也可存在于宿主菌的细胞外。因此,例如可用液体培养基等培养经真菌病毒感染的植物病原真菌,通过离心分离法来分离菌体后,从该培养上清中分离、回收病毒,从而可简便且相对大量地回收病毒。
[0056]
但是,本发明的真菌病毒并不仅限于用这种生产方法获得的病毒。即,例如从内含本真菌病毒的链格孢或匍柄霉菌中分离、回收所获取的病毒,也广义地包含在本发明中。
[0057]
〈关于植物病原真菌减毒的方法〉
[0058]
可采用使本发明的真菌病毒感染特定的植物病原真菌等,抑制该宿主菌的致病相关毒素合成等从而可使该菌减毒。
[0059]
〈关于植物病害防治剂〉
[0060]
本发明的植物病害防治剂包含全部至少含有本发明的真菌病毒或本发明的植物病原真菌减毒菌株的任意一种的防治剂。此外,也可同时含有该真菌病毒和该植物病原真菌减毒菌株,也可含有其它的成分。
[0061]
作为其它的成分,可含有例如规定的载体、粘结剂、增粘剂、固定剂、防腐防霉剂、溶剂、稳定剂、抗氧剂、紫外线吸收剂、晶体析出防止剂、消泡剂、物性改善剂、着色剂等。此外,也可以含有其它的农药成分,例如杀螨剂、杀线虫剂、杀菌剂、抗病毒剂、引诱剂、除草剂、植物生长调节剂、增效剂等。
[0062]
作为载体,例如可以使用固体载体和/或液体载体。作为固体载体,可列举例如淀粉、活性炭、大豆粉、小麦粉、木粉、鱼粉、奶粉等动植物性粉末,滑石、高岭土、膨润土、沸石、硅藻土、白炭黑、粘土、氧化铝、碳酸钙、氯化钾、硫酸铵等矿物性粉末。作为液体载体,可列举例如水、异丙醇、乙二醇等醇类,环己酮、甲基乙基酮等酮类,丙二醇单甲基醚、二甘醇单正丁基醚等醚类,煤油、轻油等脂肪族烃类,二甲苯、三甲苯、四甲苯、甲基萘、溶剂粗汽油等芳香族烃类,n-甲基-2-吡咯烷酮等酰胺类,脂肪酸的甘油酯类,大豆油、油菜籽油等植物油。
[0063]
作为粘结剂、增粘剂、固定剂,可列举例如淀粉、糊精、纤维素、甲基纤维素、乙基纤维素、羧甲基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素、羟甲基淀粉、普鲁兰、海藻酸钠、海藻酸铵、海藻酸丙二醇酯、瓜尔胶、刺槐豆胶、阿拉伯胶、黄原胶、明胶、酪蛋白、聚乙烯醇、聚氧化乙烯、聚乙二醇、乙烯-丙烯嵌段聚合物、聚丙烯酸钠、聚乙烯吡咯烷酮等。
[0064]
对本防治剂的剂型无特殊限定。例如可适用乳剂、悬浮剂、粉剂、颗粒剂、片剂、水合剂、水溶剂、液剂、水悬剂、颗粒水合剂、气溶胶剂、糊剂、油剂、乳浊剂等形态。
[0065]
〈关于植物病害的防治方法〉
[0066]
本发明的植物病害防治方法,包含全部的至少含有将上述的链格孢或匍柄霉叶斑病防治剂附加于特定的植物的步骤的方法。
[0067]
作为使防治剂附加于植物的方法,可列举例如在叶的表面或里面涂抹防治剂的方法、使用规定的载体等使防治剂附着于叶的表面或里面的方法、将防治剂散布或供应于叶上的方法等。
[0068]
防治剂的涂抹量或散布量,根据有效成分的浓度、制剂的形态、对象病害和作物的种类、病害导致的受害程度、施用场所、施用方法、施用时期、混用、合用的药剂和肥料等的使用量、种类等种种条件,可进行适当的选择。例如,通过向每叶喷雾或供应1~1000ml的调整为1
×
103~1
×
107个/ml的匍柄霉减毒菌株的分生孢子含有液,此外,通过使叶每平方毫米涂抹或附着1
×
103~1
×
10
10
个匍柄霉减毒菌株的分生孢子于叶表面或里面,有可抑制植物病害的可能性。
[0069]
本发明可适用于以真菌为主要病因的所有的植物病害。作为有适用可能性的植物病害,可列举例如下述的病害但不限定于这些:针对蔬菜的植物病害,如:番茄匍柄霉叶斑病(病原菌“s.lycopersici”)、马铃薯和番茄的早疫病(病原菌“a.solani”)等;针对果树的植物病害,如苹果斑点落叶病(病原菌“a.mali”)等;针对经济作物的烟草赤星病(病原菌“a.alternate”)等。
[0070]
实施例1本发明菌株slhn-03的制备
[0071]
从湖南长沙蔬菜基地采摘莴苣叶斑病叶片,采用常规组织分离法,取叶片病健交界处组织进行分离,经升汞1min、70%酒精浸泡5-8s,无菌水润洗三次后晾干,转移至pda平板,28℃倒置培养;待长出菌丝后将菌株接种于v8培养基(v8果汁200g,caco33.0g,琼脂20g,补充去离子水至1l)上,置于28℃光暗交替条件下培养,10d后挑取菌落生长缓慢的菌丝转接至新的pda平板。继续28℃光暗交替条件下培养,10d在显微镜下观察,挑取单个孢子到新的pda平板上,新长出的菌落为纯化的感染病毒的菌落(图1)。
[0072]
实施例2菌株内在双链rna的检测
[0073]
从包含本发明菌株slhn-03的slhn-01至slhn-12的12株番茄匍柄霉菌中检测内在的双链rna。首先,磨碎单独分离培养的12株匍柄霉菌的菌体,用酚sds法提取核酸后,通过dnase1及s1核酸酶选择性地分解dna和单链核酸,得到菌体内在的双链rna。然后,在1%琼脂糖凝胶中于120v下电泳0.5小时,用溴化乙锭进行染色。
[0074]
结果见图2,结果显示,12个菌株中,除菌株slhn-03含有1.4~3.6kb的4条双链rna谱带外,其余11株菌株均为正常或常规番茄匍柄霉菌(不含双链rna),但匍柄霉中从未报道真菌病毒。因此,本实施例的结果暗示该匍柄霉菌株中内含真菌病毒。
[0075]
实施例3
[0076]
比较上述实施例2中内含双链rna的菌株slhn-03和不含双链rna的菌株的生长速度和菌落形态。
[0077]
以实施例2中的菌株slhn-06作为不含双链rna的菌株代表。将未检测出内在性双链rna的菌株slhn-06和检测出双链rna的菌株slhn-03,分别用pda培养基进行培养,于培养开始7天后观察菌落的正反两面,结果见图3。
[0078]
结果显示,未检测出双链rna的菌株slhn-06的菌丝生长速度快,产生色素。另一方面,检测出双链rna的菌株slhn-03和未检测出的菌株slhn-06相比较,其生长迟缓,不产生色素。即,内含双链rna的菌株和不含双链rna的菌株相比较,可见到生长抑制和色素分泌减少。这些试验结果暗示实施例2中所得的双链rna(真菌病毒)是该菌株slhn-03生长异常的原因。
[0079]
实施例4
[0080]
对本发明的真菌病毒的病毒颗粒进行了生物化学特性的分析。
[0081]
取多瓶在pda中扩大培养的slhn-03菌株,过滤用无菌滤纸吸干后,在液氮中碾磨至粉末;按1g菌丝干粉加4ml磷酸缓冲液的比例,于菌丝中加入0.1m的磷酸缓冲液(ph7.0),震荡5min,4℃10000rpm离心15min;吸取上清,加入10%体积的正丁醇:氯仿(1:1),震荡5min,4℃10000rpm离心30min;吸取上清,加入50%peg6000和5m nacl,使其终浓度分别为6%和0.1m,置于4℃沉淀过夜。4℃12000rpm离心30min,弃除上清,将沉淀悬浮于0.01m磷酸缓冲液(约30ml,使病毒粒子充分溶于磷酸缓冲液),4℃12000rpm离心30min,留上清(约30ml)。然后,将上述上清液加入超高速离心管中,底部加入20%蔗糖,10万g离心4小时,将所得沉淀物溶于少量的0.01m磷酸缓冲液(ph7.0)中,该溶液即为病毒粒子粗提液。
[0082]
将该病毒粒子粗提液的一部分进行sds-page(8%凝胶、tris-甘氨酸缓冲液(ph8.8)、20ma、90分钟)电泳,用cbb(考马斯亮蓝)染色,进行病毒蛋白质的主要成分(外壳蛋白)的分子量分析。其蛋白电泳结果见图4,检测到约90kda大小来自病毒颗粒的蛋白质的谱带。用sds-苯酚法从检测出该90kda的蛋白质的成分中进行核酸提取,结果检测出1.6~3.6kbp的4条双链rna(见图5)。因此,通过本实施例能确认存在本发明的真菌病毒的病毒颗粒。
[0083]
实施例5
[0084]
在本实施例中,通过电子显微镜鉴定菌体外存在病毒颗粒。
[0085]
将本菌株slhn-03在pda培养基中培养,从该培养上清中分离病毒颗粒。将该培养上清离心(10,000
×
g、5分钟),然后超离心(100,000
×
g、30分钟)该上清,可得含病毒颗粒的沉淀物。将该沉淀物溶于0.05m磷酸缓冲液(ph7.0)中,使用磷钨酸或醋酸铀进行负染色,用电子显微镜(倍数:
×
20,000~40,000)观察。
[0086]
结果见图6。如图所示,通过电子显微镜,可鉴定本发明的真菌病毒slmv1的病毒颗粒。该病毒颗粒为约30~40nm的正六角形状,包在包膜样的结构中。因此,通过本实施例能确认含有真菌病毒slmv1的菌株液体培养基中存在本发明的真菌病毒的病毒颗粒。
[0087]
实施例6
[0088]
对本发明病毒slmv1的核苷酸序列进行了分析。
[0089]
1.双链rna的提取、纯化
[0090]
对于在实施例2中检测出双链rna的菌株slhn-03液体培养1周,然后过滤收集菌丝体;将约0.1g菌丝在液氮中研磨成粉,转移至离心管并加入700μl ste(1m tris-hcl、0.5m edta、5m nacl、10%sds)用涡震仪震荡3min使其充分混匀;加入700μl rna提取酚振荡3min,4℃ 12000rpm离心3min;取上清约650μl,加入等体积的体积比为25:24:1的rna提取酚、氯仿及异戊醇的混合液,振荡3min,4℃12000rpm离心3min;取上清约500μl,两管合成1管,加入0.1g纤维素粉末,200μl无水乙醇,振荡5min,冰上静置10min。继续振荡3min,4℃ 12000rpm 3min;弃除上清,加1020μl te缓冲液(1m tris-hcl、0.5m edta、5m nacl;ph7.0)及180μl无水乙醇,振荡1min,4℃12000rpm离心3min;弃除上清,加入420μl te,振荡3min,4℃ 12000rpm离心3min;取上清约400μl于1.5ml新离心管中,加入等体积异丙醇-20℃沉淀2h,4℃ 12000rpm离心15min,弃除上清;加入1ml 70%乙醇,12000rpm离心10min,弃上清,重复洗涤一次,彻底去除残留的乙醇后加入30μldd h2o溶解沉淀;加入1.5μldnasei(rnase-free)、1μls1 nuclease和1/5体积的dna buffer缓冲液,在37℃下反应40分钟后,得到目的双链rna。双链rna高通量测序按照通用的高通量测序方法送公司测序。
[0091]
2.末端序列的获得
[0092]
在双链rna的3
’
端加上5
’
磷酸化,3
’
氨基化的接头引物primer a,加完接头的双链rna经末端补平后纯化回收。再以随机引物和primer b引物(primer a的反向互补引物)进行反转录合成cdna。为模板合成cdna,然后进行末端序列的克隆测序。再以高通量测序得到的片段设计基因特异性引物和primer b引物做pcr,将所得的条带纯化回收后,连接至t载体,并转化大肠杆菌筛选得到阳性克隆。然后对各阳性克隆进行序列测定。得到真菌病毒slmv1的基因组信息的全长序列。该真菌病毒slmv1由4条双链rna构成(见图7),各双链rna的核苷酸序列见seq id no:1~4,该核苷酸序列所编码的蛋白质的氨基酸序列分别见seq id no:5~8。需要说明的是,为了将双链rna取代为cdna后进行序列测定,在序列表中“尿嘧啶”被取代为“胸腺嘧啶”。
[0093]
根据本病毒slmv1的rdrp序列构建的进化树见图8。
[0094]
实施例7
[0095]
在本实施例中是用低浓度的放线菌酮(蛋白质合成抑制剂)处理内含双链rna的菌株,尝试制备真菌病毒治愈株。
[0096]
制备添加有0.25~0.50μg/ml放线菌酮的pda平皿培养基,并向其中移植实施例3中于pda培养基中培养的菌株slhn-03(检测出双链rna的菌株),如此继代培养n代(n>10),观察菌株的菌落形态是否会发生变化。然后,将恢复正常生长速度的菌株进一步移植到新的pda平皿培养基中,得到放线菌酮处理后恢复生长速度的真菌病毒治愈株(标号为3、6、12、15、20、23、25、29的菌株)。接着,从所得的放线菌酮治愈株中,用与实施例2同样的方法提取双链rna,通过电泳来尝试检测双链rna的谱带。结果显示,真菌病毒治愈株3、6、12、15、20、23、25、29菌株恢复生长(图9),放线菌酮处理治愈株未检测到双链rna的谱带(图10)。同时,将本菌株slhn-03(带毒菌株)和治愈株3或治愈株15(脱毒菌株)分别接种于同一莴苣叶上,见图11,显示脱毒后的病菌生长速度和毒力都得到恢复(叶片左侧接种菌株slhn-03,右侧接种治愈株3或治愈株15)。
[0097]
上述结果显示,匍柄霉菌中内含的双链rna为真菌病毒,且该真菌病毒对匍柄霉菌的生长有抑制作用。
[0098]
实施例8
[0099]
在本实施例中,对slmv1是否具有体外感染能力进行了研究。
[0100]
将含有真菌病毒slmv1的菌株slhn-03移植于pda液体培养基中并进行培养,2周后离心培养液并回收该培养上清。接着,将所得培养上清用孔径0.22μm的细菌过滤器过滤,除去菌体细胞。然后在100ml的三角瓶中加入50mlpd培养基和10ml滤液,并在其中接种番茄匍柄霉菌的正常菌株slhn-10(无真菌病毒的菌株),共培养7天后,取菌丝接种到pda平板,以未感染病毒菌株slhn-10为对照,观察菌落的生长情况。
[0101]
结果见图12,结果显示,在接种第7天后,未添加培养上清的菌株slhn-10,其菌落平整,边缘整齐,表现出正常的生长状态(见图12左竖栏),而添加了培养上清的菌株slhn-10-v,其菌落褶皱,边缘扭曲(见图12中竖栏)。将slhn-10和slhn-10-v的菌饼分别接种在同一莴苣叶片的两边,5天后观察到感染了病毒的菌株不能导致叶片发病(见图12右竖栏)。
[0102]
考虑该结果的原因是,存在于培养上清中的真菌病毒slmv1感染了匍柄霉的正常菌株,降低其致病力。即,本实验结果说明了菌体外存在的真菌病毒并对正常的菌株具有感
染能力。
[0103]
实施例9
[0104]
在本实施例中,对于已感染真菌病毒的匍柄霉株和链格孢菌株,测定了其产生真菌致病相关毒素的能力。
[0105]
将未感染病毒的匍柄霉菌株svhn-02、slhn-10和链格孢菌株aa81601以及对应的感染了病毒的svhn-02-v、slhn-10-v和aa81601-v菌株分别接种至pda培养基,200rpm,28℃震荡培养7天后取培养基上清液离心,然后采用色质联用分离鉴定发酵液中的真菌毒素。
[0106]
结果显示,匍柄霉感染病毒后发酵液中主要致病相关毒素altersolanol a、macrosporin、alternariol和altenusin的含量显著降低(图13和14);链格孢感染病毒后发酵液中主要致病相关毒素alternariol、macrosporin、scirpentriol和hc-toxin的含量显著降低(图15)。该结果显示本发明的真菌病毒slmv1可能通过抑制宿主菌的真菌致病相关毒素合成来抑制植物病菌致病力。
[0107]
实施例10
[0108]
在本实施例中,对于已感染和未感染slmv1的菌株,测定了其分生孢子数目。
[0109]
将未感染病毒的匍柄霉菌株svhn-02、slhn-10和链格孢菌株aa81601以及对应的感染了slmv1病毒的svhn-02-v、slhn-10-v和aa81601-v菌株分别接种至pda培养基,培养2周后,用直径5mm的打孔器打出菌饼。接着,在1.5ml的离心管内加入5%甘油,再加入菌饼,混和、悬浮5分钟。然后使用血细胞计数器来计算悬浮液中存在的分生孢子数。
[0110]
结果显示,正常菌株产生的分生孢子数量比感染了真菌病毒slmv1的菌株产生的分子孢子数量要多(图16)。该结果表明本发明的真菌病毒slmv1能抑制宿主菌的分生孢子形成,表示在其抑制植物病菌致病力的同时,也很有可能会抑制其传播、感染扩大等。
[0111]
实施例11
[0112]
在本实施例中,用针刺接种法研究了本发明病毒slmv1对植物病原真菌的防治是否有效。
[0113]
1.在pda液体培养基中接种本菌株slhn-03,在25℃的室内进行培养。接种后第14天后,离心收集上清液,用0.22μm直径的细菌过滤器,除去菌体细胞。然后在100ml的三角瓶中加入50mlpda培养基和10ml滤液,并在其中接种正常的囊状匍柄霉菌株svhn-02(不含真菌病毒slmv1),共培养7天后,取菌丝接种到pda平板,获得感染slmv1病毒的菌株svhn-02-v。用针尖刺在20~30℃的温室培育的莴苣的第4叶左右两侧,造成伤口,在该伤口部分分别覆盖svhn-02和svhn-02-v的菌丝琼脂块,将植物体置于26℃、相对湿度为100%的接种箱中静置24小时后,将苗盆移到温室内,并维持室温在23~30℃,在接种后培养7天。然后计测病斑的大小。
[0114]
结果见图17,结果显示菌株svhn-02感染了病毒slmv1后,不形成病斑。说明本发明的病毒slmv1对植物病原真菌的防治是有效的。
[0115]
2.以前述同样方法感染正常的烟草赤星病菌菌株aa81601(不含真菌病毒slmv1),获得感染slmv1病毒的菌株aa81601-v,结果见图18,结果显示菌株aa81601感染病毒slmv1后生长速度减慢,未形成病斑。说明本发明的病毒slmv1对植物病原真菌的防治是有效的。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



