TCR多样性的测定方法和应用与流程
 2021-02-02 00:02:12|
2021-02-02 00:02:12| 399|
399| 起点商标网
起点商标网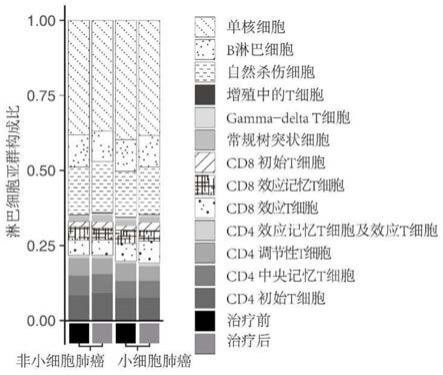
tcr多样性的测定方法和应用
技术领域
[0001]
本发明涉及免疫诊断领域,具体来说涉及通过测定tcr多样性来确定受试者的免疫状态,进而对治疗效果和预后进行预测性诊断的方法和系统。
背景技术:
[0002]
肺癌是全球癌症死亡的主要原因,是我国发病率和死亡率均居首位的恶性肿瘤。70%~80%的肺癌患者就诊时已处于中晚期,错过了最佳的治疗时机,具有五年生存率低、预后差的特点。临床医生对晚期肺癌患者临床获益和预期生存时间的可靠评估非常重要,有助于医生和患者共同选择合适的治疗方案,从而实现个体化治疗。
[0003]
晚期肺癌患者的全身免疫状态与其临床结局密切相关,而适应性免疫状态是抗肿瘤治疗的关键影响因素。机体抗肿瘤免疫应答以细胞免疫应答为主,其中t细胞介导的免疫应答在杀伤肿瘤细胞、控制肿瘤生长中至关重要。t 细胞通过t细胞抗原受体(t cell receptor,tcr)识别肿瘤抗原,引起效应细胞的激活和效应分子的释放,从而激活抗肿瘤免疫。在这一过程中,tcr多样性是特异性识别肿瘤抗原、产生有效免疫应答的先决条件。机体免疫系统的主要t细胞群体是αβt细胞,其多样性由α链和β链的可变区(v区)决定。每条肽链的可变区包含三个高可变环区:cdr1、cdr2和cdr3,cdr1和 cdr2由v基因编码,序列相对保守,与mhc分子结合;而cdr3区由重组的v(d)j编码,具有超变性,与抗原肽直接结合,是tcr识别抗原的核心部分。因此,t细胞cdr3的多样性能够直接反应出t细胞的功能及机体适应性免疫状态。
[0004]
既往已有关于晚期肺癌患者外周血免疫组库的相关研究,该研究采用了以基因组dna为模板的免疫组库测序技术,对外周血中t淋巴细胞受体 cdr3序列进行测序,发现晚期肺癌患者的外周血tcr组库与健康人存在显著差异,还发现治疗前后外周血tcr多样性增加超过10%和重叠指数高的晚期肺癌患者预后较好(liu y等.characteristics and prognostic significance of profiling the peripheral blood t-cell receptor repertoire in patients withadvanced lung cancer[j].international journal of cancer,2019)。然而,基于liu 等人的文章中的分析结果,未经治疗组的基线多样性水平与包括持续临床获益(dcb;durable clinical benefit)和无进展生存期(pfs;progress-free survival)的预后指标上并没有展现出显著关联。
[0005]
然而,使用基因组dna为模板的免疫组库测序技术存在一些缺陷。一方面重组的v(d)j基因只占基因组dna非常少的一部分,代表性相对较差;另一方面使用基因组dna作为模板会产生背景杂质,包括不参与重组的 v(d)j基因和内含子,加上多重pcr带来的非特异性扩增,误差相对较大。
[0006]
另外,对于获得的tcr测序数据如何进行分析,使其更有价值也是本领域不断探索的课题。
[0007]
因此,需要一种更准确、高效的方法来利用tcr组库测序结果预测患者的预后。
3
’
(seq id no:4);
[0032]
第二轮pcr引物:
[0033]
上游引物:5
’-
aatgatacggcgaccaccgagatctacactctttcc ctacacgacg-3
’
(seq id no:5);
[0034]
下游引物:5
’-
caagcagaagacggcatacgagat-barcode-gtg actggagttcagacgtgtg-3
’
(seq id no:6)。
[0035]
优选地,步骤(2.2)进行三轮巢氏pcr,并且分别使用如下引物:
[0036]
第一轮pcr引物:
[0037]
上游引物:5
’-
aagcagtggtatcaacgcag-3
’
(seq id no:7);
[0038]
下游引物:5
’-
gtgtggccttttgggtgtgg-3
’
(seq id no:8);
[0039]
第二轮pcr引物:
[0040]
上游引物:5
’-
tctttccctacacgacgctcttccgatctaagcagt ggtatcaacgcag(seq id no:3);
[0041]
下游引物:5
’-
gtgactggagttcagacgtgtgctcttccgatct tctgatggctcaaacacagc-3
’
(seq id no:4);
[0042]
第三轮pcr引物:
[0043]
上游引物:5
’-
aatgatacggcgaccaccgagatctacactctttcc ctacacgacg-3
’
(seq id no:5);
[0044]
下游引物:5
’-
caagcagaagacggcatacgagat-barcode-gtg actggagttcagacgtgtg-3
’
(seq id no:6)。
[0045]
在具体的实施方案中,步骤(4)中的tcr多样性是通过计算香农-威纳指数并以10为底对该指数进行对数换算确定的。
[0046]
所述受试者是肿瘤患者,优选癌症患者,更优选晚期癌症患者,最优选晚期肺癌患者;所述癌症选自非小细胞肺癌、小细胞肺癌、肺鳞状细胞癌、肺腺癌和肺大细胞癌。
[0047]
第一方面的方法可用于在治疗前、治疗中或治疗后测定受试者的tcr 多样性。
[0048]
发明人发现,受试者治疗前的基线外周血tcr多样性可以作为肺癌患者无进展生存期的独立预后指标。
[0049]
因此,第二方面,本发明涉及根据受试者的基线tcr多样性测定受试者免疫状态、预测受试者预后的方法,其中所述基线tcr多样性是根据第一方面的方法在受试者进行治疗前测定的。所述治疗包括化疗、细胞治疗、免疫治疗、细胞治疗。优选地,所述治疗是免疫检查点抑制性或激活性治疗。预测受试者预后包括预测受试者无进展生存期的长短。所述基线tcr多样性可以与预先设定的阈值或来自其他受试者的已知数据进行比较,由此判定受试者的免疫状态或治疗预后。所述受试者为晚期肺癌患者时,所述预先设定的阈值为约3.91,当受试者的tcr多样性高于该阈值时,判断所述受试者具有较好的预后;当受试者的tcr多样性低于该阈值时,判断所述受试者具有较差的预后。
[0050]
发明人还发现,治疗后的外周血tcr多样性可以用于建立评估受试者适应性免疫状态的模型,从而预测预后。
[0051]
因此,第三方面,本发明涉及根据受试者治疗后的tcr多样性预测受试者预后的方法,其中所述基线tcr多样性根据第一方面的方法在受试者进行治疗后测定,所述方法包括
使用下述公式计算风险评分:
[0052]
风险评分=(0.9617
×
吸烟状态值)+(-2.9831
×
治疗后tcr多样性值) +(-1.6088
×
免疫炎性指数(sii)变化百分比)。
[0053]
所述风险评分可以与预先设定的阈值或来自其他受试者的已知数据进行比较,由此判定受试者的适应性免疫状态或预测治疗预后。与预先设定的阈值或来自其他受试者的已知数据进行相比,风险评分更低者为低风险,无进展生存期较长,预后较好;风险评分相等或较高者为高风险,无进展生存期较短,预后较差。
[0054]
所述治疗包括化疗、细胞治疗、免疫治疗、细胞治疗。优选地,所述治疗是免疫检查点抑制性或激活性治疗。预测受试者预后包括预测受试者无进展生存期的长短。
[0055]
第四方面,本发明涉及根据受试者的基线tcr多样性测定受试者免疫状态或预测受试者治疗预后的系统,其包括:
[0056]
(1)存储装置,其存储在治疗前对受试者的tcr序列文库进行dna测序获得的测序信息,所述受试者的tcr序列文库使用来自受试者外周血的 rna建立;
[0057]
(2)计算装置,其根据所述测序信息计算受试者的基线tcr多样性,并将其与预先设定的阈值或来自其他受试者的已知数据进行比较,由此判定受试者的免疫状态或治疗预后;和
[0058]
(3)输出装置,其输出所述计算装置的计算结果、比较结果和/或判定结果。
[0059]
第五方面,本发明涉及根据受试者的治疗后tcr多样性测定受试者适应性免疫状态的系统,其包括:
[0060]
(1)存储装置,其存储在治疗后对受试者的tcr序列文库进行dna测序获得的测序信息,所述受试者的tcr序列文库使用来自受试者外周血的 rna建立,还存储所述受试者的吸烟状态和sii指数变化百分比值;
[0061]
(2)计算装置,其根据所述测序信息计算受试者的tcr多样性,并根据如下公式计算风险评分,并将风险评分与预先设定的阈值或来自其他受试者的已知数据进行比较,由此判定受试者的适应性免疫状态或治疗预后:
[0062]
风险评分=(0.9617
×
吸烟状态值)+(-2.9831
×
治疗后tcr多样性值) +(-1.6088
×
sii指数变化百分比);和
[0063]
(3)输出装置,其输出所述计算装置的计算结果、比较结果和/或判定结果。
[0064]
在第三、第四和第五方面的具体实施方案中,所述tcr序列文库使用不包括多重pcr的方法构建。在优选的实施方案中,所述方法tcr序列文库的构建包括巢氏pcr,优选多轮巢氏pcr,即至少两轮巢氏pcr。
[0065]
在第三和第四方面的具体实施方案中,所述tcr序列文库构建包括如下步骤:
[0066]
(2.1)基于模板转换技术对tcrβ链(trb)的cdr3的v、d和j区进行反转录,并在cdna的3
’
端添加共有序列和分子标签,
[0067]
(2.2)进行多轮巢式pcr,并将测序接头序列添加到终产物中;
[0068]
在所述反转录和巢式pcr中,任选地除最后一轮巢氏pcr外,使用的下游引物为针对共有序列和trb基因c区(trbc)设计的嵌套trbc特异性引物,且上游引物为基于模板转换技术中待引入反转录产物中的共有序列和分子标签设计的引物,
[0069]
反转录和每轮巢式pcr的扩增体系中分别只使用一条下游引物和一条上游引物。
[0070]
优选地,所述多轮巢氏pcr为两轮、三轮、四轮或更多轮巢氏pcr,最优选两轮或三轮巢氏pcr。
[0071]
优选地,在所述反转录和巢氏pcr中,上一轮产物作为下一轮pcr的模板,并且下一轮pcr中使用的trbc特异性引物所针对的trb基因c区中的区域相比上一轮pcr中使用的trbc特异性引物所针对的trb基因c 区中的区域更靠近c区的5
’
端,至少最后两轮巢氏pcr的引物均带有部分测序接头序列并且上游引物和下游引物均与上一轮的上游引物和下游引物分别部分重叠。
[0072]
优选地,对于所述至少最后两轮巢氏pcr,上游引物连接的部分测序接头是illumina部分p5测序接头;下游引物连接的部分测序接头是illumina部分p7测序接头。
[0073]
优选地,其中(2.1)使用如下的上游引物和下游引物进行反转录:
[0074]
上游引物为:
[0075]5’-
aagcaguggtaucaacgcagagunnnnunnnnunnnnuc tt(rg)3-3
’
(seq id no:1);
[0076]
下游引物为:
[0077]5’-
cagtatctggagtcattga-3
’
(seq id no:2)。
[0078]
优选地,步骤(2.2)进行两轮巢氏pcr,并且分别使用如下引物:
[0079]
第一轮pcr引物:
[0080]
上游引物:5
’-
tctttccctacacgacgctcttccgatctaagcagt ggtatcaacgcag-3
’
(seq id no:3);
[0081]
下游引物:5
’-
gtgactggagttcagacgtgtgctcttccgatct tctgatggctcaaacacagc-3
’
(seq id no:4);
[0082]
第二轮pcr引物:
[0083]
上游引物:5
’-
aatgatacggcgaccaccgagatctacactctttcc ctacacgacg-3
’
(seq id no:5);
[0084]
下游引物:5
’-
caagcagaagacggcatacgagat-barcode-gtg actggagttcagacgtgtg-3
’
(seq id no:6)。
[0085]
优选地,步骤(2.2)进行三轮巢氏pcr,并且分别使用如下引物:
[0086]
第一轮pcr引物:
[0087]
上游引物:5
’-
aagcagtggtatcaacgcag-3
’
(seq id no:7);
[0088]
下游引物:5
’-
gtgtggccttttgggtgtgg-3
’
(seq id no:8);
[0089]
第二轮pcr引物:
[0090]
上游引物:5
’-
tctttccctacacgacgctcttccgatctaagcagt ggtatcaacgcag(seq id no:3);
[0091]
下游引物:5
’-
gtgactggagttcagacgtgtgctcttccgatct tctgatggctcaaacacagc-3
’
(seq id no:4);
[0092]
第三轮pcr引物:
[0093]
上游引物:5
’-
aatgatacggcgaccaccgagatctacactctttcc ctacacgacg-3
’
(seq id no:5);
[0094]
下游引物:5
’-
caagcagaagacggcatacgagat-barcode-gtg actggagttcagacgtgtg-3
’
(seq id no:6)。
[0095]
第四和第五方面的系统可以进一步包括测序装置,对如上所述构建的 tcr序列文库进行测序。
[0096]
在第四和第五方面的具体实施方案中,所述计算装置通过计算香农-威纳指数并以10为底对该指数进行对数换算来计算基线tcr多样性值。
[0097]
所述受试者是肿瘤患者,优选癌症患者,更优选晚期癌症患者,最优选晚期肺癌患者;所述癌症选自非小细胞肺癌、小细胞肺癌、肺鳞状细胞癌、肺腺癌和肺大细胞癌。
附图说明
[0098]
图1显示了晚期肺癌患者pbmc细胞亚群构成比。
[0099]
图2显示了晚期肺癌患者治疗前后外周血tcr多样性的相关性。
[0100]
图3a-e显示了晚期肺癌(非小细胞肺癌和小细胞肺癌)患者中治疗前(基线)外周血tcr多样性与不同细胞亚群占比的相关性。(a)cd4
+
初始t细胞; (b)cd8
+
初始t细胞;(c)cd8
+
效应t细胞;(d)cd4
+
中央记忆t细胞;(e) cd4
+
效应记忆t细胞即效应t细胞。
[0101]
图4a-c显示了晚期肺癌(非小细胞肺癌和小细胞肺癌)患者中治疗后外周血tcr多样性与不同细胞亚群占比的相关性。(a)cd4
+
初始t细胞;(b) cd8
+
初始t细胞;(c)cd8
+
效应t细胞。
[0102]
图5a-b显示了(a)基线外周血tcr多样性与预后应答之间的关系;和(b) cd4
+
初始t细胞占比与预后应答之间的关系。
[0103]
图6a-d显示了基线外周血tcr多样性与预后的关系。(a)基于风险比显示不同因素(以香农-威纳指数体现的tcr多样性;性别;年龄;吸烟状态;病例分型)与预后的关联性。(b-d)在不同病理类型的肺癌患者中(图b,晚期肺癌患者(包含非小细胞肺癌和小细胞肺癌患者);图c,非小细胞肺癌患者;图d,小细胞肺癌患者),基线外周血tcr多样性与无进展生存率的关联性。
[0104]
图7a-e显示了预后风险评估模型的预后价值。(a-c)显示了训练集(a)、测试集(b)和整个数据集(c)中高风险组和低风险组的无进展生存率差异;(d)显示了本发明的模型在训练集、测试集和整个数据集中的一致性指数(c-index); (e)对风险评分模型进行可视化展示的列线图(nomogram),用于预测晚期肺癌患者的无进展生存期
[0105]
发明详述
[0106]
tcr多样性与免疫状态
[0107]
肿瘤患者的全身免疫状态指包括固有免疫和适应性免疫在内的整体免疫反应能力,与患者的临床结局密切相关。适应性免疫状态指适应性免疫的反应能力,是抗肿瘤治疗的关键影响因素。机体抗肿瘤免疫应答以细胞免疫应答为主,其中t细胞介导的免疫应答在杀伤肿瘤细胞、控制肿瘤生长中至关重要。
[0108]
t细胞通过t细胞抗原受体(t cell receptor,tcr)识别肿瘤抗原,引起效应细胞的激活和效应分子的释放,从而激活抗肿瘤免疫。t细胞抗原受体或t细胞受体(t cell receptor,tcr)是t细胞特异性识别和结合抗原肽-mhc 分子的分子结构,通常与cd3分子呈tcr-cd3复合物形式存在于t细胞表面。tcr可分为tcrα/β和tcrγ/δ两种类型,外周血t细胞主要是tcrα/β t细胞,是介导机体特异性细胞免疫反应的主要细胞。外周血t细胞tcr的多样性由α链和β链的v区决定,vα和vβ各有3个高度可变区,又称为互补决定区(cdr),即cdr1、
cdr2和cdr3。但只有cdr3直接与抗原相互作用,在tcr识别抗原过程中具有核心地位,序列具有高度可变性,被认为是t细胞克隆来源的标识。从基因水平来讲,cdr1、cdr2仅由v基因片段编码,而vβ的cdr3由v-d-j三个基因片段编码,vα的cdr3则由 v-j两个基因片段编码。多个基因片段编码增加了cdr3的变异,加之重排过程中的n区核苷酸插入和连接的变异性也集中在cdr3区,这些都丰富了cdr3的多样性。
[0109]
在本发明的实施方案中,优选所述tcr多样性值是外周血tcr多样性值。外周血中初始t细胞和中央记忆性t细胞是未活化的t细胞,代表机体识别和清除非己成分的能力,每个克隆仅有一个细胞,tcr多样性高;而初始t细胞或中央记忆性t细胞特异性识别抗原后被激活从而产生抗原特异性的克隆扩增,此时每个克隆由多个细胞组成,tcr多样性低。因此,外周血tcr多样性实际上定量地反映了未活化的t细胞和效应t细胞的相对比例关系,也代表着机体的适应性免疫状态。在这一过程中,tcr多样性是特异性识别肿瘤抗原、产生有效免疫应答的先决条件。
[0110]
在本文的上下文中,“基线免疫状态”反映了患者治疗前的适应性免疫反应能力。基线tcr多样性可以在治疗方案的确定中发挥作用,所述治疗包括放疗、化疗、靶向治疗、细胞治疗,优选免疫检查点抑制性或激活性治疗。
[0111]“治疗后tcr多样性值”反映了患者的适应性免疫状态。肿瘤患者的全身免疫状态是包括固有免疫和适应性免疫在内的整体免疫反应能力,与患者的临床结局密切相关。适应性免疫状态指适应性免疫的反应能力,是抗肿瘤治疗的关键影响因素。机体抗肿瘤免疫应答以细胞免疫应答为主,其中t细胞介导的免疫应答在杀伤肿瘤细胞、控制肿瘤生长中至关重要。t细胞通过 t细胞抗原受体(t cell receptor,tcr)识别肿瘤抗原,引起效应细胞的激活和效应分子的释放,从而激活抗肿瘤免疫。在这一过程中,tcr多样性是特异性识别肿瘤抗原、产生有效免疫应答的先决条件。
[0112]
发明人分析了治疗前后患者外周血tcr多样性与t细胞成分的相关性,发现治疗前后的外周血tcr多样性均能反映患者的适应性免疫状态,治疗前的基线外周血tcr多样性可以作为肺癌患者无进展生存期的独立预后指标(参见图1),且治疗前后的tcr多样性指数有强相关性(参见图2)。在建立计算模型的过程中,同时纳入了治疗前和治疗后的tcr多样性作为候选参数进行筛选,基于具体的筛选标准,确定将治疗后的tcr多样性值用于构建模型。因此,本发明特别关注治疗后的适应性免疫状态,即具体的计算公式中使用的治疗后tcr多样性值。
[0113]
在具体的实施方案中,本发明的tcr多样性值通过构建tcr多样性测序文库并进行测序,然后根据测序结果计算香农-威纳指数来计算。
[0114]
tcr多样性文库的构建
[0115]
在本发明的上下文中,“tcr多样性文库”、“tcr测序文库”、“tcr多样性测序文库”、“tcr序列文库”和“tcr文库”可互换使用,具有相同的含义。
[0116]
本发明的tcr多样性测序文库的构建使用来源于受试者外周血的rna 样品作为模板,以模板转换技术为基础,通过反转录和多轮巢氏pcr例如两轮、三轮或更多轮巢氏pcr进行。在优选的实施方案中,本发明的tcr 多样性测序文库使用中国专利申请公开cn107779495a中描述的方法建立。
[0117]
使用外周血样品在采样时对受试者的损伤小,样品易获得。以rna为模板通过反转
录得到的cdna具有免疫特异性。所述方法的扩增体系简单,避免了多重pcr带来的非特异性。同时在扩增的同时引入了分子标签,能够在后期分析数据过程中进一步增加序列的特异性,减少由pcr造成的偏倚。
[0118]
本发明的方法使用来自外周血的细胞,如外周血单个核细胞(pbmc),外周血淋巴细胞(pbl)和其他血细胞亚群,包括但不限于t细胞、自然杀伤细胞、单核细胞、单核细胞前体细胞、造血干细胞或非多能干细胞。在优选的实施方案中,本发明的方法使用外周血白细胞、外周血单个核细胞(pbmc)、外周血cd4
+
t细胞、cd8
+
t细胞。在最优选的实施方案中,本发明的方法使用外周血白细胞。
[0119]
可以使用本领域的任何技术从受试者的外周血中获得需要的细胞群体或细胞亚群。
[0120]
本发明的受试者是患有肿瘤的受试者,优选肺部肿瘤特别是肺癌,包括非小细胞肺癌如肺腺癌、肺鳞状细胞癌,小细胞肺癌,大细胞肺癌。
[0121]
转换技术是chudakov等人于2014年提出利用反转录和扩增包括trb 在内的人免疫组(nature methods 2014,11:653-655;nature protocol 2016,11: 1599-1616)。模板转换技术即利用反转录酶superscript ll内源的末端转移酶活性,在模板mrna的5
’
帽子存在的前提下,能够在cdna链的末端加上 3-6个胞嘧啶(c)的特性,在反转录体系中加入一端接有3-4个鸟嘌呤(g)的特定序列,从而将特定序列引入反转录产物的方法。chudakov等在文章(naturemethods 2014,11:653-655)中首先利用smartnnnna 5
’-
adaptor(序列为 5
’
aagcaguggta ucaacgcagagunnnnunnnnunnnnucttrgrgrgrg3
’
)和人trb基因 c段特异性引物(5
’
cagtatctggagtcattga3
’
或 5
’
gtatctggagtcattga3
’
),借助模板转换技术,将smartnnnna 5
’-ꢀ
adaptor序列引入反转录产物(cdna)。其中rgrgrgrg为碱基为g的核苷酸序列,12个n为长度为12的随机序列,作为分子标签引入反转录产物,用以纠正pcr扩增造成的偏移。随后以cdna产物为模板,smartnnnna 5
’-ꢀ
adaptor中的部分序列为上游引物(5
’-
aagcagtggtatcaacgca-3
’
),人 trbc基因更靠近5
’
端的特异性序列(5
’-
tgcttc tgatggctcaaacac-3
’
) 为下游引物,进行第一轮pcr扩增。随后产物纯化后又作为模板,以连接了随机序列的smartnnnna5
’-
adaptor中的部分序列((n)2
-ꢀ
4(xxxxx)cagtggtatcaacgcagag)为上游引物,针对人多个j基因位座的多条特异性序列为下游引物,进行第二轮pcr扩增(此过程为多重pcr)。扩增产物用二代测序建库试剂盒进行连接测序接头和测序。chudakov等巧妙的利用smartnnnna 5
′-
adaptor,既避免了起始阶段的多重pcr,又将分子标签引入体系,能够在后期数据分析时纠正pcr引入的错误和偏差。然而chudakov等在第二轮pcr时依然使用了针对人j基因位座的多条引物,还是将pcr系统变为多重pcr体系。
[0122]
用途
[0123]
通过本发明的方法获得的tcr多样性可以反映受试者的免疫状态。该免疫状态可以用于判断受试者的身体状况、预测治疗效果、预测预后等用途。
[0124]
基线tcr多样性可以用于预测受试者对于某种治疗的预后,包括药物响应率、不良反应、无进展生存期、总生存时间等。在预测预后时,根据本发明的tcr多样性测定方法在治疗之前获得受试者的基线tcr多样性,然后可以与事先设定的阈值相比较,或与从其他受试者群体采集的已知数据相比较.从而预测预后。
[0125]
在具体的实施方案中,所述阈值可以为约3.91,特别是当所述受试者为肺癌中晚期患者时,更特别是肺癌晚期患者时。在本发明的上下文中,“约”表示在本领域技术人员可以理解的范围内的系统误差,如上下浮动1%至 10%。
[0126]
也可以将患者的基线tcr多样性结果与从其他受试者处采集的已知数据比较,从而根据已知受试者的tcr多样性值与预后的对应关系做出判断。优选地,所述已知受试者与待测受试者进行的治疗相同,且采集样品建库以供测定tcr多样性的相对时间点大致相同,即均为治疗前或治疗后的一段相同的时间。
[0127]
所述治疗可以是化疗、靶向治疗、细胞治疗、免疫治疗,优选涉及免疫检查点抑制或激活的治疗,包括抑制或激活免疫检查点的治疗。例如,使用激活或抑制免疫检查点的抗体、小分子药物、经改造的免疫细胞等。所述免疫检查点包括但不限于pd-1、pdl-1、ctla-4、lag-3、tim-3、tigit、 cd27、cd40、ox40、gitr。
[0128]
本发明还建立了风险评估模型,基于患者的吸烟状态、治疗前后sii变化和治疗后的tcr多样性来预测预后。所述风险评估模型利用如下公式计算风险评分:
[0129]
风险评分=(0.9617
×
吸烟状态值)+(-2.9831
×
治疗后tcr多样性值)+ (-1.6088
×
系统免疫炎症(sii)指数变化百分比值),
[0130]
其中若所述受试者为吸烟者,则吸烟状态值为1,若所述受试者为非吸烟者,则吸烟状态值为0;所述系统免疫炎症指数(systemic immune
-ꢀ
inflammation index,sii)变化百分比值=(治疗后sii指数-治疗前sii指数)/治疗前sii指数;sii指数=p
×
n/l,其中p、n和l分别是外周血血小板、中性粒细胞和淋巴细胞的绝对值计数。
[0131]
系统免疫炎症指数(systemic immune-inflammation index,sii)是基于外周血血小板、中性粒细胞和淋巴细胞的绝对值计数来计算的指数,由hu等人提出,最初用于肝癌根治性切除后的预后评估(hu等,systemic immune
-ꢀ
inflammation index predicts prognosis of patients after curative resection forhepatocellular carcinoma.clin cancer res.2014;20(23):6212-22)。sii指数代表了机体的免疫和炎性状态。由于这三种血液细胞计数属于血常规检测的内容, sii指数非常容易获得,因此逐渐成为预测肿瘤和其他炎性疾病临床结果的常用指标。
[0132]
在本发明的方法中,在使用受试者外周血构建tcr多样性文库时,可以同时利用外周血样品测定sii,这简化了应用本发明的模型来评估预后时的采样过程。
[0133]
本发明的模型关注治疗前后sii指数的变化,因为通过筛选发现其与患者的预后情况相关,因此将其作为计算风险评分的一个关键参数并赋予权重。在本发明的模型中,sii指数变化百分比值=(治疗后sii指数-治疗前sii指数)/治疗前sii指数。治疗后的sii指数如果高于治疗前的sii指数,那么风险评分会降低,并且sii指数在治疗后升高的幅度越大,风险评分降低的越多。这意味着患者sii指数的上升预示着更好的预后,例如更长的无进展生存期。
[0134]
本领域已知吸烟会造成肺部损伤,吸烟史与肺癌的发生相关。本发明也发现患者的吸烟史与肺癌的治疗预后情况存在关联,因此将是否吸烟也纳入作为计算风险评分的参数。在本发明的模型中,吸烟状态值为1或0,代表吸烟或不吸烟,并为其赋予权重。根据本发明的计算模型,在患者为吸烟者时,风险评分更高,意味着预后更差,例如无进展生存期更短。
[0135]
本发明的受试者是患有肺癌的受试者,特别是中晚期肺癌。在优选的实施方案中,所述受试者按照ajcc肺癌分期(第8版)分为iiia期、iiib期、 iiic期、iva期ivb期的肺癌患者。肺癌包括非小细胞肺癌如肺腺癌、肺鳞状细胞癌,小细胞肺癌,大细胞肺癌。优选地,所述肺癌是非小细胞肺癌或小细胞肺癌。更优选地,所述肺癌是中期或晚期的非小细胞肺癌或小细胞肺癌。
[0136]
本发明的计算模型具有良好的一致性指数(concordance index,c-index)。一致性指数是体现模型预测能力的参数。例如,对于两名受试者a和b而言,如果基于预测模型获得的结果是a的预后好于b,且最终观察结果一致,那么说明预测结果与实际一致。一致性指数是根据模型计算的预测结果与实际结果一致的情况所占的比例,其取值范围为0.5-1。若预测与实际完全不一致,则一致性指数为0.5,意味着预测模型的准确度没有超过随机判断的情况。如果模型计算的结果与实际结果完全一致,则一致性指数为1,预测非常可信。一般来说,如果计算模型具有0.7以上的一致性指数,可以认为该计算模型是不错的计算模型;如果具有0.8以上的一致性指数,可以认为该计算模型是强大的计算模型;如果一致性指数接近1,则是近乎完美的计算模型。本发明建立的预后风险评估模型训练集和测试集的一致性指数分别是0.726和0.694,高于或接近0.7,表示其预测效能良好,预测结果可靠。
[0137]
使用本发明的模型计算的风险评分可以直接用于评估治疗的预后情况。所述预后情况包括但不限于治疗后的进展情况和治疗的最终结果,例如无进展生存期,总生存期,是否缓解,是否治愈等。优选地,所述预后情况包括无进展生存期。
[0138]
本发明的优势
[0139]
将本发明的方法和系统的优势总结如下:
[0140]
1.采用受试者的外周血进行文库构建,对患者的损伤小,样品易于获得。
[0141]
2.采取的tcr建库方法以rna为模板,反转录得到的cdna具有免疫特异性;扩增体系简单,避免了多重pcr带来的非特异性;同时引入分子标签,能够在后期分析数据过程中进一步增加序列的特异性,减少由pcr造成的偏倚。
[0142]
3.目前缺少对晚期肺癌患者适应性免疫状态系统性的评价指标,本发明的检测和分析方法能够定量地在一定程度上反映出患者适应性免疫的反应能力,并与患者的疗效和预后相关。
[0143]
4.发现治疗前(基线)外周血tcr多样性在用于评估适应性免疫状态时同时适用于晚期非小细胞肺癌患者和晚期小细胞肺癌患者,如图4所示。
[0144]
5.本发明建立的预后风险评估模型对于训练集和测试集的一致性指数 (c-index)分别是0.726、0.694,预测效能良好,预测结果可靠。
[0145]
综上,与背景技术相比,本发明采用了简单且特异性高的tcr建库方法,揭示了基线外周血多样性评价适应性免疫状态的能力及其预后意义,并进一步建立基于外周血相关指标的预后风险评估模型。
实施例
[0146]
为了更全面地理解和应用本发明,下文将参考实施例和附图详细描述本发明,所述实施例仅是意图举例说明本发明,而不是意图限制本发明的范围。本发明的范围由后附的权利要求具体限定。
[0147]
实施例1.tcr多样性的确定
[0148]
根据如下流程从72名晚期肺癌患者的外周血提取rna,通过使用提取的rna建库、测序和分析获得了tcr多样性数据。
[0149]
1.从血液样本提取rna
[0150]
研究纳入72名晚期肺癌患者,其中非小细胞肺癌49例,小细胞肺癌23 例。患者接受1-2个疗程的化疗或靶向药物治疗,根据治疗方案的不同每个疗程3-4周边不等。在接受治疗前和治疗后分别收集来自患者的外周血6ml,并使用edta抗凝。然后在12小时内提取白细胞,加入trizol裂解液保存,防止rna降解,具体方法如下。
[0151]
首先将装有肺癌患者外周血的采血管在室温下,120g离心20分钟,将上层清液转移到新的1.5ml离心管中用以分离血小板和血浆,将中间白色细胞层和下层红色液体转移到装有15ml红细胞裂解液的50ml离心管中,颠倒混匀,冰上静置裂解15分钟,期间反复颠倒混匀3次以上。将裂解红细胞后的样本于4℃条件下,400g离心10分钟,随后弃上层液体,用移液枪尽量吸干净,留下沉淀。将沉淀用2ml红细胞裂解液重新悬浮,并转移到两个1.5ml离心管中,冰上静置裂解10分钟,然后于4℃,400g条件下离心 10分钟,弃上清,保留底部白色沉淀,即为白细胞。为去除白细胞沉淀中过多的离子,我们使用含有0.8%edta的磷酸缓冲盐溶液(pbs)洗涤白细胞沉淀。使用含有0.8%edta的磷酸缓冲盐溶液重悬白细胞,吹吸混匀,于4℃, 400g条件下离心10分钟,用移液枪将上层液体吸去,尽量吸干净,获得用于后续试验的白细胞样本。为保证rna不降解,进行rna的提取和后续试验,分离得到的白细胞样本中加入1ml trizol裂解液,并吹吸15次以上,使得白细胞充分裂解,在提取rna之前保存于-80℃待用。
[0152]
使用trizol法提取白细胞的总rna。
[0153]
2.建库
[0154]
依据中国专利申请公开文本cn107779495a中描述的用于人类受试者建库的方法,使用上述步骤中获得的rna建立t细胞抗原受体多样性测序文库。使用的引物如下。
[0155]
表1:
[0156]
[0157][0158]
上表1中的所有引物溶解、均制成浓度为100μm的贮存液。工作液浓度为10μm。
[0159]
3.1反转录:以上表1中的trbc-rt和5tsa为引物,采用superscript
tm ii reverse transcriptase(thermo fisher#18064014)试剂盒,进行引物特异性反转录,生成cdna模板,具体步骤如下:
[0160]
(1)rna变性,加引物孵育:
[0161]
取700ng rna,加入trbc-rt(10μm)1μl,加水至6.9μl,混匀,pcr 仪中70℃ 2min,42℃ 2min;
[0162]
(2)反转录,通过模板置换,在cdna的3
’
端引入分子标签和共有序列,反应体系如下:
[0163][0164]
将上述体系混匀后,加入2.1中的rna与引物的混合物中,pcr仪中 42℃ 90min,70℃ 15min,随后置于冰上;
[0165]
(3)降解过量5tsa引物:
[0166]
依次加入udg酶1μl,10
×
udg缓冲液2.3μl(总体积23.3μl),混匀后于pcr仪中37℃孵育40min。
[0167]
3.2第一轮pcr:以反转录获得的cdna为模板,进行第一轮pcr。反转录后反应体系总体积约为23μl,将其按照5μl/管,分装到5个200μl pcr 管中作为pcr模板。上游引物为反转录过程中利用模板转换原理在cdna3
’
端引入的共有序列,下游引物为trbc特异性引物,引物设计的位置较反转录引物更加靠近trbc的5
’
端。采用high-fidelity dna polymerase (neb#m0491l)及配套试剂,配置pcr体系,按顺序加入以下试剂:
[0168][0169]
将上述体系混匀后加入装有5μl反转录产物的pcr管中,混匀,按照以下程序进行pcr:
[0170][0171]
本轮扩增主要目的在于通过添加一条基因特异性引物,增加产物特异性,减少非特异扩增序列对后续实验的干扰。
[0172]
3.3第二轮pcr:以第一轮pcr产物为模板,进行第二轮pcr。第一轮pcr产物5管,合计250μl,将其合并后作为模板进行第二轮pcr。本轮上游引物为反转录过程中引入的共有序列连接illumina部分p5测序接头,下游引物为第三条trbc特异性引物连接部分illumina部分p7测序接头,第三条trbc特异性引物设计的位置较前更加靠近trbc的5
’
端。此处通过pcr扩增将部分接头序列作为共有序列加入到pcr产物中。同样采用high-fidelity dna polymerase(neb#m0491l)及配套试剂,配置pcr体系,按顺序加入以下试剂:
[0173][0174]
将上述体系混匀后按照以下程序进行pcr:
[0175][0176]
3.4第三轮pcr:以第二轮pcr产物为模板,进行第三轮pcr。这轮 pcr中,利用共有序列,设计引物进行第三轮pcr,将完整的接头序列掺入pcr产物中,完成建库。
[0177]
具体而言,用qiaquick pcr purification kit(qiage#28106)纯化第二轮pcr产物,纯化产物体积约10-20μl,以此作为模板进行第三轮pcr。以 superf和superr为扩增引物。superr在设计时包含有6-8个碱基作为barcode,每个样品采用独有的barcode序列(illumina公布有多种barcode序列),可以作为每个样品pcr产物的独有标记,以便多样品混合测序。同样采用 high-fidelity dna polymerase(neb#m0491l)及配套试剂配置pcr体系,按顺序加入以下试剂:
[0178][0179]
将上述体系混匀后按照以下程序进行pcr:
[0180][0181]
3.5将得到的产物用qiaquick pcr purifcation kit(qiage#28106)纯化,纯化产物体积约30μl,建库完成。经质控合格后可混合测序。
[0182]
4.测序
[0183]
采用illumina测序仪,以双端150bp(pe150)方法测序,测序量为9g。同时对同一患者的白细胞进行转录组测序。
[0184]
5.数据清洗和处理
[0185]
在migec软件中将tcr序列文库测序数据中包含的序列按照唯一分子标识符(unique molecular identifiers,umis)分组,把至少包含4~6个序列的 umi认为是有效的分子标签,从而获得目的片段的序列。唯一分子标识符(unique molecular identifiers,umis)随机性地利用不同的分子标签标记、区分不同的分子,umi给每一条原始dna片段加上一段特有的标签序列,经pcr 扩增后一起进行测序。根据不同的标签序列,就能区分不同来源的dna模板,从而提高检测灵敏度和特异性。
[0186]
将获得的序列比对到人的tcr参考v、d、j和c基因进行序列组装,利用mixcr软件提取cdr3区序列并识别v、d和j基因区段;
[0187]
vdjtools软件计算tcr多样性指数即香浓-威纳指数,并以10为底对香浓-威纳指数进行对数转换,记录转换后获得的数值。
[0188]
实施例2.tcr多样性与适应性免疫状态的关联性
[0189]
首先利用外周血单个核细胞(peripheral blood mononuclear cell,pbmc)单细胞数据构建分子标签,随后利用cibersortx工具整合分子标签和白细胞转录组数据得到除中性粒细胞外的细胞亚群相对比例。经过血常规中性粒细胞比例矫正后得到各细胞亚群在白细胞中所占比例。
[0190]
为探究外周血tcr多样性与细胞亚群所占白细胞比例之间的关系,进行了spearman相关性分析。结果显示,基线外周血tcr多样性与cd4
+
初始t细胞(rho=0.39,p=0.00096,图3a)、cd8
+
初始t细胞(rho=0.26,p=0.029,图3b)、cd4
+
中央记忆性t细胞(rho=0.36,p=0.0022,图3d)呈正相关关系,与cd4
+
效应t细胞(rho=-0.31,p=0.0084,图2e)、cd8
+
效应t细胞(rho=
-ꢀ
0.50,p<0.0001,图3c)呈负相关关系。治疗后外周血tcr多样性与cd4
+
初始t细胞(rho=0.52,p<0.0001,图4a)、cd8
+
初始t细胞(rho=0.35,p=0.0029,图4b)呈正相关关系,与cd8
+
效应t细胞(rho=-0.58,p<0.0001,图4c)呈负相关关系。
[0191]
以上结果说明,未活化的免疫细胞占比与tcr多样性程度呈正相关,而激活后的免
疫细胞占比与tcr多样性呈负相关。具体来说,外周血中初始t细胞和中央记忆性t细胞是未活化的t细胞,代表机体识别和清除非己成分的能力,每个克隆仅有一个细胞,tcr多样性高;而初始t细胞或中央记忆性t细胞特异性识别抗原后被激活从而产生抗原特异性的克隆扩增,此时每个克隆由多个细胞组成,tcr多样性低。因此,外周血tcr多样性实际上定量地反映了未活化的t细胞和效应t细胞的相对比例关系,也代表着机体的适应性免疫状态,即治疗前外周血的基线tcr多样性与患者的适应性免疫状态至少部分相关。
[0192]
实施例3.基线外周血tcr多样性与疗效的关联性
[0193]
根据实体肿瘤疗效评价标准1.1版,发明人将接受靶向治疗和化疗的患者分为两组:pr(partial response)组和非pr组。对pr和非pr组的基线外周血tcr多样性进行比较,发现pr组的基线外周血tcr多样性高于非pr 组(t检验,p=0.04,图5a)。
[0194]
二列相关(biserial correlation)适用于分析有序二分类变量和连续变量之间的相关性,通过二列相关系数(biserial correlation coefficient)探究了外周血 tcr多样性与疗效之间的关系,结果显示基线外周血tcr多样性越高,疗效越趋向于疗效好(rb=0.032,p=0.024,图5a)。
[0195]
另外,与非pr组相比,pr组的cd4初始t细胞比例更高(图5b),意味着有更多的免疫储备去识别肿瘤抗原,这与上述实施例2中的结果相符。
[0196]
实施例4.基线外周血tcr多样性作为晚期肺癌患者无进展生存期的独立预后因素
[0197]
首先通过r语言survminer包确定了tcr多样性指数最优的截断值为 3.91,基于该值将受试者分为高多样性组(32名患者,tcr多样性值>3.91)和低多样性组(40名患者,tcr多样性值≤3.91)。
[0198]
为了进一步评估基线外周血tcr多样性的在预后预测中的价值,发明人构建了多因素cox比例风险回归模型,包括基线外周血tcr多样性、性别、年龄、病理类型、吸烟状况和肿瘤分期等参数。生存分析结果表明基线外周血tcr多样性是晚期肺癌无进展生存的独立预后因素(hr,0.37,95% ci,0.21-0.63,p=0.00031,图6a)。
[0199]
为进一步验证该截断值的适用性,分别对所有患者、非小细胞肺癌患者、小细胞肺癌患者绘制进行kaplan-meier分析。生存曲线显示,以3.91为截断值,无论是在所有晚期肺癌患者(log-rank,p=0.0003,图6b),还是在非小细胞肺癌(log-rank,p=0.009,图6c)或小细胞肺癌患者(log-rank,p=0.0005,图6d)中,基线外周血tcr高多样性组,无进展生存期较长,预后较好。
[0200]
实施例5.基于外周血相关指标建立预后风险评估模型
[0201]
由于纳入的患者包括非小细胞肺癌患者和小细胞肺癌患者,所以我们根据病理分型分层抽样,将所有的患者划分为训练集(n=52)和测试集(n=17)。
[0202]
生存资料的经典方法是cox比例风险回归模型,该模型要求自变量之间相互独立,且样本量大于预测变量,各变量之间常具有强相关、呈现高维度和共线性的资料中,传统cox模型就不再适用。而lasso(最小化绝对收缩和选择算子)方法通过构造一个罚函数得到一个较为精炼的模型,使得它压缩一些系数,同时设定一些系数为零,对高维资料进行降维,它提供了一种新的变量筛选算法,可以很好的解决共线性问题。
[0203]
在本发明的模型构建中,共纳入了28个变量作为候选变量,具体为:吸烟状态、tnm分期、病理分型、治疗前克隆性指数、治疗后克隆性指数、重叠指数overlap、重叠指数
cosine、治疗前nlr(中性粒细胞/淋巴细胞比值)、治疗后nlr、治疗前后的nlr差值、治疗前后nlr变化的百分比值、治疗前后nlr变化的百分比绝对值、治疗前plr(血小板/淋巴细胞比值)、治疗后plr、治疗前后的plr差值、治疗前后plr变化的百分比值、治疗前后plr变化的百分比绝对值、治疗前sii、治疗后sii、治疗前后的sii差值、治疗前后sii变化的百分比值、治疗前后sii变化的百分比绝对值、治疗前后tcr多样性指数差值、log10(治疗前后tcr多样性指数差值绝对值)、治疗前后tcr多样性指数变化的百分比值和治疗前后tcr多样性指数变化的百分比绝对值。应用上述28个变量建立lasso cox回归模型,并用留一交叉验证法验证,采用最小lambda值筛选出与患者无进展生存期密切相关的三个参数:治疗后的外周血tcr多样性、系统免疫炎症指数(systemic immune-inflammation index,sii)治疗前后变化的百分比和吸烟状态,根据筛选出变量的多因素cox回归系数建立了晚期肺癌患者预后风险评估模型:
[0204]
风险评分=(0.9617
×
吸烟状态值)+(-2.9831
×
治疗后tcr多样性值)+ (-1.6088
×
sii指数变化百分比值)
[0205]
其中“治疗后tcr多样性值”通过如实施例1中所述的方法确定并计算;
[0206]“吸烟状态值”在患者有吸烟史时取1,无吸烟史时取0;
[0207]
sii指数变化百分比值=(治疗后sii-治疗前sii)/治疗前sii,并且
[0208]
sii=p
×
n/l,其中p、n和l分别是外周血血小板、中性粒细胞和淋巴细胞的绝对值计数。
[0209]
预后风险评估模型在训练集、测试集和整个数据集的一致性指数 (concordance index;c-index)分别是0.726、0.694和0.675,预测效能良好(图 6d)。从图7d中可以看出,治疗后tcr多样性、sii治疗前后百分比变化和吸烟状态这三个因素都具有超过0.5的一致性指数,意味着其都可以用来预测预后情况。重要的是,将三个因素整合在一起的本发明的计算模型获得的风险评分,与这三个因素中任何一个单独使用时相比,特别是与sii指数变化或吸烟状态相比,都具有更高的一致性指数,意味着通过本发明的计算模型将三个因素整合在一起,建立了更强力的预后预测体系。
[0210]
分别计算训练集和测试集患者的风险评分,并通过中位值分组,风险评分较低的为低风险组,风险评分较高的为高风险组。具体来说,将52名训练集患者中风险评分排名前50%以内的26名患者划分为高风险组,另外26 名患者为低风险组;将17名测试集患者中风险评分前50%以内的8名患者划分为高风险组,另外9名患者为低风险组。相应地,对于整个数据集中的 69名患者而言,34名为高风险,35名为低风险。
[0211]
制作kaplan-meier生存曲线,在曲线上某个时间点上的生存率=上一个时间点的存活率
×
(当前时间有多少人确实存活/当前时间有多少人可能还活着)=上一个时间点的存活率
×
(当前时间存活人数/(当前时间存活人数+删失人数))。其中“删失人数”为随访不到的受试者数。在每个发生删失的时间点上,画小竖线标记删失样本。kaplan-meier生存曲线如图7a-c所示,可见无论是在训练集还是在测试集或整个数据集中,高风险组的患者无进展生存期较短,低风险组的患者无进展生存期较长,存在显著差异。低风险组显示的患者数为3/2/1时,存在删失数据(随访不到),因此在图上显示为一条直线。
[0212]
还统计了受试者的hr(hazardratio)风险比,hr的计算方式为:hr=暴露组的风险函数h1(t)/非暴露组的风险函数h2(t),t指在某一相同的时间点。风险函数指危险率函数、
条件死亡率、瞬时死亡率。hr由单因素cox比例风险回归模型计算得到。hr表示暴露组与非暴露组相比,发生终点事件的风险的比值,是暴露组与非暴露组患者生存情况相比的相对值。hr值大于 1,提示暴露因素是阳性事件发生的促进因素。因此,图6a-c中的风险比意味着高风险组疾病进展的风险分别是低风险组的2.72、2.22、1.82倍,进一步验证了本模型确定的低风险组具有更长的无进展生存期。
[0213]
随后对上述风险评分模型进行可视化的展示,构建了nomogram图(图 7e)以便于预测晚期肺癌患者的无进展生存期。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



