一种荧光假单胞菌的烈性噬菌体ΦPf1901、噬菌体ΦPf1901的制剂及其应用的制作方法
 2021-02-01 23:02:29|
2021-02-01 23:02:29| 385|
385| 起点商标网
起点商标网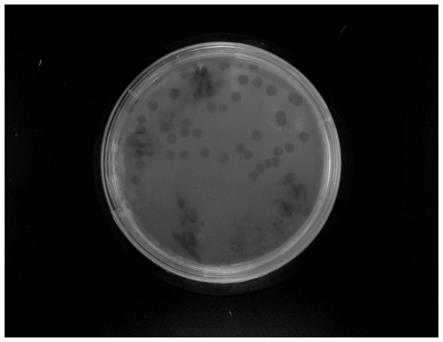
一种荧光假单胞菌的烈性噬菌体
φ
pf1901、噬菌体
φ
pf1901的制剂及其应用
技术领域
[0001]
本发明属于噬菌体应用技术领域,尤其涉及一种荧光假单胞菌的烈性噬 菌体φpf1901、噬菌体φpf1901的制剂及其应用。
背景技术:
[0002]
水产品因具有高蛋白、低脂肪、低热量的优点而倍受消费者青睐,水产 品在我国居民的膳食结构中所占比例越来越大,推动了水产养殖业的迅猛发 展。根据联合国粮农组织统计,世界水产品捕获及养殖总量的29.2%用于鲜 销出售,且其需求量以每年10%的速度递增,由此可见世界范围内对于生鲜 水产品的喜爱程度以及其背后蕴含的经济价值及潜力巨大。但水产品在贮藏 过程中,由于加工包装方式和贮藏条件的不同导致某些微生物会逐渐占据优 势地位并产生臭味和异味代谢物,最终导致水产品腐败,不仅丧失营养价值, 也给消费者的食品安全和身体健康造成危害。在可造成生鲜水产品腐败的细 菌中,荧光假单胞菌(pseudomonas fluorescens)就是其中的一种优势腐败 菌。
[0003]
荧光假单胞菌既是淡水鱼的优势腐败菌也是海产品的优势腐败菌,还常 见于临床上污染的血液及血制品中。当病人输入了被荧光假单胞菌污染的血 液及血制品后,可出现败血症、感染性休克和血管内凝血等严重后果。由于 现有的许多抗菌药物对荧光假单胞菌都不敏感,所以一旦感染此菌,病死率 很高。
[0004]
控制水产品中腐败性细菌生长的主要方法就是使用抗细菌药物,但是抗 细菌药物的长期大量使用,带来了诸如环境污染、耐药性产生以及食品安全 等问题,而且抗生素的研发的周期较长,研发成本高,所以寻求一种既能够 有效控制水产品中的细菌又完全无害的环境友好型的新技术、新产品,用以 部分或完全替代抗细菌药物成为当前研究的热点。噬菌体防治法因具有对环 境没有污染、不会破坏生态环境、不会使细菌产生耐药性等诸多优点而越来 越受到人们的重视。
[0005]
噬菌体是专门裂解细菌、放线菌和蓝细菌的病毒,主要由蛋白质和核酸 构成,没有细胞结构,广泛存在于土壤、空气、水及生物体中。根据增殖方 式可分为烈性噬菌体与温和噬菌体两大类。烈性噬菌体是指侵染宿主菌后即 展开复制与增殖过程,并最终裂解宿主细胞释放子代噬菌体的一类噬菌体, 其增殖过程分为吸附、侵入、复制、装配、释放五个步骤。因烈性噬菌体对 宿主菌有很强的裂解能力,已用于细菌感染的治疗。治疗耐药细菌感染的噬 菌体制剂的开发已成为国内外研究的热点之一。
[0006]
目前荧光假单胞菌的烈性噬菌体还存在效价低,应用困难的问题。
技术实现要素:
[0007]
有鉴于此,本发明的目的在于提供一种荧光假单胞菌的烈性噬菌体 φpf1901、噬菌体φpf1901的制剂及其应用。
[0008]
为了实现上述发明目的,本发明提供了以下技术方案:
[0009]
一种荧光假单胞菌的烈性噬菌体φpf1901,保藏编号为cctcc m2019447。
[0010]
优选的,所述烈性噬菌体φpf1901的效价为(1.4~3)
×
10
10
pfu/ml。
[0011]
优选的,所述烈性噬菌体φpf1901的最佳感染复数值为0.0001。
[0012]
本发明提供了所述的荧光假单胞菌的烈性噬菌体φpf1901在抑制荧光假 单胞菌中的应用。
[0013]
优选的,所述荧光假单胞菌的烈性噬菌体φpf1901与荧光假单胞菌的数 量比例为(1~10):1。
[0014]
本发明还提供了一种所述的荧光假单胞菌的烈性噬菌体的制剂,所述制 剂中烈性噬菌体的含量为(1.4~3)
×
10
12
pfu。
[0015]
优选的,所述制剂中烈性噬菌体的含量为1.42
×
10
12
pfu。
[0016]
本发明提供了所述的φpf1901制剂在抑制荧光假单胞菌中的应用。
[0017]
本发明的有益效果:本发明提供的荧光假单胞菌的烈性噬菌体φpf1901, 对荧光假单胞菌具有很高的特异性和裂解能力,效价为(1.4~3)
×
10
10 pfu/ml,最佳感染复数值为0.0001;本发明提供的荧光假单胞菌的烈性噬 菌体的制剂中烈性噬菌体的含量为(1.4~3)
×
10
12
pfu,可用于水产品中荧 光假单胞菌的控制,对宿主的裂解、清除作用强;环境适应能力强,对于温 度、ph的耐受范围均比较广,并且对氯仿不敏感。
附图说明
[0018]
图1为本发明提供的烈性噬菌体φpf1901裂解宿主细胞的平板裂解图;
[0019]
图2为烈性噬菌体φpf1901的热稳定性;
[0020]
图3为烈性噬菌体φpf1901的最佳ph范围测定;
[0021]
图4为烈性噬菌体φpf1901的吸附率;
[0022]
图5为烈性噬菌体φpf1901的一步生长曲线图;
[0023]
图6为烈性噬菌体φpf1901的透射电镜图;
[0024]
图7为烈性噬菌体φpf1901对罗非鱼鱼片荧光假单胞菌的控制效果。
[0025]
生物保藏说明
[0026]
本发明所述的荧光假单胞菌的烈性噬菌体φpf1901, pseudomonas fluorescens bacteriophage φpf1901保藏于中国典型培养 物保藏中心,保藏编号为cctcc m2019447,保藏日期2019年6月 11日,保藏地点:湖北省武汉市洪山区八一路,武汉大学保藏中心。
具体实施方式
[0027]
本发明提供了一种荧光假单胞菌的烈性噬菌体φpf1901,pseudomonas fluorescens bacteriophage φpf1901保藏编号为cctcc m2019447。本发明 中所述荧光假单胞菌的烈性噬菌体φpf1901来源于污水样品,在本发明具 体实施过程中,所述烈性噬菌体φpf1901来源于辽宁省锦州市;所述烈性 噬菌体φpf1901能够特异性的识别和裂解荧光假单胞菌。所述烈性噬菌体 φpf1901的效价优选为(1.4~3)
×
10
10
pfu/ml,更优选为1.42
×
10
10
pfu/ml, 所述烈性噬菌体φpf1901的最佳感染复数值为0.0001。
[0028]
在本发明中,所述烈性噬菌体φpf1901通过以下方法分离获得:1)将 污水样品与cacl2混合后进行固液分离,收集液相组分过滤获得滤液;2)将 步骤1)中所述的滤液、营养
液、荧光假单胞菌液混合震荡培养获得培养液; 3)将所述培养液离心,收集上清、过滤,将过滤获得的滤液与荧光假单胞 菌液混合孵育后与营养液混合,置于素琼脂平板中培养获得烈性噬菌体 φpf1901。
[0029]
本发明将污水样品与cacl2混合后进行固液分离,收集液相组分过滤获 得滤液。在本发明中,所述污水样品优选的来源于辽宁省锦州市小凌河排污 的废水;本发明中,所述cacl2在混合液中的浓度优选为0.8~1.2mmol/l, 更优选为1.0mmol/l;所述cacl2的作用为使样品中的噬菌体更易于吸附宿 主菌。本发明中,所述固液分离优选为离心,所述离心的转速优选为8000 r/min,所述离心的时间优选为10min;本发明在所述固液分离后收集液相组 分进行过滤,所述过滤优选为滤膜过滤,所述滤膜的孔径优选为0.22μm。
[0030]
在本发明中,将所述的滤液、营养液、荧光假单胞菌液混合震荡培养获 得培养液。在本发明中,所述滤液、营养液、荧光假单胞菌液的体积比优选 为20:5:2;所述营养液优选为lb液体培养基;所述荧光假单胞菌优选为对 数生长期的荧光假单胞菌。在本发明中,所述震荡培养的温度优选为30℃, 所述震荡培养的转速优选为130r/min,所述震荡培养的时间优选为10~14h, 更优选为12h。
[0031]
本发明在获得所述培养液后,将所述培养液离心,收集上清、过滤。在 本发明中所述离心的温度优选为4℃,所述离心的转速优选为8000r/min, 所述离心的时间优选为10min。本发明中,所述过滤优选为滤膜过滤,所述 滤膜的孔径优选为0.22μm。本发明在所述过滤后,将过滤获得的滤液与荧 光假单胞菌液混合孵育后与营养液混合,置于素琼脂平板中培养获得烈性噬 菌体φpf1901。在本发明中,所述滤液与荧光假单胞菌液的体积比优选为1:2; 所述混合孵育的时间优选为10~20min。在本发明中,所述滤液与营养液的 体积比优选为1:50;所述营养液优选为温度为50℃,琼脂含量为0.75wt%的 lb培养基。本发明中,所述素琼脂平板为1.5wt%的琼脂粉在121℃灭菌15 min的平板。本发明在上述操作后,形成双层平板。本发明待所述双层平板 凝固后置于恒温培养箱中,30℃培养10~14h,所述双层平板不需倒置培养, 双层平板中的水分有利于噬菌体的吸附。
[0032]
本发明在培养获得所述烈性噬菌体φpf1901后,优选的还包括对所述烈 性噬菌体进行纯化。在本发明中,所述纯化包括以下步骤:s1)挑取上述双 层平板上的单个噬菌斑与sm缓冲液混匀获得噬菌体液;s2)对所述噬菌体 液进行梯度稀释后置于双层平板中培养;s3)重复上述s1)~s2)步骤2~4 次获得纯化的噬菌体。
[0033]
在本发明中,所述单个噬菌斑优选的与1ml的sm缓冲液混匀,所述 混匀的时间优选的大于等于4h,所述混匀的温度优选的为4℃;所述混匀优 选的在摇床上进行。在本发明中,所述噬菌体液在稀释前优选的进行震荡, 所述稀释的倍数优选的为10倍梯度稀释,更优选的选择10-5
、10-6
两个梯度 的稀释液置于双层平板培养。在本发明具体实施过程中,所述稀释液优选的 与荧光假单胞菌对数期菌液以2:1的体积比例混合10~15min后与lb培养 基混合制成双层平板。上述双层平板纯化步骤优选的重复3次获得纯化的噬 菌体φpf1901。
[0034]
本发明在获得所述纯化的噬菌体φpf1901后,还包括对所述纯化的噬菌 体φpf1901进行保存。在本发明中,所述保存的方法优选为将所述纯化后的 噬菌体φpf1901与sm缓冲液混合震荡后离心,收集上清液,于4℃保存。
[0035]
本发明还提供了一种包括所述的荧光假单胞菌的烈性噬菌体φpf1901的 制剂,
所述制剂中烈性噬菌体的含量为(1.4~3)
×
10
12
pfu,优选为1.42
×
10
12 pfu。
[0036]
本发明还提供了所述的荧光假单胞菌的烈性噬菌体以及包括所述的荧 光假单胞菌的烈性噬菌体φpf1901的制剂在抑制荧光假单胞菌中的应用。在 本发明中,所述荧光假单胞菌的烈性噬菌体φpf1901与荧光假单胞菌的数量 比例优选为(1~10):1。在本发明中,所述荧光假单胞菌的烈性噬菌体φpf1901 能够用于抑制各种环境中的荧光假单胞菌,包括但不限于水产品中的荧光假 单胞菌。
[0037]
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把 它们理解为对本发明保护范围的限定。
[0038]
实施例1
[0039]
(1)实验材料
[0040]
耗材:0.22μm和0.45μm滤膜、eppendorf管(ep管)、试管、50ml离心 管、sm缓冲液、素琼脂平板、lb平板、lb液体培养基、lb半固体
[0041]
宿主菌:荧光假单胞菌
[0042]
培养基:lb液体培养基、琼脂粉
[0043]
(2)菌株培养
[0044]
1)从-20℃取出荧光假单胞菌,在lb培养基上划线,30℃培养16~18h。
[0045]
2)挑取荧光假单胞菌的单菌落,接种于lb液体培养基中,30℃,130 r/min振荡培养8~10h至浑浊。
[0046]
(3)噬菌体分离
[0047]
1)取污水样品(辽宁省锦州市小凌河排污口的废水)45ml,加入 cacl2(使样品中的噬菌体更易于吸附宿主菌)至终浓度1mmol/l,溶解混匀, 8000r/min离心10min,取上清,经0.22μm孔径的滤膜过滤后,滤液保存 于4℃。
[0048]
2)将20ml上述经滤膜过滤的滤液、5mllb液体培养基和2ml对数 期的菌液混合,30℃,130r/min摇床振荡培养过夜。
[0049]
3)4℃,8000r/min离心10min,经0.22μm滤膜过滤,取上清液100μl 与200μl菌液混合,室温孵育15min后,加入5ml温度为50℃,0.75wt% 琼脂的lb培养基,混匀后倒入素琼脂平板(1.5wt%的琼脂粉,121℃,15min 灭菌)中形成双层平板。
[0050]
4)双层平板凝固后置于恒温培养箱中,30℃培养过夜,不需倒置培养, 水分有利于噬菌体的吸附。
[0051]
(4)噬菌体(4℃暂保存)纯化
[0052]
1)培养过夜后,在上述出现噬菌斑的平板上,用无菌的接种针挑取单个 透明噬菌斑于1ml sm缓冲液中,4℃摇床混匀至少4h(或放置过夜)。
[0053]
2)经涡轮振荡器震荡混匀后,取10μl噬菌体液梯度稀释(稀释度选为 10-5
、10-6
)后,将100μl对数期的菌液与200μl噬菌体稀释液常温下混合 15min,再与5ml含0.75wt%琼脂的lb培养基制成双层平板,30℃恒温培 养过夜。双层平板法重复三次,即得到纯的噬菌体φpf1901。噬菌体φpf1901 的一步生长曲线如图5所示,透射电镜图如图6所示。
[0054]
(5)噬菌体效价测定及最佳感染复数的确定
[0055]
事先制备好固体素琼脂平板,作为双层平板的底层。用无菌的sm缓冲 液对噬菌体增殖液进行10倍系列梯度稀释,然后取可计数适当的稀释度(10-7
、10-8
两个稀释度)的噬菌
体稀释液100μl与对数期的菌液200μl加 入到5ml 45~50℃的lb半固体培养基中,用漩涡振荡器充分混匀后,倒入 底层平板上。培养基充分冷凝之后,倒置于恒温培养箱中30℃培养至出现清 晰噬菌斑为止(12h)。每个稀释度设置三组平行,取平均值。噬菌体效价 计算公式如下:噬菌体效价(pfu/ml)=噬菌斑数
×
稀释倍数
×
10。如表1 所示,经计算噬菌体的效价为1.42
×
10
10
pfu/ml。
[0056]
表1噬菌体效价测定结果
[0057][0058]
表2烈性噬菌体φpf1901的最佳感染复数
[0059]
细菌的数目噬菌体数目最佳感染复数12h噬菌体的效价2.236
×
10910
10
101.8
×
10
10
2.236
×
10910916.3
×
10
11
2.236
×
1091080.11.1
×
10
10
2.236
×
1091070.011.0
×
10
10
2.236
×
1091060.0012.0
×
10
10
2.236
×
1091050.00011.8
×
10
11
[0060]
(6)噬菌体保存
[0061]
在已经纯培养三次的噬菌体φpf1901平板中加入sm缓冲液(直径9cm 的平板中加5ml的sm缓冲液,直径15cm平板加入10ml的sm缓冲液), 在4℃摇床上振荡数小时。将平板中的液体转移至无菌的ep管中,4℃,5000 r/min离心15min去掉细菌碎片。吸取所得上清转入新的ep管中,放入4℃ 暂存。
[0062]
(7)吸附率测定
[0063]
以moi=0.1加入效价达10
10
的噬菌体φpf1901和菌浓度为109的菌液摇 床中培养,在不同培养时间取100μl混合液测定效价,重复试验3次。
[0064]
计算公式为:噬菌体吸附率=(1-未吸附噬菌体效价/起始噬菌体效价)
×
100%。
[0065]
由图4,当噬菌体φpf1901与宿主菌悬液混合后即有86%的噬菌体 φpf1901吸附,孵育5min后有97%的噬菌体φpf1901吸附,5min~22min 之内噬菌体φpf1901的吸附率在90%以上,表明噬菌体φpf1901有较好的吸 附率。
[0066]
(8)对氯仿的敏感性测定
[0067]
取1ml纯化制备的荧光假单胞噬菌体φpf1901增殖液,加入1%的氯仿 溶液,充分震荡混匀,室温静置30min,分层后取上层溶液测定其效价,对 比氯仿处理前后噬菌体效价的变化并记录数据。
[0068]
噬菌体φpf1901增殖液:固体平板增殖的液体。
[0069]
噬菌体φpf1901悬浮液:经nacl和peg 8000处理的噬菌体增殖液。
[0070]
噬菌体φpf190增殖液经氯仿处理前后的效价分别为:1.3
×
10
11
、 1.2
×
10
11
。
[0071]
噬菌体φpf1901悬浮液经氯仿处理前后的效价分别为:2.4
×
10
10
、 1.2
×
10
11
。
[0072]
检测结果见表3。
[0073]
表3烈性噬菌体φpf1901对氯仿的敏感性
[0074][0075]
(9)最佳温度范围测定
[0076]
将200μl噬菌体φpf1901分别置于室温25℃和先后设定30℃、40℃、50℃、60℃、70℃、80℃的水浴锅中,孵育60min后测定效价。
[0077]
结果如图2所示,噬菌体φpf1901在室温25℃、30℃、40℃、50℃处理 1h后均能保持较高的的效价,温度为60℃、70℃时,噬菌体φpf1901的效 价下降,当温度为80℃时,噬菌体φpf1901的效价为0。
[0078]
(10)最佳ph范围测定
[0079]
将10%的噬菌体φpf1901纯培养液分别于ph为4、5、6、7、8、9、10、 11、12的lb液体培养基中,室温处理1h后测定效价。
[0080]
结果如图3所示,噬菌体φpf1901在ph为5、6、7、8、9、10、11的 lb液体培养基中处理1h,噬菌体φpf1901均能保持较高的效价;ph为4、 12时,噬菌体φpf1901的效价较低。
[0081]
实施例2
[0082]
烈性噬菌体φpf1901对荧光假单胞菌裂解能力检测(平板法)
[0083]
将200μl荧光假单胞菌浓度为109的菌液与100μl噬菌体φpf1901稀 释液常温下混合10-15min,再与5ml含0.75%琼脂的lb培养基制成双层 平板,30℃恒温培养过夜,裂解宿主细胞的平板裂解图结果如图1所示,观 察、测量噬菌斑直径为1.36mm~3.06mm。
[0084]
实施例3
[0085]
烈性噬菌体φpf1901对荧光假单胞菌裂解能力检测(od
600
法)
[0086]
将单个荧光假单胞菌接种于10ml液体lb肉汤中,30℃,130r/min摇 床过夜培养,然后在取出的5ml菌液中加入200μl纯化的噬菌体φpf1901, 摇床培养2-4h每隔30min观察
菌液是否变澄清,结果如表4所示。
[0087]
表4烈性噬菌体φpf1901的裂解能力(od
600
法)
[0088][0089]
实施例4
[0090]
烈性噬菌体φpf1901对罗非鱼鱼片中荧光假单胞菌的清除作用
[0091]
将烈性噬菌体φpf1901和荧光假单胞菌按照比例为1:1、10:1,同时 设置对照,观察噬菌体对罗非鱼鱼片中荧光假单胞菌的清除作用。
[0092]
具体步骤:
[0093]
在超市购买罗非鱼,用无菌手术刀片将鱼肉切成5+0.5g的薄鱼片,用 现配70%酒精将切好的鱼片浸泡1min灭菌,灭菌后置于无菌塑料平皿中, 在超净工作台中风干。
[0094]
经风干后的鱼片,在一面均匀涂布104cfu/ml、0.1ml荧光假单胞菌菌 液。接种后置于超净工作台中放置15min使菌体自然吸附。
[0095]
低浓度组:鱼片接种荧光假单胞菌接种面均匀涂布104pfu/ml、0.1ml 噬菌体液φpf1901;
[0096]
高浓度组:鱼片接种荧光假单胞菌接种面均匀涂布105pfu/ml、0.1ml 噬菌体液φpf1901;
[0097]
对照组:鱼片接种荧光假单胞菌接种面均匀涂布0.1ml 0.85%nacl;
[0098]
在无菌平皿中保存每块鱼片,每组设置三组平行并用保鲜膜封口,放置 于25℃培养箱中,分别在0h、3h、6h、9h、12h、24h、36h取样,取样 检测时取出每块鱼片放在无菌采样袋中加入100ml 0.85%nacl,10倍梯度稀 释在固体lb平板上涂布培养后计数。
[0099]
表5烈性噬菌体φpf1901对罗非鱼鱼片中荧光假单胞菌的清除作用效果
[0100]
[0101]
由表5及图7,噬菌体液φpf1901的高、低浓度在0-15h对荧光假单胞 菌的控制效果比较明显,15-36h时可能鱼片时间放置的时间比较长,鱼片 表面的水分损失以致菌的活性较低,噬菌体对菌的清除能力下降。组间横向 比较,低浓度组在0-15h对荧光假单胞菌的控制作用较好。不同组间的纵向 比较,高浓度组和低浓度组之间无显著性(p<0.05)差异。
[0102]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普 通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润 饰,这些改进和润饰也应视为本发明的保护范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



