芳环或芳杂环并咪唑类化合物,其制备方法及制药用途与流程
 2021-02-01 23:02:47|
2021-02-01 23:02:47| 235|
235| 起点商标网
起点商标网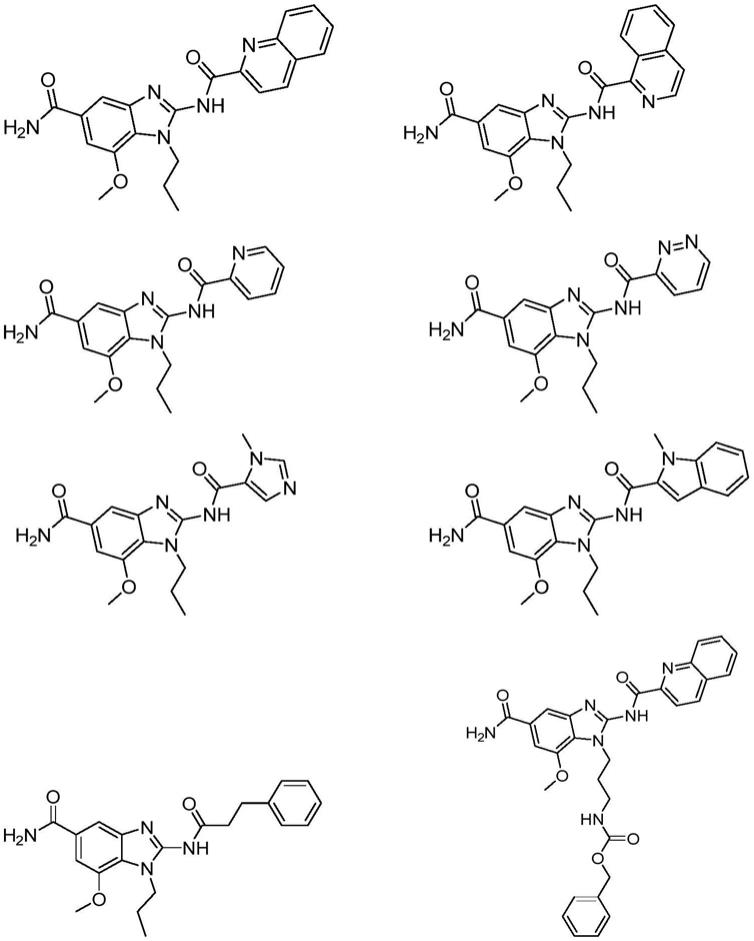
[0001]
本发明涉及药物领域,具体涉及一类含芳环或芳杂环并咪唑结构的化合物或其药学上可接受的盐,其制备方法,含有该类化合物的药物组合物以及该类化合物在制备治疗与sting蛋白功能相关的疾病的药物中的应用。
背景技术:
[0002]
先天免疫系统在识别病原体和激发获得性免疫保护中发挥着重要作用,通过多种模式识别受体(pattern recognition receptors,prrs)来识别病原相关的分子模式(pathogen associated molecular patterns,pamps)从而抵御外来病原微生物的入侵,组成了人体对抗病原体的第一道防线,其包括一系列的细胞作用及相关机制。
[0003]
干扰素基因刺激分子(stimulator of interferon genes,sting)是一种跨膜蛋白,通常形成二聚体并处于自我抑制状态。当受到部分配体(比如环二核苷酸,cdns)的刺激后分子构型发生变化并被激活,招募细胞质中的tank结合激酶1(tank-binding kinase 1,tbk1),介导tbk1对干扰素调节因子3(interferon regulatory factor 3,irf-3)的磷酸化,导致干扰素(interferon-β,ifn-β)和其它多种细胞因子(cytokines)的形成,进而调控非特异性免疫反应。
[0004]
sting蛋白作为非特异性免疫系统中模式识别受体中的一员起着重要的作用,它能够促进干扰素的产生,并且在tbk1-irf3信号通路中起着连接作用。更重要的是,在肿瘤细胞微环境中,非特异性免疫的信号传导是肿瘤特异性t细胞的激活和肿瘤浸润性淋巴细胞浸润的关键步骤,其中i型ifn对肿瘤激活的t细胞活化起着关键作用。同时,sting蛋白激动剂也可以激活包括树突状细胞等免疫细胞,改变肿瘤微环境,诱导肿瘤特异性t细胞的产生,引发机体对肿瘤细胞的免疫应答,在非特异性免疫信号通路中起着重要作用。
[0005]
sting蛋白具有明显的种属选择性,人源sting蛋白天然配体分子环二核苷类(cdns)不稳定,易被多种核酸酶和磷酸二酯酶降解,成药性差;而且,激活干扰素合成通路也带来了一系列副反应,如皮肤过敏反应,流感样综合征,造血系统改变等。
[0006]
近年来,肿瘤免疫疗法已经成为全球制药业的最大开发热点,sting蛋白介导的生理免疫通路是从更广泛的层面激活人体固有免疫系统,故有望适用于多癌种的不同人群,甚至用于治疗癌症之外的其它疾病,如病毒感染,细菌感染以及作为免疫佐剂。因此,随着近年来癌症患病人数的逐年上升,亟需发现活性高,成药性好的新型人源sting蛋白激动剂。
技术实现要素:
[0007]
本发明提供了一类含芳环或芳杂环并咪唑结构的化合物或其药学上可接受的盐,其制备方法,含有该类化合物的药物组合物以及该类化合物在制备治疗与sting蛋白功能相关的疾病的药物中的应用。
[0008]
为解决本发明的技术问题,本发明提供如下技术方案:
[0009]
本发明技术方案的第一方面是提供如通式(i)所示的化合物或其药学上可接受的盐:
[0010][0011]
其中,
[0012]
x选自c或n;条件是当x为n时,r4不存在;当x为c时,r4选自氢、羟基、取代或未取代的c
1-8
烷基、取代或未取代的c
3-8
环烷基、取代或未取代的c
1-8
烷氧基、取代或未取代的c
3-8
环烷氧基;所述的取代基选自c
1-8
烷氧基、c
3-8
环烷氧基、n-吗啉基直链c
1-8
烷基;
[0013]
y选自ch或n;
[0014]
r1选自氢、羧基、甲酯基、取代或未取代的氨甲酰基;所述的取代基选自c
1-8
烷基或c
3-8
环烷基;
[0015]
r3选自喹啉环、异喹啉环、n-取代或未取代的吲哚环、取代或未取代的芳环、取代或未取代的芳杂环、取代或未取代的脂肪环、取代或未取代的脂肪杂环;所述芳环、芳杂环、脂肪环或脂肪杂环选自五元、六元环;所述的取代基选自c
1-8
烷基、c
3-8
环烷基;所述芳杂环或脂肪杂环含有1-3个杂原子,所述杂原子选自n;
[0016]
r2选自具有如下结构的取代基:
[0017]-(ch2)
m-ch3,-(ch2)
m-nh-co
2-ra
[0018]
其中,m选自2、3或4;
[0019]
ra选自叔丁基、苄基。
[0020]
进一步地,根据权利要求1的化合物或其药学上可接受的盐,其特征在于,所述c
1-8
烷基选自甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基自、正戊基、异戊基;所述c
3-8
环烷基选自环丙基、环丁基、环戊基;所述c
1-8
烷氧基自甲氧基、乙氧基、正丙基氧基、异丙基氧基、正丁基氧基、异丁基氧基、叔丁基氧基、正戊基氧基、异戊基氧基;所述c
3-8
环烷氧基选自环丙基氧基、环丁基氧基、环戊基氧基。
[0021]
进一步地,根据权利要求1的化合物或其药学上可接受的盐,其特征在于,ra选自叔丁基,苄基;m选自2、3或4。
[0022]
所述药学上可接受的盐选自有机酸盐或无机酸盐,包括但不限于盐酸盐、氢溴酸盐,硫酸盐、磷酸盐、醋酸盐、柠檬酸盐、苹果酸盐、富马酸盐、酒石酸盐或甲磺酸盐。
[0023]
作为本发明的优选方案,通式(i)的化合物具有如下的结构:
[0024]
[0025]
[0026]
[0027][0028]
本发明技术方案的另一方面是提供如通式(i)所示的化合物或其药学上可接受的盐的合成方法,其合成路线如下:
[0029]
路线(1):
[0030][0031]
试剂与条件:(a)氨水,50℃;(b)r2nh2,碳酸钾,n-甲基吡咯烷酮,120℃;(c)锌粉,醋酸,二氯甲烷,室温;(d)溴化腈,甲醇,60℃;(e)r3cooh,2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐,n,n-二异丙基乙胺,n,n-二甲基甲酰胺;
[0032]
路线(2):
[0033][0034]
试剂与条件:(a)三溴化硼,二氯甲烷,室温;(b)r4’
cl,碳酸钾,n,n-二甲基甲酰胺,120℃;(c)n-(3-氨基丙基)氨基甲酸苄酯,碳酸钾,n-甲基吡咯烷酮,120℃;(d)锌粉,醋酸,二氯甲烷,室温;(e)溴化腈,甲醇,60℃;(f)r3cooh,2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐,n,n-二异丙基乙胺,n,n-二甲基甲酰胺;
[0035]
或
[0036]
路线(3):
[0037][0038]
试剂与条件:(a)n-叔丁氧羰基-1,3-丙二胺,碳酸钾,n-甲基吡咯烷酮,120℃;(b)氢气,钯碳,二氯甲烷,室温;(c)溴化腈,甲醇,60℃;(d)1-乙基-3-甲基-1h-吡唑-5-羧酸,2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐,n,n-二异丙基乙胺,n,n-二甲基甲酰胺;(e)0.5n氢氧化锂溶液,甲醇,室温;(f)氯甲酸乙酯,三乙胺,四氢呋喃,室温;胺的四氢呋喃溶液,室温;
[0039]
其中r1、r2、r3的定义同权利要求1-6任一项所述;r4’
选自取代或未取代的c
1-8
烷基、取代或未取代的c
3-8
环烷基、取代或未取代的c
1-8
烷氧基、取代或未取代的c
3-8
环烷氧基;所述的取代基选自c
1-8
烷氧基、c
3-8
环烷氧基、n-吗啉基直链c
1-8
烷基。
[0040]
本发明技术方案的另一方面是提供药物组合物,所述药物组合物中包含通式(i)所示的化合物或其药学上可接受的盐以及药学上可接受的载体。
[0041]
本发明技术方案的另一方面是提供如通式(i)所示的化合物或其药学上可接受的盐在制备治疗与sting蛋白功能相关的疾病的药物中的应用。
[0042]
本发明技术方案的另一方面是提供如通式(i)所示的化合物或其药学上可接受的盐在制备治疗肿瘤或病毒感染疾病的药物中的应用。
[0043]
有益技术效果
[0044]
本发明技术方案中的实施例10,11,18,19,20,21均对sting蛋白有明显的激动活性,可激活sting蛋白信号通路,介导ⅰ型干扰素,白介素-6以及下游相关细胞因子分泌,进而引起机体对肿瘤细胞的免疫应答并且调控非特异免疫反应。
具体实施方式
[0045]
实施例1
[0046]
n-(5-氨甲酰基-7-甲氧基-1-丙基-1h-苯并[d]咪唑-2-基)喹啉-2-酰胺
[0047][0048]
(1)4-氯-3-甲氧基-5-硝基苯甲酰胺的制备
[0049][0050]
将3-甲氧基-4-丙胺基-5-硝基苯羧酸甲酯(1g,4.1mmol),50ml氨水(28%,50ml)依次加入瓶中,氩气保护下加热至50℃反应5h。将反应冷却至室温,待大量浅黄色固体析出后减压抽滤,滤饼用乙醚洗,干燥得淡黄色固体0.715g,收率75.6%,熔点215-217℃。
[0051]1h nmr(400mhz,dmso-d6)δ8.29(s,1h),8.05(d,j=1.64hz,1h),7.88(d,j=1.56hz,1h),7.78(s,1h),4.02(s,3h).
[0052]
ms(esi)m/z 231.0(m+h)
+
.
[0053]
(2)3-甲氧基-5-硝基-4-丙胺基苯甲酰胺的制备
[0054][0055]
将4-氯-3-甲氧基-5-硝基苯甲酰胺(1g,4mmol),丙胺(0.715ml,8.7mmol),碳酸钾(1.8g,13mmol)置于100ml封管中,用20ml n-甲基吡咯烷酮溶解,100℃条件下反应6小时。将反应冷却至室温,加入饱和氯化铵溶液淬灭反应,砖红色固体析出,减压抽滤,滤饼用乙醚洗,干燥得砖红色固体0.887g,收率87.6%,熔点180-182℃。
[0056]1h nmr(400mhz,dmso-d6)δ8.18(d,j=1.9hz,1h),8.00(s,1h),7.67(t,j=5.8hz,1h),7.54(d,j=1.8hz,1h),7.30(s,1h),3.88(s,3h),3.65(t,j=7.0hz,2h),1.70
–
1.60(m,2h),0.85(t,j=7.4hz,3h).
[0057]
ms(esi)m/z 254.1(m+h)
+
.
[0058]
(3)3-氨基-5-甲氧基-4-丙胺基苯甲酰胺的制备
[0059][0060]
将3-甲氧基-5-硝基-4-丙胺基苯甲酰胺(1.0g,4.0mmol),溶于30ml甲醇中,加入pd/c(0.1g,10%),通入氢气,25℃下反应6h。硅藻土过滤除去pd/c,浓缩反应液,柱层析分离,洗脱剂为二氯甲烷:甲醇=10:1,得白色固体粉末0.71g,收率79.2%,熔点102-104℃。
1-羧酸(0.168g,0.97mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.368g,0.97mmol),n,n-二异丙基乙胺(0.54ml,3.25mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应5h。反应结束后加入饱和氯化铵溶液30ml,有大量淡橘色固体析出,减压抽滤,滤饼用乙醚洗,干燥得淡橘色固体0.149g,收率45.5%,熔点251-252℃.
[0076]1h nmr(400mhz,dmso-d6)δ8.57
–
8.51(m,1h),8.37(d,j=5.7hz,1h),7.89(d,j=8.2hz,1h),7.74(d,j=1.2hz,1h),7.70
–
7.66(m,2h),7.54(t,j=7.7hz,1h),7.11(d,j=1.1hz,1h),7.01(s,1h),4.18(t,j=6.6hz,2h),3.88(s,3h),1.69
–
1.60(m,2h),0.77(t,j=7.4hz,3h).
[0077]
hrms calcd.for c22h22n5o3(m+h)
+
404.17044,found 404.17172.
[0078]
实施例3
[0079]
7-甲氧基-2-(2-吡啶酰胺基)-1-丙基-1h-苯并[d]咪唑-5-酰胺
[0080][0081]
(1)标题化合物的制备
[0082]
将2-氨基-7-甲氧基-1-丙基-1h-苯并[d]咪唑-5-酰胺(0.2g,0.81mmol),吡啶-2-羧酸(0.120g,0.97mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.368g,0.97mmol),n,n-二异丙基乙胺(0.54ml,3.25mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应8h。反应结束后加入饱和氯化铵溶液30ml,有大量白色固体析出,减压抽滤,滤饼用乙醚洗,干燥得白色固体183mg,收率64.1%,熔点>300℃。
[0083]1h nmr(400mhz,dmso-d6)δ8.65(d,j=4.0hz,1h),8.40(d,j=7.8hz,1h),7.88(t,j=7.8hz,1h),7.83(s,2h),7.50
–
7.37(m,1h),7.19(s,1h),7.13(s,1h),4.36(t,j=6.7hz,2h),3.94(s,3h),1.80
–
1.71(m,2h),0.86(t,j=7.4hz,3h).
[0084]
hrms calcd.for c18h20n5o3(m+h)
+
354.15607,found 354.15649.
[0085]
实施例4
[0086]
7-甲氧基-1-丙基-2-(哒嗪-3-甲酰胺基)-1h-苯并[d]咪唑-5-酰胺
[0087][0088]
(1)标题化合物的制备
[0089]
将2-氨基-7-甲氧基-1-丙基-1h-苯并[d]咪唑-5-酰胺(0.2g,0.81mmol),哒嗪-3-羧酸(0.12g,0.97mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.368g,0.97mmol),n,n-二异丙基乙胺(0.54ml,3.25mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应8.5h。反应结束后加入饱和氯化铵溶液30ml,有大量黄色固体析出,减压
抽滤,滤饼用乙醚洗,干燥得黄色固体按实施例3中步骤(5)方法制备,得灰色固体177mg,收率61.7%,熔点268-270℃。
[0090]1h nmr(400mhz,dmso-d6)δ9.33(s,1h),8.32(d,j=8.36hz,1h),7.98(s,1h),7.83(s,1h),7.73(s,1h),7.37(s,1h),7.31(s,1h),4.37
–
4.27(m,2h),3.96(s,3h),1.81
–
1.75(m,2h),0.83(t,j=6.7hz,3h).
[0091]
hrms calcd.for c17h19n6o3(m+h)
+
355.15131,found 355.15167.
[0092]
实施例5
[0093]
7-甲氧基-2-(1-甲基-1h-咪唑-5-甲酰胺基)-1-丙基-1h-苯并[d]咪唑-5-酰胺
[0094][0095]
(1)标题化合物的制备
[0096]
将2-氨基-7-甲氧基-1-丙基-1h-苯并[d]咪唑-5-酰胺(0.2g,0.81mmol),1-甲基-1h-咪唑-5-羧酸(0.122g,0.97mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.368g,0.97mmol),n,n-二异丙基乙胺(0.54ml,3.25mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应5h。反应结束后加入饱和氯化铵溶液30ml,有大量灰色固体析出,减压抽滤,滤饼用乙醚洗,干燥得灰色固体156mg,收率54.2%,熔点>300℃。
[0097]1h nmr(400mhz,dmso-d6)δ12.71(s,1h),7.98(s,1h),7.72(s,1h),7.64(s,1h),7.61(s,1h),7.38(s,1h),7.33(s,1h),4.31(t,j=6.9hz,2h),3.98(s,3h),3.97(s,3h),1.82
–
1.73(m,2h),0.90(t,j=7.4hz,3h).
[0098]
hrms calcd.for c17h21n6o3(m+h)
+
357.16697,found 357.16702.
[0099]
实施例6
[0100]
7-甲氧基-2-(1-甲基-1h-吲哚-2-甲酰胺基)-1-丙基-1h-苯并[d]咪唑-5-酰胺
[0101][0102]
(1)标题化合物的制备
[0103]
将2-氨基-7-甲氧基-1-丙基-1h-苯并[d]咪唑-5-酰胺(0.2g,0.81mmol),1-甲基吲哚-2-甲酸(0.17g,0.97mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.368g,0.97mmol),n,n-二异丙基乙胺(0.54ml,3.25mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应6.5h。反应结束后加入饱和氯化铵溶液30ml,有大量灰色固体析出,减压抽滤,滤饼用乙醚洗,干燥得灰色固体235mg,收率71.8%,熔点>300℃。
[0104]1h nmr(400mhz,dmso-d6)δ12.78(s,1h),7.95(s,1h),7.68
–
7.59(m,2h),7.49(d,j
=8.3hz,1h),7.36(s,1h),7.31
–
7.28(m,2h),7.23(t,j=7.5hz,1h),7.04(t,j=7.3hz,1h),4.34(t,j=6.5hz,2h),4.16(s,3h),3.96(s,3h),1.84
–
1.75(m,2h),0.90(t,j=7.2hz,3h).
[0105]
hrms calcd.for c22h24n5o3(m+h)
+
406.18737,found 406.18637.
[0106]
实施例7
[0107]
7-甲氧基-2-(3-苯丙酰胺基)-1-丙基-1h-苯并[d]咪唑-5-酰胺
[0108][0109]
(1)标题化合物的制备
[0110]
将2-氨基-7-甲氧基-1-丙基-1h-苯并[d]咪唑-5-酰胺(0.2g,0.81mmol),苯丙酸(0.146g,0.97mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.368g,0.97mmol),n,n-二异丙基乙胺(0.54ml,3.25mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应4.5h。反应结束后加入饱和氯化铵溶液30ml,有大量白色固体析出,减压抽滤,滤饼用乙醚洗,干燥得白色固体203mg,收率65.8%,熔点>300℃。
[0111]1h nmr(400mhz,dmso-d6)δ10.51(s,1h),7.98(s,1h),7.77(s,1h),7.33(s,1h),7.30
–
7.27(m,5h),7.22
–
7.17(m,1h),4.00(t,j=9.1hz,2h),3.95(s,3h),2.94(t,j=7.4hz,2h),2.76(t,j=7.2hz,2h),1.72
–
1.51(m,2h),0.67(t,j=7.1hz,3h).
[0112]
hrms calcd.for c21h25n4o3(m+h)+381.19212,found 381.19214.
[0113]
实施例8
[0114]
(3-(5-氨甲酰基-7-甲氧基-2-(喹啉-2-甲酰胺基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯
[0115][0116]
(1)(3-((4-氨甲酰基-2-甲氧基-6-硝基苯基)氨基)丙基)氨基甲酸苄酯的制备
[0117][0118]
将4-氯-3-甲氧基-5-硝基苯甲酰胺(3g,13mmol),n-(3-氨基丙基)氨基甲酸苄酯(4.88ml,26mmol),碳酸钾(5.4g,40mmol)置于100ml封管中,用25ml n-甲基吡咯烷酮溶解,110℃条件下反应8小时。将反应冷却至室温,加入饱和氯化铵溶液淬灭反应,砖红色固体析出,减压抽滤,滤饼用乙醚洗,干燥得砖红色固体4.76g,收率90.8%,熔点153-155℃。
[0119]1h nmr(400mhz,dmso-d6)δ8.20(d,j=1.9hz,1h),8.02(s,1h),7.78(t,j=5.9hz,1h),7.54(d,j=1.7hz,1h),7.39
–
7.26(m,7h),5.76(s,1h),4.99(s,2h),3.86(s,3h),3.48(q,j=6.6hz,2h),3.03(q,j=6.4hz,2h),1.69
–
1.63(m,2h).
[0120]
ms(esi)m/z 403.1(m+h)
+
.
[0121]
(2)(3-((2-氨基-4-氨甲酰基-6-甲氧基苯基)氨基)丙基)氨基甲酸苄酯的制备
[0122][0123]
将(3-((4-氨甲酰基-2-甲氧基-6-硝基苯基)氨基)丙基)氨基甲酸苄酯(6.54g,16mmol),溶于50ml甲醇中,加入锌粉(10g,160mmol),缓慢滴加冰醋酸(9.2ml,160mmol),室温下反应8h。硅藻土过滤除去锌粉,浓缩反应液,加入饱和碳酸氢钠溶液调ph至中性。二氯甲烷萃取混合物三次,蒸馏水洗2次,饱和氯化钠溶液洗1次,水硫酸钠干燥。浓缩,柱层析分离,洗脱剂为二氯甲烷:甲醇=10:1,得白色固体4.12g,收率69.2%,熔点135-137℃。
[0124]1h nmr(400mhz,dmso-d6)δ7.61(s,1h),7.39
–
7.28(m,5h),6.97(s,1h),6.86(d,j=1.9hz,1h),6.79(d,j=1.9hz,1h),5.01(s,2h),4.66(s,2h),3.75(s,3h),3.07(q,j=6.6hz,2h),2.94(t,j=6.6hz,2h),1.56
–
1.49(m,2h).
[0125]
ms(esi)m/z 373.1(m+h)+.
[0126]
(3)(3-(2-氨基-5-氨甲酰基-7-甲氧基-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯的制备
[0127][0128]
将(3-((2-氨基-4-氨甲酰基-6-甲氧基苯基)氨基)丙基)氨基甲酸苄酯(5g,
13mmol),溴化氰(1.71g,16mmol)溶于40ml甲醇中,氩气保护下加热至60℃反应5h。将反应冷却至室温,加入饱和碳酸钾溶液调ph至7~8,大量白色固体析出,减压抽滤,滤饼用乙醚洗,干燥得白色固体4.2g,收率81.3%,熔点218-220℃。1h nmr(400mhz,dmso-d6)δ7.79(s,1h),7.39(d,j=1.2hz,1h),7.37
–
7.27(m,5h),7.09(d,j=1.3hz,1h),7.06(s,1h),6.44(s,2h),5.02(s,2h),4.14(t,j=7.3hz,2h),3.84(s,3h),3.04(q,j=6.6hz,2h),1.82
–
1.75(m,2h).
[0129]
ms(esi)m/z 398.1(m+h)+.
[0130]
(4)标题化合物的制备
[0131]
将(3-(2-氨基-5-氨甲酰基-7-甲氧基-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯(0.25g,0.63mmol),喹啉-2-羧酸(0.132g,0.76mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.289g,0.76mmol),n,n-二异丙基乙胺(0.42ml,2.5mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应6h。反应结束后加入饱和氯化铵溶液30ml,有大量淡黄色固体析出,减压抽滤,滤饼用乙醚洗,干燥得淡黄色固体0.201g,收率57.8%,熔点213-214℃。
[0132]1h nmr(400mhz,dmso-d6)δ13.04(s,1h),11.26(s,0.84h),8.65(d,j=8.2hz,1h),8.44
–
8.36(m,2h),8.24
–
8.14(m,4h),8.05
–
7.60(m,12h),7.40(d,j=14.7hz,3h),7.30
–
7.19(m,12h),5.02(s,2.3h),4.84(s,2h),4.54
–
4.44(m,2.37h),4.37
–
4.27(m,2h),3.98(s,3.45h),3.96(s,3h),3.16
–
3.10(m,2.31h),3.05
–
2.97(m,2h),2.01
–
1.90(m,4.38h).
[0133]
hrms calcd.for c30h29n6o5(m+h)
+
553.21939,found 553.21918.
[0134]
实施例9
[0135]
(3-(5-氨甲酰基-2-(异喹啉-1-甲酰胺基)-7-甲氧基-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯
[0136][0137]
(1)标题化合物的制备
[0138]
将(3-(2-氨基-5-氨甲酰基-7-甲氧基-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯(0.25g,0.63mmol),异喹啉-1-羧酸(0.132g,0.76mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.289g,0.76mmol),n,n-二异丙基乙胺(0.42ml,2.5mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应5h。反应结束后加入饱和氯化铵溶液30ml,有大量黄色固体析出,减压抽滤,滤饼用乙醚洗,干燥得黄色固体0.192g,收率55.2%,熔点
181-182℃.
[0139]1h nmr(400mhz,dmso-d6)δ8.77(s,1h),8.47(s,1h),8.04(s,2h),7.91
–
7.77(m,3h),7.76
–
7.69(m,1h),7.42(s,1h),7.37
–
7.30(m,6h),4.98(s,2h),4.37(t,j=6.3hz,2h),3.97(s,3h),3.04
–
3.00(m,2h),1.97
–
1.85(m,2h).
[0140]
hrms calcd.for c30h29n6o5(m+h)
+
553.21939,found 553.21997.
[0141]
实施例10
[0142]
(3-(5-氨甲酰基-7-甲氧基2-(2-吡啶酰胺基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯
[0143]
(1)标题化合物的制备
[0144]
将(3-(2-氨基-5-氨甲酰基-7-甲氧基-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯(0.25g,0.63mmol),吡啶-2-羧酸(0.94g,0.76mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.289g,0.76mmol),n,n-二异丙基乙胺(0.42ml,2.5mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应5.5h。反应结束后加入饱和氯化铵溶液30ml,有大量灰色固体析出,减压抽滤,滤饼用乙醚洗,干燥得灰色固体171mg,收率54.1%,熔点244-245℃。
[0145]1h nmr(400mhz,dmso-d6)δ12.95(s,1.75h),11.11(s,1h),8.77(s,1h),8.65(s,1h),8.47(s,1h),8.22
–
8.13(m,3h),8.08
–
8.01(m,4h),7.95
–
7.80(m,3h),7.71(s,3h),7.54
–
7.29(m,25.76h),5.10(s,3.71h),4.92(s,2h),4.48
–
4.41(m,3.76h),4.29
–
4.22(m,2h),3.98(s,5.52h),3.96(s,3h),3.07
–
2.96(m,5.68h),1.95
–
1.83(m,5.68h).
[0146]
hrms calcd.for c26h27n6o5(m+h)
+
503.20374,found 503.20343.
[0147]
实施例11
[0148]
(3-(5-氨甲酰基-7-甲氧基2-(哒嗪-3-甲酰胺基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯
[0149][0150]
(1)标题化合物的制备
[0151]
将(3-(2-氨基-5-氨甲酰基-7-甲氧基-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯(0.25g,0.63mmol),哒嗪-3-羧酸(0.95g,0.76mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.289g,0.76mmol),n,n-二异丙基乙胺(0.42ml,2.5mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应8.5h。反应结束后加入饱和氯化铵溶液30ml,有大量灰色固体析出,减压抽滤,滤饼用乙醚洗,干燥得灰色固体162mg,收率51.1%,熔点249-251℃。
[0152]1h nmr(400mhz,dmso-d6)δ13.06(s,1h),9.31(s,1h),8.37(d,j=8.0hz,1h),8.05(s,1h),7.76(s,1h),7.54
–
7.29(m,8h),4.98(s,2h),4.47
–
4.42(m,2h),3.97(s,3h),3.10
–
3.05(m,2h),1.97
–
1.90(m,2h).
[0153]
hrms calcd.for c25h26n7o5(m+h)
+
504.19899,found 504.19855.
[0154]
实施例12
[0155]
(3-(5-氨甲酰基-7-甲氧基-2-(1-甲基-1h-咪唑-5-甲酰胺基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯
[0156][0157]
(1)标题化合物的制备
[0158]
将(3-(2-氨基-5-氨甲酰基-7-甲氧基-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯(0.25g,0.63mmol),1-甲基-1h-咪唑-5-羧酸(0.122g,0.76mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.96g,0.76mmol),n,n-二异丙基乙胺(0.42ml,2.5mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应9h。反应结束后加入饱和氯化铵溶
液30ml,有大量白色固体析出,减压抽滤,滤饼用乙醚洗,干燥得白色固体164mg,收率51.6%,熔点228-229℃。
[0159]1h nmr(400mhz,dmso-d6)δ8.01(s,1h),7.73(s,1h),7.66(d,j=8.9hz,2h),7.38(s,1h),7.37
–
7.31(m,6h),5.00(s,2h),4.35(t,j=6.7hz,2h),3.95(s,6h),3.10
–
3.06(m,2h),1.93
–
1.86(m,2h).
[0160]
hrms calcd.for c25h28n7o5(m+h)
+
506.21464,found 506.21301.
[0161]
实施例13
[0162]
(3-(5-氨甲酰基-7-甲氧基-2-(1-甲基-1h-吲哚-2-甲酰胺基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯
[0163][0164]
(1)标题化合物的制备
[0165]
将(3-(2-氨基-5-氨甲酰基-7-甲氧基-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯(0.25g,0.63mmol),1-甲基吲哚-2-甲酸(0.134g,0.76mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.289g,0.76mmol),n,n-二异丙基乙胺(0.42ml,2.5mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应6.5h。反应结束后加入饱和氯化铵溶液30ml,有大量淡粉色固体析出,减压抽滤,滤饼用乙醚洗,干燥得淡粉色固体240mg,收率68.8%,熔点232-233℃。
[0166]1h nmr(400mhz,dmso-d6)δ12.84(s,1h),8.02(s,1h),7.68(s,1h),7.58(d,j=7.5hz,1h),7.50(d,j=8.3hz,1h),7.40(s,1h),7.35(s,1h),7.31
–
7.23(m,7h),7.06(t,j=7.3hz,1h),4.99(s,2h),4.43(t,j=6.6hz,2h),4.18(s,3h),3.97(s,3h),3.14
–
3.09(m,2h),1.98
–
1.92(m,2h).
[0167]
hrms calcd.for c30h31n6o5(m+h)
+
555.23504,found 555.23700.
[0168]
实施例14
[0169]
(3-(5-氨甲酰基-7-甲氧基-2-(3-苯丙酰胺基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯
[0170][0171]
(1)标题化合物的制备
[0172]
将(3-(2-氨基-5-氨甲酰基-7-甲氧基-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯(0.25g,0.63mmol),苯丙酸(0.134g,0.76mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.289g,0.76mmol),n,n-二异丙基乙胺(0.42ml,2.5mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应7h。反应结束后加入饱和氯化铵溶液30ml,有大量白色固体析出,减压抽滤,滤饼用乙醚洗,干燥得白色固体189mg,收率56.8%,熔点245-246℃
[0173]1h nmr(400mhz,dmso-d6)δ10.47(s,1h),7.96(s,1h),7.77(s,1h),7.37
–
7.24(m,13h),5.00(s,2h),4.10(t,j=9.1hz,2h),3.91(s,3h),2.95
–
2.91(m,4h),2.75(t,j=7.2hz,2h),1.82
–
1.71(m,2h).
[0174]
hrms calcd.for c29h32n5o5(m+h)+530.23980,found 530.23920.
[0175]
实施例15
[0176]
(3-(5-氨甲酰基-7-甲氧基-2-(1-甲基-1h-吡咯-2-甲酰胺基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯
[0177][0178]
(1)标题化合物的制备
[0179]
将(3-(2-氨基-5-氨甲酰基-7-甲氧基-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯(0.25g,0.63mmol),1-甲基-2-吡咯羧酸(0.96g,0.76mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.289g,0.76mmol),n,n-二异丙基乙胺(0.42ml,2.5mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应9h。反应结束后加入饱和氯化铵溶液30ml,
有大量白色固体析出,减压抽滤,滤饼用乙醚洗,干燥得白色固体164mg,收率32.6%,熔点232-233℃。
[0180]1h nmr(400mhz,dmso-d6)δ12.65(s,1h),7.98(s,1h),7.62(s,1h),7.37
–
7.30(m,8h),6.95(s,1h),6.90(s,1h),5.96(s,1h),4.99(s,2h),4.33(t,j=6.8hz,2h),3.97(s,3h),3.94(s,3h),3.08
–
3.04(m,2h),1.92
–
1.85(m,2h).
[0181]
hrms calcd.for c26h29n6o5(m+h)
+
505.21939,found 505.21945.
[0182]
实施例16
[0183]
(3-(5-氨甲酰基-7-甲氧基-2-(1-甲基吡咯烷-2-甲酰胺基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯
[0184][0185]
(1)标题化合物的制备
[0186]
将(3-(2-氨基-5-氨甲酰基-7-甲氧基-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯(0.25g,0.63mmol),1-甲基-2-吡咯烷羧酸(0.1g,0.76mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.289g,0.76mmol),n,n-二异丙基乙胺(0.42ml,2.5mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应9h。反应结束后加入饱和氯化铵溶液30ml,有大量白色固体析出,减压抽滤,滤饼用乙醚洗,干燥得白色固体195mg,收率60.6%,熔点141-142℃。
[0187]1h nmr(400mhz,methanol-d4)δ7.65(s,1h),7.38
–
7.34(m,4h),7.32
–
7.28(m,2h),5.07(s,2h),4.44(t,j=6.4hz,2h),3.98(s,3h),3.74
–
3.61(m,1h),3.16(q,j=6.9,6.2hz,2h),3.06
–
2.96(m,1h),2.92
–
2.88(m,3h),2.60
–
2.44(m,1h),2.27
–
2.12(m,1h),2.03
–
1.93(m,3h),1.35
–
1.22(m,2h).
[0188]
hrms calcd.for c26h33n6o5(m+h)
+
509.25069,found 509.25061.
[0189]
实施例17
[0190]
(3-(5-氨甲酰基-7-甲氧基-2-(1-甲基哌啶-4-甲酰胺基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯
[0191][0192]
(1)标题化合物的制备
[0193]
将(3-(2-氨基-5-氨甲酰基-7-甲氧基-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯(0.25g,0.63mmol),1-甲基-哌啶-4-羧酸(0.109g,0.76mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.289g,0.76mmol),n,n-二异丙基乙胺(0.42ml,2.5mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应5.5h。反应结束后加入饱和氯化铵溶液30ml,有大量浅褐色固体析出,减压抽滤,滤饼用乙醚洗,干燥得浅褐色固体107mg,收率32.4%,熔点101-102℃。
[0194]1h nmr(400mhz,methanol-d4)δ7.41
–
7.21(m,7h),5.05(s,2h),4.46
–
4.40(m,2h),3.97(s,3h),3.54
–
3.32(m,2h),3.24
–
3.00(m,3h),2.89
–
2.82(m,1h),2.77(s,3h),2.73
–
2.59(m,1h),2.21
–
2.12(m,4h),2.00
–
1.94(m,2h).
[0195]
hrms calcd.for c27h35n6o5(m+h)
+
523.26634,found 523.26660.
[0196]
实施例18
[0197]
(4-(5-氨甲酰基-7-甲氧基-2-(2-吡啶酰胺基)-1h-苯并[d]咪唑-1-基)丁基)氨基甲酸叔丁基酯
[0198][0199]
(1)(4-((4-氨甲酰基-2-甲氧基-6-硝基苯基)氨基)丁基)氨基甲酸叔丁酯的制备
[0200]
[0201]
将4-氯-3-甲氧基-5-硝基苯甲酰胺(1g,4mmol),n-叔丁氧羰基-1,4-丁二胺(1.7ml,8mmol),碳酸钾(1.66g,12mmol)置于瓶中,用30ml n-甲基吡咯烷酮溶解,100℃条件下反应4.5小时。将反应冷却至室温,加入饱和氯化铵溶液淬灭反应,大量橘色固体析出,减压抽滤,滤饼用乙醚洗,干燥得橘色固体1.4g,收率91.6%,熔点204-206℃。
[0202]1h nmr(400mhz,dmso-d6)δ8.19(d,j=1.9hz,1h),8.00(s,1h),7.69(t,j=5.9hz,1h),7.54(d,j=1.8hz,1h),7.30(s,1h),6.79(t,j=5.5hz,1h),3.88(s,3h),3.48
–
3.43(m,2h),2.92
–
2.87(m,2h),1.53
–
1.46(m,2h),1.41
–
1.34(m,11h).
[0203]
ms(esi)m/z 383.1(m+h)
+
.
[0204]
(2)(4-((2-氨基-4-氨甲酰基-6-甲氧基苯基)氨基)丁基)氨基甲酸叔丁酯的制备
[0205][0206]
将(4-((4-氨甲酰基-2-甲氧基-6-硝基苯基)氨基)丁基)氨基甲酸叔丁酯(1.3g,3.4mmol),溶于30ml甲醇中,加入pd/c(0.13g,10%),通入氢气,25℃下反应6h。硅藻土过滤除去pd/c,浓缩反应液,柱层析分离,洗脱剂为二氯甲烷:甲醇=10:1,得白色固体0.81g,收率67.6%,熔点134-135℃。
[0207]1h nmr(400mhz,dmso-d6)δ7.60(s,1h),6.96(s,1h),6.85(d,j=1.9hz,1h),6.78(d,j=1.9hz,1h),4.64(s,2h),3.75(s,3h),2.92
–
2.86(m,4h),1.41
–
1.38(m,2h),1.36(s,9h).
[0208]
ms(esi)m/z 353.2(m+h)+.
[0209]
(3)(4-(2-氨基-5-氨甲酰基-7-甲氧基-1h-苯并[d]咪唑-1-基)丁基)氨基甲酸叔丁酯的制备
[0210][0211]
将(4-((2-氨基-4-氨甲酰基-6-甲氧基苯基)氨基)丁基)氨基甲酸叔丁酯(1.7g,5mmol),溴化氰(0.62g,5.8mmol)溶于30ml甲醇中,氩气保护下加热至60℃反应5h。将反应冷却至室温,加入饱和碳酸钾溶液调ph至7~8,大量白色固体析出,减压抽滤,滤饼用乙醚洗,干燥得白色固体1.56g,收率82.5%,熔点211-212℃。1h nmr(400mhz,dmso-d6)δ12.85(s,1h),8.60(s,2h),8.08(s,1h),7.50(d,j=1.3hz,1h),7.45(d,j=1.3hz,1h),6.83(t,j=5.5hz,1h),4.21(t,j=7.2hz,2h),3.97(s,3h),2.95
–
2.91(m,2h),1.70
–
1.63(m,2h),1.45
–
1.40(m,2h),1.35(s,9h).
[0212]
ms(esi)m/z 378.2(m+h)+.
[0213]
(4)标题化合物的制备
[0214]
将(4-(2-氨基-5-氨甲酰基-7-甲氧基-1h-苯并[d]咪唑-1-基)丁基)氨基甲酸叔丁酯(0.3g,0.8mmol),吡啶-2-羧酸(0.119g,0.95mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.363g,0.95mmol),n,n-二异丙基乙胺(0.53ml,3.18mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应3.5h。反应结束后加入饱和氯化铵溶液30ml,有大量淡黄色固体析出,减压抽滤,滤饼用乙醚洗,干燥得淡黄色固体114mg,收率29.6%,熔点205-206℃。。。
[0215]1h nmr(400mhz,dmso-d6)δ8.76
–
8.75(m,1h),8.23(br.s,1h),8.11
–
7.96(m,2h),7.79(s,1h),7.68(s,1h),7.39(s,1h),7.35
–
7.30(m,1h),6.76(s,1h),4.40
–
4.20(m,2h),3.99(s,3h),3.01
–
2.74(m,2h),1.81
–
1.61(m,2h),1.37
–
1.27(m,11h).
[0216]
hrms calcd.for c24h31n6o5(m+h)
+
483.23504,found 483.23636.
[0217]
实施例19
[0218]
(4-(5-氨甲酰基-7-甲氧基-2-(哒嗪-3-酰胺基)-1h-苯并[d]咪唑-1-基)丁基)氨基甲酸叔丁基酯
[0219][0220]
(1)标题化合物的制备
[0221]
将(4-(2-氨基-5-氨甲酰基-7-甲氧基-1h-苯并[d]咪唑-1-基)丁基)氨基甲酸叔丁酯(0.3g,0.8mmol),哒嗪-3-羧酸(0.119g,0.95mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.363g,0.95mmol),n,n-二异丙基乙胺(0.53ml,3.18mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应3.5h。反应结束后加入饱和氯化铵溶液30ml,有大量灰色固体析出,减压抽滤,滤饼用乙醚洗,干燥得灰色固体156mg,收率40.4%,熔点244-245℃。
[0222]1h nmr(400mhz,dmso-d6)δ13.06(s,1h),9.32(s,1h),8.39
–
8.37(m,1h),8.02(s,1h),7.81(br.s,1h),7.75(s,1h),7.42(s,1h),7.37(s,1h),6.76(s,1h),4.46
–
4.37(m,2h),4.00(s,3h),2.99
–
2.83(m,2h),1.81
–
1.67(m,2h),1.46
–
1.35(m,2h),1.31(s,9h).
[0223]
hrms calcd.for c23h30n7o5(m+h)
+
484.23029,found 484.23108.
[0224]
实施例20
[0225]
(3-(5-氨甲酰基-2-(1-乙基-3-甲基-1h-吡唑-5-酰胺基)-7-(3-甲氧基丙氧基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯
[0226][0227]
(1)4-氯-3-羟基-5-硝基苯甲酰胺的制备
[0228][0229]
将4-氯-3-甲氧基-5-硝基苯甲酰胺(0.5g,2mmol),20ml二氯甲烷依次加入瓶中,缓慢滴加1m三溴化硼/二氯甲烷溶液(9ml,9mmol),氩气保护下室温反应12h。将反应液倾入冰水中,有大量白色固体析出,减压抽滤,滤饼用乙醚洗,干燥得白色固体0.296g,收率68.1%,熔点205-206℃。
[0230]1h nmr(400mhz,dmso-d6)δ11.54(s,1h),8.17(s,1h),7.92(s,1h),7.71(s,1h),7.65(s,1h).
[0231]
ms(esi)m/z 217.0(m+h)
+
.
[0232]
(2)4-氯-3-(3-甲氧基丙氧基)-5-硝基苯甲酰胺的制备
[0233][0234]
将4-氯-3-羟基-5-硝基苯甲酰胺(1g,5mmol),3-溴丙基甲基醚(0.63ml,5.5mmol),碳酸钾(0.84g,6mmol)溶于20ml n,n-二甲基甲酰胺,氩气保护下60℃反应4h。反应结束后加入饱和氯化铵溶液30ml,二氯甲烷萃取混合物三次,蒸馏水洗2次,饱和氯化钠溶液洗1次,水硫酸钠干燥。浓缩,柱层析分离,洗脱剂为二氯甲烷:甲醇=20:1,得淡黄色固体1.21g,收率84%,熔点128-130℃。
[0235]1h nmr(400mhz,dmso-d6)δ8.33(s,1h),8.05(d,j=1.8hz,1h),7.90(d,j=1.8hz,1h),7.77(s,1h),7.23(s,1h),4.29(t,j=6.3hz,2h),3.51(t,j=6.2hz,2h),3.26(s,3h),2.08
–
1.98(m,2h).
[0236]
ms(esi)m/z 289.0(m+h)
+
.
[0237]
(3)(3-((4-氨甲酰基-2-(3-甲氧基丙氧基)-6-硝基苯基)氨基)丙基)氨基甲酸苄酯的制备
[0238][0239]
将4-氯-3-(3-甲氧基丙氧基)-5-硝基苯甲酰胺(0.1g,0.35mmol),n-(3-氨基丙基)氨基甲酸苄酯(0.13ml,0.7mmol),n,n-二异丙基乙胺(0.17ml,1.1mmol)用20ml乙醇溶解,氩气保护,120℃条件下反应36小时。将反应冷却至室温,加入饱和氯化铵溶液淬灭反应,大量橘色固体析出,减压抽滤,滤饼用乙醚洗,干燥得橘色固体0.13g,收率80.7%,熔点126-127℃。
[0240]1h nmr(400mhz,dmso-d6)δ8.20(d,j=1.9hz,1h),8.01(s,1h),7.76(t,j=5.8hz,1h),7.54(d,j=1.4hz,1h),7.39
–
7.26(m,7h),4.99(s,2h),4.10(t,j=6.3hz,2h),3.57
–
3.51(m,2h),3.49(t,j=6.2hz,2h),3.25(s,3h),3.08
–
2.99(m,2h),2.08
–
1.98(m,2h),1.72
–
1.62(m,2h).
[0241]
ms(esi)m/z 461.2(m+h)
+
.
[0242]
(4)(3-((2-氨基-4-氨甲酰基-6-(3-甲氧基丙氧基)苯基)氨基)丙基)氨基甲酸苄酯的制备
[0243][0244]
将(3-((4-氨甲酰基-2-(3-甲氧基丙氧基)-6-硝基苯基)氨基)丙基)氨基甲酸苄酯(0.84g,1.83mmol),溶于30ml甲醇中,加入锌粉(1.2g,18.3mmol),缓慢滴加冰醋酸(1.1ml,18.3mmol),室温下反应8h。硅藻土过滤除去锌粉,浓缩反应液,加入饱和碳酸氢钠溶液调ph至中性。二氯甲烷萃取混合物三次,蒸馏水洗2次,饱和氯化钠溶液洗1次,水硫酸钠干燥。浓缩,柱层析分离,洗脱剂为二氯甲烷:甲醇=10:1,得白色固体0.4g,收率50.8%,熔点101-102℃。
[0245]1h nmr(400mhz,dmso-d6)δ7.61(s,1h),7.39
–
7.27(m,5h),7.25(t,j=5.7hz,1h),6.94(s,1h),6.85(d,j=1.9hz,1h),6.77(d,j=1.9hz,1h),5.01(s,2h),4.65(s,2h),3.98(t,j=6.3hz,2h),3.49(t,j=6.2hz,2h),3.24(s,3h),3.12
–
3.03(m,2h),2.98(t,j=6.4hz,2h),2.01
–
1.91(m,2h),1.58
–
1.47(m,2h).
[0246]
ms(esi)m/z 431.2(m+h)+.
[0247]
(5)(3-(2-氨基-5-氨甲酰基-7-(3-甲氧基丙氧基)-1h-苯并[d]咪唑-1-基)丙基)
氨基甲酸苄酯的制备
[0248][0249]
将(3-((2-氨基-4-氨甲酰基-6-(3-甲氧基丙氧基)苯基)氨基)丙基)氨基甲酸苄酯(0.4g,0.93mmol),溴化氰(0.118g,1.2mmol)溶于20ml甲醇中,氩气保护下加热至60℃反应6h。将反应冷却至室温,加入饱和碳酸钾溶液调ph至7~8,大量白色固体析出,减压抽滤,滤饼用乙醚洗,干燥得白色固体0.358g,收率84.6%,熔点214-215℃。
[0250]1h nmr(400mhz,dmso-d6)δ8.64(s,2h),8.09(s,1h),7.49(s,1h),7.43(s,2h),7.38
–
7.29(m,6h),5.00(s,2h),4.29
–
4.18(m,4h),3.48(t,j=5.9hz,2h),3.16
–
3.07(m,2h),2.10
–
2.00(m,2h),1.93
–
1.82(m,2h).
[0251]
ms(esi)m/z 456.2(m+h)+.
[0252]
(6)标题化合物的制备
[0253]
将(3-(2-氨基-5-氨甲酰基-7-(3-甲氧基丙氧基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯(0.3g,0.66mmol),1-乙基-3-甲基-1h-吡唑-5-羧酸(0.123g,0.8mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.304g,0.8mmol),n,n-二异丙基乙胺(0.43ml,2.6mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应6h。反应结束后加入饱和氯化铵溶液30ml,二氯甲烷萃取混合物三次,蒸馏水洗2次,饱和氯化钠溶液洗1次,水硫酸钠干燥。浓缩,柱层析分离,洗脱剂为二氯甲烷:甲醇=10:1,得淡粉色固体0.270g,收率69.2%,熔点145-146℃。
[0254]1h nmr(400mhz,dmso-d6)δ12.86(s,1h),8.03(s,1h),7.67(s,1h),7.40
–
7.23(m,8h),6.66(s,1h),5.00(s,2h),4.64
–
4.58(m,2h),4.37(t,j=7.0hz,2h),4.23(t,j=6.3hz,2h),3.52(t,j=6.1hz,2h),3.26(s,3h),3.12
–
3.07(m,2h),2.13(s,3h),2.10
–
2.04(m,2h),1.95
–
1.88(m,2h),1.35(t,j=7.1hz,3h).
[0255]
hrms calcd.for c30h38n7o6(m+h)
+
592.28781,found 592.28821.
[0256]
实施例21
[0257]
(3-(5-氨甲酰基-7-(3-甲氧基丙氧基)-2-(2-吡啶酰胺基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯
[0258][0259]
(1)标题化合物的制备
[0260]
将(3-(2-氨基-5-氨甲酰基-7-(3-甲氧基丙氧基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯(0.3g,0.66mmol),吡啶-2-羧酸(0.99g,0.8mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.304g,0.8mmol),n,n-二异丙基乙胺(0.43ml,2.6mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应9h。反应结束后加入饱和氯化铵溶液30ml,有大量棕褐色固体析出,减压抽滤,滤饼用乙醚洗,干燥得棕褐色固体201mg,收率54.1%,熔点134-135℃。
[0261]1h nmr(400mhz,dmso-d6)δ8.80(s,1h),8.60
–
8.41(m,1h),8.21(s,1h),8.01
–
7.71(m,3h),7.42
–
7.30(m,7h),5.04(s,2h),4.55
–
4.34(m,2h),4.22
–
4.18(m2h),3.54(t,j=6.0hz,2h),3.32(s,3h),3.05
–
2.96(m,2h),2.10
–
2.04(m,2h),1.94
–
1.85(m,2h).
[0262]
hrms calcd.for c29h33n6o6(m+h)
+
561.24561,found 561.24487.
[0263]
实施例22
[0264]
(3-(5-氨甲酰基-7-(3-甲氧基丙氧基)-2-(哒嗪-3-酰胺基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯
[0265][0266]
(1)标题化合物的制备
[0267]
将(3-(2-氨基-5-氨甲酰基-7-(3-甲氧丙氧基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯(0.3g,0.66mmol),哒嗪-3-羧酸(0.99g,0.8mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.304g,0.8mmol),n,n-二异丙基乙胺(0.43ml,2.6mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应9h。反应结束后加入饱和氯化铵溶液30ml,有大量浅绿色固体析出,减压抽滤,滤饼用乙醚洗,干燥得浅绿色固体159mg,收率47.9%,熔
点175-176℃。
[0268]1h nmr(400mhz,dmso-d6)δ9.19(s,1h),8.39(d,j=8.0hz,1h),7.84(s,1h),7.77(s,1h),7.70
–
7.53(m,2h),7.39
–
7.00(m,8h),4.95(s,2h),4.44(t,j=5.6hz,2h),4.19(t,j=5.8hz,2h),3.54(t,j=5.9hz,2h),3.27(s,3h),3.04
–
3.00(m,2h),2.09
–
2.03(m,2h),1.92
–
1.87(m,2h).
[0269]
hrms calcd.for c28h32n7o6(m+h)
+
562.24086,found 562.24164.
[0270]
实施例23
[0271]
(3-(5-氨甲酰基-7-(3-吗啉丙氧基)-2-(2-吡啶酰胺基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯
[0272][0273]
(1)4-氯-3-(3-吗啉丙氧基)-5-硝基苯甲酰胺的制备
[0274][0275]
将4-氯-3-羟基-5-硝基苯甲酰胺(0.2g,0.93mmol),3-溴丙基吗啉(182mg,1.12mmol),碳酸钾(0.167g,1.2mmol)溶于100ml n,n-二甲基甲酰胺,氩气保护下70℃反应4h。反应结束后加入饱和氯化铵溶液30ml,二氯甲烷萃取混合物三次,蒸馏水洗2次,饱和氯化钠溶液洗1次,水硫酸钠干燥。浓缩,柱层析分离,洗脱剂为二氯甲烷:甲醇=20:1,得淡黄色固体0.169g,收率52.9%,熔点165-166℃。1h nmr(400mhz,dmso-d6)δ8.29(s,1h),8.04(s,1h),7.87(s,1h),7.78(s,1h),4.39
–
4.18(m,2h),3.65
–
3.52(m,4h),2.47
–
2.42(m,2h),2.38
–
2.34(m,4h),2.01
–
1.89(m,2h).
[0276]
ms(esi)m/z 344.1(m+h)
+
.
[0277]
(2)(3-((4-氨甲酰基-2-(3-吗啉丙氧基)-6-硝基苯基)氨基)丙基)氨基甲酸苄酯的制备
[0278][0279]
将4-氯-3-(3-吗啉丙氧基)-5-硝基苯甲酰胺(0.1g,0.29mmol),n-(3-氨基丙基)氨基甲酸苄酯(0.1ml,0.58mmol),n,n-二异丙基乙胺(0.096ml,0.58mmol)用20ml异丙醇溶解,氩气保护,120℃条件下反应42小时。将反应冷却至室温,加入饱和氯化铵溶液淬灭反应,大量砖红色固体析出,减压抽滤,滤饼用乙醚洗,干燥得转红色固体0.113g,收率75.6%,熔点93-94℃。
[0280]1h nmr(400mhz,chloroform-d)δ8.21(s,1h),8.13(s,1h),7.41(s,1h),7.31
–
7.27(m,5h),5.05(s,2h),4.04
–
3.99(m,2h),3.74
–
3.65(m,6h),3.30
–
3.21(m,2h),2.64
–
2.48(m,6h),2.08
–
1.98(m,2h),1.84
–
1.76(m,2h).
[0281]
ms(esi)m/z 516.2(m+h)
+
.
[0282]
(3)(3-((2-氨基-4-氨甲酰基-6-(3-吗啉丙氧基)苯基)氨基)丙基)氨基甲酸苄酯的制备
[0283][0284]
将(3-((4-氨甲酰基-2-(3-吗啉丙氧基)-6-硝基苯基)氨基)丙基)氨基甲酸苄酯(1.3g,4mmol),溶于30ml甲醇中,加入锌粉(2.5g,40mmol),缓慢滴加冰醋酸(2.3ml,40mmol),室温下反应8h。硅藻土过滤除去锌粉,浓缩反应液,加入饱和碳酸氢钠溶液调ph至中性。二氯甲烷萃取混合物三次,蒸馏水洗2次,饱和氯化钠溶液洗1次,水硫酸钠干燥。浓缩,柱层析分离,洗脱剂为二氯甲烷:甲醇=10:1,得褐色油状物1.1g,收率56.7%。
[0285]1h nmr(500 mhz,chloroform-d)δ7.34
–
7.28(m,5h),6.83(s,1h),6.73(s,1h),5.07(s,2h),4.02(t,j=4.1 hz,2h),3.71
–
3.66(m,4h),3.34
–
3.26(m,2h),3.02(t,j=6.0 hz,2h),2.50
–
2.41(m,6h),2.01
–
1.91(m,2h),1.69
–
1.63(m,2h).
[0286]
ms(esi)m/z 486.2(m+h)+.
[0287]
(4)(3-(2-氨基-5-氨甲酰基-7-(3-吗啉丙氧基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯的制备
[0288][0289]
将(3-((2-氨基-4-氨甲酰基-6-(3-吗啉丙氧基)苯基)氨基)丙基)氨基甲酸苄酯(1g,2.1mmol),溴化氰(0.262g,2.5mmol)溶于30ml甲醇中,氩气保护下加热至60℃反应10h。将反应冷却至室温,加入饱和碳酸钾溶液调ph至7~8,大量白色固体析出,减压抽滤,滤饼用乙醚洗,干燥得白色固体0.801g,收率75.1%,熔点184-185℃。1h nmr(400mhz,dmso-d6)δ7.79(d,j=6.7hz,1h),7.39(s,1h),7.37
–
7.26(m,7h),7.08(s,1h),7.06(s,1h),6.45(s,1h),5.01(s,2h),4.20
–
4.13(m,2h),4.12
–
4.08(m,2h),3.59
–
3.53(m,4h),3.11
–
3.02(m,2h),2.44(t,j=6.8hz,2h),2.39
–
2.33(m,4h),2.01
–
1.92(m,2h),1.87
–
1.76(m,2h).
[0290]
ms(esi)m/z 511.2(m+h)+.
[0291]
(5)标题化合物的制备
[0292]
将(3-(2-氨基-5-氨甲酰基-7-(3-吗啉丙氧基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯(0.3g,0.6mmol),吡啶-2-羧酸(0.88g,0.71mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.27g,0.71mmol),n,n-二异丙基乙胺(0.4ml,2.4mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应9h。反应结束后加入饱和氯化铵溶液30ml,有大量白色固体析出,减压抽滤,滤饼用乙醚洗,干燥得白色固体103mg,收率57.9%,熔点165-166℃。
[0293]1h nmr(400mhz,dmso-d6)δ8.89
–
8.42(m,1h),8.40
–
8.13(m,1h),8.06
–
7.92(m,1h),7.86
–
7.68(m,1h),7.58
–
6.95(m,10h),5.01(s,2h),4.56
–
4.39(m,1h),4.37
–
4.29(m,1h),4.24
–
4.15(m,2h),3.63
–
3.51(m,4h),3.10
–
2.94(m,2h),2.49
–
2.44(m,2h),2.41
–
2.33(m,4h),2.04
–
1.95(m,2h),1.93
–
1.87(m,2h).
[0294]
hrms calcd.for c32h38n7o6(m+h)
+
616.28781,found 616.29077.
[0295]
实施例24
[0296]
(3-(5-氨甲酰基-7-(3-吗啉丙氧基)-2-(哒嗪-3-酰胺基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯
[0297][0298]
(1)标题化合物的制备
[0299]
将(3-(2-氨基-5-氨甲酰基-7-(3-吗啉丙氧基)-1h-苯并[d]咪唑-1-基)丙基)氨基甲酸苄酯(0.3g,0.6mmol),哒嗪-3-羧酸(0.89g,0.71mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.27g,0.71mmol),n,n-二异丙基乙胺(0.4ml,2.4mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应9h。反应结束后加入饱和氯化铵溶液30ml,有大量白色固体析出,减压抽滤,滤饼用乙醚洗,干燥得白色固体147mg,收率59.8%,熔点184-185℃。
[0300]1h nmr(400mhz,dmso-d6)δ11.24(s,1h),9.35(s,1h),8.29(d,j=8.2hz,1h),8.01(s,1h),7.78(s,2h),7.53(s,1h),7.38
–
7.25(m,7h),4.96(s,2h),4.46
–
4.39(m,2h),4.29
–
4.23(m,2h),4.01
–
3.94(m,2h),3.84(t,j=11.8hz,2h),3.60
–
3.53(m,2h),3.20
–
3.11(m,2h),3.11
–
3.03(m,2h),2.39
–
2.29(m,2h),2.01
–
1.91(m,2h).
[0301]
hrms calcd.for c31h37n8o6(m+h)
+
617.28306,found 617.28357.
[0302]
实施例25
[0303]
3-(3-((叔丁氧羰基)氨基)丙基)-2-(1-乙基-3-甲基-1h-吡唑-5-酰胺基)-3h-咪唑并[4,5-b]吡啶-6-甲酸甲酯
[0304][0305]
(1)6-((3-((叔丁氧羰基)氨基)丙基)氨基)-5-硝基烟酸甲酯的制备
[0306][0307]
将6-氯-5-硝基烟酸甲酯(2g,9.3mmol),n-叔丁氧羰基-1,3-丙二胺(3.3g,19mmol),碳酸钾(3.8g,27mmol)置于瓶中,用30ml n-甲基吡咯烷酮溶解,100℃条件下反应3小时。将反应冷却至室温,加入饱和氯化铵溶液淬灭反应。二氯甲烷萃取混合物三次,蒸馏水洗2次,饱和氯化钠溶液洗1次,水硫酸钠干燥。浓缩,柱层析分离,洗脱剂为二氯甲烷:甲醇=20:1,得黄色固体2.03g,收率61..6%,熔点133-135℃。
[0308]1h nmr(400mhz,dmso-d6)δ9.02(t,j=5.8hz,1h),8.89(d,j=2.1hz,1h),8.73(d,j=2.1hz,1h),6.89(t,j=5.7hz,1h),3.85(s,3h),3.68
–
3.59(m,2h),3.03
–
2.94(m,2h),1.75
–
1.64(m,2h),1.37(s,9h).
[0309]
ms(esi)m/z 355.1(m+h)
+
.
[0310]
(2)5-氨基-6-((3-((叔丁氧羰基)氨基)丙基)氨基)硝基烟酸甲酯的制备
[0311][0312]
将6-((3-((叔丁氧羰基)氨基)丙基)氨基)-5-硝基烟酸甲酯(1.0g,2.8mmol),溶于30ml甲醇中,加入pd/c(0.1g,10%),通入氢气,25℃下反应6h。硅藻土过滤除去pd/c,浓缩反应液,柱层析分离,洗脱剂为二氯甲烷:甲醇=10:1,得褐色油状物0.79g,收率87.1%。
[0313]1h nmr(400mhz,chloroform-d)δ8.38(d,j=1.9hz,1h),7.35(d,j=1.9hz,1h),3.82(s,3h),3.62
–
3.53(m,2h),3.23
–
3.15(m,2h),1.80
–
1.69(m,2h),1.42(s,9h).
[0314]
ms(esi)m/z 325.1(m+h)
+
.
[0315]
(3)2-氨基-3-(3-((叔丁氧羰基)氨基)丙基)-3h-咪唑并[4,5-b]吡啶-6-羧酸甲酯
[0316][0317]
将5-氨基-6-((3-((叔丁氧羰基)氨基)丙基)氨基)硝基烟酸甲酯(0.764g,2.36mmol),溴化氰(0.3g,2.83mmol)溶于15ml甲醇中,氩气保护下加热至60℃反应10h。将反应冷却至室温,加入饱和碳酸钾溶液调ph至7~8。二氯甲烷萃取混合物三次,蒸馏水洗2次,饱和氯化钠溶液洗1次,水硫酸钠干燥。浓缩,柱层析分离,洗脱剂为二氯甲烷:甲醇=20:1,得白色固体0.413g,收率50.1%,熔点184-185℃。
[0318]1h nmr(400mhz,dmso-d6)δ8.50(d,j=1.8hz,1h),7.81(d,j=1.8hz,1h),7.12(s,2h),6.86(t,j=5.2hz,1h),4.06(t,j=7.3hz,2h),3.84(s,3h),3.01
–
2.92(m,2h),1.84
–
1.72(m,2h),1.37(s,9h).
[0319]
ms(esi)m/z 350.1(m+h)+.
[0320]
(4)标题化合物的制备
[0321]
将2-氨基-3-(3-((叔丁氧羰基)氨基)丙基)-3h-咪唑并[4,5-b]吡啶-6-羧酸甲酯(0.25g,0.72mmol),1-乙基-3-甲基-1h-吡唑-5-羧酸(0.111g,0.86mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(0.327g,0.86mmol),n,n-二异丙基乙胺(0.47ml,2.86mmol)溶于10ml n,n-二甲基甲酰胺中,室温搅拌反应3.5h。反应结束后加入饱和氯化铵溶液30ml,二氯甲烷萃取混合物三次,蒸馏水洗2次,饱和氯化钠溶液洗1次,水硫酸钠干燥。浓缩,柱层析分离,洗脱剂为二氯甲烷:甲醇=20:1,得白色固体0.297g,收率85.0%,熔点213-215℃。。
[0322]1h nmr(400mhz,dmso-d6)δ12.90(s,1h),8.79(d,j=4.0hz,1h),8.16(s,1h),6.86(t,j=5.6hz,1h),6.73(s,1h),4.63
–
4.58(m,2h),4.20(t,j=7.1hz,2h),3.90(s,3h),3.03
–
2.99(m,2h),2.19(s,3h),1.98
–
1.91(m,2h),1.40
–
1.30(m,12h).
[0323]
hrms calcd.for c23h32n7o5(m+h)
+
486.24594,found 486.24338.
[0324]
实施例26
[0325]
3-(3-((叔丁氧羰基)氨基)丙基)-2-(1-乙基-3-甲基-1h-吡唑-5-酰胺基)-3h-咪唑并[4,5-b]吡啶-6-甲酸
[0326][0327]
(1)标题化合物的制备
[0328]
将3-(3-((叔丁氧羰基)氨基)丙基)-2-(1-乙基-3-甲基-1h-吡唑-5-酰胺基)-3h-咪唑并[4,5-b]吡啶-6-甲酸甲酯(0.1g,0.21mmol)溶于10ml甲醇中,缓慢加入3n氢氧化锂(0.756ml,0.26mmol),室温下搅拌反应6h。反应结束后,缓慢滴加冰醋酸溶液至中性,蒸除大部分溶剂,加入蒸馏水,减压抽滤,滤饼用乙醚洗,干燥得白色固体0.075g,收率75.8%,熔点202-203℃。
[0329]1h nmr(400mhz,dmso-d6)δ12.87(s,1h),8.78(d,j=1.8hz,1h),8.17(d,j=1.7hz,1h),6.86(t,j=5.5hz,1h),6.72(s,1h),4.65
–
4.56(m,2h),4.21(t,j=7.1hz,2h),3.05
–
2.97(m,2h),2.19(s,3h),1.99
–
1.89(m,2h),1.38
–
1.33(m,12h).
[0330]
hrms calcd.for c22h30n7o5(m+h)+472.23029,found 472.22864.
[0331]
实施例27
[0332]
(3-(6-氨甲酰基-2-(1-乙基-3-甲基-1h-吡唑-5-酰胺基)-3h-咪唑并[4,5-b]吡啶-3-基)丙基)氨基甲酸叔丁基酯
[0333][0334]
(1)标题化合物的制备
[0335]
将3-(3-((叔丁氧羰基)氨基)丙基)-2-(1-乙基-3-甲基-1h-吡唑-5-酰胺基)-3h-咪唑并[4,5-b]吡啶-6-甲酸(0.2g,0.43mmol),氯甲酸乙酯(0.045ml,0.47mmol),三乙胺(0.065ml,0.47mmol)溶于10ml四氢呋喃中,室温搅拌反应6h,然后加入0.5n氨的四氢呋喃溶液(1.72ml,0.86mmol)。反应结束后蒸去全部溶剂,加入饱和氯化铵溶液30ml,二氯甲烷萃取混合物三次,蒸馏水洗2次,饱和氯化钠溶液洗1次,水硫酸钠干燥。浓缩,柱层析分离,洗脱剂为二氯甲烷:甲醇=20:1,得白色固体0.105g,收率51.9%,熔点121-122℃。
[0336]1h nmr(400mhz,methanol-d4)δ8.78(d,j=1.6hz,1h),8.19(d,j=1.4hz,1h),6.78(s,1h),4.70(q,j=7.0hz,2h),4.37(t,j=6.9hz,2h),3.13(t,j=6.4hz,2h),2.26(s,3h),2.11
–
2.04(m,2h),1.47
–
1.37(m,12h).
[0337]
hrms calcd.for c22h31n8o4(m+h)
+
471.24628,found 471.24619.
[0338]
药理实验
[0339]
实验例1、对sting蛋白的激动活性
[0340]
实验目的:通过thp-1-dual细胞(有sting蛋白表达)和thp-1-dual ko-sting细胞(无sting蛋白表达)建立细胞筛选模型,对本发明化合物进行体外sting蛋白的激动活性和专属性评价。
[0341]
实验方法:实验采用了96孔板的体外筛选体系,每孔铺100,000个thp1-dual细胞后加入化合物刺激24h,化合物浓度梯度设置在10-4
—10-9
m之间,每孔的最终体积为200ul。刺激完成后取10ul上清至白色96孔酶标板中,加入50ul配制好的quanti-luc检测试剂,并用envision多功能酶标仪进行荧光检测,测量方法为终点检测法:4秒开始,0.1秒读取。最终的读数表示分泌型荧光素酶的含量,用以评价化合物对sitng蛋白的激动作用。
[0342]
实验结果:如表1所示,本发明化合物具有较高的sting蛋白激动活性,半数有效率ec
50
均在μm级,且对sting蛋白没有抑制作用(ic
50
>100μm),对于无sting表达的细胞(sting-ko)无激动或抑制效果(ic
50
>100μm,ec
50
>100μm),表明本发明化合物具有特异性激动sting蛋白的作用。
[0343]
表1本发明化合物对sting蛋白的激动活性
[0344]
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



