通过肝脏表达具有脱氧核糖核酸酶(DNA酶)活性的酶治疗疾病的制作方法
 2021-02-01 22:02:07|
2021-02-01 22:02:07| 294|
294| 起点商标网
起点商标网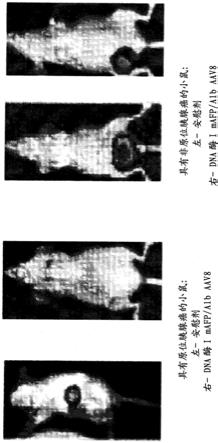
通过肝脏表达具有脱氧核糖核酸酶(dna酶)活性的酶治疗疾病
相关申请的交叉引用
[0001]
本申请要求2018年1月16日提交的美国临时专利申请号62/617,879的优先权,其公开内容通过引用整体并入本文。序列表
[0002]
本申请包含序列表,该序列表已经以ascii格式以电子方式提交,并且通过引用整体并入本文。所述ascii副本创建于2019年1月10日,名称为252732.000003_st25.txt,以及大小为52,177字节。
技术领域
[0003]
本发明涉及用于增强在肝门-血窦循环中积累的无细胞dna(cfdna)的清除的具有脱氧核糖核酸酶(dna酶)活性的酶的肝脏特异性递送和/或表达,以及这样的肝脏特异性递送和/或表达用于治疗各种疾病和病症(包括癌症和神经变性)的用途。
背景技术:
[0004]
与健康个体相比,患有恶性肿瘤的患者在其血浆和血清中的循环无细胞dna(cfdna)的水平升高(fleischhacker,2007)。在癌症患者中,循环cfdna来源于濒死的非肿瘤细胞、肿瘤细胞和中性粒细胞。肿瘤会使中性粒细胞释放细胞外dna陷阱,这促进在癌症患者中促血栓形成状态、恶病质和器官衰竭的建立(demmers,2012)。源自肿瘤的cfdna可促进转移和化学疗法耐药性的发展(garc
í
a-olmo,2013)。随着肿瘤的进展,循环cfdna的量增加(sawyers,2008),在患有晚期疾病和转移性疾病的患者中达到最高水平(butt,2008)。已经表明,较高的循环cfdna量与低患者存活率显著相关(schwarzenbach,2008)。
[0005]
神经变性是具有神经元的结构和/或功能逐步丧失(包括神经元死亡)的单独的临床病理病状。导致神经变性的分子途径是高度疾病特异性的(例如,阿尔茨海默病患者脑中异常折叠的淀粉样蛋白-β和tau蛋白的积累;帕金森病中α-突触核蛋白的积累;亨廷顿病中突变的亨廷顿蛋白的积累;肌萎缩性脊髓侧索硬化(als)中tdp-43和fus蛋白聚集体的积累;衰老过程中线粒体dna突变的积累和线粒体分裂机制的破坏),并在疾病进展的晚期导致神经元细胞死亡。对动物模型和细胞系的研究表明,包括细胞凋亡在内的程序性细胞死亡似乎在疾病晚期神经变性的进展中起关键作用,如通过动物模型和细胞系的研究所证明的(radi e.,等人,j alzheimers dis.2014;42)。
[0006]
患有神经变性疾病的患者具有增加的循环cfdna(包括微生物来源的cfdna)水平,其通过不同机制显著促进神经变性的进展(参见,例如,国际申请公开号wo2016/190780),所述不同机制包括经由血脑屏障(bbb)的转移和直接神经元损伤、大脑内的中性粒细胞dna陷阱释放(zenaro,2015)以及触发脑血栓性动脉病。
[0007]
本发明人先前已经证明,将高剂量的dna酶蛋白全身性施用至患者的循环中可用于治疗与血液中cfdna水平升高有关的多种疾病和病状,包括癌症(例如,癌、肉瘤、淋巴瘤、
黑色素瘤;参见,例如,美国专利号7,612,032;8,710,012;9,248,166)、体细胞嵌合的发展(参见,例如,美国专利申请公开号us20170056482)、与化学疗法或辐射疗法相关的副作用(参见,例如美国专利申请公开号us20170100463)、神经变性疾病(参见,例如国际申请公开号wo2016/190780)、感染(参见,例如美国专利号8,431,123和9,072,733)、糖尿病(参见,例如美国专利号8,388,951)、动脉粥样硬化(参见,例如美国专利号8,388,951)、中风(参见,例如美国专利号8,796,004)、心绞痛(参见,例如美国专利号8,796,004),缺血(参见,例如美国专利号8,796,004)、肾损伤(参见,例如美国专利号9,770,492)、迟发型超敏反应诸如例如移植物抗宿主病[gvhd])(参见,例如美国专利号8,535,663)、生育力降低(参见,例如美国专利号8,916,151)、年龄特异性精子活力损害(参见,例如美国专利号8,871,200)和衰老(参见,例如美国专利申请公开号us20150110769)。所有这些专利和申请均通过引用整体并入本文。
[0008]
其他人后来证明了类似的作用。(wen,2013;cederval,2015;tohme,2016;patutina,2011;li,2015)。当在肺癌和肝癌转移性疾病模型中以0.02-2.3mg/kg每天施用时,rhdnase i还抑制60-90%的转移性疾病的发展(patutina,2011)。li(li,2015)报告成功使用dna酶i治疗小鼠gvhd。
[0009]
尽管dna酶蛋白的全身施用似乎可用于治疗与循环cfdna量增加有关的疾病和病状,但是在临床环境中,用dna酶蛋白进行的全身治疗显示出有限的作用(参见,例如,国际申请公开号wo2014/020564)。因此,需要更有效的降低循环cfdna水平的方法,以提高治疗与血液中cfdna水平升高相关的疾病和病状的有效性,所述疾病和病状例如,癌症、体细胞嵌合的发展、与化学疗法或辐射疗法相关的副作用、神经变性疾病、感染、迟发型超敏反应、糖尿病、动脉粥样硬化、缺血、中风、心绞痛、生育力降低、年龄特异性精子活力损害、衰老等。
技术实现要素:
[0010]
如在上述背景技术部分所讨论的,需要更有效的降低循环cfdna水平的方法,以提高治疗与血液中cfdna水平升高相关的疾病和病状的有效性。本发明通过提供用于肝脏特异性递送和/或表达具有dna酶活性的酶的方法和组合物来解决这些和其他需求。
[0011]
在一方面,本发明提供了一种重组腺相关病毒(raav)表达载体,其包含(i)衣壳蛋白和(ii)包含可操作地连接至编码具有脱氧核糖核酸酶(dna酶)活性的酶的核苷酸序列的启动子的核酸,其中所述启动子是肝脏特异性启动子。在一个实施方案中,所述肝脏特异性启动子介导与其他组织和器官相比所述酶在肝脏中实质增加的表达。
[0012]
在另一方面,本发明提供了一种重组腺相关病毒表达载体(raav),其包含(i)衣壳蛋白和(ii)包含可操作地连接至编码具有脱氧核糖核酸酶(dna酶)活性的酶的核苷酸序列的启动子的核酸,其中当在体内施用时,所述衣壳蛋白介导载体有效和/或优先靶向肝脏。在一个实施方案中,所述衣壳蛋白是vp3。在一个实施方案中,所述衣壳蛋白包含一种或多种突变,与相应的野生型衣壳蛋白相比,所述突变改善载体向肝脏递送的效率和/或特异性。在一个特定的实施方案中,与其他组织和器官相比,载体向肝脏的递送的效率和/或特异性的改善导致所述酶在肝脏中实质增加的表达。
[0013]
可用于本发明的载体的具有dna酶活性的酶的非限制性实例包括例如dna酶i、dna
酶x、dna酶γ、dna酶1l1、dna酶1l2、dna酶1l3、dna酶ii、dna酶iiα、dna酶iiβ、胱天蛋白酶-活化的dna酶(cad)、内切核酸酶g(endog)、颗粒酶b(gzmb)、磷酸二酯酶i、乳铁蛋白、乙酰胆碱酯酶、或其突变体或其衍生物。在一个实施方案中,具有dna酶活性的酶是dna酶i(例如,人dna酶i)或其突变体或其衍生物。在一个实施方案中,核酸包含seq id no:30或seq id no:31的序列。在一个实施方案中,dna酶i突变体包含在肌动蛋白结合位点(例如,gln-9、glu-13、thr-14、his-44、asp-53、tyr-65、val-66、val-67、glu-69、asn-74、ala-114及其任意组合;相对于缺少分泌信号序列的成熟蛋白质序列指示的位置)中的一个或多个突变。在一个实施方案中,肌动蛋白结合位点中的突变之一是在ala-114处的突变。在一个实施方案中,dna酶i突变体包含一种或多种提高dna酶活性的突变(例如,q9r、e13r、e13k、t14r、t14k、h44r、h44k、n74k、a114f及其任意组合;相对于缺少分泌信号序列的成熟蛋白质序列指示的位置)。在一个实施方案中,dna酶i突变体包含一个或多个选自q9r、e13r、n74k和a114f及其任意组合的突变。在一个实施方案中,dna酶i突变体包含突变q9r。在一个实施方案中,dna酶i突变体包含突变e13r。在一个实施方案中,dna酶i突变体包含突变n74k。在一个实施方案中,dna酶i突变体包含突变a114f。
[0014]
在一个实施方案中,dna酶i突变体包含与seq id no:5的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。在一个实施方案中,dna酶i突变体包含突变q9r、e13r、n74k和a114f。在一个实施方案中,dna酶i突变体包含seq id no:5的序列。
[0015]
在一个实施方案中,dna酶i突变体包含与seq id no:2的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。在一个实施方案中,dna酶i突变体包含突变q9r、e13r、n74k和a114f。在一个实施方案中,dna酶i突变体包含seq id no:2的序列。
[0016]
在一个实施方案中,dna酶i突变体由seq id no:2或seq id no:5的序列组成。
[0017]
在一个实施方案中,dna酶i突变体包含一种或多种选自以下的突变:h44c、h44n、l45c、v48c、g49c、l52c、d53c、d53r、d53k、d53y、d53a、n56c、d58s、d58t、y65a、y65e、y65r、y65c、v66n、v67e、v67k、v67c、e69r、e69c、a114c、a114r、h44n:t46s、d53r:y65a、d53r:e69r、h44a:d53r:y65a、h44a:y65a:e69r、h64n:v66s、h64n:v66t、y65n:v67s、y65n:v67t、v66n:s68t、v67n:e69s、v67n:e69t、s68n:p70s、s68n:p70t、s94n:y96s、s94n:y96t及其任意组合。在一个实施方案中,核苷酸序列编码包含序列seq id no:4的dna酶i。在一个实施方案中,核酸包含与seq id no:23具有至少85%同一性的核苷酸序列。在一个实施方案中,核酸包含与seq id no:23具有至少90%同一性的核苷酸序列。在一个实施方案中,核酸包含与seq id no:23具有至少95%同一性的核苷酸序列。在一个实施方案中,核酸包含核苷酸序列seq id no:23。在一个实施方案中,核苷酸序列编码包含序列seq id no:1的dna酶i。在一个实施方案中,核酸包含与seq id no:22具有至少85%同一性的核苷酸序列。在一个实施方案中,核酸包含与seq id no:22具有至少90%同一性的核苷酸序列。在一个实施方案中,核酸包含与seq id no:22具有至少95%同一性的核苷酸序列。在一个实施方案中,核酸包含核苷酸序列seq id no:22。在一个实施方案中,核酸包含与seq id no:32具有至少85%同一性的核苷酸序列。在一个实施方案中,核酸包含与seq id no:32具有至少90%同一性的核苷酸序列。在一个实施方案中,核酸包含与seq id no:32具有至少95%同一性的核苷酸序
列。在一个实施方案中,核酸包含核苷酸序列seq id no:32。在一个实施方案中,核苷酸序列编码包含序列seq id no:24的dna酶i突变体。在一个实施方案中,核酸包含与seq id no:29具有至少85%同一性的核苷酸序列。在一个实施方案中,核酸包含与seq id no:29具有至少90%同一性的核苷酸序列。在一个实施方案中,核酸包含与seq id no:29具有至少95%同一性的核苷酸序列。在一个实施方案中,核酸包含核苷酸序列seq id no:29。在一个实施方案中,核苷酸序列编码包含序列seq id no:26的dna酶i突变体。在一个实施方案中,核酸包含与seq id no:28具有至少85%同一性的核苷酸序列。在一个实施方案中,核酸包含与seq id no:28具有至少90%同一性的核苷酸序列。在一个实施方案中,核酸包含与seq id no:28具有至少95%同一性的核苷酸序列。在一个实施方案中,核酸包含核苷酸序列seq id no:28。在一个实施方案中,核苷酸序列编码包含序列seq id no:5的dna酶i突变体。在一个实施方案中,核酸包含与seq id no:21具有至少85%同一性的核苷酸序列。在一个实施方案中,核酸包含与seq id no:21具有至少90%同一性的核苷酸序列。在一个实施方案中,核酸包含与seq id no:21具有至少95%同一性的核苷酸序列。在一个实施方案中,核酸包含核苷酸序列seq id no:21。在一个实施方案中,核苷酸序列编码包含序列seq id no:2的dna酶i突变体。在一个实施方案中,核酸包含与seq id no:19具有至少85%同一性的核苷酸序列。在一个实施方案中,核酸包含与seq id no:19具有至少90%同一性的核苷酸序列。在一个实施方案中,核酸包含与seq id no:19具有至少95%同一性的核苷酸序列。在一个实施方案中,核酸包含核苷酸序列seq id no:19。
[0018]
在一个实施方案中,具有dna酶活性的酶是融合蛋白,所述融合蛋白包含:(i)dna酶或其片段,所述dna酶或其片段连接至(ii)白蛋白或fc多肽或其片段。在一个实施方案中,编码具有dna酶活性的酶的序列包含编码分泌信号序列的序列,其中当载体在肝脏中表达时,所述分泌信号序列介导所述酶向肝血窦系统的有效分泌。有用的分泌信号序列的非限制性实例包括例如dna酶i分泌信号序列、il2分泌信号序列、白蛋白分泌信号序列、β-葡糖醛酸糖苷酶分泌信号序列、碱性蛋白酶分泌信号序列和纤连蛋白分泌信号序列。在一个特定的实施方案中,所述分泌信号序列包含与序列mrgmkllgallalaallqgavs(seq id no:6)具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。在一个特定的实施方案中,所述分泌信号序列包含序列mrgmkllgallalaallqgavs(seq id no:6)。在一个特定的实施方案中,所述分泌信号序列由序列mrgmkllgallalaallqgavs(seq id no:6)组成。在一个特定的实施方案中,所述分泌信号序列包含与序列myrmqllscialslalvtns(seq id no:7)具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。在一个特定的实施方案中,所述分泌信号序列包含序列myrmqllscialslalvtns(seq id no:7)。在一个特定的实施方案中,所述分泌信号序列由序列myrmqllscialslalvtns(seq id no:7)组成。在一个特定的实施方案中,编码分泌信号序列的序列包含与seq id no:20具有至少85%同一性的核苷酸序列。在一个特定的实施方案中,编码分泌信号序列的序列包含与seq id no:20具有至少90%同一性的核苷酸序列。在一个特定的实施方案中,编码分泌信号序列的序列包含与seq id no:20具有至少95%同一性的核苷酸序列。在一个特定的实施方案中,编码分泌信号序列的序列包含核苷酸序列seq id no:20。
[0019]
在一个特定的实施方案中,分泌信号序列包含序列mrytglmgtlltlvnllqlagt(seq id no:25)。在一个特定的实施方案中,分泌信号序列由序列mrytglmgtlltlvnllqlagt(seq id no:25)组成。在一个特定的实施方案中,分泌信号序列包含与序列mrytglmgtlltlvnllqlagt(seq id no:25)具有至少80%序列同一性的序列。在一个特定的实施方案中,编码分泌信号序列的序列包含与seq id no:27具有至少85%同一性的核苷酸序列。在一个特定的实施方案中,编码分泌信号序列的序列包含与seq id no:27具有至少90%同一性的核苷酸序列。在一个特定的实施方案中,编码分泌信号序列的序列包含与seq id no:27具有至少95%同一性的核苷酸序列。在一个特定的实施方案中,编码分泌信号序列的序列包含seq id no:27的核苷酸序列。
[0020]
可用于本发明的载体的启动子的非限制性实例包括例如白蛋白启动子、α1-抗胰蛋白酶(aat)启动子、甲状腺激素结合球蛋白启动子、甲胎蛋白启动子、醇脱氢酶启动子、因子viii(fviii)启动子、hbv基本核心启动子(basic core promoter,bcp)、hbv pres2启动子、磷酸烯醇(phosphoenol)丙酮酸羧化激酶(pepck)启动子、甲状腺素结合球蛋白(tbg)启动子、肝控制区(hcr)-apocii杂合启动子、hcr-haat杂合启动子、载脂蛋白e(apoe)启动子、低密度脂蛋白启动子、丙酮酸激酶启动子、磷酸烯醇(phosphenol)丙酮酸羧化激酶启动子、苯丙氨酸羟化酶启动子、卵磷脂-胆固醇酰基转移酶(lcat)启动子、载脂蛋白h(apoh)启动子、载脂蛋白a-ii启动子(apoa2)、转铁蛋白启动子、转甲状腺素蛋白启动子、α-纤维蛋白原启动子、β-纤维蛋白原启动子、α1-抗胰凝乳蛋白酶启动子、α2-hs糖蛋白启动子、触珠蛋白启动子、铜蓝蛋白启动子、纤溶酶原启动子、补体蛋白启动子、α1-酸性糖蛋白启动子、lsp1启动子、丝氨酸蛋白酶抑制蛋白(serpin)肽酶抑制剂启动子、进化枝a成员1(serpina1)(haat)启动子、细胞色素p450家族3亚家族a多肽4(cyp3a4)启动子、微rna 122(mir-122)启动子、肝脏特异性igf-ii启动子p1、转甲状腺素蛋白(mttr)启动子和甲胎蛋白(afp)启动子。
[0021]
在一个实施方案中,启动子是白蛋白启动子。在一个特定的实施方案中,白蛋白启动子包含seq id no:8的序列。在一个特定的实施方案中,白蛋白启动子由seq id no:8的序列组成。也参见frain等人,mol.cell biol.,1990,10(3):991-999。
[0022]
在一个实施方案中,启动子是α1-抗胰蛋白酶(aat)启动子。在一个实施方案中,启动子是人α1-抗胰蛋白酶(haat)启动子。在一个特定的实施方案中,抗胰蛋白酶启动子包含与seq id no:15的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。在一个特定的实施方案中,aat启动子包含seq id no:15的序列。在一个特定的实施方案中,aat启动子由seq id no:15的序列组成。
[0023]
在一个实施方案中,衣壳蛋白包含选自s279a、s671a、k137r、t252a及其任意组合的一种或多种突变。在一个实施方案中,衣壳蛋白中的一种或多种突变包括突变k137r。在一个实施方案中,衣壳蛋白包含序列seq id no:3[anc80]。在一个实施方案中,衣壳蛋白由序列seq id no:3[anc80]组成。在一个实施方案中,衣壳蛋白包含序列seq id no:9[anc80]。在一个实施方案中,衣壳蛋白由序列seq id no:9[anc80]组成。在一个实施方案中,衣壳蛋白包含序列seq id no:34[anc80l65]。在一个实施方案中,衣壳蛋白由序列seq id no:34[anc80l65]组成。在一个实施方案中,衣壳蛋白包含序列seq id no:35[anc80l65
变体]。在一个实施方案中,衣壳蛋白由序列seq id no:35[anc80l65变体]组成。在一个实施方案中,衣壳蛋白是突变的aav8衣壳蛋白,诸如,例如,aav3g1、aavt20或aavtr1,或在国际专利申请公开号wo2017/180854中公开的另一种突变衣壳蛋白(例如,在氨基酸263-267[例如,263ngtsg267->sgth或263ngtsg267->sdth]和/或氨基酸457-459[例如,457tan459->srp]、和/或氨基酸455-459[例如,455ggtan459->dgsgl]和/或氨基酸583-597中包含vp3突变)。
[0024]
可用于本发明的载体的aav的非限制性实例包括例如血清型1(aav1)、aav2、aav3(包括aav3a和aav3b)、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、aavrh10、aavlk03、aavhu37、aavrh64r1和anc80。在一个特定的实施方案中,aav来自血清型8或anc 80。
[0025]
在一个实施方案中,aav载体的核酸还包含两个aav反向末端重复序列(itr),其中itr位于编码具有dna酶活性的酶的核苷酸序列的侧翼。
[0026]
在一个实施方案中,aav载体的核酸还包含一种或多种位于启动子上游或下游的增强子。在一个实施方案中,增强子可以位于启动子的紧邻上游,例如,其中增强子序列的3'端直接与启动子序列的5'端融合。有用的增强子的非限制性实例包括例如载脂蛋白e(apoe)增强子(例如,apoe肝控制区1(hcr-1)增强子或apoe hcr-2增强子)、甲胎蛋白增强子、ttr增强子、lsp增强子、α1-微球蛋白/bikunin增强子、白蛋白基因增强子(ealb)及其任意组合。在一个特定的实施方案中,增强子是apoe增强子。在一个特定的实施方案中,增强子是位于启动子上游的apoe增强子。在一个特定的实施方案中,增强子是与启动子5'端融合的apoe增强子。在一个特定的实施方案中,apoe增强子是肝控制区(hcr)增强子。在一个特定的实施方案中,增强子包含与seq id no:17的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。在一个特定的实施方案中,增强子包含seq id no:17的序列。在一个特定的实施方案中,增强子由seq id no:17的序列组成。
[0027]
在一个实施方案中,aav载体的核酸还包含可操作地连接至编码具有dna酶活性的酶的核苷酸序列的多腺苷酸化信号。
[0028]
在一个实施方案中,核酸还包含kozak序列。在一个特定的实施方案中,kozak序列包含5'-gccgccacc-3'的序列(seq id no:33)的序列。在一个实施方案中,核酸包含与seq id no:30具有至少80%同一性的核苷酸序列。在一个实施方案中,核酸包含与seq id no:30具有至少85%同一性的核苷酸序列。在一个实施方案中,核酸包含与seq id no:30具有至少90%同一性的核苷酸序列。在一个实施方案中,核酸包含与seq id no:30具有至少95%同一性的核苷酸序列。在一个实施方案中,核酸包含核苷酸序列seq id no:30。
[0029]
在一个实施方案中,核酸还包含转录后调节元件。在一个实施方案中,转录后调节元件是土拨鼠肝炎转录后调节元件(wpre)。在一个特定的实施方案中,wpre不编码功能性x蛋白。在一个实施方案中,转录后调节元件包含与seq id no:16的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。在一个具体的实施方案中,转录后调节元件包含seq id no:16的序列。在一个特定的实施方案中,转录后调节元件由seq id no:16的序列组成。
[0030]
在一个实施方案中,本发明的raav载体的核酸包含与seq id no:19的序列具有至
少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、91.5%、92%、92.5%、93%、93.5%、94%、94.5%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%或99.5%同一性的序列。在一个特定的实施方案中,所述核酸包含seq id no:19的序列。在一个特定的实施方案中,所述核酸由seq id no:19的序列组成。在一个特定的实施方案中,所述核酸具有图10所示的图谱。
[0031]
在一个实施方案中,本发明提供了一种重组腺相关病毒(raav)表达载体,其包含(i)包含序列seq id no:34的衣壳蛋白和(ii)包含可操作地连接至白蛋白启动子或α1-抗胰蛋白酶(aat)启动子的编码包含序列seq id no:4的脱氧核糖核酸酶(dna酶)的核苷酸序列的核酸。
[0032]
在一个实施方案中,本发明提供了一种重组腺相关病毒(raav)表达载体,其包含(i)包含序列seq id no:34的衣壳蛋白和(ii)包含可操作地连接至白蛋白启动子或α1-抗胰蛋白酶(aat)启动子的编码包含序列seq id no:5的脱氧核糖核酸酶(dna酶)的核苷酸序列的核酸。
[0033]
在一个实施方案中,本发明提供了一种重组腺相关病毒(raav)表达载体,其包含(i)包含序列seq id no:34的衣壳蛋白和(ii)包含可操作地连接至白蛋白启动子或α1-抗胰蛋白酶(aat)启动子的编码包含序列seq id no:1的脱氧核糖核酸酶(dna酶)的核苷酸序列的核酸。
[0034]
在一个实施方案中,本发明提供了一种重组腺相关病毒(raav)表达载体,其包含(i)包含序列seq id no:34的衣壳蛋白和(ii)包含可操作地连接至白蛋白启动子或α1-抗胰蛋白酶(aat)启动子的编码包含序列seq id no:2的脱氧核糖核酸酶(dna酶)的核苷酸序列的核酸。
[0035]
在一个实施方案中,本发明提供了一种重组腺相关病毒(raav)表达载体,其包含(i)包含序列seq id no:34的衣壳蛋白和(ii)包含seq id no:30的核苷酸序列的核酸。
[0036]
在一个实施方案中,本发明提供了一种重组腺相关病毒(raav)表达载体,其包含(i)包含序列seq id no:34的衣壳蛋白和(ii)包含seq id no:31的核苷酸序列的核酸。
[0037]
在相关方面,本发明提供了药物组合物和剂型,其包含本发明的任何raav载体和药学上可接受的载体和/或赋形剂。
[0038]
在相关方面,本发明提供了一种在有需要的受试者中向肝脏递送具有脱氧核糖核酸酶(dna酶)活性的酶的方法,所述方法包括向受试者施用上述任何raav载体或药物组合物。
[0039]
在另一方面,本发明提供了一种在有需要的受试者中治疗疾病或病状(例如,癌症、神经变性疾病、动脉粥样硬化或迟发型超敏反应)的方法,其中所述疾病或病状伴有受试者的肝门-血窦循环中无细胞dna(cfdna)的积累/水平升高,所述方法包括向受试者施用治疗有效量的上述任何raav载体或药物组合物。
[0040]
在另一方面,本发明提供了一种在有需要的受试者中治疗癌症的方法,所述方法包括向受试者施用治疗有效量的上述任何raav载体或药物组合物。在一个实施方案中,癌症起源于和/或转移至向门静脉引流的器官、组织和/或结构。在一个实施方案中,所述方法有效抑制转移。通过本发明的方法可治疗的癌症的非限制性实例包括例如腹膜癌扩散(peritoneal carcinomatosis)、淋巴瘤、胃癌、结肠癌、肠癌、结直肠癌、胰腺癌、肝癌、胆管
癌、胆囊癌、肉瘤和任何起源的肝脏转移性疾病。
[0041]
在另一方面,本发明提供了一种在有需要的受试者中治疗神经变性疾病的方法,所述方法包括向受试者施用治疗有效量的上述任何raav载体或药物组合物。通过本发明的方法可治疗的神经变性疾病的非限制性实例包括例如阿尔茨海默病、轻度认知损害(mci)、cadasil综合征、帕金森病、肌萎缩性脊髓侧索硬化、进行性核上性麻痹(psp)、皮质基底节变性(cbd)、嗜银颗粒病(agd)、皮克病(pid)、亨廷顿病(hd)和额颞叶痴呆伴帕金森综合征-17(ftdp-17)。在一个实施方案中,神经变性疾病与由dna的存在引起的错误折叠蛋白的形成有关。在一个特定的实施方案中,dna是人dna、微生物dna、无细胞dna或细胞内dna。
[0042]
在一个实施方案中,神经变性疾病继发于下述疾病:糖尿病、类风湿性关节炎、系统性红斑狼疮(sle)、痛风、代谢综合征、淀粉样变性、哮喘或朊病毒病。在一个实施方案中,淀粉样变性是伴有遗传性脑出血的淀粉样变性、原发性系统性淀粉样变性、继发性系统性淀粉样变性、血清淀粉样变性、老年性系统性淀粉样变性、血液透析相关的淀粉样变性、芬兰遗传性系统性淀粉样变性、心房淀粉样变性、溶菌酶系统性淀粉样变性、胰岛素相关的淀粉样变性或纤维蛋白原α链淀粉样变性。
[0043]
在又一方面,本发明提供了一种在有需要的受试者中治疗迟发型超敏反应的方法,所述方法包括向受试者施用治疗有效量的上述任何raav载体或药物组合物。在一个实施方案中,迟发型超敏反应是移植物抗宿主病(gvhd)。
[0044]
在另一方面,本发明提供了一种在有需要的受试者中治疗动脉粥样硬化的方法,所述方法包括向受试者施用治疗有效量的上述任何raav载体或药物组合物。
[0045]
在另一方面,本发明提供了一种在有需要的受试者中预防或改善与化学疗法或辐射疗法相关的一种或多种副作用的方法,所述方法包括向受试者施用治疗有效量的上述任何raav载体或药物组合物。在一个实施方案中,所述化学疗法的一种或多种副作用选自体重减轻、骨髓毒性、血液生化的分解代谢变化、心脏毒性(例如,心肌坏死)、胃肠毒性、免疫抑制和中性粒细胞减少症。在一个实施方案中,化学疗法包括施用一种或多种选自抗代谢药、烷化剂、抗癌抗生素、微管靶向剂、拓扑异构酶抑制剂、生物碱和靶向治疗剂的化合物。在一个实施方案中,化学疗法包括施用一种或多种选自蒽环类、多柔比星、5-氟尿嘧啶(5-fu)、依托泊苷(etoposide)、紫杉烷和环磷酰胺的化合物。在一个实施方案中,所述辐射疗法的一种或多种副作用选自体重减轻、皮肤刺激、皮肤损伤、疲劳、恶心、呕吐、纤维化、肠损伤、记忆丧失、不育和第二癌症。在一个实施方案中,辐射疗法是外部线束辐射疗法或全身放射性同位素疗法。在一个实施方案中,在化学疗法或辐射疗法的周期期间施用raav载体或载体组合物。在另一个实施方案中,在化学疗法或辐射疗法的周期之后施用raav载体或载体组合物。在一个实施方案中,化学疗法或放射疗法用于治疗选自以下的癌症:腹膜癌扩散、淋巴瘤、胃癌、结肠癌、肠癌、结直肠癌、胰腺癌、肝癌、胆管癌、胆囊癌、肉瘤和任何起源的肝脏转移性疾病。
[0046]
在本发明的任何上述方法的一个实施方案中,raav载体或载体组合物的施用导致具有dna酶活性的酶的表达并将其分泌至受试者的肝门-血窦循环中。
[0047]
在本发明的任何上述方法的一个实施方案中,以足以降低所述受试者的门-血窦循环中的无细胞dna(cfdna)水平的剂量和方案施用raav载体或载体组合物。
[0048]
在本发明的任何上述方法的一个实施方案中,所述受试者是人。
[0049]
在另一方面,本发明提供了一种在有需要的受试者中向肝脏递送具有脱氧核糖核酸酶(dna酶)活性的酶的方法,所述方法包括向受试者施用包含核酸的表达载体,所述核酸包含可操作地连接至编码所述酶的序列的启动子,其中所述启动子是肝脏特异性启动子。
[0050]
在另一方面,本发明提供了一种在有需要的受试者中向肝脏递送具有脱氧核糖核酸酶(dna酶)活性的酶的方法,所述方法包括向受试者施用包含核酸的表达载体,所述核酸包含可操作地连接至编码所述酶的序列的启动子,其中当体内施用时,所述载体包含一种或多种能够将核酸靶向肝脏细胞的分子。
[0051]
在又一方面,本发明提供了一种在有需要的受试者中治疗疾病或病状的方法,其中所述疾病或病状伴有受试者的肝门-血窦循环中无细胞dna(cfdna)的积累/水平升高。所述方法包括向受试者施用包含核酸的表达载体,所述核酸包含可操作地连接至编码具有脱氧核糖核酸酶(dna酶)活性的酶的序列的启动子,其中所述启动子是肝脏特异性启动子。在一个实施方案中,疾病选自癌症(包括肝脏转移性疾病)、神经变性疾病、动脉粥样硬化和迟发型超敏反应。
[0052]
在另一方面,本发明提供了一种在有需要的受试者中治疗疾病或病状的方法,其中所述疾病或病状伴有受试者的肝门-血窦循环中无细胞dna(cfdna)的积累/水平升高,所述方法包括向受试者施用包含核酸的表达载体,所述核酸包含可操作地连接至编码具有脱氧核糖核酸酶(dna酶)活性的酶的序列的启动子,其中所述载体包含一种或多种能够将核酸靶向肝脏细胞的分子。在一个实施方案中,疾病选自癌症(包括肝脏转移性疾病)、神经变性疾病、动脉粥样硬化和迟发型超敏反应。
[0053]
在另一方面,本发明提供了一种在有需要的受试者中治疗癌症的方法,所述方法包括向受试者施用包含核酸的表达载体,所述核酸包含可操作地连接至编码具有脱氧核糖核酸酶(dna酶)活性的酶的序列的启动子,其中所述启动子是肝脏特异性启动子。在一个实施方案中,癌症起源于和/或转移至向门静脉引流的器官、组织和/或结构。
[0054]
在另一方面,本发明提供了一种在有需要的受试者中治疗癌症的方法,所述方法包括向受试者施用包含核酸的表达载体,所述核酸包含可操作地连接至编码具有脱氧核糖核酸酶(dna酶)活性的酶的序列的启动子,其中所述载体包含一种或多种能够将核酸靶向肝脏细胞的分子。在一个实施方案中,癌症起源于和/或转移至向门静脉引流的器官、组织和/或结构。
[0055]
在另一方面,本发明提供了一种在有需要的受试者中治疗癌症的方法,所述方法包括向受试者施用包含核酸的表达载体,所述核酸包含可操作地连接至编码具有脱氧核糖核酸酶(dna酶)活性的酶的序列的启动子,其中所述表达载体在所述受试者的肝脏中提供dna酶的合成,并且其中所述癌症起源于和/或转移至向门静脉引流的器官、组织和/或结构。
[0056]
可通过任何上述用于治疗癌症的方法进行治疗的癌症的非限制性实例包括例如腹膜癌扩散、淋巴瘤、胃癌、结肠癌、肠癌、结直肠癌、胰腺癌、肝癌、胆管癌、胆囊癌、肉瘤和任何起源的肝脏转移性疾病。
[0057]
在上述用于治疗癌症的任何方法的一个实施方案中,所述方法有效抑制转移。
[0058]
在又一方面,本发明提供了一种在有需要的受试者中治疗神经变性疾病的方法,所述方法包括向受试者施用包含核酸的表达载体,所述核酸包含可操作地连接至编码具有
脱氧核糖核酸酶(dna酶)活性的酶的序列的启动子,其中所述启动子是肝脏特异性启动子。
[0059]
在另一方面,本发明提供了一种在有需要的受试者中治疗神经变性疾病的方法,所述方法包括向受试者施用包含核酸的表达载体,所述核酸包含可操作地连接至编码具有脱氧核糖核酸酶(dna酶)活性的酶的序列的启动子,其中所述载体包含一种或多种能够将核酸靶向肝脏细胞的分子。
[0060]
在另一方面,本发明提供了一种在有需要的受试者中治疗神经变性疾病的方法,所述方法包括向受试者施用表达载体,所述表达载体包含编码具有脱氧核糖核酸酶(dna酶)活性的酶的核酸,其中所述表达载体在所述受试者的肝脏中提供dna酶的合成,并且其中在所述患者的血液中可检测到肠来源的微生物无细胞dna(cfdna)。
[0061]
可通过任何上述用于治疗神经变性疾病的方法进行治疗的神经变性疾病的非限制性实例包括例如阿尔茨海默病、轻度认知损害(mci)、cadasil综合征、帕金森病、肌萎缩性脊髓侧索硬化、进行性核上性麻痹(psp)、皮质基底节变性(cbd)、嗜银颗粒病(agd)、皮克病(pid)、亨廷顿病(hd)和额颞叶痴呆伴帕金森综合征-17(ftdp-17)。在一个实施方案中,神经变性疾病继发于下述疾病:糖尿病、类风湿性关节炎、系统性红斑狼疮(sle)、痛风、代谢综合征、淀粉样变性、哮喘或朊病毒病。在一个实施方案中,淀粉样变性是伴有遗传性脑出血的淀粉样变性、原发性系统性淀粉样变性、继发性系统性淀粉样变性、血清淀粉样变性、老年性系统性淀粉样变性、血液透析相关的淀粉样变性、芬兰遗传性系统性淀粉样变性、心房淀粉样变性、溶菌酶系统性淀粉样变性、胰岛素相关的淀粉样变性或纤维蛋白原α链淀粉样变性。
[0062]
在另一方面,本发明提供了一种在有需要的受试者中治疗迟发型超敏反应的方法,所述方法包括向受试者施用包含核酸的表达载体,所述核酸包含可操作地连接至编码具有脱氧核糖核酸酶(dna酶)活性的酶的序列的启动子,其中所述启动子是肝脏特异性启动子。在一个实施方案中,迟发型超敏反应是移植物抗宿主病(gvhd)。
[0063]
在又一方面,本发明提供了一种在有需要的受试者中治疗迟发型超敏反应的方法,所述方法包括向受试者施用包含核酸的表达载体,所述核酸包含可操作地连接至编码具有脱氧核糖核酸酶(dna酶)活性的酶的序列的启动子,其中所述载体包含一种或多种能够将核酸靶向肝脏细胞的分子。在一个实施方案中,迟发型超敏反应是移植物抗宿主病(gvhd)。
[0064]
在另一方面,本发明提供了一种在有需要的受试者中治疗动脉粥样硬化的方法,所述方法包括向受试者施用包含核酸的表达载体,所述核酸包含可操作地连接至编码具有脱氧核糖核酸酶(dna酶)活性的酶的序列的启动子,其中所述启动子是肝脏特异性启动子。
[0065]
在又一方面,本发明提供了一种在有需要的受试者中治疗动脉粥样硬化的方法,所述方法包括向受试者施用包含核酸的表达载体,所述核酸包含可操作地连接至编码具有脱氧核糖核酸酶(dna酶)活性的酶的序列的启动子,其中所述载体包含一种或多种能够将核酸靶向肝脏细胞的分子。
[0066]
在另一方面,本发明提供了一种在有需要的受试者中预防或改善与化学疗法或辐射疗法相关的一种或多种副作用的方法,所述方法包括向受试者施用包含核酸的表达载体,所述核酸包含可操作地连接至编码具有脱氧核糖核酸酶(dna酶)活性的酶的序列的启动子,其中所述启动子是肝脏特异性启动子。
[0067]
在另一方面,本发明提供了一种在有需要的受试者中预防或改善与化学疗法或辐射疗法相关的一种或多种副作用的方法,所述方法包括向受试者施用包含核酸的表达载体,所述核酸包含可操作地连接至编码具有脱氧核糖核酸酶(dna酶)活性的酶的序列的启动子,其中所述载体包含一种或多种能够将核酸靶向肝脏细胞的分子。
[0068]
在上述用于预防或改善与化学疗法相关的一种或多种副作用的任何方法的一个实施方案中,所述化学疗法的一种或多种副作用选自体重减轻、骨髓毒性、血液生化的分解代谢变化、心脏毒性(例如,心肌坏死)、胃肠毒性、免疫抑制和中性粒细胞减少症。
[0069]
在上述用于预防或改善与化学疗法相关的一种或多种副作用的任何方法的一个实施方案中,所述化学疗法包括施用一种或多种选自抗代谢药、烷化剂、抗癌抗生素、微管靶向剂、拓扑异构酶抑制剂、生物碱和靶向治疗剂的化合物。
[0070]
在上述用于预防或改善与化学疗法相关的一种或多种副作用的任何方法的一个实施方案中,所述化学疗法包括施用一种或多种选自蒽环类、多柔比星、5-氟尿嘧啶(5-fu)、依托泊苷、紫杉烷和环磷酰胺的化合物。
[0071]
在上述用于预防或改善与辐射疗法相关的一种或多种副作用的任何方法的一个实施方案中,所述辐射疗法的一种或多种副作用选自体重减轻、皮肤刺激、皮肤损伤、疲劳、恶心、呕吐、纤维化、肠损伤、记忆丧失、不育和第二癌症。
[0072]
在上述用于预防或改善与辐射疗法相关的一种或多种副作用的任何方法的一个实施方案中,所述辐射疗法是外部线束辐射疗法或全身放射性同位素疗法。
[0073]
在上述用于预防或改善与化学疗法或辐射疗法相关的一种或多种副作用的任何方法的一个实施方案中,在化学疗法或辐射疗法的周期期间施用载体。
[0074]
在上述用于预防或改善与化学疗法或辐射疗法相关的一种或多种副作用的任何方法的一个实施方案中,在化学疗法或辐射疗法的周期之后施用载体。
[0075]
在本发明的任何方法的一个实施方案中,载体还包含一种或多种能够将核酸靶向肝脏细胞的分子。
[0076]
在本发明的任何方法的一个实施方案中,启动子是肝脏特异性启动子。
[0077]
在本发明的任何方法的一个实施方案中,将载体包装在脂质体或纳米颗粒中。
[0078]
在本发明的任何方法的一个实施方案中,载体作为裸dna使用。
[0079]
在本发明的任何方法的一个实施方案中,载体是病毒载体。有用的病毒载体的非限制性实例包括例如腺相关病毒载体、腺病毒载体、逆转录病毒载体(例如,慢病毒载体)和嗜肝病毒载体(例如,乙型肝炎病毒(hbv)载体)。
[0080]
在本发明的任何方法的一个实施方案中,具有dna酶活性的酶选自dna酶i、dna酶x、dna酶γ、dna酶1l1、dna酶1l2、dna酶1l3、dna酶ii、dna酶iiα、dna酶iiβ、胱天蛋白酶-活化的dna酶(cad)、内切核酸酶g(endog)、颗粒酶b(gzmb)、磷酸二酯酶i、乳铁蛋白、乙酰胆碱酯酶、及其突变体或其衍生物。在一个实施方案中,dna酶是dna酶i(例如,人dna酶i)或其突变体或其衍生物。在一个实施方案中,dna酶i突变体包含在肌动蛋白结合位点(例如,gln-9、glu-13、thr-14、his-44、asp-53、tyr-65、val-66、val-67、glu-69、asn-74、ala-114及其任意组合;相对于缺少分泌信号序列的成熟蛋白质序列指示的位置)中的一个或多个突变。在一个实施方案中,肌动蛋白结合位点中的突变之一是在ala-114处的突变。在一个实施方案中,dna酶i突变体包含一种或多种增加dna酶活性的突变(例如,q9r、e13r、e13k、t14r、
t14k、h44r、h44k、n74k、a114f及其任意组合;相对于缺少分泌信号序列的成熟蛋白质序列指示的位置)。在一个实施方案中,dna酶i突变体包含一个或多个选自q9r、e13r、n74k和a114f及其任意组合的突变。在一个实施方案中,dna酶i突变体包含突变q9r。在一个实施方案中,dna酶i突变体包含突变e13r。在一个实施方案中,dna酶i突变体包含突变n74k。在一个实施方案中,dna酶i突变体包含突变a114f。
[0081]
在一个实施方案中,dna酶i突变体包含一种或多种选自以下的突变:h44c、h44n、l45c、v48c、g49c、l52c、d53c、d53r、d53k、d53y、d53a、n56c、d58s、d58t、y65a、y65e、y65r、y65c、v66n、v67e、v67k、v67c、e69r、e69c、a114c、a114r、h44n:t46s、d53r:y65a、d53r:e69r、h44a:d53r:y65a、h44a:y65a:e69r、h64n:v66s、h64n:v66t、y65n:v67s、y65n:v67t、v66n:s68t、v67n:e69s、v67n:e69t、s68n:p70s、s68n:p70t、s94n:y96s、s94n:y96t及其任意组合。在一个实施方案中,dna酶i突变体是dna酶的长效形式。在一个实施方案中,dna酶i包含序列seq id no:4。在一个实施方案中,dna酶i包含序列seq id no:1。在一个实施方案中,dna酶i突变体包含序列seq id no:5。在一个实施方案中,dna酶i突变体包含序列seq id no:2。
[0082]
在本发明的任何方法的一个实施方案中,编码具有dna酶活性的酶的序列包含分泌信号序列,其中所述分泌信号序列在将载体施用至受试者后介导酶有效分泌到肝门-血窦循环中。在一个实施方案中,分泌信号序列选自dna酶i分泌信号序列、il2分泌信号序列、白蛋白分泌信号序列、β-葡糖醛酸糖苷酶分泌信号序列、碱性蛋白酶分泌信号序列和纤连蛋白分泌信号序列。在一个特定的实施方案中,分泌信号序列包含与序列mrgmkllgallalaallqgavs(seq id no:6)具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。在一个实施方案中,分泌信号序列包含序列mrgmkllgallalaallqgavs(seq id no:6)。在一个实施方案中,分泌信号序列由序列mrgmkllgallalaallqgavs(seq id no:6)组成。在一个特定的实施方案中,分泌信号序列包含与序列myrmqllscialslalvtns(seq id no:7)具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。在一个实施方案中,分泌信号序列包含序列myrmqllscialslalvtns(seq id no:7)。在一个特定的实施方案中,分泌信号序列由序列myrmqllscialslalvtns(seq id no:7)组成。
[0083]
在本发明的任何方法的一个实施方案中,所述肝脏特异性启动子介导与其他组织和器官相比所述酶在肝脏中实质增加的表达。在本发明的方法和载体中有用的肝脏特异性启动子的非限制性实例包括例如白蛋白启动子、α1-抗胰蛋白酶(aat)启动子、甲状腺激素结合球蛋白启动子、甲胎蛋白启动子、醇脱氢酶启动子、因子viii(fviii)启动子、hbv基本核心启动子(bcp)、hbv pres2启动子、磷酸烯醇丙酮酸羧化激酶(pepck)启动子、甲状腺素结合球蛋白(tbg)启动子、肝控制区(hcr)-apocii杂合启动子、hcr-haat杂合启动子、载脂蛋白e(apoe)启动子、低密度脂蛋白启动子、丙酮酸激酶启动子、磷酸烯醇丙酮酸羧化激酶启动子、苯丙氨酸羟化酶启动子、卵磷脂-胆固醇酰基转移酶(lcat)启动子、载脂蛋白h(apoh)启动子、载脂蛋白a-ii启动子(apoa2)、转铁蛋白启动子、转甲状腺素蛋白启动子、α-纤维蛋白原启动子、β-纤维蛋白原启动子、α1-抗胰凝乳蛋白酶启动子、α2-hs糖蛋白启动子、触珠蛋白启动子、铜蓝蛋白启动子、纤溶酶原启动子、补体蛋白启动子、α1-酸性糖蛋白
启动子、lsp1启动子、丝氨酸蛋白酶抑制蛋白肽酶抑制剂启动子、进化枝a成员1(serpina1)(haat)启动子、细胞色素p450家族3亚家族a多肽4(cyp3a4)启动子、微rna 122(mir-122)启动子、肝脏特异性igf-ii启动子p1、转甲状腺素蛋白(mttr)启动子和甲胎蛋白(afp)启动子。在一个实施方案中,肝脏特异性启动子是白蛋白启动子。在一个特定的实施方案中,白蛋白启动子包含seq id no:8的序列。在一个实施方案中,白蛋白启动子由seq id no:8的序列组成。也参见frain等人,mol.cell biol.,1990,10(3):991-999。
[0084]
在一个特定的实施方案中,肝脏特异性启动子是α1-抗胰蛋白酶(aat)启动子。在一个特定的实施方案中,抗胰蛋白酶启动子是人α1-抗胰蛋白酶(aat)启动子。在一个特定的实施方案中,aat启动子包含seq id no:15的序列。在一个特定的实施方案中,aat启动子包含seq id no:15的序列。在一个特定的实施方案中,aat启动子由seq id no:15的序列组成。在本发明的任何方法的各种实施方案中,载体包含增强子。增强子可以是肝控制区增强子,例如与apoe基因(例如,人apoe基因)相关的hcr-1或hcr-2。在一个特定的实施方案中,增强子包含seq id no:17的序列。在一个特定的实施方案中,增强子由seq id no:17的序列组成。
[0085]
在本发明的任何方法的各种实施方案中,载体在dna酶编码序列上游包含kozak序列。kozak序列可以具有5'-gccgccacc-3'的序列(seq id no:33)。
[0086]
在本发明任何方法的各种实施方案中,载体包含转录后调节元件,例如不编码功能性x蛋白的wpre。在一个特定的实施方案中,转录后调节元件包含seq id no:16的序列。在一个特定的实施方案中,转录后调节元件由seq id no:16的序列组成。
[0087]
在本发明的任何方法的各种实施方案中,载体包含与seq id no:19的序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、91.5%、92%、92.5%、93%、93.5%、94%、94.5%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%或99.5%同一性的序列。在一个特定实施方案中,核酸包含序列seq id no:19。在一个特定实施方案中,核酸由序列seq id no:19组成。在一个特定的实施方案中,核酸具有图10所示的图谱。
[0088]
在本发明的任何方法的一个实施方案中,载体的施用导致酶的表达及其分泌到受试者的肝门-血窦循环中。
[0089]
在本发明的任何方法的一个实施方案中,以足以降低所述受试者的门-血窦循环中的无细胞dna(cfdna)水平的剂量和方案施用所述载体。
[0090]
在本发明的任何方法的一个实施方案中,所述受试者是人。
[0091]
在本发明的任何方法的一个实施方案中,所述方法还包括选择与正常健康受试者的血液中的无细胞dna(cfdna)水平相比血液中cfdna水平升高的受试者。
[0092]
在本发明的任何方法的一个实施方案中,所述方法进一步包括向受试者施用脱氧核糖核酸酶(dna酶)(例如,dna酶i、dna酶x、dna酶γ、dna酶1l1、dna酶1l2、dna酶1l3、dna酶ii(包括dna酶iiα、dna酶iiβ)、胱天蛋白酶-活化的dna酶(cad)、内切核酸酶g(endog)、颗粒酶b(gzmb)、磷酸二酯酶i、乳铁蛋白、乙酰胆碱酯酶、及其突变体或其衍生物)。在一个特定的实施方案中,dna酶是dna酶i或其突变体或其衍生物。
[0093]
在下面的描述、权利要求书和附图中,本发明的这些和其他方面对于本领域普通技术人员将是显而易见的。
附图说明
[0094]
图1显示了肝门静脉引流的器官和组织。例如,门静脉从食道下部、胃、胰、胆囊、脾、小肠、大肠、膀胱上部和肝脏引流血液。
[0095]
图2a-2i显示了来自九名接受静脉内牛dna酶i治疗的晚期转移性疾病患者的患者总结和个体血液电泳数据。(a)直肠癌、(b)肺癌、(c)肺癌、(d)黑色素瘤、(e)乳腺癌、(f)腺癌、(g)肾癌、(h)直肠癌、(i)乳腺癌。
[0096]
图3显示了在第15天在注射99mtc标记的抗dna抗体一小时后获得的荷瘤小鼠的γ-免疫闪烁图像,与左下方的肿瘤区(a)相比,在中部/右侧的肝脏区(b)中观察到明显更多的放射性。
[0097]
图4显示了来自表3中所列并如实施例4中的描述进行处理的不同组的肝脏组织的ihc显微照片。在用吉西他滨处理的小鼠的肝脏中观察到大量的cfdna(第7组)。在用dna酶i mafp/alb aav8(将dna酶i基因靶向肝脏细胞以在白蛋白启动子下表达的aav8载体)处理的小鼠的肝脏中观察到的cfdna相对较少(第2组)。
[0098]
图5a显示了mafp/alb aav8载体4658_paav-afp-alb-hudna酶i_mut的图谱。该载体包含(i)用于在细菌中繁殖的元件,即ampr标记、cole1、f1和m13复制起点,和(ii)可操作地连接至小鼠最小白蛋白启动子的hdna酶i_mut序列(seq id no:2;抗高活性肌动蛋白的dna酶i突变体),小鼠甲胎蛋白(afp)增强子ii(具有l-itr),hgh polya信号,侧翼为aav8 l-itr和r-itr,m13复制起点和f1复制起点。图5b显示了anc80、aav2和aav8 vp3蛋白的序列比对(摘自zinn等人,cell rep.,2015,12(67):1056-1068)。图5c显示了基于5型人腺病毒(de1/e3)的adv-207186载体的图谱,其中人dna酶i在cmv启动子的控制下表达。
[0099]
图6显示了反映肿瘤尺寸的生物发光数据。当用hdna酶i_mut(seq id no:5;抗高活性肌动蛋白的dna酶i突变体)mafp/alb处理时,具有原位mia paca-2肿瘤植入物的小鼠和具有非原位mia paca-2肿瘤植入物的小鼠的肿瘤的尺寸均减小。
[0100]
图7显示了肝脏组织学数据,表明当用dna酶i mafp/alb aav8表达载体替代dna酶i蛋白处理时,用dna酶i mafp/alb aav8处理的动物具有低得多的炎性细胞密度,无坏死,以及在血管界面低得多的亲核物质。
[0101]
图8显示了与重组dna酶i处理的小鼠相比,在dna酶i mafp/alb aav8处理的小鼠的外周淋巴结、肠系膜淋巴结和派伊尔氏斑中,供体来源的t细胞、供体来源的cd4+和cd8+t细胞的总数显著减少。
[0102]
图9显示了实施例7中用于递送dna酶i的慢病毒载体plv2-il2ss-dna酶i mut的限制性图谱。该载体包含ampr标记,以及f1和sv40的复制起点。该载体在dna酶i上游的il-2前导序列的上游包含ef-1a启动子。
[0100]
图10a显示了下述的完整序列:构建体apoehcr增强子:haat启动子>hdna酶i(超活性)正确前导序列-wpre xinact,或apoe-hcr增强子:haat启动子>具有正确前导序列(分泌序列)的人dna酶i超活性变体:不编码功能蛋白x的土拨鼠肝炎病毒转录后调节元件(wpre)。图10b显示了apoehcr增强子:haat启动子>hdna酶i(超活性)正确前导序列-wpre xinact的载体图谱。图10c显示了apoehcr增强子:haat启动子>hdna酶i(野生型)-wpre xinact的载体图谱。
[0101]
图11显示了用于制备apoehcr增强子:haat启动子>hdna酶i(超活性)正确前导序
列-wpre xinact的paav-mcs无启动子表达载体的图谱。
[0102]
图12显示了纯化的anc80 vr-18013ad aav载体的sds-page分析结果。观察到三条比率为约1:1:10的60、72和90kda的条带,这对应于vp1-3蛋白。
[0103]
图13a和图13b示出了其中apoehcr增强子-haat启动子-hdna酶i(超活性)正确前导序列-wpre xinact和apoehcr增强子-haat启动子-hdna酶i(野生型)-wpre xinact载体仅有效转导肝细胞来源的细胞并触发高产量表达和由转导的g2细胞分泌生物学上增强的dna酶i酶或野生型dna酶i酶的数据。
[0104]
图14示出了y迷宫行为测试的结果。
[0105]
图15示出了情境性恐惧条件测试的结果。
[0106]
图16显示与3xtg-ad对照小鼠相比,vr-18013ad处理的3xtg-ad小鼠中的小胶质细胞活化显著降低,尤其是在脑皮层区域。
[0107]
图17显示了表明相对于3xtg-ad对照小鼠,vr-18013ad处理的3xtg-ad小鼠的脑皮层区域中的小胶质细胞活化显著降低的数据。
[0108]
图18显示了表明相对于3xtg-ad对照小鼠,用vr-18013ad处理显著降低了vr-18013ad处理的3xtg-ad小鼠中的淀粉样蛋白沉积的数据。
[0109]
图19显示了相对于3xtg-ad对照小鼠,用vr-18013ad处理显著降低了vr-18013ad处理的3xtg-ad小鼠中的过度磷酸化tau沉积。
[0110]
图20显示了表明在vr-18013ad处理的治疗后,海马区中的p-tau降低显著降低的数据。
[0111]
图21显示了对照(单次iv注射pbs)和vr-18014ad(以1.0
×
10
11
gc/每只小鼠剂量单次iv注射vr-18014ad)处理的小鼠的典型形态测定图像。
具体实施方式
[0112]
本发明基于一个出乎意料的发现,即在以循环cfdna水平升高为特征的疾病和病状的过程中(例如,肿瘤生长和进展、自身免疫和神经变性疾病、感染等),显著量的cfdna在肝脏中积累,主要在内皮周隙和disse间隙中。即使是大量的全身施用的dna酶蛋白,也显示出有限的消化肝脏cfdna的功效。这种cfdna连续地以肝脏储库为源头至肝门静脉,以及进一步到全身血液循环。如下面实施例部分所证明的,当dna酶分泌到肝脏的血窦空间时,肝脏中dna酶i的转基因表达(例如,使用病毒表达载体)导致肝脏中和门-血窦循环中积累的cfdna几乎完全清除。这种肝脏中dna酶的转基因表达导致显著的抗肿瘤作用(尤其是在通过门静脉引流的器官和组织中的肿瘤中)、抗癌化学疗法的毒性降低、自身免疫和神经变性疾病进展减慢等。当dna酶分泌到血窦空间时,这种肝脏中dna酶的转基因表达在肿瘤通过门静脉系统引流并且肿瘤生长区域中产生的cfdna经历通过门-血窦循环“首次通过”时会提供更多的益处。(图1示出了通过门静脉引流的器官和系统。)这同样适用于通过肠道渗漏促进的神经退行性和自身免疫病状,其中进入全身血液循环的微生物dna具有相应的通过门-血窦循环“首次通过”。
[0113]
本发明提供了用于将dna酶递送至肝脏的各种载体。此类载体的具体非限制性实例包括aav载体、腺病毒载体、逆转录病毒载体(例如,慢病毒载体)、嗜肝病毒载体(例如,乙型肝炎病毒(hbv)载体)、纳米颗粒(例如,亚磷酰胺纳米颗粒)、脂质体(例如,阳离子脂质体
(例如,n-[1-(2,3-二油酰氧基)丙基]-n,n,n-三甲基氯化铵(dotma))、乳铁蛋白、聚l-赖氨酸、聚乙烯亚胺、壳聚糖(chitosan)等。
[0114]
具有dna酶活性的酶可以在肝脏特异性启动子和/或另一种肝脏特异性控制元件(例如,增强子)的控制下表达。肝脏特异性启动子和控制元件的具体非限制性实例包括例如白蛋白启动子;人α1-抗胰蛋白酶(haat)启动子;tbg(甲状腺素结合球蛋白);载脂蛋白e肝控制区;载脂蛋白a-ii启动子(apoa2);丝氨酸蛋白酶抑制蛋白肽酶抑制剂,进化枝a成员1(serpina1)(haat)启动子;细胞色素p450家族3亚家族a多肽4(cyp3a4)启动子;微rna 122(mir122)启动子;肝脏特异性igf-ii启动子p1;鼠转甲状腺素蛋白(mttr)启动子;和甲胎蛋白(afp)启动子。启动子可以在增强子的上游或下游。启动子序列可以直接与增强子序列融合。
[0115]
可用于本发明的组合物和方法中的具有dna酶活性的酶的具体非限制性实例包括dna酶i、dna酶x、dna酶γ、dna酶1l1、dna酶1l2、dna酶1l3、dna酶ii(例如,dna酶iiα、dna酶iiβ)、胱天蛋白酶-活化的dna酶(cad)、内切核酸酶g(endog)、颗粒酶b(gzmb)、磷酸二酯酶i、乳铁蛋白、乙酰胆碱酯酶、及其突变体或其衍生物。
[0116]
如果具有dna酶活性的酶是dna酶i,则可以使用各种弱化肌动蛋白结合的突变体。野生型重组人dna酶i(seq id no:4)中可以突变的残基的具体非限制性实例包括例如gln-9、glu-13、thr-14、his-44、asp-53、tyr-65、val-66、val-67、glu-69、asn-74和ala-114。在各种实施方案中,使用ala-114突变。例如,在包含seq id no:5的序列的人dna酶i超活性突变体中,ala-114残基发生突变。其他dna酶中的互补残基也可能发生突变。野生型人重组dna酶i中的突变的具体非限制性实例包括h44c、h44n、l45c、v48c、g49c、l52c、d53c、d53r、d53k、d53y、d53a、n56c、d58s、d58t、y65a、y65e、y65r、y65c、v66n、v67e、v67k、v67c、e69r、e69c、a114c、a114r、h44n:t46s、d53r:y65a、d53r:e69r、h44a:d53r:y65a、h44a:y65a:e69r、h64n:v66s、h64n:v66t、y65n:v67s、y65n:v67t、v66n:s68t、v67n:e69s、v67n:e69t、s68n:p70s、s68n:p70t、s94n:y96s、s94n:y96t。
[0117]
可以使用用于增加dna酶活性的各种dna酶突变体。野生型人重组dna酶i中的突变的具体非限制性实例包括例如gln-9、glu-13、thr-14、his-44、asp-53、tyr-65、val-66、val-67、glu-69、asn-74和ala-114。用于增加野生型人重组dna酶i活性的突变的具体非限制性实例包括q9r、e13r、e13k、t14r、t14k、h44r、h44k、n74k和a114f。例如,可以使用q9r、e13r、n74k和a114f突变的组合,并且至少在包含seq id no:5的序列的超活性dna酶i突变体中发现这种组合。
[0118]
当将aav载体用于dna酶表达时,它们可以源自任何血清型,例如,源自血清型1(aav1)、aav2、aav3(例如,aav3a、aav3b)、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、aavrh10(例如,在美国专利号9,790,472、国际专利申请公开号wo2017/180857和wo2017/180861中所公开的)、aavlk03(例如,在wang等人,mol.ther.,2015,23(12):1877-1887中所公开的)、aavhu37(例如,在国际专利申请公开号wo2017180857中所公开的)、aavrh64r1(例如,在国际专利申请公开号wo2017180857中所公开的)或anc80(zinn等人,cell rep.,2015,12(67):1056-1068)。
[0119]
可以对衣壳蛋白(例如,vp3)进行点突变以提高肝脏特异性递送的效率和/或特异性。aav8 vp3衣壳蛋白中此类点突变的具体非限制性实例包括例如s279a、s671a、k137r和
t252a,以及在国际专利申请公开号wo2017/180854中公开的aav8衣壳突变(例如,aav3g1、aavt20或aavtr1,在氨基酸263-267[例如,263ngtsg267->sgth或263ngtsg267->sdth]和/或氨基酸457-459[例如,457tan459->srp]、和/或氨基酸455-459[例如,455ggtan459->dgsgl]和/或氨基酸583-597中的vp3突变)。
[0120]
本发明的载体和组合物可以以各种模式靶向肝脏。向肝脏施用的途径的具体非限制性实例包括肝内注射、静脉内注射和动脉内注射。序列seq id no:1-人dna酶i,野生型(wt),前体;genbank登录号np_005214.2;分泌信号序列用下划线表示:seq id no:2-人dna酶i突变体,前体;与seq id no:1相比突变的残基用粗体和下划线表示;分泌信号序列用下划线表示:seq id no:3-anc80 vp1衣壳蛋白:x1=k或r;x2=a或s;x3=a或g;x4=r或k;x5=e或q;x6=t或e;x7=a或t;x8=s或n;x9=q或e;x
10
=s或a以及x
11
=n或d。seq id no:4-成熟野生型(wt)人dna酶i(无分泌信号序列;genbank登录号4awn_a):seq id no:5-成熟人dna酶i突变体(无分泌信号序列);与seq id no:4相比突变的残
基用粗体和下划线表示:seq id no:6-人dna酶i的分泌信号序列:mrgmkllgallalaallqgavsseq id no:7-il2的分泌信号序列:myrmqllscialslalvtnsseq id no:8-人白蛋白启动子:seq id no:9-anc80 vp1衣壳蛋白:x1=k或r;x2=a或s;x3=a或g;x4=r或k;x5=e或q;x6=t或e;x7=a或t;x8=s或n;x9=q或e;x
10
=s或a以及x
11
=n或dseq id no:10-人β珠蛋白引物:caacttcatccacgttcaccseq id no:11-正向nlrp3引物:gttctgagctccaaccattctseq id no:12-反向nlrp3引物:cactgtgggtccttcatctttseq id no:13-正向16s通用细菌rna基因引物:seq id no:14-反向16s通用细菌rna基因引物:seq id no:15-人抗胰蛋白酶启动子序列:
seq id no:16-不编码功能蛋白x的土拨鼠肝炎病毒转录后调节元件:seq id no:17-载脂蛋白e(apoe)增强子,肝控制区(hcr):seq id no:18-编码seq id no:5的人dna酶i超活性变体的多核苷酸:seq id no:19-编码seq id no:2的人dna酶i突变体前体的多核苷酸(用下划线表示分泌信号序列):
seq id no:20-编码人dna酶i分泌信号序列(seq id no:6)的多核苷酸:seq id no:21-编码seq id no:5的成熟人dna酶i突变体(无分泌信号序列)的多核苷酸:seq id no:22-编码人dna酶i,野生型(wt),seq id no:1的前体的多核苷酸:
seq id no:23-编码seq id no:4的成熟野生型(wt)人dna酶i的多核苷酸:4的成熟野生型(wt)人dna酶i的多核苷酸:seq id no:24-小家鼠(mus musculus)野生型dna酶i,前体;genbank登录号np_034191.3;分泌信号序列用下划线表示:seq id no:25-小家鼠野生型dna酶i的分泌信号序列mrytglmgtlltlvnllqlagtseq id no:26-成熟野生型(wt)小家鼠野生型dna酶iseq id no:27-编码小家鼠野生型dna酶i分泌信号序列的多核苷酸
seq id no:28-编码成熟野生型(wt)小家鼠野生型dna酶i的多核苷酸seq id no:29-编码小家鼠野生型dna酶i(前体)的多核苷酸seq id no:30-apoehcr增强子-haat启动子-hdna酶i(超活性)正确前导序列-wpre xinact(vr-18013ad)的完整序列
[0121]
(apoe hcr增强子:碱基1-320;人α-1-抗胰蛋白酶启动子:碱基321-717;kozak序列:碱基718-726;具有天然完整正确的前导序列的人dna酶i超活性变体:碱基727-1575;wpre x蛋白(失活的):碱基1576-2212)seq id no:31-apoehcr增强子-haat启动子-hdna酶i野生型-wpre xinact(vr-18014ad)的完整序列
[0122]
(apoe hcr增强子:碱基1-320;人α-1-抗胰蛋白酶启动子:碱基321-717;kozak序列:碱基718-726;具有天然完全正确的前导序列的人dna酶i野生型:碱基727-1575;wpre x蛋白(失活的):碱基1576-2212)seq id no:32-具有终止密码子的编码人dna酶i,野生型(wt),seq id no:1的前体的多核苷酸:
seq id no:33-kozak序列5
′-
gccgccacc-3
′
seq id no:34-anc80l65 vp1衣壳蛋白seq id no:35-anc80l65 vp1衣壳蛋白变体定义
[0123]
术语“具有脱氧核糖核酸酶(dna酶)活性的酶”在本文中用于指能够水解切割dna骨架中的磷酸二酯键的酶。
[0124]
如本文所使用的术语“脱氧核糖核酸酶”和“dna酶”用于指催化dna骨架中磷酸二酯键的水解切割的任何酶。多种脱氧核糖核酸酶是已知的并且可以用于本发明的方法。在本发明的方法中有用的dna酶的非限制性实例包括例如dna酶i(例如,重组人dna酶i(rhdnase i)或牛胰dna酶i)、dna酶i的类似物(例如,dna酶x、dna酶γ和dnas1l2)、dna酶ii(例如,dna酶iiα、dna酶iiβ)、磷酸二酯酶i、乳铁蛋白和乙酰胆碱酯酶。本发明还包括具有延长的半衰期的dna酶(例如,白蛋白和/或fc融合体,或通过修饰肌动蛋白结合位点而被保护免于与肌动蛋白结合;参见,例如,gibson等人,(1992)j.immunol.methods,155,249-256)。dna酶i的肌动蛋白结合位点可以在例如以下残基处突变:重组人dna酶i(seq id no:4)的gln-9、glu-13、thr-14、his-44、asp-53、tyr-65、val-66、val-67、glu-69、asn-74、ala-114。例如,在包含seq id no:5的序列的人dna酶i超活性变体中,ala-114残基发生突变。示例性突变包括h44c、h44n、l45c、v48c、g49c、l52c、d53c、d53r、d53k、d53y、d53a、n56c、d58s、d58t、y65a、y65e、y65r、y65c、v66n、v67e、v67k、v67c、e69r、e69c、a114c、h44n:t46s、d53r:y65a、d53r:e69r、h44a:d53r:y65a、h44a:y65a:e69r、h64n:v66s、h64n:v66t、y65n:v67s、y65n:v67t、v66n:s68t、v67n:e69s、v67n:e69t、s68n:p70s、s68n:p70t、s94n:y96s、s94n:y96t(在seq id no:4的序列中)。还包括具有增加的dna酶i活性的dna酶i中的突变。此类突变的非限制性实例是例如重组人dna酶i(seq id no:4)的q9r、e13r、e13k、t14r、t14k、h44r、h44k、n74k和a114f。例如,在包含seq id no:5的序列的超活性dna酶i中发现了q9r、e13r、n74k和a114f突变的组合。dna酶i优先在与嘧啶核苷酸相邻的磷酸二酯键处切割dna,产生在3'位具有游离羟基的5'-磷酸封端的多核苷酸,平均产生四核苷酸。dna酶i作用于单链dna、双链dna和染色质。
[0125]
术语“约”是指如本领域普通技术人员所确定的特定值的可接受误差范围内,这将部分取决于如何测量或确定该值,即测量系统的限制。例如,根据本领域的实践,“约”可以是指在可接受的标准偏差内。备选地,“约”可以表示给定值的至多
±
20%、至多
±
10%、至多
±
5%和至多
±
1%的范围。备选地,特别是关于生物系统或过程,该术语可以是指在数值的一个数量级内,例如在两倍以内。除非另有说明,否则在本申请和权利要求书中描述了特定值的情况下,术语“约”是隐含的,并且在这种情况下意味着在该特定值的可接受误差范围内。
[0126]
术语“细胞外dna”、“无细胞dna”和“cfdna”可互换使用,是指在患者的血液、脑脊液(csf)或肠中发现的细胞外dna(例如,真核、古细菌或原核来源的细胞外dna)。
[0127]
状态、病症或病状的术语“治疗”包括:(1)预防、延迟或减少在可能患有或易患所述状态、病症或病状但尚未经历或显示所述状态、病症或病状的临床或亚临床症状的受试者中发展的所述状态、病症或病状的至少一种临床或亚临床症状出现的发生率和/或可能性,或(2)抑制所述状态、病症或病状,即阻止、减少或延迟疾病或其复发或其至少一种临床或亚临床症状的发展;或(3)缓解疾病,即导致所述状态、病症或病状或其至少一种临床或亚临床症状的消退。对待治疗的受试者的益处在统计学上是显著的或者至少是患者或医师可察觉的。
[0128]
术语“个体”、“受试者”、“动物”、“患者”和“哺乳动物”可互换使用,是指哺乳动物,包括人、兽类动物(例如,猫、狗、牛、马、羊、猪等)和疾病的实验动物模型(例如,小鼠、大鼠)。
[0129]
应用于剂量或量的术语“有效”是指化合物或药物组合物在施用于有需要的受试者时足以导致所需活性的量。注意,当施用活性成分的组合时,该组合的有效量可以包括或可以不包括如果单独施用将是有效的每种成分的量。所需的确切量将因受试者而异,这取决于受试者的种类、年龄和总体病状、所治疗病状的严重程度、所使用的一种或多种特定药物、施用方式等。
[0130]
如本文所使用的应用于剂量或量的术语“治疗有效”是指化合物或药物组合物在施用于有需要的受试者时足以导致所需活性的量。注意,当施用活性成分的组合(例如,dna酶和另一种化合物的组合)时,该组合的有效量可以包括或可以不包括如果单独施用将是有效的每种成分的量。
[0131]
如本文所使用的术语“启动子”是指核酸片段,其作用是控制一个或多个编码序列的转录,并位于相对于编码序列转录起始位点转录方向的上游,并在结构上通过dna依赖性rna聚合酶、转录起始位点和任何其他dna序列(包括但不限于转录因子结合位点、阻遏物和激活蛋白结合位点以及任何其他本领域技术人员已知的直接或间接起作用以调节来自启动子的转录量的核苷酸序列)的结合位点的存在来鉴别。“组织特异性”启动子可以优先在特定类型的组织或细胞中具有活性。
[0132]
如本文所使用的术语“肝脏特异性表达”是指在肝脏中占优势或排他性表达,即,表达程度实质上大于在其他组织和器官中的表达程度。
[0133]
术语“肝脏特异性启动子”在本文中用于指优势地或排他地在肝脏细胞(例如,肝细胞)中具有活性并且在肝脏中比在其他组织和器官中明显更大程度地指导/起始转录的启动子。在本文中,术语“优势地”是指至少50%的所述启动子驱动的表达,更典型地至少90%的所述启动子驱动的表达(例如,100%的所述启动子表达)发生在肝脏细胞中。肝脏表达与非肝脏表达的比率在不同的肝脏特异性启动子之间可以变化。在一些实施方案中,肝脏特异性启动子可以优先指导/起始特定肝脏细胞类型(例如,肝细胞、库普弗细胞、内皮细胞等)中的转录。在本发明的表达盒中可用的一些肝脏特异性启动子包含至少一个、通常几个肝核因子结合位点。在本发明的表达盒中可用的肝脏特异性启动子可以是组成型或诱导型启动子。在本发明的表达盒中可用的肝启动子的一些非限制性实例包括:白蛋白启动子(alb)、人α1-抗胰蛋白酶(haat)启动子、甲状腺素结合球蛋白(tbg)、载脂蛋白e肝控制区启动子、载脂蛋白a-ii(apoa2)启动子、丝氨酸蛋白酶抑制蛋白肽酶抑制剂、进化枝a成员1(serpina1)(haat)启动子、细胞色素p450家族3亚家族a多肽4(cyp3a4)启动子、微rna 122(mir-122)启动子、肝脏特异性igf-ii启动子p1、鼠转甲状腺素蛋白(mttr)启动子、甲胎蛋白(afp)启动子、卵磷脂-胆固醇酰基转移酶(lcat)启动子、载脂蛋白h(apoh)启动子和小鼠前白蛋白基因启动子。
[0134]
肝脏特异性启动子的非限制性实例包括例如白蛋白启动子(alb)、人α1-抗胰蛋白酶(haat)启动子、甲状腺素结合球蛋白(tbg)启动子、载脂蛋白e肝控制区启动子、载脂蛋白a-ii(apoa2)启动子、丝氨酸蛋白酶抑制蛋白肽酶抑制剂、进化枝a成员1(serpina1)(haat)启动子、细胞色素p450家族3亚家族a多肽4(cyp3a4)启动子、微rna 122(mir-122)启动子、肝脏特异性igf-ii启动子p1、鼠转甲状腺素蛋白(mttr)启动子、甲胎蛋白(afp)启动子、甲状腺素结合球蛋白启动子、醇脱氢酶启动子、因子viii(fviii)启动子、hbv基本核心(bcp)和pres2启动子、磷酸烯醇丙酮酸羧激酶(pepck)启动子、肝控制区(hcr)-apocii杂合启动
子、与小鼠白蛋白基因增强子(ealb)元件结合的aat启动子、低密度脂蛋白启动子、丙酮酸激酶启动子、磷酸烯醇丙酮酸羧激酶启动子、卵磷脂-胆固醇酰基转移酶(lcat)启动子、载脂蛋白h(apoh)启动子、转铁蛋白启动子、转甲状腺素蛋白启动子、α-纤维蛋白原和β-纤维蛋白原启动子、α1-抗胰凝乳蛋白酶启动子、α2-hs糖蛋白启动子、触珠蛋白启动子、铜蓝蛋白启动子、纤溶酶原启动子、补体蛋白启动子(例如,clq、clr、c2、c3、c4、c5、c6、c8、c9、补体因子i和因子h)、c3补体激活剂和[α]1-酸性糖蛋白启动子。其他组织特异性启动子可以在组织特异性启动子数据库tiprod(nucleic acids research,j4:d104-d107(2006))中找到。
[0135]
在一些实施方案中,例如,当肝脏靶向由衣壳蛋白介导时,编码具有dna酶活性的酶的核酸可以可操作地连接至允许有效系统性表达的启动子(例如,cmv启动子、鸡β肌动蛋白启动子(cba)、ef1a启动子)。
[0136]
术语“门静脉癌”在本文中用于指已起源于或转移至引流至门静脉的器官或组织的癌症(例如,癌、肉瘤或淋巴瘤)。这种器官和组织的非限制性实例在图1中示出,并且包括例如肝、结肠、小肠和大肠、胃、脾、胰和胆囊。
[0137]
术语“神经变性”在本文中用于指具有神经元结构和/或功能进行性丧失(包括神经元死亡)的单独临床病理病状。神经变性可以是原发性或继发性的。涉及原发性神经变性的疾病的非限制性实例包括例如,阿尔茨海默病(ad)、轻度认知损害(mci)、帕金森病(pd)、亨廷顿病(hd)、朊病毒引起的疾病、额颞叶痴呆(ftd)、额颞叶痴呆伴帕金森综合征-17(ftdp-17)、路易体痴呆、血管性痴呆、肌萎缩性脊髓侧索硬化症(als)、慢性创伤性脑病(cte)、进行性核上性麻痹(psp)、多系统萎缩(msa)、皮质基底节变性(cbd)、嗜银颗粒病(agd)、皮克病、橄榄体脑桥小脑萎缩(opca)、阿尔茨海默型老年性痴呆、进行性核上性麻痹(steel-richardson-olszewski)、corticodentatonigral变性、hallervorden-spatz病、进行性家族性肌阵挛型癫痫、纹状体黑质变性、扭转性张力失常(例如,扭转性痉挛;变形性肌张力障碍)、痉挛性斜颈和其他运动障碍,家族性震颤,多发性抽动-秽语综合征(gilles de la tourette syndrome)、小脑皮质变性、脊髓小脑变性(例如,弗里德希氏共济失调和相关病症)、shy-drager综合征、脊髓性肌萎缩症、原发性侧索硬化、遗传性痉挛性截瘫、腓骨肌萎缩症(charcot-marie-tooth)、肥厚性间质性多神经病(dejerine-sottas)、慢性进行性神经病、视网膜色素变性(色素性视网膜炎)和遗传性视神经萎缩(leber病)。继发性神经变性主要由坏死引起。可能导致继发性神经变性的病状的非限制性实例包括由肿瘤、水肿、出血、中风、创伤、免疫攻击、缺氧、中毒、代谢缺陷和感染引起的神经元破坏。
[0138]
与本发明的组合物结合使用的短语“药学上可接受的”是指这样的组合物的分子实体和其他成分在生理上是可耐受的并且当施用于受试者(例如,哺乳动物(例如,人))时通常不产生不良反应。如本文所使用的术语“药学上可接受的”是指由联邦或州政府的监管机构批准或在美国药典或其他公认的药典中列出用于哺乳动物,并且更特别用于人类。
[0139]
术语“细胞生长抑制和/或细胞毒性化学疗法”和“化学疗法”在本文中可互换使用,是指涉及施用细胞生长抑制剂和/或细胞毒性剂的疗法。
[0140]
术语“抗癌剂”和“抗癌化学治疗剂”在本文中是指用于治疗癌症的任何化合物。抗癌化学治疗剂在本领域中是众所周知的(参见,例如,gilman a.g.,等人,the pharmacological basis of therapeutics,第8版,sec 12:1202-1263(1990))。在整个说
明书中提供了化学治疗剂的具体实例。
[0141]
如本文所使用的术语“化学疗法的副作用”是指化学疗法的不希望的和非预期的(尽管不一定是出乎意料的)结果。
[0142]
如本文所使用的术语“放射疗法”、“辐射疗法”和“rt”可互换使用,是指电离辐射的医学用途,电离辐射作为癌症治疗的一部分,以直接或通过在受影响的细胞内产生损害dna的带电粒子来损害恶性细胞的dna。本发明包括的常用类型的辐射疗法包括例如外部线束辐射疗法(ebrt或xrt)、近距离放射疗法/密封源辐射治疗和全身放射性同位素疗法/未密封源辐射疗法。
[0143]
如本文所使用的术语“放射疗法的副作用”或“辐射疗法的副作用”是指辐射疗法的不希望的和非预期的(尽管不一定是出乎意料的)结果。产生哪种副作用取决于所治疗的身体区域、每天给予的剂量、给予的总剂量、患者的一般医学状态以及同时给予的其他治疗,并且可能包括例如皮肤刺激或损伤、疲劳、恶心、呕吐、纤维化、肠损伤、记忆丧失、不育或第二癌症。
[0144]
如本文所使用的术语“分解代谢状态”是指以快速体重减轻以及脂肪和骨骼肌质量的丧失为特征的病状,其可能发生在化学疗法或化学辐射疗法的背景下。相关临床事件包括例如免疫抑制、肌肉无力、易发肺栓塞、血栓性静脉炎和应激反应改变。
[0145]
如本文所使用的术语“病毒载体”和“病毒构建体”是指包含一个或多个异源核苷酸序列(例如,编码具有dna酶活性的酶的核苷酸序列)的重组病毒构建体。在一些实施方案中,病毒载体是复制缺陷型的。在一些实施方案中,病毒结构和非结构编码序列不存在于病毒载体中,而是在病毒载体产生期间通过载体(例如,质粒)或通过将序列稳定整合到包装细胞系中来反式提供。取决于病毒,病毒载体可以包装在衣壳(例如,aav载体)和/或脂质包膜(例如,慢病毒载体)内。
[0146]
如本文所使用的术语“多腺苷酸化信号”是指介导聚腺嘌呤片段延伸至mrna的3'末端的连接的核酸序列。可用于本发明的表达构建体的多腺苷酸化信号的非限制性实例包括例如sv40早期多腺苷酸化信号、sv40晚期多腺苷酸化信号、hsv胸苷激酶多腺苷酸化信号、鱼精蛋白基因多腺苷酸化信号、腺病毒5eib多腺苷酸化信号、牛生长激素多腺苷酸化信号、人变体生长激素多腺苷酸化信号等。
[0147]
如在本说明书和所附权利要求书中所使用的,单数形式“一个”、“一种”和“该”包括复数引用,除非上下文另外明确指出。
[0148]
根据本发明,可以在本领域技术范围内采用常规药理学和分子生物学技术。文献中充分解释了这些技术。特别参见,例如,sambrook,fritsch&maniatis,molecular cloning:a laboratory manual,第二版(1989)cold spring harbor laboratory press,cold spring harbor,new york(本文中为“sambrook等人,1989”);dna cloning:a practical approach,第i和第ii卷(d.n.glover编辑.1985);oligonucleotide synthesis(mj.gait编辑.1984);nucleic acid hybridization(b.d.hames&s.j.higgins编辑.(1985));transcription and translation(b.d.hames&s.j.higgins,编辑.(1984));animal cell culture(r.i.freshney,编辑.(1986);immobilized cells and enzymes(irl press,(1986));b.perbal,a practical guide to molecular cloning(1984);f.m.ausubel等人(编辑),current protocols in molecular biology,john wiley&sons,
inc.(1994)。靶向肝脏的dna酶
[0149]
本发明人出乎意料地发现,将具有dna酶活性的酶靶向肝脏表达可以导致从整个循环中,并且尤其是从门-血窦循环中增强清除疾病相关的cfdna。如下文实施例部分所述,cfdna可以在肝脏中积累,特别是在内皮周隙和disse间隙中积累。通过具有dna酶活性的酶的局部表达来降解这种cfdna储库可以降低循环中cfdna的总体水平。
[0150]
如在整个申请中所讨论的,具有dna酶活性的酶可以通过使用病毒载体(例如,腺相关病毒(aav)载体、逆转录病毒载体(例如,慢病毒载体)或腺病毒载体)、脂质体、携带dna酶转基因的纳米颗粒或裸dna而在肝脏细胞中有效表达。成年人的肝脏接收将近四分之一的心脏血输出量,每分钟过滤约1l的血液,并且在任何给定时刻都占血液体积的10-15%。这种活跃的循环允许在肝脏内快速积累高水平的载体颗粒。载体颗粒可以沿着肝血窦穿过有孔内皮细胞直接到达肝细胞。此类肝细胞可被载体颗粒转染并继续产生dna酶。所产生的dna酶分泌到内皮周隙和disse间隙中,在那里可以有效降解浓缩的cfdna池。
[0151]
本发明人已发现,转染肝脏细胞以表达具有dna酶活性的酶提供了令人惊讶地更大的cfdna减少,以及与血流中高水平cfdna相关的疾病和病状明显的和令人惊讶的改善。
[0152]
在一些实施方案中,通过使用在肝脏中优势表达的核酸表达盒来实现dna酶在肝脏中的表达。在一些实施方案中,这样的表达盒可以包含以下元件中的一个或多个:(a)肝基因座控制元件;(b)位于肝基因座控制元件3'的肝启动子;(c)位于肝启动子3'的编码序列,所述编码序列编码多肽,例如脱氧核糖核酸酶;(d)位于编码序列3'的多腺苷酸化信号;以及(e)位于肝启动子3'和多腺苷酸化信号5'的内含子。元件(a)、(b)、(c)、(d)和(e)可以可操作地连接以表达由编码序列编码的多肽。在一些实施方案中,本发明的表达盒指导治疗量的多肽在肝脏细胞中表达至少100天(例如,至少200天、至少300天、至少400天或至少500天)的时间。在一些实施方案中,所述多肽是dna酶。dna酶可以是本文所述的任何dna酶,例如dna酶i。
[0153]
多腺苷酸化信号可以可操作地连接至编码dna酶的核酸。多腺苷酸化信号的非限制性实例包括例如sv40早期多腺苷酸化信号、sv40晚期多腺苷酸化信号、hsv胸苷激酶多腺苷酸化信号、鱼精蛋白基因多腺苷酸化信号、腺病毒5eib多腺苷酸化信号、牛生长激素多腺苷酸化信号、人变体生长激素多腺苷酸化信号等。
[0154]
在另一方面,本发明提供了载体,其包含在哺乳动物肝脏中优势表达的核酸表达盒。这种表达盒可包括例如:(a)肝基因座控制元件;(b)位于肝基因座控制元件3'的肝启动子;(c)位于肝启动子3'的编码序列,所述编码序列编码多肽,例如脱氧核糖核酸酶;(d)位于编码序列3'的多腺苷酸化信号;(e)位于肝启动子3'和多腺苷酸化信号5'的内含子。元件(a)、(b)、(c)、(d)和(e)可操作地连接以表达由编码序列编码的多肽。本发明的一些载体是游离型载体,以及本发明的一些载体是整合型载体,例如整合型病毒载体。在一些实施方案中,所述多肽是脱氧核糖核酸酶(dna酶)。dna酶可以是本文所述的任何dna酶,例如dna酶i。
[0155]
在另一方面,本发明提供了用于治疗与cfdna水平升高相关的疾病或病状的方法。所述疾病或病状可以是在本文或美国专利号7,612,032;8,388,951;8,431,123;8,535,663;8,710,012;8,796,004;8,871,200;8,916,151;9,072,733;9,248,166;9,770,492;美国专利申请公开号us20170056482、us20170100463、us20150110769以及国际申请公开号
wo2016/190780中任一个所描述的,它们的全部内容通过引用整体并入本文。在一个实施方案中,所述方法包括以下步骤:(1)将包含核酸表达盒的载体引入受试者的肝脏,所述表达盒包含:(a)肝脏特异性启动子;(b)位于肝脏特异性启动子3'的编码序列,所述编码序列编码具有dna酶活性的酶(例如,本文所述的任何dna酶);(c)位于编码序列3'的多腺苷酸化信号;以及任选地(d)位于肝启动子3'以及多腺苷酸化信号5'的内含子。元件(a)、(b)、(c)和(d)可操作地连接以表达由编码序列编码的多肽;以及(2)在肝脏中表达治疗量的所述多肽。在本发明该方面的方法的一些实施方案中,治疗量的多肽表达至少100天(例如,至少200天、至少300天、至少400天和至少500天)。
[0156]
本发明该方面的核酸表达载体和表达盒在肝脏中优势表达,例如,至少50%的编码多肽的表达发生在肝脏内。更典型地,至少90%的表达发生在肝脏内。本发明该方面的一些表达载体和表达盒仅在肝脏内表达。
[0157]
肝基因座控制元件可以被掺入到本发明的表达盒中,所述肝基因座控制元件能够增强核酸分子在肝脏细胞中的表达,并对表达盒赋予拷贝数依赖性、位置无关的表达。可用于本发明的表达盒的一些肝基因座控制区包括例如基质附着区和/或肝脏特异性增强子元件。
[0158]
除启动子外,表达盒和/或载体可包含一个或多个额外的转录起始、终止和/或增强子序列;rna加工信号(例如,剪接和多腺苷酸化(poly a)信号);稳定细胞质mrna的序列;增强翻译效率的序列(例如,kozak共有序列,例如5'-gccgccacc-3'[seq id no:33]);增强蛋白质稳定性的序列;以及增强编码多肽分泌的序列。合适的polya序列的实例包括例如sv40、sv50、牛生长激素(bgh)、人生长激素和合成的polya。合适的增强子的实例包括例如甲胎蛋白增强子、ttr最小启动子/增强子、lsp(th-结合球蛋白启动子/α1-微球蛋白/bikunin增强子)、serpin1增强子等。在一个实施方案中,表达盒包含一种或多种表达增强子。在一个实施方案中,表达盒包含两种或更多种表达增强子。这些增强子可以相同或可以彼此不同。例如,增强子可以包括αmic/bik增强子。该增强子可以以彼此相邻的两个拷贝存在。备选地,增强子的双拷贝可以被一个或多个序列分开。
[0159]
在又一个实施方案中,表达盒还包含内含子(例如,promega内含子、截短的嵌合内含子(t-嵌合内含子)、在国际专利申请公开号wo 2011/126808中描述的内含子)。
[0160]
任选地,可以选择一种或多种序列来稳定mrna。这种序列的一个实例是经修饰的wpre序列,其可以改造在polya序列的上游和编码序列的下游(参见,例如,ma zanta-boussif,等人,gene therapy(2009)16:605-619)。
[0161]
增强子可以是衍生自载脂蛋白e或apoe的约155bp的apoe增强子元件。apoe是一种载脂蛋白,其介导脂蛋白颗粒的结合、内化和分解代谢,并且是低密度脂蛋白(apob/e)受体和肝组织apoe受体的配体。与apoe基因相关的遗传增强子是一种真核控制元件,其可特异性增加核酸在肝脏中的转录。
[0162]
增强子可包含来自与apoe基因相关的肝控制区(例如,hcr-1或hcr-2)的元件。例如,来自hcr-1的序列存在于seq id no:17的序列中。
[0163]
在又一个实施方案中,表达盒和/或载体还包含转录后调节元件(pre)。示例性转录后调节元件是土拨鼠肝炎病毒转录后调节元件(wpre)。例如,来自wpre的序列显示在seq id no:16中。wpre可以有效地增加蛋白质(例如,dna酶)的表达。可以对wpre进行修饰,以免
于产生wpre中编码的截短的x蛋白的活性形式。至少在seq id no:16的序列中和在apoehcr增强子:haat启动子>hdna酶i(超活性)正确前导序列-wpre xinact(seq id no:30的碱基1576-2212),也参见图10a和10b)中提供了一种这样的经修饰的wpre。
[0164]
在一些实施方案中,本发明的盒指导治疗量的编码序列编码的多肽在延长时间内的表达,通常大于200天,并且在某些情况下大于500天。编码序列编码的多肽的表达可通过任何本领域公认的方法来测量,诸如例如通过基于抗体的测定法(例如,western blot或elisa测定法)。再次,作为非限制性实例,由表达盒内的编码序列编码的多肽的表达可以在检测多肽的酶促活性或生物学活性的生物测定中进行测量。
[0165]
一旦进入肝脏细胞(例如,肝细胞),载体可以保持游离(即,不整合到宿主细胞的基因组中),或者可以整合到宿主细胞的基因组中。游离型载体的非限制性实例包括腺病毒载体,以及整合到宿主细胞基因组的载体的实例包括逆转录病毒载体。
[0166]
在本发明的一些实施方案中,将包含编码具有dna酶活性的酶的核苷酸序列的表达载体以脂质体的形式递送至细胞,其中dna与一种或多种脂质(例如,dotma(1,2-二油酰氧基丙基-3-三甲基溴化铵)和dope(二油酰磷脂酰乙醇胺))缔合。在一些实施方案中,含有dotma的阳离子脂质体有效地将本发明的表达载体靶向肝脏。在一些实施方案中,将乳铁蛋白和/或聚l-赖氨酸和/或聚乙烯亚胺和/或壳聚糖缀合至表达载体,在直接引入受试者中后,该缀合物有效靶向肝脏。
[0167]
在一些实施方案中,脂质体的尺寸小于肝脏中肝血窦内衬内皮层膜孔的尺寸。
[0168]
在一些实施方案中,将表达载体包装到纳米载体中或由纳米载体包封。
[0169]
在一些实施方案中,将表达载体包装到亚磷酰胺纳米颗粒中。
[0170]
已经开发出各种装置来增强本发明的编码具有dna酶活性的酶的核酸对靶细胞的可用性,所述装置包括例如导管或含有dna的可植入材料(g.d.chapman等人,circulation res.71:27-33(1992))和无针的喷射注射装置,其在高压下将液体柱直接射入靶组织中(p.a.furth等人,anal biochem.20:365-368(1992);(h.l.vahlsing等人,j.immunol.meth.175:11-22(1994);(f.d.ledley等人,cell biochem.18a:226(1994))。
[0171]
靶向肝脏递送本发明的编码具有dna酶活性的酶的核酸的另一种方法是使用分子缀合物,其由蛋白质或合成配体组成,核酸结合剂已附着至这些蛋白质或合成配体以用于核酸对细胞的特异性靶向(r.j.cristiano等人,proc.natl.acad.sci.usa 90:11548-52(1993);b.a.bunnell等人,somat.cell mol.genet.18:559-69(1992);m.cotten等人,proc.natl.acad.sci.usa 89:6094-98(1992))。这种基因递送系统已被证明能够通过使用不同的配体靶向递送至许多细胞类型(r.j.cristiano等人,proc.natl.acad.sci.usa 90:11548-52(1993))。例如,脂质转染和疟疾环子孢子蛋白已经用于肝脏特异性基因递送(z.ding等人,j.biol.chem.270:3667-76(1995))。
[0172]
本发明的表达载体的优选施用途径是肝内、静脉内和动脉内施用。但是,也可以采用其他允许肝脏靶向的施用途径,例如,肠内(例如,口服)、肌内、腹膜内等。
[0173]
本发明的表达载体可以通过任何本领域公认的方法直接引入肝脏,例如,通过直接注射到肝脏、门静脉注射或尾静脉注射。
[0174]
本发明的表达载体可以通过以下方式进行递送:(1)在哺乳动物的动脉中创建进入部位,(2)将导丝引入动脉,(3)经导丝将鞘引入动脉,(4)将导管穿过鞘推进到肝脏中;
(5)将表达载体(例如,raav病毒体)通过导管注入肝脏中;(6)从动脉中取出导管和鞘,以及(7)修复进入部位。可以通过合适的静脉或动脉将导管引入靶器官。例如,可以通过门静脉或肝动脉进入肝脏。可以使用本领域已知的技术(例如,seldinger技术)来进入合适的静脉或动脉。参见,例如,conahan等人,(1977)jama 237:446-447,其通过引用并入本文。还已知其他进入静脉和动脉的方法。参见,例如,美国专利号5,944,695,通过引用并入本文。
[0175]
在某些其他实施方案中,阻塞一个或多个将血液输送到肝脏或从肝脏排空血液的血管。阻塞装置可以是例如附接到导管顶端的气囊。可以阻塞所有进入或离开肝脏的动脉和静脉,从而通过血性肝灌注来递送表达载体,由此在排除来自肝脏的正常血流之后选择性地灌注肝脏。这可以通过夹住肝动脉、门静脉、肝上腔静脉、右肾上静脉和肝下腔静脉来完成,以实现肝脏的全部血管排除。然后用适当规格的导管对门静脉进行插管,同时在肝下腔静脉的前壁切开一个切口,并在腔静脉内放置抽吸套管以收集流出物。然后使用泵进行肝脏灌注,优选单向灌注。流速可以为每克肝脏0.1ml/min到每克肝脏10ml/min。优选每克肝脏1ml/min的速度,并且可以提高速度以确保令人满意的器官灌注。灌注后,缝合门静脉和腔静脉切口,并使肝脏血运重建。cardoso,等人,human gene therapy 4:411-418at 412(1993)。
[0176]
在其他实施方案中,表达载体通过注射到肝动脉而被递送至肝脏中。
[0177]
在肝脏器官中,实质细胞包括肝细胞、库普弗细胞和胆道和胆管内衬的上皮细胞。肝实质的主要成分是多面体肝细胞(也称为肝细胞),其至少在肝血窦的一侧和胆小管的对侧出现。作为非实质细胞的肝脏细胞包括血管内的细胞,例如内皮细胞或成纤维细胞。
[0178]
在肝脏中,肝静脉是传出血管,因为它通常将血液从肝脏带入下腔静脉。同样在肝脏中,门静脉和肝动脉相对于肝脏是传入血管,因为它们通常将血液带入肝脏。
[0179]
肝脏血管包括将血液从胃肠道和其他内部器官(例如,脾、胰和胆囊)输送到肝脏的门静脉系统。另一个肝脏血管是肝静脉。肝静脉也可以通过下腔静脉或最终连接到肝脏的另一条血管到达。可以使用针或导管将多核苷酸注射到血管系统中。可以在切开和可视化组织血管后的直接观察下进行注射。备选地,可以将导管插入远处并穿线,使其位于与靶组织相连的血管系统中。在一些实施方案中,执行深入注射至腔静脉。在另一个实施方案中,可以通过使用穿过完整皮肤并进入供应靶组织或从靶组织引流的血管的针来执行注射。
[0180]
在一些实施方案中,递送如下执行。通过腹部中线切口可以看到肝脏和门静脉。在约30秒内,使用针将1ml含有肝素以防止凝结的载体/脂质体/裸dna各种溶液注入门静脉。
[0181]
具有dna酶活性的酶的肝脏递送、表达和分泌的效率可以例如通过测定血液(例如,从眼眶后静脉窦获得的血液)中的酶水平来进行确定,例如,使用免疫学测定(例如,用识别酶的抗体进行的测定,诸如例如放射免疫测定法(ria)(来自nichols institute,san juan capistrano,calif.,usa的hgh-tges 100t试剂盒))。在实验动物模型中,可以确定具有dna酶活性的酶的肝脏递送、表达和分泌的效率,例如,通过颈椎脱臼处死动物并将肝脏(平均重量为1.5g)分成六个部分(由两片中叶、两片左侧叶、右侧叶和尾叶加一小片右侧叶组成)。六个部分中的每一个都可以分别放入匀浆缓冲液中。可以将匀浆物离心,并分析上清液中的外源基因产物(即具有dna酶活性的酶)。肝脏注射可以被引导至下腔,该下腔在以下两个位置被夹住:肝静脉进入下腔静脉的近端和远端。具体而言,下游下腔静脉钳可放置
在隔膜和肝静脉入口点之间。上游下腔静脉钳可放置在肾静脉入口点的正上游。由于其他器官的静脉(例如,肾静脉)在该位置进入下腔静脉,因此并非所有注射液都进入肝脏。在一些在下腔静脉中接受逆行注射的动物中,可以夹住(阻塞)肝动脉、肠系膜动脉和门静脉。细小病毒载体,包括腺相关病毒载体
[0182]
在某些实施方案中,本发明中使用的载体是细小病毒载体,例如,腺相关病毒(aav)载体。如本文所使用的术语“细小病毒”涵盖细小病毒科,包括自主复制的细小病毒和依赖病毒属(dependoviruses)。自主细小病毒包括细小病毒属、红细胞病毒属、浓核病毒属、重复病毒属(iteravirus)和反病毒属(contravirus)的成员。自主细小病毒包括但不限于小鼠微小病毒、牛细小病毒、犬细小病毒、鸡细小病毒、猫泛白细胞缺乏症病毒(feline panleukopenia virus)、猫细小病毒、鹅细小病毒、h1细小病毒、番鸭细小病毒、b 19病毒和现在已知或以后发现的任何其他自主细小病毒。其他自主细小病毒是本领域技术人员已知的。参见,例如,bernard n.fields等人,virology,第2卷,第69章(第4版,lippincott-raven publishers)。
[0183]
在一些实施方案中,细小病毒载体是单链细小病毒载体,例如aav载体。aav(依赖病毒属)通常感染人类(例如,血清型1、2、3a、3b、4、5和6)或灵长类动物(例如,血清型1和4)或其他温血动物(例如,牛、犬、马和羊aav)。例如,在fields virology(第3版.1996)第69章的kenneth i.berns,“parvoviridae:the viruses and their replication,”中提供了关于细小病毒和细小病毒科其他成员的进一步信息。
[0184]
本文公开的aav载体可以衍生自任何aav血清型,包括血清型的组合(例如,“假型”aav)或衍生自各种基因组(例如,单链或自身互补)。传统上,基于针对一种病毒的抗体与另一种病毒相比缺乏交叉反应性来定义“血清型”。这种交叉反应性差异通常是由于衣壳蛋白序列/抗原决定簇的差异(例如,由于vp1、vp2和/或vp3序列差异)。可用于开发本发明的aav表达载体的aav血清型的非限制性实例包括例如aav血清型1(aav1)、aav2、aav3(包括3a和3b型)、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、aavrh10(例如,在美国专利号9,790,472、国际专利申请公开号wo2017180857和wo2017/180861中所公开)、aavlk03(例如,在wang等人,mol.ther.,2015,23(12):1877-1887中所公开)、aavhu37(例如,在国际专利申请公开号wo2017180857中所公开)、aavrh64r1(例如,在国际专利申请公开号wo2017180857中所公开)、anc80(基于血清型aav1、aav2、aav8和aav9的预测祖先;参见zinn等人,cell rep.,2015,12(67):1056-1068)、禽类aav、牛aav、犬aav、马aav、羊aav以及现在已知或以后发现的任何其他aav。参见,例如,fields等人,virology,第2卷,第69章(第4版,lippincott-raven publishers)。
[0185]
最近,已经鉴定了许多推定的新的aav血清型和进化枝(参见,例如,gao等人,(2004)j.virology 78:6381-6388;moris等人,(2004)virology 33-:375-383)。aav和自主细小病毒的各种血清型的基因组序列以及末端重复序列、rep蛋白和衣壳亚基的序列是本领域已知的,例如,srivistava等人,(1983)j.virology 45:555;chiorini等人,(1998)j.virology 71:6823;chiorini等人,(1999)j.virology 73:1309;bantel-schaal等人,(1999)j.virology 73:939;xiao等人,(1999)j.virology 73:3994;muramatsu等人,(1996)virology 221:208;shade等人,(1986)j.virol.58:921;gao等人,(2002)proc.nat.acad.sci.usa 99:11854;moris等人,(2004)virology 33-:375-383;genbank登
录号u89790;genbank登录号j01901;genbank登录号af043303;genbank登录号af085716;genbank登录号nc 006152;genbank登录号y18065;genbank登录号nc 006260;genbank登录号nc_006261;国际专利公开号wo 00/28061,wo 99/61601,wo98/11244;以及美国专利号6,156,303,它们的公开内容通过引用并入本文以教导细小病毒和aav核酸和氨基酸序列。
[0186]
所有已知的aav血清型的基因组结构非常相似。aav的基因组是线性的单链dna分子,其长度小于约5,000个核苷酸(nt)。反向末端重复序列(itr)位于非结构复制(rep)蛋白和结构(vp)蛋白的独特编码核苷酸序列的侧翼。vp蛋白(vp1、vp2和vp3)形成衣壳。末端145个核苷酸是自身互补的并且被组织,使得可以形成形成t形发夹的能量稳定的分子内双链体。这些发夹结构作为病毒dna复制的起点,用作细胞dna聚合酶复合物的引物。在哺乳动物细胞中wtaav感染后,分别从p5启动子和p19启动子表达rep基因(即rep78和rep52),并且这两种rep蛋白在病毒基因组复制中均具有功能。
[0187]
在一些实施方案中,重组aav(raav)载体包含一个或多个目的核苷酸序列,其侧翼为至少一个细小病毒或aav反向末端重复序列(itr)。当在表达aav rep和cap基因产物(即aav rep和cap蛋白)的包装细胞中产生时,这样的raav载体可以复制并包装成病毒颗粒。如本文所使用的术语“aav cap蛋白”或“aav衣壳蛋白”是指具有天然aav cap蛋白(例如,vp1、vp2、vp3)的至少一种功能活性的多肽。cap蛋白(例如,vp1、vp2、vp3)的功能活性的实例包括诱导衣壳形成、促进单链dna积累、促进aav dna包装成衣壳(即衣壳化),结合细胞受体并促进病毒体进入宿主细胞的能力。
[0188]
在一些实施方案中,aav载体可以包含所需的蛋白质或蛋白质变体。如本文所使用的“变体”是指一个或多个氨基酸改变的氨基酸序列。变体可以具有“保守”变化,其中置换的氨基酸具有相似的结构或化学性质,例如,用异亮氨酸取代亮氨酸。更罕见的是,变体可具有“非保守”变化,例如,用色氨酸取代甘氨酸。类似的微小变化也可以包括氨基酸缺失或插入,或两者。
[0189]
将aav载体包装到aav病毒衣壳中。aav病毒衣壳蛋白的序列定义了特定aav载体的许多特征。例如,衣壳蛋白影响衣壳结构和组装、与aav非结构蛋白(例如,rep和aap蛋白)的相互作用、与宿主体液和细胞外基质的相互作用、病毒从血液中的清除、血管通透性、抗原性、与中和抗体的反应性、组织/器官/细胞类型的向性、细胞附着和内化的效率、细胞内运输途径、病毒体脱壳率等。衣壳蛋白(例如,vp3)的序列可以被改变以增强向肝脏的递送。
[0190]
aav构建体可进一步包含编码包装上述多核苷酸序列的一种或多种衣壳蛋白(vp1和/或vp2和/或vp3衣壳蛋白,优选仅vp3衣壳蛋白)的序列。编码用于本发明上下文的一种或多种衣壳蛋白的序列可以取自任何已知的42种血清型,例如,aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、anc80或通过例如衣壳改组技术和/或使用aav衣壳库获得的新开发的aav样颗粒。对于衣壳蛋白序列的一些非限制性实例,参见,例如,美国专利号9,790,472;9,677,089;7,282,199;国际专利申请公开号wo 2015/054653,wo2017/180857(aav8、aav9、aavrh10、aavhu37、aavrh64r1),wo2017/180861(aavrh10)、wo2017/180854(aav8突变体)和wang等人,mol.ther.,2015,23(12):1877-1887(aav8、aavrh10、aav3b和aavlk03)。当编码衣壳蛋白的序列衍生自与itr不同的aav血清型时,aav构建体被称为“杂合”细小病毒基因组(即,其中aav衣壳和一个或多个aav末端重复序列来自不同的aav),如在国际专利申请公开号wo 00/28004和chao等人,(2000)molecular therapy 2:619中所描
述的。
[0191]
在一些实施方案中,一种或多种衣壳蛋白介导aav载体有效靶向肝脏。在一些实施方案中,一种或多种衣壳蛋白介导aav载体优先靶向肝。一些衣壳蛋白(例如,anc80的vp3、aav8和aav3b)是天然肝特异性的。本发明也涵盖增强肝脏靶向性和/或肝脏特异性的aav衣壳突变体的用途。aav8衣壳序列的此类点突变的非限制性实例包括例如s279a、s671a、k137r和t252a,以及在国际专利申请公开号wo2017/180854中公开的aav8衣壳突变(例如,aav3g1、aavt20或aavtr1,在氨基酸263-267[例如,263ngtsg267->sgth或263ngtsg267->sdth]和/或氨基酸457-459[例如,457tan459->srp]和/或氨基酸455-459[例如,455ggtan459->dgsgl]和/或氨基酸583-597中的vp3突变)。
[0192]
本文公开的aav载体包括编码具有dna酶活性的酶的核酸,诸如例如,dna酶i。在各种实施方案中,所述核酸还可以包含一个或多个允许表达和分泌所编码的酶的调节序列,例如,启动子、增强子、多腺苷酸化信号、内部核糖体进入位点(ires)、编码蛋白质转导结构域(ptd)的序列、分泌信号序列等。因此,在一些实施方案中,核酸可包含与编码序列可操作地连接的启动子区,以引起或改善目的蛋白在转染细胞中的表达。这样的启动子可以是遍在的、细胞或组织特异性的、强的、弱的、调节的、嵌合的等,例如以允许在肝脏中有效和稳定地产生蛋白质。尽管通常在公开的方法中使用的启动子在人细胞起作用,但启动子可以与编码的蛋白质是同源的,也可以是异源的。调节型启动子的实例包括但不限于含tet on/off元件的启动子、雷帕霉素诱导型启动子、他莫昔芬诱导型启动子和金属硫蛋白启动子。可以使用的其他启动子包括组织特异性启动子,例如肝脏特异性启动子。肝脏特异性启动子的非限制性实例包括例如白蛋白启动子(alb)、人α1-抗胰蛋白酶(haat)启动子、甲状腺激素结合球蛋白启动子(tbg)、载脂蛋白e肝控制区启动子、载脂蛋白a-ii(apoa2)启动子、丝氨酸蛋白酶抑制蛋白肽酶抑制剂启动子、进化枝a成员1(serpina1)(haat)启动子、细胞色素p450家族3亚家族a多肽4(cyp3a4)启动子、微rna 122(mir-122)启动子、肝脏特异性igf-ii启动子p1、转甲状腺素蛋白(mttr)启动子和甲胎蛋白(afp)启动子。遍在启动子的非限制性实例包括例如病毒启动子(例如,cmv启动子、rsv启动子、sv40启动子等),以及细胞启动子(例如,磷酸甘油酸激酶(pgk)启动子、ef1a启动子、cmve/cag启动子系统和β-肌动蛋白启动子)。
[0193]
本发明的aav构建体还可包含不可分解的末端重复序列。如本文所使用的表述“不可分解的末端重复序列”涉及无法被aav rep蛋白识别并被aav rep蛋白分解(即“形成切口”)的末端重复序列,使得末端重复序列的分解明显降低(例如,与可分解的末端重复序列相比,至少降低约50%、60%、70%、80%、90%、95%、98%或更大)或被消除。此类不可分解的末端重复序列可以是天然存在的末端重复序列(包括其改变的形式)以及例如可以衍生自细小病毒(包括aav),或者可以衍生自另一种病毒,或者作为另一种备选方案,可以是部分或完全合成的。不可分解的末端重复序列可以是aav rep蛋白无法识别的非aav病毒序列,或者也可以是已被修饰(例如,通过插入、取代和/或缺失)使得其不再被aav rep蛋白识别的aav末端重复序列。此外,不可分解的末端重复序列可以是在用于产生病毒载体的条件下不可分解的任何末端重复序列。此外,可以修饰aav末端重复序列,从而明显降低或消除aav rep蛋白的分解。不可分解的末端重复序列可以是形成发夹结构且不能被aav rep蛋白切割的任何反向重复序列。
[0194]
反向末端重复序列(itr)通常以至少两个拷贝存在于aav载体中,通常位于含有编码具有dna酶活性的酶的核苷酸序列的表达盒的侧翼。itr通常将处于编码具有dna酶活性的酶的一个或多个核苷酸序列的5'和3'末端,但不必与其邻接。itr可以彼此相同或不同。术语“末端重复序列”包括形成发夹结构并起反向末端重复序列作用的任何病毒末端重复序列和/或部分或完全合成的序列,例如samulski等人的美国专利号5,478,745中所述的“双d序列”。“aav末端重复序列”可以来自任何aav,包括但不限于血清型1、2、3、4、5、6、7、8、9、10、11、12、anc80或现在已知或以后发现的任何其他aav。aav末端重复序列不必具有野生型序列(例如,野生型序列可以通过插入、缺失、截短或错义突变来改变),只要该末端重复序列介导所需的功能,例如,复制、产生切口、病毒包装、整合和/或前病毒拯救等。载体构建体可以包含一个或多个(例如,两个)aav末端重复,其可以相同或不同。此外,一个或多个aav末端重复序列可以与aav衣壳来自相同的aav血清型,或者可以不同。在特定的实施方案中,载体构建体包含aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12和/或anc80末端重复序列。
[0195]
细小病毒itr核苷酸序列通常是回文序列,主要包括互补的、对称排列的序列,也称为“a”、“b”和“c”区。itr用作复制起点,在复制中具有“顺式”作用的位点,即,是反式作用复制蛋白(例如,rep 78(或rep68))的识别位点,反式作用复制蛋白识别回文和回文内部的特定序列。itr序列对称性的一个例外是itr的“d”区。它是独特的(在一个itr内不具有互补物)。单链dna的切口出现在a区和d区之间的连接处。这是新dna合成起始的区域。d区通常位于回文序列的一侧,并为核酸复制步骤提供方向性。在哺乳动物细胞中复制的细小病毒通常具有两个itr序列。但是,可以对itr进行改造,使得结合位点位于a区的两条链上以及d区则对称地位于回文的每一侧。然后在双链环状dna模板(例如质粒)上,rep78-或rep68-辅助的核酸复制沿两个方向进行,并且单个itr就足以实现细小病毒环状载体复制。因此,可以在本发明的上下文中使用一个itr核苷酸序列。可以使用两个或其他偶数个常规itr。
[0196]
功能性itr序列对于aav病毒体的复制、拯救和包装是必需的。itr序列可以是野生型序列,或者可以与野生型序列具有至少80%、85%、90%、95%或100%的序列同一性。可以通过例如核苷酸的插入、突变、缺失或取代来改变itr序列,只要它们保持功能性。在本文中,功能性是指引导将基因组包装到衣壳中并然后允许在待转导的宿主细胞或靶细胞中表达的能力。
[0197]
aav载体可以由单链或双链(自身互补的)dna组成。单链核酸分子是有义链或反义链,因为两种极性都同等地能够进行基因表达。aav载体可以进一步包含标记或报道基因,诸如例如编码抗生素抗性基因的基因、编码荧光蛋白(例如,gfp)的基因或本领域已知的编码化学、酶促或其他方式可检测和/或选择的产物的基因(例如,lacz、aph等)。
[0198]
aav表达载体可以包含核酸,其可以包含分泌信号序列,该信号序列允许从被转导的细胞分泌所编码的具有dna酶活性的酶。这样的分泌信号序列的非限制性实例包括例如dna酶i分泌信号序列、il2分泌信号序列、白蛋白分泌信号序列、β-葡糖醛酸糖苷酶分泌信号序列、碱性蛋白酶分泌信号序列和纤连蛋白分泌信号序列。
[0199]
在一些实施方案中,基于aav8或基于anc80的载体用作表达载体。aav8和anc80载体特别适合于肝脏靶向和表达。例如,与aav2载体相比,aav8和anc80载体均可以更高的效率转染肝脏细胞。与其他一些aav载体相比,aav8和anc80均诱导较少量的中和抗体。
[0200]
可以肝内(例如,通过直接器官注射)或全身性(例如,通过静脉内注射)施用包含编码具有dna酶活性的酶的核苷酸的aav8载体或anc80载体,其中aav8或anc80载体有效转染肝脏细胞并介导所编码的具有dna酶活性的酶的有效产生,及其在内皮周隙和disse间隙中的分泌。在一些实施方案中,anc80衣壳蛋白(例如,包含序列seq id no:3或seq id no:9的anc80 vp1衣壳蛋白,或包含seq id no:34的序列的anc80l65 vp1衣壳蛋白,或包含seq id no:35的序列的变体anc80l65 vp1衣壳蛋白)由表达载体中的核苷酸序列编码。在一些实施方案中,aav8衣壳蛋白(例如,aav8 vp1或aav8vp3)由表达载体中的核苷酸序列编码。本发明的aav载体的外周施用可以包括全身性注射,例如肌内、静脉内、腹膜内和动脉内注射。
[0201]
本发明的aav载体编码的dna酶的所需剂量可以由本领域技术人员容易地调整,例如,取决于疾病病状、受试者、治疗方案等。在一些实施方案中,每剂量施用105至10
14
个重组病毒颗粒,例如,106至10
11
、107至10
11
或108至10
14
个。在其他实施方案中,用于实现治疗效果的示例性剂量可包括至少约105、106、107、108、109、10
10
或10
11
个重组病毒颗粒或更多的滴度。
[0202]
一个或多个外源靶向序列可以取代或置换主要衣壳亚基(例如,vp3)的部分或全部。或者作为另一种备选方案,可以将多于一种外源靶向序列,例如,两个、三个、四个、五个或更多个序列引入病毒体衣壳中。在备选实施方案中,可以进行次要衣壳亚基(例如,vp1和vp2)内的插入和置换。对于aav衣壳,可以进行vp2或vp3中的插入或置换。
[0203]
通过插入或置换氨基酸序列可以降低或消除天然病毒体向性。备选地,外源氨基酸序列的插入或置换可以将病毒体靶向一种或多种特定细胞类型。外源性靶向序列可以是编码改变病毒体向性的蛋白质或肽的任何氨基酸序列。在特定的实施方案中,靶向肽或蛋白质可以是天然存在的,或者,备选地是完全或部分合成的。示例性肽和蛋白质包括配体以及结合至肝脏细胞中存在的细胞表面受体的其他肽,包括能够结合载脂蛋白e、半乳糖和乳糖特异性凝集素的sr-b1受体的配体、低密度脂蛋白受体配体、脱唾液酸糖蛋白(半乳糖-末端)配体等。
[0204]
备选地,外源靶向序列可以是抗体或其抗原识别部分。如本文所使用的术语“抗体”是指所有类型的免疫球蛋白,包括igg、igm、iga、igd和ige。抗体可以是单克隆的或多克隆的,并且可以是任何来源的物种的,包括(例如)小鼠、大鼠、兔、马或人,或者可以是嵌合抗体。术语“抗体”还包括本领域技术人员已知的双特异性或“桥连”抗体。在本发明范围内的抗体片段包括例如fab、f(ab')2和fc片段,以及从igg以外的抗体获得的相应片段。这样的片段可以通过已知技术产生。插入病毒体衣壳中的外源氨基酸序列可以是有助于纯化或检测病毒体的序列。例如,如本领域技术人员所知,外源氨基酸序列可包括可用于在镍柱上纯化病毒体的聚组氨酸序列,或可用于通过标准的免疫纯化技术纯化病毒体的抗原肽或蛋白质。备选地,氨基酸序列可编码受体配体或可用于通过亲和纯化或本领域已知的任何其他技术(例如,基于差异性尺寸、密度、电荷或等电点的纯化技术、离子交换色谱或肽色谱)纯化经修饰的病毒体的任何其他肽或蛋白质。
[0205]
备选地,外源靶向序列可以是抗体或其抗原识别部分。如本文所使用的术语“抗体”是指所有类型的免疫球蛋白,包括igg、igm、iga、igd和ige。抗体可以是单克隆的或多克隆的,并且可以是任何来源的物种的,包括(例如)小鼠、大鼠、兔、马或人,或者可以是嵌合
抗体。术语“抗体”还包括本领域技术人员已知的双特异性或“桥连”抗体。在本发明范围内的抗体片段包括例如fab、f(ab')2和fc片段,以及从igg以外的抗体获得的相应片段。这样的片段可以通过已知技术产生。
[0206]
插入病毒体衣壳中的外源氨基酸序列可以是有助于纯化或检测病毒体的序列。根据本发明的这个方面,外源氨基酸序列不必改变经修饰的细小病毒的病毒体。例如,如本领域技术人员已知的,外源氨基酸序列可包括可用于在镍柱上纯化病毒体的聚组氨酸序列,或可用于通过标准的免疫纯化技术纯化病毒体的抗原肽或蛋白质。备选地,氨基酸序列可编码受体配体或可用于通过亲和纯化或本领域已知的任何其他技术(例如,基于差异性尺寸、密度、电荷或等电点的纯化技术、离子交换色谱或肽色谱)纯化经修饰的病毒体的任何其他肽或蛋白质。腺病毒载体
[0207]
腺病毒基因组是一种线性的36kb双链dna,包含多个高度剪接的转录体。在基因组的任一端是反向末端重复(itr)。基因分为早期(e1-e4)和晚期(l1-l5)转录体。
[0208]
在一些实施方案中,重组腺病毒载体具有两个基因缺失:e1和e3(de1/e3)。e1的缺失使病毒载体成为复制缺陷型的。e1可由腺病毒包装细胞系(例如,t 293或911)提供。e3参与逃避宿主免疫力,并且对于病毒产生不是必需的。e1和e3的缺失导致转基因包装容量>8kb。在一些实施方案中,构建体包含左臂和右臂以促进转基因同源重组为腺病毒质粒。
[0209]
可以使用任何可接受的人类腺病毒类型,如例如基于ad5的腺病毒载体。基于ad5的载体利用柯萨奇-腺病毒受体(coxsackie-adenovirus receptor,car)进入细胞。在一些实施方案中,将人5型腺病毒(de1/e3)用作载体。大多数腺病毒载体工程化改造为使得转基因取代ad e1a、e1b和/或e3基因;随后,复制缺陷型载体在反式提供缺失的基因功能的人293细胞中增殖。腺病毒载体可以在体内转导多种类型的组织,包括非分裂的分化细胞,例如在肝脏中发现的细胞。常规的ad载体具有大的承载容量。在临床试验中使用ad载体的例子涉及多核苷酸疗法,其用于肌内注射进行抗肿瘤免疫(sterman等人,hum.gene ther.7:1083-9(1998))。在临床试验中使用腺病毒载体进行基因转移的其他例子包括rosenecker等人,infection 24:1 5-10(1996);sterman等人,hum.gene ther.9:71083-1089(1998);welsh等人,hum.gene ther.2:205-18(1995);alvarez等人,hum.gene ther.5:597-613(1997);topf等人,gene ther.5:507-513(1998);sterman等人,hum.gene ther.7:1083-1089(1998)。乙型肝炎载体和其他嗜肝性载体
[0210]
在一些实施方案中,可以通过使用天然靶向肝细胞的病毒载体来实现具有dna酶活性的酶的肝特异性递送和表达。可以通过循环施用源自嗜肝病毒(例如乙型肝炎病毒(hbv)或来自嗜肝dna病毒科(hepadnaviridae)的其他病毒)的载体,且所述载体使用与野生型病毒的相同的受体靶向肝细胞。乙型肝炎病毒(hbv)是嗜肝dna病毒科的原型,该病毒科是一种小型的包膜dna病毒,具有明显的宿主和组织特异性(ganem,1996)。已在哺乳动物例如人(hbv)、土拨鼠(whv)和地松鼠(gshv)中以及在鸟类(例如北京鸭(dhbv)和苍鹭(hhbv))中发现了嗜肝dna病毒。
[0211]
在本发明的一个实施方案中,hbv载体保留了病毒基因组复制所必需的所有顺式作用元件。但是,本发明不限制两个新型的顺式作用元件(即α元件和β元件)位于图谱上指
示的位置处。在一个实施方案中,考虑到为了适应更大的插入且不超过包装大小限制,可以改变新型顺式作用元件的位置而不损害载体功能。
[0212]
在该方法的一个实施方案中,将编码具有dna酶活性的酶的序列插入hbv载体的α元件和dr2之间。在该方法的另一个实施方案中,考虑将编码具有dna酶活性的酶的序列插入hbv载体的5'ε和α元件之间。裸dna递送
[0213]
在一些实施方案中,将包含编码具有dna酶活性的酶的序列的表达载体作为裸dna施用给受试者。这种裸dna可以例如在远端点或近端点递送到肝血管中。包膜病毒载体
[0214]
在本发明的各种实施方案中,包膜病毒颗粒可以用于编码具有dna酶活性的酶的核酸的肝递送。
[0215]
在一些实施方案中,本文所述的病毒颗粒衍生自逆转录病毒科的病毒。在一个特定的实施方案中,本文所述的病毒颗粒是逆转录病毒颗粒。在另一个具体的实施方案中,本文所述的病毒颗粒是慢病毒颗粒。与其他基因转移系统相比,慢病毒和逆转录病毒载体具有广泛的优势,包括其转导多种细胞类型、将转移的遗传物质稳定整合到靶宿主细胞基因组中以及以显著水平表达转导基因的能力。源自γ-逆转录病毒的载体,例如鼠白血病病毒(mlv),已经用于临床基因治疗试验中(ross等人,hum.gen ther.7:1781-1790,1996)。
[0216]
在一个特定的实施方案中,与目的核苷酸关联的至少一种病毒元件是逆转录病毒元件。在另一个具体的实施方案中,与目的核苷酸关联的至少一种病毒元件是慢病毒元件。在一个特定的实施方案中,与目的核苷酸关联的至少一种病毒元件是psi(ψ)包装信号。
[0217]
在一个特定的实施方案中,慢病毒颗粒不包含gp120表面包膜蛋白和/或gp41跨膜包膜蛋白。在另一个特定的实施方案中,慢病毒颗粒包含突变体gp120表面包膜蛋白和/或突变体gp41跨膜包膜蛋白。
[0218]
在一些实施方案中,本文所述的病毒颗粒是复制缺陷型的,并且仅包含其所来源的病毒的不完整基因组。例如,在某些实施方案中,慢病毒颗粒和逆转录病毒颗粒不包含gag、env或pol基因(其可能参与病毒颗粒的组装)的遗传信息,这是成功复制慢病毒或逆转录病毒的已知最低要求。在这些情况下,通过包装细胞系反式提供组装载体颗粒所需的病毒蛋白的最小集合。在一个特定的实施方案中,env、tat、vif、vpu和nef基因在源自hiv-1的慢病毒颗粒中缺乏,并且是反式提供的或通过使用一个或多个移码突变而使其失活。
[0219]
在一些实施方案中,掺入慢病毒或逆转录病毒颗粒(并编码具有dna酶活性的酶)的rna分子包含psi包装信号和ltr。为了在肝细胞中实现编码具有dna酶活性的酶的核苷酸序列的表达,通常将这类序列置于遍在启动子的控制下,所述遍在启动子的非限制性例子包括例如病毒启动子,例如cmv启动子、rsv启动子、sv40启动子等,以及细胞启动子,例如磷酸甘油酸激酶(pgk)启动子、ef1a启动子、cmve/cag启动子系统和β-肌动蛋白启动子。
[0220]
在慢病毒颗粒和逆转录病毒颗粒的一些实施方案中,然后将rna分子与包装细胞系反式提供的gag和pol编码蛋白质一起组装到载体颗粒中,其然后感染细胞,逆转录包含在启动子控制下的编码具有dna酶活性的酶的核苷酸序列的rna分子,并且将所述遗传信息整合到靶细胞的基因组中或保持游离(如果整合所需的一种或多种成分被破坏)。如果在转导的rna分子上不存在gag和pol编码蛋白的遗传信息,则载体颗粒是复制缺陷型的,即转导
的细胞不会因此产生新一代的所述载体颗粒,从而确保了临床应用中的安全性。
[0221]
在上述任何方法的一些实施方案中,一个或多个病毒元件编码一个或多个人类免疫缺陷病毒(hiv)组分、一个或多个牛免疫缺陷病毒(biv)组分、一个或多个猫免疫缺陷病毒(fiv)组分、一个或多个猿猴免疫缺陷病毒(siv)组分、一个或多个马传染性贫血病毒(eiav)组分、一个或多个鼠干细胞病毒(mscv)组分、一个或多个鼠白血病病毒(mlv)组分、一个或多个禽白血性增生病毒(avian leukosis virus,alv)组分、一个或多个猫白血病病毒(flv)组分、一个或多个牛白血病病毒(blv)组分、一个或多个人嗜t淋巴细胞病毒(htlv)组分、一个或多个猫肉瘤病毒组分、一个或多个禽网状内皮组织增殖病毒组分、一个或多个山羊关节炎脑炎病毒(caev)组分和/或一个或多个维斯那-梅迪病毒(visna-maedi virus,vmv)组分。
[0222]
结合本文描述的病毒颗粒,本文描述了用于检测和/或分离细胞的方法。在一些实施方案中,这样的方法使用包含选择性标记(例如,新霉素抗性)和/或报道分子(例如,gfp或egfp)的病毒颗粒作为目标核苷酸序列,从而允许使用例如选择化合物暴露或荧光激活细胞分选(facs)来选择靶细胞。
[0223]
在一些实施方案中,本文所述的逆转录病毒载体源自鼠白血病病毒(mlv)。编码mlv的逆转录病毒载体是本领域技术人员广泛可获得的,例如pinco(grignani等人,1998)或pbabe载体系列(morgenstern和land,1990)。
[0224]
在一些实施方案中,本文所述的慢病毒颗粒源自慢病毒,例如人免疫缺陷病毒(hiv)。技术人员可以容易地鉴别和/或制备编码hiv和其他可用病毒的合适载体。
[0225]
在一个具体的实施方案中,转移载体包含:巨细胞病毒(cmv)增强子/启动子序列;来自hiv 5'ltr的r和u5序列;hiv-1flap信号;内部增强子;内部启动子;目的核苷酸序列;土拨鼠肝炎病毒应答元件;trna琥珀抑制子序列;u3元件,其增强子序列缺失;鸡β-珠蛋白绝缘子(chickenβ-globin insulator);以及3'hiv ltr的r和u5序列。
[0226]
本发明还涵盖包膜病毒载体,其包含插入或取代到天然包膜中的异源靶向序列或分子。异源靶向序列或分子可赋予对肝的改变的向性或增加载体的肝递送效率。用于施用编码dna酶的表达载体的方法和方案
[0227]
在本发明的方法中,包含编码具有dna酶活性的酶的核酸的表达载体可以一次或通过一系列治疗;每天一次或几次施用于患者。
[0228]
待施用的表达载体的有效量将因患者而异。因此,有效量最好由施用该组合物的医师确定,并且合适的剂量可由本领域普通技术人员容易地确定。对载体编码的具有dna酶活性的酶的血液(血清、血浆)或组织水平进行分析,并与施用前的初始水平进行比较,可以确定施用量是否过低、在正确范围内还是过高。初次和随后施用的合适方案也是可变的,但典型的是初次施用和在需要时随后进行后续施用。后续施用可以以可变的时间间隔进行,范围从每天至每周至每月至每年至每几年。
[0229]
编码具有dna酶活性的酶的表达载体的剂量取决于要治疗的病状类型,这些副作用的严重程度和进程,患者的临床病史,主治医师的判断力以及对先前治疗例如化学疗法或辐射疗法以及dna酶蛋白疗法的响应。在一些实施方案中,表达载体的有效量是导致肝门静脉中dna酶蛋白水平为0.5至100mg/l或1000至200000kunitz单位(ku)/l、0.5至50mg/l或1000至100000kunitz单位(ku)/l、1.5至50mg/l或3000至100000ku/l、10至50mg/l或20000
至100000ku/l的量。
[0230]
根据本发明的方法,编码dna酶的表达载体(例如aav载体或病毒载体)和/或dna酶的施用可以通过任何合适的途径进行,包括例如静脉内、动脉内和肝内施用。癌症治疗
[0231]
在一方面,提供了一种用于治疗或改善患有癌症的受试者中的癌症的方法,该方法包括向受试者施用治疗有效量的表达载体,该表达载体编码具有dna酶活性的酶(例如,dna酶i,如例如人重组dna酶i或牛胰dna酶i),dna酶i的类似物(如例如dna酶x,dna酶γ或dnas1l2),dna酶ii(例如dna酶iiα,dna酶iiβ),磷酸二酯酶i,乳铁蛋白或乙酰胆碱酯酶)。在一些实施方案中,dna酶包含seq id no:1所示的序列(包含分泌信号序列的野生型前体序列)。在一些实施方案中,dna酶包含seq id no:2所示的序列(前体突变体序列,其包含分泌信号序列,并且还包含减弱肌动蛋白介导的抑制的突变)。在一些实施方案中,dna酶包含seq id no:4所示的序列(没有分泌信号序列的野生型成熟序列)。在一些实施方案中,dna酶包含seq id no:5所示的序列(没有分泌信号序列的成熟突变体序列,并且包含削弱肌动蛋白介导的抑制的突变)。在一些实施方案中,dna酶在肝脏特异性启动子或肝脏特异性增强子元件的控制下表达。
[0232]
本发明表达载体的施用量和施用方式应有效地治疗癌症,例如,通过减小肿瘤大小、降低肿瘤生长速率、降低转移速率、增强化学疗法和/或辐射疗法的治疗效果、延长寿命、降低与癌症或治疗相关的体重减轻率或增加体重增加率中的一种或多种。
[0233]
在一些实施方案中,编码具有dna酶活性的酶的表达载体的施用可以与同一种酶作为蛋白质的施用(例如静脉内,动脉内,肝内,肌肉内,腹膜内,肠内等)联合。该酶可以是,例如dna酶中的任何一种(例如,dna酶i(例如,人重组dna酶i或牛胰dna酶i),dna酶i的类似物(如例如,dna酶x,dna酶γ或dnas1l2),dna酶ii(例如dna酶iiα,dna酶iiβ),磷酸二酯酶i,乳铁蛋白或乙酰胆碱酯酶)。
[0234]
使用本发明的载体的治疗方法可以用于患有广泛种类的癌症的受试者。本发明对于治疗“门静脉癌”特别有用,所述“门静脉癌”包括源自或已转移至向门静脉引流的器官、组织和结构(参见图1)的任何癌、肉瘤、黑素瘤或淋巴瘤。门静脉癌的非限制性实例包括例如腹膜癌扩散,淋巴瘤(例如,b细胞淋巴瘤,t细胞淋巴瘤,非霍奇金淋巴瘤,霍奇金淋巴瘤),胃癌,结肠癌,肠癌,结直肠癌,胰腺癌,肝癌,脾癌,胆管癌,胆囊癌,引流至门静脉的组织中的肉瘤(例如,血管肉瘤(angiosarcoma),内皮细胞肉瘤,血管肉瘤(hemangiosarcoma),平滑肌肉肉瘤,其他肉瘤和此类组织中的上皮癌)以及任何来源的肝转移性疾病。
[0235]
可以通过本发明的方法治疗的其他癌症的非限制性实例包括例如乳腺癌,前列腺癌,多发性骨髓瘤,移行细胞癌,肺癌(例如非小细胞肺癌(nsclc)),肾癌,甲状腺癌,白血病(例如,慢性粒细胞白血病,急性粒细胞白血病,慢性淋巴细胞性白血病,急性淋巴细胞性白血病),头颈癌,食管癌,直肠癌,卵巢癌,子宫内膜癌,阴道癌,宫颈癌,膀胱癌,神经母细胞瘤,肉瘤,骨肉瘤,恶性黑色素瘤,鳞状细胞癌,骨癌(包括原发性骨癌(例如,骨肉瘤、软骨肉瘤、尤因氏肉瘤、纤维肉瘤、恶性纤维组织细胞瘤、釉质瘤、巨细胞瘤和脊索瘤)和继发性(转移性)骨癌),软组织肉瘤,基底细胞癌,血管肉瘤(angiosarcoma),血管肉瘤(hemangiosarcoma),粘液肉瘤,脂肪肉瘤,成骨肉瘤,血管肉瘤,内皮肉瘤,淋巴管血管肉
瘤,淋巴管内皮肉瘤,滑膜瘤,睾丸癌,子宫癌,间皮瘤,平滑肌肉瘤,横纹肌肉瘤,腺癌,汗腺癌,皮脂腺癌,乳头状癌,waldenstroom巨球蛋白血症,乳头状腺癌,囊腺癌,支气管癌,绒膜癌,精原细胞瘤,胚胎性癌,wilms肿瘤,上皮癌,神经胶质瘤,胶质母细胞瘤,星形细胞瘤,髓母细胞瘤,颅咽管瘤,室鼓膜瘤,松果体瘤,血管母细胞瘤,听神经瘤,少突神经胶质瘤,脑膜瘤,视网膜母细胞瘤,髓样癌,胸腺瘤,肉瘤等。
[0236]
对于联合癌症治疗,可以在化学治疗剂(或辐射疗法)之前、一起或之后施用表达载体,例如,编码具有dna酶活性的酶的aav载体或慢病毒载体或腺病毒载体。
[0237]
在一些实施方案中,本发明的方法用于预防患者(例如具有易患癌症的高风险的患者)的癌症。
[0238]
在一些实施方案中,本发明的方法用于在检测癌症的易感性的基于血液的dna筛查测试(例如,液体活检)为阳性结果之后预防癌症。
[0239]
在一些实施方案中,本发明的方法用于在评估肿瘤易感性基因之后预防癌症。肿瘤易感性基因的实例包括但不限于abl1(abl)、abl2(abll、arg)、akap13(ht31、lbc.brx)、araf1、arhgef5(tim)、atf1、axl、bcl2、braf(braf1、rafb1)、brca1、brca2(fancd1)、brip1、cbl(cbl2)、csf1r(csf-1、fms、mcsf)、dapk1(dapk)、dek(d6s231e)、dusp6(mkp3、pyst1)、egf、egfr(erbb、erbb1)、erbb3(her3)、erg、ets1、ets2、ewsr1(ews、es、pne)、fes(fps)、fgf4(hstf1、kfgf)、fgfr1、fgfr10p(fop)、flcn、fos(c-fos)、frap1、fus(tls)、hras、gli1、gli2、gpc3、her2(erbb2、tkr1、neu)、hgf(sf)、irf4(lsirf、mum1)、junb、kit(scfr)、kras2(rask2)、lck、lco、map3k8(tpl2、cot、est)、mcf2(dbl)、mdm2、met(hgfr、rccp2)、mlh型基因、mmd、mos(msv)、mras(rras3)、msh型基因、myb(amv)、myc、mycl1(lmyc)、mycn、ncoa4(ele1、ara70、ptc3)、nf1型基因、nmyc、nras、ntrk1(trk、trka)、nup214(can、d9s46e)、ovc、tp53(p53)、palb2、pax3(hup2)、stat1、pdgfb(sis)、pim基因、pml(myl)、pms(pmsl)基因、ppm1d(wip1)、pten(mmac1)、pvt1、raf1(craf)、rb1(rb)、ret、rras2(tc21)、ros1(ros、mcf3)、smad型基因、smarcb1(snf5、ini1)、smurf1、src(avs)、stat1、stat3、stat5、tdgf1(crgf)、tgfbr2、thra(erba、ear7等)、tfg(trkt3)、tif1(trim24、tif1a)、tnc(tn、hxb)、trk、tusc3、usp6(tre2)、wnt1(int1)、wt1和vhl。
[0240]
可以通过下一代测序、全基因组测序、外显子组测序、基于elisa的方法和pcr扩增中的一种或多种方法来评估易感性基因。其他方法也可以用于评估易感性基因。
[0241]
在另一方面,本发明提供了一种在有此需要的受试者中治疗或改善癌症的方法,所述方法包括向所述受试者施用表达载体,所述表达载体包含编码具有脱氧核糖核酸酶(dna酶)活性的酶的核酸,其中所述表达载体提供了在所述受试者肝脏中dna酶的合成。在一些实施方案中,癌症伴有所述受试者的血液中微生物来源的无细胞dna(cfdna)的总水平或相对含量的增加。在一些实施方案中,该方法包括检测受试者血液中微生物来源的cfdna的水平或微生物来源的cfdna与cfdna的总水平的比率。检测微生物来源的cfdna的方法的非限制性实例包括例如pcr、rt-pcr、下一代测序(ngs)和全基因组测序(wgs)。在一些实施方案中,可以例如使用16s核糖体rna、16s核糖体dna或基因间隔区(intergenic spacer region)的pcr或rt-pcr检测微生物来源的cfdna。在一些实施方案中,确定微生物来源的cfdna的总水平或相对含量包括将受试者血液中的微生物来源的cfdna水平或微生物来源的cfdna与cfdna总水平的比率与对照水平或比率比较(例如,使用年龄匹配的无癌受试者
确定的预定标准或相应水平或比率)。
[0242]
在本发明的任何方法的一个实施方案中,受试者是人。改善癌症化学疗法或辐射疗法的毒性
[0243]
在一个方面,本发明提供了一种用于预防或改善患有癌症并接受或认为接受所化学疗法的受试者中与细胞抑制和/或细胞毒性化学疗法相关的毒性或病状的方法,该方法包括:向受试者施用治疗有效量的编码具有dna酶活性的酶(例如,dna酶i(例如,人重组dna酶i或牛胰dna酶i),dna酶i的类似物(如例如,dna酶x,dna酶γ或dnas1l2),dna酶ii(例如dna酶iiα,dna酶iiβ),磷酸二酯酶i,乳铁蛋白或乙酰胆碱酯酶)的载体。在一些实施方案中,dna酶包含seq id no:1所示的序列(包含分泌信号序列的野生型前体序列)。在一些实施方案中,dna酶包含seq id no:2所示的序列(前体突变体序列,其包含分泌信号序列,并且还包含减弱肌动蛋白介导的抑制的突变)。在一些实施方案中,dna酶包含seq id no:4所示的序列(没有分泌信号序列的野生型成熟序列)。在一些实施方案中,dna酶包含seq id no:5所示的序列(没有分泌信号序列的成熟突变体序列,并且包含削弱肌动蛋白介导的抑制的突变)。在一些实施方案中,dna酶在肝脏特异性启动子和/或肝脏特异性增强子元件的控制下表达。
[0244]
表达载体的施用量和方式可有效改善所述化学疗法的至少一种副作用。
[0245]
与细胞抑制和/或细胞毒性化学疗法相关的病状可包括,例如,(i)导致体重减轻的分解代谢状态,(ii)血液生化中的骨髓毒性和/或分解代谢变化,(iii)心脏毒性(例如,心肌坏死),(iv)胃肠道毒性,(v)抑制免疫力,(vi)中性粒细胞减少和(vii)体重减轻。
[0246]
在一些实施方案中,所述癌症与患者的血液或脑脊髓液(csf)或肠中的cfdna水平升高相关,该水平高于对照水平(例如,健康的年龄匹配个体的血液或csf或肠中的cfdna水平,或几个健康的年龄匹配个体的血液或csf或肠中的cfdna的平均水平)。
[0247]
在一些实施方案中,化学疗法的作用与患者的血液或csf、腹水或肠中的cfdna水平升高相关,该水平高于对照水平(例如,具有类似癌症概况但未接受化学疗法的年龄匹配个体的血液或脑脊髓液或肠中的cfdna水平,或几个患有癌症但未接受化学疗法的年龄匹配个体的血液或csf或肠中的cfdna的平均水平)。
[0248]
在另一方面,本发明提供了一种用于在患有癌症并接受或认为接受所述化学疗法的受试者中提高细胞抑制和/或细胞毒性化学疗法的功效的方法,该方法包括向该受试者施用治疗有效量的编码具有dna酶活性的酶(例如dna酶i(例如人重组dna酶i或牛胰dna酶i),dna酶i的类似物(如例如dna酶x,dna酶γ或dnas1l2),dna酶ii(dna酶iiα,dna酶iiβ),磷酸二酯酶i,乳铁蛋白或乙酰胆碱酯酶)的表达载体(例如anc80或aav8 aav载体或慢病毒载体或腺病毒载体)。表达载体的施用量和方式有效地预防或改善了所述化学疗法的至少一种副作用,并预防或改善了与所述化学疗法有关的毒性。在一些实施方案中,dna酶(例如,dna酶i(例如,人重组dna酶i或牛胰dna酶i),dna酶i的类似物(例如,dna酶x,dna酶γ或dnas1l2),dna酶ii(例如,dna酶iiα,dna酶iiβ),磷酸二酯酶i,乳铁蛋白或乙酰胆碱酯酶)中的任何一种也例如静脉内施用。
[0249]
本发明的表达载体可用于改善多种不同化学治疗剂的毒性和/或提高其功效。此类药剂的非限制性实例包括抗代谢药,例如嘧啶类似物(例如5-氟尿嘧啶[5-fu];氟尿苷,卡培他滨,吉西他滨和阿糖胞苷)和嘌呤类似物,叶酸拮抗剂和相关抑制剂(例如巯基嘌呤,
硫代鸟嘌呤,喷司他丁和2-氯脱氧腺苷(克拉屈滨));抗增殖剂/抗有丝分裂剂,包括天然产物例如长春花生物碱(例如长春碱,长春新碱和长春瑞滨),微管干扰物例如紫杉烷类(例如紫杉醇,多西他赛),长春新碱,长春花碱,诺考达唑,埃博霉素和诺维本,表鬼臼毒素(epidipodophyllotoxins)(例如依托泊苷,替尼泊苷),dna破坏剂(例如放线菌素、安吖啶、蒽环类、博来霉素、白消安、喜树碱、卡铂、苯丁酸氮芥、顺铂、奈达铂、环磷酰胺、cytoxan、更生菌素、柔红霉素、多柔比星、表柔比星、阿柔比星、吡柔比星、六甲蜜胺奥沙利铂(hexamethyhnelamineoxaliplatin)、异环磷酰胺、美法仑(melphalan)、二氯甲基二乙胺(merchlorehtamine)、丝裂霉素、米托蒽醌、亚硝基脲、尼莫斯汀、拉莫司汀、雌莫司汀、普卡霉素、甲基苄肼、紫杉醇、泰索帝、替尼泊苷、三亚乙基硫代磷酰胺和依托泊苷(vp16));抗生素(例如更生菌素(放线菌素d)、柔红霉素、多柔比星(阿霉素)、伊达比星、蒽环类、米托蒽醌、博来霉素、普卡霉素(光神霉素)、满菌素、培洛霉素、丝裂霉素(例如丝裂霉素c)、放线菌素(例如放线菌素d)、净司他丁斯酯;酶(例如l-天冬酰胺酶);新卡他汀类;抗血小板剂;抗增殖/抗有丝分裂的烷基化剂,例如氮芥(例如二氯甲基二乙胺、环磷酰胺及其类似物、咪唑羧酰胺、美法仑、苯丁酸氮芥、氮芥-n-氧化物盐酸化物、异环磷酰胺)、乙烯亚胺和甲基三聚氰胺(六甲蜜胺、噻替派、卡波醌、三乙烯硫代磷酰胺)、烷基磺酸盐(例如白消安、isoprosulfan tosylate)、亚硝基脲(例如卡莫司汀(bcnu)及类似物,链脲霉素),曲安-达卡巴嗪(dtic);环氧化物型化合物(例如二溴甘露醇);抗增殖/抗有丝分裂抗代谢药,例如叶酸类似物(例如甲氨蝶呤);铂配位配合物(例如顺铂、卡铂)、甲基苄肼、羟基脲、米托坦、氨鲁米特;激素、激素类似物(例如雌激素、他莫昔芬、戈舍瑞林、比卡鲁胺、尼鲁米特)和芳香酶抑制剂(例如来曲唑、阿那曲唑);抗分泌剂(例如breveldin);免疫抑制剂(例如环孢霉素、他克莫司(fk-506)、西罗莫司(雷帕霉素)、硫唑嘌呤、霉酚酸酯);抗血管生成化合物(例如tnp-470、染料木黄酮(genistein)、贝伐单抗)和生长因子抑制剂(例如成纤维细胞生长因子(fgf)抑制剂);血管紧张素受体阻滞剂;一氧化氮供体;反义寡核苷酸;抗体(例如曲妥珠单抗);细胞周期抑制剂和分化诱导剂(例如维甲酸);mtor抑制剂、拓扑异构酶抑制剂(例如多柔比星(阿霉素)、安吖啶、喜树碱、柔红霉素、更生菌素、依尼泊苷、表柔比星、依托泊苷、伊达比星、米托蒽醌、托泊替康、伊立替康);生长因子信号转导激酶抑制剂;线粒体功能障碍诱导剂;染色质破坏剂;索布佐生;维甲酸;喷司他丁;氟他胺;卟吩姆钠(porphimer natrium);法倔唑;甲基苄肼;醋葡醛内酯;放射免疫疗法(rit)化合物(例如替伊莫单抗、碘(
131
i)托西莫单抗);和靶向放射性核素治疗(trt)化合物(例如钐-153-edtmp、锶-89-氯化物)。
[0250]
通过根据本发明的方法施用表达载体可以预防或改善的细胞抑制和/或细胞毒性化学疗法的副作用的非限制性实例包括,例如,骨髓毒性,中性粒细胞减少,脊髓病(例如白细胞减少,粒细胞减少,淋巴细胞减少,血小板减少,红细胞减少);血液病(例如血浆纤维蛋白原减少);血液生化的分解代谢变化;胃肠道病症(例如恶心,呕吐,厌食,体重减轻,胃部不适,腹泻,便秘,口腔炎,食管炎);肺功能不全(例如慢性肺炎,肺纤维化,ards,als,肺栓塞);皮肤病(例如角质化,皮膜肥厚,色素沉着,脱毛,皮疹,指甲交替(nail alternation),癌症引起的脱发);神经系统疾病(例如感觉异常,抑郁,深部反射消失,神经麻痹,听觉障碍,言语障碍,定向障碍,神经系统表现,小脑性共济失调,嗜睡,昏迷,眩晕,尿频,排便感频繁);内分泌病症(例如垂体病症,肾上腺病症,高血糖症,低血糖症);生殖器疾病(例如,性
欲低下,少精子症,男性乳腺发育,月经失调);心血管病症(例如,心肌坏死,心肌病,心律不齐,低血压,心动过速,心力衰竭);肝病,胰腺病症,肾病,膀胱问题,高尿酸血症,免疫能力下降和感染。
[0251]
本发明的表达载体还可以用于改善各种类型辐射疗法的毒性并提高其功效,所述各种类型辐射疗法包括例如外部线束辐射治疗(ebrt或xrt),近距离放射疗法/密封源辐射疗法和全身放射性同位素疗法/未密封源放射疗法。可通过根据本发明方法施用表达载体来预防或改善的放射疗法副作用的非限制性实例包括,例如,皮肤刺激或损伤,疲劳,恶心,呕吐,纤维化,肠损伤,记忆丧失,不育和第二癌症。
[0252]
本发明的表达载体可以用于提高癌症免疫疗法的功效,癌症免疫疗法包括例如抗体(裸单克隆抗体,缀合的单克隆抗体,化学标记的抗体,双特异性单克隆抗体),癌症疫苗,免疫检查点抑制剂(靶向pd-1或pd-l1、ctla-4的药物),非特异性癌症免疫疗法和佐剂,car-t疗法。神经变性治疗
[0253]
在一方面,本发明提供了一种治疗或改善神经变性的方法。本文使用的术语“神经变性”是指具有神经元的结构和/或功能进行性丧失(包括神经元死亡)的单独的临床病理状况。神经变性可以是原发性或继发性的。
[0254]
在一些实施方案中,神经变性与患者的血液或脑脊液(csf)或肠中的cfdna(例如,微生物dna或人dna)水平升高相关,该水平高于对照水平(例如,健康的年龄匹配的个体的血液或csf或肠中的cfdna的水平或几个健康的年龄匹配的个体的血液或脑脊液或肠中的cfdna的平均水平)。在一个实施方案中,神经变性与神经变性病症有关。所涵盖的神经变性病症的非限制性实例包括例如阿尔茨海默病(例如迟发性阿尔茨海默病),轻度认知损害(mci),帕金森病,肌萎缩性侧索硬化(als)和亨廷顿病(hd),朊病毒引起的疾病,进行性核上性麻痹(psp),进行性核上性麻痹(steel-richardson-olszewski),皮质基底节变性(cbd),慢性创伤性脑病(cte),多系统萎缩(msa),嗜银颗粒病(agd),皮克病(pid),额颞叶痴呆(ftd),额颞叶痴呆伴帕金森综合征-17(ftdp-17),多发性硬化,cadasil综合征,强直性脊柱炎,dentatorubro-pallido-luysian萎缩,肯尼迪病,弗里德希氏共济失调,小脑共济失调,脊髓小脑共济失调,路易体痴呆,血管性痴呆,家族性丹麦型痴呆,家族性英国型痴呆,脊髓性肌萎缩,橄榄体脑桥小脑萎缩(opca),阿尔茨海默型老年性痴呆,corticodentatonigral变性,hallervorden-spatz病,进行性家族性肌阵挛性癫痫,纹状体黑质变性,扭转性张力失常(例如扭转性痉挛;变形性肌张力障碍),痉挛性斜颈和其他运动障碍,家族性震颤,多发性抽动-秽语综合征(gilles de la tourette syndrome),小脑皮质变性,脊髓小脑变性(例如弗里德里希共济失调和相关病症),shy-drager综合征,原发性侧索硬化,遗传性痉挛截瘫,腓侧肌萎缩(charcot-marie-tooth),肥厚性间质性多神经病(dejerine-sottas),慢性进行性神经病,视网膜色素变性(色素性视网膜炎)和遗传性视神经萎缩(leber病),坏死引起的继发性神经变性(例如肿瘤、水肿、出血、中风、创伤、免疫攻击、缺氧、中毒、代谢缺陷和感染引起的神经元破坏),以及各种tau蛋白病(例如,与年龄有关的原发性tau蛋白病(part)/神经纤维缠结为主的老年性痴呆,nft与ad相似但无斑块,cte,lytico-bodig病,神经节神经胶质瘤和神经节细胞瘤,脑膜血管瘤病,脑炎后帕金森病,亚急性硬化性全脑炎)。在一些实施方案中,神经变性与神经系统功能障碍有关,所述神
经系统功能障碍例如精神分裂症或双相障碍,抑郁症,自闭症,自闭症谱系障碍,慢性疲劳综合征,强迫症,广泛性焦虑症(gad),重度抑郁症(mdd)或社交焦虑症(sad)。在一些实施方案中,神经变性病症是由淀粉样变性引起,继发于淀粉样变性或与淀粉样变性有关。在一些实施方案中,神经变性病症是蛋白质错误折叠相关疾病。在一些实施方案中,神经变性病症由以下引起、继发于以下或与以下有关:糖尿病,类风湿性关节炎,系统性红斑狼疮(sle),痛风,代谢综合征,淀粉样变性(例如,伴有淀粉样变性的遗传性脑出血,原发性系统性淀粉样变性,继发性系统性淀粉样变性,血清淀粉样变性,老年性系统性淀粉样变性,血液透析相关的淀粉样变性,芬兰遗传性系统性淀粉样变性,心房淀粉样变性,溶菌酶系统性淀粉样变性,胰岛素相关的淀粉样变性,纤维蛋白原α链淀粉样变性),哮喘或朊病毒病。
[0255]
在一些实施方案中,神经变性是由于dna(例如,人,微生物,无细胞或细胞内)的存在而引起的错误折叠的蛋白质的形成所致,继发于其或与其相关。在一些实施方案中,神经变性是由于dna(例如人,微生物,无细胞或细胞内)的存在而形成错误折叠的蛋白质而引起的。
[0256]
在一些实施方案中,神经变性是由错误折叠的蛋白质的形成引起的,继发于其或与其有关的,所述错误折叠的蛋白质包括但不限于β-淀粉样蛋白,tau蛋白,α-突触核蛋白,sod1,tdp-43,iapp,adan,abri,融合于肉瘤(fus)蛋白,notch3,胶质纤维酸性蛋白,seipin,转甲状腺素蛋白,丝氨酸蛋白酶抑制蛋白,载脂蛋白,淀粉样蛋白β肽,乳铁蛋白,半乳凝素7角膜锁链蛋白(corneodesmosin)。
[0257]
在一些实施方案中,本发明的方法可用于在评估疾病相关易感性基因的存在或活性后,预防神经变性疾病或与蛋白质错误折叠相关的另一种疾病的发展。与疾病相关的易感性基因的例子包括但不限于adar1,mda5(ifih1),rnaseh亚基,samhd1,trex,tbk1,optineurin,p62(sequestosome 1),颗粒蛋白前体,tdp43,fus,vcp,chmp2b,抑制蛋白(profilin)-1,淀粉样β蛋白,tau,α-突触核蛋白,pink,parkin,lrrk2,dj-1,gba,atpa13a2,exosciii,tsen2,tbc1d23,风险因子等位基因,plcg2,trem2,apoe,tomm40,il-33,葡萄糖脑苷脂酶,ataxin2,c9orf72,sod1和fus。可以通过下一代测序、全基因组测序、外显子组测序、基于elisa的方法和pcr扩增中的一种或多种方法来评估易感性基因。其他方法也可以用于评估易感性基因。
[0258]
在上述方法的一个实施方案中,通过使用本文公开的表达载体来预防或治疗哺乳动物生物流体和组织中错误折叠的蛋白质聚集体形成,所述表达载体包括包含seq id no:30(apoehcr增强子-haat启动子-hdna酶i(超活性)正确前导序列-wpre xinact)或seq id no:31的序列(apoehcr增强子-haat启动子-hdna酶i野生型-wpre xinact5653)的那些。在seq id no:30的序列中,碱基1-320对应于apoe hcr增强子,碱基321-717对应于人α-1-抗胰蛋白酶启动子,碱基718-726对应于kozak序列,碱基727-1575对应于具有天然完整正确前导序列的人dna酶i超活性变体,和碱基1576-2212对应于失活的wpre x蛋白。在seq id no:31的序列中,碱基1-320对应于apoe hcr增强子,碱基321-717对应于人α-1-抗胰蛋白酶启动子,碱基718-726对应于kozak序列,碱基727-1575对应于具有天然完整正确前导序列的人dna酶i野生型,和碱基1576-2212对应于失活的wpre x蛋白。
[0259]
如国际专利申请公开号wo 2016/190780中所述,来自患有神经变性的患者的肠、血液和csf的cfdna引起神经元细胞死亡和凋亡,并且用破坏这种cfdna的重组dna酶蛋白治
疗改善了这些患者的神经系统功能。如以下实施例部分所示,与dna酶蛋白施用相比,使用本发明的载体用于肝脏特异性表达dna酶提供了进一步的治疗改善。
[0260]
可以使用本领域已知的任何方法来评估对神经变性和神经炎症的治疗功效,例如,根据公认的认知能力下降的临床诊断标准,例如mmse、panss、身体机能和/或功能性任务(参见,例如,holmes等人,(1999)the british journal of psychiatry,174(1),45-50;os等人,(2006)acta psychiatricascandinavica,113(2),91-95;o'shea等人,(2002)physical therapy,82(9),888-897;rochester等人,arch.phys.med.rehabil.(2004)85(10),1578-1585)。
[0261]
在本发明的一些实施方案中,神经变性是由增加的肠道通透性以及胃肠道细菌易位和微生物来源的damp(包括微生物cfdna)引起的或加重的。此类cfdna可能触发神经炎症和一系列神经变性疾病。源自消化道微生物群的cfdna经过肝脏中的门-血窦(porto-sinusoidal)循环“首次通过”。nlrp3炎性体被认为是神经炎症发展的关键因素。例如,nlrp3炎性体可在脑例如脑皮层组织中显著上调。nlrp3炎性体信号转导的异常激活已被证明为促进广泛的神经系统疾病的病理学(song,2017)。
[0262]
在一些实施方案中,本发明提供了用于在患有神经变性的受试者中治疗神经变性的方法,该方法包括向受试者施用治疗有效量的编码具有dna酶活性的酶(例如,dna酶i(例如,人重组dna酶i或牛胰dna酶i),dna酶i的类似物(例如dna酶x,dna酶γ或dnas1l2),dna酶ii(例如dna酶iiα,dna酶iiβ),磷酸二酯酶i,乳铁蛋白或乙酰胆碱酯酶)的表达载体。该表达载体(例如,aav载体或慢病毒载体或腺病毒载体或脂质体或裸dna)的施用量和方式应有效治疗一种或多种来自这种神经变性的症状或作用。
[0263]
不希望受到理论的束缚,在使用本发明的载体将编码具有dna酶活性的酶的核酸递送至肝脏后,该酶变为由肝脏细胞产生并被分泌到内皮周隙和disse间隙中,在该处酶有效降解其中存在的浓缩cfdna池。
[0264]
在一些实施方案中,本发明表达载体的使用与dna酶蛋白(例如,dna酶i(例如,人重组dna酶i或牛胰dna酶i),dna酶i的类似物(例如dna酶x,dna酶γ或dnas1l2),dna酶ii(例如dna酶iiα,dna酶iiβ),磷酸二酯酶i,乳铁蛋白,或乙酰胆碱酯酶)的施用(例如静脉内,动脉内,肝内,肌内,腹膜内或肠施用)联合。不受理论的束缚,dna酶蛋白的全身施用结合使用本发明的表达载体在肝脏细胞中如上述的dna酶产生,更快地降解血流和肝脏中cfdna的任何浓缩池中的cfdna。
[0265]
在一些实施方案中,可以将编码具有dna酶活性的酶的表达载体与可用于治疗神经变性疾病或其他涵盖的神经系统功能障碍(例如,双相障碍,偏头痛,精神分裂症,癫痫)的其他治疗组合施用。这种另外的治疗的非限制性例子包括,例如,组蛋白乙酰转移酶激活剂,细胞周期蛋白依赖性蛋白激酶5抑制剂,神经营养蛋白模拟物,脑信号蛋白(semaphorin)-4d阻滞剂,微粒体前列腺素e合酶-1抑制剂,左旋多巴和n-甲基-d-天冬氨酸(nmda)受体抑制剂(例如美金刚(memantine))。迟发型超敏反应的治疗
[0266]
在一方面,本发明提供了一种在有需要的受试者中治疗迟发型超敏反应(例如,移植物抗宿主病(gvhd))的方法,该方法包括向该受试者施用治疗有效量的表达载体,所述表达载体编码具有dna酶活性的酶(例如dna酶i,例如人重组dna酶i或牛胰dna酶i),dna酶i的
类似物(例如dna酶x,dna酶γ或dnas1l2),dna酶ii(例如dna酶iiα,dna酶iiβ),磷酸二酯酶i,乳铁蛋白或乙酰胆碱酯酶)。在一些实施方案中,dna酶包含seq id no:1所示的序列(包含分泌信号序列的野生型前体序列)。在一些实施方案中,dna酶包含seq id no:2所示的序列(前体突变体序列,其包含分泌信号序列,并且还包含减弱肌动蛋白介导的抑制的突变)。在一些实施方案中,dna酶包含seq id no:4所示的序列(没有分泌信号序列的野生型成熟序列)。在一些实施方案中,dna酶包含seq id no:5所示的序列(没有分泌信号序列的成熟突变体序列,并且包含削弱肌动蛋白介导的抑制的突变)。在一些实施方案中,dna酶在肝脏特异性启动子或肝脏特异性增强子元件的控制下表达。
[0267]
不希望受到理论的束缚,中性粒细胞的活化可以释放颗粒蛋白与双链dna(dsdna)一起,形成称为net的细胞外纤维。补体由net激活。补体的激活可导致在迟发型超敏反应中观察到的症状。
[0268]
在一些实施方案中,迟发型超敏反应与患者的血液或csf或肠中的cfdna水平升高相关,该水平高于对照水平(例如,健康的年龄匹配的个体的血液或脑脊液或肠中的cfdna水平,或几个健康的年龄匹配的个体的血液或csf或肠中的cfdna的平均水平)。施用编码具有dna酶活性的酶的表达载体可以抑制net的形成并导致补体的激活减少。
[0269]
不希望受理论的束缚,dna酶的全身施用结合使用表达载体在肝脏细胞中如上述的dna酶产生,更快地降解血流和肝脏中cfdna的任何浓缩池中的cfdna。
[0270]
编码dna酶的表达载体也可以与一种或多种其他可用于治疗迟发型超敏反应的疗法联合施用,所述其他疗法例如环孢霉素,他克莫司(fk506),甲泼尼龙,强的松,atg,西罗莫司,霉酚酸酯,抗-白介素2(il-2)受体,抗cd5特异性免疫毒素,泛t细胞蓖麻毒素a链免疫毒素(xomazyme),将源自无关供体的离体培养的间充质细胞添加到常规类固醇治疗中,以及它们的任何组合。动脉粥样硬化的治疗
[0271]
在一方面,提供了一种用于在有需要的受试者中治疗动脉粥样硬化的方法,该方法包括向该受试者施用治疗有效量的表达载体,该表达载体编码具有dna酶活性的酶(例如,dna酶i,如例如人重组dna酶i或牛胰dna酶i),dna酶i的类似物(如例如dna酶x,dna酶γ或dnas1l2),dna酶ii(例如dna酶iiα,dna酶iiβ),磷酸二酯酶i,乳铁蛋白或乙酰胆碱酯酶)。在一些实施方案中,dna酶包含seq id no:1所示的序列(包含分泌信号序列的野生型前体序列)。在一些实施方案中,dna酶包含seq id no:2所示的序列(前体突变体序列,其包含分泌信号序列,并且还包含减弱肌动蛋白介导的抑制的突变)。在一些实施方案中,dna酶包含seq id no:4所示的序列(没有分泌信号序列的野生型成熟序列)。在一些实施方案中,dna酶包含seq id no:5所示的序列(没有分泌信号序列的成熟突变体序列,并且包含削弱肌动蛋白介导的抑制的突变)。在一些实施方案中,dna酶在肝脏特异性启动子或肝脏特异性增强子元件的控制下表达。
[0272]
在一些实施方案中,动脉粥样硬化与患者的血液或csf或肠中的cfdna水平升高相关,该水平高于对照水平(例如,健康的年龄匹配个体的血液或脑脊液或肠中的cfdna水平,或几个健康的年龄匹配个体的血液或脑脊液或肠中cfdna的平均水平)。
[0273]
编码dna酶的表达载体,例如anc80或另一种aav或慢病毒载体可以任选地与另外的dna酶一起施用。在一些实施方案中,dna酶(例如,dna酶i(例如,人重组dna酶i或牛胰dna
酶i),dna酶i的类似物(如例如dna酶x,dna酶γ或dnas1l2),dna酶ii(例如,dna酶iiα,dna酶iiβ),磷酸二酯酶i,乳铁蛋白或乙酰胆碱酯酶)中的任何一种也例如静脉内施用。不希望受到理论的束缚,dna酶的全身施用结合肝脏细胞中如上述的dna酶产生,更快地降解血流和肝脏中cfdna的任何浓缩池中的cfdna。
[0274]
编码dna酶的表达载体也可以与可用于治疗动脉粥样硬化的其他治疗联合施用。药物组合物、制剂和剂型
[0275]
本文公开的aav载体可以以任何合适的形式施用,例如以液体溶液或悬浮液的形式,以适合于在注射之前在液体中形成溶液或悬浮液的固体形式。可以将载体与任何合适且药学上可接受的赋形剂、载体、佐剂、稀释剂等一起配制。例如,对于注射,合适的载体或稀释剂可以是等渗溶液、缓冲剂、无菌和无热原的水,或例如,无菌且无热原的磷酸盐缓冲盐溶液。表达载体可以配制在药物组合物和剂型中。这样的药物组合物和剂型可以使用一种或多种生理上可接受的载体和/或赋形剂以任何常规方式配制。可以将载体颗粒配制成用于通过例如注射给药。药学上可接受的载体部分地取决于所施用的特定组合物以及用于施用该组合物的特定方法。因此,有很多种药物组合物的合适制剂可用,如下所述(参见,例如,remington's pharmaceutical sciences,第17版,1989)。
[0276]
制剂还包括在液体或乳化液体中的悬浮液。通常将活性成分与药学上可接受的并且与活性成分相容的赋形剂混合。合适的赋形剂包括例如水,盐水,右旋糖,甘油,乙醇等,以及它们的组合。另外,该组合物可以包含少量辅助物质,例如润湿剂或乳化剂,ph缓冲剂,稳定剂或增强药物组合物有效性的其他试剂。
[0277]
用于本发明方法的制剂可以方便地以单位剂型存在,并且可以通过本领域已知的方法制备。可与载体材料组合以产生单个剂型的活性成分的量将根据所治疗的宿主和特定的施用模式而变化。可与载体材料组合以产生单个剂型的活性成分的量通常将是产生治疗效果的化合物的量。
[0278]
适用于肠胃外施用的药物组合物可进一步包含一种或多种其他活性成分(例如dna酶蛋白或另一种活性化合物),组合有一种或多种药学上可接受的无菌等渗水性或非水性溶液、分散剂、悬浮剂或乳剂或无菌粉剂(可以刚好在使用前将其重构为无菌的可注射溶液或分散液),其可以包含抗氧化剂、缓冲剂、抑菌剂、可使制剂与预期接受者的血液等渗的溶质或悬浮剂或增稠剂。可以在本公开的药物组合物中使用的合适的水性和非水性载体的实例包括水,乙醇,多元醇(例如甘油,丙二醇,聚乙二醇等)及其合适的混合物,植物油例如橄榄油和可注射的有机酯例如油酸乙酯。例如,通过使用包衣材料例如卵磷脂,在分散液的情况下通过保持所需的粒径,以及通过使用表面活性剂,可以保持适当的流动性。
[0279]
这些组合物还可包含防腐剂、湿润剂、乳化剂和分散剂。可以通过包含各种抗细菌和抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚山梨酸等来确保防止微生物的作用。还可能需要在组合物中包括等渗剂,例如糖、氯化钠等。实施例
[0280]
还通过以下实施例描述和证明本发明。然而,在说明书中任何地方使用这些和其他实例仅是说明性的,且不以任何方式限制本发明或任何示例性术语的范围和含义。同样,本发明不限于这里描述的任何特定的优选实施方案。实际上,在阅读本说明书之后,本发明的许多修改和变型对于本领域技术人员而言可能是明显的,并且在不脱离本发明的精神或
范围的情况下,可以做出这种变型。因此,本发明仅由所附权利要求的条款以及那些权利要求所赋予的等同物的全部范围来限制。实施例1:dna酶消化肿瘤患者中循环的无细胞dna(cfdna)的有限能力
[0281]
在kostushko医院(俄罗斯圣彼得堡)的胸外科招募的九名患有晚期转移性疾病的患者接受了为期3周的使用牛胰dna酶i蛋白的静脉内治疗,该蛋白比活度为2500ku/mg(俄罗斯samson)。治疗按照以下时间表进行:在第i周中,每天通过六次30分钟的静脉内输注施用300mg;在第ii周,每天通过六次30分钟的静脉内输注施用450mg;且在第iii周,每天通过六次30分钟的静脉内输注施用600mg。
[0282]
在第一次输注dna酶i蛋白之前,第ii周结束时和最后一次输注dna酶i蛋白之后立即地,对每位患者进行循环cfdna的电泳概况分析。使用经典的苯酚-氯仿方法从血液血浆中分离dna。在1%琼脂糖凝胶上进行血液cfdna电泳。用溴化乙锭显现dna。在最后一次输注dna酶i蛋白后一周,使用基于recist标准的螺旋ct扫描评估治疗效果(参见例如recist 1.1,于2009年1月发布,http://www.irrecist.com)。在图2a-2ij中示出了患者总结和个体血液电泳数据。总体而言,根据recist结果,实体瘤的直径几乎没有减少(图2a-2h)。在大多数患者中,第iii周后循环中仍然有cfdna。
[0283]
尽管连续增加地高剂量静脉内输注dna酶i酶,但只有一名患有复发性直肠癌的患者(pviii)通过凝胶电泳显示从血浆中完全清除了循环cfdna。根据recist标准,患者pviii病情稳定,无进展迹象。如通过凝胶电泳测量的,根据recist标准符合稳定疾病患者标准的其他三名患者(pix,pvii,pi)的来自血浆的循环cfdna没有增加或几乎没有增加。
[0284]
如通过凝胶电泳测定的,根据recist标准符合进展性疾病患者标准的五名患者(pii,piii,piv,pv和pvi)的来自血浆的循环cfdna实质性增加。而且,在9名患者中的8名(88%)中,连续3周静脉内输注增加的高剂量的dna酶未能提供从血浆中治疗有效地清除循环cfdna。实施例2:无细胞dna在荷瘤动物肝脏中的积累
[0285]
将大约12x 106个ls174t人结肠癌细胞皮下接种到十二只8周龄的雌性nu/nu小鼠(ibch ras品种)的左侧腹中。小鼠按照以下时间表接受一次静脉内注射99mtc标记的抗dna抗体:三只小鼠在d5接受注射,三只小鼠在d10接受注射,三只小鼠在d15接受注射,且三只小鼠在d25接受注射。注射后两个小时处死小鼠,收集组织和血液用于γ计数。
[0286]
将ac-30-10dna结合抗体(genetex)如下所述用99mtc标记:将抗体在0.3m柠檬酸盐缓冲液(ph4.2)中的0.024mg/ml溶液与0.25ml盐水中1mci的99mtc-高锝酸盐混合,并与在0.1n hcl中的sncl2二水合物的10-mg/ml溶液混合。在室温下孵育5分钟后,加入1.9ml盐水和825μl igm溶液。单次注射剂量的制备如下:将16.6μci(36852000cpm,约合0.047μg的99mtc-igm)的99mtc-igm溶液与3.3μg未标记的igm混合,并用盐水稀释至100μl的体积。使用自动γ计数器在每个组织中对γ信号定量。以cmp单位进行测量。基于γ计数数据、组织重量、所施用igm制备物的比放射性和99mtc半衰期,对99mtc igm的浓度进行定量。
[0287]
放射性的组织分布示于下表1中:表1:荷瘤小鼠组织中抗dna抗体的积累。(%注射剂量/g组织)。 d5d10d15d25脑0.020
±
0.00.056
±
0.040.078
±
0.050.507
±
0.36
脾0.06
±
0.020.154
±
0.070.451
±
0.180.501
±
0.18肾0.21
±
0.020.412
±
0.262.44
±
3.050.593
±
0.15肝1.07
±
0.232.382
±
0.973.542
±
1.626.41
±
3.76肿瘤0.08
±
0.020.257
±
0.221.443
±
0.793.374
±
4.8心0.13
±
0.160.323
±
0.270.407
±
0.310.334
±
0.06血液0.22
±
0.020.384
±
0.060.719
±
0.641.123
±
0.3
[0288]
图3显示了在第15天注射99mtc标记的抗dna抗体后一小时获得的荷瘤小鼠的γ-免疫闪烁图像。图像右中部分的肝脏区域(b)产生的放射性信号大于图像左下方部分的肿瘤区域(a)的放射性信号。因此,肝脏显示出循环cfdna的积累最多。实施例3:肿瘤来源cfdna从肝脏到血液的源头供应
[0289]
对六只6周龄雌性裸鼠(ibch ras品种)进行了皮下注射,将2x106个mcf-7细胞皮下注射到左侧腹。在注射后第20天,通过手术去除肿瘤。在第25天,将所有小鼠麻醉,并从每只小鼠的门静脉、肝动脉和肝静脉中采集500μl血液样品。通过2000g离心10分钟从血细胞中分离血浆;将顶部的透明血浆相转移至新管中,并以14000g离心。将上清液转移至新管中以进行dna提取。根据制造商的说明使用qiaamp dna blood mini kit从血液血浆样品中提取cfdna。使用人β珠蛋白引物caacttcatccacgttcacc(seq id no:10)通过rt-pcr(icycler iq5бbio-rad)在每个样品中定量无细胞dna中的人β珠蛋白序列。下表2列出了从不同血管采样的血液血浆中人β珠蛋白序列的ct值:表2:小鼠编号门静脉肝动脉肝静脉129.49+0.16131.86+0.81723.59+0.109229.2+0.37928.62+0.27823.85+0.218329.94+0.87430.09+0.34724.22+0.0964
→0→0→
0530.26+0.2129.42+0.34127.89+0.112630.44+0.15130.26+0.17625.78+0.155
[0290]
即使通过外科手术切除了肿瘤,也只有一只小鼠的血浆中没有人源的循环cfdna。皮下生长时mcf-7肿瘤不产生转移。通过肉眼和显微镜检查进一步证实了肝或肺中不存在转移性结节。在小鼠的血液中可检测到源自人肿瘤异种移植物的循环cfdna,在肝静脉中可检测到的循环cfdna量最高。这些结果证实了肝窦是循环cfdna的储库源。实施例4:dna酶i的转基因递送和重组dna酶i蛋白的静脉内递送在胰腺癌模型中的效果
[0291]
用于dna酶i(4658_paav-afp-alb-hudnasei_mut)的肝脏特异性转基因表达的aav载体由sirion biotech(德国martinsried)定制生产。载体图谱如图5a所示。aav载体基于有效靶向肝脏的aav血清型8。该载体包含seq id no:2所示的序列,该序列编码突变的人dna酶i酶,其包含几种使该酶对肌动蛋白抑制的敏感性降低并且具有更大的催化活性的突变。dna酶i编码序列还包含分泌信号序列。dna酶i编码序列在5'端与mafp/alb增强子/启动子系统(肝脏特异性小鼠甲胎蛋白增强子和肝脏特异性小鼠最小白蛋白启动子)可操作地连接,并在3'端与hgh polya信号可操作地连接。表达盒进一步侧接aa8 l-itr和r-itr。
[0292]
将hudnasei_mut表达盒克隆到aav转移载体中,并通过转移载体与aav8包装质粒的共转染而在293t细胞中产生。纯化病毒颗粒,浓缩至1x10
13 gc/ml,并在pbs中冷冻。
[0293]
还产生了与4658_paav-afp-alb-hudnasei_mut相同但具有对肝脏非特异性的cmve/cag启动子/增强子系统而不是肝脏特异性mafp/alb增强子/启动子系统的对照载体。
[0294]
人重组dna酶i蛋白(rhdnasei)由catalent(madison,usa)生产,并以10mg/ml的原液在1mm cacl2和150mm nacl中冷冻保存。
[0295]
实验中使用56只6-8周龄和18-22g体重的雌性balb/c裸鼠(ibch ran)。将小鼠饲养在温度和湿度受控的单独通风笼中,每笼中有四只动物。每只小鼠在右侧腹皮下接种在补充有bd matrigel(1:1)的0.2ml pbs中的mia paca-2胰腺肿瘤细胞(1x 107个)。当肿瘤平均尺寸达到约170mm 3
时,在接种肿瘤后第17天开始治疗。每组由八只荷瘤小鼠组成。按照下表3所示的预定方案,将测试的载体和组合物施用于小鼠:表3:实验设计
[0296]
使用卡尺每周两次在二维上测量肿瘤尺寸,并使用下式以mm3表示体积:v=0.5a x b2,其中a和b分别是肿瘤的长径和短径。在常规监测时,每天检查动物的肿瘤生长和治疗对正常行为如活动性、食物和水消耗(仅通过肉眼检查)的任何影响,体重减轻或增加(每周测量两次),眼部/毛发缠结(hair matting)以及其他任何异常影响。在第35天,研究终止,小鼠通过co2人道处死,并从中央静脉和肝静脉采血样。还对肝组织取样,并将其浸入福尔马林中固定。
[0297]
使用h.goldstein,“a rapid direct fluorescent assay for cell-free dna quantification in biological fluids”,annals of clinical biochemistry,vol 46,issue 6,pp.488-494中描述的方法测量血浆中的循环cfdna。gold核酸凝胶染料(invitrogen)首先在二甲基亚砜中以1:1000稀释,然后在磷酸盐缓冲盐水中以1:8稀释。将10μl血浆样品加到96孔板上。向每个孔中添加40μl稀释的gold(最终稀释度为1:10,000),并使用96孔荧光计在535nm的发射波长和485nm的激发波长测量荧光。
[0298]
使用org590(orgentec)根据制造商的方案测量血清dna酶i活性。使用微板光度计(multiscan fc)在450nm处进行检测,校正波长为620nm。使用ac-30-10小鼠igg dna结合抗体(sigma)作为一抗和novolink polymer detection systems novocastra(leica biosystems),在肝脏石蜡切片中通过免疫组织化学(ihc)对肝脏组织中的cfdna进行定量。
[0299]
下表4显示了用测试的载体和组合物(按照表3)剂量给药的携带mia paca-2异种移植物的雌性balb/c裸鼠随时间推移的平均肿瘤体积:表4:随时间推移的平均肿瘤体积天数组1组2组3组4组5组6组717172
±
14171
±
15171
±
15172
±
15170
±
14170
±
14170
±
1321214
±
18147
±
17166
±
14207
±
17164
±
16202
±
16164
±
1424242
±
18117
±
16161
±
17235
±
18193
±
25220
±
14197
±
1728275
±
1886
±
19152
±
20274
±
21202
±
37239
±
28246
±
1031299
±
1958
±
11119
±
17310
±
31189
±
41212
±
23220
±
835335
±
3244
±
12107
±
19368
±
40167
±
36197
±
27264
±
14
[0300]
下表5中显示了每组携带mia paca-2异种移植物并用测试的载体和组合物剂量给药(按表3)的雌性balb/c裸鼠中在第35天体重减轻的动物的数量:表5:第35天体重减轻的动物数量 组1组2组3组4组5组6组7bwl>10%3/80/84/88/86/83/88/8bwl>20%0/80/80/83/81/80/84/8
[0301]
下表6总结了中央静脉和肝静脉中血液中循环cfdna和dna酶i酶活性的定量结果:表6:
[0302]
图4显示了来自不同组的肝脏组织的ihc显微照片。
[0303]
上表4-6的数据和图4清楚地表明,dna酶i酶的肝脏特异性转基因表达与化学疗法联合不仅在抗肿瘤功效方面产生了显著优越的结果,而且还能够完全改善化学疗法诱导的体重减轻。与dna酶i的肝脏特异性转基因表达相比,以三个递增剂量每天两次给药的重组dna酶i酶以及不靶向肝脏的dna酶i的转基因表达表现出显著更低的抗肿瘤功效和化学疗法诱导的毒性的改善。用肝脏特异性dna酶i mafp/alb aav8载体处理的小鼠具有最低的循环cfdna量,肝脏中最低的残留的cfdna量,和肝静脉中最高的dna酶i酶活性。实施例5:dna酶i的转基因递送对胰腺癌的原位和非原位生长的效果
[0304]
实验中使用十二只8周龄的scid小鼠(ibch ras),分为4个实验组。六只小鼠在右股骨处皮下接受100μl matrigel中的表达荧光素酶的4x106个mia paca-2胰腺癌细胞(非
原位模型)。六只小鼠在胰体尾部植入100μl matrigel中的表达荧光素酶的4x106个mia paca-2胰腺癌细胞(原位模型)。次日,3只具有原位mia paca-2植入物的小鼠接受剂量为1,00x10
11 gc/kg的mafp/alb aav8载体4658_paav-afp-alb-hudnasei_mut的静脉内注射,3只具有原位mia paca-2植入物的小鼠接受安慰剂(pbs)注射。三只具有非原位mia paca-2植入物的小鼠接受剂量为1.00x10
11 gc/kg的dnasei mafp/alb aav8载体的静脉内注射,而三只具有非原位mia paca-2植入物的小鼠接受安慰剂(pbs)注射。四周后实验结束时,使用ami-1000成像系统通过生物发光成像评估了肿瘤。生物发光数据总结在下表7中,典型图像如图6所示。表7:
[0305]
因此,dna酶i酶向肝脏的转基因递送完全阻断了由门静脉引流的区域(即胰)中以原位方式的肿瘤生长的进展。注射dna酶i mafp/alb aav8也显著地抑制非原位方式的相同胰腺癌异种移植物的进展,但没有达到完全消除肿瘤生长的程度。实施例6:dna酶i转基因的肝脏和肺递送对乳腺癌模型中乳腺癌生长的效果
[0306]
adv-207186载体购自vector biolabs(malvern,pa)。载体图谱如图5c所示。该载体基于人腺病毒5型(de1/e3)(具有天然肝脏向性),并包含野生型人dna酶i编码序列,其包含分泌信号序列(seq id no:1)。dna酶i编码序列在5'端与肝脏非特异性cmv启动子可操作地连接,在3'端与hgh polya信号可操作地连接。表达盒进一步侧接att-l1和att-l2。
[0307]
使用mmtv-pymt雌性小鼠ibch ras品种进行研究。当每只小鼠形成至少3个至少3mm
×
5mm的可触知肿瘤时(通常发生在8周龄),六只小鼠静脉内注射0.2x10
11 pfu/小鼠的adv-207186,且六只小鼠在麻醉下鼻内注射0.2x10
11 pfu/小鼠的adv-207186。在14周龄处死小鼠。六只小鼠用作对照。使用卡尺以二维方式测量肿瘤尺寸,并使用下式以mm3表示体积:v=0.5a x b2,其中a和b分别是肿瘤的长径和短径。使用下式计算每组的tgi:tgi(%)=[1-(ti-t0)/(vi-v0)]
×
100;ti是在给定日治疗组的平均肿瘤体积,t0是治疗开始当天治疗组的平均肿瘤体积,vi是具有媒介物对照组在与ti同一天的平均肿瘤体积,v0是治疗开始当天的媒介物组的平均肿瘤体积。在研究结束时从中央静脉对血液取样。如实施例4中所述测量循环cfdna和血清dna酶i活性。数据报告在下表8中。表8:
[0308]
数据显示,与将dna酶i转基因递送至支气管肺泡系统相比,尽管在血液中存在近似相同水平的dna酶的酶活性,用携带dna酶i转基因的腺病毒载体靶向肝脏提供了优越的乳腺肿瘤生长抑制和循环cfdna从血液的清除。实施例7:肌动蛋白抗性超活性dna酶i在肝脏和肌肉中的转基因表达对微生物cfdna水平和神经炎症水平的影响。
[0309]
胃肠道微生物群的肠道通透性和易位增加以及微生物起源的损伤相关分子模式(damp)(包括微生物cfdna)引发神经炎症和多种神经变性疾病。源自胃肠道微生物群的cfdna通过门-血窦循环进行“首次通过”。进一步研究了肌肉和肝脏递送的超活性肌动蛋白抗性的dna酶i转基因的效果,野生型dna酶i蛋白注射对脑和肝脏中微生物cfdna水平的影响,以及噬菌体诱导的肠漏综合征之后csf和脑中的神经炎症水平。
[0310]
健康成年雄性wistar大鼠(n=24;12周龄,240
–
280g)维持在p3房间中的各个笼中,在12小时的明暗循环下,温度为22至25℃,大气湿度为60
±
5%。根据《实验动物的护理和使用指南》,所有动物均可自由获得食物和水。
[0311]
合成编码超活性肌动蛋白抗性dna酶i突变体(seq id no:5)的dna分子(genecust),其中dna酶i分泌信号序列替换为il2分泌信号序列,克隆到plv2慢病毒载体(clontech)中处在ef1a启动子(不是肝脏特异性的)的控制下。所得的构建体是plv2-il2ss-dna酶i mut,如图9所示。将293t慢病毒包装细胞系(clontech)培养在dmem(gibco)中。使用lipofectamine 2000(life technology),用基于plv2的慢病毒载体plv2-il2ss-dna酶i mut转染hek 293t细胞。转染后48小时收集5ml上清液。通过0.45μm聚醚砜膜滤器(millipore)过滤收集慢病毒,并在30m内以20,000g离心。将所得沉淀重悬于1ml pbs中。
[0312]
使用针对肠杆菌科(enterobacteriaceae)、葡萄球菌科(staphylococcaceae)和链球菌科(streptococcaceae)的噬菌体混合物在24只大鼠中诱导肠泄漏,从而诱发微生物群疾病。该混合物包括来自microgen(moscow,russia)的沙门氏菌(salmonella)噬菌体混合物,含有针对副伤寒沙门氏菌(s.paratyphi)、鼠伤寒沙门氏菌(s.typhimurium)、海德堡沙门氏菌(s.heidelberg)、纽波特沙门氏菌(s.newport)、猪霍乱沙门氏菌(s.choleraesuis)、奥拉宁堡沙门氏菌(s.oranienburg)、s.infans、都柏林沙门氏菌(s.dublin)、肠炎沙门氏菌(s.enteritidis)、鸭沙门氏菌(s.anatum)和s.newlands的噬菌体,以及来自microgen的pyobacteriophage噬菌体混合物,含有针对7种细菌菌种即金黄色葡萄球菌(staphylococcus aureus)、酿脓链球菌(streptococcus pyogenes)、奇异变形杆菌(proteus mirabilis)、普通变形杆菌(proteus vulgaris)、绿脓假单胞菌(pseudomonas aeruginosa)、肺炎克雷伯氏菌(klebsiella pneumoniae)和大肠杆菌(escherichia coli)
的噬菌体。根据制造商的说明将噬菌体(每种噬菌体混合物1.5ml,1x106噬菌斑形成单位/ml)添加到饮用水中,并口服施用10天。在噬菌体处理的第7天,将大鼠随机分为如下4组:六只大鼠接受体积为200μl的1.0
×
10
12
lvp肝内注射;六只大鼠接受体积为200μl的1.0
×
10
12
lvp注射到大腿肌肉中;六只大鼠在第7天至第12天接受每日两次的50mg/kg的重组dna酶i蛋白的静脉内注射。其余六只大鼠用作未经治疗的肠渗漏对照。另外六只健康大鼠用作健康对照。在第12天,处死所有大鼠并收集血液样品以测量血液中的dna酶活性。收集大脑尸检样品以进行nlrp3炎性体表达分析和16s通用细菌rna基因定量。
[0313]
nlrp3炎性体被认为是神经炎症发展的关键因素。nlrp3炎性体信号传导的异常激活已被证明促进广泛的神经系统疾病的病理学(song,2017)。通过收集50mg皮层组织样品评估nlrp3表达。使用sv总rna分离系统(promega)分离rna。使用platinum taq dna聚合酶(invitrogen)通过superscript iii一步式rt-pcr系统,使用5
′-
gttctgagctccaaccattct-3
′
(seq id no:11)作为正向nlrp3引物和5'-cactgtgggtccttcatcttt-3
′
(seq id no:12)作为反向nlrp3引物进行逆转录pcr。使用16s通用细菌rna基因引物(正向:5'-tcgtcggcagcgtcagatgtgtataaga gacagcctacgggnggcwgcag-3'(seq id no:13);反向:5'-gtctcgtgggctcggagatgtgtataagagacaggactac hvgggtatctaatcc-3'(seq id no:14))来定量肝脏和脑中微生物来源的dna的存在。使用比较性ct方法进行基因表达分析。
[0314]
使用org590(orgentec)根据制造商的方案测量血清dna酶i活性。使用微板光度计(multiscan fc)在450nm处进行检测,校正波长为620nm。结果总结在下表9中:表9:
[0315]
数据表明,渗漏性肠的诱导导致内源性血液dna酶活性的抑制,肝脏和脑皮层中微生物cfdna的存在显著增加以及脑皮层组织中nlrp3炎性体成分的显著上调。与向肌肉组织递送相同转基因或静脉内注射dna酶i蛋白相比,超活性肌动蛋白抗性dna酶i慢病毒转基因向肝脏的递送几乎完全阻止了肝脏和脑中微生物cfdna的增加和脑炎性体活化,尽管在中央血流中保持了相当的dna酶活性。实施例8:超活性肌动蛋白抗性dna酶i的转基因递送和重组dna酶i蛋白的静脉内递送对gvhd的效果
[0316]
mhc i类和ii类相异模型c57bl/6(h-2b)与balb/c(h-2d)用于建立gvhd。所有接受
者均为年龄匹配的雌性,在骨髓移植(bmt)时为2-6月龄。在注射用盐水中制备骨髓细胞和脾细胞的单细胞悬液。为了产生bmt嵌合体,接受者balb/c小鼠接受分为2剂的1200rad tbi(137cs来源)。然后,小鼠接受来自c57bl/6小鼠的细胞:5x106个骨髓细胞和10x106个脾细胞。
[0317]
实验设计以比较以下两种治疗:每天施用野生型小鼠dna酶i蛋白(50mg/kg)和单次静脉内注射的肝脏特异性野生型小鼠dna酶i mafp/alb aav8载体。在与bmt同一天开始,每天两次通过ip途径用dna酶i处理接受者,或以1.00x10
11 gc/kg剂量单次静脉内递送dna酶i mafp/alb aav8来处理接受者。对于组织病理学,在移植后第16天处死小鼠。将组织置于10%福尔马林中,包埋在石蜡中,切片,并用苏木精和曙红染色。为了量化供体来源的t细胞脾(sp),在移植后第16天从接受者小鼠中收获外周淋巴结(pln)、肠系膜淋巴结(mln)和派尔淋巴集结(pp)。从这些组织中回收的细胞用cd3、cd4、cd8和h-2db抗体染色。通过facs确定供体来源的t细胞(h-2db+)和cd4+/h-2db+和cd8+/h-2db+亚群的数量。
[0318]
存活数据列于下表10:表10:
[0319]
dna酶i处理的和dna酶i mafp/alb aav8处理的接受者小鼠中的肝脏组织病理学数据如图7所示。左图显示了在仅使用dna酶i蛋白(而不是dna酶i mafp/alb aav8)处理的动物中门汇管的淋巴浆细胞浸润、胆管上皮细胞节段性损失、肝细胞局灶性坏死区域以及血管界面处有大量亲核物质。右图显示了用dna酶i mafp/alb aav8处理的动物的肝脏的炎性细胞密度低得多,没有坏死,且血管界面处的亲核物质少得多。
[0320]
图8显示了经dna酶i蛋白处理和经dna酶i mafp/alb aav8处理的接受者小鼠中供体来源t细胞的数据。特别是,图8显示了与dna酶i蛋白处理的接受者相比,在经dna酶i mafp/alb aav8处理的接受者中外周淋巴结(pln)、肠系膜淋巴结(mln)和派尔淋巴集结(pp)中供体来源t细胞、供体来源cd4+和cd8+t细胞的总数的显著减少。
[0321]
结果表明,与dna酶i蛋白处理相比,dna酶i酶的肝脏特异性转基因表达使动物存活提高了一倍。这种存活受益伴随着用dna酶i mafp/alb aav8处理的接受者中pln、mln和pp中的供体来源的t细胞、供体来源的cd4+和cd8+t细胞的总数相比于用dna酶i蛋白处理的接受者的显著减少。在肝脏中,dna酶i mafp/alb aav8处理导致门汇管的淋巴浆细胞浸润显著减少,防止细胞损失以及导致血管界面的亲核物质的清除。实施例9:克隆aav载体:apoehcr增强子-haat启动子-hdnasei(超活性)正确前导序列-wpre xinact(vr-18013ad)
[0322]
aav无启动子表达载体paav-mcs-promoterless获自cell bio labs(目录号vpk-411;图11)。通过执行smai限制酶消化,然后进行凝胶纯化以评估以下预期条带的存在来检
08854,usa)生产。使用anc80l65 aav顺式、aav反式和腺病毒辅助质粒在接近汇合的单层hek293细胞中的大规模聚乙烯亚胺转染,生产相应的hdna酶i(超活性)vr-18013ad aav载体和hdna酶i(野生型)vr-18014ad aav载体,并进一步使用传统方案按规模在碘克沙醇梯度上进一步纯化。纯化的apoehcr增强子-haat启动子-hdnasei(超活性)正确前导序列-wpre xinact(vr-18013ad;vr-18013ad的转基因盒包含seq id no:30的序列;参见图10b的载体图谱)和apoehcr增强子-haat启动子-hdnasei(野生型)-wpre xinact(vr-18014ad(图谱显示在图10c。载体的转基因盒具有序列(seq id no:31))载体在补充有35mm nacl和0.001%pf68的pbs中重新配制,且包含1.0x10
13 gc/ml(vr-18014ad)和5.0x10
12 gc/ml(vr-18013ad)。
[0327]
通过sds-page分析纯化的vr-18013ad aav载体,结果如图12所示。观察到60、72和90kda的三个条带,比例约为1:1:10,对应于vp1
–
3蛋白。
[0328]
为了进行转导,将vr-18014ad和vr-18013ad制备为重组vr-18014ad和vr-18013ad颗粒的无菌、透明、无色、高度纯化的溶液。实施例12:肝脏特异性转导aav载体:apoehcr增强子-haat启动子-hdnasei(超活性)正确前导序列-wpre xinact(vr-18013ad)和apoehcr增强子-haat启动子-hdnasei(野生型)-wpre xinact(vr-18014ad)
[0329]
研究了以下两个基因治疗载体的转导效率:apoehcr增强子-haat启动子-hdnasei(超活性)正确前导序列-wprexinact和apoehcr增强子-haat启动子-hdnasei(野生型)-wpre xinact。使用hep g2人肝细胞瘤衍生细胞系(atcc hb-8065)和内皮源性sk-hep1人肝腺癌(atcc htb-52)在体外研究了这些基因治疗载体候选物。
[0330]
将细胞以5
×
105个细胞/ml接种至48孔板并在dmem adv、10%fbs培养基中生长。接种后24小时,使用moi为104gc/细胞、105gc/细胞和106gc/细胞的vr-18013ad或vr-18014ad或空白对照,补充孔。每个孔一式三份。
[0331]
使用荧光探针(terekhov等人,pnas 2017;www.pnas.org/content/pnas/114/10/2550.full.pdf)分析dna酶活性,该探针代表用荧光染料和淬灭剂标记的发夹寡核苷酸。使用variscan flash读板器(thermo scientific)监测荧光的增加。通过反应缓冲液20mm tris-hcl ph 7.5、1mm mncl2和0.3mm cacl2将培养基稀释20倍至200倍。使用0.25μm浓度的荧光探针。反应条件下荧光探针的完全水解在测定条件下产生28rfu荧光。背景探针荧光低于0.3rfu。使用纯dna酶i pulmozyme“dornase alfa”(roche)的连续稀释液获得用于dna酶浓度估算的校准曲线。使用线性回归估计样品中dna酶的浓度。数据示于图13a和13b中。
[0332]
图13a和13b中的数据表明,apoehcr增强子-haat启动子-hdnasei(超活性)正确前导序列-wpre xinact(vr-18013ad)和apoehcr增强子-haat启动子-hdnasei(野生型)-wpre xinact(vr-18014ad)载体仅有效地转导肝细胞来源的细胞,并从转导的g2细胞中触发生物增强的dna酶i酶或野生型dna酶i酶的高产量表达和分泌。dna酶浓度估算是使用纯dna酶i pulmozyme“dornase alfa”(roche)的连续稀释液获得的。转导对于细胞似乎是安全的,因为在观察的72小时内,即使在106gc/细胞的最高vr-18013ad和vr-18014ad剂量时也没有任何细胞死亡的迹象,并且任何转导的细胞与对照细胞之间都没有形态上的差异。实施例13:用于治疗阿尔茨海默病的apoehcr增强子-haat启动子-hdnasei(超活性)正确前导序列-wpre xinact(vr-18013ad)
[0333]
在表达以下三种突变人类转基因的3xtg-ad小鼠中研究了单次静脉内(iv)注射vr-18013ad(apoehcr增强子-haat启动子-hdnasei(超活性)正确前导序列-wpre xinact)的治疗效果:早老素(ps)1(m146v)、βapp(瑞典突变)和tau(p301l)。这些转基因小鼠形成淀粉样蛋白和tau病理。
[0334]
通过执行以下行为测试来评估vr-18013ad对学习和记忆缺陷的作用:1)y迷宫交替测试,其测量空间工作记忆并依赖于边缘和非边缘路径的完整性;和2)情境性恐惧条件测试(cfc),其高度依赖于海马和杏仁核的功能,也依赖于皮层。
[0335]
该研究的目的是通过免疫组织化学定量单次vr-18013ad静脉内注射对3xtg-ad中淀粉样蛋白沉积和tau磷酸化的作用。使用对pser202/thr205表位具有特异性的at8 mab抗体在3xtg-ad小鼠中研究了vr-18013ad对tau超磷酸化的影响,所述表位是ad患者中最早磷酸化的tau表位之一。还测定了治疗和未治疗的3xtg-ad小鼠的总tau。小胶质细胞过度活化可引起高度有害的神经毒性作用;因此,已经提出减弱小胶质细胞应答作为ad潜在的治疗方法。
[0336]
实验的设计总结在下表11中:表11表11
[0337]
在第0天,以下几组小鼠接受了治疗:(a)13只6月龄的野生型(wt)小鼠注射磷酸盐缓冲盐水(pbs);(b)15只6月龄的3xtg-ad小鼠仅注射磷酸盐缓冲盐水(pbs);和(c)以每只小鼠1.0x10
11 gc的剂量给10只6月龄的3xtg-ad小鼠注射vr-18013ad。数据总结如下。在图14中,y迷宫行为测试显示,与3xtg-ad对照小鼠相比,vr-18013ad治疗的3xtg-ad小鼠略有改善。在图15中,情境性恐惧条件测试的结果显示,与3xtg-ad对照小鼠相比,vr-18013ad治疗的3xtg-ad小鼠略有改善。图16的数据表明,与3xtg-ad对照小鼠相比,vr-18013ad治疗的3xtg-ad小鼠的小胶质细胞活化显著降低,尤其是在脑皮层区域。
[0338]
图17的数据表明,与3xtg-ad对照小鼠相比,vr-18013ad治疗的3xtg-ad小鼠的皮层脑区域中的小胶质细胞活化显著减少。图18的数据表明,与3xtg-ad对照小鼠相比,用vr-18013ad治疗显著降低了用vr-18013ad治疗的3xtg-ad小鼠中的淀粉样蛋白沉积。图19的数据表明,与3xtg-ad对照小鼠相比,用vr-18013ad治疗显著降低了用vr-18013ad治疗的3xtg-ad小鼠中的超磷酸化tau的沉积。图20中的照片显示了vr-18013ad处理的治疗后海马区中p-tau的显著降低。总而言之,单次静脉内注射vr-18013ad在阿尔茨海默病小鼠模型中显示出显著的治疗活性。
实施例14:vr-18014ad作为腹膜癌扩散的治疗
[0339]
将12只ibch ras品种的balb/c小鼠(20-22g)置于20-22℃的受控温度下。在第1天,给小鼠腹膜内注射200μl的细胞悬液,该细胞悬液包含5
×
105个ct26 nnmu诱导的未分化结肠癌细胞。在肿瘤移植后第6天,将小鼠随机分为对照组(六只小鼠,单次静脉内注射pbs)或治疗组(六只小鼠,单次静脉内注射vr-18014ad,剂量为1.0
×
10
11
gc/每只小鼠)。在接种肿瘤细胞后第16天小鼠安乐死后,进行每组中的形态计量学评估和肿瘤结节数的测量。对照组的小鼠每只小鼠具有14-22个肿瘤结节,部分结节形成团块。相比之下,vr-18014ad治疗的小鼠只有2-5个尺寸较小的结节,没有团块形成的迹象。对照和vr-18014ad治疗的小鼠的典型形态图像如图21所示。实施例15:从具有诱导的肠渗漏的小鼠中提取的cfdna触发tau聚集,并且肝脏特异性dna酶基因转移抑制cfdna诱导tau聚集的能力。
[0340]
聚集的tau蛋白与超过20种神经系统病症有关,包括阿尔茨海默病。如实施例7中所详述的,在18只大鼠中诱导肠渗漏。按照下表12中所示的预定方案将测试的载体和组合物施用于小鼠:表12
[0341]
cfdna提取如下进行。通过心脏穿刺在无细胞dna bct管中收集外周血样品(5ml)。通过在4℃以800g 10min的首次离心将血浆与细胞级分分离。将血浆在4℃以13,000g进一步离心10min以沉淀并除去任何剩余的细胞,然后以1ml等分试样在-80℃保存直至dna提取。
[0342]
对于cfdna提取,按照制造商的规程使用qiaamp circulating nucleic acid(qiagen)。
[0343]
实施cfdna对tau聚集的评估。使用了全长人tau(4r2n)。对于测定,将含有1mg/ml tau单体在2.5μm肝素存在下于100mm hepes ph 7.4、100mm nacl中的溶液在25μl提取的
dna traps that contribute to cancer-associated thrombosis”pnas,2012,109(32):13076
–
13081.garc
í
a-olmo d.c.and garc
í
a-olmo,d.“biological role of cell-free nucleic acids in cancer:the theory of genometastasis”crit rev oncolog.,2013,18:153-161.sawyers 2008c.l.,“the cancer biomarker problem”nature,2008,452(7187):548
–
552.butt a.n.等人overview of circulating nucleic acids in plasma/serum.ann.n.y.acad.sci.,2008,1137:236
–
242.schwarzenbach h.等人,“detection and monitoring of cell-free dna in blood of patients with colorectal cancer”ann.n.y.acad.sci.,2008,1137:190
–
196.zenaro e,等人,neutrophils promote alzheimer's disease-like pathology and cognitive decline via lfa-1integrin.nat rev nephrol.,2015,author manuscript;available in pmc 2017jul 14.fushi,w.等人,“extracellular dna in pancreatic cancer promotes cell invasion and metastasis”cancer res.,2013,73:4256-4266.tohme,s.等人,“neutrophil extracellular traps promote the development and progression of liver metastases after surgical stress”cancer res.,2016mar 15,76(6):1367
–
1380.patutina,o.等人,inhibition of metastasis development by daily administration of ultralow doses of rnase a and i.biochimie.,2011apr,93(4):689-96.dan li,i treatment reduces gvhd in mice.biology of blood and marrow transplantation,volume 21,issue 2,page s339.***
[0346]
本发明不限于本文所述的具体实施方案的范围。实际上,根据前面的描述,除了本文描述的那些之外,本发明的各种修改对于本领域技术人员而言将变得显而易见。这样的修改旨在落入所附权利要求的范围内。
[0347]
本文引用的所有专利、申请、出版物、测试方法、文献和其他材料均通过引用以其整体并入本文,如同其实体存在于本说明书中一样。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签:
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



