一种提高纳米材料储氢性能的方法与流程
 2021-01-30 23:01:57|
2021-01-30 23:01:57| 297|
297| 起点商标网
起点商标网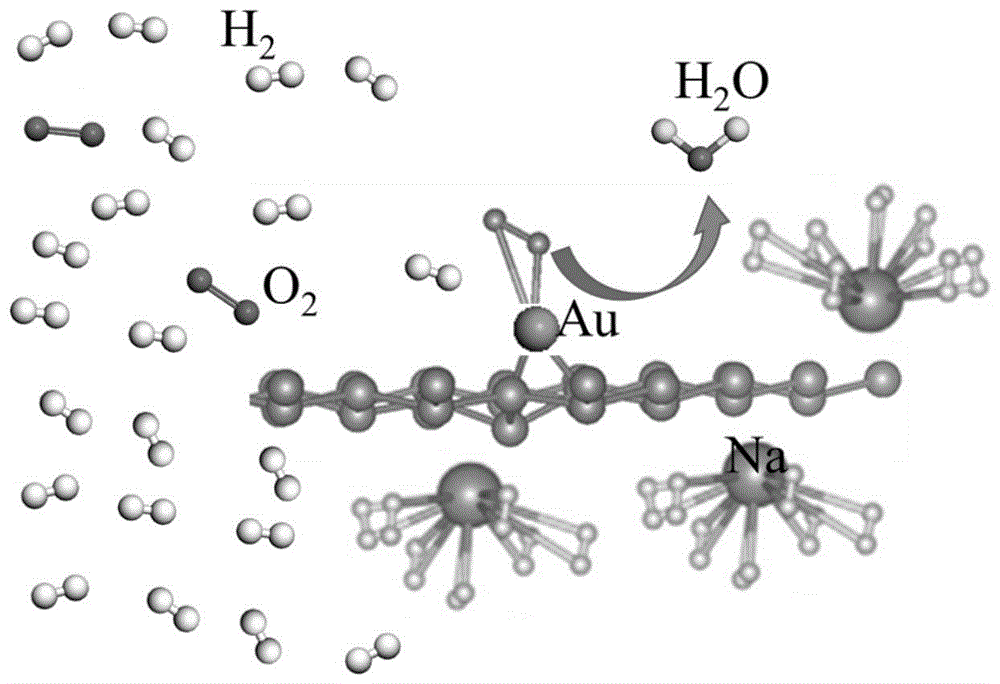
本发明涉及储氢材料模拟储氢技术领域,具体来说是一种提高纳米材料储氢性能的方法。
背景技术:
氢作为一种清洁能源,由于其储量丰富、无污染、能量密度高等优点已经引起人们的广泛关注。然而,到目前为止氢能源并没有得到大规模的应用,一个重要原因就是没有找到合适的储氢方式。常规的储氢方式如:压缩储氢、液化储氢,由于高能耗和安全问题,至今未能实现大规模应用。而轻金属氢化物中虽然氢的质量密度较高,但是由于氢以原子形式存在,所以放氢比较困难。近年来的研究发现,吸附储氢是一种极具潜力的储氢方式。衡量吸附储氢材料的优劣有两个基本因素:储氢的质量比和对氢分子的吸附能。对于质量比来说越大越好,对于吸附能却要求不能过大也不能太小。如果吸附能太大,放氢需要很高的温度;如果太小,储氢需要低温或者高压。
碳基纳米材料由于比表面积大的优点在储氢方面得到系统研究,然而纯的碳纳米材料对氢的吸附比较弱,储氢量也比较低。为了提高纳米材料的储氢能力,控制储氢材料储、放氢过程,科学家已经做了一些尝试。2005年以来,研究者利用金属修饰(或掺杂)碳基纳米材料后,储氢效果得到明显提高。所涉及到的碳基纳米材料包括富勒烯、纳米管、石墨烯和石墨炔等。修饰原子可以是碱金属、碱土金属和过渡金属。金属修饰后的纳米材料的储氢量和吸附能基本接近可以利用的范围。然而用金属修饰纳米材料储氢也存在一些不容忽视的问题:金属原子与碳基纳米材料结合较弱,形成的复合材料不稳定,不利于储放氢的可逆利用。为了解决金属原子和衬底结合较弱容易聚合的问题,我们研究了锂修饰的碳氮单层多孔纳米材料、硼单层纳米材料和硼氮原子链等的储氢性能,由于锂原子与上述几种纳米材料结合较强,吸附能大于内聚能,所以可以稳定的分散在纳米材料中,避免了金属聚合的问题。我们选用的几种材料都是比表面积较大的体系,所以储氢质量密度较高,是极具潜力的储氢材料。
在储氢领域,纳米团簇也是储氢材料的选择之一。z.p.jiang等研究了li3n团簇的几何结构、电子结构和储氢性能,由于锂原子本身包含在团簇中,避免了修饰原子聚合的问题。在(li3n)n团簇中,锂氮键既有离子键的特点又有共价键的特征,表现出一定的极性,每个团簇可以吸附多个氢分子。但是,用团簇储氢也同样存在上述不容忽视的问题——氧气对储氢的影响。
使纳米材料带电可以调制材料的储氢性能。此外,人们在利用电场来调制材料的储氢性质方面也做出了一些尝试。j.zhou等研究了电场对极性材料储、放氢的影响,由于硼氮石墨烯材料的硼氮键本身具有极性,所以可以吸附氢分子,但是吸附能只有0.03ev/h2。加上垂直于硼氮石墨烯平面的电场后,氢分子被电场进一步极化,产生了较大的偶极矩,吸附能随着外场的变大而增加,所以利用电场可以一定程度上控制材料的储氢能力。但是电场对氧分子吸附的调制作用仍然是未知的,电场对其他非极性的纳米材料储氢的调控还有待研究。目前还没有找到能够只吸附氢气而不吸附氧气的材料,因此杂质气体氧气的存在是制约材料储存分子氢的重要因素,是储氢领域必须考虑和解决的问题。
在催化领域,金属修饰的碳基纳米材料和团簇由于其优良的特性而引起了广大科学工作者广泛和持之以恒的兴趣。一些金属材料本身不具有催化能力,但它们形成纳米团簇或者分散在基底上以后却表现出较强的催化能力。例如,金属原子包括au、cu、fe等镶嵌在具有缺陷的石墨烯上形成的复合材料对一氧化碳氧化反应有较强的催化能力,可以实现低温消除一氧化碳。张海军研究组制备的“皇冠-宝石”型(crown-jewel)的au-pd团簇,由于pd原子向au原子转移了电荷,au原子带负电,表现出较强的催化活性。
氧还原反应(orr)是燃料电池、金属空气电池等装置中的一个重要反应。传统的铂催化剂由于其价格昂贵、持久性差在实际应用中受到限制。寻找高效、经济、耐久特别是不包含铂的电催化材料已经成为科学家努力完成的研究热点。2009年,gongkuanping研究小组发现n掺杂(doped)的碳纳米管具有较强的催化能力,由于n的电子亲和力较大,近邻的c原子向其转移电荷,使得电子局域在n原子周围,而近邻的c原子显示正电性。由于n原子的存在,使得氧分子由倾斜的吸附转变为平行于表面的吸附,o-o键变弱,促进了orr反应。b掺杂的石墨烯对orr反应也同样具有催化作用。把单个原子(包括ni,pd,pt,sn等)镶嵌在具有缺陷的石墨烯后对orr反应表现出较高的催化活性。b、fe、co等原子与n共掺杂石墨烯后仍然表现出一定的催化能力,共掺杂以后使得体系更加稳定。
考虑到纳米复合团簇、掺杂的石墨烯等在储氢材料和氧还原反应的研究中都有涉及,同时通过外场也可以调控材料的性质。如果在储氢材料中引入催化剂,使氢与杂质气体——氧气反应,将会有效的消除储氢过程中氧气对储氢材料吸附氢气的抑制作用。本专利将为室温下实现可调控储、放氢提供理论支持,为消除o2对储氢抑制作用提供材料基础和理论参考,具有重要的学术意义和应用价值。
现有技术中缺少合适的储氢方式是阻碍氢能源大规模应用的重要因素之一,在纳米材料吸附储氢过程中,由于氧气会干扰氢气的存储,不利于氢气的可逆利用。研究表明,金属修饰的石墨烯对氧气的吸附要比氢气强,如果用氢分子来取代氧分子,取代能也较大,即使氧气的压强很低(10-10bar),提高氢气的压强(1~200bar)也很难实现用氢气来取代氧气而有效的储氢,所以在氧气存在的环境中,金属修饰的石墨烯更容易吸附氧气,而不是氢气,无法实现可逆储氢,这就限制了石墨烯的进一步应用,因此在分子氢的存储研究中,如何消除氧气的影响是亟待解决的问题。
技术实现要素:
针对上述存在的技术不足,本发明的目的是提供了一种提高纳米材料储氢性能的方法,本发明通过在硅烯上结合金属以将金属做为催化剂,使混合气体中的杂质气体氧气和氢气反应氧化还原反应生成水,在放氢的过程中从储氢材料当中释放出去,以消除氧气等杂质气体对储氢性能的影响。
为解决上述技术问题,本发明采用如下技术方案:
一种提高纳米材料储氢性能的方法,包括以下步骤:
先将金属原子ⅰ与硅烯进行一次结合,得到结合材料,再将金属原子ⅱ与结合材料进行二次结合,制得金属修饰硅烯;
其中,所述一次结合采用共溅射退火法,二次结合采用电沉积法;
所述金属原子ⅰ为li、na、k、ca、sc、ti、cr、mn、fe或au;
所述金属原子ⅱ为碱金属或者碱土金属原子。
优选的,所述金属原子ⅰ为au原子。
优选的,所述金属原子ⅱ为na、k、mg、ca原子中的一种。
优选的,金属原子ⅰ和硅烯的结合能计算方法如下:
采用基于密度泛函理论的第一性原理计算方法,
ead=e(m@silicene)–e(m)–e(silicene)
ead>e(silicene),ead>e(m)
其中,ead为金属原子ⅰ和硅烯的结合能;e(m@silicene)为金属修饰硅烯的自由能;e(silicene)为硅烯的自由能;e(m)为金属原子ⅰ的自由能。
优选的,氢气分子、氧气分子或水分子与金属修饰硅烯的结合能计算方法如下:
采用基于密度泛函理论的第一性原理计算方法,
eb=e(f/m@silicene)–e(f)–e(m@silicene)
其中,e(f/m@silicene)为分子吸附在金属修饰硅烯上的自由能;e(m@silicene)为金属修饰硅烯的自由能;e(f)为分子的自由能,所述分子为分子氢气分子、氧气分子或水分子。
与现有技术相比,本发明具有的有益效果是:
1、本发明模拟的原理是:本发明采用金属原子ⅰ和金属原子ⅱ共修饰硅烯,金属原子ⅰ用于与硅烯结合,得到结合材料,金属原子ⅱ用于为所述结合材料修饰;储氢过程中,硅烯表面分散催化剂金属原子ⅰ,使混合气体中的杂质气体氧气和氢气反应生成水,在放氢的过程中从储氢材料当中释放出去;碱金属或者碱土金属原子在与硅烯结合后,一部分电子转移至硅烯上,剩余的金属或碱土金属阳离子附近产生电场,并对h2产生极化作用,导致h2内的电荷向两级转移,此时剩余h2能够吸附在碱金属或者碱土金属原子(金属原子ⅱ)附近,从而实现可逆储氢并通过氧还原反应消除杂质气体o2的目的。
2、与石墨烯相似,硅烯可以看作是由两层硅原子形成的两个互相渗透的三角格子而构成;由于硅原子间的π键比碳原子的弱,平面是不稳定的,因此硅原子在硅层上是弯曲的,从而导致硅烯与金属原子的作用比石墨烯与金属原子的作用强,这就避免了金属原子在二维材料表面的聚合趋势。
3、本发明进行了模拟实验,实验结果表明:当金属原子ⅰ为au原子,金属原子ⅱ为li、na或k原子时,储氢性能最佳;利用氧还原反应,消除氧气等杂质气体对储氢的影响,通过au原子催化反应生成水分子,为可调控储氢材料的应用提供理论模型,为消除氧气对储氢的影响提供理论依据,为氢能源的利用提供良好的存储介质,通过金属原子ⅰ与氢气分子、氧气分子和水分子的结合能反映了储氢性能,金属原子ⅰ与氧气分子的结合能高、同时与氢气分子和水分子结合能低,在au原子催化作用下,实现了氧气分子与氢气分子发生氧化还原反应,并以水分子的方式逸出,进入提高储氢性能。
附图说明
图1为实施例1的na和au修饰硅烯储氢材料的结构示意图;
图2为实施例1的h2、o2和h2o分别吸附在金修饰的硅烯的结构图,其中(a)图为h2,(b)图为o2,(c)图为h2o;
图3为实施例1的h2、o2和h2o在不同金属原子ⅰ修饰的硅烯上的吸附能对照图。
具体实施方式
下面结合本发明实施例,用以较佳的实施例及附图配合详细的说明。
实施例1
一种提高纳米材料储氢性能的方法,包括以下步骤:
s1:先将金属原子ⅰau原子通过磁控溅射退火法与硅烯结合,磁控溅射退火法的条件为:
(1)将硅烯衬底置于磁控溅射系统中,反应室压力为2pa,通入氮气和氩气10min;
(2)以金为靶材,采用射频磁控溅射工艺,在硅烯衬底上溅射金薄膜,得到au修饰硅烯基板;
(3)热处理:将au修饰硅烯的基板于惰性气体气氛中,将反应室加热至1000℃,热处理25min热处理,得到结合材料;
再将金属原子ⅱna原子通过电沉积法与结合材料结合,电沉积法的条件为:将结合材料、金属钠、celgard隔膜以及litfsi-dol+dme电解液组成cr2032纽扣电池,组装成电池后进行放电,在1ma/cm2的电流密度放电24h后,放电完成后拆除电池,取出气凝胶并进行洗涤、干燥,得到金属修饰硅烯材料。
s2:采用基于密度泛函理论的第一性原理计算方法,进行金属原子和硅烯的结合能计算:
ead=e(m@silicene)–e(m)–e(silicene)
ead>e(silicene),ead>e(m)
其中,当金属原子ⅰ为au原子,ead为au原子和硅烯的结合能;e(m@silicene)为au修饰硅烯的自由能;e(silicene)为硅烯的自由能;e(m)为au的自由能;
s3:采用基于密度泛函理论的第一性原理计算方法,进行氢气分子、氧气分子或水分子与金属修饰硅烯的结合能计算:
eb=e(f/m@silicene)–e(f)–e(m@silicene)
其中,e(f/m@silicene)为分子吸附在金属修饰硅烯上的自由能;e(m@silicene)为金属修饰硅烯的自由能;e(f)为分子的自由能,所述分子为分子氢气分子、氧气分子或水分子。
实施例2
与实施例1的步骤相同,不同之处仅在于,金属原子ⅰau原子替换为li原子。
实施例3
与实施例1的步骤相同,不同之处仅在于,金属原子ⅰau原子替换为na原子。
实施例4
与实施例1的步骤相同,不同之处仅在于,金属原子ⅰau原子替换为k原子。
实施例5
与实施例1的步骤相同,不同之处仅在于,金属原子ⅰau原子替换为ca原子。
实施例6
与实施例1的步骤相同,不同之处仅在于,金属原子ⅰau原子替换为sc原子。
实施例7
与实施例1的步骤相同,不同之处仅在于,金属原子ⅰau原子替换为ti原子。
实施例8
与实施例1的步骤相同,不同之处仅在于,金属原子ⅰau原子替换为v原子。
实施例9
与实施例1的步骤相同,不同之处仅在于,金属原子ⅰau原子替换为cr原子。
实施例10
与实施例1的步骤相同,不同之处仅在于,金属原子ⅰau原子替换为mn原子。
实施例11
与实施例1的步骤相同,不同之处仅在于,金属原子ⅰau原子替换为fe原子。
本发明结果主要采用基于密度泛函理论的第一性原理计算方法。金属原子和硅烯的结合能按照下面的公式(1)计算:
ead=e(m@silicene)–e(m)–e(silicene)(1)
式中,ead为金属原子ⅰ和硅烯的结合能;e(m@silicene)为金属修饰硅烯的自由能;e(silicene)为硅烯的自由能;e(m)为金属原子ⅰ的自由能;
表1.金属原子ⅰ与硅烯的结合能(ev)
表1说明上述几种金属元素均能够与硅烯结合。
氢气、氧气和水分子的结合能按照下面公式(2)计算:
eb=e(f/m@silicene)–e(f)–e(m@silicene)(2)
式中,e(f/m@silicene)为分子吸附在金属修饰硅烯上的自由能;e(m@silicene)为金属修饰硅烯的自由能;e(f)为分子的自由能,所述分子为分子氢气分子、氧气分子或水分子;
表2.氢分子、氧分子和水分子吸附在金属修饰硅烯上的自由能(ev)
“/”表示无结合能或者结合能小于0.2ev;
计算结果表明金属原子ⅰ与硅烯的结合较强,结合能比金属本身的内聚能要大,所以比较稳定,避免了金属原子在硅烯表面的聚合现象;表2给出了h2、o2和h2o分别在不同金属修饰的硅烯上的吸附能,大多数金属对h2的吸附较弱,对o2的吸附较强。
若金属原子ⅰ采用碱金属li、na和k的话,碱金属li、na和k对h2和o2的吸附能相差不大,所以o2对li、na、k结合的硅烯储氢影响不大,可以和h2同步存储和释放,因此li、na、k不适用;ca对o2的吸附能为1.22ev,所以释放的时候需要较高的温度;对于过渡金属修饰的硅烯,o2的吸附能较大,在1.7ev和3.4ev之间,所以很难释放掉,如果储氢的话,会影响氢气的可逆存储;由于过渡金属对o2的吸附较强,氧气被活化,可以使h2和o2容易发生氧还原反应,生成h2o分子,而过渡金属修饰的硅烯对h2o的吸附能不是太大,可以释放出去。
au修饰的硅烯对o2的吸附能为3.39ev,对h2o的吸附能只有0.21ev,因此au修饰的硅烯很容易能够催化h2和o2发生氧还原反应,并且生成的水分子吸附不强,很容易释放掉,所以可以通过碱金属或碱土金属与au原子共修饰的方法,杂质气体o2在au原子附近与h2发生氧还原反应,生成水分子,h2可以吸附在碱金属或者碱土金属原子(金属原子ⅱ)附近,从而实现可逆储氢并通过氧还原反应消除杂质气体o2。
如图1所示,为实施例1的na和au修饰硅烯储氢材料的结构示意图,au用于催化氢气和氧气反应,na用于对游离h2吸附;
如图2所示,h2,o2和h2o能够分别吸附在图1的金属修饰硅烯上;
如图3所示为实施例1-实施例11的h2、o2和h2o在不同金属原子ⅰ修饰硅烯上的吸附能对照图,对比来看,au对o2的吸附能高,对h2和h2o的吸附能均较低,说明au能够吸附o2并使得o2在au表面与h2发生氧化还原反应并得到水,此时水易于释放掉,从而性能最佳。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



