植物催化制备活性小分子人参膏及其制备方法和使用方法与流程
 2021-01-07 10:01:38|
2021-01-07 10:01:38| 716|
716| 起点商标网
起点商标网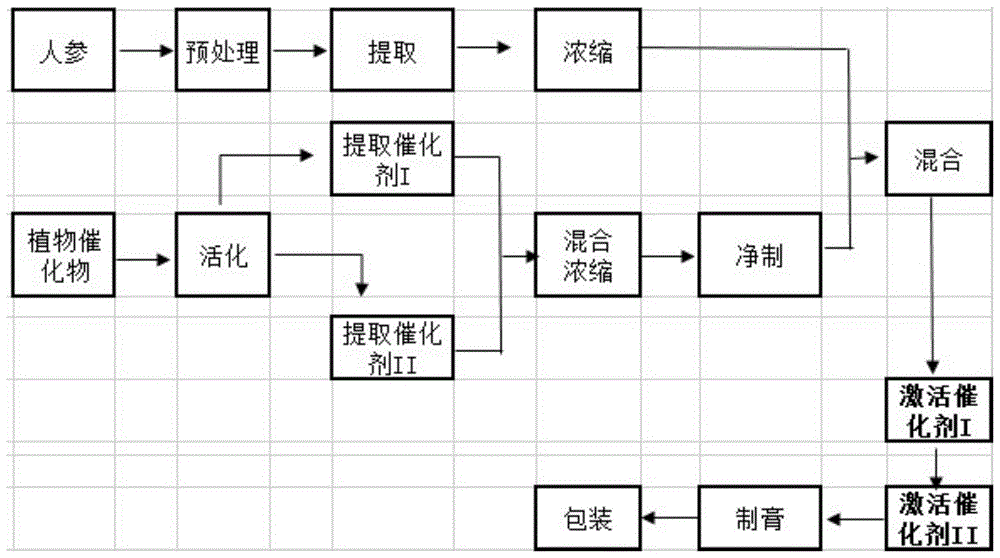
本发明涉及人参深加工及天然催化剂领域,尤其是一种植物催化制备活性小分子人参膏的方法。
背景技术:
人参是中国传统名贵中草药,以其突出药用价值在我国起到重要价值,被称为“百草之王”。人参既是种名又是属名,人参属植物属于五加科,包括十余个种,常用的有人参(中国人参、高丽参)、西洋参(美国参)、三七参(田七参)。皂苷类成分是其标志性活性成分,人参中含量4~10%,见表一所示。
人参皂苷是人参中的主要功效性成分。其中,人参本身含量较高的是分子量较大的原人参皂苷,占人参总皂苷含量的95%以上,平均分子量898~992da,见表二所示。这些含量高的大分子皂苷本身活性低、难吸收,是中药有效成分的“前体药物”,口服后需要在体内进一步代谢成低糖基的小分子皂苷才能发挥药效。并且,人参皂苷分子量越小活性越强。但是,人参直接口服在体内转化个体差异化较大、转化效率低,原人参皂苷平均吸收率仅为5%,即95%不能被人体利用,并容易引起部分人流鼻血、上火等副作用。而直接口服小分子人参皂苷,则活性高、易吸收、不上火。因此,改变人参中的难吸收、低活性的大分子成分,转化为高活性、易吸收、不上火的小分子成分,是人参等中草药行业的技术现代化和国际化、产品创新、产业升级的核心科技。
目前常用的水解方法有物理法、化学法和酶解法。物理法如热解法可以对糖苷键不稳定的糖苷键进行水解,例如传统的红参加工使一小部分人参皂苷在加工过程中发生了转化,但是这种转化率极低,仅为2%左右(如:发明专利、《高活性红参的制作方法》公开号:cn1846720a)。
化学法包括酸解、碱解以及金属离子水解法。化学水解法反应条件苛刻,对设备具有相当严重的腐蚀性,对生态环境污染也比较大,有时还会需要高压条件,对设备要求高;化学法制备小分子皂苷,也需要预先提纯总皂苷或单体皂苷,费用高昂(如:发明专利《一种阴离子催化水解苷类化合物的方法》、公开号:cn108586412a)这些因素都在一定程度上限制了工业上的广泛应用。
酶解法以其高效性、专一性等特点受到越来越多的重视。但是目前工业化生产的糖苷酶,例如淀粉酶、糖化酶、纤维素酶等是水解糖类化合物的普通糖苷键,对苷类化合物的β构型的糖苷键水解效率并不高。另外,部分实验室制备的特异酶,虽然可以高效水解皂苷,但是需要制备人参皂苷单体或人参皂苷分离物,才可以转化(如:发明专利,《微生物酶转化人参茎叶皂苷制备人参稀有皂苷的方法》公开号:cn104894204a)。但是,分离人参皂苷的成本极高。更为重要的是,大孔吸附树脂、硅胶等分离方法以及氯仿、甲醇等洗脱剂,因为其毒性而不允许在食品中使用。所以,难以产业化应用,仅能在实验室研究使用。
膏方是中医药经典传承方剂之一,被认为是是滋补强身、治疗慢性疾病、养生保健的最佳剂型。膏方融入传统医学精髓理念,其通过反复煎煮提取浓缩,最大限度地萃取药材中的有效成分,让药效成分精微化,滋补调治效果显著。同时,其药效浓度高、易吸收、口服方便、体量小便于携带也符合现代人的生活方式,在愈加重视养生保健的现今社会,膏方养生已成为一个弘扬传统中医文化的新途径。
以膏滋为载体的人参膏,国内外专家研发较多,但是多集中在口感及得率;对于功效成分群的组分、含量、分子量的研究涉及很少。特别是,从植物中萃取天然催化剂,不需要预先分离人参皂苷、直接转化制备固形物48brix以上,人参皂苷分子量分布于604~785da的粘稠膏滋形态的人参膏,未见报道。例如:
中国发明专利《一种食品人参膏及其制备方法》(吉林人参研究院,公开号:cn110584037a)公开了一种人参膏的制法:将人参、山药、山楂、大枣、蜂蜜相混合,制成一种风味独特、方便快捷的食;中国发明专利《人参膏及其制备工艺》(长春中医药大学,公开号cn110051782a)公开了一种人参膏及其制备工艺:将人参、黄精、桑葚、枸杞子、蜂蜜进行提取制备人参膏。该类方法仅考虑了产品风味及提取得率,未考虑有效成分群的“组分、含量、加工过程中的动态变化”,更没有注明产品中“皂苷分子量”。
中国发明专利《一种黑人参蜜膏及其制备方法》(吉林修福源生物科技有限责任公司,公开号:cn108157880a)和中国发明专利《一种鲜人参膏的制备方法及应用》(辽宁熙峰药业集团有限公司,公开号:cn109316517a)公开的方法,虽然含有小分子稀有人参皂苷,但含量极其微少、仅为万分之几。归根结底,是没有发现植物催化剂的存在,不能很好的激活催化活性。
技术实现要素:
针对现有技术不足,本发明公开了一种活性小分子人参膏的方法。特别是围绕“利用从植物中提取的天然催化剂、不需要预先提取及分离人参皂苷、直接催化制备固形物48brix以上,人参皂苷分子量分布于604~785da的粘稠膏滋形态的、可即食服用的、活性小分子人参膏的方法”。催化机理如图2所示。
按以下步骤进行:
s1:人参预处理:人参清洗后,在95~150℃、压力为0.60~4.0kgf/cm2条件下处理10~90min,使人参的植株组织松散但不破裂,然后干燥至含水量低于10%。
s2:提取:人参中加入3~8倍体积的食用乙醇-水溶液,乙醇含量为0~95%;回流提取,提取温度为80~98℃,提取时间为30min~12h;提取1~3次,合并提取液。
s3:浓缩:提取液中加入植物催化剂,催化剂添加量为初始人参的0.01~85倍重量,充分混合后减压浓缩至38brix以上。
s4:催化反应a:减压激活催化剂a,在45~65℃、-0.001~-0.1mp下,催化时间为3~12h。利用植物催化液中的a类人参皂苷催化剂,催化分解分子量为1109.29的rb1,分子量为1079.27的rb2、rb3、rc以及分子量为963.17的rd的20-o-上的糖基,或将20-c上的羟基脱水转化成20-21烯或20-22烯皂苷,生成分子量为785.02的r-rg3和s-rg3以及分子量为767.01的rk1和rg5;催化分解分子量为947.14的re的20碳的20-o-糖基,或将20-c上的羟基脱水转化成20-21烯或20-22烯皂苷,生成分子量为785.01的r-rg2和s-rg2以及分子量为767.01的rg4和rg6;催化分解分子量为801.01的rg1的20碳的20-o-糖基,生成分子量为638.87的s-rh1和r-rh1以及分子量为620.87的rh4和rk3。
s5:催化反应b:常压状态下激活催化剂b,在55~87℃下、催化8~24h,使s4中的分解产物进一步水解。利用植物催化液中的b类人参皂苷催化剂,催化分解r-rg3、s-rg3、rk1和rg5的3-o-糖基,生成分子量为622.87的s-rh2和r-rh2和分子量为604.88的rk2和rh3;催化分解r-rg2、s-rg2、rg4、rg6的6-o-糖基,生成分子量为638.87的s-rh1和r-rh1以及分子量为620.87的rh4和rk3。
s6:制膏:调整固形物含量至48brix以上,即得到活性小分子人参膏。可以直接包装成产品,也可以加入其他辅料制成产品。
使用的植物催化剂从植物中萃取得到,包括以下步骤:
s1:催化性能活化:把拥有催化活性的植株组织在120~240℃下、活化0.5~30min,活化催化性能;并使植株组织熟化、破而不碎,催化剂裸露而便于提取。
s2:提取植物催化剂a:加入植株4~8倍体积的水,在65~85℃下,提取2~8h;
s3:提取植物催化剂b:加入植株2~4倍体积的水,在85~98℃下,提取2~8h;
s4:净制:合并提取的催化液,并浓缩至38~45brix,在16000rpm~24000rpm下离心处理,收集离心液,即得植物催化剂。
所述的人参为人参属植物,具体包括人参、三七参、西洋参、竹节参、珠子参;提取催化剂的植物,至少包括麦冬、枸杞、甘草、苦瓜、大枣、黄精中的一种;催化过程可以加入适量的酸、碱或盐,调节溶液ph;制备的人参膏,可以直接使用,也可以添加到功能食品、保健品、化妆品、药品中。
附图说明
图1:工艺流程图
图2:植物催化机理图
图3:天然人参hplc检测图
图4:小分子人参膏hplc检测图
图5:小分子西洋参膏hplc检测图
图6:小分子人参膏hplc检测图
具体实施方式
实施例1
500kg人参,清洗后在110℃、压力为1.5kgf/cm2条件下处理35min,使人参的植株组织松散但不破裂,然后干燥至含水量低于10%;干燥后的人参中加入8倍体积的15%食用乙醇-水溶液,回流提取,提取温度为84℃,提取时间为4h;提取3次,合并提取液,待用。
250kg枸杞、120kg麦冬在150℃下、炒制3min,活化催化性能,并使植株组织熟化、破而不碎;加入2.2t的水,在85℃下提取2h,收集清液;再加入1.1t的水,在95℃下提取3h,收集清液。合并两次提取到的催化液,并浓缩至40brix,在24000rpm下离心处理15min,收集离心液,即得植物催化剂。
合并人参提取液和植物催化剂,充分混合后浓缩至55brix;先减压激活催化剂a,在65℃、-0.05mpa下,催化5h;再在常压状态下激活催化剂b,在75℃下、催化12h;调整固形物含量至65brix,即得到活性小分子人参膏。
试验例1:天然人参的成分分析
此试验为对照试验,使用《韩国健康机能食品公典(2004)》中载明的水饱和正丁醇提取方法提取和测定人参中的总皂苷含量。并采用高效液相色谱法对皂苷群进行定性、定量分析。方法如下具体如下:
分别取干燥的人参、西洋参、三七参,粉碎成100目的粉末。再分别精密称取样品各5g,分别置于250ml圆底烧瓶中,各加50ml水饱和正丁醇,在70~80℃水浴回流提取1h,冷却后过滤,收集滤液,对残留物进行以上操作重复2次,滤纸用10ml水饱和正丁醇洗涤,分别合并滤液。滤液移到250ml分液漏斗中加50ml蒸馏水充分振荡,待明显分层。已分层的水饱和正丁醇放入已恒重的蒸馏烧瓶中,在水浴中减压回收正丁醇。残留物中加50ml乙醚,在36℃水浴中回流30分钟脱脂,除掉乙醚。上述蒸馏烧瓶移至干燥箱(105℃)中恒重为止,干燥30min,把蒸馏烧瓶移至干燥器中放置30min后分别称量,增重既是总皂苷的重量。实验结果如表一所示。
高效液相色谱法对皂苷群进行定性、定量分析:色谱仪,waterse2696高效液相色谱分析仪,waters2998光电二极管阵列(pda)检测器及empower3色谱工作站;色谱柱:xbridgec18柱(5μm,
精确称取皂苷样品,溶于1ml的色谱甲醇中,浓度为4mg/ml;检测程序为:乙腈(a)-水(b):0-5min,20%a-40%a等度;5-10min,40%a-60%a线性梯度,10-70min,60%a-100%a线性梯度。
天然人参的检测图谱如图1所示,不同人参属植物的天然人参的皂苷分子量及百分含量如表二所示。
可知,天然人参的分子量居于883.45~991.69。
实验例2:小分子人参膏检测
精密称取实施例1所获得的小分子人参膏7g试样,置于250m圆底烧瓶中、加20毫升蒸馏水混合,加50ml石油醚振荡脱脂20min,移去石油醚层,重复2次;残留物加50ml水饱和正丁醇,在70-80℃水浴回流提取1h,冷却后过滤,收集滤液,对残留物进行以上操作重复2次,滤纸用10ml水饱和正丁醇洗涤,合并滤液。滤液移到250ml分液漏斗中加20ml蒸馏水充分振荡,待明显分层。已分层的水饱和正丁醇放入蒸馏烧瓶中,在水浴中减压回收正丁醇。上述蒸馏烧瓶移至干燥箱(105℃)中,干燥30min,收集烧瓶中的固体粉末,即位总皂苷。
采用实验例1中的方法对皂苷群进行定性、定量分析。检测图谱结果如图4所示。可知:84.38%摩尔比例的皂苷为分子量分布于604~785da的小分子皂苷。
实施例2
取300kg西洋参,清洗干净后在120℃、1.3kgf/cm2的压力条件下处理30min,使西洋参的植株组织松散但不破裂,然后对其干燥,至含水量低于10%;在干燥后的西洋参中加入8倍体积的10%食用乙醇-水溶液,回流提取,提取温度为90℃,提取时间为5h;提取3次,合并提取液,待用。
称取50kg枸杞、30kg黄精、20kg甘草在130℃下、炒制15min,活化催化性能,并使植株组织熟化、破而不碎;加入500kg的水,在75℃下提取3h,收集清液;再加入300kg的水,在96℃下提取4h,收集清液。合并两次提取到的催化液,并浓缩至45brix,在24000rpm下离心处理15min,收集离心液,即得植物催化剂。
合并人参提取液和植物催化剂,充分混合后浓缩至58brix;先减压激活催化剂a,在60℃、-0.06mpa下,催化10h;再在常压状态下激活催化剂b,在70℃下、催化20h;浓缩使固形物含量至70brix,即得到活性小分子西洋参膏。结果见图5。87.9%摩尔比例的皂苷分子量分布于604~785da。
实施例3
取300kg人参,清洗干净后,在130℃、1.5kgf/cm2的压力条件下处理40min,达到组织松散的效果,干燥。加入200l水,在98℃提取8h,过滤后重复提取2次,合并三次提取液,备用。
取80kg苦瓜,100kg大枣,110℃蒸制30min活化,然后加1t水,在70℃提取3h,得到植物催化剂a,然后再加入800kg水,于98℃提取4h,得到植物催化剂b,合并两次的提取液,浓缩汁40brix,在20000rpm下离心除去杂质,得植物催化剂。与人参提取物混合,先浓缩至50brix,然后在65℃,-0.06mpa下激活催化剂a,催化反应10h;再在80℃、常压状态下激活催化剂b,催化反应12h;浓缩使固形物含量至68brix,即得到活性小分子人参膏。结果见图6。80.04%摩尔比例的皂苷分子量分布于604~785da。
表一:人参中皂苷的含量
表二:天然人参的皂苷分子量及百分含量
以上所述仅为本发明的优选实施例,并非因此限制本发明的专利范围,凡是在本发明的发明构思下,利用本发明说明书及附图内容所作的等效结构变换,或直接/间接运用在其他相关的技术领域均包括在本发明的专利保护范围内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



