一种快速鉴定萌发期棉花种子耐盐性的方法与流程
 2021-01-06 18:01:25|
2021-01-06 18:01:25| 491|
491| 起点商标网
起点商标网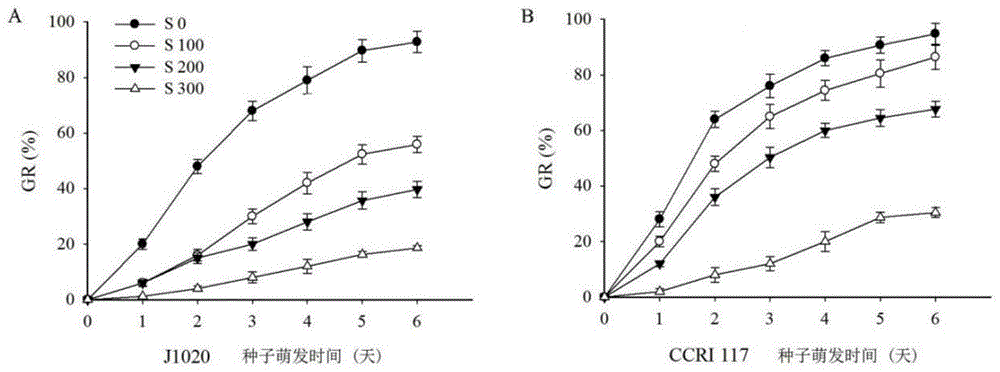
本发明涉及鉴定棉花品种耐盐性的技术领域,具体为利用非损伤微测技术测定盐胁迫下棉花种子萌发期胚根分生区的氯离子外排速率,来鉴定棉花种子萌发期耐盐性的方法。
背景技术:
当前,土壤盐渍化已经成为一个全球性的问题,全球土地盐碱化呈现越来越严重的趋势。土壤盐分浓度过大会对棉花产生严重的危害,尤其是种子萌发期对盐胁迫十分敏感(alkhatibetal,1993;kongetal,2017)。棉花在盐碱地种植时,时常表现出种子萌发受到严重抑制、种子发芽率等指标显著降低、出苗困难、甚至死苗,盐碱地立苗难长期困扰棉花生产(蒋玉蓉等,2006)。种子萌发期耐盐性是盐碱地区棉花品种必须具备的特性,是保证棉花出苗的基础。因此,如何快速地从丰富的棉花品种资源中筛选出适合在盐碱地种植应用的耐盐品种显得尤为重要。
长期以来,对抗/耐盐碱棉花材料的筛选或鉴定,均是采用田间盐碱地、人工盐池进行试验,或室内测定一些生理生化的参数,作为比较参考。常规的盐碱地或盐池鉴定鉴定结果相对较直接,但在进行大规模材料耐盐性的鉴定时,容易受环境等外界因素的影响,并且大田鉴定既需要花费大量的物力,也需要消耗大量的人力(刘庆宏等,2015)。不同棉花品种的种子对盐胁迫的抗性与感性表现在种子发芽率、平均发芽时间及活力指数上。因此,室内测定种子的耐盐性,主要通过测定种子萌发期的一些形态指标,如发芽率、发芽势、根长、根数等指标综合评价材料的耐盐性强弱(陈建平等,2014;杨保新等,2015)。这些鉴定工作通常需要测量许多指标,综合分析之后所得结果才能比较符合实际,这样的鉴定工作难免会耗时费力。
技术实现要素:
本发明的目的在于,提供一种操作方便、省时省力且准确度高的快速鉴定棉花种子耐盐性的方法。
具体而言,本发明提供的上述方法是通过检测棉花种子氯离子外排速率来实现鉴定棉花种子耐盐性的。在获得本发明所述方法的过程中,发明人进行了以下探究。
发明人选择耐盐型与敏感型棉花品种测定其在盐胁迫下的种子发芽率、平均发芽时间及种子平均活力指数。
具体方法参考如下:
(1)发芽率统计:在棉花种子萌发时期,每隔24h记录一次萌发数和根长,待萌发第6天结束试验,统计分析发芽率(gr),计算公式为:gr(%)=供试种子的发芽数/供试种子数×100;
(2)平均发芽时间(mgt)计算公式为:mgt=∑(gt×dt)/∑gt,式中gt为t日的发芽数,dt为发芽天数;
(3)种子活力指数(vi)计算公式为:vi=∑(gt/dt)×s,式中gt为t日的发芽数,dt为发芽天数,s为芽的长度+根的长度。
发明人检测了处于萌发期的耐盐型与敏感型棉花品种在盐胁迫下种子离子含量。并对离子与种子活力指数(vi)的相关性进行检测,发现k离子、na离子、cl离子中,cl离子与种子活力指数(vi)的相关性最强,
种子中离子浓度检测方法参考如下:
种子萌发2天后,取发芽盒中待测样品,用蒸馏水冲洗干净,并用吸水纸吸去表面附着的水分。将样品杀青烘直至恒重,称其干物质量。将烘干后的植株粉碎过筛,用hcl浸提、振荡、过滤,用原子吸收分光光度计测定k离子和na离子浓度,利用氯离子测定仪测定样品中cl离子浓度。
与此同时,发明人还选择对种子胚轴组织的离子含量进行检测,检测方法参考如下:
种子萌发两天后,将经盐胁迫处理后已发芽的棉花胚的胚轴组织切小块,浸在戊二醛和磷酸缓冲液配制的固定液中。化学固定后将材料浸于丙酮中以除去组织中游离水,脱水之后用epon812树脂剂进行组织包埋处理。使用reichert-jungultracute型超薄切片机(奥地利),将处理好的组织样品切成70nm的切片,然后利用透射电镜能谱分析(tem-eds)测定萌发期棉花种子胚轴部位离子含量情况。
发明人发现,胚轴中cl离子含量的累积是造成种子萌发受到抑制的主要因素。为了进一步明确cl离子与萌发期种子耐盐性的关系,对棉花胚根中cl离子的累积动态变化进行检测。证实了在盐胁迫下,氯离子外排率越高,萌发期种子耐盐性越强。因此,可以采用萌发期胚轴组织的氯离子外排量来鉴定萌发期种子耐盐性。
进一步地,本发明所述鉴定棉花种子耐盐性的方法是通过检测萌发期棉花种子氯离子外排速率来判断棉花种子的耐盐性。更进一步的,本发明所述鉴定棉花种子耐盐性的方法是通过检测萌发期棉花种子胚根分生区氯离子外排速率来判断棉花种子的耐盐性。
本发明所述鉴定棉花种子耐盐性的方法中,采用非损伤离子微测技术检测在体组织的棉花种子萌发期胚根分生区氯离子外排速率。
本发明所述鉴定棉花种子耐盐性的方法中,选择生长整齐的萌发期种子用去离子水冲洗干净,将其浸入测试液中平衡,然后再转入新的测试液中开始检测,检测的时间为7-10min;
本发明所述鉴定棉花种子耐盐性的方法中,检测部位为在体组织的棉花种子萌发期胚根分生区,距根尖250-400μm处;或检测部位为离体组织棉花种子萌发期胚根分生区。
本发明所述鉴定棉花种子耐盐性的方法中,还包括在检测中设置阳性对照,所述阳性对照为已知耐盐型的棉花种质材料,和/或设置阴性对照,所述阴性对照为已知对盐胁迫敏感的棉花种质材料;
若氯离子外排速率接近或高于阳性对照材料,则待测棉花种子耐盐性高;若氯离子外排速率接近或低于阴性对照材料,则待测棉花种子耐盐性低;若氯离子外排速率介于阴性对照材料和阳性对照材料之间,则待测棉花种子为中度耐盐。
具体地,本发明所述鉴定棉花种子耐盐性的方法,包括以下步骤:(1)供试样品与盐胁迫处理,确定阴性对照与阳性对照,采用培养皿滤纸发芽法进行发芽实验。(2)离子流速测定,在旭月(北京)科技有限公司采用非损伤微测技术(nmt,bio-001a,youngerusasci.&tech.corp.,amherst,ma,usa)测定培养2天的在体的种子胚根分生区的中cl离子流速,将待测品种的cl离子流速与阴性对照和阳性对照做对比。
本发明所述鉴定棉花种子耐盐性的方法用于筛选棉花种质资源中耐盐材料或感盐材料。
基于本领域技术人员的理解,应用本发明所述鉴定棉花种子耐盐性的方法,快速预测种植于盐碱地的棉花种子活力、快速预测种植于盐碱地的棉花种子的发芽率。
本发明的有益效果是,本发明所述鉴定棉花种子耐盐性的方法速度快,效果准确、直观,对鉴定环境条件要求低,可控性强,该方法可筛选大批棉花种质资源或育种材料中的耐盐和盐敏感材料。
附图说明
图1为本发明实施例1中不同浓度的盐胁迫处理下棉花不同品种发芽率(gr);其中a为棉花品种j1020的发芽率(gr);b为棉花品种ccri117的发芽率(gr)。
图2为本发明实施例1中不同浓度的盐胁迫处理下不同品种平均发芽时间(mgt)和平均活力指数(vi);其中a为平均发芽时间(mgt);b为平均活力指数(vi)。
图3为本发明实施例2中不同浓度的盐胁迫处理下不同品种中na离子、k离子和cl离子含量变化以及离子浓度与活力指数(vi)的相关性;其中a为na离子含量变化;b为k离子含量变化;c为cl离子含量变化;d为离子浓度与活力指数(vi)的相关性。
图4为本发明实施例3中清水条件下j1020的胚轴细胞中离子含量能谱图。
图5为本发明实施例3中盐胁迫(s200)条件下j1020的胚轴细胞中离子含量能谱图。
图6为本发明实施例3中清水条件下ccri117的胚轴细胞中离子含量能谱图。
图7为本发明实施例3中盐胁迫(s200)条件下ccri117的胚轴细胞中离子含量能谱图。
图8为本发明实施例3中盐胁迫(s200)条件下培养2天对j1020和ccri117胚根分生区中cl离子流的影响。
图9为本发明实施例4中盐胁迫(s200)条件下培养2天对不同品种胚根分生区中cl离子流的影响。
图10为本发明实施例4中cl离子外排量与vi的相关性
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若无特殊说明,实施例中所用实验耗材均为市售。且实施例中所有实验至少独立重复3次,采用spss16.0(spssinc.chicago,usa)处理数据,以duncan’s多重比较进行差异显著性检验(p<0.05)。
实施例1
棉花品种在种子萌发期对盐胁迫的抗性与感性表现在种子发芽率、平均发芽时间及活力指数上。棉花种子发芽率、平均发芽时间和种子活力指数测定方法,参考如下:
(1)供试品种和盐胁迫处理
敏感型材料j1020和耐盐型材料中棉所117(ccri117,曾用名为cz91)来自中国农业科学院棉花研究所东场试验站繁种圃中,采集后脱绒晾干于4℃保存。以不同盐浓度(0mm、100mm、200mm、300mm)培养为处理因素,采用培养皿滤纸发芽法进行发芽实验。种子用10%的h2o2消毒10min,再用蒸馏水冲洗数次洗净用清水冲洗后选取成熟饱满、大小一致的种子均匀播于发芽盒中;每盒50粒,每处理4个重复,置于光照/黑暗时长为16h/8h,温度为(28±2)℃/(20±2)℃、湿度80%的人工气候培养箱中进行萌发。
(2)发芽率统计
在棉花种子萌发时期,每隔24h记录一次萌发数和根长,待萌发第6天结束试验,统计分析发芽率(gr),计算公式为:gr(%)=供试种子的发芽数/供试种子数×100;发芽率结果见图1。
结果表明,在不施盐条件下培养(s0),不同棉花材料间最终的的发芽率均在90%以上,且不同材料间差异不显著。盐胁迫培养显著的降低了棉花种子的发芽率,其中j1020对盐胁迫较为敏感;在轻度盐胁迫(s100)、中度盐胁迫(s200)和重度盐胁迫(s300)条件下,j1020的发芽率分别降低到55.9%、39.7%和18.6%。ccri117的耐盐性较强,在s100、s200和s300条件下其发芽率比j1020的发芽率分别高30.5%、28.0%和11.8%。
(3)平均发芽时间(mgt)
计算公式为:mgt=∑(gt×dt)/∑gt,式中gt为t日的发芽数,dt为发芽天数;结果见图2的a。
结果显示,盐胁迫处理延长了种子的萌发时间,且盐浓度越高种子的萌发时间就越长。不同品种相比,盐胁迫下ccri117的平均发芽时间(mgt)较短;在s100、s200和s300条件下,ccri117的mgt比j1020分别减少了1.6天、2.0天和7.2天。
(4)种子活力指数(vi)。
其计算公式为:vi=∑(gt/dt)×s,式中gt为t日的发芽数,dt为发芽天数,s为芽的长度+根的长度,种子活力结果见图2的b。
结果表明,种子在失去发芽力之前,已发生劣变,可从活力指数反映出来;活力指数是表示种子活力比较全面的一项指标,它把种子的发芽能力和幼苗长势综合起来表示,故比发芽率更能灵敏地表现种子活力,指数数值高,种子活力大。盐胁迫导致种子的发芽能力显著降低,其中j1020的活力指数(vi)受影响最大,在s100、s200和s300条件下,分别降低到1.71、0.39和0.11,显著低于ccri117的vi值(分别为3.51、2.12和0.65
实施例2
对处于盐胁迫下萌发期棉花种子的k离子、na离子、cl离子含量进行测定,测定方法可参考如下:
种子萌发2天后,取发芽盒中待测样品,用蒸馏水冲洗干净,并用吸水纸吸去表面附着的水分。将样品于105℃杀青30min后,80℃下烘直至恒重,称其干物质量。将烘干后的植株粉碎过筛,用1moll-1hcl浸提12h并振荡30min后过滤,用原子吸收分光光度计测定k离子和na离子浓度,利用氯离子测定仪测定样品中cl离子浓度,结果见图3。
结果显示,随着盐浓度的增加,萌发的种子中na和cl离子浓度显著增加,尤其是cl离子浓度增加的幅度更高;不同品种间比较,ccri117在中低盐胁迫下(s100和s200)的na离子浓度显著高于j1020,而在重度盐胁迫下(s300)的na离子浓度显著低于j1020。与na离子浓度变化趋势不同,在不同的盐胁迫下,ccri117的cl离子浓度均显著低于j1020。盐胁迫处理显著的降了种子中k离子浓度,但不同品种变化趋势不同;其中,j1020在低盐胁迫下(s100)k离子浓度便显著降低,但是随着盐浓度的增加种子中k离子浓度则不再发生变化;ccri117种子中k离子浓度则只在重度盐胁迫下(s300)显著的降低,而中低盐胁迫(s100和s200)对k离子浓度无显著的影响。
进一步明确盐胁迫下种子中离子浓度与vi的关系,分别将na离子、k离子和cl离子浓度与vi进行相关分析,结果见图3的d图;其中cl离子浓度与vi的线性方程为:y=-52.065x+171.49,相关性最高且达显著水平(r2=0.7789,p=0.01),k离子浓度与vi的线性方程为:y=0.8127x+11.4,相关性次之但未达显著水平(r2=0.4985,p=0.058),na离子浓度与vi的线性方程为:y=-0.0208x+3.9628,线性相关性最差(r2=0.007,p=0.481)。
实施例3
探究盐胁迫下萌发期棉花种子胚根各离子含量变化及离子流速测定方法如下:
1、盐胁迫处理下萌发期棉花种子胚轴中离子含量测定
在盐胁迫环境下,na和cl离子在种子中的累积和k离子含量的降低,会对种子产生毒害作用,尤其是在胚芽中的累积是造成抑制种子萌发的重要原因。因此,对处于盐胁迫下棉花种子萌发期胚根的离子含量进行测定,测定方法可参考如下:
使用透射电镜能谱分析法进行测定,种子萌发两天后,将经盐胁迫处理后已发芽的棉花胚的胚轴组织切成1立方毫米左右小块,浸在2.5%戊二醛和磷酸缓冲液配制的固定液中4小时。化学固定后将材料浸于丙酮中以除去组织中游离水,脱水之后用epon812树脂剂进行组织包埋处理。使用reichert-jungultracute型超薄切片机(奥地利),将处理好的组织样品切成70nm的切片,然后利用透射电镜能谱分析(tem-eds)测定萌发期棉花种子胚轴部位离子含量情况。结果见图4、图5、图6、图7。
中度盐胁迫s200培养条件下培养2天,不同品种胚轴细胞中离子含量差异明显;盐胁迫处理显著的增加了细胞中cl离子含量,j1020和ccri117胚轴细胞中cl离子含量分别增加了11.2倍和1.4倍;在清水和盐胁迫培养下,不同的品种的胚轴细胞中均未检测到na和k离子见表1,因此,胚轴中cl离子含量的累积是造成种子萌发受到抑制的主要因素。
表1不同培养条件下不同品种胚轴细胞中离子含量比较
2、盐胁迫处理下萌发期棉花种子cl离子流速测定
对棉花胚根中cl离子的累积动态变化进行检测,明确氯离子与棉花种子萌发期耐盐性的关系。检测步骤如下:
在旭月(北京)科技有限公司采用非损伤微测技术(nmt,bio-001a,youngerusasci.&tech.corp.,amherst,ma,usa)测定培养2天的种子中cl离子流速。选用在体组织为测定对象,选生长整齐的萌发期种子用去离子水冲洗干净,将其浸入10ml测试液中平衡15min,然后再转入新的10ml测试液中开始测试。测试液配方:0.5mmnacl、0.1mmkcl、0.1mmcacl2、0.1mmmgcl2、0.3mmmes、0.2mmna2so4、ph6.0。每处理测定5-8个样品,测试部位为萌发期种子胚根分生区(大约距根尖300μm处);测试持续7-10min(达到稳定状态),计算时舍弃前2-3min的数据。
采用nmt技术测定不同品种胚根中cl离子流,结果见图8。正常培养条件下,不同品种胚根中均有少量的cl离子外排(约100pmolcm-2s-1)现象,且品种间无显著差异;盐胁迫显著的增加了胚根中cl离子外排,j1020和ccri117的cl离子外排分别增加到945.9pmolcm-2s-1和1805.3pmolcm-2s-1。因此,ccri117萌发期较强的耐盐性,可能是在盐胁迫下具有较高的cl离子外排,从而降低了胚根中cl离子累积所造成的离子毒害作用。
本实施例中测定了不同盐胁迫下,棉花胚轴细胞中的离子类型及含量,进一步明确了cl离子与种子活力具有相关性;通过离子流可以反应离子的积累情况,使用非损伤微测技术测定cl离子流,发现耐盐性材料cl离子流高,因此,cl离子外排量可以作为反应盐胁迫下种子活力的指标。
实施例4棉花种子萌发期耐盐性测定
(1)供试样品与盐胁迫处理
以j1020为盐敏感对照和以ccri117为耐盐性对照,测定了7个耐盐性差异的品种在盐胁迫下的cl离子外排与vi的相关性。采用培养皿滤纸发芽法进行发芽实验。种子用10%的h2o2消毒10min,再用蒸馏水冲洗数次洗净,用清水冲洗后选取成熟饱满、大小一致的种子均匀播于发芽盒中;每盒50粒,每处理4个重复,置于光照/黑暗时长为16h/8h,温度为(28±2)℃/(20±2)℃、湿度80%的人工气候培养箱中进行萌发。
(2)离子流速测定
在旭月(北京)科技有限公司采用非损伤微测技术(nmt,bio-001a,youngerusasci.&tech.corp.,amherst,ma,usa)测定培养2天的在体的种子胚根中cl离子流速。
选用在体组织为测定对象,选生长整齐的萌发期种子用去离子水冲洗干净,将其浸入10ml测试液中平衡15min,然后再转入新的10ml测试液中开始测试。测试液配方:0.5mmnacl、0.1mmkcl、0.1mmcacl2、0.1mmmgcl2、0.3mmmes、0.2mmna2so4、ph6.0。每处理测定5-8个样品,测试部位为萌发期种子胚根分生区(大约距根尖300μm处);测试持续7-10min(达到稳定状态),计算时舍弃前2-3min的数据。
结果表明,盐胁迫下,不同品种间cl离子外排差异明显,见图9;其中,中棉所119(ccri119)和zhongmian9001(zm9001)的cl离子外排显著高于耐盐性对照ccri117,中棉所9a02(ccri9a02)和zhongmian9101(zm9101)的cl离子外排与耐盐性对照ccri117无明显差异;中棉所49(ccri49)和中棉所35(ccri35)的cl离子外排显著低于耐盐性对照ccri117,但其外排速率显著高于盐敏感对照j1020;棉花品种z0102的cl离子外排为725.9pmolcm-2s-1,其外排速率显著低于盐敏感对照j1020。随后,通过cl离子外排与vi的相关性分析发现,cl离子外排速率与vi呈显著的正相关,见图10。即盐胁迫下棉花品种的cl离子外排速率越高,其萌发期的耐盐性就越强,可以通过cl离子外排速率来评估萌发期的耐盐性,其准确率在85%以上(r2=0.8953)。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



