一种快速高效的芝麻毛状根遗传转化体系的建立方法与流程
 2021-01-06 18:01:08|
2021-01-06 18:01:08| 625|
625| 起点商标网
起点商标网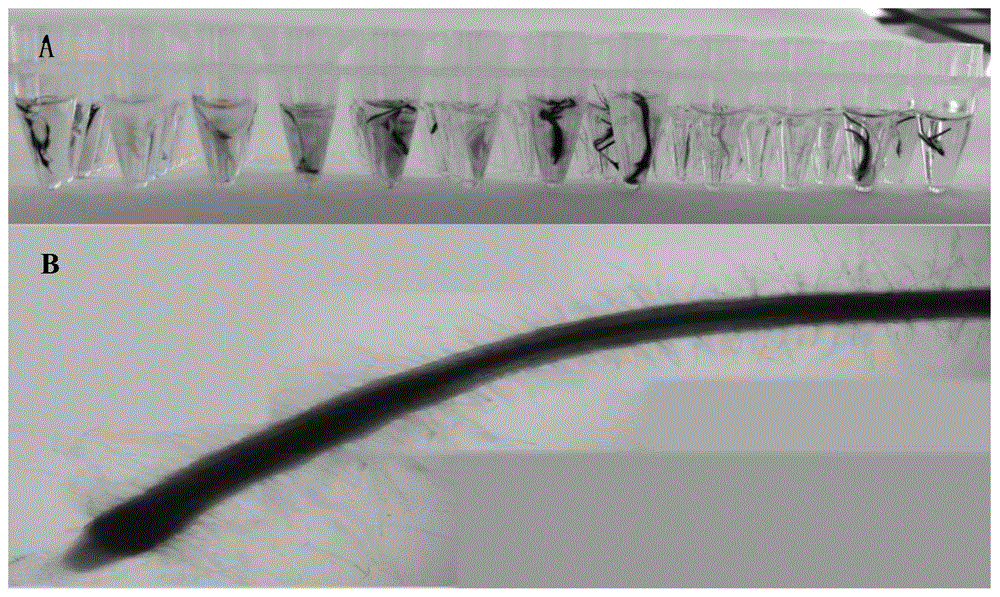
本发明属于农业生物技术领域,具体涉及一种快速高效的芝麻毛状根遗传转化体系的建立方法。
背景技术:
芝麻(sesamumindicuml.)属胡麻科,在世界许多热带和亚热带地区广泛栽培和利用的优质油料和特色经济作物,许多进化论工作者都认为芝麻是人类最古老的油料作物之一。芝麻在世界各地都有种植,主要生产国包括中国、印度、韩国、土耳其以及南美洲、拉丁美洲和非洲等国家。芝麻在我国栽培历史悠久,长达2100多年,其富含不饱和脂肪酸、维生素e、甾醇、芝麻素等功能保健物质,具有食用、保健、医药等多种用途,特别是小磨香油、芝麻酱深受我国消费者喜爱。
芝麻易受到一系列生物和非生物逆境的影响,从而影响作物的产量潜力,由于野生芝麻和栽培芝麻的杂交不亲和,所以想利用野生亲缘关系将理想性状导入栽培品种是非常困难的,通过现代植物育种改良作物是克服阻碍芝麻产量提升的重要手段之一。芝麻之所以很少受到生物技术和现代分子生物学领域的关注,部分原因是难以建立一个可靠的遗传转化体系。芝麻是一种难以再生的植物,在过去的40年里,人们一直致力于从不同的外植体来源获得再生的植株,包括成熟胚、未成熟胚、未成熟子叶、从种子中直接切下的子叶、从萌发的幼苗中切下的子叶、下胚轴、茎尖和根段等有不同程度的成功,但植株再生率都非常的低。此外,重要的是芝麻的成功再生植株是高度基因型依赖的,利用其它基因型很难进行重复。有关芝麻遗传转化的报道非常的少,且很少获得再生的转基因植株,转基因阳性率非常的低且不稳定。因此,当前急需构建一种高效的芝麻遗传转化体系为芝麻各类基因的功能验证提供技术支持。经文献查询,国内外尚没有芝麻毛状根培养体系建立相关的专利技术或非专利文献公开或使用。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种周期短,遗传转化率高,毛状根生长速度快的芝麻毛状根遗传转化体系建立方法。
本发明主要涉及利用芝麻无菌苗的子叶为外植体,利用发根农杆菌介导,建立芝麻毛状根培养体系的方法。
一种快速高效的芝麻毛状根遗传转化体系的建立方法,包括以下步骤:
(1)培养得到芝麻无菌苗;
(2)外植体转化
在无菌芝麻苗离体子叶上产生伤口,得到外植体,然后利用发根农杆菌菌液侵染,置于共培养基上共培养,发根农杆菌菌液的浓度为:od600为0.6-0.8;
(3)外植体抑菌及毛状根诱导
将上述共培养的外植体用含有抑菌剂的清洗培养基清洗,然后转入诱导生根和继代培养基上培养,诱导生根和继代培养基中添加有抑菌剂;
(4)芝麻毛状根继代增殖培养
将上述获得的诱导培养生长至12-14d的毛状根从子叶上切下,接种到诱导生根和继代培养基(和前述相同)上继续扩大培养。
按上述方案,步骤(1)为将芝麻种子预先灭菌处理,将灭菌后的芝麻种子接种到芝麻生长培养基上培养,所述的无菌芝麻种子生长培养基为:ms(nh4no31650mg/l+kno31900mg/l+cacl2·2h2o440mg/l+mgso4·7h2o370mg/l+kh2po4170mg/l+ki0.83mg/l+h3bo36.2mg/l+mnso4·4h2o22.3mg/l+znso4·7h2o8.6mg/l+na2moo4·2h2o0.25mg/l+cuso4·5h2o0.025mg/l+cocl2·6h2o0.025mg/l+na2edta37.25mg/l+feso4·7h2o27.85mg/l+肌醇100mg/l+甘氨酸2mg/l+盐酸硫胺素0.1mg/l+盐酸吡哆醇0.5mg/l+烟酸0.5mg/l)+蔗糖30g/l+琼脂8g/l+0.075%ppm,ph5.8培养基,培养条件28±2℃、16/8h(光照16h,黑暗8h)光周期培养,培养时间7-10d,获得芝麻的无菌苗。采用生长7-10d的芝麻无菌苗的子叶为外植体进行遗传转化,操作简单方便,可以避免外植体不易灭菌、灭菌不彻底带来的污染以及外植体易于获得,7-8d便可以从子叶柄伤口以及子叶伤口边缘诱导出毛状根,再生速度快。
按上述方案,步骤(2)中取培养7-10d的无菌芝麻苗子叶切2-3个伤口进行发根农杆菌菌液侵染,伤口大小5-10mm。
按上述方案,步骤(2)中发根农杆菌培养至od600值于1.1-1.8之间,之后用重悬培养基(ms液体培养基)重悬至od600值为0.6-0.8;或者培养至od600值为0.6-0.8直接用于子叶外植体的侵染。
按上述方案,步骤(2)中发根农杆菌为发根农杆菌k599。
按上述方案,步骤(2)的浸染时间为10-15min。
按上述方案,步骤(2)的共培养基为:1/10ms(nh4no3165mg/l+kno3190mg/l+cacl2·2h2o44mg/l+mgso4·7h2o37mg/l+kh2po417mg/l+ki0.83mg/l+h3bo36.2mg/l+mnso4·4h2o22.3mg/l+znso4·7h2o8.6mg/l+na2moo4·2h2o0.25mg/l+cuso4·5h2o0.025mg/l+cocl2·6h2o0.025mg/l+na2edta37.25mg/l+feso4·7h2o27.85mg/l+肌醇100mg/l+甘氨酸2mg/l+盐酸硫胺素0.1mg/l+盐酸吡哆醇0.5mg/l+烟酸0.5mg/l)+蔗糖30g/l+mes(吗啉乙磺酸)3.9g/l+琼脂8g/l+dtt(二硫苏糖醇)150mg/l+as(乙酰丁香酮)0.02g/l,ph5.4。
按上述方案,步骤(3)所述的清洗培养基清洗步骤为:用清洗培养基清洗3次,每次1min至培养基清澈,然后置于无菌滤纸上自然吹干至子叶表面无明显水分;所述的清洗培养基为ms+蔗糖30g/l+噻孢霉素200-250mg/l+羧苄青霉素200-250mg/l,ph5.8。
按上述方案,诱导生根和继代培养基为1/2ms(nh4no3825mg/l+kno3950mg/l+cacl2·2h2o220mg/l+mgso4·7h2o185mg/l+kh2po485mg/l+ki0.83mg/l+h3bo36.2mg/l+mnso4·4h2o22.3mg/l+znso4·7h2o8.6mg/l+na2moo4·2h2o0.25mg/l+cuso4·5h2o0.025mg/l+cocl2·6h2o0.025mg/l+na2edta37.25mg/l+feso4·7h2o27.85mg/l+肌醇100mg/l+甘氨酸2mg/l+盐酸硫胺素0.1mg/l+盐酸吡哆醇0.5mg/l+烟酸0.5mg/l)+蔗糖30g/l+mes0.6g/l+琼脂7g/l+特美汀200mg/l,ph5.8。
按上述方案,步骤(3)所述的培养条件为28±2℃、16/8h光周期条件下抑菌并诱导生根,培养7-8d后子叶上就能长出毛状根。
本发明以芝麻无菌苗子叶为外植体,通过对外源生长调节物质,各培养基的组成,子叶生长状态,共培养时间,菌液浓度,侵染时间,抑菌剂的加入等条件摸索研究,建立了利用发根农杆菌介导的快速高效的芝麻毛状根遗传转化体系,其可作为芝麻的一种遗传转化体系,将带有目的基因的发根农杆菌诱导产生的毛状根可用于特定基因或启动子等组件的功能研究,为芝麻转基因功能研究奠定了技术基础。
此转化方法具有很高的遗传转化率,周期短,毛状根生长速度快。从种子到形成毛状根最少只要16d的时间;遗传转化率高,pcr检测证明,3种外源空载体(pcambia1301s、pcambia1381z和pgreenii-0800-luc)所携带的目的基因已经整合进芝麻毛状根体内,遗传转化率为100%,荧光定量pcr检测证明毛状根外源基因表达阳性率为75%;毛状根生长速度快,7d就能增殖3-4倍。
本发明的有益效果:
1)以芝麻无菌苗子叶为外植体建立了芝麻毛状根遗传转化体系。
2)芝麻毛状根培养体系实施周期非常短,从芝麻种子至毛状根诱导产生仅需16d。
3)芝麻毛状根生长速度快,继代培养后7d就能增殖3-4倍。
4)可作为芝麻的一种遗传转化体系,将带有目的基因的发根农杆菌诱导产生的毛状根可用于特定基因或启动子等组件的功能研究。
附图说明:
附图1不同浓度菌液侵染子叶后毛状根诱导情况(a:od600<0.6;b:od600=0.6-0.8;c:od600>0.8);
附图2不同侵染时间侵染子叶后毛状根诱导情况(a:侵染5min;b:侵染10min;c:侵染15min;d:侵染20min;e:侵染25min;f:侵染30min);
附图3芝麻无菌苗子叶诱导毛状根;
附图4继代培养基上生长7d的芝麻毛状根(a:刚接种至继代培养基的毛状根;b:继代培养基上生长7d的毛状根);
附图5转基因毛状根gus染色示意图,a:少量毛状根于pcr板中gus染色结果;b:显微镜下根系gus染色图(20x);
附图6转基因毛状根pcr检测,m,dl2000marker;1,阳性对照(质粒dna);2,阴性对照(非转化芝麻根);3-22,转化的不同毛状根系(a:pcambia1301s;b:pcambia1381z;c:pgreenii-0800-luc);
附图7转基因毛状根荧光定量pcr检测(wt:非转基因根系对照;p1301-1至p1301-20:pcambia1301s载体转基因根系样品;pc-1至pc-20:pcambia1381z载体转基因根系样品;pg-1至pg-20:pgreenii-0800-luc载体转基因根系样品)。
具体实施方式:
1、芝麻无菌苗的获得
将芝麻种子预先灭菌处理,具体灭菌方法为:无菌水摇晃冲洗1min→70%-75%乙醇处理30s→无菌水冲洗1次→3%次氯酸钠处理8-10min→无菌水冲洗1次→无菌水冲洗3-5次,每次1min→种子置于无菌滤纸上自然吹干。将灭菌后的芝麻种子接种到ms+蔗糖30g/l+琼脂8g/l+0.075%ppm,ph5.8培养基上。培养条件为温度(28±2℃),光照强度1500-2000lux,光周期16h/8h,7-10d可获得芝麻无菌苗。
2、外植体转化
(1)外植体的准备
在超净工作台中,将芝麻无菌苗的子叶从幼苗上分离下来,再用解剖刀把子叶与子叶柄完全分离,然后在每个子叶上用解剖刀切出5mm左右的伤口2-3个,先把处理好的子叶摆在普通固体ms培养基(nh4no31650mg/l+kno31900mg/l+cacl2·2h2o440mg/l+mgso4·7h2o370mg/l+kh2po4170mg/l+ki0.83mg/l+h3bo36.2mg/l+mnso4·4h2o22.3mg/l+znso4·7h2o8.6mg/l+na2moo4·2h2o0.25mg/l+cuso4·5h2o0.025mg/l+cocl2·6h2o0.025mg/l+na2edta37.25mg/l+feso4·7h2o27.85mg/l+肌醇100mg/l+甘氨酸2mg/l+盐酸硫胺素0.1mg/l+盐酸吡哆醇0.5mg/l+烟酸0.5mg/l+蔗糖30g/l+琼脂7-8g/l,ph5.8)上保湿,等待用于农杆菌侵染。
(2)菌液浓度的确定
本发明所采用的发根农杆菌菌株为k599,将菌株划线培养在ty固体培养基(胰蛋白胨5g/l+酵母提取物3g/l+氯化钙10mmol/l+琼脂15g/l)上,28℃培养2-3d后,挑取单菌落接种到5mlty液体培养基中,200rpm,28℃振荡培养24h。取1ml菌液继续接种到200ml液体ty培养基中,200rpm,28℃振荡至菌液od600值分别为0.2、0.4、0.6、0.8及1.0时,侵染处理过的子叶外植体;或者将菌液培养过夜,当菌液od600值在1.1-1.8之间时,5000rpm离心10min沉淀菌体,然后用ms液体培养基(nh4no31650mg/l+kno31900mg/l+cacl2·2h2o440mg/l+mgso4·7h2o370mg/l+kh2po4170mg/l+ki0.83mg/l+h3bo36.2mg/l+mnso4·4h2o22.3mg/l+znso4·7h2o8.6mg/l+na2moo4·2h2o0.25mg/l+cuso4·5h2o0.025mg/l+cocl2·6h2o0.025mg/l+na2edta37.25mg/l+feso4·7h2o27.85mg/l+肌醇100mg/l+甘氨酸2mg/l+盐酸硫胺素0.1mg/l+盐酸吡哆醇0.5mg/l+烟酸0.5mg/l+蔗糖30g/l,ph5.8)重悬菌液od600值分别为0.2、0.4、0.6、0.8及1.0时,侵染处理过的子叶外植体。
实验发现,当菌液或者重悬菌液od600值为0.6-0.8时,外植体毛状根生根效率最高。因此od600的值为0.6-0.8的菌液或重悬菌液均可用于侵染。菌液浓度低于0.6或高于0.8,芝麻毛状根再生速度慢,菌液浓度大于0.8,外植体容易卷曲褐化死亡(图1);
(3)菌液侵染时间的确立
在确立号菌液浓度的基础上,将处理好的子叶放进准备好的菌液(od600的值为0.6-0.8),设置不同的侵染时间:5min、10min、15min、20min、25min及30min。结果表明,随着侵染时间的延长,子叶外植体卷曲的程度加深,子叶褐化的时间缩短,褐化的程度加深。生根效率随着侵染时间延长先提高后降低,在侵染10min为最佳,生根效率最高,可以保证每片子叶都能长出毛状根,效率为100%。因此确定10min为最佳的菌液侵染时间。侵染时间过短或过长,均不利于毛状根的发生效率(图2)。
(4)共培养时间的确立
将侵染10min的子叶取出,置于无菌滤纸上至子叶表面无多余菌液,然后放置在共培养基1/10ms(nh4no3165mg/l+kno3190mg/l+cacl2·2h2o44mg/l+mgso4·7h2o37mg/l+kh2po417mg/l+ki0.83mg/l+h3bo36.2mg/l+mnso4·4h2o22.3mg/l+znso4·7h2o8.6mg/l+na2moo4·2h2o0.25mg/l+cuso4·5h2o0.025mg/l+cocl2·6h2o0.025mg/l+na2edta37.25mg/l+feso4·7h2o27.85mg/l+肌醇100mg/l+甘氨酸2mg/l+盐酸硫胺素0.1mg/l+盐酸吡哆醇0.5mg/l+烟酸0.5mg/l)+蔗糖30g/l+mes3.9g/l+琼脂8g/l+dtt150mg/l+as0.02g/l,ph5.4上,设置不同的共培养时间:1d,2d,3d,4d及5d。共培养2-3d的毛状根生根效率最高,因此最佳的共培养时间为2-3d。共培养时间过长,发根农杆菌过度增殖,抑菌困难,且子叶外植体容易过度翻卷易褐化死亡,不利于诱导毛状根的产生。
(5)外植体的抑菌
将共培养3d的外植体转入清洗培养基ms(nh4no31650mg/l+kno31900mg/l+cacl2·2h2o440mg/l+mgso4·7h2o370mg/l+kh2po4170mg/l+ki0.83mg/l+h3bo36.2mg/l+mnso4·4h2o22.3mg/l+znso4·7h2o8.6mg/l+na2moo4·2h2o0.25mg/l+cuso4·5h2o0.025mg/l+cocl2·6h2o0.025mg/l+na2edta37.25mg/l+feso4·7h2o27.85mg/l+肌醇100mg/l+甘氨酸2mg/l+盐酸硫胺素0.1mg/l+盐酸吡哆醇0.5mg/l+烟酸0.5mg/l)+蔗糖30g/l+噻孢霉素200-250mg/l+羧苄青霉素200-250mg/l,ph5.8中,清洗3次,每次1min至培养基清澈,然后置于无菌滤纸上,自然吹干至子叶表面无明显水分后置于诱导生根和继代培养基1/2ms(nh4no3825mg/l+kno3950mg/l+cacl2·2h2o220mg/l+mgso4·7h2o185mg/l+kh2po485mg/l+ki0.83mg/l+h3bo36.2mg/l+mnso4·4h2o22.3mg/l+znso4·7h2o8.6mg/l+na2moo4·2h2o0.25mg/l+cuso4·5h2o0.025mg/l+cocl2·6h2o0.025mg/l+na2edta37.25mg/l+feso4·7h2o27.85mg/l+肌醇100mg/l+甘氨酸2mg/l+盐酸硫胺素0.1mg/l+盐酸吡哆醇0.5mg/l+烟酸0.5mg/l)+蔗糖30g/l+mes0.6g/l+琼脂7g/l,ph5.8上,同时添加抑菌剂,抑菌剂具体分别采用了噻孢霉素、羧苄青霉素、特美汀和ppm,发现单独或者一起使用噻孢霉素、羧苄青霉素对毛状根的诱导和生长有抑制作用;而低浓度ppm(0.075%)不足以抑制农杆菌,而高于0.075%浓度的ppm对毛状根的诱导和生长也同样具有抑制作用,而200mg/l的特美汀不但抑菌效果好,而且毛状根的生长和诱导未受影响,因此本发明在诱导生根和继代培养基中采用了特美汀作为农杆菌抑菌剂,工作浓度为200mg/l。
3、芝麻毛状根诱导及继代增殖培养
将外植体转入诱导生根和继代培养基,7-8d后,于子叶与子叶柄伤口以及子叶伤口部位都会有毛状根出现(图3)。将上述获得的诱导培养生长至12-14d的毛状根从子叶上切下,接种到诱导生根和继代培养基上继续扩大培养,继代培养7d后,毛状根大量生长且分枝多,能增殖3-4倍(图4)。
4、芝麻毛状根gus染色、pcr及荧光定量pcr检测
在继代培养基上生长一段时间后,将获得的毛状根进行gus染色(含pcambia1301s载体的转基因系)、pcr以及荧光定量pcr检测,将含pcambia1301s载体的转基因毛状根系进行gus染色结果表明,转基因毛状根gus染色阳性率为25%(图5),阳性根系的整个根系(根冠部位除外)都能被染色;pcr检测(pcambia1301s和pcambia1381z载体采用gus基因序列通用引物:f:5’-gtcgcgcaagactgtaacca-3’,r:5’-cggcgaaattccatacctg-3’,产物1081bp;pgreenii-0800-luc载体采用kanr基因序列引物:f:5’-ccgaggcagttccata-3’,r:5’-gcaatcaggtgcgaca-3’,产物609bp)结果表明,含有3种空载体的发根农杆菌所携带的质粒基因已经整合进芝麻毛状根体内(图6),遗传转化率为100%;3种载体的转基因毛状根系的荧光定量pcr检测(pcambia1301s载体采用gus基因序列设计定量引物:f:5’-gattatcatcaccgaatacg-3’,r:5’-gatactcttcactccacat-3’;pcambia1381z载体采用kanr基因序列设计定量引物:f:5’-gatatgtcgatggagtga-3’,r:5’-ggaagagtatgaagatgaac-3’;pgreenii-0800-luc载体采用rluc基因序列设计定量引物:f:5’-ttcgtcgtccaacattatc-3’,r:5’-gcaccttcaacaatagca-3’。)结果都表明,转基因毛状根转录表达阳性率为75%(图7)。
本发明上述所使用的培养基都是按照常规的灭菌方法处理的,高温高压(121℃,1.5个大气压)灭菌20min后使用的。
本发明的培养室是在常规的芝麻组织培养室(温度28℃左右,光照1000-1500lux,光/暗周期16h/8h,湿度70%左右)中进行的。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



