CD8+抑制性T细胞在免疫调节中的应用及诱导方法与流程
 2021-01-08 12:01:05|
2021-01-08 12:01:05| 394|
394| 起点商标网
起点商标网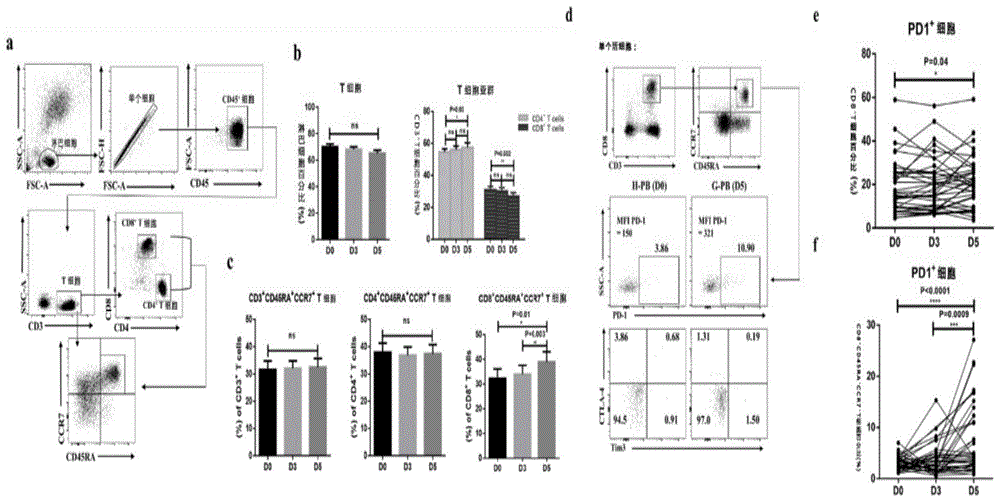
本发明涉及免疫学技术领域,尤其涉及cd8+抑制性t细胞在免疫调节中的应用及诱导方法。
背景技术:
异基因造血干细胞移植(allo-hct)是治疗血液病的有效治疗手段,但是急性移植物抗宿主反应(agvhd)仍然是all-hct主要的威胁生命的并发症。gvhd的发生是由于移植物中供者t细胞将受者的组织识别为异己,从而扩增并导致受者的组织损伤。将供者移植物中的t细胞去除可以减少gvhd的发生,但是这会提高肿瘤复发,移植失败和机会性感染的发生机率。免疫抑制药物也常用于治疗gvhd,然而也带来药物相关的毒性作用,以及死亡和感染的问题。故而,将供者移植物中的供者t细胞保留并通过调节t细胞免疫生物学功能达到异基因移植免疫耐受而不影响移植物抗白血病gvl效应仍然是一个临床和基础研究的长期目标。
粒细胞集落刺激因子(g-csf)通常被临床用来动员供者骨髓造血干细胞。国内外的研究证据表明,g-csf可诱导具有免疫调节作用的tr1、mdscs和浆细胞样dc细胞等;我们之前研究发现,g-csf使骨髓中初始t细胞上的cd62l,cd54等下调,但g-csf对cd8+t细胞功能的诱导作用尚未可知。
技术实现要素:
本发明的第一个目的在于,提供cd8+抑制性t细胞在制备治疗急性gvhd和诊断造血干细胞移植预后药物中的应用。
本发明的第二个目的在于,提供g-csf在体内外诱导cd8+抑制性t细胞中的应用。
本发明的第三个目的在于,提供一种cd8+抑制性t细胞中pd-1+上调的方法。
为了实现上述第一个目的,本发明提供了cd8+抑制性t细胞在制备治疗急性gvhd和诊断造血干细胞移植预后药物中的应用,所述cd8+抑制性t细胞功能特征为pd-1+。cd8+pd-1+亚群可减轻供者t细胞引发的gvhd,具有免疫调节作用,介导异基因移植耐受。
作为一个优选方案,所述cd8+抑制性t细胞共同表面特征为cd45ra+ccr7+。
为了实现上述第二个目的,本发明提供了g-csf在体内外诱导cd8+抑制性t细胞中的应用,所述cd8+抑制性t细胞功能特征为pd-1+。
作为一个优选方案,所述cd8+抑制性t细胞共同表面特征为cd45ra+ccr7+。
体内注射g-csf后,可选择性在供者外周血诱导一群cd8+tpd-1+细胞,此类细胞具有治疗agvhd和预测异基因造血干细胞预后的结果,此类细胞特征还包括cd45ra+ccr7+。临床队列研究显示g-csf诱导的供者外周pd-1+cd8+cd45ra+ccr7+t细胞的比例不低于4.15%,造血干细胞移植预后作用相关。
为了实现上述第三个目的,本发明提供了一种cd8+抑制性t细胞中pd-1+上调的方法,通过g-csf诱导供者外周血细胞。
作为一个优选方案,连续诱导5天。
本发明的优点在于,我们体内外的研究结果首次发现g-csf处理后cd8+t细胞亚群上pd-1表达选择性地升高,供者cd8+cd45ra+ccr7+t细胞的pd-1+亚群具有免疫抑制的功能,可诱导免疫耐受。该群细胞比例的高低与受者agvhd的发生有关,说明pd-1+cd8+cd45ra+ccr7+t细胞可能是供者外周血中可用于防治agvhd的细胞亚群以及预测预后的生物标记物,可作为一个生物标记用来鉴别合适的供者从而减少gvhd以及诱导all-hct的免疫耐受。
附图说明
图1.g-csf动员后健康供者体内pd-1+cd8+t细胞亚群的选择性扩增。
图2.g-csf处理前后cd8+cd45ra+ccr7+t细胞的pd-1+亚群和pd-1-亚群的表型变化。
图3.g-csf处理前后cd8+cd45ra+ccr7+t细胞pd-1+和pd-1-亚群的功能变化。
图4.在鼠类gvhd模型中,g-csf的免疫调节功能在敲除pd-1cd8+cd44-cd62l+t细胞移植物中取消了。
具体实施方式
以下,结合具体实施方式对本发明的技术进行详细描述。应当知道的是,以下具体实施方式仅用于帮助本领域技术人员理解本发明,而非对本发明的限制。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
实施例
材料和方法
小鼠
雌性c57bl/6(b6,h-2kbcd45.2+)和balb/c(h-2kdcd45.2+)小鼠(slac,中国上海)在上海交通大学医学院动物科学实验室的无特定病原体的环境中饲养繁殖。小鼠在8至12周龄之间使用。pd1敲除(pd1-/-)的小鼠(c57bl/6背景)由剑桥大学刘彭涛博士提供。所有动物实验均按照上海交通大学医学院实验动物管理委员会(iacuc)批准的方案进行。
健康供者外周血样本
所有纳入研究的健康供者均来自于2018年1月至2019年10月瑞金医院接受了半相合或者是hla配型的造血干细胞移植患者的相关供者。来自39个供者的外周血(pb,edta管内10ml)取自重组人g-csf(rhg-csf)(filgrastim,kirin,japan;)处理的之前和之后的第3和第5天。在健康志愿者知情同意下收集了外周血进行体外培养。外周血用rbc裂解缓冲液(ebioscience)进行处理,用以流式细胞仪表面标志物分析。使用标准密度梯度离心法从白膜中分离得到外周血单核细胞(pbmc),用于细胞内细胞因子染色和体外测定。根据赫尔辛基宣言,该研究已由瑞金医院伦理委员会批准,并且所有受试者进入研究前均已签署知情同意书。
移植过程和gvhd管理
供者在移植前注射重组人g-csf,每天5μg/kg,连续注射5天。移植物来自配型的半相合的供者。
agvhd的诊断依据是glucksberg-seattle标准,胃肠道agvhd依据结肠镜和组织活检诊断。agvhd治疗的完全缓解(cr)根据已出版的标准进行鉴定。
流式细胞术
免疫荧光标记的抗小鼠抗体和同型对照抗体购买于biolegend,bdbiosciencesorebioscience。为确定最适浓度,所有试剂在使用前已被滴定。测量表面标志物表达量时,将细胞在室温下培养20分钟。分析细胞内细胞因子时,用rpmi-1640培养基、10%fbs和细胞激活混合剂(包含蛋白转运抑制剂)培养细胞4小时。随后根据说明使用cytofix/cytopermkit(bdbiosciences)进行细胞表面染色、穿膜。细胞内分子在室温下染色30分钟。利用死活细胞鉴定染料(ebioscience)去除死细胞。对于综合多色分析,利用compbeads(bdbiosciences)和单一染色进行补偿的调节。数据获取于lsrfortessa(bdbiosciences),并用flowjov10进行分析。
体外rhg-csf诱导制备cd8+抑制性t细胞
1、用密度梯度离心将pbmc从外周血样本中分离pbmc。
2、pbmc以5x105/ml的浓度种于96孔板中,培养液为rpmi1640培养基、10%fbs或g-csf注射前/注射后5天的健康供者的20%血浆。
3、加入0,100或500ng/mlrhg-csf,5%co2and95%空气下培养12或36小时。培养后,收集细胞进行计数,并测量t细胞亚群上pd-1的表达量。将以上细胞和cd45-af700,cd3-apc/fire750,cd4-buv496,cd8-buv395,cd45ra-bv510,ccr7-apc,pd-1-pe-cy7抗人抗体(,biolegendorbdbiosciences)在室温下避光培养20分钟,之后进行流式分析。
多元细胞因子的检测
在健康供者rhg-csf注射后3天和5天分别提取血浆。使用多元试验系统(bio-plexprohumancytokinegrpⅰpanel27-plex)分析27种不同的细胞因子,并用bio-plexmagpixsystem(bio-rad)进行定量分析。
小鼠体内rhg-csf诱导制备cd8+抑制性t细胞
向野生型和pd1-/-b6小鼠经皮注射盐水稀释的125μg/kgrhg-csf(filgrastim,kirin,japan),每天2次,共7天。在第3和第6天,进行血常规检测,监测外周血中的白细胞计数。注射后第7天,将小鼠处死,计数外周血白细胞、骨髓细胞和脾细胞。将外周血细胞和脾细胞用cd3-apc-cy7,cd4-pe-cy7,cd8-percp-cy5.5,cd44-fitc,cd62l-pe,pd-1-apc抗小鼠抗体(ebioscienceorbdbiosciences)在室温下染色20分钟,并用流式细胞仪进行分析。
gvhd模型
在前一天用rs2000prox-ray(radsourcetechnologies,inc.,usa)8gy照射balb/c小鼠,分次完成,每次间隔4小时。第0天,给balb/c受者小鼠静脉注射①wtb6供者小鼠提取的5x106t细胞去除的骨髓细胞(t-celldeletedbonemarrow,tcd-bm)②5x105rhg-csf处理的wtb6小鼠提取出的cd8+cd44-cd62l+脾脏t细胞③5x105rhg-csf处理的pd-1-/-b6小鼠提取出的cd8+cd44-cd62l+脾脏t细胞。根据厂商的实验方案,tcd-bm和脾脏cd8+cd44-cd62l+t细胞是分别通过anti-cd90.2microbeads和cd8+未致敏tcells分离kit(miltenyibiotec)被分离的。
gvhd评级和组织病理分析
在进行细胞移植后,小鼠每两天称量一次体重,并根据临床评分系统进行系统性地gvhd评分,评分包含5个参数,分别是体重丢失、姿势、活动性、皮毛皱褶程度和皮肤完整性。对于组织病理分析,来自受体小鼠gvhd靶向器官(肝、肺、小肠、结肠、皮肤)的组织和脾脏切片先被4%多聚甲醛固定,后在石蜡中包埋、切割,固定在玻片上,再进行he染色。两组的器官由一位病理学家根据临床评分系统进行打分。
免疫荧光
在移植后,gvhd发生时,取得了受体小鼠的肺、肝、小肠组织。用4um厚的福尔马林固定、经石蜡包埋,再用一抗、neon-tsakit(d110041-20t,yuanxibio)、dapi进行染色。具体来说,去石蜡的切片用兔抗鼠cd8抗体在室温下培养1小时,再用羊抗兔hrp(horseradishperoxidase)共轭的二抗培养10分钟。之后再用neon-tsa570标记切片10分钟,用tbst缓冲溶液冲洗。随后,将切片转移到预热(90℃)的柠檬酸盐溶液中,用20%最大力度微波加热15分钟,再在相同溶液中冷却到室温。兔抗鼠pd-1抗体(84651s,cst)/neon-tsa520染色也采用相同步骤。dapi用来染细胞核。图像通过leicatcssp8共焦显微镜获取。
数据统计
两组数据的统计学比较是通过非参数非配对mann-whitneyu检验来表现。用log-rank检验来进行生存分析。对于正态分布值,使用的是pearson相关性分析。所有图表中的数据用平均值±标准差来表示,且p值<0.05表示统计学上存在差异。数据分析软件是graphpadprism6.0。
结果
g-csf诱导制备健康供者外周血中cd8+pd-1+cd45ra+ccr7+抑制性t细胞
我们通过流式细胞仪分析pd-1+细胞的频率和平均荧光强度升高(mfi)(图1a)。cd8+cd45ra+ccr7+t细胞亚群在cd8+t细胞中数量显著上升(图1c)。g-csf诱导后,cd8+细胞中pd-1+细胞的比例上升(图1e)。与day0(p<0.0001)和day3(p<0.009)相比,day5,cd8+cd45ra+ccr7+t细胞亚群中pd-1+细胞频率显著上升(图1d,f)。
传统认为人初始t细胞的标记为cd45ra+ccr7+,但越来越多的证据表明“初始t细胞”的表型、功能和分化阶段具有异质性。cd45ra+ccr7+t细胞中包括调节性t细胞、干细胞记忆性t细胞(tscm)和其他具有初始表型的记忆性t细胞。供者来源的tscm选择性富集于半相合hsct之后不久且与gvhd发生有关,我们发现pd-1+细胞的频率在cd95+tscm中显著高于在cd95-tn中的(d0:11.7%(4.93%-33.80%)vs.1.52%(0.55%-6.21%);d5:18.1%(6.90%-44.80%)vs.2.74%(0.98%-14.80%))。pd-1+细胞在cd95+tscm(p=0.04)和cd95-tn(p=0.007)中的频率在g-csf动员后增加(supplementalfigure3c)。
供者外周血中的cd8+cd45ra+ccr7+t细胞中pd-1+亚群的生物学特征分析
为了鉴定g-csf诱导的外周cd8+cd45ra+ccr7+t细胞中独特的pd-1+亚群的特性,我们进一步分析了g-csf动员前后pd-1+cd8+cd45ra+ccr7+t细胞(pd-1+亚群)的表型,并与同一样本中pd-1-cd8+cd45ra+ccr7+t细胞(pd-1-亚群)相比较。
g-csf诱导后,cd103、cd69、cd49d和cxcr3两种黏附分子在pd-1+亚群中显著下调,而在pd-1-亚群中则保持了稳定(图2a,b)。同时,cd69的mfi在pd-1+亚群中下降,在pd-1+亚群中cd39和cd73两种胞外酶的mfi显著高于pd-1-亚群。
因此,cd8+cd45ra+ccr7+t细胞中的pd-1+亚群相比于pd-1-亚群下调了黏附分子和趋化分子受体,具有潜在的免疫抑制。
g-csf诱导后,供者外周血cd8+cd45ra+ccr7+t细胞中的pd-1+亚群具有免疫抑制功能
在研究了cd8+cd45ra+ccr7+t细胞中的pd-1+亚群的表型之后,我们接着分析了它们在g-csf注射前后的细胞功能。我们通过流式细胞计数检测pd-1+和pd-1-亚群的脱颗粒标志cd107a、细胞内穿孔素和颗粒酶b在g-csf注射前后的表达,测试了它们的细胞毒性潜能。在g-csf注射前后,pd-1+亚群中表达cd107a、穿孔素和颗粒酶b的细胞频率均显著高于pd-1-亚群。然而,g-csf治疗对pd-1+或pd-1-亚群的细胞毒性都没有显著影响(图3a,b)。
敲除pd-1的cd8+t细胞抗gvhd的免疫抑制功能消失
利用磁珠分选小鼠cd8+cd44-cd62l+t细胞。之后将分选自野生型b6供体的5×106去除t细胞的骨髓(tcd-bm)与5×105cd8+cd44-cd62l+细胞混合,经辐照balb/c受体进行作为移植物静脉注射,建立同种异体agvhd模型(图4a,b)。通过测定外周血h2kb+细胞频率,所有受体都确认在移植后达到完全供体嵌合体。结果只接受了b6tcd-bm的balc/c小鼠没有发生gvhd,而同时绝大部分接受b6供体tcd-bm+cd8+cd44-cd62l+t细胞的balc/c小鼠均死于gvhd(图4c)。与之相反,g-csf诱导得到cd8+pd1+t细胞则阻止了t细胞受体发生gvhd,其中约85%未发生致死性gvhd并得以存活(图4c)。我们的结果表明cd8+pd1+cd44-cd62l+t细胞亚群有着免疫调控作用。反之,g-csf诱导pd-1敲除小鼠的cd8+cd44-cd62l+t细胞作为供体移植物时,balc/c受体则会在移植后发展出更为严重的gvhd(图4c),并伴有更多的体重减轻(图4d)和更高的临床评分(图4e)。
我们在移植47天之后对gvhd靶器官(肝、小肠、结肠)进行了免疫荧光显微检查。在pd-1-/-组中,小肠绝大部分cd8+t细胞不表达pd-1,同时在野生型中大量的cd8+t细胞表达pd-1(图4f)。平行的两种情况也在结肠(图4a)和肝(图4b)中出现。与免疫荧光结果共存的是,组织学检测显示,更多pd-1+cd8+t亚群细胞的野生型小鼠gvhd靶器官也表现出相对低的病例损害(图4g)。此外,其他器官如肺和脾的损伤同样是pd-1-/-组比wt组更严重。
因此,我们的数据说明g-csf诱导的cd8+pd1+t细胞具有抑制作用,可在异基因造血干细胞移植中发挥其免疫调控功能,外周诱导的cd8+pd1+t细胞作为一种新的细胞学生物标志,可用于治疗急性gvhd和诊断造血干细胞移植预后预测。
g-csf可调整t细胞功能以抑制异体造血干细胞移植中移植物抗宿主病(gvhd)的发生并保持移植物抗白血病效果(gvl)。虽然已有证据表明g-csf作用后供者t细胞会发生表型与功能的改变,但agvhd中g-csf对于t细胞亚群的具体作用未知。本次研究中,我们证明了在体内外g-csf使得供者外周血中cd8+cd45ra+ccr7+t细胞上pd-1表达上升。除此之外,在gvhd小鼠模型和临床样本中,上升的pd-1+的t细胞亚群使得agvhd反应减弱。
我们的研究表明在g-csf动员后,供者外周cd8+t细胞,特别是cd8+cd45ra+ccr7+t细胞,存在pd-1表达的上调。通过分别分析未刺激骨髓与g-csf刺激后骨髓中pd-1+细胞在cd8+t细胞中占比,发现两者相似,这意味着g-csf的免疫调节作用机制在骨髓和外周血中不同。进一步的证据表明,cd45ra+ccr7+t细胞,即
pd-1在cd8+cd45ra+ccr7+t细胞上表达上调与agvhd发生的临床关联性已在小鼠gvhd模型和临床研究中被证实。之前的研究表明人cd8+t细胞中的cd45ra+ccr7+亚群与小鼠中cd8+cd44-cd62l+t细胞群代表着同样的细胞组成。g-csf处理后小鼠的脾脏细胞有一个与人类相似的模式改变:分泌的th2型细胞因子(如il-4)增加,th1型细胞因子(如ifn-γ)下降。因此,我们用rh-g-csf处理供体小鼠,模拟临床对健康供体进行g-csf动员的作用,发现pd-1在脾脏cd8+cd44-cd62l+t细胞上中表达升高,这与我们的人体数据一致。我们的结果表明,供体cd8+cd44-cd62l+t细胞可在mhc非匹配的同种异体移植中可诱导gvhd,而在供者体内用g-csf预处理t细胞移植物可逆转gvhd。然而,在使用g-csf处理来自pd-1-/-小鼠的cd8+cd44-cd62l+t细胞移植物时,g-csf失去了自身的减轻gvhd严重程度的免疫调节作用,。在g-csf动员5天后,若供体外周血cd8+cd45ra+ccr7+t细胞上pd-1表达水平较高,则受者agvhd发生率较低,这也提示了这些发现的临床相关性。由于我们的研究涉及的供体相对较少,因此需要更大规模的研究来确定g-csf诱导后cd8+cd45ra+ccr7+t细胞上pd-1的表达对agvhd发生的影响。此外,我们发现即使在接受相同剂量和处理时间后,pd-1在部分供者中显著上升,而其他供者则相对稳定,这表明健康的供者有不同的g-csf反应性,这种反应性可通过外周t细胞上pd-1的表达量来评估。供体g-csf反应性似乎是影响患者造血重建和移植预后的重要因素。在这方面,pd-1对g-csf动员的反应程度可能是指导选择最佳供体和替代动员剂的潜在指标。
综上所述,体内外的供者外周cd8+cd45ra+ccr7+t细胞上pd-1的表达上升受g-csf刺激,这可能有助于异体造血干细胞移植移植后agvhd的缓和。因此,pd-1的表达,作为一种新的生物标志,其临床的意义将使得供者移植物移植前处理的新的策略得到发展,并在未来可能为预防和治疗agvhd提供新的方法。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



