用于治疗哮喘或变应性疾病的方法与流程
 2021-01-08 11:01:31|
2021-01-08 11:01:31| 254|
254| 起点商标网
起点商标网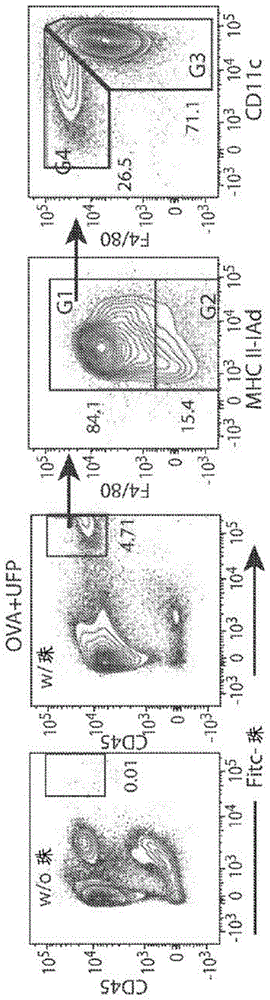
相关申请的交叉引用
根据35u.s.c.§119(e),本国际申请要求2018年3月15日提交的美国临时申请no.62/643,476、2018年4月4日提交的u.s.62/652,630以及2018年4月18日提交的u.s.62/659,379的权益,以引用的方式将其各自内容整体并入本文。
政府支持
本发明是在由美国国立卫生研究院授予的基金号2r01ai065617和r01ai115699的政府支持下完成的。美国政府对本发明享有一定的权利。
背景技术:
暴露至与交通相关的颗粒物(pm)促进哮喘和变应性疾病。然而,pm暴露对这些作用进行介导的确切细胞分子机制尚不清楚。对于开发治疗或预防哮喘和变应性疾病的治疗剂来说,理解对由环境超细颗粒(ufp)诱导的变应性气道炎症的增强而言至关重要的细胞靶标和信号传导途径是必需的。
技术实现要素:
本文所述的发明部分地涉及如下发现:超细颗粒通过促进肺泡巨噬细胞和变应原特异性t细胞之间的jag1-notch4依赖性相互作用而加重变应性气道炎症,导致增强的th细胞分化。因此,本文所述发明的一个方面提供了用于治疗哮喘或变应性疾病的方法,所述方法包括向患有哮喘或变应性疾病的受试者给予有效量的抑制notch4的试剂。
本文所述发明的另一方面提供了用于治疗哮喘或变应性疾病的方法,所述方法包括:(a)对患有哮喘或变应性疾病的受试者进行鉴别;以及(b)向受试者给予有效量的抑制notch4的试剂。
本文所述发明的另一方面提供了用于治疗哮喘或变应性疾病的组合物,所述组合物包含抑制notch4的试剂和药学上可接受的载体。在任何方面的一个实施方式中,将所述组合物配制成用于吸入给予。
在任何方面的一个实施方式中,所述哮喘选自于由如下组成的清单:变应性哮喘、无变应性哮喘、阿司匹林加重性呼吸系统疾病、运动诱发的哮喘、咳嗽变异性哮喘和职业性哮喘。
在任何方面的一个实施方式中,所述变应性疾病选自于由如下组成的清单:变应性鼻炎、鼻窦炎、中耳炎、特应性皮炎、荨麻疹、血管性水肿和过敏性反应。
在任何方面的一个实施方式中,所述抑制notch4的试剂选自于由如下组成的组:小分子、抗体、肽、基因组编辑系统、反义寡核苷酸和rnai。
在任何方面的一个实施方式中,所述抗体是人源化抗体。
在任何方面的一个实施方式中,所述rnai是微小rna、sirna或shrna。
在任何方面的一个实施方式中,抑制notch4是对notch4的表达水平和/或活性进行抑制。在任何方面的一个实施方式中,与适当的对照相比,notch4的表达水平和/或活性被抑制至少50%、至少60%、至少70%、至少80%、至少90%或更多。
在任何方面的一个实施方式中,在调节性t细胞上对notch4进行抑制。
在任何方面的一个实施方式中,所述方法进一步包括给予至少一种额外的抗哮喘治疗剂。在任何方面的一个实施方式中,所述方法进一步包括给予至少一种额外的抗变应性疾病治疗剂。
本文所述发明的一个方面提供了用于预防哮喘或变应性疾病的方法,所述方法包括向处于患哮喘或变应性疾病的风险的受试者给予抑制notch4的试剂。在任何方面的一个实施方式中,所述方法进一步包括,在给予之前,对处于患哮喘或变应性疾病的风险的受试者进行鉴别。
本文所述发明的另一方面提供了用于对处于患哮喘或变应性疾病的风险的受试者进行鉴别的方法,所述方法包括:(a)从所述受试者获得生物样品;(b)对生物样品中的notch4的水平进行测量,其中,如果notch的水平与参比水平相比增加,则所述受试者处于患哮喘或变应性疾病的风险;以及(c)向处于风险的受试者给予抑制notch4的试剂。
在任何方面的一个实施方式中,与参比水平相比,notch4的水平增加至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍或更多。
本文所述发明的一个方面提供了在经诊断患有哮喘或变应性疾病的受试者的治疗中对治疗剂的功效进行确定的方法,所述方法包括:(a)在给予治疗剂之前,确定由经诊断患有哮喘或变应性疾病的受试者提供的样品中的notch4表达或活性的第一水平;(b)在给予治疗剂之后,确定由患者提供的样品中的notch4表达或活性的第二水平;以及(c)对notch4表达或活性的所述第一水平和第二水平进行比较,其中,如果notch4表达或活性的所述第二水平低于所述第一水平,则认为所述治疗剂是有效的,并且其中,如果notch4表达的所述第二水平与所述第一水平相同或高于所述第一水平,则认为在(b)中给予的所述治疗剂是无效的。在一个实施方式中,所述治疗剂是抑制notch4的试剂。
定义
为了方便起见,下文提供了在说明书、实施例和所附的权利要求中所使用的一些术语和短语的含义。除非另有说明、或上下文中有所暗示,以下术语和短语包括下文提供的含义。提供所述定义来帮助对具体实施方式进行描述,而并非旨在限制要求保护的技术,这是因为该技术的范围仅由权利要求书限定。除非另有定义,否则本文所使用的所有技术术语和科学术语具有与本技术所属技术领域中的普通技术人员通常理解的含义相同的含义。如果术语在本领域中的使用和本文所提供的定义之间存在明显差异,应以本说明书中所提供的定义为准。
本文所使用的术语“治疗(treat/treatment/treating)”或“减轻(amelioration)”是指治疗剂治疗,其中,目的是逆转、缓解、减轻、抑制、减缓或停止与哮喘或变应性疾病相关的病症的进展或严重程度。术语“治疗”包括降低或缓解哮喘或变应性疾病(例如气道发炎)的至少一种不利影响或症状。如果一种或多种症状或临床标记物减少,则治疗通常是“有效”的。或者,如果疾病的进展减弱或停止,则治疗是“有效”的。也就是说,“治疗”不仅包括症状或标记物的改善,还包括与不存在治疗时所预期的情况相比症状的进展或恶化中止或至少减缓。有益或期望的临床结果(无论可测定或不可测定)包括但不限于:缓解一种或多种症状、减小疾病程度、稳定疾病状态(即,不恶化)、延迟或减缓疾病进展、减轻或减缓疾病状态、缓和(部分或全部)、和/或减少死亡率。术语“治疗”疾病还包括提供疾病的症状或副作用的舒解(包括姑息治疗)。
本文所使用的“预防(preventing/prevention)”是指由于该方法学的作用而未发生疾病状态或障碍(例如哮喘或变应性疾病)的任何方法学(例如本文所述的抑制nocth4的试剂或组合物的给予)。一方面,可理解的是,预防还可意味着疾病的确立未达到未经处理的对照中发生的程度。例如,相对于未经处理的对照,在疾病频率的确立方面可存在5%、10%、15%、20%、25%、30%、35%、40%、50%、60%、70%、80%、90%或100%的减少。因此,疾病的预防涵盖相对于未经处理的受试者(例如未经本文所述的含有微生物菌群的组合物处理的受试者),受试者发展出疾病的可能性减少。
本文所使用的术语“给予/给药(administering)”是指通过使得试剂至少部分递送至受试者的方法或途径将本文所公开的治疗剂(例如抑制notch4的试剂)或药物组合物置于受试者中。可通过在受试者中产生有效治疗的任何适当的途径给予含有本文所公开的试剂的药物组合物。
本文所使用的“受试者”是指人或动物。通常,所述动物为脊椎动物,如灵长类动物、啮齿动物、家养动物或狩猎动物(gameanimal)。灵长类动物包括例如黑猩猩、食蟹猴、蜘蛛猴和猕猴(如恒河猴)。啮齿动物包括例如小鼠、大鼠、旱獭(woodchucks)、雪貂(ferrets)、兔和仓鼠。家养动物和狩猎动物包括例如牛(cows)、马、猪、鹿、野牛、水牛、猫科物种(如家猫)、犬科物种(如狗、狐狸、狼)、鸟类(如鸡、鸸鹋、鸵鸟)和鱼类(如鳟鱼(trout)、鲶鱼和鲑鱼)。在一些实施方式中,所述受试者是哺乳动物,例如灵长类动物、如人类。术语“个体”、“患者”和“受试者”在本文中可互换使用。
优选地,所述受试者是哺乳动物。所述哺乳动物可以是人、非人灵长类动物、小鼠、大鼠、狗、猫、马或牛,但不限于这些实例。除人以外的哺乳动物可有利地用作代表疾病(例如哮喘或变应性疾病)的动物模型的受试者。受试者可为雄性或雌性。受试者可为儿童(例如,小于18岁)或成年人(例如,大于18岁)。
受试者可为先前已被诊断为患有或鉴别为遭受或患有需要治疗的疾病或障碍(例如,哮喘或变应性疾病)、或与此类疾病或障碍相关的一种或多种并发症、并任选地已经经历对疾病或障碍或与疾病或障碍相关的一种或多种并发症进行的治疗的受试者。或者,受试者也可为在先未被诊断为患有此类疾病或障碍(例如,哮喘或变应性疾病)或相关并发症的受试者。例如,受试者可为表现出疾病或障碍或与疾病或障碍相关的一种或多种并发症的一种或多种风险因素的受试者、或并未表现出风险因素的受试者。
本文所使用的“试剂”是指例如分子、蛋白质、肽、抗体或核酸,其抑制多肽或多核苷酸的表达,或结合至多肽或多核苷酸,部分地或完全地阻断多肽或多核苷酸的刺激,减少、防止、延迟多肽或多核苷酸的活化,使多肽或多核苷酸失活、脱敏或活性下调。抑制notch4的试剂例如抑制多肽的表达(例如翻译、翻译后加工)、稳定性、降解或细胞核定位或细胞质定位,或抑制多核苷酸的转录、转录后加工、稳定性或降解,或结合至多肽或多核苷酸,部分地或完全地阻断多肽或多核苷酸的刺激、dna结合、转录因子活性或酶活性,减少、防止、延迟多肽或多核苷酸的活化,使多肽或多核苷酸失活、脱敏或活性下调。试剂可直接或间接起作用。
本文所使用的术语“试剂”是指任何化合物或物质,例如但不限于小分子、核酸、多肽、肽、药物、离子等。“试剂”可为任何化学品、实体或部分,包括但不限于合成和天然存在的蛋白类实体和非蛋白类实体。在一些实施方式中,试剂是核酸、核酸类似物、蛋白质、抗体、肽、适体、核酸的寡聚物、氨基酸或碳水化合物,包括但不限于蛋白质、寡核苷酸、核糖酶、dna酶、糖蛋白、sirna、脂蛋白、适体以及它们的修饰和组合等。在某些实施方式中,试剂是具有化学部分的小分子。例如,化学部分包括未取代或取代的烷基部分、芳基部分或杂环基部分,包括大环内酯、细霉素和相关的天然产物或它们的类似物。已知化合物可具有期望的活性和/或性质,或者可选自各种化合物的库。
试剂可为来自一种或多种化学类别的分子(例如有机分子),所述分子可包括有机金属分子、无机分子、遗传序列等。试剂也可为来自一种或多种蛋白质的融合蛋白、嵌合蛋白(例如相关或不同分子的功能上重要的区域的结构域转换或同源重组)、合成蛋白质或其它蛋白质变型(包括取代、缺失、插入和其它变体)。
本文所使用的术语“小分子”是指化学试剂,可包括但不限于肽、拟肽、氨基酸、氨基酸类似物、多核苷酸、多核苷酸类似物、适体、核苷酸、核苷酸类似物、分子量小于约10,000克/摩尔的有机或无机化合物(例如,包括杂有机化合物和有机金属化合物)、分子量小于约5,000克/摩尔的有机或无机化合物、分子量小于约1,000克/摩尔的有机或无机化合物、分子量小于约500克/摩尔的有机或无机化合物,以及此类化合物的盐、酯和其它药学上可接受的形式。
本文所使用的术语“rnai”是指干扰rna或rna干扰。rnai是指选择性的转录后基因沉默的手段,其通过结合和抑制mrna加工(例如抑制mrna翻译或导致mrna降解)的分子来破坏特定的mrna。本文所使用的术语“rnai”是指任何类型的干扰rna,包括但不限于sirna、shrna、内源性微小rna和人工微小rna。例如,rnai包括先前鉴定为sirna的序列,而与rna下游加工的机制无关(即,尽管认为sirna具有产生mrna切割的体内加工的特定方法,但可将此类序列并入在本文所述的侧翼序列的背景下的载体中)。
本文所述的方法和组合物要求对notch4的水平和/或活性进行抑制。如本文所使用的,神经源性基因座缺口同源蛋白4(也称为“notch4”)是指i型跨膜蛋白,该蛋白是共享下述结构特征的家族的成员,该结构特征包括:由多个表皮生长因子样(egf)重复序列组成的胞外结构域、以及由多个不同结构域组成的胞内结构域。已知许多物种的notch4序列,例如人notch4(ncbi基因id:4855)多肽(例如ncbi参考序列np_004548.3)和mrna(例如ncbi参考序列nm_004557.3)。notch4可指人notch4,包括其天然存在的变体、分子和等位基因。notch4是指例如小鼠、大鼠、兔、狗、猫、牛、马、猪等的哺乳动物notch4。seqidno:1的核酸序列包含编码notch4的核酸序列。
术语“减少/降低”(decrease/reduced/reduction)或“抑制(inhibit)”在本文中都用于表示降低统计学上显著的量。在一些实施方式中,“减少”或“降低”或“抑制”通常是指与适当的对照(例如不进行给定治疗)相比降低至少10%,并且可包括例如降低至少约10%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约98%、至少约99%或更多。本文所使用的“减少”或“抑制”不包括与参比水平相比的完全抑制或减少。“完全抑制”是指与适当的对照相比的100%抑制。
术语“增加/提高(increase)”、“增强(enhance)”或“活化/激活(activate)”在本文中都用于表示增加可重现的统计学上显著的量。在一些实施方式中,术语“增加/提高”、“增强”或“活化/激活”可表示与参比水平相比增加至少10%,例如与参比水平相比增加至少约20%、或至少约30%、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%、或至少约90%、或上至并包括增加100%、或10%-100%之间的任何增加,或与适当的对照相比的至少约2倍、或至少约3倍、或至少约4倍、或至少约5倍或至少约10倍的增加、20倍的增加、30倍的增加、40倍的增加、50倍的增加、6倍的增加、75倍的增加、100倍的增加等、或2倍至10倍之间的任何增加或更高量的增加。在标记物的上下文中,“增加”是此类水平的可重现的统计学上显著的增加。
本文所使用的“参比水平”是指正常的在其它方面未受影响的细胞群或组织(例如,从健康受试者获得的生物样品,或在先前时间点从受试者获得的生物样品、例如在被诊断为患有哮喘或变应性疾病之前从患者获得的生物样品,或尚未与本文所公开的试剂接触的生物样品)。
本文所使用的“适当的对照”是指未经处理的在其它方面相同的细胞或群体(例如,与非对照细胞相比,未给予本文所述试剂或仅通过本文所述试剂的子集进行给予的患者)。
术语“统计学上显著的”或“显著地”是指统计学显著性,并且通常指两个标准偏差(2sd)或更大的差异。
本文所使用的术语“包含/包括(comprising或comprises)”用于指对方法或组合物必要的组合物、方法及其各自的组成部分,并且无论是否必要都仍然对未指明的要素保持开放。
除非上下文另外明确指出,单数术语“一/该/所述(a/an/the)”包括复数的指示对象。类似地,除非上下文另外明确指出,词语“或”旨在包括“和/以及”。尽管与本文所述的方法和材料相似或等同的方法和材料可用于本公开的实践或测试中,以下描述了合适的方法和材料。缩写“例如(e.g.)”来源于拉丁文“例如(exempligratia)”,并且在本文中用于指示非限制性实例。因此,缩写“例如(e.g.)”与术语“例如(forexample)”同义。
附图说明
这一申请文件包含至少一幅着色的附图。经请求并支付必要的费用,具有彩色附图的这一专利申请公开的拷贝将由官方(office)提供。
图1a-图1g呈现的数据显示出am差异化地摄取纳米颗粒并响应于ufp而高度表达jag1。图1a和图1b,在经受由ova+ufp诱导的变应性气道炎症的小鼠中,通过不同肺细胞群对荧光纳米颗粒摄取的流式细胞术分析。图1c,肺巨噬细胞(am和im)、树突细胞(dc)和嗜中性粒细胞(neu)之间的纳米颗粒的分布的条形图呈现。图1d和图1e,在从il4rar576或il4rar576lyz2creahrδ/δ小鼠中纯化并经pbs或ufp(10μg/ml)处理的肺apc中,通过rt-pcr量化的jag1转录物的相对倍数变化(图1d)以及jag1表达的流式细胞术分析(图1e)。图1f和图1g,如图1d和图1e所述,在从il4rar576或il4rar576lyz2crejag1δ/δ小鼠中纯化并经pbs或ufp处理的肺apc中,jag1转录物的相对倍数变化(图1d)和jag1表达(图1e)。结果代表2次独立实验。n=3只小鼠/组。单因素anova与事后检验分析(子图的图1c、图1d和图1f)或学生非配对双尾t检验(子图的图1f,cd11c+dc组比较),*p<.05、**p<.01、***p<.001、***p<.0001。
图2a-图2b呈现的数据显示出am支持通过变应原特异性cd4+t细胞以jag1依赖的方式对th细胞的细胞因子产生的ufp依赖性上调。图2a,通过与经facs纯化的am共培养的初始il4rar576cd4+do11.10+rag2-/-t细胞进行的il-4、il-13、il-17和ifn-γ细胞因子产生的代表性流式细胞术分析,所述am分离自在ufp(10μg/ml)存在下经ova323-339肽冲击的il4rar576或il4rar576lyz2crejag1δ/δ小鼠。在门控的cd4+foxp3–t细胞中对细胞因子表达进行分析。图2b,与am共培养后表达各自的细胞因子的cd4+foxp3–t细胞的频率,所述am经假处理(pbs)、或者单独或在ufp存在下经ova323-339肽冲击。结果代表3次独立实验。双向anova与事后检验分析,*p<.05、**p<.01、***p<.001和****p<.0001。
图3a-图3j呈现的数据显示出ufp以jag1依赖的方式使am依赖的itreg细胞偏向于朝向th2/17细胞样表型分化。图3a,在初始il4rar576cd4+do11.10+rag2-/-t细胞与经facs纯化的am的共培养后,cd4+foxp3+itreg细胞的频率及其il-4、il-13、il-17和fn-γ的表达的代表性流式细胞术分析,所述am分离自在ufp存在下经ova323-339肽冲击的il4rar576或il4rar576lyz2crejag1δ/δ小鼠。图3b,表达各自的细胞因子的foxp3+itreg细胞及其亚群的频率,所述细胞经假处理(pbs)、或者单独或在ufp存在下经ova323-339肽冲击。结果代表3次独立实验。双向anova与事后检验分析,**p<.01、***p<.001、****p<.0001。
图4a-图4o呈现的数据显示出jag1的髓系特异性缺失赋予了保护免于ufp诱导的变应性气道炎症的加重。图4a,从pbs、ova或ova+ufp组的il4rar576或il4rar576lyz2crejag1δ/δ小鼠中分离的肺的代表性pas染色切片(放大200倍)。图4b,从图4a中描述的小鼠组中分离的肺组织中的炎症评分。图4c-图4g,图4a中描述的小鼠组的响应于乙酰甲胆碱的气道高反应性(图4c)、bal液中的嗜酸性粒细胞(图4d)和t细胞(图4e)的绝对数量、血清中的总水平(图4f)和ova特异性水平(图4g)。图4h-图4k,在图4a中描述的小鼠组中,分泌il-4(图4h)、il13(图4i)、il-17(图3j)和ifn-γ(图4k)的肺foxp3-cd4+t细胞的绝对数量。图4l-图4o,在子图图4a中描述的小鼠组中,分泌il-4(图4l)、il13(图4m)、il-17(图4n)和ifn-γ(图3o)的肺foxp3+cd4+treg细胞的绝对数量。结果代表2次独立实验。n=5只小鼠/组。双因素anova与事后检验分析,*p<0.05、**<0.01、***<0.001、****<0.0001。
图5a-图5o呈现的数据显示出jag1充足的am挽救了il4rar576lyz2crejag1δ/δ小鼠中ufp介导的变应性气道炎症。图5a,经气管内补充am的il4rar576lyz2crejag1δ/δ小鼠的肺组织的代表性pas染色切片,所述am分离自经假处理的(pbs)、或者荷载有单独的ova323-339肽(ova)或荷载有与ufp一起的ova323-339肽(ova+ufp)的il4rar576或il4rar576lyz2crejag1δ/δ小鼠。图5b,图5a中描述的小鼠的肺组织的炎症评分。c-g,图5a中描述的小鼠的气道高反应性(图5c)、bal液中的嗜酸性粒细胞(图5d)和t细胞(图5e)的数量、血清中的总水平(图5f)和ova特异性水平(图5g)。图5h-图5k,图5a中描述的小鼠的bal液中的分泌il-4(图5h)、il13(图5i)、il-17(图5j)和ifn-γ(图5k)的肺foxp3-cd4+t细胞的数量。图5l-图5o,图5a中描述的小鼠的bal液中的分泌il-4(图5l)、il13(图5m)、il-17(图5n)和ifn-γ(图5o)的肺foxp3+cd4+treg细胞的数量。结果代表3次独立实验。n=7-12只小鼠/组。双因素anova与bonferroni事后检验分析,*p<0.05、**<0.01、***<0.001、****<0.0001。n.s.:不显著。
图6a-图6b呈现的数据显示出am支持通过变应原特异性cd4+t细胞以notch4依赖的方式对th细胞的细胞因子产生的ufp依赖性上调。图6a,通过与经facs纯化的am共培养的初始il4rar576cd4+do11.10+rag2-/-t细胞对il-4、il-13和il-17细胞因子的产生的代表性流式细胞术分析,所述am分离自在ufp(10μg/ml)存在下经ova323-339肽冲击的il4rar576或il4rar576lyz2crejag1δ/δ小鼠。如所指出的,用同型对照(iso)ab或抗notch4mab处理共培养物,并对门控的cd4+foxp3–t细胞进行细胞因子分析。图6b,与am共培养后表达各自的细胞因子的t细胞的频率,所述am经假处理(pbs)、或者经单独的ova323-339肽冲击或经与ufp(10μg/ml)组合的ova323-339肽冲击。如所指出的,添加抗notch4mab或同型对照ab。结果代表3次独立实验。双因素anova与事后检验分析,*p<.05、**p<.01、***p<.001、****p<.0001。
图7a-图7p呈现的数据显示出ufp以notch4依赖的方式增强变应性气道炎症。图7a,从il4rar576小鼠中分离的肺组织的代表性pas染色,所述il4rar576小鼠在同型对照(iso)ab或抗notch4mab的存在下经单独的ova或经与ufp一起的ova致敏和激发。图7b,图7a中描述的小鼠组的肺组织中的炎症评分。图7c-图7h,图7a中描述的小鼠组的响应于乙酰甲胆碱的气道高反应性(图7c),bal液中的嗜酸性粒细胞(图7d)、t细胞(图7e)和嗜中性粒细胞(图7f)的绝对数量,血清中的总水平(图7g)和ova特异性水平(图7h)。图7i-图7l,图7a中描述的小鼠组中的分泌il-4(图7i)、il13(图7j)、il-17(图7k)和ifn-γ(图7l)的肺foxp3-cd4+t细胞的绝对数量。图7m-图7p,子图图7a中描述的小鼠组中的分泌il-4(图7l)、il13(图7m)、il-17(图7n)和ifn-γ(图7o)的肺foxp3+cd4+treg细胞的绝对数量。结果代表2次独立实验。n=5只小鼠/组。双因素anova与事后检验分析,*p<0.05、**<0.01、***<0.001、****<0.0001。
图8a-图8g呈现的数据显示出在经受假处理(pbs)、ova或ova+ufp诱导的变应性气道炎症的小鼠的不同肺细胞亚群中的荧光纳米珠(“fluoresbriteyg”)的分布。将小鼠用ova致敏,然后用pbs(假处理)、ova或ova+ufp激发。在所有激发组中通过鼻内滴注引入荧光纳米珠。图8a和图8b,在经受变应性气道炎症的小鼠中,通过cd45+肺细胞群(图e1,a)以及在肺巨噬细胞群中对荧光纳米颗粒摄取的流式细胞术分析,所述肺巨噬细胞群通过标记物f4/80和cd11c(图e1,a)以及随后的cd11b和cd11c(图e1,b)分隔。图8c-图8g,由所指出的标记物和各自的门控按顺序分隔的cd45+f4/80–细胞部分中的纳米珠的分布。结果代表2次独立实验。n=3只小鼠/组/实验。
图9a-图9d呈现的数据显示出fluoresbriteyg纳米珠并不诱导am中的jag1表达或影响小鼠中的变应性气道炎症。图9a,细胞分选的am中的jag1表达的流式细胞术分析,所述am在体外培养24小时并用pbs(假处理)、fluoresbriteyg纳米珠或ufp(分别为10μg/ml)处理。图9b-图9d,在变应性气道炎症的ova模型中的荧光纳米珠“fluoresbriteyg”的分布和作用。将小鼠用ova致敏,然后用pbs(假处理)或ova激发。通过鼻内滴注将fluoresbriteyg纳米珠引入分开的经ova致敏和激发的组。图9b,在经受变应性气道炎症的小鼠中,通过cd45+肺细胞群以及在肺巨噬细胞群中对fluoresbriteyg纳米珠摄取的流式细胞术分析,所述肺巨噬细胞群通过标记物f4/80和cd11c以及随后的cd11b和cd11c分隔。图9c、图9d,各小鼠组中的气道高反应性(ri)以及肺嗜酸性粒细胞和淋巴细胞计数。n=5只小鼠/组。
图10a-10c呈现的数据显示出摄取荧光纳米颗粒的肺巨噬细胞的表征,所述肺巨噬细胞来自经受由ova+ufp诱导的变应性气道炎症的小鼠。图10a和图10b,如所指出的,针对标记物cd64、cd38、egr2和mhcii类i-ad,对cd45+f4/80+cd11bintcd11chiam细胞(图e2,a)和cd45+f4/80+cd11bhicd11cintim细胞(图9b)进行染色。结果代表2次独立实验,n=3个/组/实验。图10c,细胞分选的am产生的il-6、il-10、il-12p40亚基、tnfα和ccl17,所述am用10μg/ml的ufp体外处理48hr。n=5个独立培养物/细胞因子测定。学生双尾t检验,p<****<0.0001。
图11a-图11b呈现的数据显示出在另外的非炎症条件下(无变应性致敏)经鼻内滴注后小鼠中不同肺细胞亚群中的荧光微粒的分布。图11a,通过cd45+肺细胞群以及在肺巨噬细胞群中对荧光微粒摄取的流式细胞术分析,所述肺巨噬细胞群通过标记物f4/80和cd11c以及随后的cd11b和cd11c分隔。图11b,由所指出的标记物和各自的门控按顺序分隔的cd45+f4/80–细胞部分中的微粒摄取的流式细胞术分析。结果代表2次独立实验。n=3只小鼠/组/实验。
图12a-图12b呈现的数据显示出,ufp上调了源自bm的巨噬细胞中的jag1表达。图12a,从il4rar576或il4rar576lyz2creahr1δ/δ小鼠制备并经pbs、ufp(10μg/ml)、6-ficz(300nm)或cb(10μg/ml)体外处理的源自bm的巨噬细胞中的jag1表达的流式细胞术分析。图12b,经pbs或ova致敏并经ova或ova+ufp激发的il4rar576或il4rar576lyz2creahr1δ/δ小鼠的肺中的am、im和dc中的jag1表达的流式细胞术分析。
图13a-图13d呈现的数据显示出,am支持通过变应原特异性cd4+t细胞以jag1依赖的方式对th细胞的细胞因子产生的ufp依赖性上调。图13a-图13d,通过与经facs纯化的am共培养的初始的il4rar576cd4+do11.10+rag2-/-t细胞对il-4(图12a)、il-13(图12b)、il-17(图12c)和ifn-γ(图12d)细胞因子产生的代表性流式细胞术分析,所述am分离自经假处理冲击(pbs)、或单独(ova)或在ufp存在下(ova+ufp)经ova323-339肽冲击的il4rar576或il4rar576lyz2crejag1δ/δ小鼠。
图14a-图14m呈现的数据显示出,jag1的髓系特异性缺失赋予了保护免于ufp对由dm诱导的变应性气道炎症的加重。图14a,从pbs、dm或dm+ufp组中的il4rar576或il4rar576lyz2crejag1δ/δ小鼠中分离的肺的代表性高碘酸-席夫(periodicacid-schiff,pas)染色切片。图14b,从图e6,a中描述的小鼠组中分离的肺组织中的炎症评分。图14c-图14e,图13a中描述的小鼠组中的bal液中的嗜酸性粒细胞(图e6,c)和t细胞(图e6,d)的绝对数量、以及血清总ige浓度(图e6,e)。图14f-图14i,图13a中描述的小鼠组中的分泌il-4(图13f)、il13(图13g)、il-17(图13h)和ifn-γ(图13i)的肺foxp3-cd4+t细胞的绝对数量。图14j-图14m,子图图3a中描述的小鼠组中的分泌il-4(图13j)、il13(图13k)、il-17(图13l)和ifn-γ(图13m)的肺foxp3+cd4+treg细胞的绝对数量。结果代表2次独立实验。n=5只小鼠/组。双因素anova与事后检验分析,*p<0.05、**<0.01、***<0.001、****<0.0001。
图15a-图15n呈现的数据显示出,ahr的髓系特异性缺失赋予了保护免于ufp诱导的变应性气道炎症的加重。图15a,从pbs、ova或ova+ufp组中的il4rar576或il4rar576lyz2creahr1δ/δ小鼠中分离的肺的代表性高碘酸-席夫(pas)染色切片。图15b,从图14a中描述的小鼠组分离的肺组织中的炎症评分。图15c-图15f,图14a中描述的小鼠组中的bal液中的嗜酸性粒细胞(图14c)和t细胞(图14d)的绝对数量、以及血清总ige浓度(图14e)和ova特异性ige浓度(图14f)。图15g-图15j,图14a中描述的小鼠组中的分泌il-4(图14g)、il13(图14h)、il-17(图14i)和ifn-γ(图14j)的肺foxp3–cd4+t细胞的绝对数量。图15k-图15n,子图图14a描述的小鼠组中的分泌il-4(图14k)、il13(图14l)、il-17(图14m)和ifn-γ(图14n)的肺foxp3+cd4+treg细胞的绝对数量。结果代表2次独立实验。n=5只小鼠/组。双因素anova与事后检验分析,*p<0.05、**<0.01、***<0.001、****<0.0001。
图16a-16f呈现的数据显示出,cd11ccre介导的jag1缺失不能保护免于ufp对由dm诱导的变应性气道炎症的加重。图16a,从pbs、ova或ova+ufp组中的il4rar576或il4rar576cd11ccrejag1δ/δ小鼠中分离的肺的代表性高碘酸-席夫(pas)染色切片。图16b,从图15a中描述的小鼠组分离的肺组织中的炎症评分。图16c-图16f,图15a中描述的小鼠组中的bal液中的嗜酸性粒细胞(图15c)和t细胞(图15d)的绝对数量、以及血清总ige浓度和ova特异性ige浓度(图15e和图15f)。结果代表2次独立实验。n=5只小鼠/组。双因素anova与事后检验分析,*p<0.05、**<0.01、***<0.001、****<0.0001。
图17a-图17l呈现的数据显示出,jag1充足的im和dc未能在il4rar576lyz2crejag1δ/δ小鼠中挽救ufp介导的变应性气道炎症。图17a-图17f,im转移;图17g-图17l,dc转移。响应于乙酰甲胆碱的气道高反应性(图16a和图16g),嗜酸性粒细胞的绝对数量(图16b和图16h),ova特异性血清ige抗体浓度(图5c和图5i)和肺组织cd4+t细胞(图5d和图5j)、分泌il13和il-17的肺cd4+foxp3–t细胞的绝对数量(图5e和图5k)、分泌il13和il-17的肺foxp3+cd4+treg细胞的绝对数量(图16f和图16l)。n=4只小鼠/组。双因素anova与bonferroni事后检验分析,*p<0.05、**<0.01、***<0.001、****<0.0001。
图18呈现的数据显示出,在变应性气道炎症中对cd4+t细胞上的notch受体表达的流式细胞术分析。左子图:对小鼠肺中的cd4+t细胞上的notch1-notch4染色的代表性流式细胞术分析,所述小鼠经pbs(假处理)或ova致敏、然后用ova激发,或经ova致敏、并用ova和ufp(ova+ufp)激发。右子图:表达各自的notch受体的cd4+t细胞的频率。结果代表2次独立实验;n=4只小鼠/组。单因素anova与事后检验分析,***p<.001以及****p<.0001。
图19a-图19d呈现的数据显示出,中和抗notch1-4mab处理对如下的作用:通过由经ova323-339+ufp处理的am所诱导的变应原特异性cd4+foxp3–t细胞对th细胞的细胞因子的产生的上调。图19a-图19d,如所指出的,由与经facs纯化的am共培养的初始的il4rar576cd4+do11.10+rag2-/-t细胞产生的il-4(图16a)、il-13(图16b)、il-17(图16c)和ifn-γ(图16d)细胞因子的条形图分布,所述am分离自经假处理冲击(pbs)、或单独(ova)或在ufp存在下(ova+ufp)经ova323-339肽冲击的il4rar576或il4rar576lyz2crejag1δ/δ小鼠。如所指出的,添加对照或抗notchab。结果代表来自两次独立实验的6个重复的平均值+s.e.m。单因素anova与事后检验分析,**<0.01、***<0.001、****<0.0001。
图20a-图20b呈现的数据显示出,中和抗notch4mab处理对如下的作用:通过当与经变应原+ufp冲击的am共培养时所诱导的变应原特异性cd4+foxp3+treg细胞对th细胞的细胞因子的产生的上调。图20a,il4rar576cd4+do11.10+rag2-/-初始t细胞与经facs纯化的am共培养时所诱导的cd4+foxp3+treg细胞产生的il-4、il-13和il-17细胞因子的代表性流式细胞术分析,所述am分离自il4rar576或il4rar576lyz2crejag1δ/δ小鼠并经ova323-339和ufp(10μg/ml)冲击。如所指出的,用同型对照抗体(isoab)或抗notch4mab处理共培养物,并对门控的cd4+foxp3+t细胞进行细胞因子分析。图20b,与am共培养时表达各自的细胞因子的treg细胞的频率,所述am已进行假处理(pbs)、或用单独的ova323-339肽或用与ufp(10μg/ml)组合的ova323-339肽进行冲击。如所指出的,添加抗notch4mab或同型对照ab。结果代表3次独立实验。双因素anova与事后检验分析,*p<.05、**p<.01、***p<.001和****p<.0001。
图21a-图21c呈现的数据显示出,通过中和抗notch4mab的处理抑制经变应原+ufp刺激的t细胞中的notch靶基因表达。将do11.10+t细胞进行假处理(pbs+对照ab;白色条形),或在对照ab(黑色条形)或抗notch4mab(灰色条形)的存在下与经ova323-339肽+ufp冲击的am进行共培养,然后通过实时pcr测定各靶基因的转录物的表达。图21a,hes1表达。图21b,hey1表达。图21c,nrarp表达,n=4个培养物/组。单因素anova与事后检验分析,*<0.05、***<0.001。
图22a-图22h呈现的数据显示出treg细胞中的notch信号传导的中断保护免于变应性气道炎症。图22a,具有所指出的notch组分的treg细胞特异性缺失的小鼠与foxp3gfpcre(对照)小鼠的肺切片的pas染色。图22b,经pbs/ova或ova/ova免疫/激发的所指出的小鼠品系中的ahr。图22c,总ige和ova特异性ige。图22d,肺组织嗜酸性粒细胞和嗜中性粒细胞。图22e-图22h:各小鼠组的肺组织中的foxp3+treg细胞(图22e)以及il-4+和il-13+(图22f)、il-17+(图22g)和ifn-γ+cd4+t细胞的频率。n=6-12次重复/组,来自3个实验。双因素anova与bonferroni事后检验分析,*p<0.05、**<0.01、***<0.001、****<0.0001。
图23呈现的数据显示出treg细胞中的notch信号传导的失效保护免于ufp诱导的变应性气道炎症的加重。如所指定的,用pbs-ova、ova-ova或ova-ova+ufp致敏和激发的所指出的小鼠组中的ahr。结果代表来自两次独立实验的5-6只小鼠。双因素anova与bonferroni事后检验分析,*p<0.05、**<0.01、***<0.001。
图24a-图24c呈现的数据显示出在变应性气道炎症中,通过变应原和ufp急剧上调了肺treg细胞上的notch4表达。图24a,肺cd4+tconv和treg细胞中的notch1-notch4mrna的表达。通过细胞分选从foxp3yfpcre小鼠的肺中分离cd4+foxp3+(yfp+)和cd4+foxp3–(yfp–)细胞,所述小鼠用pbs(假处理)或ova致敏,然后用单独的1%的雾化ova激发或用与鼻内滴注的ufp(10μg/d×3)一起的1%的雾化ova激发,每天1次持续3天。通过实时pcr对notch1/4mrna转录物的表达进行分析,并归一化为β肌动蛋白转录物。图24b呈现的数据显示出,在经受假处理(pbs)诱导的、ova诱导的或ova+ufp诱导的变应性气道炎症小鼠中,肺treg和tconv细胞(分别为上排和下排)上的notch4表达的流式细胞术分析。图24c,图24b所示的不同细胞组中的notch4表达的图形显示。单因素anova与事后检验分析,***p<0.001和****p<0.0001。
图25a-图25h呈现的数据显示出,notch4的treg细胞特异性缺失赋予了保护免于变应原和ufp诱导的变应性气道炎症。图25a,从pbs、ova或ova+ufp组中的foxp3yfpcre或foxp3yfpcrenotch4δ/δ小鼠中分离的肺的代表性pas染色切片(放大200倍)。图25b,从子图a中描述的小鼠组中分离的肺组织中的炎症评分。图25c-图25g,响应于乙酰甲胆碱的气道高反应性(图25c),嗜酸性粒细胞的绝对数量(图25d),血清ova特异性ige水平(图25e),肺foxp3-cd4+t细胞的绝对数量(图25f),分泌il-13(图25g)和il-17(图25h)的肺foxp3-cd4+t细胞的绝对数量。结果代表2次独立实验。n=5只小鼠/组。双因素anova与事后检验分析,p**<0.01、***<0.001、****<0.0001。
图26a-图26d呈现的数据显示出,在哮喘受试者的循环的调节性t细胞中notch4表达增加是疾病严重程度的生物标记物。图26a-图26b,在对照受试者和患有轻度持续性哮喘、中度持续性哮喘以及重度哮喘的受试者中,循环的cd4+foxp3+调节性t细胞和cd4+foxp3-效应t细胞中的notch4表达。图26c-图26d,在各受试者组的cd4+foxp3+调节性t细胞和cd4+foxp3-效应t细胞中,notch4表达细胞的细胞频率和notch4表达的平均荧光强度(mfi)。n=6-10名受试者/组。单因素anova与事后检验分析,*p<0.05、**p<0.01、***p<0.001、****p<0.0001。
具体实施方式
本文所述的发明部分基于如下发现:notch4信号传导途径的激活足以诱导细胞分化为引起哮喘的t辅助(th)细胞。使用体外细胞培养测定法(该测定法使用源自肺的抗原呈递细胞和变应原特异性t细胞)以及变应性气道炎症的小鼠模型,发现肺泡巨噬细胞(am)在促进气道炎症中作为ufp的关键细胞靶标。
对于变应性气道炎症通过ufp的增强而言,am中的jagged1(jag1)表达的芳烃受体(ahr)依赖性诱导是必需和足够的。ufp以jag1和notch4依赖的方式促进变应原特异性t细胞的th2和th17细胞分化。本文呈现的数据具体显示出,用抗notch4抗体处理小鼠通过阻止th细胞分化而消除了ufp诱导的变应性气道炎症的加重。本文特别考虑了抗notch4抗体在治疗和/或预防由于暴露于环境刺激物(例如超细颗粒)而引起的疾病(例如哮喘和变应性疾病)中将是有用的。
另外,本文公开了用于如下的方法:1)对处于患哮喘或变应性疾病风险的受试者进行鉴别,以及2)对哮喘或变应性疾病的功效进行测量。这些方法部分基于如下发现:notch4表达和/或活性的丰度与疾病或障碍的流行相对应。本文特别考虑了notch4表达或活性在各种方法中作为哮喘或变应性疾病的指标的用途。
notch4
notch信号传导途径是在进化上保守的细胞间信号传导途径,该途径调节物理上相邻的细胞之间的相互作用。notch信号传导调节多种细胞命运决定;每个notch家族成员在各种发展过程中都发挥着作用。在哺乳动物中,notch家族由四个notch受体(notch1-notch4)和五个配体(δ样配体1(dll1)、dll3、dll4、jagged(jag)1和jag2)组成。与相邻细胞上的jagged或δ样配体结合时,两个连续的蛋白水解事件释放notch的细胞内结构域(nicd),允许其易位至细胞核。在那里,nicd通过maml1-maml3结合将dna结合因子rbp-j从转录阻遏因子转化为转录激活因子1。
notch蛋白在反面高尔基网中被切割,然后作为异二聚体存在于细胞表面上。该蛋白起着膜结合配体的受体的作用,并可在血管、肾脏和肝脏的发育中发挥作用。
seqidno:1包含编码notch4的核酸序列。
治疗或预防哮喘或变应性疾病
本发明的一个方面是通过向患有哮喘或变应性疾病的受试者给予抑制notch4的试剂来治疗哮喘或变应性疾病的方法。另一个方面提供了通过鉴别患有哮喘或变应性疾病的受试者并向患有哮喘或变应性疾病的受试者给予抑制notch4的试剂来治疗哮喘或变应性疾病的方法。
本文所使用的“哮喘”是指特征在于肺气道炎症、可逆气道阻塞、支气管痉挛、喘息、咳嗽、胸闷和呼吸急促的疾病。哮喘被认为是由环境和遗传因素引起的,包括但不限于暴露于空气污染物和变应原、阿司匹林和β受体阻滞剂以及哮喘家族史。
根据症状的频率、症状的严重程度、一秒用力呼气量(fev1)和峰值呼气流速对哮喘进行分类。可根据受试者对药物的反应(例如特应性或非特应性)进一步对哮喘进行分类,其中特应性是指发展出1型超敏反应的倾向。
在各种实施方式中,哮喘是变应性哮喘(例如由暴露于变应原诱导)、无变应性哮喘(例如由诸如感冒、流感或鼻病毒的上呼吸道感染诱导)、阿司匹林加重性呼吸系统疾病(例如由摄入阿司匹林诱导)、运动诱发的哮喘、咳嗽变异性哮喘(例如,以不断干咳为特征)或职业性哮喘(例如由受试者在工作中暴露于刺激物诱导,例如消防员在执行其工作时暴露于烟雾,并可能会经历烟雾吸入)。熟练的临床医师可使用标准技术来鉴别受试者患有的哮喘的类型或处于患有风险的患者的哮喘的类型(例如消防员将处于患职业性哮喘的风险)。
本文所使用的“变应性疾病”是一种以对环境中在其它方面无害的物质的免疫系统应答为特征的疾病。例如,当患有变应性疾病的受试者暴露于常见的环境物质时,受试者的b淋巴细胞产生针对该物质的特异性抗体,从而产生免疫应答。例如,可能引起变应性疾病的示例性物质包括尘螨、花粉(例如,来自植物、树木、花或草)、动物皮屑(例如,来自家养动物或农场动物)、霉菌、食物(例如,树坚果、花生、贝类、鱼、牛奶、蛋或小麦)和乳胶。父母中的一个或多个患有过敏症的儿童处于发展出变应性疾病的增加的风险。可由熟练的临床医师使用常见技术(例如皮肤点刺试验和放射变应原吸附试验)来鉴别变应性疾病的具体原因(例如变应原是什么)。
在一个实施方式中,变应性疾病是变应性鼻炎、鼻窦炎、中耳炎、特应性皮炎(例如湿疹)、荨麻疹、血管性水肿和过敏性反应。
熟练的临床医师可将受试者鉴别为患有例如哮喘或变应性反应。在鉴别患有哮喘或变应性疾病的受试者方面有用的诊断性检查是本领域已知的,并且在下文中进一步描述。
本发明的另一方面是通过向处于发展出哮喘或变应性疾病的风险的受试者给予抑制notch4的试剂来预防哮喘或变应性疾病的方法。在一个实施方式中,该方法进一步包括在给予试剂之前对处于发展出哮喘或变应性反应的风险的受试者进行鉴别。
本文所使用的“处于患哮喘的风险”的受试者是指与已知的哮喘触发物(例如,可能导致哮喘发作的因素)接触或潜在接触的受试者。可能例如触发哮喘或变应性疾病发作的非限制性因素包括:气载物质(例如,花粉、尘螨、霉菌孢子、宠物皮屑或蟑螂废物颗粒);呼吸道感染(例如,普通感冒);体育活动(例如,可能触发运动诱发的哮喘);冷空气;空气污染物和刺激物(例如,烟雾和香烟烟雾);某些药物(例如,阻滞剂、阿司匹林、布洛芬(advil、motrinib等)和萘普生(aleve));强烈的情绪或压力;添加了亚硫酸盐和防腐剂的食物和/或饮料(例如,可见于虾、干果、经加工的马铃薯、啤酒和葡萄酒);以及胃食管反流病(gerd)。如果受试者具有哮喘或变应性疾病的家族史(例如,如果直系家族成员已经患有哮喘或变应性疾病),则认为该受试者也处于哮喘或变应性疾病的风险。
试剂
一方面,向患有哮喘或变应性疾病或处于患哮喘或变应性疾病的风险的受试者给予抑制notch4的试剂。在一个实施方式中,抑制notch4的试剂是小分子、抗体或抗体片段、肽、反义寡核苷酸、基因组编辑系统或rnai。
如果例如在给予后,试剂抑制细胞中的notch4的存在、量、活性和/或水平,则认为该试剂对抑制notch4有效。
在一个实施方式中,抑制notch4对表达nocth4的treg细胞向促进疾病的th细胞的分化进行抑制。
试剂可抑制例如notch4在细胞中的转录或翻译。试剂可抑制细胞中的notch4的活性或改变其活性(例如,使该活性不再发生或以降低的速率发生)(例如,notch4的表达)。
在一个实施方式中,抑制notch4的试剂促进程序性细胞死亡,例如杀伤表达notch4的细胞,例如treg细胞。为了确定试剂是否有效抑制notch4,可分别使用rt-pcr和蛋白免疫印迹法评估给定靶标(例如,notch4)的mrna和蛋白质水平。可将检测notch4活性的生物测定法(例如,测量notch受体与配体的结合的notch报告分子)用于评估是否发生了程序性细胞死亡。或者,可使用免疫荧光检测来确定在给予试剂后是否已经发生细胞死亡,该检测使用与细胞死亡标记物(例如caspase)组合的对notch4具有特异性的抗体。
在一个实施方式中,与适当的对照相比,试剂将notch4的水平和/或活性抑制至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少100%或更多。本文所使用的“适当的对照”是指在给予试剂之前的notch4的水平和/或活性,或不与试剂接触的细胞群中的notch4的水平和/或活性。
试剂能够以其给予的形式直接起作用。或者,可在细胞内修饰或利用该试剂以产生抑制notch4的物质,例如核酸序列向细胞中的引入及其产生notch4的核酸和/或蛋白抑制剂的转录。在一些实施方式中,试剂是任何化学品、实体或部分,包括但不限于合成和天然存在的非蛋白类实体。在某些实施方式中,试剂是具有化学部分的小分子。例如,化学部分包括未取代或取代的烷基部分、芳香族部分或杂环基部分,包括大环内酯、细霉素和相关的天然产物或它们的类似物。已知试剂可具有期望的活性和/或性质,或者可从各种化合物的库中鉴别。
在各种实施方式中,试剂是抑制notch4的小分子。筛选小分子的方法是本领域已知的,并且可用于鉴别在给定的期望靶标(例如notch4)的情况下例如在诱导致病性cd4细胞的细胞死亡方面有效的小分子。
在各种实施方式中,抑制notch4的试剂是抗体或其抗原结合片段,或对notch4具有特异性的抗体试剂。本文所使用的术语“抗体试剂”是指包含至少一个免疫球蛋白可变结构域或免疫球蛋白可变结构域序列并且特异性结合给定抗原的多肽。抗体试剂可含有包含抗体的抗原结合结构域的抗体或多肽。在任何方面的一些实施方式中,抗体试剂可包括单克隆抗体或含有单克隆抗体的抗原结合结构域的多肽。例如,抗体可包含重链(h)可变区(在此缩写为vh)和轻链(l)可变区(在此缩写为vl)。在另一实例中,抗体包含两个重链(h)可变区和两个轻链(l)可变区。术语“抗体试剂”包括抗体的抗原结合片段(例如单链抗体、fab和sfab片段、f(ab')2、fd片段、fv片段、scfv、cdrs和结构域抗体(dab)片段(参见,例如dewildt等,eurj.immunol1996,26(3):629-39,以引用的方式将其整体并入本文)以及完整的抗体。抗体可具有iga、igg、ige、igd或igm(以及其亚型和组合)的结构特征。抗体可来自任何来源,包括小鼠、兔、猪、大鼠和灵长类动物(人以及非人灵长类动物)和灵长类化抗体。抗体还包括midibodies、纳米抗体、人源化抗体、嵌合抗体等。
在一个实施方式中,抑制notch4的试剂是人源化的单克隆抗体或其抗原结合片段或抗体试剂。本文所使用的“人源化”是指来自非人物种(例如,小鼠、大鼠、羊等)的抗体,其蛋白质序列已被修饰以使得其增加与人中的天然产生的抗体变体的相似性。在一个实施方式中,人源化抗体是人源化单克隆抗体。在一个实施方式中,人源化抗体是人源化多克隆抗体。在一个实施方式中,人源化抗体用于治疗用途。
在一个实施方式中,抗体或抗体试剂结合至与编码notch4的氨基酸序列(seqidno:2)相对应的氨基酸序列。
在另一个实施方式中,抗notch4抗体或抗体试剂与包含seqidno:2的序列的氨基酸序列结合;或与如下氨基酸序列结合,所述氨基酸序列包含与seqidno:2的序列具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更高的序列同源性的序列。在一个实施方式中,抗notch4抗体或抗体试剂与包含seqidno:2的整个序列的氨基酸序列结合。在另一个实施方式中,抗体或抗体试剂与包含seqidno:2的序列的片段的氨基酸序列结合,其中该片段足以结合其靶标(例如notch4),并抑制表达nocth4的treg细胞向促进疾病的th细胞的分化。
在一个实施方式中,抑制notch4的试剂是反义寡核苷酸。本文所使用的“反义寡核苷酸”是指与dna或mrna序列(例如微小rna的序列)互补的合成核酸序列。通常将反义寡核苷酸设计为通过与靶标结合并在转录、翻译或剪接水平上使表达停止,来阻断dna或rna靶标的表达。本发明的反义寡核苷酸是被设计成在细胞条件下与基因(例如notch4)杂交的互补核酸序列。因此,选择与靶标充分互补的寡核苷酸(即在细胞环境的情况下充分良好地杂交并具有足够的特异性)以产生期望的效果。例如,抑制notch4的反义寡核苷酸可包含与人notch4基因(例如seqidno:1)的编码序列的一部分互补的至少5个、至少10个、至少15个、至少20个、至少25个、至少30个或更多个碱基。
在一个实施方式中,使用任何基因组编辑系统(包括但不限于锌指核酸酶、talens、大范围核酸酶和crispr/cas系统)从细胞基因组中去除notch4。在一个实施方式中,用于将编码一种或多种向导rna的核酸并入细胞基因组中的基因组编辑系统不是crispr/cas系统;这可在保留少量cas酶/蛋白质的细胞中防止不期望的细胞死亡。本文还考虑了cas酶或sgrna各自在不同的诱导型启动子的控制下表达,从而允许各自的时序性表达以防止此种干扰。
当编码一种或多种sgrna的核酸和编码rna指导的核酸内切酶的核酸各自需要被给予时,特别考虑使用腺病毒相关载体(aav)。用于同时将核酸递送至基因组编辑/片段化系统的两个组分(例如sgrna、rna指导的核酸内切酶)的其它载体包括慢病毒载体,例如epsteinbarr病毒、人类免疫缺陷病毒(hiv)和乙型肝炎病毒(hbv)。rna指导的基因组编辑系统的每个组分(例如,sgrna和核酸内切酶)可如本领域已知的或如本文所述在单独的载体中递送。
在一个实施方式中,试剂通过rna抑制来抑制notch4。给定基因的表达的抑制剂可为抑制性核酸。在任何方面的一些实施方式中,抑制性核酸是抑制性rna(irna)。rnai可为单链的或双链的。
irna可为sirna、shrna、内源性微小rna(mirna)或人工mirna。在一个实施方式中,如本文所述的irna实现对靶标例如notch4的表达和/或活性的抑制。在任何方面的一些实施方式中,试剂是抑制notch4的sirna。在任何方面的一些实施方式中,试剂是抑制notch4的shrna。
本领域技术人员能够例如使用公众可获得的设计工具设计靶向notch4的sirna、shrna或mirna。sirna、shrna或mirna通常使用例如dharmacon(layfayette,co)或sigmaaldrich(st.louis,mo)公司来生产。
在任何方面的一些实施方式中,irna可为dsrna。dsrna包括两条rna链,其在使用dsrna的条件下充分互补以杂交形成双链体结构。dsrna的一条链(反义链)包括互补区域,该区域与靶序列实质上互补、并且通常完全互补。靶序列可源自在靶标表达过程中形成的mrna的序列。另一条链(有义链)包括与反义链互补的区域,使得当在合适条件下结合时,两条链杂交并形成双链体结构。
可对irna的rna进行化学修饰以增强稳定性或其它有益特性。可通过本领域良好建立的方法来合成和/或修饰本发明中刊登的核酸,例如在“currentprotocolsinnucleicacidchemistry,beaucage,s.l.等(edrs.),johnwiley&sons,inc.,纽约,ny,usa”中描述的方法,通过引用的方式将其并入本文。
在一个实施方式中,试剂是抑制notch4的mirna。微小rna是小的非编码rna,平均长度为22个核苷酸。通常在3'非翻译(3'utr)区域中,这些分子通过与mrna分子内的互补序列结合而起作用,从而促进靶mrna降解或抑制mrna翻译。微小rna和mrna之间的相互作用由称为“种子序列”的序列介导,该序列是微小rna的6个-8个核苷酸区域,其通过不完全的watson-crick碱基配对指导与mrna的序列特异性结合。已知在哺乳动物中表达了超过900种微小rna。这些中的许多可基于它们的种子序列分组入家族中,从而鉴别相似微小rna的“簇(cluster)”。mirna可在细胞中表达为例如裸dna。mirna可由在细胞中表达的核酸(例如裸dna)编码,或者可由载体中包含的核酸编码。
试剂可例如用rnai分子(例如sirna或mirna)引起靶基因(例如notch4)的基因沉默。这使得细胞中靶标的mrna水平降低了在不存在该试剂的细胞中发现的mrna水平的至少约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约95%、约99%、约100%。在一个优选的实施方式中,mrna水平降低了至少约70%、约80%、约90%、约95%、约99%、约100%。本领域的技术人员将能够容易地评估sirna、shrna或mirna是否有效靶向例如notch4以用于其下调,例如通过将sirna、shrna或mirna转染到细胞中并经由蛋白免疫印迹法检测细胞内发现的基因(例如notch4)的水平。
试剂可包含在载体中,并因此进一步包括载体。用于将外源基因转移到靶哺乳动物细胞中的许多此类载体是可获得的。载体可以是游离型的,例如质粒、病毒衍生的载体(如巨细胞病毒、腺病毒等),或者可以通过同源重组或随机整合来整合到靶细胞基因组中,例如逆转录病毒衍生的载体如mmlv、hiv-1、alv等。在一些实施方式中,也可使用逆转录病毒和合适的包装细胞系的组合,其中衣壳蛋白的功能为感染靶细胞。通常,将细胞和病毒在培养基中孵育至少约24小时。然后,在一些应用中,使细胞能够在培养基中生长短的时间间隔(例如24-73小时)或至少两周,并且在分析之前可使其能够生长五周以上。常用的逆转录病毒载体是“缺损型”的,即不能产生生产性感染所需的病毒蛋白。载体的复制需要在包装细胞系中生长。
本文所使用的术语“载体”是指设计用于递送至宿主细胞或用于在不同宿主细胞之间转移的核酸构建体。如本文所使用的载体可以是病毒性的或非病毒性的。术语“载体”包含与适当的控制元件关联时能够复制并且可将基因序列转移至细胞的任何遗传元件。载体可包括但不限于克隆载体、表达载体、质粒、噬菌体、转座子、粘粒、人工染色体、病毒、病毒粒子等。
本文所使用的术语“表达载体”是指指导rna或多肽(例如notch4抑制剂)从其中所含的核酸序列进行表达的载体,所述核酸序列连接至载体上的转录调控序列。所表达的序列通常但不必然与细胞异源。表达载体可包含额外的元件,例如表达载体可具有两个复制系统,从而使其能够保持在两个生物体中,例如在人类细胞中用于表达并在原核宿主中用于克隆和扩增。术语“表达”是指在产生rna和蛋白质以及适当时分泌蛋白质中涉及的细胞进程,包括但不限于可应用至例如转录、转录物加工、翻译和蛋白质折叠、修饰和加工。“表达产物”包括从基因转录的rna和通过从基因转录的mrna的翻译获得的多肽。术语“基因”是指当与适当的调控序列可操作地连接时,在体外或体内转录为rna的核酸序列(dna)。该基因可能包含或可能不包含编码区之前和之后的区域,例如5'非翻译(5'utr)或“前导”序列和3'utr或“尾”序列,以及各个编码区段(外显子)之间的间插序列(内含子)。
整合载体将其递送的rna/dna永久并入宿主细胞染色体中。非整合载体保持游离,这意味着其中所含的核酸从未被整合到宿主细胞染色体中。整合载体的实例包括逆转录病毒载体、慢病毒载体、杂交腺病毒载体和单纯疱疹病毒载体。
非整合载体的一个实例是非整合病毒载体。非整合病毒载体消除了整合逆转录病毒带来的风险,这是因为非整合病毒载体不会将其基因组整合到宿主dna中。一个实例是epsteinbarrorip/核抗原-1(“ebna1”)载体,其能够有限自我复制并且已知在哺乳动物细胞中起作用。由于含有来自epstein-barr病毒的两个元件orip和ebna1,ebna1蛋白与病毒复制子区orip的结合维持了哺乳动物细胞中的质粒的相对长期的游离存在。orip/ebna1载体的这种特定特征使其理想地用于产生无整合ipsc。另一非整合病毒载体是腺病毒载体和腺相关病毒(aav)载体。
另一非整合病毒载体是rnasendai病毒载体,它可以产生蛋白质而不会进入经感染细胞的细胞核。f缺损型sendai病毒载体在经感染细胞的细胞质中保留了数代,但在数次传代(例如10次传代)后迅速被稀释并完全消失。
非整合载体的另一实例是微环载体。微环载体是环状载体,其中质粒骨架已被释出而仅留下真核启动子和待表达的cdna。
本文所使用的术语“病毒载体”是指核酸载体构建体,其包含病毒来源的至少一个元件并且具有包装成病毒载体颗粒的能力。病毒载体可包含编码如本文所述的多肽的核酸替代非必要的病毒基因。载体和/或颗粒可用于在体外或体内将核酸转移到细胞中的目的,许多形式的病毒载体是本领域已知的。
对处于患哮喘或变应性疾病的风险的受试者进行鉴别
本文所述发明的一个方面提供了用于对处于患哮喘或变应性疾病的风险的受试者进行鉴别的方法,所述方法包括:(a)从所述受试者获得生物样品;(b)对样品中的notch4的水平进行测量,其中,如果notch的水平与参比水平相比增加,则所述受试者处于患哮喘或变应性疾病的风险;以及(c)向处于风险的受试者给予抑制notch4的试剂。
在一个实施方式中,与参比水平相比,notch4的水平增加至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少30倍、至少40倍、至少50倍、至少60倍、至少70倍、至少80倍、至少90倍、至少100倍或更多,或者与参比水平相比,增加至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或至少99%或更多。参比水平可以是从健康受试者(例如未处于哮喘或变应性反应的风险的受试者)获得的样品中的notch4的水平。
在一个实施方式中,对notch4的水平进行体外或离体测量。可使用标准技术(如facs分析或免疫荧光法)测量样品中的notch4的水平。如本文所述,可分别使用蛋白免疫印迹法或基于pcr的测定法评估notch4的蛋白和mrna水平。
在一个实施方式中,生物样品是血液样品、外周血样品、痰样品、肺组织样品、肺活检样品、或支气管灌洗样品。在一个实施方式中,生物样品是包含肺泡巨噬细胞的任何样品。在一个实施方式中,生物样品取自先前经诊断患有哮喘或变应性疾病的受试者。在一个实施方式中,生物样品取自先前经诊断患有哮喘或变应性疾病并对其进行治疗的受试者。在一个实施方式中,生物样品取自尚未被诊断患有哮喘或变应性疾病的受试者。从受试者收集样品的方法是本领域已知的,并且可由技术人员执行。
测量治疗功效
本发明的一个方面提供了在经诊断患有哮喘或变应性疾病的受试者的治疗中确定治疗剂的功效的方法,所述方法包括:(a)在给予治疗剂之前,确定由经诊断患有哮喘或变应性疾病的受试者提供的样品中的notch4表达或活性的第一水平;(b)在给予治疗剂之后,确定由患者提供的样品中的notch4表达或活性的第二水平;以及(c)对notch4表达或活性的所述第一水平和第二水平进行比较,其中,如果notch4表达或活性的所述第二水平低于所述第一水平,则认为所述治疗剂是有效的,并且其中,如果notch4表达的所述第二水平与所述第一水平相同或高于所述第一水平,则认为在(b)中给予的所述治疗剂是无效的。
在一个实施方式中,如果与notch4表达或活性的第一水平相比,notch4表达或活性的第二水平降低至少1%、至少5%、至少10%、至少20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少99%或100%,则认为治疗剂是有效的。
在一个实施方式中,生物样品是血液样品、外周血样品、痰样品、肺组织样品、肺活检样品、或支气管灌洗样品。在一个实施方式中,生物样品是包含肺泡巨噬细胞的任何样品。从受试者收集样品的方法是本领域已知的,并且可由技术人员执行。
在一个实施方式中,生物样品取自经诊断患有哮喘或变应性疾病、但未给予治疗剂以治疗哮喘或变应性疾病的受试者。在一个实施方式中,生物样品取自经诊断患有哮喘或变应性疾病、但已给予治疗剂以治疗哮喘或变应性疾病的受试者。
在一个实施方式中,治疗剂是抑制notch4的试剂。在另一个实施方式中,治疗剂是抗哮喘或抗变应性疾病的治疗剂。在下文对示例性的抗哮喘和抗变应性疾病的治疗剂进行进一步描述。
给予/给药(administration)
在一些实施方式中,本文所述的方法涉及对患有或经诊断患有哮喘或变应性疾病的受试者进行治疗,包括给予如本文所述的抑制notch4的试剂。可通过医师使用诊断病症的当前方法来鉴别患有哮喘或变应性疾病的受试者。表征此类疾病并有助于诊断的哮喘或变应性疾病的症状和/或并发症在本领域中是公知的,并且包括但不限于持续咳嗽、呼吸困难、喘息、呼吸急促和皮疹。可能有助于诊断例如哮喘的试验包括但不限于乙酰甲胆碱激发、一氧化氮试验、过敏测试和痰嗜酸性粒细胞。例如哮喘的家族史也将有助于确定受试者是否可能具有病症或有助于诊断哮喘或变应性疾病。
可向患有或经诊断患有哮喘或变应性疾病的受试者给予本文所述的试剂(例如抑制notch4的试剂)。在一些实施方式中,本文所述的方法包括向受试者给予有效量的试剂,以缓解例如哮喘的至少一种症状。本文所使用的“缓解哮喘或变应性疾病的至少一种症状”是减轻与例如哮喘有关的任何病症或症状(例如持续咳嗽、呼吸困难、喘息、呼吸急促和皮疹)。如按任何标准技术所测得的,与等效的未处理的对照相比,此种减少为至少5%、10%、20%、40%、50%、60%、80%、90%、95%、99%或更多。用于向受试者给予本文所述试剂的多种手段是本领域技术人员已知的。在一种实施方式中,全身或局部(例如向肺)给予试剂。在一个实施方式中,静脉内给予试剂。在一个实施方式中,连续、间隔或偶发地给予试剂。试剂的给予途径将针对所递送的试剂的类型(例如抗体、小分子、rnai)进行优化,并且可由技术从业者确定。
在一个实施方式中,通过吸入给予试剂或包含试剂的组合物。
本文所使用的术语“有效量”是指可向患有或经诊断患有哮喘或变应性疾病的受试者给予的、使例如哮喘的至少一种或多种症状得到缓解所需的试剂(例如,抑制notch4的试剂)的量。因此,术语“治疗有效量”是指当给予典型的受试者时,足以提供例如特定的抗哮喘效果的试剂的量。在各种背景下,本文所使用的有效量还包括足以使例如哮喘的症状发展延迟、改变例如哮喘的症状进程(例如减缓肺功能丧失、呼吸不畅或喘息的进展)或者使例如哮喘的症状逆转(例如改善肺功能或呼吸)的试剂的量。因此,指明精确的“有效量”通常是不可行的。然而,对于任何给定的情况,本领域普通技术人员仅使用惯用的实验即可确定合适的“有效量”。
在一个实施方式中,连续给予试剂(例如在一段时间内以恒定水平)。试剂的连续给予可例如通过表皮贴剂、连续释放制剂或随身注射器(on-bodyinjector)来实现。
可在细胞培养物或实验动物中通过标准药学程序评价有效量、毒性和治疗功效。剂量可随所使用的剂型和所用的给予途径而变化。毒性作用和治疗效果之间的剂量比为治疗指数,并且可表示为ld50/ed50的比值。优选表现出高治疗指数的组合物和方法。可由细胞培养测定法初步评估治疗有效剂量。还可在动物模型中配制剂量以达到循环血浆浓度范围,所述范围包括如在细胞培养物或合适的动物模型中确定的ic50(即,达到症状的半最大抑制的试剂的浓度)。可通过例如高效液相色谱测量血浆中的水平。可通过合适的生物测定法(例如尤其是测量神经功能、或血液检查(bloodwork))监测任何特定剂量的效果。如有需要,可由医师确定并调整剂量,以适于所观察到的治疗效果。
剂量
作为本文所使用的术语“单位剂型”是指用于合适的一次给予的剂量。通过示例的方式,单位剂型可为置于递送装置(例如注射器或静脉滴注袋)中的治疗剂的量。在一个实施方式中,以单次给药给予单位剂型。在另一个实施方式中,可同时给予多于一个的单位剂型。
如有需要,可由医师确定并调整本文所述试剂的剂量,以适于所观察到的治疗效果。关于治疗持续时间和频率,对熟练的临床医师而言,一般对受试者进行监测以确定所述治疗何时提供治疗益处,并确定是否给予进一步的细胞、是否中止治疗、是否恢复治疗或是否对治疗方案进行其它改变。剂量不应太大而引起不良副作用,例如细胞因子释放综合征。通常,剂量将随患者的年龄、状况和性别而变化,并且可由本领域技术人员确定。在任何并发症的情况下,剂量还可由个体医师调整。
组合疗法
在一个实施方式中,将本文所述的试剂用作单一疗法。在一个实施方式中,可将本文所述的试剂与其它已知的用于哮喘或变应性疾病的试剂和疗法组合使用。本文所使用的“组合”给予是指在受试者遭受障碍折磨的过程中,向受试者递送两种(或更多种)不同的治疗,例如在受试者经诊断患有障碍或疾病(哮喘或变应性疾病)之后并且在该障碍被治愈或消除、或者治疗由于其它原因被停止之前,递送两种或更多种治疗。在一些实施方式中,一种治疗的递送在第二治疗的递送开始时仍在进行,从而在给予方面存在重叠。本文有时将其称为“同时”或“并行递送”。在其它实施方式中,一种治疗的递送在其它治疗的递送开始之前结束。在任一种情况的一些实施方式中,由于组合给予,治疗更有效。例如,例如与如果在不存在第一治疗的情况下给予第二治疗所观察到的相比,用较少的第二治疗观察到等同的效果、或者第二治疗更大程度地减轻症状,第二治疗更有效,或者用第一治疗观察到类似的情况。在一些实施方式中,递送使得症状或与障碍相关的其它参数的降低大于在不存在其它治疗的情况下递送的一种治疗所观察到的降低。所述两种治疗的效果可以是部分累加、完全累加或大于累加。递送可使得当递送第二治疗时仍然可检测到递送的第一治疗的效果。可同时、以相同或分开的组合物或顺序地给予本文所述的试剂和至少一种额外的疗法。对于顺序给予,可首先给予本文所述的试剂,然后可给予额外的试剂,或者给予次序可以颠倒。试剂和/或其它治疗试剂、程序或模式可在障碍活跃期间或在缓解期或疾病较不活跃期间给予。试剂可在另一种治疗之前、与治疗同时、在治疗之后或在障碍缓解期间给予。
用于治疗哮喘的示例性治疗剂包括但不限于:吸入的皮质类固醇(例如氟替卡松(flonase、floventhfa)、布地奈德(pulmicortflexhaler、rhinocort)、氟尼缩松(aerospanhfa)、环索奈德(alvesco、omnaris、zetonna)、倍氯米松(qnasl、qvar)、莫米松(asmanex)和白三烯改性剂(例如孟鲁司特(singulair)、扎鲁司特(安可来)和齐留通(zyflo));长效β激动剂(例如沙美特罗(serevent)和福莫特罗(foradil、perforomist));组合吸入剂(例如氟替卡松-沙美特罗(advairdiskus)、布地奈德-福莫特罗(symbicort)和福莫特罗-莫米松(dulera));茶碱(例如茶碱(theo-24、elixophylline));短效β激动剂(例如沙丁胺醇(proairhfa、ventolinhfa等)和左旋沙丁胺醇(xopenex));异丙托溴铵(例如爱喘乐);以及口服和静脉内皮质类固醇。
用于治疗变应性疾病的示例性治疗剂包括但不限于:抗炎治疗剂(例如皮质类固醇、糖皮质激素或盐皮质激素);抗组胺药(例如,溴苯那敏(dimetane)、西替利嗪(仙特明)、氯苯那敏(氯屈米通)、氯马斯汀(tavist)、苯海拉明(benadryl)、非索非那定(allegra)或氯雷他定(alavert、claritin));以及肾上腺素。
当组合给予时,能够以比单独使用的每种试剂(例如作为单一疗法)的量或剂量更高、更低或与其相同的量或剂量,来给予试剂和额外的试剂(例如,第二或第三试剂)或全部。在某些实施方式中,试剂、额外的试剂(例如,第二或第三试剂)或全部的给予量或剂量比单独使用的每种试剂的量或剂量低(例如,低至少20%、至少30%、至少40%、或至少50%)。在其它实施方式中,产生期望效果(例如,治疗哮喘或变应性疾病)的试剂、额外的试剂(例如,第二或第三试剂)或全部的量或剂量比单独达到相同治疗效果所需的每种试剂的量或剂量低(例如,低至少20%、至少30%、至少40%或至少50%)。
胃肠外剂型
可通过各种途径向受试者给予本文所述的试剂的胃肠外剂型,所述途径包括但不限于:皮下、静脉内(包括推注)、肌内以及动脉内。由于胃肠外剂型的给予通常绕开患者对污染物的天然防御,胃肠外剂型优选是无菌的或能够在给予至患者之前灭菌。胃肠外剂型的实例包括但不限于:准备用于注射的溶液剂、准备用于溶解或悬浮在用于注射的药学上可接受的辅料中的干燥产品、准备用于注射的混悬剂、受控释放的胃肠外剂型、以及乳剂。
可用于提供本公开的胃肠外剂型的合适辅料是本领域技术人员公知的。实例包括但不限于:无菌水;usp注射用水;盐水溶液;葡萄糖溶液;水性辅料,例如但不限于氯化钠注射液、林格氏注射液、右旋糖(dextrose)注射液、右旋糖和氯化钠注射液、以及乳酸盐林格氏注射液;与水混溶的辅料,例如但不限于乙醇、聚乙二醇和丙二醇;以及非水性辅料,例如但不限于玉米油、棉籽油、花生油、芝麻油、油酸乙酯、肉豆蔻酸异丙酯和苯甲酸苄酯。
气雾制剂
可通过雾化或以气雾剂的形式直接向受试者的气道给予包含抑制notch4的试剂的组合物。为了用作气雾剂,可将处于溶液剂或混悬剂中的抑制notch4的试剂与合适的推进剂(例如烃类推进剂,如丙烷、丁烷或异丁烷)以及常规助剂一起包装在加压气雾剂容器中。也能够以非加压形式(例如在喷雾器或雾化器中)给予抑制notch4的试剂。
术语“雾化”是本领域公知的,包括将液体减小为细喷雾。优选地,通过此种雾化,以受控的方式从较大的液体产生均匀尺寸的小液滴。因此,可通过任何合适的方式来实现雾化,包括通过使用当今已知和销售的许多雾化器。例如,可从inhalationplastic,inc.ofniles,ill获得的aeromist气动雾化器。当活性成分适于通过雾化器(作为单位剂量或多剂量装置)一起或单独给予时,它们可处于雾化的水性混悬剂或溶液剂的形式,具有或不具有适当的ph或渗透压调节剂(tonicityadjustment)。
如所公知的,在雾化过程中可使用任何合适的气体来施加压力,迄今为止优选的气体是对抑制notch4的试剂的调节剂而言化学上惰性的气体。可使用包括但不限于氮气、氩气或氦气的示例性气体以具有高的优势。
在一些实施方式中,还能够以干粉的形式直接向气道给予抑制notch4的试剂。为了用作干粉,可通过使用吸入器来给予ghk三肽。示例性的吸入器包括定量吸入器和干粉吸入器。
定量吸入器或“mdi”是装有产品的耐压罐或容器,所述产品例如溶解在液化推进剂中的药物组合物或悬浮在液化推进剂中的微粉化颗粒。可使用的推进剂包括氯氟烃、烃或氢氟烷烃。特别优选的推进剂是p134a(四氟乙烷)和p227(七氟丙烷),它们各自可单独使用或组合使用。它们任选地与一种或多种其它推进剂和/或一种或多种表面活性剂和/或一种或多种其它赋形剂(例如乙醇、润滑剂、抗氧化剂和/或稳定剂)组合使用。向患者递送正确剂量的组合物。
干粉吸入器(即turbuhaler(astraab))是可用压缩空气源操作以产生压制成非常小体积的药物组合物的干粉颗粒的系统。
通常,以主要在<5μm的范围内的平均直径产生用于吸入疗法的干粉气雾剂。当颗粒直径超过3μm时,巨噬细胞的吞噬作用越来越少。然而,还发现由于在口咽区或鼻区中的过度沉积,增加粒径使得颗粒(具有标准质量密度)进入气道和腺泡的可能性最小化。
作为说明,合适的粉末组合物包括与乳糖或对于支气管内给予而言可接受的其它惰性粉末彻底混合的抑制notch4的试剂的粉末制剂。粉末组合物可经由气雾剂器发生进行给予,或者可将粉末组合物包封在易碎胶囊中,患者可将该易碎胶囊插入刺破胶囊并以适于吸入的稳定气流将粉末吹出的装置。该组合物可含有推进剂、表面活性剂和共溶剂,并可被装入由合适的计量阀闭合的常规气雾剂容器中。
用于递送至呼吸道的气雾剂在本领域中是已知的。参见例如adjei,a.和garren,j.pharm.res.,1:565-569(1990);zanen,p.和lamm,j.-w.j.int.j.pharm.,114:111-115(1995);gonda,i.“aerosolsfordeliveryoftherapeuticandiagnosticagentstotherespiratorytract”,criticalreviewsintherapeuticdrugcarriersystems,6:273-313(1990);anderson等,am.rev.respir.dis.,140:1317-1324(1989)),并且还具有全身递送肽和蛋白的潜力(patton和platz,advanceddrugdeliveryreviews,8:179-196(1992));timsina等,int.j.pharm.,101:1-13(1995);以及tansey,i.p.,spraytechnol.market,4:26-29(1994);french,d.l.、edwards,d.a.和niven,r.w.,aerosolsci.,27:769-783(1996);visser,j.,powdertechnology58:1-10(1989));rudt,s.和r.h.muller,j.controlledrelease,22:263-272(1992);tabata,y和y.ikada,biomed.mater.res.,22:837-858(1988);wall,d.a.,drugdelivery,2:101-20(1995);patton,j.和platz,r.,adv.drugdel.rev.,8:179-196(1992);bryon,p.,adv.drug.del.rev.,5:107-132(1990);patton,j.s.等,controlledrelease,28:1579-85(1994);damms,b.和bains,w.,naturebiotechnology(1996);niven,r.w.等,pharm.res.,12(9),1343-1349(1995);以及kobayashi,s.等,pharm.res.,13(1):80-83(1996),以引用的方式将它们的内容以其整体全部并入本文。
受控释放和延迟释放剂型
在本文所述方面的一些实施方式中,通过受控释放或延迟释放的手段向受试者给予试剂。理想的是,在医学治疗中使用优化设计的受控释放制剂的特征在于使用最少的药物物质在最短时间内治愈或控制病情。受控释放制剂的优点包括:1)延长药物活性;2)降低剂量频率;3)提高患者依从性;4)使用较少的总药物;5)减少局部或全身副作用;6)使药物累积最小化;7)减少血液水平波动;8)改善治疗功效;9)减少药物活性的增强作用(potentiation)或损失;以及10)改善疾病或病症的控制速度(kim,cherng-ju,controlledreleasedosageformdesign,2(technomicpublishing,lancaster,pa:2000))。受控释放制剂可用于控制式(i)化合物的起效、作用持续时间、治疗窗内的血浆水平、以及峰值血液水平。特别是,受控释放或延迟释放剂型或制剂可用于确保实现试剂的最大效果,同时使潜在的不利影响和安全隐患最小化,这些不利影响和安全隐患可能在不足量给药(即,低于最低治疗水平)时以及超过药物的毒性水平时发生。
多种已知的受控释放或延迟释放剂型、制剂和装置可适于与本文所述的任何试剂一起使用。实例包括但不限于在以下文献中描述的实例:美国专利no.3,845,770、3,916,899、3,536,809、3,598,123、4,008,719、5674,533、5,059,595、5,591,767、5,120,548、5,073,543、5,639,476、5,354,556、5,733,566以及6,365,185,以引用的方式将其各自整体并入本文。使用例如羟丙基甲基纤维素、其它聚合物基质、凝胶、可渗透膜、渗透系统(例如
功效
可由熟练的从业者确定本文所述的试剂的功效(例如用于治疗哮喘或变应性疾病)。然而,在用本文所述的方法治疗后,如果例如哮喘的一个或多个的征象或症状以有益的方式改变或者其它临床上接受的症状得以改善或甚至减轻、或者诱导例如至少10%的期望的应答,则认为该治疗是“有效治疗”(如本文所使用的术语)。可例如通过测量根据本文所述的方法治疗的病症的标记物、指标、症状和/或发病率或任何其它可测量的合适参数(例如气道炎症减少、肺功能增强、正常呼吸恢复)来评估功效。还可通过住院治疗或需要医学干预评估的个体不再恶化(即呼吸并发症、哮喘发作频率、肺功能减退的进展)来测量功效。测量这些指标的方法对于本领域技术人员是已知的和/或是本文所述的。
可在本文所述病症的动物模型中评估功效,例如可视情况而定的小鼠模型或者哮喘或变应性疾病的适当的动物模型。当使用实验动物模型时,当观察到标记物的统计学上显著的变化(例如气道炎症减少、肺功能增强、正常呼吸恢复)时,治疗的功效得以证实。
可使用本文所述的方法对抑制notch4的试剂的功效进行额外地评估。
本文公开的本发明的替代性要素或实施方式的分组不应解释为限制。各组成员可单独地提及和请求保护或者以与该组的其它成员或本文出现的其它要素的任意组合被提及和请求保护。出于方便和/或专利性的原因,组的一个或多个成员可被包含在组中或从组中删除。当任何此类包含或删除发生时,在本文认为本申请文件包含经修饰的组,从而实现所附权利要求中使用的所有马库什组的书面描述。
除非本文另有定义,否则与本申请结合使用的科学术语和技术术语应具有与本公开所属领域的普通技术人员通常理解的含义。应当理解的是,本发明不限于在本文中描述的特定的方法学、方案和试剂等,而是可由此进行变化。本文中使用的术语仅用于描述特定实施方式的目的,并不旨在对本公开的范围进行限制,而本公开的范围仅仅由权利要求来限定。免疫学和分子生物学中的常见术语的定义可见于:themerckmanualofdiagnosisandtherapy,第20版,由mercksharp&dohmecorp.出版,2018(isbn0911910190,978-0911910421);roberts.porter等(编),theencyclopediaofmolecularcellbiologyandmolecularmedicine,blackwellscienceltd.出版,1999-2012(isbn9783527600908);以及roberta.meyers(编),molecularbiologyandbiotechnology:acomprehensivedeskreference,由vchpublishers,inc.出版,1995(isbn1-56081-569-8);immunologybywernerluttmann,由elsevier出版,2006;janeway'simmunobiology,kennethmurphy,allanmowat,caseyweaver(编),w.w.norton&company,2016(isbn0815345054,978-0815345053);lewin'sgenesxi,由jones&bartlettpublishers出版,2014(isbn-1449659055);michaelrichardgreenandjosephsambrook,molecularcloning:alaboratorymanual,第4版,coldspringharborlaboratory出版社,coldspringharbor,n.y.,usa(2012)(isbn1936113414);davis等,basicmethodsinmolecularbiology,elseviersciencepublishinginc.,纽约,usa(2012)(isbn044460149x);laboratorymethodsinenzymology:dna,jonlorsch(编),elsevier,2013(isbn0124199542);currentprotocolsinmolecularbiology(cpmb),frederickm.ausubel(编),johnwileyandsons,2014(isbn047150338x,9780471503385);currentprotocolsinproteinscience(cpps),johne.coligan(编),johnwileyandsons,inc.,2005;以及currentprotocolsinimmunology(cpi)(johne.coligan,adamkruisbeek,davidhmargulies,ethanmshevach,warrenstrobe(编)johnwileyandsons,inc.,2003(isbn0471142735,9780471142737);以引用的方式将它们的内容以其整体全部并入本文。
本文在对本发明各个方面的描述中对其它术语进行定义。
出于描述和公开的目的,将本申请全文中引用的所有专利和其它出版物(包括文字出版物、授予的专利、公开的专利申请和同时待决的专利申请)以引用的方式明确地并入本文,例如,在此类出版物中描述的可与本文描述的技术关联使用的方法学。这些出版物仅由于它们的公开早于本申请的申请日而提供。在这一方面,不应当视作承认了本发明人没有权利借助于先前的发明或因为任何其它原因而将此类公开内容提前。所有关于这些文件的日期的声明或关于这些文件的内容的表述是基于申请人可获得的信息,并不构成关于这些文件的日期或内容的正确性的任何承认。
对本公开的实施方式的描述并非旨在进行穷举或将本公开限制为所公开的明确的形式。尽管本文中出于说明性目的描述了本公开的具体实施方式和实施例,然而正如相关领域的技术人员将了解的,可在本公开的范围内进行各种等同修改。例如,当以给定的顺序给出方法步骤或功能时,替代的实施方式能够以不同的顺序执行功能、或可以实质上同时执行功能。本文所提供的本公开的教导可以施用至其它适当的程序或方法。本文所述的各种实施方式可以组合以提供进一步的实施方式。如果需要的话,可对本公开的方面进行修改,以采用上述参考文献和应用的组合、功能和构思,从而提供本公开的进一步的实施方式。此外,由于生物功能等效性的考虑,可以在种类或量上对蛋白结构进行不影响生物或化学作用的一些改变。鉴于详细的描述,可以对本公开作出这些改变和其它改变。所有这些修饰都旨在包含于所附的权利要求的范围之内。
可将任何上述实施方式中的特定要素与其它实施方式中的要素进行组合或置换。此外,尽管在这些实施方式的上下文中已经描述了与本公开的一些实施方式相关的优点,然而其它实施方式也可以表现出此类优点,并且,并非所有的实施方式都必须表现出这样的优点才能落入本公开的范围之内。
本文所述的技术通过以下实施例进行进一步说明,而不应以任何方式将其解释为进行了进一步的限定。
本文所述的技术的一些实施方式可根据下列编号段落的任何一段进行定义:
1)一种用于治疗哮喘或变应性疾病的方法,所述方法包括向患有哮喘或变应性疾病的受试者给予有效量的抑制notch4的试剂。
2)一种用于治疗哮喘或变应性疾病的方法,所述方法包括:
a.对患有哮喘或变应性疾病的受试者进行鉴别;以及
b.向患有哮喘或变应性疾病的受试者给予有效量的抑制notch4的试剂。
3)如段落1和2所述的方法,其中,所述哮喘选自于由如下所组成的清单:变应性哮喘、无变应性哮喘、阿司匹林加重性呼吸系统疾病、运动诱发的哮喘、咳嗽变异性哮喘和职业性哮喘。
4)如段落1和2所述的方法,其中,所述变应性疾病选自于由如下所组成的清单:变应性鼻炎、鼻窦炎、中耳炎、特应性皮炎、荨麻疹、血管性水肿和过敏性反应。
5)如段落1和2所述的方法,其中,所述抑制notch4的试剂选自于由如下所组成的组:小分子、抗体、肽、基因组编辑系统、反义寡核苷酸和rnai。
6)如段落5所述的方法,其中,所述抗体是人源化抗体。
7)如段落5所述的方法,其中,所述rnai是微小rna、sirna或shrna。
8)如段落1-7所述的方法,其中,抑制notch4是对notch4的表达水平和/或活性进行抑制。
9)如段落8所述的方法,其中,与适当的对照相比,所述notch4的表达水平和/或活性被抑制至少50%、至少60%、至少70%、至少80%、至少90%或更多。
10)如段落1或2所述的方法,其中,在调节性t细胞上对notch4进行抑制。
11)如段落1和2所述的方法,所述方法进一步包括给予至少一种额外的抗哮喘治疗剂。
12)如段落1和2所述的方法,所述方法进一步包括给予至少一种额外的抗变应性疾病治疗剂。
13)一种用于预防哮喘或变应性疾病的方法,所述方法包括向处于患哮喘或变应性疾病的风险的受试者给予抑制notch4的试剂。
14)如段落13所述的方法,所述方法进一步包括,在给予之前,对处于患哮喘或变应性疾病的风险的受试者进行鉴别。
15)一种用于治疗哮喘或变应性疾病的组合物,所述组合物包含抑制notch4的试剂和药学上可接受的载体。
16)如段落15所述的组合物,其中,所述抑制notch4的试剂选自于由如下所组成的组:小分子、抗体、肽、基因组编辑系统、反义寡核苷酸和rnai。
17)如段落15所述的组合物,其中,所述抗体是人源化抗体。
18)如段落15所述的组合物,其中,所述rnai是微小rna、sirna或shrna。
19)如段落15所述的组合物,其中,将所述组合物配制成用于吸入给予。
20)一种用于治疗处于患哮喘或变应性疾病的风险的受试者的方法,所述方法包括:
a.从所述受试者获得生物样品;
b.对候选细胞群中的notch4的水平进行测量;
其中,如果notch的水平与参比水平相比增加,则所述受试者处于患哮喘或变应性疾病的风险;以及
c.向处于风险的受试者给予抑制notch4的试剂。
21)如段落20所述的方法,其中,与参比水平相比,notch4的水平增加至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍或更多。
22)一种在经诊断患有哮喘或变应性疾病的受试者的治疗中对治疗剂的功效进行确定的方法,所述方法包括:
a)在给予治疗剂之前,确定由经诊断患有哮喘或变应性疾病的受试者提供的样品中的notch4表达或活性的第一水平;
b)在给予所述治疗剂之后,确定由患者提供的样品中的notch4表达或活性的第二水平;以及
c)对notch4表达或活性的所述第一水平和第二水平进行比较,其中,如果notch4表达或活性的所述第二水平低于所述第一水平,则认为所述治疗剂是有效的,并且其中,如果notch4表达的所述第二水平与所述第一水平相同或高于所述第一水平,则认为在(b)中给予的所述治疗剂是无效的。
23)如段落22的方法,其中,所述治疗剂是抑制notch4的试剂。
实施例
实施例1
引言
众所周知,近几十年来,暴露于空气污染、特别是燃烧源排放的颗粒物(pm)在哮喘发病率和流行增加中起重要作用1-6。在空气污染物中,暴露于pm显示出与不良的呼吸健康影响具有最强的相关性7-10。这些颗粒已显示出在暴露的宿主中促进th2和th17细胞应答并上调ige产生11-15。吸入的pm表现出根据尺寸而分级的差异化的气道渗透性(airwaypenetrance)。与截留在鼻咽区域的粗颗粒(cp;直径≥2.5μm)不同,细颗粒(fp;直径≤2.5μm)和超细颗粒(ufp;直径≤0.2μm)能够渗透到下呼吸道,在下呼吸道中它们被抗原呈递细胞(apc)摄取,以介导局部和全身炎症16。apc功能的pm调节可能与pm在促进对变应原的免疫应答方面的佐剂样效应(adjuvant-likeeffect)特别相关13,17。最近的研究已经鉴别出ufp和fp共同的关键机制,ufp和fp通过该机制增强变应性应答,该机制涉及ufp和fp在apc上诱导notch受体配体jagged1(jag1)15。此种诱导通过pm相关的芳烃受体(ahr)的多环芳烃(pah)的激活而介导,其进而介导了jag1的转录激活。jag1与变应原特异性t细胞上的notch受体结合,导致变应原特异性t细胞向促进疾病的th细胞的增强的分化。这些研究既未准确地鉴别出参与此过程的相关apc种类,也未准确地鉴别出介导对pm诱导的jag1的应答的靶notch受体。
肺巨噬细胞先前参与对pm的摄取和应答18-20。它们包括两个主要子集:肺泡巨噬细胞(am),表达高水平的β2整联蛋白cd11c(cd11chi);以及间质巨噬细胞(im),表达中等水平的cd11c(cd11cint)21,22。研究表明,两个群均通过诱导初始t细胞向treg细胞分化来促进稳定状态下的免疫耐受性23,24。然而,炎性刺激物(包括变应原和内毒素)调节共刺激分子的表达,并改变肺巨噬细胞作为抗原呈递细胞的效力25,26。类似地,am暴露于pm会改变其功能,使其具有促炎性27。除靶向肺巨噬细胞外,pm还显示出加强肺树突状细胞(dc)的抗原呈递功能28。每种apc类型对由pm诱导的变应性气道炎症应答的相对贡献仍有待充分阐明。
为了研究pm暴露可以通过其靶向肺apc以促进变应性疾病的机制,采用了一系列遗传、免疫学和全动物(wholeanimal)方法。本文提供了如下的证据,通过涉及notch4依赖的变应原特异性t辅助细胞分化的过程,am中的pm介导的ahr依赖的jag1诱导在促进变应性气道炎症中起着关键作用。
方法和材料
小鼠。先前对il4rar576和foxp3egfp小鼠进行了描述15,29,30。从jaxlab获得如下小鼠:blab/c(wt)、ahrfl/fl(ahrtm3.1bra)31、lyz2cre(creb6.129p2-lyz2tm1(cre)ifo/j)以及cd11ccre(b6.cg-tg(itgax-cre)1-1reiz/j)32。从taconic农场获得do11.10rag2–/–小鼠。使它们与il4rar576小鼠杂交,以产生do11.10rag2–/–il4rar576foxp3egfp小鼠30。jag1fl/fl小鼠由freddyradtke博士友好提供33。
颗粒。如先前所报道的,在洛杉矶市中心的城市地区收集ufp(≤0.18μm)15。如所描述的,分析了颗粒的组成组分34。将各个颗粒悬浮在水溶液中,亲水性组分成为溶液的一部分,而固态不溶性ufp核则处于悬浮状态。如下所指出的,整个混合物经鼻内给予。
t细胞与肺巨噬细胞和dc的共培养。通过荧光激活细胞分选术(facs)从cd4+do11.10+rag2–/–il4rar576foxp3egfp小鼠的脾脏中分离出初始cd4+do11.10+t细胞。通过facs分离am和im,并在48孔板中以2×104个细胞进行等分,然后进行假处理或用10μg/ml的ufp处理过夜。如通过膜联蛋白v染色所评估的,与假处理相比,ufp处理并未诱导增加的细胞凋亡(数据未示出)。用pbs将apc洗涤两次以除去残留的ufp,然后将t细胞以4×105个细胞/孔加入到最终体积为0.5ml的10%胎牛血清/rpmi培养基中。如所指出的,用1μm的ova323-339肽处理培养物。如所指出的,各自以10μg/ml加入抗鼠notchab。
变应性致敏和激发。通过腹膜内(i.p.)注射处于100μlpbs中的100μgova使小鼠对ova致敏,然后在两周后用处于pbs中的ova的第二次i.p.注射进行强化。对照小鼠进行假致敏并用单独的pbs进行强化。从第29天开始,用1%的雾化ova对经ova致敏的小鼠和经假致敏的小鼠两者进行激发,每天30分钟,持续3天。每次ova气雾剂暴露前两个小时,向小鼠亚群鼻内(i.n.)给予pbs或ufp(10μg/100μlpbs/滴注)。对于抗notch4抗体阻断,将150μg亚美尼亚仓鼠(armenianhamster)抗小鼠notch4iggmab(克隆hmn4-14;biox细胞)35或对照亚美尼亚仓鼠igg多克隆抗体(ab)(biox细胞)悬浮于100μlpbs缓冲液中,在ova气雾剂激发期间连续三天每天给予。在致敏后第32天对小鼠实施安乐死并进行分析。对于尘螨诱导的变应性气道炎症,在方案开始时,使小鼠经鼻内接受处于100μlpbs中的5μg的冻干的屋尘螨(d.pteronyssinus)提取物(greer),持续3天,然后在第15天-第17天用相同剂量的屋尘螨提取物与ufp或不与ufp一起对小鼠进行激发。在第18天对小鼠实施安乐死并分析气道炎症的测量值(measures)。按照先前发表的方法15,30,获得支气管肺泡灌洗液(bal)和肺组织,并分析其细胞组分和t细胞的细胞因子表达。
对于am、im和dc细胞转移研究,通过facs从il4rar576或il4rar576lyz2crejag1δ/δ供体小鼠分离细胞。将细胞培养过夜,进行假处理、或者单独或与10μg/ml的ufp一起加载5nm肽浓度的ova323-339肽。以105个细胞/小鼠,将细胞经气管内转移至经ova致敏的il4rar576lyz2crejag1δ/δ受体小鼠,两天内重复两次。在第三天对小鼠实施安乐死并分析变应性气道炎症的不同参数。
肺组织病理学染色。如所描述的,用苏木精和曙红(h&e)对石蜡包埋的肺切片进行染色36。由不知情的操作者对肺部病理进行评分。分别针对血管和气道周围的细胞浸润对炎症进行评分:0,无浸润;1,炎症细胞很少;2,1个细胞层深的炎症细胞环(ring);3,2个-4个细胞深的炎症细胞环;4,>4个细胞深的炎症细胞环37。通过将血管和气道的炎症评分相加来确定综合评分。通过粘蛋白颗粒的高碘酸席夫(pas)染色对杯状细胞的数量和分布进行评估。根据以下量表对单个气道(支气管/细支气管)的杯状细胞增生进行评分:0,无pas阳性细胞;1,<5%pas阳性细胞;2,5%-10%pas阳性细胞;3,10%-25%pas阳性细胞;4,>25%pas阳性细胞38。
统计分析。如所指出的,使用组的学生双尾t检验、单因素和双因素anova以及重复测量双因素anova与bonferroni事后检验分析,对试验组进行比较。认为p值<0.05是统计学上显著的。
研究批准。所有动物研究均由波士顿儿童医院动物保护资源办公室(bostonchildren’shospitalofficeofanimalcareresources)审查并批准。
其它方法。本文的在线资料库(例如可见于万维网www.jacionline.org)的方法部分提供了信息实时pcr分析、流式细胞术(包括
结果
肺巨噬细胞是基础和炎症条件下肺中的ufp的主要细胞靶标。为了进一步阐明jag1-ahr-notch途径在ufp促进气道炎症中的作用,在基础以及特别的变应性炎症条件两者下,首先试图在本文呈现的研究模型中建立pm靶向的apc的详细的免疫表型表征。对ufp的研究主要集中在,哪些由于其深度渗透性、大的表面积与尺寸比、每质量pah的较高含量和诱导氧化应激的较大能力而特别具有毒性39,40。使用ova诱导的变应性气道炎症模型,该模型使用il4rar576小鼠。这些小鼠携带il-4受体α链(il-4rα-r576)变体,通过介导il-4r依赖的混合th2/th17细胞炎症,该变体单独或与ufp组合介导变应原的过度变应性气道炎症15,30。通过腹膜内注射ova使小鼠致敏,然后通过重复吸入pbs(假激发)或1%雾化ova对小鼠进行激发。在ova气雾剂激发前2小时,用与
ufp差异性地诱导肺am中的jag1表达。ufp在源自骨髓的树突状细胞15和巨噬细胞中以ahr依赖的方式诱导jag1表达(图12a)。在从il4rar576小鼠的肺分离并经假处理或用ufp体外处理的不同的apc群中检查了jag1转录物的表达。与im和dc相比,jag1表达在am中在基线处最高(图1d)。用ufp的体外处理在am中对jag1转录物表达进行超诱导,而相同的处理在im和dc中与适度增加相关(图1d)。相比之下,用
通过使用lyz2cre(il4rar576lyz2crejag1δ/δ)在髓系中删除floxedjag1基因进一步确定了这些结果(图1f和图1g)。在基线处和ufp处理后,am中的jag1转录物表达和jag1表面染色均被完全消除。降低的jag1转录物表达和jag1蛋白染色在im中持续存在,而它们的水平在dc中不受影响。这些发现证实了在基线处和ufp处理后,am作为表达jag1的主要apc细胞类型,并且该表达通过ahr依赖的机制进行。它们还显示出,lyz2cre优先靶向巨噬细胞(尤其是am)中的jag1,而在dc中却大量保留它,这与先前关于巨噬细胞与树突状细胞中的lyz2cre活性的谱系追踪分析一致47。
经ufp处理的am以jag1依赖的机制促进th细胞分化。为了检查ufp对am中的jag1表达的诱导是否增强了变应原诱导的th细胞分化,使用了涉及初始的il4rar576do11.10+cd4+t细胞(该细胞源自do11.10+rag2-/-小鼠)的体外th细胞分化系统。将初始的do11.10+cd4+t细胞与经facs纯化的am(分离自il4r576或il4rar576lyz2crejag1δ/δ小鼠)一起孵育。用pbs对am进行假冲击、或者用单独的ova肽ova323-339或用与ufp一起的ova肽ova323-339对am进行冲击。在孵育期结束时,在门控的cd4+foxp3-(非调节性)t细胞中对th细胞的细胞因子表达进行分析。如通过流式细胞术染色所揭示的,与经ova323-339肽冲击的il4rr576am的共培养引起do11.10+cd4+foxp3-t细胞对il-17、il-13和il-4的产生增加,以及增加更低程度的ifn-γ(图2a、图2b和图13a-图13d)。通过添加ufp(10μg/ml),前三种细胞因子的表达显著上调,而ifn-γ的表达下调,这与过度的th2/th17偏移(skewing)一致30。相比之下,当使用il4rar576lyz2crejag1δ/δam作为apc时,ova323-339对do11.10+cd4+t细胞中的il-17、il-13和il-4表达的诱导被适度抑制,并且ufp对它们的超诱导被完全消除。在那些共培养物中,ifn-γ的表达也受到严重损害(图2a和图2b)。
还使用了do11.10细胞体外th细胞分化系统,来检查ufp处理对am支持初始的变应原特异性t细胞分化为诱导的treg细胞的能力的影响。在不存在ufp的情况下,荷载ova323-339的am驱使高达40%的初始的il4rar576do11.10+cd4+t细胞分化为foxp3+诱导的调节性t(itreg)细胞。用ufp处理部分抑制itreg细胞分化,而不依赖于jag1表达(图3a和图3b)。然而,重要的是,ova323-339肽呈递的am的ufp处理使形成的itreg细胞偏移以分泌th2/17细胞的细胞因子(包括il-4、il-13和il-17)而非th1细胞因子ifn-γ。通过am中的jag1的缺失在很大程度上逆转了这种偏向(图3c和图3d)。这些结果指出,部分地通过以jag1依赖的方式使新形成的itreg细胞失去稳定性而向th2/17细胞分化,ufp不利地影响了变应原特异性itreg细胞的分化。
髓系中的jag1缺失消除了ufp对变应性气道炎症的增强。为了确定am上的jag1表达在支持ufp体内上调变应性气道炎症中的作用,首先使用lyz2cre来删除髓系细胞中的ahr-jag1遗传回路的组成基因。相应地,il4rar576lyz2crejag1δ/δ小鼠和il4rar576小鼠通过腹膜内注射ova进行致敏,然后通过吸入1%雾化的ova进行激发。对照小鼠用pbs假致敏并用雾化的ova激发。在ova气雾剂激发之前2小时,用ufp(10μg/滴注)或pbs经鼻内对小鼠亚群进行处理41。用ova对il4rar576小鼠进行的致敏和激发导致强烈的气道炎症应答,其特征在于气道炎症和高反应性、bal液中的t细胞浸润和嗜酸性粒细胞增多、总的和ova特异性的血清ige应答升高、以及th2和th17细胞应答增加(图4a-图4k)。在ova激发阶段期间,通过ufp暴露显著增强了所有的这些参数。il4rar576lyz2crejag1δ/δ小鼠的ova致敏和激发还产生了强烈的变应性气道炎症应答,其与在经ova致敏和激发的il4rar576小鼠中注意到的相似。然而,在il4rar576lyz2crejag1δ/δ小鼠中,ufp对变应性气道炎症的所有上述参数的增强被完全消除,表明在髓系中的jaf1表达是ufp在气道中发挥其促炎作用的必要条件(图4a-图4i)。
还用屋尘螨(d.pteronyssinus,一种常见且强效的人变应原)提取物检查了,髓系细胞中的jag1表达介导ufp增强变应性气道炎症(其由经鼻内处理的il4rar576小鼠而诱导)的作用。结果与用ova致敏和激发观察到的结果一致。虽然ufp增强了通过用低剂量的屋尘螨(5μg)处理il4rar576小鼠诱导的气道炎症,但在il4rar576lyz2crejag1δ/δ小鼠中这一作用被消除(图14a-图14m)。il4rar576小鼠中的ahr的髓系特异性缺失(il4rar576lyz2creahrδ/δ)也消除了ufp增强由ova诱导的变应性气道炎症的各种参数的能力,这与用于ufp对jag1表达的诱导的ahr信号传导的要求是一致的(图15a-图15n)。相比之下,在所有cd11c+apc谱系中使用cd11ccre删除jag1并不会抑制ufp对气道炎症的促进作用,而实际上加重了这种促进作用,这表明在am中ufp的jag1诱导是它们获得促炎功能的独特和特定的要求(图16a-图16f)。
am中的jag1表达足以介导ufp对变应性气道炎症的上调。为了具体确立am中的jag1表达在ufp加重变应原诱导的气道炎症中的作用,检查了转移到il4rar576lyz2crejag1δ/δ小鼠中时am挽救ufp效应的能力。相应地,从il4rar576或il4rar576lyz2crejag1δ/δ小鼠分离am,所述小鼠经假处理或在存在或不存在ufp的情况下荷载有ova323-339肽。将细胞转移到用ova致敏的il4rar576lyz2crejag1δ/δ小鼠的气道中,然后检查其对变应性气道炎症的诱导。结果揭示了,向经ova致敏的il4rar576lyz2crejag1δ/δ小鼠中转移jag1充足的经ova323-339肽冲击和ufp处理的il4rar576am重现了由ufp诱导的加重的变应性气道炎症的所有迹象(stigmata),包括组织炎症增强、气道高反应性增加、血清总ige和ova特异性ige增加、以及bal液的cd4+t细胞浸润和嗜酸性粒细胞增多(图5a-图5g)。其还增强了th细胞因子的产生和treg细胞去稳定化而成为th细胞样表型(图5h-图5o)。相比之下,经类似处理的jag1缺损的il4rar576lyz2crejag1δ/δam的转移未能做到,表明am的jag1表达足以恢复ufp增强变应原诱导的气道炎症的能力。
当经气管内转移至经ova致敏的il4rar576lyz2crejag1δ/δ小鼠中时,还检查了从il4rar576或il4rar576lyz2crejag1δ/δ小鼠的肺分离并经假处理、或荷载有ova323-339或ova323-339+ufp的im和dc促进气道炎症的能力。然而,与jag1充足的am的情况不同,经转移的im不论其处理模式都不能促进变应性气道炎症(图17a-图17f)。经转移的dc也不能诱导气道高反应性。与am相比,荷载ova323-339的dc诱导了嗜酸性粒细胞和th细胞的亚最佳组织的浸润(suboptimaltissueinfiltration),而其未被ufp处理增强。这些结果与jag1充足的am在促进气道炎症中以及ufp对其的超诱导中的独特作用相一致(图17g-图17l)。
ufp对变应原诱导的th细胞分化的促进涉及jag1-notch4相互作用。接下来确定在ufp处理时各notch受体在介导由am表达的jag1的促炎效果中的作用。相应地,首先在经facs纯化的cd4+egfp-t常规细胞和cd4+egfp+treg细胞(分离自il4rar576foxp3egfp小鼠)中对不同notch受体的离体表达进行了分析。从未经操纵的小鼠的脾脏、以及从不具有或具有ufp共同处理的经受变应性气道炎症的小鼠的肺中分离细胞。脾脏cd4+t细胞主要表达notch1和notch2(数据未示出),与先前的结果一致48。相比之下,在从经ova致敏并经ova+ufp激发的小鼠的肺中分离的cd4+t细胞中,notch4表达被上调,成为四个notch受体中最高的(图18)。notch1和notch2的表达也被上调,但程度较小,而notch3的表达则下降。
受上述结果的启示,接下来使用图2a和图2b中所述的体外共培养系统,以确定中和notch1、notch2和notch4ab来对如下进行逆转的能力:ova323-339肽呈递am的ufp处理对应答性do11.10t细胞的th细胞的细胞因子的产生的增强。将经facs纯化的jag1充足的(il4rar576)或jag1缺损的(il4rar576lyz2crejag1δ/δ)am进行假处理、或用单独的ova323-339肽或用与ufp一起的ova323-339肽进行处理。在同型对照mabs或对单个notch受体而言特异性的中和mabs的存在下,将它们与初始的il4rar576do11.10+cd4+t细胞共培养,并检查t细胞的th细胞的细胞因子表达。如所预期的,经ova323-339肽冲击的il4rar576am的ufp处理上调了do11.10+cd4+foxp3-t细胞对il-17、il-13和il-4的产生,对ifn-γ上调的程度要小得多,而当使用il4rar576lyz2crejag1δ/δam作为apc时,这一作用被消除。重要的是,通过用高度特异性的中和抗notch4mab共同处理,ufp对th细胞的细胞因子(包括il-4、il-13和il-17)表达的上调被一律抑制(图6a和图6b以及图19a-图19d)49。抗notch4mab还抑制由单独的ova或与ufp一起的ova诱导的剩余的ifn-γ产生。相比之下,用对其它notch受体而言特异性的中和mab处理产生了部分和/或选择性的抑制结果(图19a-图19d)。当与经ufp处理的ova323-339肽呈递am一起培养时,抗notch4mab还阻抑do11.10+cd4+foxp3+itreg细胞的th细胞的细胞因子的产生(图20a-图20b)。值得注意的是,用抗notch4进行的处理偶尔会阻抑剩余的th细胞的细胞因子产生(例如il-4产生),超出了jag1激活所能解释的范围,这表明通过notch4起作用的其它notch配体在支持此种th细胞应答中的额外影响。
在经ova323-339和ufp处理的am与il4rar576cd4+do11.10+rag2-/-t细胞的体外共培养物中,进一步确定了抗notch4mab阻断变应原特异性t细胞中的notch信号传导的特异性和功效,其中用抗notch4mab处理阻断了notch靶基因hes1、hey1和nrarp的转录上调(图21a-图21c)。总体而言,本文呈现的这些发现表明notch4是关键的notch受体,经由该受体jag1通过促进th细胞分化来介导对ufp的炎症应答。
notch4抑制阻抑了ufp对变应性气道炎症的加重。考虑到中和抗notch4mab在对由变应原肽呈递am的ufp处理诱导的变应原特异性th细胞的增强的体外分化进行逆转中的功效,检查了抑制notch4对ufp诱导的变应性气道炎症应答的加重的影响。相应地,在激发阶段期间用抗notch4或同型对照mab对用单独的ova或用与ufp一起的ova致敏和激发的il4rar576小鼠进行处理,然后分析气道变应性炎症应答的各种参数。在组织炎症、气道高反应性、bal液嗜酸性粒细胞增多、血清总ige应答和ova特异性ige应答以及气道th2和th17细胞应答方面而言,抗notch4mab处理对ova诱导的变应性气道炎症影响很小或没有影响。相比之下,它完全抑制了由ufp诱导的上述参数的增强,从而表明notch4介导ufp对变应性气道炎症的增强作用(图7a-图7g)。
讨论
先前的研究证明,与交通有关的pm(包括ufp和fp)通过如下来促进变应性气道炎症:以ahr依赖的方式诱导apc上的jag1表达,进而激活notch信号传导,以通过变应原特异性t细胞增强th细胞因子的表达15。然而,这些研究没有教导notch4作为减轻气道炎症的潜在治疗靶标。与其它的肺apc相比,由于它们对纳米颗粒和微粒的狂热摄取(aviduptake)以及在pm摄取时它们对jag1表达的超诱导,本文呈现的数据将am鉴别为pm的关键靶标。另外,本文提出了将t细胞上的notch4鉴别为如下的关键介导物:经ufp处理的am对变应原特异性th细胞分化和itreg细胞失稳的jagl依赖的上调。通过中和抗notch4mab进行的notch4抑制完全消除了ufp对变应性气道炎症的上调。因此,这些研究证实了在变应性气道炎症中,细胞元件(包括am和变应原特异性cd4+th细胞和treg细胞)以及分子效应物(包括jag1和notch4)参与介导pm激活的ahr-jag1-notch回路的促炎作用。
由于它们下调dc的抗原呈递能力50并促进itreg细胞分化23,已表明am在气道中的耐受性的稳态维持。与dc相比,am在呈递抗原方面也不太有效,这一缺陷可通过提供辅助信号(例如与cd28或il-2共同刺激t细胞)来克服51,52。由pm介导的ahr激活对am中的jag1表达的上调可使得能够用jag1-notch进行有效的抗原呈递,该jag1-notch作为增大th细胞的细胞因子产生的共受体对而起作用53。本文呈现的结果清楚地证明了,对于在其髓系中缺乏jag1的小鼠中挽救ufp对变应性气道炎症的增强而言的jag1充足的am的必需和充分的作用。在炎症条件下,注意到im对纳米颗粒的摄取增加,这可能部分反映了发炎的肺组织中的该后一细胞的增加的丰度和/或它们对这些颗粒的提高的亲合力。然而,用im或dc对il4rar576lyz2crejag1δ/δ小鼠的重构未能挽救对ufp的炎症应答,这表明jag1充足的am在此过程中的必要的作用。
虽然am上的jag1的缺失逆转了ufp诱导的变应性气道炎症的增强,但在不存在ufp的情况下,它也减弱了变应原诱导的气道炎症的一些参数,例如肺组织中的cd4+t细胞的动员(图4a-图4o和图5a-图5o)。这些发现表明,在不进行ufp处理的情况下,am上的剩余的jag1表达可有助于变应原诱导的气道炎症,并且ufp起了极大放大这一过程的作用。
出人意料的是,本文呈现的发现将notch4鉴别为关键的notch受体,通过该受体ufp介导了其在上调变应性气道炎症中的作用。notch4抑制对变应原特异性t细胞向不同的th细胞亚群的ufp和am依赖的体外分化提供了有效和一致的阻抑。相比之下,抑制其它notch受体(包括notch1和notch2)对th细胞的细胞因子表达提供了选择性和/或部分抑制。notch4抑制还阻抑了ufp对小鼠中的变应性气道炎症的加重。notch4基因座先前与重度哮喘相关54,表明该途径可能调节疾病的严重程度,尤其是当其涉及到环境暴露(例如ufp)时。
与其它notch受体相比,am上表达的jag1可能优先与notch4相互作用。可替代地或并行地,与其它notch受体相比,notch4可通过notch经典和非经典的信号传导机制来差异化地增大th细胞的细胞因子的产生、或者可指导th细胞因子的特异性产生53,55。notch4信号传导也使itreg细胞的分化不稳定,引起其产生th细胞的细胞因子。此类itreg细胞表型与阻抑功能下降和谱系不稳定性有关,潜在地导致treg细胞最终分化为th细胞系30,56。在变应性气道炎症中,th和treg细胞群中的不同的notch受体的独特的专用功能可为靶向治疗干预提供机会。最后并且除了靶向t细胞外,中和notch4mab还可用于调节参与动员气道炎症应答的其它细胞元件(例如血管内皮)57,58。
参考文献
1.brandteb,myersjm,ryanph,hersheygk.airpollutionandallergicdiseases.curropinpediatr2015;27:724-35.
2.bowatteg,lodgec,loweaj,erbasb,perretj,abramsonmj,etal.theinfluenceofchildhoodtraffic-relatedairpollutionexposureonasthma,allergyandsensitization:asystematicreviewandameta-analysisofbirthcohortstudies.allergy2015;70:245-56.
3.gehringu,wijgaah,hoekg,bellandert,berdeld,bruskei,etal.exposuretoairpollutionanddevelopmentofasthmaandrhinoconjunctivitisthroughoutchildhoodandadolescence:apopulation-basedbirthcohortstudy.lancetrespirmed2015;3:933-42.
4.adarsd,filigranapa,clementsn,peeljl.ambientcoarseparticulatematterandhumanhealth:asystematicreviewandmeta-analysis.currenvironhealthrep2014;1:258-74.
5.khreish,kellyc,tatej,parslowr,lucask,nieuwenhuijsenm.exposuretotraffic-relatedairpollutionandriskofdevelopmentofchildhoodasthma:asystematicreviewandmeta-analysis.environint2017;100:1-31.
6.brunstkj,ryanph,brokampc,bernsteind,reponent,lockeyj,etal.timinganddurationoftraffic-relatedairpollutionexposureandtheriskforchildhoodwheezeandasthma.amjrespircritcaremed2015;192:421-7.
7.dockerydw,popeca,3rd.acuterespiratoryeffectsofparticulateairpollution.annurevpublichealth1994;15:107-32.
8.brunekreefb,holgatest.airpollutionandhealth.lancet2002;360:1233-42.
9.saxona,diaz-sanchezd.airpollutionandallergy:youarewhatyoubreathe.natimmunol2005;6:223-6.
10.nela.atmosphere.airpollution-relatedillness:effectsofparticles.science2005;308:804-6.
11.diaz-sanchezd,dotsonar,takenakah,saxona.dieselexhaustparticlesinducelocaligeproductioninvivoandalterthepatternofigemessengerrnaisoforms.jclininvest1994;94:1417-25.
12.diaz-sanchezd,tsiena,flemingj,saxona.combineddieselexhaustparticulateandragweedallergenchallengemarkedlyenhanceshumaninvivonasalragweed-specificigeandskewscytokineproductiontoathelpercell2-typepattern.jimmunol1997;158:2406-13.
13.lin,harkemajr,lewandowskirp,wangm,bramblela,gookingr,etal.ambientultrafineparticlesprovideastrongadjuvanteffectinthesecondaryimmuneresponse:implicationfortraffic-relatedasthmaflares.amjphysiollungcellmolphysiol2010;299:l374-83.
14.brandteb,kovacicmb,leegb,gibsonam,accianith,lecrastd,etal.dieselexhaustparticleinductionofil-17acontributestosevereasthma.jallergyclinimmunol2013;132:1194-204e2.
15.xiam,viera-hutchinsl,garcia-lloretm,novalrivasm,wisep,mcgheesa,etal.vehicularexhaustparticlespromoteallergicairwayinflammationthroughanarylhydrocarbonreceptor-notchsignalingcascade.jallergyclinimmunol2015.
16.oberdorsterg.pulmonaryeffectsofinhaledultrafineparticles.intarchoccupenvironhealth2001;74:1-8.
17.brandteb,biaginimyersjm,accianith,ryanph,sivaprasadu,ruffb,etal.exposuretoallergenanddieselexhaustparticlespotentiatessecondaryallergen-specificmemoryresponses,promotingasthmasusceptibility.jallergyclinimmunol2015;136:25-303e7.
18.hiraiwak,vaneedensf.contributionoflungmacrophagestotheinflammatoryresponsesinducedbyexposuretoairpollutants.mediatorsinflamm2013;2013:619523.
19.hardycl,lemasurierjs,mohamudr,yaoj,xiangsd,rollandjm,etal.differentialuptakeofnanoparticlesandmicroparticlesbypulmonaryapcsubsetsinducesdiscreteimmunologicalimprints.jimmunol2013;191:5278-90.
20.blankf,stumblespa,seydouxe,holtpg,finka,rothen-rutishauserb,etal.size-dependentuptakeofparticlesbypulmonaryantigen-presentingcellpopulationsandtraffickingtoregionallymphnodes.amjrespircellmolbiol2013;49:67-77.
21.garbin,lambrechtbn.location,function,andontogenyofpulmonarymacrophagesduringthesteadystate.pflugersarch2017;469:561-72.
22.kopfm,schneiderc,nobssp.thedevelopmentandfunctionoflung-residentmacrophagesanddendriticcells.natimmunol2015;16:36-44.
23.colemanmm,ruaned,moranb,dunnepj,keanej,millskh.alveolarmacrophagescontributetorespiratorytolerancebyinducingfoxp3expressioninnaivetcells.amjrespircellmolbiol2013;48:773-80.
24.sorooshp,dohertyta,duanw,mehtaak,choih,adamsyf,etal.lung-residenttissuemacrophagesgeneratefoxp3+regulatorytcellsandpromoteairwaytolerance.jexpmed2013;210:775-88.
25.duanw,sot,croftm.antagonismofairwaytolerancebyendotoxin/lipopolysaccharidethroughpromotingox40iandsuppressingantigen-specificfoxp3+tregulatorycells.jimmunol2008;181:8650-9.
26.moonka,kimsy,kimtb,yunes,parkcs,choys,etal.allergen-inducedcd11b+cd11c(int)ccr3+macrophagesinthelungpromoteeosinophilicairwayinflammationinamouseasthmamodel.intimmunol2007;19:1371-81.
27.miyatar,vaneedensf.theinnateandadaptiveimmuneresponseinducedbyalveolarmacrophagesexposedtoambientparticulatematter.toxicolapplpharmacol2011;257:209-26.
28.dehaarc,koolm,hassingi,bolm,lambrechtbn,pietersr.lungdendriticcellsarestimulatedbyultrafineparticlesandplayakeyroleinparticleadjuvantactivity.jallergyclinimmunol2008;121:1246-54.
29.tachdjianr,mathiasc,alkhatibs,brycepj,kimhs,blaeserf,etal.pathogenicityofadisease-associatedhumanil-4receptoralleleinexperimentalasthma.jexpmed2009;206:2191-204.
30.massoudah,charbonnierlm,lopezd,pellegrinim,phipatanakulw,chatilata.anasthma-associatedil4rvariantexacerbatesairwayinflammationbypromotingconversionofregulatorytcellstoth17-likecells.natmed2016;22:1013-22.
31.walisserja,glovere,pandek,lissal,bradfieldca.arylhydrocarbonreceptor-dependentliverdevelopmentandhepatotoxicityaremediatedbydifferentcelltypes.procnatlacadsciusa2005;102:17858-63.
32.clausenbe,burkhardtc,reithw,renkawitzr,forsteri.conditionalgenetargetinginmacrophagesandgranulocytesusinglysmcremice.transgenicres1999;8:265-77.
33.mancinisj,mantein,dumortiera,suteru,macdonaldhr,radtkef.jagged1-dependentnotchsignalingisdispensableforhematopoieticstemcellself-renewalanddifferentiation.blood2005;105:2340-2.
34.shirmohammadif,hasheminassabs,saffaria,schauerjj,delfinorj,sioutasc.fineandultrafineparticulateorganiccarboninthelosangelesbasin:trendsinsourcesandcomposition.scitotalenviron2016;541:1083-96.
35.murataa,yoshinom,hikosakam,okuyamak,zhoul,sakanos,etal.anevolutionary-conservedfunctionofmammaliannotchfamilymembersascelladhesionmolecules.plosone2014;9:e108535.
36.blaeserf,brycepj,hon,ramanv,dedeogluf,donaldsondd,etal.targetedinactivationoftheil-4receptoralphachaini4rmotifpromotesallergicairwayinflammation.jexpmed2003;198:1189-200.
37.fordjg,rennickd,donaldsondd,venkayyar,mcarthurc,hanselle,etal.il-13andifn-gamma:interactionsinlunginflammation.jimmunol2001;167:1769-77.
38.mcmillansj,xanthoug,lloydcm.manipulationofallergen-inducedairwayremodelingbytreatmentwithanti-tgf-betaantibody:effectonthesmadsignalingpathway.jimmunol2005;174:5774-80.
39.lin,wangm,bramblela,schmitzda,schauerjj,sioutasc,etal.theadjuvanteffectofambientparticulatematteriscloselyreflectedbytheparticulateoxidantpotential.environhealthperspect2009;117:1116-23.
40.lin,georass,alexisn,fritzp,xiat,williamsma,etal.aworkgroupreportonultrafineparticles(americanacademyofallergy,asthma&immunology):whyambientultrafineandengineerednanoparticlesshouldreceivespecialattentionforpossibleadversehealthoutcomesinhumansubjects.jallergyclinimmunol2016;138:386-96.
41.whitekusmj,lin,zhangm,wangm,horwitzma,nelsonsk,etal.thiolantioxidantsinhibittheadjuvanteffectsofaerosolizeddieselexhaustparticlesinamurinemodelforovalbuminsensitization.jimmunol2002;168:2560-7.
42.misharinav,morales-nebredal,mutlugm,budingergr,perlmanh.flowcytometricanalysisofmacrophagesanddendriticcellsubsetsinthemouselung.amjrespircellmolbiol2013;49:503-10.
43.jablonskika,amicisa,webblm,ruiz-rosadojded,popovichpg,partida-sanchezs,etal.novelmarkerstodelineatemurinem1andm2macrophages.plosone2015;10:e0145342.
44.mantovania,sicaa,sozzanis,allavenap,vecchia,locatim.thechemokinesystemindiverseformsofmacrophageactivationandpolarization.trendsimmunol2004;25:677-86.
45.katakurat,miyazakim,kobayashim,herndondn,suzukif.ccl17andil-10aseffectorsthatenablealternativelyactivatedmacrophagestoinhibitthegenerationofclassicallyactivatedmacrophages.jimmunol2004;172:1407-13.
46.meradm,sathep,helftj,millerj,morthaa.thedendriticcelllineage:ontogenyandfunctionofdendriticcellsandtheirsubsetsinthesteadystateandtheinflamedsetting.annurevimmunol2013;31:563-604.
47.abramcl,robergegl,huy,lowellca.comparativeanalysisoftheefficiencyandspecificityofmyeloid-credeletingstrainsusingrosa-eyfpreportermice.jimmunolmethods2014;408:89-100.
48.charbonnierlm,wangs,georgievp,sefike,chatilata.controlofperipheraltolerancebyregulatorytcell-intrinsicnotchsignaling.natimmunol2015;16:1162-73.
49.moriyamay,sekinec,koyanagia,koyaman,ogatah,chibas,etal.delta-likelisessentialforthemaintenanceofmarginalzonebcellsinnormalmicebutnotinautoimmunemice.intimmunol2008;20:763-73.
50.holtpg,oliverj,bilykn,mcmenaminc,mcmenaminpg,kraalg,etal.downregulationoftheantigenpresentingcellfunction(s)ofpulmonarydendriticcellsinvivobyresidentalveolarmacrophages.jexpmed1993;177:397-407.
51.blumenthalrl,campbellde,hwangp,dekruyffrh,frankellr,umetsudt.humanalveolarmacrophagesinducefunctionalinactivationinantigen-specificcd4tcells.jallergyclinimmunol2001;107:258-64.
52.chelencj,fangy,freemangj,secristh,marshalljd,hwangpt,etal.humanalveolarmacrophagespresentantigenineffectivelyduetodefectiveexpressionofb7costimulatorycellsurfacemolecules.jclininvest1995;95:1415-21.
53.bailisw,yashiro-ohtaniy,fangtc,hattonrd,weaverct,artisd,etal.notchsimultaneouslyorchestratesmultiplehelpertcellprogramsindependentlyofcytokinesignals.immunity2013;39:148-59.
54.hirotat,takahashia,kubom,tsunodat,tomitak,dois,etal.genome-wideassociationstudyidentifiesthreenewsusceptibilitylociforadultasthmainthejapanesepopulation.natgenet2011;43:893-6.
55.tindemansi,peetersmjw,hendriksrw.notchsignalinginthelpercellsubsets:instructororunbiasedamplifier?frontimmunol2017;8:419.
56.komatsun,okamotok,sawas,nakashimat,oh-horam,kodamat,etal.pathogenicconversionoffoxp3+tcellsintoth17cellsinautoimmunearthritis.natmed2014;20:62-8.
57.uyttendaeleh,clossonv,wug,rouxf,weinmasterg,kitajewskij.notch4andjagged-1inducemicrovesseldifferentiationofratbrainendothelialcells.microvascres2000;60:91-103.
58.miniatid,jelineb,ngj,wuj,carlsontr,wux,etal.constitutivelyactiveendothelialnotch4causeslungarteriovenousshuntsinmice.amjphysiollungcellmolphysiol2010;298:l169-77.
实施例2
t辅助细胞分化中的notch信号传导。在免疫细胞中,notch在各种t细胞系的发育和分化的多个阶段被激活2,3。例如,初始的cd8+t细胞的激活需要通过notchl或notch2结合抗原呈递细胞上的dll1,并引起脱中胚蛋白(eomes)、粒酶b和ifnγ的表达。norch信号传导还指导t辅助(th)细胞亚群的分化2,3。在初始的cd4+t细胞中,dll1和dll4激活notch信号传导和tbx21的转录,后者编码th1细胞的转录调节因子t-bet。在th2细胞的分化过程中,jagged1和jagged2对notch1和notch2的激活有助于gata3和il-4的表达。据报道,notch1信号传导通过促进rorγt和il-9的表达而在辅助t细胞的th17和th9亚群的分化中是重要的4,5。
在小鼠中的研究显示出,用γ-分泌酶抑制剂抑制notch加工、或抑制具有显性失活maml1的cd4+t细胞中的notch功能降低了针对胃肠蠕虫、鼠鞭虫(trichurismuris)和变应原激发的肺变应性应答的保护性th2免疫力,并阻抑了th1介导的炎症6。另外,最近的研究集中在notch信号传导在treg分化和功能中的作用。treg细胞中的notch信号传导的阻抑看起来驱动超调节表型,并且具有foxp3+t细胞中的rbpj或notch1或pofut1的靶向缺失的小鼠被保护免于致命的gvhd。相比之下,过表达notch1的构建型活性形式n1c的treg细胞看起来将treg细胞极化成更加th1样的表型,驱动了自身免疫表型。notch信号传导在负向调节变应性气道炎症中的作用在很大程度上是未知的。如下所详述的,我们的研究揭露了notch4的可诱导性treg细胞特异性表达在促进气道炎症中的关键作用。这一途径的特征及其作为治疗干预靶标的潜力是本方案的主题。
创新
发现notch4信号传导在气道炎症中的作用定义了疾病发病机理中迄今尚未明确的新途径,该途径有望成为哮喘治疗干预的靶标。此外,通过本文呈现的数据证明,该途径主要起使气道炎症中的treg细胞功能失效的作用,表明其靶向作用将允许有效的变应原特异性treg细胞应答和可能的长期致耐受性效应。本文详细描述了notch4在人哮喘中的作用的范围以及该途径如何靶向treg细胞亚群以使其功能失效。
treg细胞中的notch信号传导不利地影响气道炎症。
先前已经描述了treg细胞内在的notch信号传导在控制外周耐受中的负面功能8。为了确定treg细胞中的notch信号传导在气道炎症中的作用,使用了下述小鼠(foxp3gfpcrepofut1δ/δ),在该小鼠中通过使用foxp3基因驱动的cre重组酶的编码pofut1酶的基因的细胞系特异性删除而特异性地使treg细胞中的notch信号传导失活8。pofut1介导notch受体的o-岩藻糖基化,这是它们的糖基化中必不可少的事件并且对它们的功能至关重要9。其缺损会消除经由所有notch受体的信号传导10。与经类似的致敏和激发的pofut1充足的对照foxp3gfpcre小鼠相比,经ova致敏和激发的foxp3gfpcrepofut1δ/δ小鼠表现出显著降低的组织炎症和气道高反应性(ahr)、肺组织嗜酸性粒细胞增多和嗜中性粒细胞增多、总ige应答和ova特异性ige应答以及肺组织th2和th17细胞浸润(图22a-图22h)。使用另一种foxp3驱动的cre重组酶(foxp3yfpcre;数据未示出)发现了相似的结果。
为了确定经典与非经典途径在介导notch信号传导对气道炎症中的treg细胞的影响中的作用,考查了在treg细胞中删除编码经典notch因子rbpj的rbpj对气道反应性的影响8,11。结果表明,具有rpbj的treg细胞特异性删除的小鼠(foxp3yfpcrerpbjδ/δ)表现出降低的ahr和组织嗜酸性粒细胞增多的中间表型,介于foxp3crepofut1δ/δ和foxp3yfpcre小鼠之间(图22a-图22h)。显著地,rbpj缺损的treg细胞阻抑了气道嗜酸性粒细胞增多(而非嗜中性粒细胞增多)和th2细胞应答(而非th17细胞应答),这表明需要treg细胞特异性的经典的(rbpj依赖的)notch信号传导来控制气道th17细胞应答。检查了单独的notch受体在气道炎症中调节treg细胞功能中的作用。然而,先前已经发现,treg细胞中的notch1的删除使得它们能够调节th1应答8,floxednotch1或notch2等位基因的treg细胞特异性删除对变应性气道炎症没有影响(图22a-图22h)。因此,treg细胞中的notch经典途径和非经典途径最有可能通过notch3和/或notch4信号传导来促进变应性气道炎症(也参见图23)。
最后,treg细胞特异性pofut1删除以与单独的ova类似的方式显著阻抑了ufp对ova诱导的变应性气道炎症的加重(图23)。再次,treg细胞特异性的rbpj删除产生了中间表型,而notch1删除没有影响。各个小鼠品系中的th细胞的细胞因子的表达与图22a-图22h中观察到的相似。这些结果表明,treg细胞中的notch信号传导的激活是变应原和pm共享的促进气道炎症的共同机制(图23)。
notch4控制气道炎症中的treg细胞应答。
notch1/notch2看起来是在t细胞上表达的主要受体,然而notch1或notch2ko动物的表型以及所观察到的g-分泌酶抑制剂的毒性限制了这些工具(axes)对炎性疾病的临床干预。相比之下,notch4ko小鼠的表型是非常良好的(benign),一些数据支持了该受体在发育和生理学中的引人注目的作用。chatila实验室的最新数据表明,响应于气道中的变应原激发(单独或与由车辆内燃机产生的环境超细颗粒物(ufp)协同ova/ufp激发),notch4表达看起来优先在肺驻留treg细胞上升高,驱动gata3表达和treg细胞的th2细胞样表型(其在气道炎症中起关键作用)。
先前已显示,内燃机产生的超细颗粒(ufp)(以及较粗的细颗粒)通过诱导肺中的抗原呈递细胞上的jagged1(jag1)表达来促进变应性气道炎症12。jag1转而与变应原特异性t细胞上的notch受体相互作用,以加重变应性气道炎症。
肺泡巨噬细胞被鉴别作为ufp作用位点特别令人感兴趣,因为这些细胞类型介导了气道中的变应原特异性treg细胞的诱导13。这一发现表明,treg细胞的破坏是ufp加重炎症应答的潜在机制。显示出,尽管treg细胞上的notch1或notch2删除不会影响经单独的变应原卵清蛋白(ova)或经与ufp一起的ova致敏和激发所诱导的气道炎症,但pofut1(notch岩藻糖基化酶,对notch的信号传导功能至关重要)的删除几乎完全消除了变应原和ufp诱导的气道炎症。相较于经假致敏的小鼠,在经ova致敏并经ova或ova+ufp激发的小鼠的、经细胞分选的肺驻留cd4+foxp3+treg细胞和cd4+foxp3-tconv细胞中,使用气道炎症的ova模型来检查notch1-notch4转录物。结果表明,在经ova致敏并经ova或尤其是ova+ufp激发的小鼠中,肺驻留cd4+foxp3+treg细胞(而非cd4+foxp3-tconv细胞)中的notch4转录物被显著上调(图24a)。相比之下,与notch4的转录物相比,其它notch受体的转录物未改变或略有增加(数据未示出)。用抗notch4mab染色揭示了treg细胞上的notch4表达在驻留treg细胞中被类似地上调,但在经ova和ova+ufp处理的小鼠的驻留tconv细胞中仅被略微上调(图24b-图24c)。
使用遗传小鼠模型对treg细胞中的notch4上调在气道炎症中的功能意义进行了研究,在该模型中使用foxp3驱动的cre重组酶(foxp3yfpcre)在treg细胞中特异性地删除了floxednotch4等位基因。当用ova致敏并随后用ova或ova/ufp激发时,与具有notch4充足的treg细胞的小鼠相比,在其treg细胞中具有删除的notch4的经ova致敏的小鼠(foxp3yfpcrenotch4δ/δ)表现出显著减弱的气道炎症应答,并具有降低的气道阻力、组织炎症、嗜酸性粒细胞增多和ova特异性ige应答(图23)。foxp3yfpcrenotch4δ/δ小鼠中的减弱的气道炎症应答与我们先前在foxp3yfpcrepofut1δ/δ小鼠的资助提案中所显示的相似,由于岩藻糖基化酶pofut1的缺损,foxp3yfpcrepofut1δ/δ小鼠的treg细胞中的notch信号传导被消除,表明通过notch4进行的信号传导负责气道炎症中的treg细胞中的notch信号传导的大部分(如果不是全部)免疫失调作用。显著地,在treg细胞中的notch4缺失后,由ova或ova/ufp诱导的气道炎症被降低至相同水平,表明notch4信号传导是与变应原介导的气道炎症和ufp介导的气道炎症均相关的共同途径。虽然肺泡巨噬细胞中的jagl缺失消除了ufp对气道炎症的增强,但它对变应原诱导的气道炎症影响很小,表明不同的notch配体(一种由ova诱导,对其的鉴别目前正在研究中;而另一种为由ufp诱导的jagl)与tre细胞上的notch4相互作用,以介导气道炎症。
总体而言,本文呈现的这些结果表明,notch4是驱动变应性炎症的关键途径,该途径对变应原和环境颗粒物污染物而言是共同的,并且它通过影响组织treg细胞的可塑性变化而起作用,从而导致对变应原丧失耐受性。此外,有关小儿重度哮喘患者的初步数据表明,与正常的健康对照相比,notch4在患者外周血treg细胞上的表达升高,示出了可在哮喘患者中作为疾病的生物标记物和用于治疗目的而监测的溢出效应(spill-overeffect)。综上所述,这些数据表明,靶向notch4可能是在哮喘患者中恢复正常的气道稳态的一种方法,并可能扩展至其它疾病,例如慢性阻塞性肺病(copd)。
参考文献
1.siebel,c.&lendahl,u.notchsignalingindevelopment,tissuehomeostasis,anddisease.physiolrev97,1235-1294(2017).
2.amsen,d.,helbig,c.&backer,r.a.notchintcelldifferentiation:allthingsconsidered.trendsimmunol36,802-814(2015).
3.tindemans,i.,peeters,m.j.w.&hendriks,r.w.notchsignalinginthelpercellsubsets:instructororunbiasedamplifier?frontiersinimmunology8,419(2017).
4.meyerzuhorste,g.,etal.rbpjcontrolsdevelopmentofpathogenicth17cellsbyregulatingil-23receptorexpression.cellreports16,392-404(2016).
5.elyaman,w.,etal.notchreceptorsandsmad3signalingcooperateintheinductionofinterleukin-9-producingtcells.immunity36,623-634(2012).
6.tu,l.,etal.notchsignalingisanimportantregulatoroftype2immunity.jexpmed202,1037-1042(2005).
7.hirota,t.,etal.genome-wideassociationstudyidentifiesthreenewsusceptibilitylociforadultasthmainthejapanesepopulation.natgenet43,893-896(2011).
8.charbonnier,l.m.,wang,s.,georgiev,p.,sefik,e.&chatila,t.a.controlofperipheraltolerancebyregulatorytcell-intrinsicnotchsignaling.natimmunol16,1162-1173(2015).
9.stanley,p.&guidos,c.j.regulationofnotchsignalingduringt-andb-celldevelopmentbyo-fucoseglycans.immunolrev230,201-215(2009).
10.shi,s.&stanley,p.proteino-fucosyltransferase1isanessentialcomponentofnotchsignalingpathways.procnatlacadsciusa100,5234-5239(2003).
11.han,h.,etal.induciblegeneknockoutoftranscriptionfactorrecombinationsignalbindingprotein-jrevealsitsessentialroleintversusblineagedecision.intimmunol14,637-645(2002).
12.xia,m.,etal.vehicularexhaustparticlespromoteallergicairwayinflammationthroughanarylhydrocarbonreceptor-notchsignalingcascade.jallergyclinimmunol(2015).
13.soroosh,p.,etal.lung-residenttissuemacrophagesgeneratefoxp3+regulatorytcellsandpromoteairwaytolerance.jexpmed210,775-788(2013).
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



