缓释肽配制品的制作方法
 2021-01-08 11:01:36|
2021-01-08 11:01:36| 280|
280| 起点商标网
起点商标网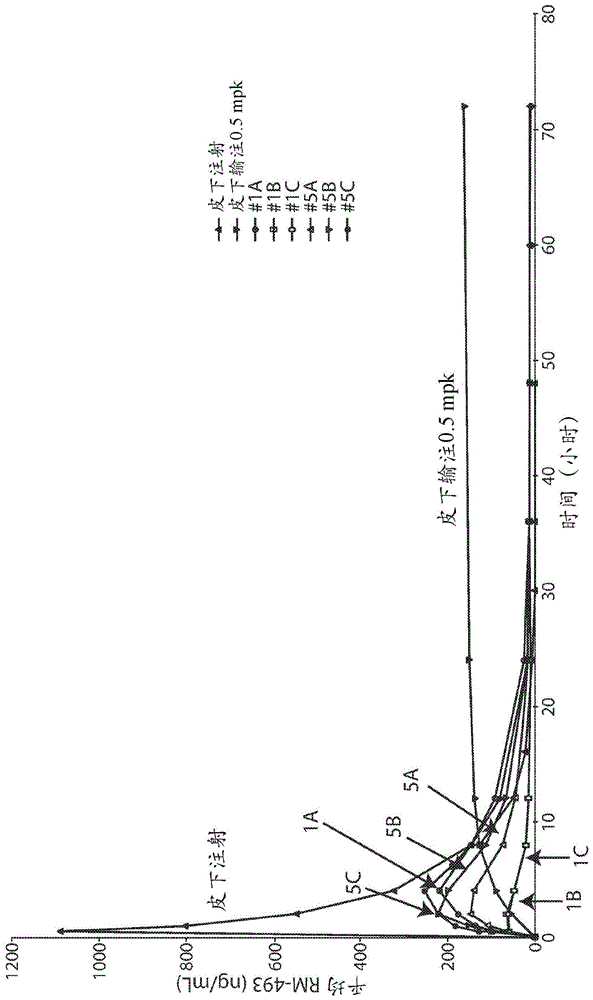
优先权要求
本申请要求2017年11月15日提交的美国申请号62/586,643的优先权,其全部内容通过引用并入本文。
背景技术:
许多生物化合物在以标准配制品施用后迅速释放。因此,需要开发延长释放的配制品,其可以延长在循环中化合物的持续时间并且提供所需的药代动力学和药效学特性。
技术实现要素:
本披露至少部分提供了一种药物产品,该药物产品包含:塞美兰肽(也称为rm493);作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的具有mc4受体激动剂(本文称为mc4rap)的主要作用机制的另一种药物组合物,所述mc4受体激动剂例如为bim-22511(也称为rm511)、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或者如wo2008/147556所披露的包含seqidno:11的mc4受体激动剂(以下称为mc4r-11)。药物产品包含不同摩尔比率的脂质赋形剂、醇和极性溶剂或其组合。药物产品还可以包含药学上可接受的载体。如与塞美兰肽(或mc4rap)的单独施用相比,本文所述的药物产品提供了例如具有药理活性的塞美兰肽(或mc4rap)的缓释,例如逐步释放或延长释放。施用后,药物产品还产生更理想的药代动力学和药效学特征。
在一方面,本披露提供了一种药物产品,该药物产品包含:a)中性二酰基脂质和/或生育酚;b)磷脂;c)醇;d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及e)塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、用于注射剂的唯一活性成分、活性药物成分或用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在另一方面,本披露提供了一种药物产品,该药物产品包含:a)中性二酰基脂质和/或生育酚;b)磷脂;c)醇;d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及e)塞美兰肽。
在另一方面,本披露提供了一种药物产品,该药物产品包含:a)中性二酰基脂质和/或生育酚;b)磷脂;c)醇;d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及e)作为唯一活性成分的塞美兰肽。
在另一方面,本披露提供了一种药物产品,该药物产品包含:a)中性二酰基脂质和/或生育酚;b)磷脂;c)醇;d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及e)作为活性药物成分的塞美兰肽。
在另一方面,本披露提供了一种药物产品,该药物产品包含:a)中性二酰基脂质和/或生育酚;b)磷脂;c)醇;d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及e)作为用于注射的活性药物成分的塞美兰肽。
在另一方面,本披露提供了一种药物产品,该药物产品包含:a)中性二酰基脂质和/或生育酚;b)磷脂;c)醇;d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及e)mc4rap,例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11。
在另一方面,本披露提供了一种药物产品,该药物产品包含:a)中性二酰基脂质和/或生育酚;b)磷脂;c)醇;d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及e)作为唯一活性成分的mc4rap,例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11。
在另一方面,本披露提供了一种药物产品,该药物产品包含:a)中性二酰基脂质和/或生育酚;b)磷脂;c)醇;d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及e)作为用于注射的唯一活性成分的mc4rap,例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11。
在另一方面,本披露提供了一种药物产品,该药物产品包含:a)中性二酰基脂质和/或生育酚;b)磷脂;c)醇;d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及e)作为活性药物成分的mc4rap,例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11。
在另一方面,本披露提供了一种药物产品,该药物产品包含:a)中性二酰基脂质和/或生育酚;b)磷脂;c)醇;d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及e)作为用于注射的活性药物成分的mc4rap,例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11。
在实施例中,组合物的组分a)包含中性二酰基脂质。在实施例中,该中性二酰基脂质包含甘油二酯。在实施例中,该中性二酰基脂质包含二油酸甘油酯(gdo)。
在实施例中,组合物的组分b)包含磷脂酰胆碱。在另一个实施例中,该磷脂包含大豆磷脂酰胆碱。
在实施例中,组合物的组分c)包含乙醇。在实施例中,该乙醇以足够大的量提供,以提供至少10mg/g、20mg/g或30mg/g的塞美兰肽的溶解度。
在实施例中,组合物的组分d)包含极性溶剂,例如缓冲液,例如柠檬酸盐缓冲液,任选地其中该缓冲液的ph是6.4。在实施例中,该极性溶剂,例如缓冲液,包含柠檬酸一水合物。在另一个实施例中,该极性溶剂,例如缓冲液,包含另外的组分,例如抗氧化剂或者化学或物理稳定剂。在实施例中,该抗氧化剂是edta。在实施例中,该极性溶剂,例如缓冲液,包含柠檬酸一水合物、edta二钠和水。
在实施例中,组合物的组分e)包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,组合物的组分e)包含塞美兰肽。
在实施例中,组分e)提供了作为唯一活性成分的塞美兰肽。
在实施例中,组分e)提供了作为活性药物成分的塞美兰肽。
在实施例中,组分e)提供了作为用于注射的活性药物成分的塞美兰肽。
在实施例中,组分e)提供了作为唯一活性成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,组分e)提供了作为用于注射的唯一活性成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,组分e)提供了作为活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,组分e)提供了作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,该组合物包含:含有二油酸甘油酯的中性二酰基脂质;含有磷脂酰胆碱的磷脂;含有乙醇的醇;极性溶剂,例如缓冲液,所述缓冲液包含例如含有edta的在ph6.4下的柠檬酸盐缓冲液;以及塞美兰肽。
在实施例中,该组合物包含,每一毫升的组合物,419.8mg二油酸甘油酯(gdo);419.8mg大豆磷脂酰胆碱;105mg乙醇;20mg柠檬酸盐缓冲液;以及30mg塞美兰肽。
在另一方面,本披露提供了一种可注射药物产品,该可注射药物产品包含:a)中性二酰基脂质和/或生育酚;b)磷脂;c)醇;d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及e)塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,组分e)提供了作为唯一活性成分的塞美兰肽。
在实施例中,组分e)提供了作为活性药物成分的塞美兰肽。
在实施例中,组分e)提供了作为用于注射的活性药物成分的塞美兰肽。
在实施例中,组分e)提供了作为唯一活性成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,组分e)提供了作为用于注射的唯一活性成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,组分e)提供了作为活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,组分e)提供了作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,组合物的组分a)包含中性二酰基脂质。在实施例中,该中性二酰基脂质包含甘油二酯。在实施例中,该中性二酰基脂质包含二油酸甘油酯(gdo)。
在实施例中,组合物的组分b)包含磷脂酰胆碱。在实施例中,该磷脂包含大豆磷脂酰胆碱。
在实施例中,组合物的组分c)包含乙醇。在实施例中,该乙醇以足够大的量提供,以提供至少10mg/g、20mg/g或30mg/g的塞美兰肽的溶解度。
在实施例中,组合物的组分d)包含极性溶剂,例如缓冲液,例如柠檬酸盐缓冲液,任选地其中该缓冲液的ph是6.4。在实施例中,该极性溶剂,例如缓冲液,包含柠檬酸一水合物。在实施例中,该极性溶剂,例如缓冲液,包含另外的组分,例如抗氧化剂或者化学或物理稳定剂。在实施例中,该抗氧化剂是edta。在实施例中,该极性溶剂,例如缓冲液,包含柠檬酸一水合物、edta二钠和水。
在实施例中,组分e)是塞美兰肽。在实施例中,组分e)是mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,组分e)提供了作为唯一活性成分的塞美兰肽。
在实施例中,组分e)提供了作为活性药物成分的塞美兰肽。
在实施例中,组分e)提供了作为用于注射的活性药物成分的塞美兰肽。
在实施例中,组分e)提供了作为唯一活性成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,组分e)提供了作为用于注射的唯一活性成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,组分e)提供了作为活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,组分e)提供了作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,该可注射药物产品包含塞美兰肽作为活性药物成分。在实施例中,该可注射药物产品包含:含有二油酸甘油酯的中性二酰基脂质;含有磷脂酰胆碱的磷脂;含有乙醇的醇;极性溶剂,例如缓冲液,所述缓冲液包含例如含有edta的在ph6.4下的柠檬酸盐缓冲液;以及塞美兰肽。
在实施例中,该可注射药物产品包含,每一毫升的组合物,419.8mg二油酸甘油酯(gdo);419.8mg大豆磷脂酰胆碱;105mg乙醇;20mg柠檬酸盐缓冲液;以及30mg塞美兰肽。
在另一方面,本披露提供了制造制剂或组合物,例如药物组合物,例如具有控制水平的etoh的制剂或组合物的方法,该制剂或组合物包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法包括:
i)提供塞美兰肽、作为被配制用于注射的唯一活性药物成分的塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)、第一量的etoh和一种或多种以下组分的混合物:
a)中性二酰基脂质和/或生育酚;
b)磷脂;
c)醇;以及
d)极性溶剂,例如缓冲液;以及
ii)添加第二量的etoh,
从而制造制剂或组合物,例如药物组合物,该制剂或组合物包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,该药物产品包含塞美兰肽。
在实施例中,该方法还包括制造混合物,该混合物包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);etoh、中性二酰基脂质和/或生育酚和磷脂,
其中在将塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),和etoh合并之后,添加中性二酰基脂质和/或生育酚中的一种或两种、和磷脂;
从而制造具有以下的组合物或制剂例如药物产品:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在另一方面,一种制造药物产品的方法,该药物产品包含:塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a;组分b;组分d;和预定量的醇,该方法包括:
将塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a、组分b、组分d和醇(以任何顺序)合并,以提供混合物,并且
将该混合物中醇含量的值与醇含量的参考值进行比较,
从而制造具有以下的配制品:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),组分a,组分b,组分d和预定量的醇。
在实施例中,该药物产品包含塞美兰肽。
在实施例中,该方法还包括响应于该值或比较,增加或减少该混合物中的醇的量以提供具有预定量的醇的配制品。在实施例中,该方法包括将添加量的醇添加至该混合物。
在另一方面,制造包含以下的药物产品的方法:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),组分a(例如,gdo)、组分b(例如,大豆pc)、组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液)和预定量的醇,该方法包括:
合并(以任何顺序)塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a(例如,gdo)、组分b(例如,大豆pc)、组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液)和醇,以提供混合物,并且
将该混合物中醇含量的值与醇含量的参考值进行比较,
从而制造药物产品,该药物产品包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),组分a(例如,gdo)、组分b(例如,大豆pc)、组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液)和预定量的醇。
在实施例中,该药物产品包含塞美兰肽。
在实施例中,该方法还包括将添加量的醇添加至该混合物。在实施例中,该添加量的醇多于该预定量的醇。
在一方面,制造包含组分e)的药物产品的方法,该组分e)包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法包括:
(i)提供包含组分e)和醇的混合物(组分e)-醇混合物),该组分e)包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该混合物例如包含与醇例如乙醇接触,例如溶解或分散在醇例如乙醇中的塞美兰肽、作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽、作为活性药物成分的塞美兰肽、作为用于注射的活性药物成分的塞美兰肽、或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);以及
(ii)将组分e)-醇混合物与一定量的组分a例如gdo、组分b例如大豆pc、和组分d例如在ph6.4下的柠檬酸盐缓冲液、或组分a、b和d的全部合并。
在实施例中,该方法还包括在密闭器皿中进行步骤(i)、(ii)、或(i)和(ii)。
在一方面,本披露提供了一种制造具有以下的制剂或针对例如质量控制或释放规格评价候选制剂的方法:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法包括:
提供在塞美兰肽的候选制剂中etoh的量的值;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);以及
将该值与etoh的量的参考值进行比较;
从而制造以下的制剂:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,该药物产品包含塞美兰肽。
在一方面,本文提供了一种制造具有以下的组合物或制剂例如药物产品的方法:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法包括:
制造混合物,该混合物包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);etoh、中性二酰基脂质和/或生育酚和磷脂,
其中在将塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),和etoh合并之后,添加中性二酰基脂质和/或生育酚中的一种或两种、和磷脂;
从而制造具有以下的组合物或制剂例如药物产品:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,在允许至少10%、25%、50%、75%或全部的以下项进入溶液中之后,添加中性二酰基脂质和/或生育酚中的一种或两种、和磷脂:塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,配制混合物的顺序是:
i)使塞美兰肽、作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽、作为活性药物成分的塞美兰肽、作为用于注射的活性药物成分的塞美兰肽、或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)与etoh(和任选地水或缓冲液)接触;
ii)将磷脂添加到从i)中得到的混合物中;以及
iii)将中性二酰基脂质和/或生育酚添加到从ii)得到的混合物中。
在实施例中,该药物产品包含塞美兰肽。
在另一方面,一种制造具有组分(e)的药物产品的方法,该组分(e)包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法按顺序包括以下步骤:
(i)提供混合物(组分(e)-醇混合物),该混合物包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),以及醇,该混合物例如包含与醇例如乙醇接触,例如溶解或分散在醇例如乙醇中的塞美兰肽、作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽、作为活性药物成分的塞美兰肽、作为用于注射的活性药物成分的塞美兰肽、或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);以及
(ii)将组分(e)-醇混合物与一定量的组分a(例如,gdo)、组分b(例如,大豆pc)和组分d(例如,在ph6.4下的柠檬酸盐缓冲液)或一定量的组分a、b和d的全部合并;
从而制造具有以下的药物产品:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),例如,具有以下且包含预定量的醇例如10wt.%醇例如乙醇的药物产品:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,该药物产品包含塞美兰肽。
在一方面,一种制造具有组分(e)的药物产品的方法,该组分(e)包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法按顺序包括以下步骤:
(i)提供混合物(组分(e)-醇-缓冲液混合物),该混合物包含:塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);醇;和组分d(例如极性溶剂,例如缓冲液,例如在ph6.4的柠檬酸盐缓冲液),该混合物例如包含与醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液接触,例如溶解或分散在醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液中的塞美兰肽、作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽、作为活性药物成分的塞美兰肽、作为用于注射的活性药物成分的塞美兰肽、或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);以及
(ii)将组分(e)-醇-缓冲液混合物与一定量的组分a(例如,gdo)、组分b(例如,大豆pc)或一定量的组分a和b的全部合并;
从而制造具有以下的药物产品:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),例如,具有以下且包含预定量的醇例如10wt.%的醇例如乙醇的药物产品:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、用于注射、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,该药物产品包含塞美兰肽。
在又另一方面,一种制造药物产品的方法,该药物产品包含:塞美兰肽、组分a、组分b、组分d和预定量的醇,该方法包括
以指定顺序,将塞美兰肽、组分a、组分b、组分d和添加量的醇合并,其中该添加量的醇导致该药物产品中预定量的醇,并且其中该指定顺序按顺序包括以下步骤:
(i)提供混合物(塞美兰肽-醇混合物),该混合物包含塞美兰肽和添加量的醇,例如与醇例如乙醇接触,例如溶解或分散在醇例如乙醇中的塞美兰肽;以及
(ii)将该塞美兰肽-醇混合物与一定量的组分a、b和d或组分a、b和d的全部合并;
其中在密闭器皿中进行(i)、(ii)、或(i)和(ii),从而制造药物产品,该药物产品包含塞美兰肽、组分a、组分b、组分d和预定量的醇,例如10wt.%醇,例如乙醇。
在另一方面,一种制造药物产品的方法,该药物产品包含:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a(例如,gdo);组分b(例如,大豆pc);组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液);和预定量的醇,该方法包括
以指定顺序,将以下合并:组分(e),其包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a(例如,gdo);组分b(例如,大豆pc);组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液);和添加量的醇,其中添加量的醇导致在药物产品中预定量的醇,其中该指定顺序按顺序包括以下步骤:
(i)提供包含组分(e)和添加量的醇的混合物(组分(e)-醇混合物),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该混合物例如包含与醇例如乙醇接触,例如溶解或分散在醇例如乙醇中的塞美兰肽、作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽、作为活性药物成分的塞美兰肽、作为用于注射的活性药物成分的塞美兰肽、或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);以及
(ii)将组分(e)-醇混合物与一定量的组分a(例如,gdo)、组分b(例如,大豆pc)和组分d(例如,在ph6.4下的柠檬酸盐缓冲液)或组分a、b和d的全部合并;
其中在密闭器皿中进行(i)、(ii)、或(i)和(ii),从而制造包含以下的药物产品:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a(例如,gdo);组分b(例如,大豆pc);组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液);和预定量的醇,例如10wt.%醇,例如乙醇。
在实施例中,该药物产品包含塞美兰肽。
在另一方面,一种制造包含塞美兰肽、组分a(例如,gdo)、组分b(例如,大豆pc)、组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液)和预定量的醇的药物产品的方法包括
以指定顺序,将塞美兰肽、组分a(例如,gdo)、组分b(例如,大豆pc)、组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液)和添加量的醇合并,其中该添加量的醇导致该药物产品中预定量的醇,其中该指定顺序按顺序包括以下步骤:
(i)提供混合物(塞美兰肽部分-醇混合物),该混合物包含塞美兰肽和添加量的醇,例如与醇例如乙醇接触,例如溶解或分散在醇例如乙醇中的塞美兰肽;以及
(ii)将该塞美兰肽-醇混合物与一定量的组分a(例如,gdo)、组分b(例如,大豆pc)和组分d(例如,在ph6.4下的柠檬酸盐缓冲液)或组分a、b和d的全部合并;
其中在密闭器皿中进行(i)、(ii)、或(i)和(ii),从而制造药物产品,该药物产品包含塞美兰肽、组分a(例如,gdo)、组分b(例如,大豆pc)、组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液)和预定量的醇,例如10wt.%醇,例如乙醇。
在另一方面,一种制造药物产品的方法,该药物产品包含:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a;组分b;组分d;和预定量的醇,该方法包括
以指定顺序,将以下合并:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a;组分b;组分d;和添加量的醇,其中添加量的醇导致药物产品中预定量的醇,其中该指定顺序按顺序包括以下步骤:
(i)提供混合物(组分(e)-缓冲液混合物),该混合物包含:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);添加量的醇;和组分d(例如极性溶剂,例如缓冲液,例如在ph6.4的柠檬酸盐缓冲液),该混合物例如包含与醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液接触,例如溶解或分散在醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液中的塞美兰肽、作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽、作为活性药物成分的塞美兰肽、作为用于注射的活性药物成分的塞美兰肽、或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);以及
(ii)将组分(e)-醇-缓冲液混合物与一定量的组分a和b或组分a和b的全部合并;
其中在密闭器皿中进行(i)、(ii)、或(i)和(ii),从而制造包含以下的药物产品:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a;组分b;组分d;和预定量的醇,例如10wt.%醇,例如乙醇。
在实施例中,该药物产品包含塞美兰肽。
在实施例中,组分e)提供了作为唯一活性成分的塞美兰肽。
在实施例中,组分e)提供了作为活性药物成分的塞美兰肽。
在实施例中,组分e)提供了作为用于注射的活性药物成分的塞美兰肽。
在实施例中,组分e)提供了作为唯一活性成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,组分e)提供了作为用于注射的唯一活性成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,组分e)提供了作为活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,组分e)提供了作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在一方面,一种制造包含塞美兰肽、组分a(例如,gdo)、组分b(例如,大豆pc)、组分d(例如,在ph6.4下的柠檬酸盐缓冲液)和预定量的醇的药物产品的方法包括:
以指定顺序,将该塞美兰肽、组分a、组分b、组分d和添加量的醇合并,其中该添加量的醇导致该药物产品中预定量的醇,其中该指定顺序按顺序包括以下步骤:
(i)提供混合物(塞美兰肽-醇-缓冲液混合物),该混合物包含塞美兰肽、添加量的醇和组分d例如极性溶剂例如缓冲液例如在ph6.4下的柠檬酸盐缓冲液,例如与醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液接触,例如溶解或分散在醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液中的塞美兰肽;以及
(ii)将塞美兰肽-醇-缓冲液混合物与一定量的组分a和b或组分a和b的全部合并;
其中在密闭器皿中进行(i)、(ii)、或(i)和(ii),从而制造药物产品,该药物产品包含塞美兰肽、组分a、组分b、组分d和预定量的醇,例如10wt.%醇,例如乙醇。
在另一方面,一种制造药物产品的方法,该药物产品包含:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a(例如,gdo);组分b(例如,大豆pc);组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液);和预定量的醇,该方法包括
以指定顺序,将以下合并:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a;组分b;组分d;和添加量的醇,其中添加量的醇导致药物产品中预定量的醇,其中该指定顺序按顺序包括以下步骤:
(i)提供包含组分(e)、添加量的醇、和组分d(例如极性溶剂,例如缓冲液,例如在ph6.4的柠檬酸盐缓冲液)的混合物(组分(e)-醇-缓冲液混合物),该组分(e)包含:塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该混合物例如包含与醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液接触,例如溶解或分散在醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液中的含有以下的组分(e):塞美兰肽、作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽、作为活性药物成分的塞美兰肽、作为用于注射的活性药物成分的塞美兰肽、或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);以及
(ii)将组分(e)-醇-缓冲液混合物与一定量的组分a(例如,gdo)和组分b(例如,大豆pc)或组分a和b的全部合并;
其中在密闭器皿中进行(i)、(ii)、或(i)和(ii),从而制造包含以下的药物产品:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a(例如,gdo);组分b(例如,大豆pc);组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液);和预定量的醇,例如10wt.%醇,例如乙醇。
在实施例中,该药物产品包含塞美兰肽。
在一方面,一种制造包含塞美兰肽、组分a(例如,gdo)、组分b(例如,大豆pc)、组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液)和预定量的醇的药物产品的方法包括:
以指定顺序,将该塞美兰肽、组分a、组分b、组分d和添加量的醇合并,其中该添加量的醇导致该药物产品中预定量的醇,其中该指定顺序按顺序包括以下步骤:
(i)提供混合物(塞美兰肽-醇-缓冲液混合物),该混合物包含该塞美兰肽、添加量的醇和组分d例如极性溶剂例如缓冲液例如在ph6.4下的柠檬酸盐缓冲液,例如与醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液接触,例如溶解或分散在醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液中的塞美兰肽;以及
(ii)将该塞美兰肽-醇-缓冲液混合物与一定量的组分a(例如,gdo)、组分b(例如,大豆pc)或组分a和b的全部合并;
其中在密闭器皿中进行(i)、(ii)、或(i)和(ii),从而制造药物产品,该药物产品包含塞美兰肽、组分a(例如,gdo)、组分b(例如,大豆pc)、组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液)和预定量的醇,例如10wt.%醇,例如乙醇。
在另一方面,一种制造包含以下的药物产品的方法:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法按顺序包括以下步骤:
i)将一定量的组分a、b、c和d中的一种或多种(例如,全部)合并;
ii)向此混合物提供塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);以及
iii)将(i)和(ii)的混合物混合指定的时间长度以溶解或分散塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),
从而制造具有以下的药物产品:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),例如,包含以下且包含预定量的醇例如10wt.%醇例如乙醇的药物产品:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、用于注射、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,该药物产品包含塞美兰肽。在实施例中,将该混合进行至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30小时。在实施例中,将该混合进行1-30小时。在另一实施例中,将该混合进行不超过30、40或50小时。
在一方面,一种制造包含以下的药物产品的方法:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法按顺序包括以下步骤:
i)将一定量的组分a、b、d中的一种或多种(例如,全部)和以下合并:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);
ii)向此混合物提供预定量的组分c;以及
iii)将(i)和(ii)的混合物混合指定的时间长度以溶解或分散塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),
从而制造具有以下的药物产品:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),例如,包含以下且包含预定量的醇例如10wt.%的醇例如乙醇的药物产品:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,该药物产品包含塞美兰肽。
在实施例中,将该混合进行至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30小时。在实施例中,将该混合进行1-30小时。在另一实施例中,将该混合进行不超过30、40或50小时。
在另一方面,本文披露了一种向受试者提供以下的方法:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法包括向受试者施用有效量的本文所述的药物产品或由本文所述的一种或多种方法制造的药物产品。
在实施例中,该受试者患有对黑皮质素-4受体(mc4r)的调节有反应的障碍,或具有患该障碍的风险。在实施例中,该障碍选自:1型糖尿病、2型糖尿病、肥胖症、胰岛素抵抗、代谢综合征、男性勃起功能障碍、女性性功能障碍、非酒精性脂肪肝病、非酒精性脂肪性肝炎、包括酗酒在内的物质滥用障碍、饮食障碍、恶病质、炎症或焦虑。在实施例中,该障碍是肥胖症。在实施例中,该障碍是1型糖尿病。在实施例中,该障碍是2型糖尿病。在实施例中,该障碍是普拉德-威利综合征。在实施例中,该障碍是巴-比二氏综合征。在实施例中,该障碍是阿尔斯特伦综合征。
在实施例中,该受试者在1-80岁之间。在实施例中,该受试者在1-10岁之间、10-20岁之间、20-30岁之间、30-40岁之间、40-50岁之间、50-60岁之间、60-70岁之间或70-80岁之间。在实施例中,该受试者大于80岁。
在相关方面,本披露提供了治疗受试者的方法,该方法包括向有需要的受试者施用有效量的包含以下的组合物:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,该受试者患有对黑皮质素-4受体(mc4r)的调节有反应的障碍,或具有患该障碍的风险。在实施例中,该障碍选自:1型糖尿病、2型糖尿病、肥胖症、胰岛素抵抗、代谢综合征、男性勃起功能障碍、女性性功能障碍、非酒精性脂肪肝病、非酒精性脂肪性肝炎、包括酗酒在内的物质滥用障碍、饮食障碍、恶病质、炎症或焦虑。在实施例中,该障碍是肥胖症。在实施例中,该障碍是1型糖尿病。在实施例中,该障碍是2型糖尿病。在实施例中,该障碍是普拉德-威利综合征。在实施例中,该障碍是巴-比二氏综合征。在实施例中,该障碍是阿尔斯特伦综合征。
在实施例中,该受试者在1-80岁之间。在实施例中,该受试者在1-10岁之间、10-20岁之间、20-30岁之间、30-40岁之间、40-50岁之间、50-60岁之间、60-70岁之间或70-80岁之间。在实施例中,该受试者大于80岁。
在一方面,本文提供了包含以下的组合物:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该组合物用于治疗有需要的受试者,该用途包括向该受试者施用有效量的组合物。
在实施例中,该受试者患有对黑皮质素-4受体(mc4r)的调节有反应的障碍,或具有患该障碍的风险。在实施例中,该障碍选自:1型糖尿病、2型糖尿病、肥胖症、胰岛素抵抗、代谢综合征、男性勃起功能障碍、女性性功能障碍、非酒精性脂肪肝病、非酒精性脂肪性肝炎、包括酗酒在内的物质滥用障碍、饮食障碍、恶病质、炎症或焦虑。在实施例中,该障碍是肥胖症。在实施例中,该障碍是1型糖尿病。在实施例中,该障碍是2型糖尿病。在实施例中,该障碍是普拉德-威利综合征。在实施例中,该障碍是巴-比二氏综合征。在实施例中,该障碍是阿尔斯特伦综合征。
在实施例中,该受试者在1-80岁之间。在实施例中,该受试者在1-10岁之间、10-20岁之间、20-30岁之间、30-40岁之间、40-50岁之间、50-60岁之间、60-70岁之间或70-80岁之间。在实施例中,该受试者大于80岁。
本文提供了包含以下的优化的药物产品以及制造和使用这些优化的药物产品的方法:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap,例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11。典型地,该药物产品包含中性甘油二酯和/或生育酚、磷脂酰胆碱、醇、极性溶剂(任选地包含抗氧化剂)和塞美兰肽(或本文披露的mc4rap)。在实施例中,该药物产品具有低粘度相,如l2(反胶束)相。本文披露的药物产品提供了以下的控制释放:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,该药物产品提供了优化的释放特征,相对容易制造,可以无菌过滤,在递送时具有低粘度(允许通过例如细针,例如27号或更小直径的针容易且较少痛苦地施用),允许掺入高水平的:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)(从而在实施例中,允许使用较少量的组合物和/或塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)),允许浅注射(例如,注射入皮下组织层)和/或在体内形成贮库(例如非层状贮库)组合物,例如具有“非突释”特征的贮库。在实施例中,药物产品是由无毒、可生物耐受和可生物降解的材料形成的,其可以通过肌内(i.m.)或皮下(s.c.)施用来施用,并且适于自我施用。在实施例中,药物产品最小化或消除了注射时的刺激(包括瞬时刺激)。
尽管不希望受到理论的束缚,认为在实施例中,药物产品在施用后产生结晶相,例如非层状液体结晶相。
在实施例中,药物产品提供以下的低初始释放(“非突释特征”):塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。这可以这样定义,相对于7天(例如1、2、3、4、5、6、7、8、9、10、14、21或28天)稳定状态给药间隔的药物浓度时间曲线下面积,在给药后的前几个小时(例如,前6、9、12、15、18、21或24小时)期间药物浓度曲线下的部分面积小于40%(例如,小于35%、30%、25%、20%、15%、10%或更少)。在实施例中,相对于7天(例如168小时)稳定状态给药间隔的药物浓度时间曲线下面积,给药后前6小时期间药物浓度曲线下的部分面积小于10%。在实施例中,相对于7天(例如168小时)稳定状态给药间隔的药物浓度时间曲线下面积,给药后前12小时期间药物浓度曲线下的部分面积是10%-20%(例如,10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或20%)。在实施例中,相对于7天(例如168小时)稳定状态给药间隔的药物浓度时间曲线下面积,给药后前24小时期间药物浓度曲线下的部分面积是20%-30%(例如,20%、21%、22%、23%、24%、25%、26%、27%、28%、29%或30%)。
在实施例中,在每周一次(例如,每4、5、6、7、8、9、10、11、12、13或14天一次)的5-20mg范围内的注射剂量(例如,10mg的注射剂量)后,药物产品提供了在稳定状态下血浆中5-15ng/ml范围内的平均最大药物浓度(cmax)(例如11ng/ml),该平均最大药物浓度比1-8ng/ml范围内的平均药物浓度(cave)(例如4ng/ml)高3倍以下(高1、1.5、2或2.5倍)。在实施例中,在每周一次10mg的注射剂量后,药物产品提供了在稳定状态下血浆中11ng/ml的平均最大药物浓度(cmax),该平均最大药物浓度比4ng/ml的平均药物浓度(cave)高3倍以下。
在实施例中,在给药时,在稳定状态下血浆中最小药物浓度(cmin)在1-3ng/ml的范围内(例如,1.88ng/ml)。在实施例中,平均累计指数在1-3的范围内(例如,1.48),并且平均波动因子在180%-210%的范围内(例如,199%)。在实施例中,塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),在稳定状态下在血浆中的特征提供了一周(例如4、5、6、7、8、9、10、11、12、13或14天)给药间隔内的药物覆盖。
在实施例中,将本文所述的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)进行优化,以允许将中性二酰基脂质和/或生育酚和磷脂组分以宽范围比例进行配制。在实施例中,药物产品与先前获得的相比,中性二酰基脂质和/或生育酚与磷脂的比例更大,在配制品中无相分离风险和/或无不可接受的高粘度。在实施例中,中性二酰基脂质和/或生育酚与磷脂的比率是1:1,或在0.5至1.0、0.7至1.0或1至0.5或1至0.7之间的比率。
本文所述的方法允许制剂中更严格和准确水平的醇。醇的水平可以影响释放动力学,例如突释特征。太高的水平可影响例如负面影响释放动力学,例如突释特征。因此,对醇的水平的控制可以允许更可预测和可重复地实现优化的释放特征。醇的水平也可影响注射前的粘度,醇水平越高导致粘度越低。因此,确定和可重复的醇水平可允许优化的性能。本文描述了将已知量的醇的添加与步骤合并以最小化或控制蒸发损失水平的方法。在实施例中,制造本文所述的药物产品的方法包括使用控制量的醇以制造药物产品。在实施例中,例如通过使用密闭器皿(从而减少或控制蒸发),制备药物产品从而减少或控制蒸发。密闭器皿的使用可以允许严格调节用于制造药物产品的醇的量,并且可以改善药物产品的可重现性。防止蒸发损失是减少药物产品批次之间以及批次内各个剂量单位之间变化的重要特征。由于该配制品可用于在体内递送塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),重要的是每批次的药物产品以相似的浓度含有相似量的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;或mc4rap。
本文尤其披露了将组分添加到制剂中的指定顺序。该指定顺序可以对制剂中组分相互的溶解度,例如以下的溶解度具有显著影响:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,一种制造本文所述的药物产品的方法包括以指定顺序添加组分以制造药物产品。在实施例中,在使塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)与醇接触之后,使塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)与一种或多种其他组分接触。该方法可以进一步优化制造该制剂所需的时间。由特定顺序添加组分产生的具有以下的药物产品具有低粘度和与体内使用相容的一定量的醇:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,可以将醇含量的控制和添加顺序合并。
本披露预期了任何一个或多个前述方面和/或实施例的所有组合,以及在具体描述和实例中提出的任何一个或多个实施例的组合。
虽然类似或等同于本文所述的那些的方法和材料可以用于本发明的实践或测试,但是以下描述了适合的方法和材料。本文提及的所有出版物、专利申请、专利和其他参考(例如,序列数据库参考号)通过引用以其全文而结合。
附图说明
图1a-b是描绘皮下注射塞美兰肽配制品1a-1c(这些配制品的组分在表4中提供)、5a-5c(这些配制品的组分在表2中提供)和3a/4a(这些配制品的组分在表3中提供);和sc输注塞美兰肽的浓度时间特征的图。图1a描绘了线性标度的浓度数据,以及图1b描绘了半对数标度的浓度数据。
图2a-b是描绘皮下注射塞美兰肽配制品1d-1e(这些配制品的组分在表4中提供)和5d(这些配制品的组分在表2中提供);和sc输注塞美兰肽的浓度时间特征的图。图2a描绘了线性标度的浓度数据,以及图2b描绘了半对数标度的浓度数据。
图3是示出了向健康受试者施用单次皮下剂量(30mg、10mg或2.5mg)后血浆中平均塞美兰肽浓度(ng/ml)的图。
图4是描绘在每周多次给予皮下注射长效塞美兰肽配制品持续4周后,受试者的血浆中塞美兰肽的谷浓度(ng/ml)的图。
图5是示出在示例性配制品中塞美兰肽的降解百分数的图,其中gdo组分是i)商业纯度的gdo;ii)商业纯度的gdo,经进一步纯化以除去脂肪酸化合物;iii)或合成的gdo。
图6是描绘edta浓度对示例性塞美兰肽配制品的稳定性的影响的图。
图7是描绘示例性塞美兰肽配制品中塞美兰肽浓度的影响及其对降解的影响的图。
具体实施方式
本披露至少部分提供了一种药物产品,该药物产品包含:塞美兰肽(也称为rm493);作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的具有mc4受体激动剂(称为mc4rap)的主要作用机制的另一种药物组合物,所述mc4受体激动剂例如为bim-22511(也称为rm511)、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或者如wo2008/147556中披露为seqidno:11的mc4受体激动剂(称为mc4r-11)。
本披露的药物产品在施用后产生非层状液体结晶相。在生物活性剂的递送中使用非层状相结构(如液体结晶相)是本领域已知的。示例性脂质贮库系统描述于例如wo2005/117830中,将其全部内容通过引用以其整体并入。
除非另外指出,否则所有%均在本文全文中以重量计指定。此外,所指示的重量%是包括本文所指示的所有组分的总药物产品的%。该药物产品可以任选地基本上仅由本文所指示的组分(包括在适当的情况下本文下文和所附权利要求中指示的其他任选的组分)组成,并且一方面完全由此类组分组成。
在实施例中,药物产品具有l2相结构。在实施例中,该药物产品在施用后形成非层状(例如液体结晶)相。
在实施例中,药物产品允许在释放时间段内将血浆中药物的峰浓度(cmax)控制在等于或小于受试者可耐受的水平,例如以避免副作用,例如头痛、血压、心率、呼吸速率变化、过度出汗或其他不良或不希望的影响,同时提供或达到有效的例如治疗有效的水平。通常,在施用下一个剂量之前在释放时间段期间,平均浓度cave落在治疗范围内。为了随时间获得有效和安全的治疗,在限定的剂量期内(例如每周一次或每月一次)对最大(cmax)和最小(cmin)浓度的控制也很重要。在一个实施例中,初始突释不是释放特征的cmax。
不管初始突释是否还是cmax,cmax/cave比率都小于或等于10。在实施例中,cave/cmin比率小于或等于10,例如小于或等于9、8、7、6、5、4、3、2或1。在实施例中,cave/cmin比率小于3。cmax被定义为在施用下个剂量之前在释放时间段期间观察到的峰或最大血浆浓度,并且cave被定义为在该释放时间段期间的平均血浆浓度。相应地cmin是在此期间的最小浓度。可以通过将血浆中存在的药物计算为在所选的时间段(通常在施用下个剂量前整个释放时间段)内的曲线下面积(auc),并且除以该时间段来计算cave。
组分(a)—中性二酰基脂质和/或生育酚
如本文所述,组分“a”是包含极性“头”基团和非极性“尾”基团的中性脂质。通常,脂质的头和尾部分将通过酯部分连接,但是此附接可以借助于醚、酰胺、碳-碳键或其他附接。在实施例中,极性头基团包含非离子头基团,该非离子头基团包括多元醇(例如甘油、二甘油或糖部分(例如,基于肌醇或葡糖基的部分))以及多元醇的酯(例如乙酸酯或琥珀酸酯)。在实施例中,极性“头”基团包含甘油或二甘油。
在实施例中,组分(a)包含具有两个非极性“尾”基团的二酰基脂质。两个非极性基团可以具有相同或不同数目的碳原子,并且可以各自独立地为饱和或不饱和的。在实施例中,两个非极性“尾”基团可以具有相同或不同数目的碳原子,并且可以各自独立地为饱和或不饱和的。在实施例中,非极性基团包括c6-c32烷基和烯基基团,其通常作为长链羧酸的酯存在。这些通常通过参考碳原子数目和碳链中的不饱和数目来描述。因此,cx:z指示具有x个碳原子和z个不饱和键的烃链。
在实施例中,组分(a)的非极性“尾”基团选自:月桂酰基(c12:0)、肉豆蔻酰基(c14:0)、棕榈酰基(c16:0)、植烷酰基(c16:0)、棕榈油酰基(c16:1)、硬脂酰基(c18:0)、油酰基(c18:1)、反油酰基(c18:1)、亚油酰基(c18:2)、亚麻酰基(c18:3)、花生四烯酰基(c20:4)、山嵛酰基(c22:0)或二十四碳酰基(c24:9)。通常,非极性链基于天然酯脂质的脂肪酸(包括己酸、辛酸、癸酸、月桂酸、肉豆蔻酸、棕榈酸、植烷酸、棕榈油酸、硬脂酸、油酸、反油酸、亚油酸、亚麻酸、花生四烯酸、山嵛酸或二十四烷酸)或相应的醇。在实施例中,组分(a)的非极性“尾”基团选自棕榈酸、硬脂酸、油酸或亚油酸。在实施例中,组分(a)的非极性“尾”基团是油酸。
在实施例中,组分(a)的二酰基脂质选自:丁酸(c4)、戊酸(c5)、己酸(c6)、庚酸(c7)、辛酸(c8)、壬酸(c9)、癸酸(c10)、十一烷酸(c11)、月桂酸(c12)、十三烷酸(c13)、肉豆蔻酸(c14)、十五烷酸(c15)、棕榈酸(c16)、十七烷酸(c17)、硬脂酸(c18)、十九烷酸(c19)、花生酸(c20)、二十一烷酸(c21)、山萮酸(c22)、二十三烷酸(c23)、二十四烷酸(c24)、二十五烷酸(c25)、二十六烷酸(c26)、二十七烷酸(c27)、二十八烷酸(c28)、二十九烷酸(c29)、三十烷酸(c30)、三十一烷酸(c31)、三十二烷酸(c32)、三十三烷酸(c33)、三十四烷酸(c34)、三十五烷酸(c35)、三十六烷酸(c36)、三十七烷酸(c37)、三十八烷酸(c38)、α-亚麻酸(18:3)、亚麻油酸(18:4)、二十碳五烯酸(20:5)、二十二碳六烯酸(22:6)、亚油酸(18:2)、γ-亚麻酸(18:3)、二高-γ-亚麻酸(20:3)、花生四烯酸(20:4)、二十二碳四烯酸(22:4)、棕榈油酸(16:1)、异油酸(18:1)、二十烯酸(20:1)、油酸(18:1)、反油酸(反式-18:1)、巨头鲸鱼酸(20:1)、芥酸(22:1)、神经酸(24:1)和米德酸(20:3)或与酸形成的任何药学上可接受的酯。
在实施例中,任何数目的二酰基脂质的混合物可以用作组分(a)。在实施例中,组分(a)包含c18脂质的部分(例如,具有一个或多个c18:0、c18:1、c18:2或c18:3非极性“尾”基团的甘油二酯),例如,二油酸甘油酯(gdo)或二亚油酸甘油脂(gdl)。
在实施例中,组分(a)的二酰基脂质包含甘油二酯(dag),例如,二油酸甘油酯(gdo)。在实施例中,组分(a)的dag是gdo。
在实施例中,组分(a)是包含至少50wt.%、至少80wt.%、至少90wt.%、至少95wt.%或100wt.%gdo的dag。在实施例中,组分(a)包含100wt.%gdo。
在实施例中,二酰基脂质,当用作组分(a)的全部或部分时,可以是合成的或可以衍生自纯化的和/或化学修饰的天然来源,例如植物油。在实施例中,二酰基脂质(例如dag,例如gdo)是合成的。在实施例中,二酰基脂质(例如dag,例如gdo)衍生自天然来源,例如植物来源或细菌来源。
在实施例中,二酰基脂质具有至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%、99.9%或更高的纯度。在一些实施例中,二酰基脂质是gdo。在实施例中,gdo具有至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%、99.9%或更高的纯度。在实施例中,gdo具有至少50%的纯度。在实施例中,gdo具有至少75%的纯度。在实施例中,gdo具有至少85%的纯度。在实施例中,gdo具有至少90%的纯度。在实施例中,gdo具有至少95%的纯度。在实施例中,gdo具有至少98%的纯度。在实施例中,gdo具有至少99%的纯度。在实施例中,gdo具有在约50%至100%、约75%至约100%、或约90%至100%之间的纯度。在实施例中,gdo具有在约85%至99%、约88%至96%、约90%至98%、约90%至96%、约90%至94%、约90%至92%、约92%至98%、约92%至96%、约92%至94%、约94%至98%、约94%至96%、约96%至98%、或98%至100%之间的纯度。
在实施例中,如本文所述,gdo是指具有伴随杂质的任何商业级别的gdo(商业纯度的gdo)。示例性杂质包括不期望的脂质和脂肪酸化合物。这些杂质可以通过纯化来分离和除去。在实施例中,gdo包含化学纯的gdo,例如,至少80%纯、至少85%纯、至少90%纯、至少95%纯、至少99%纯或100%纯的gdo。在实施例中,gdo含有少于约50%、45%、40%、35%、30%、25%、20%、15%、10%、5%、2.5%、1%或0.5%的杂质,例如不期望的脂质或脂肪酸化合物。在实施例中,gdo含有少于约20%的杂质,例如不期望的脂质或脂肪酸化合物。在实施例中,gdo含有少于约10%的杂质,例如不期望的脂质或脂肪酸化合物。在实施例中,gdo含有少于约5%的杂质,例如不期望的脂质或脂肪酸化合物。在实施例中,gdo含有少于约2%的杂质,例如不期望的脂质或脂肪酸化合物。在实施例中,gdo含有少于约1%的杂质,例如不期望的脂质或脂肪酸化合物。
在实施例中,不期望的脂质或脂肪酸化合物是饱和脂质或不饱和脂质。示例性不期望的脂质或脂肪酸化合物包括丙酸、丁酸、戊酸、己酸、庚酸、辛酸、壬酸、癸酸、十一烷酸、十三烷酸、肉豆蔻酸、棕榈酸、十七烷酸、硬脂酸、十九烷酸、花生酸、二十一烷酸、山萮酸、二十三烷酸、二十四烷酸、二十五烷酸、二十六烷酸、二十七烷酸、二十八烷酸、二十九烷酸、三十烷酸、三十一烷酸、三十二烷酸、三十三烷酸、三十四烷酸、三十五烷酸、三十六烷酸、三十七烷酸、三十八烷酸、肉豆蔻油酸、棕榈油酸、异油酸、顺式-异油酸、二十烯酸、油酸、反油酸、11-二十碳烯酸(即,巨头鲸鱼酸)、芥酸(erucicacid)、芸苔酸(brassidicacid)、神经酸、十六碳烯酸(sapienicacid)、鳕油酸、岩芹酸和亚油酸(例如,α-亚麻酸)或者其异构体或变体。
在实施例中,组分(a)包含生育酚。在实施例中,组分(a)的生育酚包含非离子脂质生育酚(例如,维生素e)或其任何合适的盐或类似物。在实施例中,生育酚的合适的类似物包含提供以下特征的那些:暴露于水性流体后,相行为、无毒性和相变化。
在实施例中,生育酚是从天然来源纯化,并且可以包含少于10wt.%的非生育酚“污染物”,例如,包含少于10、5、4、3、2、1wt.%或更少污染物。在实施例中,组分(a)包含至少50、80、85、90、95、99wt.%或更多的生育酚(例如,维生素e)或其任何合适的盐或类似物。在实施例中,组分(a)包含100wt.%生育酚(例如,维生素e)或其任何合适的盐或类似物。
组分(b)--磷脂酰胆碱
如本文所述,组分“b”包含含有极性头基团和至少一个非极性尾基团的磷脂。该非极性尾基团可以衍生自以上针对组分a所描述的脂肪酸或相应醇。在实施例中,组分(b)的磷脂含有两个非极性尾基团。在一个实施例中,组分(b)的磷脂包含c18基团,并且可以与任何其他合适的非极性尾基团,特别是c16基团组合。在一个实施例中,组分(b)的磷脂包含两个相同的非极性尾基团。
在实施例中,组分(b)的磷脂包含选自以下的极性头基团:磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸或磷脂酰肌醇。在实施例中,组分(b)的磷脂的极性头基团是磷脂酰胆碱(pc)。在实施例中,组分(b)包含至少50wt.%、至少70wt.%、至少80wt.%、至少90wt.%、至少95wt.%、至少99wt.%或100wt.%pc。在实施例中,组分(b)包含pc。
在实施例中,组分(b)的pc可以是天然衍生的,例如卵pc、心pc(例如,牛心pc)、脑pc、肝pc(例如,牛脑pc或牛肝pc)和植物(例如,大豆pc)。在实施例中,天然衍生的pc可以包含磷脂的任何混合物。在实施例中,天然衍生的pc包含大豆pc或卵pc。在实施例中,天然衍生的pc包含大豆pc。在实施例中,pc包含至少50wt.%大豆pc或卵pc、至少75wt.%大豆pc或卵pc、至少80wt.%大豆pc或卵pc、至少90wt.%大豆pc或卵pc、至少95wt.%大豆pc或卵pc、至少99wt.%大豆pc或卵pc或100wt.%大豆pc或卵pc。
在实施例中,组分(b)的pc是大豆pc。在实施例中,pc包含18:2脂肪酸作为主要的脂肪酸组分,16:0和/或18:1作为次要脂肪酸组分,其中主要酸组分与次要酸组分的比率在1.5:1与6:1之间。在实施例中,组分(b)的pc包含60%-65%18:2、10%至20%16:0、5%-15%18:1,其余主要为其他16碳和18碳脂肪酸。在实施例中,由大豆pc构成的pc具有上述组成。
在实施例中,组分(b)的pc包含合成的二油酰基pc。认为合成的二油酰基pc提供了增加的稳定性,并且因此适用于需要在长期储存下稳定和/或具有体内长释放时间段的组合物。在实施例中,组分(b)的pc包含至少50wt.%、至少75wt.%、至少80wt.%、至少90wt.%、至少95wt.%、至少99wt.%或100wt.%的合成二油酰基pc。
在实施例中,组分(b)的磷脂具有至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%、99.9%或更高的纯度。在一些实施例中,组分(b)的磷脂是磷脂酰胆碱(pc)。在实施例中,pc具有至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%、99.9%或更高的纯度。
在实施例中,组分(b)包含合成的或高度纯化的pc,例如二油酰基磷脂酰胆碱(dopc)。在实施例中,合成的二油酰基pc包括1,2-二油酰基-sn-甘油-3-磷酸胆碱和其他合成的pc组分,例如,ddpc(1,2-二癸酰基-sn-甘油-3-磷酸胆碱);depc(1,2-二芥酰基-sn-甘油-3-磷酸胆碱);dlopc(1,2-二亚油酰基-sn-甘油-3-磷酸胆碱);dlpc(1,2-二月桂酰基-sn-甘油-3-磷酸胆碱);dmpc(1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱);dopc(1,2-二油酰基-sn-甘油-3-磷酸胆碱);dppc(1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱);dspc(1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱);mppc(1-肉豆蔻酰基-2-棕榈酰基-sn-甘油-3-磷酸胆碱);mspc(1-肉豆蔻酰基-2-硬脂酰基-sn-甘油-3-磷酸胆碱);pmpc(1-棕榈酰基-2-肉豆蔻酰基-sn-甘油-3-磷酸胆碱);popc(1-棕榈酰基-2-油酰基-sn-甘油-3-磷酸胆碱);pspc(1-棕榈酰基-2-硬脂酰基-sn-甘油-3-磷酸胆碱);smpc(1-硬脂酰基-2-肉豆蔻酰基-sn-甘油-3-磷酸胆碱);sopc(1-硬脂酰基-2-油酰基-sn-甘油-3-磷酸胆碱);和sppc(1-硬脂酰基-2-棕榈酰基-sn-甘油-3-磷酸胆碱)或其任何组合。
在实施例中,包含合成的或高度纯化的pc(例如dopc)的组分(b)可以为配制品中的活性剂提供更大的稳定性。在其中配制品不包含抗氧化剂的实施例中,组分(b)包含(例如,至少75wt.%)合成的或高度纯化的(例如,纯度>90%)pc(例如,dopc)。在实施例中,其中配制品包含抗氧化剂,组分(b)包含(例如包含至少75wt.%)天然衍生的pc,例如大豆pc或卵pc。
在实施例中,该药物产品包含在20-80wt.%、30-70wt.%、33-60wt.%或38-43wt.%范围内的组分(a)。在实施例中,该药物产品包含在20-80wt.%、30-70wt.%、33-55wt.%或38至43wt.%范围内的组分(b)。
在实施例中,该药物产品包含42wt.%的组分(a)。在实施例中,该药物产品包含42wt.%的组分(a),其中该中性二酰基脂质是二油酸甘油酯(gdo)。
在实施例中,该药物产品包含42wt.%的组分(b)。在实施例中,该药物产品包含42wt.%的组分(b),其中该磷脂是磷脂酰胆碱(pc)。在实施例中,该pc是大豆pc。
在实施例中,该药物产品包含至少80、70、60、50、40、30或20wt.%组分(a)。在实施例中,该药物产品包含至少80、70、60、50、40、30或20wt.%组分(b)。在实施例中,该药物产品包含至少42%组分(a)(例如,gdo)和至少42%组分(b)(例如,大豆pc)。
在实施例中,该药物产品包含组分(a)和(b),其中组分(a)(例如,gdo)以42wt.%+/-10、42wt.%+/-5、42wt.%+/-2或42wt.%+/-1存在。
在实施例中,该药物产品包含组分(a)和(b),其中组分(b)(例如,大豆pc)以42wt.%+/-10、42wt.%+/-5、42wt.%+/-2或42wt.%+/-1存在。
在实施例中,该药物产品包含组分(a)和(b),其中组分(a)(例如,gdo)和组分(b)(例如,大豆pc)各自以42wt.%+/-10、42wt.%+/-5、42wt.%+/-2或42wt.%+/-1存在。
在实施例中,组分(a):(b)的比率是40:60至70:30、45:55至55:45或40:60至54:46。在实施例中,(a):(b)的比率是50:50。
在实施例中,组分(a)和(b)构成药物产品中95wt.%,例如至少95、96、97、98、99wt.%或更多的脂质组分。在实施例中,组分(a)和(b)构成药物产品中99wt.%的脂质组分。在实施例中,药物产品的脂质组分基本上包含全部例如100wt.%组分(a)和(b)。
组分(c)--醇
如本文所述的组分(c)包含醇。由于药物产品在施用后(例如体内)通常在与过量的水性流体接触后可用于产生贮库组合物,因此希望该醇对受试者是耐受的并且能够与水性流体混合和/或从配制品中扩散或溶解到水性流体中。在实施例中,组分(c)包含具有至少中等水溶性的醇。
在实施例中,组分(c)的醇包含乙醇、丙醇、异丙醇或其混合物。在实施例中,组分(c)包含乙醇。
在实施例中,向包含(a)和(b)的混合物中添加或存在少于20wt.%(例如,少于20、15、14、13、12、11、10、9、8、7、6、5、4、3.5、3、2.5、2、1wt.%或更少)的醇给出了大的粘度降低,例如30%-70%的粘度降低,例如,30%、40%、50%、60%或70%降低或更多降低。在实施例中,向包含(a)和(b)的混合物中添加或存在10wt.%的醇给出了50%的粘度降低。
在实施例中,向包含(a)和(b)的混合物中添加或存在至少10wt.%醇给出了至少50%的粘度降低(例如,至少51%、52%、53%、54%、55%、56%、57%、58%、59%或60%粘度降低)。在实施例中,向包含(a)、(b)和至少10wt.%醇的混合物中添加或存在至少2.5%wt.%醇给出了至少50%的进一步的粘度降低(例如,至少51%、52%、53%、54%、55%、56%、57%、58%、59%或60%粘度降低)。在实施例中,向包含(a)、(b)和至少12.5wt.%醇的混合物中添加或存在至少3.5wt.%醇给出了至少50%的进一步的粘度降低(例如,至少51%、52%、53%、54%、55%、56%、57%、58%、59%或60%粘度降低)。
药物产品中的组分(c)的量可能会对若干特征产生重大影响。具体而言,粘度和释放速率(及持续时间)将随醇水平变化。因此,醇的量将至少足以提供低粘度的混合物,该低粘度的混合物可以通过患者向注射装置施加手动压力而容易并且舒适地进行注射,但是醇的量将另外进行确定以提供释放速率。
当使用机械或其他动力装置(例如通过施加高于手动施加的力的力辅助注射的装置,例如自动注射器)施用药物产品时,物理属性(如粘度)和重现性(例如批次间或注射间的重现性)很重要。当使用此类装置例如自动注射器施用该药物产品时,批次内和批次之间的醇(例如乙醇)含量的一致性对于可重现的性能例如优化的药代动力学是重要的。
通常,0.1-35wt.%或5-20wt.%醇的水平将提供合适的释放和粘度特性。醇的量还将至少足以确保以下的溶解度:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,该药物产品包含一定量的组分(c),例如乙醇,该组分(c)足以提供至少10mg/g、20mg/g、30mg/g、40mg/g、50mg/g或更高的以下项的溶解度:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,该药物产品包含一定量的组分(c),例如乙醇,该组分(c)足以提供至少30mg/g的以下项的溶解度:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,药物产品中组分(c)的量足够低,以使在注射后,在施用下个剂量之前药物在皮下注射后的初始突释产生小于8(例如,小于7、6.5、6、5.5、5、4.5、4、3.5、3、2.5、2或更小)的血浆中最大浓度(cmax)与血浆中最小浓度(cmin)的比率。
在实施例中,该药物产品包含0.1-35wt.%、5-20wt.%、8-15wt.%或9-11wt.%组分(c)。在实施例中,该药物产品包含20、15、14、13、12、11、10、9、8、7、6、5wt.%或更少的组分(c),其中组分(c)的醇是乙醇。在实施例中,该药物产品包含10wt.%组分(c),其中组分(c)的醇是乙醇。
本文所述的药物产品中组分(c)的量足以提供组分(a)、(b)、(c)和(d)的低粘度混合物(例如分子溶液),并且可以通过标准方法针对组分的任何特定组合被确定。
在实施例中,组分(c)包含小于5wt.%(例如小于5、4、3、2、1wt.%或更少)的经卤素取代的烃,这些烃具有较低的生物相容性。
可以通过技术,如目视观察与偏振光显微镜、x射线散射和衍射技术、核磁共振和低温透射电子显微镜(cryo-tem)相组合,分析相行为,以观察分子溶液、l2或l3相或液体结晶相或在cryotem的情况下时此类相的分散片段。可以通过标准手段直接测量粘度。在实施例中,适当的实际粘度是可以允许将有效压力施加在例如含有药物产品的装置(例如注射筒,例如手动注射筒(例如,通过手动压力)或弹簧加载注射筒(例如,自动注射器))上的粘度。在实施例中,具有合适的实际粘度的药物产品允许将压力施加到装置(例如具有附接的针的注射筒,例如具有适用于注射的小直径的针(例如27号针))上以施用(例如释放)该药物产品。在实施例中,可以将具有合适的实际粘度的药物产品例如通过孔径为0.2微米或更小的过滤器进行无菌过滤。
在实施例中,组分(c)包含单一醇或醇(例如具有低粘度的醇)的混合物。在实施例中,本文提供的配制品具有低粘度,并且合适的溶剂的主要作用是降低此粘度。此降低将归因于较低的溶剂粘度的影响和溶剂与脂质组合物之间的分子相互作用的影响的组合。本文披露了以下观察结果:本文所述的低粘度含氧溶剂具有与组合物的脂质部分有利的分子相互作用,从而在添加小体积溶剂的情况下提供了粘度的非线性降低。
在实施例中,组分(c)的低粘度醇(单一溶剂或混合物)的粘度在20℃下不大于18mpas,例如不大于15mpas、10mpas或7mpas。
在实施例中,该药物产品包含组分(a)、(b)和(c),其中组分(a)是gdo,组分(b)是大豆pc,以及组分(c)是乙醇。在实施例中,该药物产品包含42wt.%的组分(a)、42wt.%的组分(b)和10wt.%的组分(c),其中组分(a)是gdo,组分(b)是大豆pc,以及组分(c)是乙醇。
组分(d)-极性溶剂或缓冲液
在实施例中,将醇与极性溶剂(如二醇或水或水性溶液,例如水性缓冲液,例如柠檬酸盐缓冲液)组合使用允许改善基于脂质的控释组合物的性能。已经观察到二醇(例如丙二醇)或水的添加降低了药物产品脂质/醇/塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的粘度,而不会不利影响塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的释放特征,和/或允许增加醇的比例而不会不利影响释放特征和/或允许改善释放特征。当在本文中使用时,“不利影响释放特征”指示cmax/cave的比率增加和/或cmax/cmin的比率增加,例如增加至少1.2倍。类似地,当在本文中使用时,“改善释放特征”指示cmax/cave和/或cmax/cmin的比率降低,例如降低至少1.2倍。
在实施例中,包含极性溶剂(例如包含水的极性溶剂)允许改进对初始释放的控制,并且允许以下的更高的稳定负载:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,包含极性溶剂(例如包含水的极性溶剂)的输注提供了更快的储库形成和/或提供了注射后进一步减轻的不适感。在治疗性药物递送、患者健康和/或患者依从性的背景中,这些因素中的任何一个都提供了显著的改善。
本文所述的组分(d)包含稳定药物产品ph的极性溶剂,例如,包含水并且任选地包含ph调节或缓冲化合物的溶剂。在实施例中,组分(d)的极性溶剂选自:组氨酸缓冲液、柠檬酸盐缓冲液、琥珀酸盐缓冲液、乙酸盐缓冲液或磷酸盐缓冲液或其混合物。在实施例中,组分(d)包含柠檬酸盐缓冲液、l-组氨酸缓冲液、或l-组氨酸和盐酸l-组氨酸缓冲液的混合物。在实施例中,组分(d)是柠檬酸盐缓冲液。
在实施例中,组分(d)的柠檬酸盐缓冲液包含5.8至7范围内的ph,例如,5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9或7.0的ph。在实施例中,组分(d)的柠檬酸盐缓冲液包含6.4的ph。
在实施例中,该药物产品包含至少10wt.%(例如,展示10、9、8、7、6、5、4、3、2、1、0.5wt.%或更少)的组分(d),其中组分(d)是缓冲液,例如,在ph6.4下的柠檬酸盐缓冲液。在实施例中,该药物产品包含在0.5-10wt.%、1-5wt.%或1-3wt.%范围内的组分(d),其中组分(d)是缓冲液,例如,在ph6.4下的柠檬酸盐缓冲液。在实施例中,该药物产品包含2wt.%的组分(d),其中组分(d)是缓冲液,例如,在ph6.4下的柠檬酸盐缓冲液。
在实施例中,组分(d)的柠檬酸盐缓冲液包含柠檬酸一水合物和任选地抗氧化剂,例如乙二胺四乙酸二钠(edta二钠盐)。在实施例中,组分(d)包含30mm柠檬酸一水合物的溶液。例如,30mm、25mm、24mm、23mm、22mm、21mm、20mm、15mm、10mm或5mm柠檬酸一水合物。在实施例中,组分(d)包含23mm柠檬酸一水合物的溶液。
在实施例中,组分(d)的柠檬酸盐缓冲液包含柠檬酸一水合物和抗氧化剂,例如,其中该抗氧化剂是乙二胺四乙酸二钠(edta)。在实施例中,组分(d)包含30mm柠檬酸一水合物(例如,30、25、24、23、22、21、20、15、10或5mm柠檬酸一水合物)的溶液和350μm乙二胺四乙酸二钠(例如,350、340、330、320、310、300、290、280、270、260、250、200、100或50um乙二胺四乙酸二钠)的溶液。在实施例中,组分(d)包含23mm柠檬酸一水合物的溶液和300um乙二胺四乙酸二钠的溶液。
在实施例中,组分(d)包含任选的组分,例如选自以下的抗氧化剂或化学或物理稳定剂:edta(例如,乙二胺四乙酸盐,与药学上可接受的盐如但不限于钠盐、钙盐、镁盐)、bha(丁基化羟基茴香醚)、bht(丁基化羟基甲苯)、抗坏血酸、α生育酚(维生素-e)或硫代硫酸盐(与药学上可接受的盐如但不限于钠盐或钙盐)。
在实施例中,组分(d)的任选的组分,例如抗氧化剂或化学或物理稳定剂,可以稳定并且抑制本文所述的以下的氧化降解:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11。在实施例中,组分(d)的任选的组分,例如抗氧化剂或化学或物理稳定剂,不降低以下的溶解度:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);或不降低药物产品的透明度,例如溶液的透明度。在实施例中,组分(d)的任选的组分,例如抗氧化剂或化学或物理稳定剂,不降低药物产品在注射后或与模拟的生理学流体接触后形成结构化凝胶样结构的能力。
在实施例中,组分(d)的抗氧化剂增加了溶解的或分散的以下项的物理和化学稳定性:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),导致了在抗氧化剂的存在下更大量的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,在脂质配制品中在通常的储存条件(例如,0-5℃或20℃-25℃)下,组分(d)的抗氧化剂增加了以下的化学和/或物理稳定性:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
通过包含一些可与醇组分混溶的极性溶剂(尤其是水),可以基本上消除在注射部位由醇含量引起的轻微感觉。在实施例中,该药物产品包含比率在10:90至90:10、20:80至80:20、30:70至70:30、或40:60至60:40之间的组分(c):(d)。
在实施例中,该药物产品包含组分(c)和(d),其中组分(c)包含乙醇(例如,至少20、15、14、13、12、11、10、9、8、7、6、5wt.%或更少的乙醇),以及组分(d)包含任选地含有抗氧化剂的柠檬酸盐缓冲液(例如,至少10、9、8、7、6、5、4、3、2、1、0.5wt.%或更少的柠檬酸盐缓冲液,任选地包含抗氧化剂)。在实施例中,该配制品包含10%的乙醇和2%的柠檬酸盐缓冲液,其中该缓冲液任选地包含抗氧化剂。
在实施例中,本文所述的药物产品包含gdo(例如,40-70wt.%gdo)、大豆pc(例如,40-70wt.%gdo)、乙醇(例如,5-20wt.%乙醇)和含有乙二胺四乙酸二钠的柠檬酸盐缓冲液(例如,0.5-10wt.%的包含300mm乙二胺四乙酸二钠的23mm柠檬酸盐缓冲液)或其混合物。在实施例中,该药物产品包含42wt.%gdo、42wt.%大豆pc、10wt.%乙醇、2wt.%的包含300mm乙二胺四乙酸二钠的23mm柠檬酸盐缓冲液或其混合物。
组分(e)
如本文所述,组分(e)包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,组分e)包含塞美兰肽。
在本文所述的任一个实施例中,组分(e)包含在合适的盐或凝胶形式中的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,该盐形式是药学上可接受的盐。示例性盐(例如,药学上可接受的盐)包括乙酸盐、苯磺酸盐、苯甲酸盐、重碳酸盐、酒石酸氢盐、溴化物、依地酸钙、樟脑磺酸盐、碳酸盐、氯化物、柠檬酸盐、二氢氯化物、依地酸盐、乙二磺酸盐、丙酸月桂基硫酸盐(estolate)、乙磺酸盐、富马酸盐、葡庚糖酸盐(glyceptate)、葡萄糖酸盐、谷氨酸盐、对羟乙酰氨基苯胂酸盐、己基间苯二酚盐、氢溴化物、盐酸盐、羟萘甲酸盐、碘化物、羟乙磺酸盐、乳酸盐、乳糖醛酸盐、苹果酸盐、马来酸盐、扁桃酸盐、甲磺酸盐、甲基硫酸盐、粘酸盐、萘磺酸盐、硝酸盐、扑酸盐、泛酸盐、磷酸盐/二磷酸盐、聚半乳糖醛酸盐、水杨酸盐、硬脂酸盐、碱式乙酸盐、琥珀酸盐、硫酸盐、鞣酸盐、酒石酸盐、茶氯酸盐、甲苯磺酸盐、三乙基碘以及三氟乙酸盐。在实施例中,组分(e)包含在合适的盐(例如氯化物盐)中的塞美兰肽。在实施例中,组分(e)包含以下的氯化物盐:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,组分(e)包含塞美兰肽的氯化物盐。
在实施例中,组分(e)包含mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。表1中描述了示例性mc4rap化合物的结构。
表1:mc4rap化合物的结构
在实施例中,组分(e)包含mc4rap,例如,如国际申请wo2008/147556中所述的包含seqidno:11的化合物,将该文献的全部内容通过引用特此并入。在实施例中,包含seqidno:11的化合物在本文中称为mc4r-11。
在实施例中,包含seqidno:11的化合物(例如,mc4r-11)的实例包括:
环[乙内酰脲(c(o)-(glu-d-ala))-his-d-phe-arg-trp-orn]-nh2;
环[乙内酰脲(c(o)-(glu-d-ala))-his-d-phe-arg-trp-dab]-nh2;或环[乙内酰脲(c(o)-(glu-d-ala))-his-d-phe-arg-trp-dap]-nh2;
或其药学上可接受的盐,特别是环[乙内酰脲(c(o)-(glu-d-ala))-his-d-phe-arg-trp-dap]-nh2。
在实施例中,包含seqidno:11的化合物,也称为mc4r-11,包含以下氨基酸序列:
hxrwx(seqidno:11),其中x可以选自:鸟氨酸(orn);2,4-二氨基丁酸(dab);或2,3-二氨基丙酸(dap)。
在实施例中,该药物产品包含0.02-12wt.%的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,该药物产品包含0.02-12wt.%的塞美兰肽。
在实施例中,该药物产品包含0.1-10wt.%、0.2-8wt.%、0.5-6wt.%、1-4wt.%的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,该药物产品包含0.1-10wt.%、0.2-8wt.%、0.5-6wt.%、1-4wt.%的塞美兰肽。
在实施例中,该药物产品包含约1mg/ml、2mg/ml、5mg/ml、10mg/ml、15mg/ml、20mg/ml、25mg/ml、30mg/ml、35mg/ml、40mg/ml、45mg/ml、50mg/ml、55mg/ml、60mg/ml、65mg/ml、70mg/ml、75mg/ml或更多的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,该药物产品包含约5mg/ml塞美兰肽。在实施例中,该药物产品包含约10mg/ml塞美兰肽。在实施例中,该药物产品包含约20mg/ml塞美兰肽。在实施例中,该药物产品包含约25mg/ml塞美兰肽。在实施例中,该药物产品包含约30mg/ml塞美兰肽。在实施例中,该药物产品包含约35mg/ml塞美兰肽。在实施例中,该药物产品包含约40mg/ml塞美兰肽。
在实施例中,该药物产品包含多于约1mg/ml、2mg/ml、5mg/ml、10mg/ml、15mg/ml、20mg/ml、25mg/ml、30mg/ml、35mg/ml、40mg/ml、45mg/ml、50mg/ml、55mg/ml、60mg/ml、65mg/ml、70mg/ml、75mg/ml或更多的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,该药物产品包含少于约50mg/ml、40mg/ml、35mg/ml、30mg/ml、25mg/ml、20mg/ml、15mg/ml、10mg/ml、5mg/ml、2mg/ml或1mg/ml的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,该药物产品包含3wt.%的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,该药物产品包含3wt.%的塞美兰肽。
在实施例中,包含3wt.%的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的药物产品在25℃下稳定储存至少1-6个月,例如至少1、2、3、4、5、6个月或更长,而无以下的损失或降解:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,该药物产品包含3wt.%的塞美兰肽。
在实施例中,包含3wt.%的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的药物产品例如配制品在5℃下稳定储存至少1-6个月,例如至少1、2、3、4、5、6个月或更长,而无以下的损失或降解:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,该药物产品包含3wt.%的塞美兰肽。
在实施例中,包含约1mg/ml、2mg/ml、5mg/ml、10mg/ml、15mg/ml、20mg/ml、25mg/ml、30mg/ml、35mg/ml、40mg/ml、45mg/ml、50mg/ml、55mg/ml、60mg/ml、65mg/ml、70mg/ml、75mg/ml或更多的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的药物产品在25℃下稳定储存至少1-6个月,例如至少1、2、3、4、5、6个月或更长,而无以下的损失或降解:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,包含约1mg/ml、2mg/ml、5mg/ml、10mg/ml、15mg/ml、20mg/ml、25mg/ml、30mg/ml、35mg/ml、40mg/ml、45mg/ml、50mg/ml、55mg/ml、60mg/ml、65mg/ml、70mg/ml、75mg/ml或更多的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的药物产品在5℃下稳定储存至少1-6个月,例如至少1、2、3、4、5、6个月或更长,而无以下的损失或降解:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
在实施例中,其中塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)高度可溶于组分(c)的醇中的实施例中,控制了以下在醇中的溶解度:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
尽管不希望受到理论的束缚,但是认为,在实施例中,塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)在组分(c)的醇中的过度溶解导致在贮库组合物在体内形成的情况下醇将大量的以下项运输出该贮库组合物:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在一个实施例中,使用药物产品的极性溶剂以控制以下在药物产品中的溶解度:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),从而帮助控制释放特征。在实施例中,该药物产品包含塞美兰肽。
在实施例中,本披露提供了用于控制以下项在低粘度混合物中的溶解度的方法:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该低粘度混合物包含:(a)40-70wt.%的甘油二酯和/或生育酚;(b)40-70wt.%的磷脂;(c)5-20wt.%的醇;(e)1-4wt.%的肽;和(d)0.5-10wt.%的极性溶剂(任选地包含抗氧化剂)以形成贮库药物产品。在实施例中,该药物产品包含塞美兰肽。
在实施例中,本披露提供了对以下项从通过注射低粘度混合物形成的贮库组合物中释放的特征进行调节的方法:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该低粘度混合物包含:(a)40-70wt.%的甘油二酯和/或生育酚;(b)40-70wt.%的磷脂;(c)5-20wt.%的醇;(e)1-4wt.%的塞美兰肽;和(d)0.5-10wt.%的极性溶剂(任选地包含抗氧化剂)在所述低粘度混合物中以形成贮库药物产品。在实施例中,该药物产品包含塞美兰肽。
在实施例中,本披露提供了减轻注射部位不适、降低药物产品的粘度和/或减少低粘度混合物的初始突释的方法和用途,该低粘度混合物包含:(a)40-70wt.%的甘油二酯和/或生育酚;(b)40-70wt.%的磷脂;(c)5-20wt.%的醇;(e)1-4wt.%的塞美兰肽;和(d)0.5-10wt.%的极性溶剂(任选地包含抗氧化剂)在所述低粘度混合物中以形成药物产品的贮库。在实施例中,该药物产品包含塞美兰肽。
在实施例中,本披露提供了改善药物产品和/或所得贮库组合物的特性而没有负面影响以下的释放特征的方法和用途:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,该药物产品包含塞美兰肽。
任选的另外的组分
在实施例中,本文披露的药物产品不包括(或包括少于5、2、1或0.5重量%)片段化试剂,如聚氧乙烯或聚(乙二醇)(peg)片段化试剂,例如,peg接枝的脂质和/或表面活性剂。
在实施例中,本文披露的药物产品不包括(或包括少于5、2、1或0.5重量%)片段化试剂,如聚山梨酯80(p80)或其他聚山梨酯(例如,聚山梨酯20)、peg化磷脂(peg-脂质,如dspe-peg(2000)、dspe-peg(5000)、dope-peg(2000)和dope-peg(5000))、solutolhs15、peg化脂肪酸(例如,peg-油酸酯)、嵌段共聚物(如pluronic.rtm.f127和pluronic.rtm.f68)、乙氧基化蓖麻油衍生物(例如chremophores)、peg化甘油脂肪酸酯(如来自nikkochemicals的tmgo-15)和peg化生育酚(如d-α生育酚聚(乙二醇)1000琥珀酸酯,称为来自伊士曼公司(eastman)的维生素etpgs。
在实施例中,塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)是例如在试剂盒中的粉末。在实施例中,该试剂盒包含塞美兰肽。
在实施例中,塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)溶解在脂质药物产品中,并且通过某些稳定性添加剂增加稳定性,例如储存稳定性和体内稳定性,这些稳定性添加剂例如为包含糖(例如蔗糖、海藻糖或乳糖)、聚合物(例如,多元醇,如羧甲基纤维素)、氨基酸(例如,甲硫氨酸、谷氨酸或赖氨酸)、脂溶性酸组分(例如,hcl)、阴离子脂质或表面活性剂(例如,二油酰基磷脂酰甘油(dopg)、棕榈酰基油酰基磷脂酰甘油(popg)或油酸(oa))的添加剂。在一些实施例中,该脂质药物产品包含塞美兰肽。
在实施例中,本文所述的药物产品包含单剂量形式或多剂量形式。在实施例中,可以将单剂量形式或多剂量形式的药物产品储存于药学上可接受的玻璃或塑料容器中。在实施例中,单剂量形式的药物产品保持稳定,例如化学上和物理上稳定,并且在使用前在储存中有效,但是在单次使用后可丢弃。在一个实施例中,单剂量形式或多剂量形式的药物产品在4℃下,例如在0℃、1℃、2℃、3℃或4℃下,是稳定的,持续至少36个月,例如至少1、2、3、4、5、6、7、8、9、10、11、12、15、20、25、30或36个月。在实施例中,单剂量形式或多剂量形式的药物产品在30℃下,例如在20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃或30℃下,是稳定的,持续至少36个月,例如至少1、2、3、4、5、6、7、8、9、10、11、12、15、20、25、30或36个月。在实施例中,多剂量形式的药物产品保持稳定,例如化学上和物理上稳定,并且在使用前有效,并且在多剂量使用方案施用时间段内在密封已经被破坏的第一次使用后还保持稳定(例如化学上和物理上稳定)、有效且相对不含细菌。在实施例中,多剂量形式的药物产品包含抗微生物剂或抑微生物剂,例如抑细菌剂或防腐剂。
在实施例中,本文所述的药物产品任选地包含具有足够的抗微生物活性的抗微生物剂或抑微生物剂,例如抑细菌剂或防腐剂,以符合欧洲药典(ph.eur.)、日本药典(jp)和美国药典(usp)标准。在实施例中,抑细菌剂或防腐剂允许将药物产品储存并且用于多剂量。在实施例中,抑细菌剂或防腐剂不会降低以下的溶解度:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),或者降低药物产品的透明度,例如溶液的透明度。在实施例中,药物产品中包含的抑细菌剂或防腐剂选自苯酚、苯甲酸、氯丁醇、苯扎氯铵、间甲酚、对甲酚、苯甲醇或其他酚类防腐剂。在实施例中,以其中抑细菌剂或防腐剂有效的浓度使用抑细菌剂或防腐剂。在实施例中,药物产品中包含的抑细菌剂或防腐剂是药学上可接受的以用于通过注射施用。
在实施例中,本文所述的药物产品除了包含抗氧化剂或化学或物理稳定剂(例如,edta)还任选地包含抗微生物剂或抑微生物剂。
在实施例中,本文所述的包含以下的药物产品不需要另外的防腐剂、抗微生物剂或抑微生物剂(例如抑细菌剂或杀细菌剂)以提供多剂量形式:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,该药物产品包含塞美兰肽。
在实施例中,本文所述的药物产品提供了防腐效果以及以下项的可接受稳定性和药物产品稳定性:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),并且可用于单剂量以及多剂量用途。在实施例中,该药物产品包含塞美兰肽。
在实施例中,用于多用途形式的本文所述的药物产品包含足够浓度的单独或组合的乙醇和柠檬酸盐缓冲液(任选地包含足够浓度的乙二胺四乙酸二钠),以提供防腐效果,同时保持以下的稳定性:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),和药物产品。在实施例中,该药物产品包含塞美兰肽。
制造方法-指定顺序
以下的药物产品的组分合并的顺序可以优化制造方法:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),例如通过减少增溶以下所花费的时间:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,该药物产品包含塞美兰肽。
在实施例中,在将以下与醇接触,例如溶解或分散在醇中之后,添加组分a、b、或a和b二者的大部分例如全部:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)溶解或分散在醇例如乙醇中。一旦将全部或一些,例如至少50%、70%、80%、90%、95%或99%的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)溶解或分散在乙醇中,则将组分a、b、或a和b二者的大部分例如全部添加到混合物中。在实施例中,在将塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)溶解或分散在醇中时,例如在将至少50%、70%、80%、90%、95%或99%的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)溶解或分散在乙醇中时,该混合物还可以含有组分d,例如极性溶剂,例如柠檬酸盐缓冲液。在实施例中,该药物产品包含塞美兰肽。
在实施例中,在将塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)溶解或分散在醇中之后,使塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)与一种或多种组分a、b和d接触。在实施例中,该药物产品包含塞美兰肽。
制造方法-控制乙醇量
可能重要的是在含有预定或指定水平(例如,优化药物产品在注射前的粘度和注射后的释放特征的水平)的醇的药物产品中具有生物活性部分(例如塞美兰肽)。制造方法可以允许在制造期间不可控制或不可预测的醇损失水平(例如通过蒸发),并且此损失可妨碍配制品中具有控制水平和可重复水平的醇的能力。本文提供了制造包含以下的药物产品的方法:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该药物产品具有控制水平和可重复水平的醇例如乙醇。醇的水平影响了递送前粘度和递送后释放特征。通常醇促进较低的粘度,但是如果存在太多,它可能以不希望的方式,例如通过增加cmax影响释放特征。因此,需要控制的和可重复的醇水平。
本文所述的方法控制在完整的药物产品,例如包含塞美兰肽的药物产品中的醇水平。通过蒸发而损失的添加的醇可导致药物产品中存在的醇的水平的变化。在实施例中,该方法包括在密闭系统或器皿中通过添加控制量的乙醇来生产药物产品。使用密闭系统或器皿可以最小化蒸发所致的醇损失。
在实施例中,本披露提供了制造具有控制量或预定量的醇例如乙醇的本文所述的药物产品的方法。在实施例中,药物产品中的醇例如乙醇的量是预定量,例如10%。本披露的方法包括添加测量量(在本文中有时称为“添加量”)的醇,例如乙醇,其在制造条件下导致在制造之后具有预定量的醇例如乙醇的药物产品。通常,例如由于在制造期间醇的蒸发,添加量将大于制造后存在的预定量。在实施例中,将添加量作为单个等分试样添加,并且在其他实施例中,添加多个等分试样以提供添加量。在实施例中,该方法包括减少醇蒸发的另外的措施,例如,在减少醇蒸发的条件下进行制造过程的一个或多个阶段,例如在密闭器皿中控制温度或进行过程的一个阶段。
在实施例中,可以以一种或多于一种的量或等分试样,例如以一种、两种、三种或四种量或等分试样,将醇例如乙醇提供到药物产品中。在实施例中,一种制造药物产品的方法包括向以下提供第一量或等分试样的醇例如乙醇以溶解或分散肽:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,一种制造药物产品的方法还包括向溶解或分散于乙醇中的以下的混合物提供大部分的组分a、b和d或组分a、b和d的全部:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,该药物产品包含塞美兰肽。
在实施例中,一种制造药物产品的方法还包括向混合物提供下一量或等分试样例如第二、第三或第四量或等分试样的醇,例如乙醇,从而制造包含10wt.%醇例如乙醇的具有以下的药物产品:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分、或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
用配制品治疗的方法
本文所述的施用药物产品的方法描述于,例如国际申请wo2013/102047、wo2014/144842和wo2017/059076中,将其全部内容通过引用以其整体特此并入。
在实施例中,将如文本所述的包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的药物产品施用于患有对由例如以下的药物产品多肽所拥有的药物活性有反应的疾病或障碍的受试者:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在一个实施例中,该药物产品包含塞美兰肽。
在一个实施例中,在需要治疗的受试者中,待治疗的障碍对mc4r的调节有反应。该方法包括向受试者施用有效量的药物产品,该药物产品包含作为多肽的mc4r调节剂,例如,塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。在实施例中,该药物产品包含塞美兰肽。
在实施例中,对mc4r的调节有反应的障碍包括1型糖尿病、2型糖尿病、肥胖症、胰岛素抵抗、代谢综合征、男性勃起功能障碍、女性性功能障碍、非酒精性脂肪肝病、非酒精性脂肪性肝炎、包括酗酒在内的物质滥用障碍、饮食障碍、恶病质、炎症和焦虑。在实施例中,该障碍是肥胖症、1型糖尿病或2型糖尿病。在实施例中,该障碍是肥胖症或肥胖症相关病症。在实施例中,该障碍是普拉德-威利综合征。在实施例中,该障碍是巴-比二氏综合征。在实施例中,该障碍是阿尔斯特伦综合征。
在实施例中,待治疗的障碍包含1型糖尿病、2型糖尿病、肥胖症、普拉德-威利综合征、胰岛素抵抗、代谢综合征、男性勃起功能障碍、女性性功能障碍、非酒精性脂肪肝病、非酒精性脂肪性肝炎、包括酗酒在内的物质滥用障碍、饮食障碍、恶病质、炎症、焦虑、巴-比二氏综合征、或阿尔斯特伦综合征。在实施例中,该障碍是肥胖症、1型糖尿病或2型糖尿病。在实施例中,该障碍是肥胖症或肥胖症相关病症。在实施例中,该障碍是普拉德-威利综合征。在实施例中,该障碍是巴-比二氏综合征。在实施例中,该障碍是阿尔斯特伦综合征。在实施例中,待治疗的障碍涉及与瘦素-黑皮质素途径或pomc-mc4r途径(如瘦素、瘦素受体、阿黑皮质素原(pomc)、激素原转化酶(例如,pcsk1)或α-msh)相关的基因中的一种或多种突变相关的障碍或由前述一种或多种突变导致的障碍。
定义
如本文所用,“天然衍生的”是指从天然来源分离的化合物,以及具有与天然存在的化合物相同或基本上相同的结构的完全或部分以合成方式合成的化合物。
本文披露的组合物和方法涵盖具有指定序列、或与其基本上相同或相似的序列(例如,与指定的序列至少85%、90%、95%或更多相同的序列)的多肽和核酸。在氨基酸序列的上下文中,在本文中使用术语“基本上相同”来指含有足够或最少数量的如下氨基酸残基的第一氨基酸,所述氨基酸残基i)与第二氨基酸序列中的比对的氨基酸残基相同,或ii)是第二氨基酸序列中的比对的氨基酸残基的保守取代,使得第一和第二氨基酸序列可以具有共有结构域和/或共同功能活性。例如,含有共有结构域的氨基酸序列与参考序列(例如,本文提供的序列)具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
配制品
药物产品可以包括例如含有以下的本文所述的药物产品和缓冲液:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。配制品的ph通常是ph5.5-7.0。
在实施例中,该药物产品是具有低粘度的液体配制品。在实施例中,将药物产品配制用于直接注射,例如在注射前无需进一步添加或调节。在实施例中,将该药物产品在装置,例如注射筒,例如本文所述的注射筒中作为液体储存。在实施例中,该注射筒可以选自:手动注射筒、包含针(例如,具有适当直径的针,例如27号针)的注射筒、单次使用注射筒、多次使用注射筒、或弹簧加载注射筒(例如,自动注射器)。
在实施例中,可以将药物产品的组分制备为单独的液体或固体(例如冻干的)配制品,并且分开储存。在实施例中,可以将药物产品的组分制备为至少两种,例如2、3、4或5种分开的组分。在实施例中,可以在注射前不久,将组分,例如包含药物产品的至少两种组分进行合并、混合、溶解或分散。在实施例中,制备组分,例如包含药物产品的至少两种组分,并且将其储存在分开的容器中,例如至少两个分开的容器,例如本文所述的容器中,并且通过将组分例如至少两种组分合并在一个容器例如本文所述的容器中进行混合。在实施例中,将组分例如包含药物产品的至少两种组分合并在一个容器(例如本文所述的容器,例如具有多于一个腔室,例如至少两个腔室的容器)中,该容器通过药学上可接受的密封将组分例如至少两种组分分开,例如将组分例如至少两种组分维持在该一个容器(例如本文所述的容器)中的分开的腔室中。在实施例中,可以操纵,例如打开或移除密封以使组分,例如包含药物产品的至少两种组分进行混合,以在容器中形成单一溶液或悬浮液。在实施例中,可以将药物产品的溶液或悬浮液加载到注射筒,例如本文所述的注射筒中。在实施例中,可以向有需要的受试者,例如本文所述的受试者以有效量(例如治疗有效量)施用药物产品的溶液或悬浮液。
在实施例中,容器可以选自:注射筒,例如手动注射筒、包含针(例如,具有适当直径的针,例如27号针)的注射筒、单次使用注射筒、多次使用注射筒或弹簧加载注射筒(例如,自动注射器);小瓶(单次使用小瓶或多次使用小瓶);或其他药学上可接受的容器。
在实施例中,如本文所述的容器包括但不限于:vetterlyo-
缓冲液
如本文所用,术语“缓冲液”表示稳定药物组合物ph的赋形剂。缓冲液的实例包括组氨酸缓冲液、柠檬酸盐缓冲液、琥珀酸盐缓冲液、乙酸盐缓冲液和磷酸盐缓冲液或其混合物。在实施例中,药物产品的缓冲液包含柠檬酸盐、l-组氨酸、或l-组氨酸和盐酸l-组氨酸的混合物。在实施例中,药物产品的缓冲液是乙酸盐缓冲液。独立于所用的缓冲液,可以用酸或碱,例如盐酸、乙酸、磷酸、硫酸和柠檬酸、氢氧化钠和氢氧化钾调节ph。
如本文所述的药物产品的ph通常在ph5.0至7.5之间,例如ph5.5至6.5、ph5.5至6.0、ph6.0至6.5、ph6.5至7.0、ph5.5、ph6.0、ph6.5或ph7.0。在实施例中,可以将溶液维持在ph5.5至ph7.0的缓冲液用于制备药物产品。在实施例中,用于制备药物产品的缓冲液包括而不限于柠檬酸、hepes、组氨酸、精氨酸、乙酸钾、柠檬酸钾、磷酸钾(k2hpo4)、乙酸钠、碳酸氢钠、柠檬酸钠、磷酸钠(nah2po4)、tris碱和tris-hcl。在实施例中,缓冲液的浓度在5mm与100mm之间,例如5mm至50mm。在实施例中,以25nm的浓度使用磷酸钠缓冲液。在实施例中,以10mm或25mm的浓度使用柠檬酸钠缓冲液。在实施例中,以25mm的浓度使用组氨酸缓冲液。在实施例中,以25mm的浓度使用精氨酸缓冲液。
编号的实施例
参考以下编号的实施例进一步描述本发明。
1.一种组合物或制剂,例如药物产品的组合物,该组合物或制剂包含:
a)中性二酰基脂质和/或生育酚;
b)磷脂:
c)醇;
d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及
e)塞美兰肽,例如作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或例如作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
2.一种组合物或制剂,例如药物产品的组合物,该组合物或制剂包含:
a)中性二酰基脂质和/或生育酚;
b)磷脂:
c)醇;
d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及
e)塞美兰肽。
3.一种组合物或制剂,例如药物产品的组合物,该组合物或制剂包含:
a)中性二酰基脂质和/或生育酚;
b)磷脂:
c)醇;
d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及
e)作为被配制用于注射的唯一活性药物成分的塞美兰肽。
4.一种组合物或制剂,例如药物产品的组合物,该组合物或制剂包含:
a)中性二酰基脂质和/或生育酚;
b)磷脂:
c)醇;
d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及
e)作为活性药物成分的塞美兰肽。
5.一种组合物或制剂,例如药物产品的组合物,该组合物或制剂包含:
a)中性二酰基脂质和/或生育酚;
b)磷脂:
c)醇;
d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及
e)作为用于注射的活性药物成分的塞美兰肽。
6.一种组合物或制剂,例如药物产品的组合物,该组合物或制剂包含:
a)中性二酰基脂质和/或生育酚;
b)磷脂:
c)醇;
d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及
e)mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
7.一种组合物或制剂,例如药物产品的组合物,该组合物或制剂包含:
a)中性二酰基脂质和/或生育酚;
b)磷脂:
c)醇;
d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及
e)作为唯一活性成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
8.一种组合物或制剂,例如药物产品的组合物,该组合物或制剂包含:
a)中性二酰基脂质和/或生育酚;
b)磷脂:
c)醇;
d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及
e)作为用于注射的唯一活性成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
9.一种组合物或制剂,例如药物产品的组合物,该组合物或制剂包含:
a)中性二酰基脂质和/或生育酚;
b)磷脂:
c)醇;
d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及
e)作为活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
10.一种组合物或制剂,例如药物产品的组合物,该组合物或制剂包含:
a)中性二酰基脂质和/或生育酚;
b)磷脂:
c)醇;
d)任选地,极性溶剂,例如缓冲液,该极性溶剂任选地包含抗氧化剂;以及
e)作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
11.如前述实施例中任一项所述的组合物,该组合物包含中性二酰基脂质。
12.如实施例11所述的组合物,其中该中性二酰基脂质包含甘油二酯。
13.如实施例11-12中任一项所述的组合物,其中该中性二酰基脂质包含二油酸甘油酯(gdo)。
14.如前述实施例中任一项所述的组合物,其中该磷脂包含磷脂酰胆碱。
15.如前述实施例中任一项所述的组合物,其中该磷脂包含大豆磷脂酰胆碱。
16.如前述实施例中任一项所述的组合物,其中该醇包含乙醇。
17.如前述实施例中任一项所述的组合物,其中该醇以足够大的量提供,以提供至少10mg/g、20mg/g或30mg/g的塞美兰肽的溶解度。
18.如实施例17所述的组合物,其中乙醇的量以重量%计大于1重量%,例如在1-20重量%之间。
19.如实施例17-18中任一项所述的组合物,其中乙醇的量足够低,以使受试者例如本文所述的受试者可以通过操作例如注射筒的装置容易并且舒适地进行注射。
20.如实施例17-19中任一项所述的组合物,其中乙醇的量以重量%计小于20%、15%或10%。
21.如实施例17-20中任一项所述的组合物,其中乙醇的量足够大,以使该组合物具有足够低的粘度以用装置舒适地递送,该装置例如为具有细针例如27号针的注射筒。
22.如实施例17-21中任一项所述的组合物,其中乙醇的量
足够低,以使在注射后在施用下个剂量之前药物在皮下注射后的初始突释例如初始释放产生小于8(例如小于7、6.5、6、5.5、5、4.5、4、3.5、3、2.5、2或更小)的血浆中最大浓度(cmax)与血浆中最小浓度(cmin)的比率。
23.如实施例17-22中任一项所述的组合物,其中乙醇的量:
足够低,以使在注射后,该药物产品提供塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的低初始释放。
24.如实施例23所述的组合物,其中该低初始释放是
相对于7天稳定状态给药间隔的药物浓度时间曲线下面积,通过给药后前几小时(例如前6小时)期间药物浓度曲线下的部分面积测量的,该部分面积为小于10%或更少。
25.如实施例23所述的组合物,其中该低初始释放是相对于7天稳定状态给药间隔的药物浓度时间曲线下面积,通过给药后前几小时(例如前12小时)期间药物浓度曲线下的部分面积测量的,该部分面积为小于10%-20%或更少。
26.如实施例23所述的组合物,其中该低初始释放是
相对于7天稳定状态给药间隔的药物浓度时间曲线下面积,通过给药后前几小时(例如前24小时)期间药物浓度曲线下的部分面积测量的,该部分面积为小于20%-30%或更少。
27.如实施例19所述的组合物,其中该装置可以是单次使用装置,或多次使用装置。
28.如实施例19所述的组合物,其中该装置选自:手动注射筒(例如,包含针(例如,具有适当直径的针,例如27号针)的注射筒)或自动注射器(例如,弹簧加载注射筒或笔式注射器)。
29.如前述实施例中任一项所述的组合物,其中该极性溶剂,例如缓冲液,包含柠檬酸盐缓冲液,任选地其中缓冲液的ph是6.4。
30.如前述实施例中任一项所述的组合物,其中该极性溶剂,例如缓冲液,包含柠檬酸一水合物。
31.如前述实施例中任一项所述的组合物,其中该极性溶剂,例如缓冲液,包含另外的组分,例如抗氧化剂或者化学或物理稳定剂。
32.如实施例31所述的组合物,其中该抗氧化剂是edta。
33.如前述实施例中任一项所述的组合物,其中该极性溶剂,例如缓冲液,包含柠檬酸一水合物、edta二钠和水。
34.如前述实施例中任一项所述的组合物,其中塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)以氯化物盐存在。
35.如前述实施例中任一项所述的组合物,其中该药物产品任选地包含抗微生物剂或抑微生物剂,例如抑细菌剂或防腐剂。
36.如前述实施例中任一项所述的组合物,其中a:b的重量比率是70:30至40:60。
37.如前述实施例中任一项所述的组合物,其中a:b的重量比率是70:30、65:45、60:40、55:45、50:50、45:55或40:60。
38.如前述实施例中任一项所述的组合物,其中组分a按重量计是组分a、b和c溶液的总重量的20%-80%、30%-70%、33%-60%或38%-43%。
39.如前述实施例中任一项所述的组合物,其中组分b按重量计是组分a、b和c溶液的总重量的20%-80%、30%-70%、33%-60%或38%-43%。
40.如前述实施例中任一项所述的组合物,其中组分c,例如乙醇,按重量计是组分a、b和c溶液的总重量的0.5%-50%、2%-30%或5%-20%。
41.如前述实施例中任一项所述的组合物,其中,
该中性二酰基脂质包含二油酸甘油酯;
该磷脂包含磷脂酰胆碱;
该醇包含乙醇;以及
该极性溶剂,例如缓冲液,包含柠檬酸盐缓冲液。
42.如前述实施例中任一项所述的组合物,其中,
该中性二酰基脂质包含二油酸甘油酯;
该磷脂包含大豆磷脂酰胆碱;
该醇包含乙醇;以及
该极性溶剂,例如缓冲液,包含含有edta的在ph6.4的柠檬酸盐缓冲液。
43.如前述实施例中任一项所述的组合物,该组合物包含,每一毫升的组合物:
420+/-20%mg二油酸甘油酯(gdo);
420+/-20%mg大豆磷脂酰胆碱;
105+/-20%mg乙醇;
20+/-20%mg柠檬酸盐缓冲液;以及
30+/-20%mg塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
44.如前述实施例中任一项所述的组合物,该组合物包含,每一毫升的组合物:
420+/-10%mg二油酸甘油酯(gdo);
420+/-10%mg大豆磷脂酰胆碱;
105+/-10%mg乙醇;
20+/-10%mg柠檬酸盐缓冲液;以及
30+/-10%mg塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
45.如前述实施例中任一项所述的组合物,该组合物包含,每一毫升的组合物:
420+/-5%mg二油酸甘油酯(gdo);
420+/-5%mg大豆磷脂酰胆碱;
105+/-5%mg乙醇;
20+/-5%mg柠檬酸盐缓冲液;以及
30+/-5%mg塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
46.如前述实施例中任一项所述的组合物,该组合物包含,每一毫升的组合物:
420+/-2%mg二油酸甘油酯(gdo);
420+/-2%mg大豆磷脂酰胆碱;
105+/-2%mg乙醇;
20+/-2%mg柠檬酸盐缓冲液;以及
30+/-2%mg塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
47.如前述实施例中任一项所述的组合物,该组合物包含,每一毫升的组合物
419.8mg二油酸甘油酯(gdo);
419.8mg大豆磷脂酰胆碱;
105mg乙醇;
20mg柠檬酸盐缓冲液;以及
30mg塞美兰肽。
48.如前述实施例中任一项所述的组合物,该组合物包含:
组分a的中性二酰基脂质,其按重量计占该组合物的组分a、b和c;组分a、b、c和d;或组分a、b、c、d和e的20%-80%、30%-70%、33%-60%或38%-43%;
组分b的磷脂,其按重量计占该组合物的组分a、b和c;组分a、b、c和d;或组分a、b、c、d和e的20%-80%、30%-70%、33%-60%或38%-43%;
组分c的醇,其按重量计占该组合物的组分a、b和c;组分a、b、c和d;或组分a、b、c、d和e的0.1%-35%、5%-20%、8%-15%或9%-11%;
组分d的极性溶剂,例如缓冲液,其按重量计占该组合物的组分a、b和c;组分a、b、c和d;或组分a、b、c、d和e的0.5%-10%、1%-5%或1%-3%;以及
塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),按重量计占该组合物的组分a、b和c;组分a、b、c和d;或组分a、b、c、d和e的0.1%-10%、0.2%-8%、0.5%-6%、1%-4%。
49.如前述实施例中任一项所述的组合物,该组合物包含:
中性二酰基脂质,其按重量计占该组合物的组分a、b和c;组分a、b、c和d;或组分a、b、c、d和e的42%+/-10、42%+/-5、42%+/-2或42%+/-1;
磷脂,其按重量计占该组合物的组分a、b和c;组分a、b、c和d;或组分a、b、c、d和e的42%+/-10、42%+/-5、42%+/-2或42%+/-1;
醇,其按重量计占该组合物的组分a、b和c;组分a、b、c和d;或组分a、b、c、d和e的10%+/-8、10%+/-6、10%+/-5或10%+/-1;
极性溶剂,例如缓冲液,其按重量计占该组合物的组分a、b和c;组分a、b、c和d;或组分a、b、c、d和e的2%+/-1、2%+/-0.5、2%+/-0.25或2%+/-0.1;以及
塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),其按重量计占该组合物的组分a、b和c;组分a、b、c和d;或组分a、b、c、d和e的3%+/-1.5、3%+/-1或3%+/-0.5。
50.如前述实施例中任一项所述的组合物,该组合物在与水性环境接触,例如注射,例如皮下注射到受试者中之后,形成或能够形成至少一种液体结晶结构。
51.如前述实施例中任一项所述的组合物,其中该粘度:
(i)足够低以用装置舒适地递送,该装置例如为具有细针例如27号针的注射筒;
(ii)足够低,以使在注射后在施用下个剂量之前塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)在皮下注射后从该药物产品的初始突释例如初始释放产生小于8(例如小于7、6.5、6、5.5、5、4.5、4、3.5、3、2.5、2或更小)的血浆中最大浓度(cmax)与血浆中最小浓度(cmin)的比率;或者
(iii)足够低,以使在注射后,该药物产品提供塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的低初始释放。
52.如前述实施例中任一项所述的组合物,其中当注射入受试者体内时:
i)在施用下个剂量之前塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)在皮下注射后从该药物产品的初始突释例如初始释放产生小于8(例如小于7、6.5、6、5.5、5、4.5、4、3.5、3、2.5、2或更小)的血浆中最大浓度(cmax)与血浆中最小浓度(cmin)的比率;或者
ii)该药物产品提供塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的低初始释放。
53.如实施例51或52所述的组合物,其中该低初始释放是相对于7天稳定状态给药间隔的药物浓度时间曲线下面积,通过给药后前几小时(例如前6小时)期间药物浓度曲线下的部分面积测量的,该部分面积为小于10%或更少。
54.如实施例51或52所述的组合物,其中该低初始释放是相对于7天稳定状态给药间隔的药物浓度时间曲线下面积,通过给药后前几小时(例如前12小时)期间药物浓度曲线下的部分面积测量的,该部分面积为小于10%-20%或更少。
55.如实施例51或52所述的组合物,其中该低初始释放是相对于7天稳定状态给药间隔的药物浓度时间曲线下面积,通过给药后前几小时(例如前24小时)期间药物浓度曲线下的部分面积测量的,该部分面积为小于20%-30%或更少。
56.如前述实施例中任一项所述的组合物,该组合物包含塞美兰肽。
57.如实施例1-55中任一项所述的组合物,该组合物包含塞美兰肽作为被配制用于注射的唯一活性药物成分。
58.如实施例1-55中任一项所述的组合物,该组合物包含塞美兰肽作为唯一活性成分。
59.如实施例1-55中任一项所述的组合物,该组合物包含塞美兰肽作为活性药物成分。
60.如实施例1-55中任一项所述的组合物,该组合物包含塞美兰肽作为用于注射的活性药物成分。
61.如实施例1-55中任一项所述的组合物,该组合物包含mc4rap(例如,作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分)。
62.如实施例1-55中任一项所述的组合物,该组合物包含bim-22511。
63.如实施例1-55中任一项所述的组合物,该组合物包含bim-22287。
64.如实施例1-55中任一项所述的组合物,该组合物包含bim-22512。
65.如实施例1-55中任一项所述的组合物,该组合物包含001152c。
66.如实施例1-55中任一项所述的组合物,该组合物包含001543c。
66a.如实施例1-55中任一项所述的组合物,该组合物包含001003c。
66b.如实施例1-55中任一项所述的组合物,该组合物包含001574c。
66c.如实施例1-55中任一项所述的组合物,该组合物包含001555c。
66d.如实施例1-55中任一项所述的组合物,该组合物包含001554c。
66e.如实施例1-55中任一项所述的组合物,该组合物包含001556c。
66f.如实施例1-55中任一项所述的组合物,该组合物包含001358c。
66g.如实施例1-55中任一项所述的组合物,该组合物包含001576c。
66h.如实施例1-55中任一项所述的组合物,该组合物包含001364c。
66i.如实施例1-55中任一项所述的组合物,该组合物包含001258c。
66j.如实施例1-55中任一项所述的组合物,该组合物包含mc4r-11。
67.一种包含如实施例1-76中任一项所述的组合物的单位剂型。
68.如实施例67所述的单位剂型,该单位剂型包含至少2、1.8、1.6、1.4、1.2、1、0.8、0.6、0.4或0.2ml的组合物。
69.如实施例67-68中任一项所述的单位剂型,该单位剂型布置在液密外壳,例如小瓶或药筒中。
70.如实施例67-69中任一项所述的单位剂型,该单位剂型布置在注射装置,例如单次使用装置或多次使用装置中。
71.如实施例70所述的单位剂型,其中该装置选自:手动注射筒(例如,包含针(例如,具有适当直径的针,例如27号针)的注射筒)或自动注射器(例如,弹簧加载注射筒或笔式注射器)。
72.如实施例67-71中任一项所述的单位剂型,该单位剂型包含10-70;20-60,25-50;25-40;25-35mg的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
73.如实施例67-71中任一项所述的单位剂型,该单位剂型包含50+/-20%;40+/-20%;或30+/-20%mg的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
74.如实施例67-71中任一项所述的单位剂型,该单位剂型包含50+/-10%;40+/-10%;或30+/-10%mg的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
75.如实施例67-71中任一项所述的单位剂型,该单位剂型包含50+/-5%;40+/-5%;或30+/-5%mg的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
76.如实施例67-71中任一项所述的单位剂型,该单位剂型包含40、35或30mg的塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
77.如实施例67-76中任一项所述的单位剂量,其中该组合物适于注射,例如皮下注射或肌内注射。
78.如实施例67-77中任一项所述的单位剂型,其中该粘度:
i)足够低以用装置舒适地递送,该装置例如为具有细针例如27号针的注射筒;
ii)足够低,以使在注射后在施用下个剂量之前塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)在皮下注射后从该药物产品的初始突释例如初始释放产生小于8(例如小于7、6.5、6、5.5、5、4.5、4、3.5、3、2.5、2或更小)的血浆中最大浓度(cmax)与血浆中最小浓度(cmin)的比率;或者
iii)足够低,以使在注射后,该药物产品提供塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的低初始释放。
79.如实施例67-77中任一项所述的单位剂型,其中当注射到受试者体内时:
i)在施用下个剂量之前塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)在皮下注射后从该药物产品的初始突释例如初始释放产生小于8(例如小于7、6.5、6、5.5、5、4.5、4、3.5、3、2.5、2或更小)的血浆中最大浓度(cmax)与血浆中最小浓度(cmin)的比率;或者
ii)该药物产品提供塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的低初始释放。
80.如实施例78或79所述的单位剂型,其中该低初始释放是相对于7天稳定状态给药间隔的药物浓度时间曲线下面积,通过给药后前几小时(例如前6小时)期间药物浓度曲线下的部分面积测量的,该部分面积为小于10%或更少。
81.如实施例78或79所述的单位剂型,其中该低初始释放是相对于7天稳定状态给药间隔的药物浓度时间曲线下面积,通过给药后前几小时(例如前12小时)期间药物浓度曲线下的部分面积测量的,该部分面积为小于10%-20%或更少。
82.如实施例78或79所述的单位剂型,其中该低初始释放是相对于7天稳定状态给药间隔的药物浓度时间曲线下面积,通过给药后前几小时(例如前24小时)期间药物浓度曲线下的部分面积测量的,该部分面积为小于20%-30%或更少。
83.一种制造制剂或组合物例如药物组合物,例如具有控制水平的etoh的制剂或组合物的方法,该制剂或组合物包含组分(e),该组分(e)包含:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法包括:
i)提供具有以下的混合物:包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e),第一量的etoh和一种或多种以下组分:
a)中性二酰基脂质和/或生育酚;
b)磷脂;
c)醇;以及
d)极性溶剂,例如缓冲液;以及
ii)添加第二量的etoh,
从而制造制剂或组合物例如药物组合物,该制剂或组合物包含组分(e),该组分(e)包含:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
84.如实施例83所述的方法,其中提供包括形成该混合物。
85.如实施例83-84中任一项所述的方法,其中该第二量的etoh的添加导致如下的etoh的量,该etoh的量满足参考值,例如落入值的范围内,例如落入由下限值和上限值例如重量%etoh的上限值和下限值所定义的范围例如10-0.5重量%内。
86.如实施例85所述的方法,其中该参考值是在5至20;8.5至12.5;和9至11重量%etoh范围内的值,例如,10重量%。
87.如实施例85所述的方法,其中该参考值是在9至11重量%etoh范围内的值,例如10重量%。
88.如实施例83-87中任一项所述的方法,该方法包括通过适当的分析测定来确定该混合物中etoh的量。
89.如实施例88所述的方法,该方法包括响应于该确定,选择要添加到该混合物中的etoh的量,例如将达到该参考值的量。
90.如实施例89所述的方法,该方法包括将选定量的etoh添加至该混合物,以形成etoh补充的混合物。
91.如实施例90所述的方法,其中将该选定量作为单个等分试样或作为相同或不同量的多个等分试样添加到该混合物中。
92.如实施例83-91中任一项所述的方法,其中在形成该混合物与确定该混合物中etoh的量、选择要添加的etoh的量、或添加该第二量之间,经过了少于48小时、少于24小时或少于4小时。
93.如实施例83-91中任一项所述的方法,该方法包括提供添加到该混合物中的组分的量。
94.如实施例93所述的方法,其中提供包括称量添加到该混合物中的组分的量。
95.如实施例83-94中任一项所述的方法,该方法包括提供该混合物中etoh的量的值,并且确定需要添加的etoh的量以满足etoh的量的参考。
96.如实施例83-95中任一项所述的方法,其中形成该混合物之后,etoh例如通过蒸发,例如蒸发到容器例如混合器皿的顶部空间中,从该混合物中损失。
97.如实施例83-96中任一项所述的方法,其中将该第二量添加到该混合物中后,确定在该etoh补充的混合物中etoh的量。
98.如实施例97所述的方法,该方法包括响应于该确定,选择要添加到该etoh补充的混合物中的etoh的量。
99.如实施例98所述的方法,该方法包括将选定量的etoh添加至该etoh补充的混合物,以形成两次补充的混合物。
100.如实施例83-99中任一项所述的方法,该方法还包括提供第二制剂或组合物,例如药物产品,该第二制剂或组合物包含组分(e),该组分(e)包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
101.如实施例83-100中任一项所述的方法,该方法包括:
制造包含含有塞美兰肽的组分(e)、etoh、中性二酰基脂质和/或生育酚和磷脂的混合物,
其中在将塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)和etoh合并后,添加中性二酰基脂质和/或生育酚中的一种或两种、和磷脂,
从而制造具有组分(e)的组合物或制剂例如药物产品,该组分(e)包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
102.如实施例83-100中任一项所述的方法,该方法包括:
制造混合物,该混合物包含:含有塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e)、水或极性溶剂(例如缓冲液)、中性二酰基脂质和/或生育酚和磷脂,
其中在将包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e)和水或极性溶剂(例如缓冲液)合并后,添加中性二酰基脂质和/或生育酚中的一种或两种、和磷脂,
从而制造具有组分(e)的组合物或制剂例如药物产品,该组分(e)包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
103.如实施例83-102中任一项所述的方法,其中该混合物形成的顺序是:
i)使包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e)与etoh(和任选地水或极性溶剂,例如缓冲液)接触;
ii)将该磷脂添加至从i)得到的混合物中;以及
iii)将该中性二酰基脂质和/或生育酚添加到从ii)得到的混合物中。
104.如实施例83所述的方法,其中该制剂或组合物包含塞美兰肽。
105.如实施例83所述的方法,其中该制剂或组合物包含作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;或作为用于注射的活性药物成分的塞美兰肽。
106.如实施例83所述的方法,其中该制剂或组合物包含mc4rap,例如,作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分。
107.如实施例83所述的方法,其中该制剂或组合物包含bim-22511。
108.如实施例83所述的方法,其中该制剂或组合物包含bim-22287。
109.如实施例83所述的方法,其中该制剂或组合物包含bim-22512。
110.如实施例83所述的方法,其中该制剂或组合物包含001152c。
111.如实施例83所述的方法,其中该制剂或组合物包含001543c。
112.如实施例83所述的方法,其中该制剂或组合物包含001003c。
113.如实施例83所述的方法,其中该制剂或组合物包含001574c。
114.如实施例83所述的方法,其中该制剂或组合物包含001555c。
115.如实施例83所述的方法,其中该制剂或组合物包含001554c。
116.如实施例83所述的方法,其中该制剂或组合物包含001556c。
117.如实施例83所述的方法,其中该制剂或组合物包含001358c。
118.如实施例83所述的方法,其中该制剂或组合物包含001576c。
119.如实施例83所述的方法,其中该制剂或组合物包含001364c。
120.如实施例83所述的方法,其中该制剂或组合物包含001258c。
121.如实施例83所述的方法,其中该制剂或组合物包含mc4r-11。
122.一种制造药物产品的方法,该药物产品包含:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a;组分b;组分d;和预定量的醇,该方法包括
将包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e)、组分a、组分b、组分d和醇(以任何顺序)合并成混合物,以及
将该混合物中醇含量的值与醇含量的参考值进行比较,
从而制造具有以下的配制品:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a;组分b;组分d;和预定量的醇。
123.如实施例122所述的方法,该方法包括:响应于该值或比较,增加或减少该混合物中的醇的量以提供具有预定量的醇的配制品。
124.如实施例123所述的方法,该方法包括将添加量的醇添加至该混合物。
125.如实施例124所述的方法,其中该添加量的醇多于该预定量的醇。
126.如实施例122所述的方法,其中该药物产品包含塞美兰肽。
127.如实施例122所述的方法,其中该药物产品包含作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽、或作为用于注射的活性药物成分的塞美兰肽。
128.如实施例122所述的方法,其中该药物产品包含mc4rap,例如,作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分。
129.如实施例122所述的方法,其中该药物产品包含bim-22511。
130.如实施例122所述的方法,其中该药物产品包含bim-22287。
131.如实施例122所述的方法,其中该药物产品包含bim-22512。
132.如实施例122所述的方法,其中该药物产品包含001152c。
133.如实施例122所述的方法,其中该药物产品包含001543c。
134.如实施例122所述的方法,其中该药物产品包含001003c。
135.如实施例122所述的方法,其中该药物产品包含001574c。
136.如实施例122所述的方法,其中该药物产品包含001555c。
137.如实施例122所述的方法,其中该药物产品包含001554c。
138.如实施例122所述的方法,其中该药物产品包含001556c。
139如实施例122所述的方法,其中该药物产品包含001358c。
140.如实施例122所述的方法,其中该药物产品包含001576c。
141.如实施例122所述的方法,其中该药物产品包含001364c。
142.如实施例122所述的方法,其中该药物产品包含001258c。
143.如实施例122所述的方法,其中该药物产品包含mc4r-11。
144.一种制造药物产品的方法,该药物产品包含:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a(例如,gdo);组分b(例如,大豆pc);组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液);和预定量的醇,该方法包括:
将包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e)、组分a(例如,gdo)、组分b(例如,大豆pc)、组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液)和醇(以任何顺序)合并成混合物,以及
将该混合物中醇含量的值与醇含量的参考值进行比较,
从而制造包含以下的药物产品:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a(例如,gdo);组分b(例如,大豆pc);组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液);和预定量的醇。
145.如实施例144所述的方法,该方法包括将添加量的醇添加至该混合物。
146.如实施例145所述的方法,其中该添加量的醇多于该预定量的醇。
147.如实施例83-146中任一项所述的方法,其中,该预定量是5-20、10-20、15-20、5-15、5-10、5-15或10-15重量%。
148.如实施例83-146中任一项所述的方法,其中,该预定量是10+/-5重量%。
149.如实施例83-146中任一项所述的方法,其中,该预定量是10+/-4重量%。
150.如实施例83-146中任一项所述的方法,其中,该预定量是10+/-3重量%。
151.如实施例83-146中任一项所述的方法,其中,该预定量是10+/-2重量%。
152.如实施例83-146中任一项所述的方法,其中,该预定量是10+/-1重量%。
153.如实施例83-146中任一项所述的方法,其中,该预定量是10+/-0.5重量%。
154.如实施例83-153中任一项所述的方法,其中该方法包括生产多个批次的配制品。
155.如实施例154所述的方法,其中该多个批次中的每个批次具有在该多个批次中的一个或多个其他批次的2、1或0.5重量%内的醇含量。
156.如实施例154-155所述的方法,其中该多个批次中的每个批次具有在参考值的2、1或0.5重量%内的醇含量。
157.如实施例156所述的方法,其中该参考值是以下范围内的值:
5-20、10-20、15-20、5-15、5-10、5-15或10-15重量%;
10+/-5重量%;
10+/-4重量%;
10+/-3重量%;
10+/-2重量%;
10+/-1重量%;或者
10+/-0.5重量%。
158.如实施例155或156所述的方法,其中该参考值是在10+/-2重量%范围内的值,并且该多个批次中的每个批次具有在该参考值的1或0.5重量%内的醇含量。
159.如实施例155或156所述的方法,其中该参考值是10重量%,并且该多个批次中的每个批次具有在该参考值的0.5重量%内的醇含量。
160.如实施例154-159中任一项所述的方法,其中该多个批次中的每个批次具有足够大的醇含量,以使该组合物具有足够低的粘度以用装置舒适地递送,该装置例如为具有细针例如27号针的注射筒。
161.如实施例154-159中任一项所述的方法,其中该多个批次中的每个批次具有足够低的醇含量,以使在注射后在施用下个剂量之前药物在皮下注射后的初始突释例如初始释放产生小于8(例如小于7、6.5、6、5.5、5、4.5、4、3.5、3、2.5、2或更小)的血浆中最大浓度(cmax)与血浆中最小浓度(cmin)的比率。
162.如实施例154-159中任一项所述的方法,其中该多个批次中的每个批次具有足够低的醇含量,以使在注射后,该药物产品提供组分(e)的低初始释放,该组分(e)包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
163.如实施例162所述的方法,其中该低初始释放是相对于7天稳定状态给药间隔的药物浓度时间曲线下面积,通过给药后前几小时(例如前6小时)期间药物浓度曲线下的部分面积测量的,该部分面积为小于10%或更少。
164.如实施例162所述的方法,其中该低初始释放是相对于7天稳定状态给药间隔的药物浓度时间曲线下面积,通过给药后前几小时(例如前12小时)期间药物浓度曲线下的部分面积测量的,该部分面积为小于10%-20%或更少。
165.如实施例162所述的方法,其中该低初始释放是相对于7天稳定状态给药间隔的药物浓度时间曲线下面积,通过给药后前几小时(例如前24小时)期间药物浓度曲线下的部分面积测量的,该部分面积为小于20%-30%或更少。
166.如实施例160所述的方法,其中该装置可以是单次使用装置,或多次使用装置。
167.如实施例160或166所述的方法,其中该装置选自:手动注射筒(例如,包含针(例如,具有适当直径的针,例如27号针)的注射筒)或自动注射器(例如,弹簧加载注射筒或笔式注射器)。
168.如实施例122-153中任一项所述的方法,其中,将预定量的醇作为单个等分试样添加。
169.如实施例122-153中任一项所述的方法,其中将预定量的醇作为多个等分试样添加。
170.如实施例122-153或168-169中任一项所述的方法,其中在密闭器皿中进行添加醇之后的至少一部分过程。
171.如实施例122-153或168-170中任一项所述的方法,其中在密闭器皿中进行添加醇之后的过程。
172.如实施例122-153或168-170中任一项所述的方法,其中在密闭器皿中进行添加醇之前的至少一部分过程。
173.如实施例122-153或168-170中任一项所述的方法,其中在密闭器皿中进行添加醇之前的过程。
174.如实施例144所述的方法,其中该药物产品包含塞美兰肽。
175.如实施例144所述的方法,其中该药物产品包含作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽、或作为用于注射的活性药物成分的塞美兰肽。
176.如实施例144所述的方法,其中该药物产品包含mc4rap,例如,作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分。
177.如实施例144所述的方法,其中该药物产品包含bim-22511。
178.如实施例144所述的方法,其中该药物产品包含bim-22287。
179.如实施例144所述的方法,其中该药物产品包含bim-22512。
180.如实施例144所述的方法,其中该药物产品包含001152c。
181.如实施例144所述的方法,其中该药物产品包含001543c。
182.如实施例144所述的方法,其中该药物产品包含001003c。
183.如实施例144所述的方法,其中该药物产品包含001574c。
184.如实施例144所述的方法,其中该药物产品包含001555c。
185.如实施例144所述的方法,其中该药物产品包含001554c。
186.如实施例144所述的方法,其中该药物产品包含001556c。
187如实施例144所述的方法,其中该药物产品包含001358c。
188.如实施例144所述的方法,其中该药物产品包含001576c。
189.如实施例144所述的方法,其中该药物产品包含001364c。
190.如实施例144所述的方法,其中该药物产品包含001258c。
191.如实施例144所述的方法,其中该药物产品包含mc4r-11。
192.一种制造药物产品的方法,该药物产品包含组分(e),该组分(e)包含:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法包括:
(i)提供包含组分(e)和醇的混合物(组分(e)-醇混合物),该组分(e)包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该混合物例如包含与醇例如乙醇接触,例如溶解或分散在醇例如乙醇中的含有塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e);以及
(ii)将包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e)-醇混合物与一定量的组分a(例如,gdo)、组分b(例如,大豆pc)和组分d(例如,在ph6.4下的柠檬酸盐缓冲液)或组分a、b和d的全部合并。
193.如实施例192所述的方法,其中在密闭器皿中进行步骤(i)、(ii)、或(i)和(ii)。
194.如实施例192所述的方法,其中该药物产品包含塞美兰肽。
195.如实施例192所述的方法,其中该药物产品包含作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽、作为活性药物成分的塞美兰肽、或作为用于注射的活性药物成分的塞美兰肽。
196.如实施例192所述的方法,其中该药物产品包含mc4rap,例如,作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分。
197.如实施例192所述的方法,其中该药物产品包含bim-22511。
198.如实施例192所述的方法,其中该药物产品包含bim-22287。
199.如实施例192所述的方法,其中该药物产品包含bim-22512。
200.如实施例192所述的方法,其中该药物产品包含001152c。
201.如实施例192所述的方法,其中该药物产品包含001543c。
202.如实施例192所述的方法,其中该药物产品包含001003c。
203.如实施例192所述的方法,其中该药物产品包含001574c。
204.如实施例192所述的方法,其中该药物产品包含001555c。
205.如实施例192所述的方法,其中该药物产品包含001554c。
206.如实施例192所述的方法,其中该药物产品包含001556c。
207如实施例192所述的方法,其中该药物产品包含001358c。
208.如实施例192所述的方法,其中该药物产品包含001576c。
209.如实施例192所述的方法,其中该药物产品包含001364c。
210.如实施例192所述的方法,其中该药物产品包含001258c。
211.如实施例192所述的方法,其中该药物产品包含mc4r-11。
212.一种制造制剂或针对例如质量控制或释放规格评价候选制剂的方法,该制剂包含:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法包括
提供在组分(e)的候选制剂中etoh的量的值,该组分(e)包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);以及
将该值与etoh的量的参考值进行比较;
从而制造具有组分(e)的制剂,该组分(e)包含:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
213.如实施例212所述的方法,该方法还包括响应于比较,选择具有组分(e)的候选制剂,该组分(e)包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
214.如实施例212-213中任一项所述的方法,其中该参考值包含由下限值和上限值例如重量%etoh的上限值和下限值所定义的范围,例如10重量%。
215.如实施例214所述的方法,其中满足该参考值包括落入范围内。
216.如实施例214所述的方法,其中该参考值是在5至20;8.5至12.5;和9至11重量%etoh范围内的值,例如,10重量%。
217.如实施例214所述的方法,其中该参考值是在9至11重量%etoh范围内的值,例如10重量%。
218.如实施例212-217中任一项所述的方法,该方法包括
提供在组分(e)的第二候选制剂中etoh的量的值,该组分(e)包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);以及
将该值与etoh的量的参考值进行比较。
219.如实施例212-217中任一项所述的方法,该方法包括
提供在组分(e)的n种候选制剂中etoh的量的值,该组分(e)包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),其中n等于或大于1、2、3、4、5、6、7、8、9、10、50、100或1,000;以及
将该值与etoh的量的参考值进行比较。
220.如实施例218-219中任一项所述的方法,其中在该多种制剂中的每一种中的etoh的量在彼此的5%、2%、1%或0.5%内。
221.如实施例218-219中任一项所述的方法,其中在该多种制剂中的每一种中的etoh的量在彼此的2%内。
222.如实施例218-219中任一项所述的方法,其中在该多种制剂中的每一种中的etoh的量在彼此的0.5%内。
223.如实施例212-222中任一项所述的方法,其中在彼此的10、20、30、60、180或365天内制造该多种制剂中的第一制剂和第二制剂。
224.如实施例212-223中任一项所述的方法,其中在该第一制剂后少于10、20、30、60、180或365天制造第二制剂。
225.如实施例212所述的方法,其中该制剂包含塞美兰肽。
226.实施例212所述的方法,其中该制剂包含作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽、或作为用于注射的活性药物成分的塞美兰肽。
227.如实施例212所述的方法,其中该制剂包含mc4rap,例如,作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分。
228.如实施例212所述的方法,其中该制剂包含bim-22511。
229.如实施例212所述的方法,其中该制剂包含bim-22287。
230.如实施例212所述的方法,其中该制剂包含bim-22512。
231.如实施例212所述的方法,其中该制剂包含001152c。
232.如实施例212所述的方法,其中该制剂包含001543c。
233.如实施例212所述的方法,其中该制剂包含001003c。
234.如实施例212所述的方法,其中该制剂包含001574c。
235.如实施例212所述的方法,其中该制剂包含001555c。
236.如实施例212所述的方法,其中该制剂包含001554c。
237.如实施例212所述的方法,其中该制剂包含001556c。
238.如实施例212所述的方法,其中该制剂包含001358c。
239.如实施例212所述的方法,其中该制剂包含001576c。
240.如实施例212所述的方法,其中该制剂包含001364c。
241.如实施例212所述的方法,其中该制剂包含001258c。
242.如实施例212所述的方法,其中该制剂包含mc4r-11。
243.一种制造具有组分(e)的组合物或制剂例如药物产品的方法,该组分(e)包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法包括:
制造混合物,该混合物包含:含有塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e)、etoh、中性二酰基脂质和/或生育酚和磷脂,
其中在将包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e)和etoh合并后,添加中性二酰基脂质和/或生育酚中的一种或两种、和磷脂,
从而制造具有组分(e)的组合物或制剂例如药物产品,该组分(e)包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
244.如实施例243所述的方法,其中在允许至少10%、25%、50%、75%或全部包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e)进入溶液之后,添加中性二酰基脂质和/或生育酚中的一种或两种、和磷脂。
245.如实施例243-244中任一项所述的方法,其中该混合物形成的顺序是:
i)使包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e)与etoh(和任选地水或缓冲液)接触;
ii)将磷脂添加到从i)中得到的混合物中;以及
iii)将中性二酰基脂质和/或生育酚添加到从ii)得到的混合物中。
246.如实施例243所述的方法,其中该组合物或制剂包含塞美兰肽。
247.如实施例243所述的方法,其中该组合物或制剂包含作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽、或作为用于注射的活性药物成分的塞美兰肽。
248.如实施例243所述的方法,其中该组合物或制剂包含mc4rap,例如,作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分。
249.如实施例243所述的方法,其中该组合物或制剂包含bim-22511。
250.如实施例243所述的方法,其中该组合物或制剂包含bim-22287。
251.如实施例243所述的方法,其中该组合物或制剂包含bim-22512。
252.如实施例243所述的方法,其中该组合物或制剂包含001152c。
253.如实施例243所述的方法,其中该组合物或制剂包含001543c。
254.如实施例243所述的方法,其中该组合物或制剂包含001003c。
255.如实施例243所述的方法,其中该组合物或制剂包含001574c。
256.如实施例243所述的方法,其中该组合物或制剂包含001555c。
257.如实施例243所述的方法,其中该组合物或制剂包含001554c。
258.如实施例243所述的方法,其中该组合物或制剂包含001556c。
259.如实施例243所述的方法,其中该组合物或制剂包含001358c。
260.如实施例243所述的方法,其中该组合物或制剂包含001576c。
261.如实施例243所述的方法,其中该组合物或制剂包含001364c。
262.如实施例243所述的方法,其中该组合物或制剂包含001258c。
263.如实施例243所述的方法,其中该组合物或制剂包含mc4r-11。
264.一种制造具有组分(e)的药物产品的方法,该组分(e)包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法按顺序包括以下步骤:
(i)提供混合物(组分(e)-醇混合物),该混合物包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)以及醇,例如与醇例如乙醇接触,例如溶解或分散在醇例如乙醇中的塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);以及
(ii)将组分(e)-醇混合物与一定量的组分a(例如,gdo)、组分b(例如,大豆pc)和组分d(例如,在ph6.4下的柠檬酸盐缓冲液)或一定量的组分a、b和d的全部合并;
从而制造具有以下的药物产品:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),例如,具有以下且包含预定量的醇例如10wt.%醇例如乙醇的药物产品:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
265.如实施例264所述的方法,其中该药物产品包含塞美兰肽。
266.如实施例264所述的方法,其中该药物产品包含作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽、作为活性药物成分的塞美兰肽、或作为用于注射的活性药物成分的塞美兰肽。
267.如实施例264所述的方法,其中该药物产品包含mc4rap,例如,作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分。
268.如实施例264所述的方法,其中该药物产品包含bim-22511。
269.如实施例264所述的方法,其中该药物产品包含bim-22287。
270.如实施例264所述的方法,其中该药物产品包含bim-22512。
271.如实施例264所述的方法,其中该药物产品包含001152c。
272.如实施例264所述的方法,其中该药物产品包含001543c。
273.如实施例264所述的方法,其中该药物产品包含001003c。
274.如实施例264所述的方法,其中该药物产品包含001574c。
275.如实施例264所述的方法,其中该药物产品包含001555c。
276.如实施例264所述的方法,其中该药物产品包含001554c。
277.如实施例264所述的方法,其中该药物产品包含001556c。
278如实施例264所述的方法,其中该药物产品包含001358c。
279.如实施例264所述的方法,其中该药物产品包含001576c。
280.如实施例264所述的方法,其中该药物产品包含001364c。
281.如实施例264所述的方法,其中该药物产品包含001258c。
282.如实施例264所述的方法,其中该药物产品包含mc4r-11。
283.一种制造具有组分(e)的药物产品的方法,该组分(e)包含塞美兰肽,该方法按顺序包括以下步骤:
(i)提供混合物(塞美兰肽-醇混合物),该混合物包含塞美兰肽和醇,例如与醇例如乙醇接触,例如溶解或分散在醇例如乙醇中的塞美兰肽;以及
(ii)将塞美兰肽-醇混合物与一定量的组分a(例如,gdo)、组分b(例如,大豆pc)和组分d(例如,在ph6.4下的柠檬酸盐缓冲液)或一定量的组分a、b和d的全部合并;
从而制造具有包含塞美兰肽的组分(e)的药物产品;例如,包含预定量的醇例如10wt.%醇例如乙醇且包含塞美兰肽的药物产品。
284.一种制造具有组分(e)的药物产品的方法,该组分(e)包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法按顺序包括以下步骤:
(i)提供组分(e)、醇和组分d(例如,极性溶剂,例如缓冲液)的混合物(组分(e)-醇-缓冲液混合物),该组分(e)包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该混合物例如包含与醇例如乙醇和缓冲液接触,例如溶解或分散在醇例如乙醇和缓冲液中的含有塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e);以及
(ii)将组分(e)-醇-缓冲液混合物与一定量的组分a(例如,gdo)和b(例如,大豆pc)中的一种或多种合并;
从而制造具有组分(e)的药物产品,该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该药物产品例如为具有组分(e)且包含预定量的醇例如10wt.%醇例如乙醇的药物产品,该组分(e)包含:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
285.如实施例284所述的方法,其中该药物产品包含塞美兰肽。
286.如实施例284所述的方法,其中该药物产品包含作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽、或作为用于注射的活性药物成分的塞美兰肽。
287.如实施例284所述的方法,其中该药物产品包含mc4rap,例如,作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分。
288.如实施例284所述的方法,其中该药物产品包含bim-22511。
289.如实施例284所述的方法,其中该药物产品包含bim-22287。
290.如实施例284所述的方法,其中该药物产品包含bim-22512。
291.如实施例284所述的方法,其中该药物产品包含001152c。
292.如实施例284所述的方法,其中该药物产品包含001543c。
293.如实施例284所述的方法,其中该药物产品包含001003c。
294.如实施例284所述的方法,其中该药物产品包含001574c。
295.如实施例284所述的方法,其中该药物产品包含001555c。
296.如实施例284所述的方法,其中该药物产品包含001554c。
297.如实施例284所述的方法,其中该药物产品包含001556c。
298如实施例284所述的方法,其中该药物产品包含001358c。
299.如实施例284所述的方法,其中该药物产品包含001576c。
300.如实施例284所述的方法,其中该药物产品包含001364c。
301.如实施例284所述的方法,其中该药物产品包含001258c。
302.如实施例284所述的方法,其中该药物产品包含mc4r-11。
303.一种制造具有组分(e)的药物产品的方法,该组分(e)包含塞美兰肽,该方法按顺序包括以下步骤:
(i)提供包含以下的混合物(塞美兰肽-醇-缓冲液混合物):含有塞美兰肽的组分(e);醇;和组分d,例如极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液,该混合物例如包含与醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液接触,例如溶解或分散在醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液中的塞美兰肽;以及
(ii)将组分(e)-醇-缓冲液混合物与一定量的组分a(例如,gdo)、组分b(例如,大豆pc)或一定量的组分a和b的全部合并;
从而制造具有包含塞美兰肽的组分(e)的药物产品;例如,包含预定量的醇例如10wt.%醇例如乙醇且具有组分(e)的药物产品,该组分(e)包含塞美兰肽。
304.一种制造药物产品的方法,该药物产品具有:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a;组分b;组分d;和预定量的醇,该方法包括
以指定顺序,将包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e)、组分a、组分b、组分d和添加量的醇合并,其中该添加量的醇导致该药物产品中预定量的醇,并且其中该指定顺序按顺序包括以下步骤:
(i)提供包含组分(e)和添加量的醇的混合物(组分(e)-醇混合物),该组分(e)包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该混合物例如包含与醇例如乙醇接触,例如溶解或分散在醇例如乙醇中的含有塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e);以及
(ii)将组分(e)-醇混合物与一定量的组分a、b和d或组分a、b和d的全部合并;
其中在密闭器皿中进行(i)、(ii)、或(i)和(ii),从而制造包含以下的药物产品:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a;组分b;组分d;和预定量的醇,例如10wt.%醇,例如乙醇。
305.如实施例304所述的方法,其中该药物产品包含塞美兰肽。
306.如实施例304所述的方法,其中该药物产品包含作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽、作为活性药物成分的塞美兰肽、或作为用于注射的活性药物成分的塞美兰肽。
307.如实施例304所述的方法,其中该药物产品包含mc4rap,例如,作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分。
308.如实施例304所述的方法,其中该药物产品包含bim-22511。
309.如实施例304所述的方法,其中该药物产品包含bim-22287。
310.如实施例304所述的方法,其中该药物产品包含bim-22512。
311.如实施例304所述的方法,其中该药物产品包含001152c。
312.如实施例304所述的方法,其中该药物产品包含001543c。
313.如实施例304所述的方法,其中该药物产品包含001003c。
314.如实施例304所述的方法,其中该药物产品包含001574c。
315.如实施例304所述的方法,其中该药物产品包含001555c。
316.如实施例304所述的方法,其中该药物产品包含001554c。
317.如实施例304所述的方法,其中该药物产品包含001556c。
318如实施例304所述的方法,其中该药物产品包含001358c。
319.如实施例304所述的方法,其中该药物产品包含001576c。
320.如实施例304所述的方法,其中该药物产品包含001364c。
321.如实施例304所述的方法,其中该药物产品包含001258c。
322.如实施例304所述的方法,其中该药物产品包含mc4r-11。
323.一种制造药物产品的方法,该药物产品包含塞美兰肽、组分a、组分b、组分d和预定量的醇,该方法包括
以指定顺序,将塞美兰肽、组分a、组分b、组分d和添加量的醇合并,其中该添加量的醇导致该药物产品中预定量的醇,并且其中该指定顺序按顺序包括以下步骤:
(i)提供混合物(塞美兰肽-醇混合物),该混合物包含塞美兰肽和添加量的醇,例如与醇例如乙醇接触,例如溶解或分散在醇例如乙醇中的塞美兰肽;以及
(ii)将该塞美兰肽-醇混合物与一定量的组分a、b和d或组分a、b和d的全部合并;
其中在密闭器皿中进行(i)、(ii)、或(i)和(ii),从而制造药物产品,该药物产品包含塞美兰肽、组分a、组分b、组分d和预定量的醇,例如10wt.%醇,例如乙醇。
324.一种制造药物产品的方法,该药物产品包含:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a(例如,gdo);组分b(例如,大豆pc);组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液);和预定量的醇,该方法包括
以指定顺序,将包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e)、组分a(例如,gdo)、组分b(例如,大豆pc)、组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液)和添加量的醇合并,其中该添加量的醇导致该药物产品中预定量的醇,其中该指定顺序按顺序包括以下步骤:
(i)提供包含组分(e)和添加量的醇的混合物(组分(e)-醇混合物),该组分(e)包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该混合物例如包含与醇例如乙醇接触,例如溶解或分散在醇例如乙醇中的含有塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e);以及
(ii)将组分(e)-醇混合物与一定量的组分a(例如,gdo)、组分b(例如,大豆pc)和组分d(例如,在ph6.4下的柠檬酸盐缓冲液)或组分a、b和d的全部合并;
其中在密闭器皿中进行(i)、(ii)、或(i)和(ii),从而制造包含以下的药物产品:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a(例如,gdo);组分b(例如,大豆pc);组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液);和预定量的醇,例如10wt.%醇,例如乙醇。
325.如实施例324所述的方法,其中该药物产品包含塞美兰肽。
326.如实施例324所述的方法,其中该药物产品包含作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽、作为活性药物成分的塞美兰肽、或作为用于注射的活性药物成分的塞美兰肽。
327.如实施例324所述的方法,其中该药物产品包含mc4rap,例如,作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分。
328.如实施例324所述的方法,其中该药物产品包含bim-22511。
329.如实施例324所述的方法,其中该药物产品包含bim-22287。
330.如实施例324所述的方法,其中该药物产品包含bim-22512。
331.如实施例324所述的方法,其中该药物产品包含001152c。
332.如实施例324所述的方法,其中该药物产品包含001543c。
333.如实施例324所述的方法,其中该药物产品包含001003c。
334.如实施例324所述的方法,其中该药物产品包含001574c。
335.如实施例324所述的方法,其中该药物产品包含001555c。
336.如实施例324所述的方法,其中该药物产品包含001554c。
337.如实施例324所述的方法,其中该药物产品包含001556c。
338.如实施例324所述的方法,其中该药物产品包含001358c。
339.如实施例324所述的方法,其中该药物产品包含001576c。
340.如实施例324所述的方法,其中该药物产品包含001364c。
341.如实施例324所述的方法,其中该药物产品包含001258c。
342.如实施例324所述的方法,其中该药物产品包含mc4r-11。
343.一种制造包含塞美兰肽、组分a(例如,gdo)、组分b(例如,大豆pc)、组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液)和预定量的醇的药物产品的方法,该方法包括:
以指定顺序,将塞美兰肽、组分a(例如,gdo)、组分b(例如,大豆pc)、组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液)和添加量的醇合并,其中该添加量的醇导致该药物产品中预定量的醇,其中该指定顺序按顺序包括以下步骤:
(i)提供混合物(塞美兰肽-醇混合物),该混合物包含塞美兰肽和添加量的醇,例如与醇例如乙醇接触,例如溶解或分散在醇例如乙醇中的塞美兰肽;以及
(ii)将该塞美兰肽-醇混合物与一定量的组分a(例如,gdo)、组分b(例如,大豆pc)和组分d(例如,在ph6.4下的柠檬酸盐缓冲液)或组分a、b和d的全部合并;
其中在密闭器皿中进行(i)、(ii)、或(i)和(ii),从而制造药物产品,该药物产品包含塞美兰肽、组分a(例如,gdo)、组分b(例如,大豆pc)、组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液)和预定量的醇,例如10wt.%醇,例如乙醇。
344.一种制造药物产品的方法,该药物产品包含:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a;组分b;组分d;和预定量的醇,该方法包括
以指定顺序,将包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e)、组分a、组分b、组分d和添加量的醇合并,其中该添加量的醇导致该药物产品中预定量的醇,其中该指定顺序按顺序包括以下步骤:
(i)提供包含组分(e)、添加量的醇和组分d(例如极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液)的混合物(组分(e)-缓冲液混合物),该组分(e)包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该混合物例如包含与醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液接触,例如溶解或分散在醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液中的含有塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e);以及
(ii)将组分(e)-醇-缓冲液混合物与一定量的组分a和b或组分a和b的全部合并;
其中在密闭器皿中进行(i)、(ii)、或(i)和(ii),从而制造包含以下的药物产品:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a;组分b;组分d;和预定量的醇,例如10wt.%醇,例如乙醇。
345.如实施例344所述的方法,其中该药物产品包含塞美兰肽。
346.如实施例344所述的方法,其中该药物产品包含作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽、作为活性药物成分的塞美兰肽、或作为用于注射的活性药物成分的塞美兰肽。
347.如实施例344所述的方法,其中该药物产品包含mc4rap,例如,作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分。
348.如实施例344所述的方法,其中该药物产品包含bim-22511。
349.如实施例344所述的方法,其中该药物产品包含bim-22287。
350.如实施例344所述的方法,其中该药物产品包含bim-22512。
351.如实施例344所述的方法,其中该药物产品包含001152c。
352.如实施例344所述的方法,其中该药物产品包含001543c。
353.如实施例344所述的方法,其中该药物产品包含001003c。
354.如实施例344所述的方法,其中该药物产品包含001574c。
355.如实施例344所述的方法,其中该药物产品包含001555c。
356.如实施例344所述的方法,其中该药物产品包含001554c。
357.如实施例344所述的方法,其中该药物产品包含001556c。
358.如实施例344所述的方法,其中该药物产品包含001358c。
359.如实施例344所述的方法,其中该药物产品包含001576c。
360.如实施例344所述的方法,其中该药物产品包含001364c。
361.如实施例344所述的方法,其中该药物产品包含001258c。
362.如实施例344所述的方法,其中该药物产品包含mc4r-11。
363.一种制造药物产品的方法,该药物产品包含塞美兰肽、组分a、组分b、组分d和预定量的醇,该方法包括
以指定顺序,将该塞美兰肽、组分a、组分b、组分d和添加量的醇合并,其中该添加量的醇导致该药物产品中预定量的醇,其中该指定顺序按顺序包括以下步骤:
(i)提供混合物(塞美兰肽-醇-缓冲液混合物),该混合物包含塞美兰肽、添加量的醇和组分d例如极性溶剂例如缓冲液例如在ph6.4下的柠檬酸盐缓冲液,例如与醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液接触,例如溶解或分散在醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液中的塞美兰肽;以及
(ii)将塞美兰肽-醇-缓冲液混合物与一定量的组分a和b或组分a和b的全部合并;
其中在密闭器皿中进行(i)、(ii)、或(i)和(ii),从而制造药物产品,该药物产品包含塞美兰肽、组分a、组分b、组分d和预定量的醇,例如10wt.%醇,例如乙醇。
364.一种制造药物产品的方法,该药物产品包含:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a(例如,gdo);组分b(例如,大豆pc);组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液);和预定量的醇,该方法包括
以指定顺序,将包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e)、组分a、组分b、组分d和添加量的醇合并,其中该添加量的醇导致该药物产品中预定量的醇,其中该指定顺序按顺序包括以下步骤:
(i)提供包含组分(e)、添加量的醇和组分d(例如极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液)的混合物(组分(e)-醇-缓冲液混合物),该组分(e)包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该混合物例如包含与醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液接触,例如溶解或分散在醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液中的含有塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e);以及
(ii)将组分(e)-醇-缓冲液混合物与一定量的组分a(例如,gdo)和组分b(例如,大豆pc)或组分a和b的全部合并;
其中在密闭器皿中进行(i)、(ii)、或(i)和(ii),从而制造包含以下的药物产品:组分(e),该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽,或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11);组分a(例如,gdo);组分b(例如,大豆pc);组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液);和预定量的醇,例如10wt.%醇,例如乙醇。
365.如实施例364所述的方法,其中该药物产品包含塞美兰肽。
366.如实施例364所述的方法,其中该药物产品包含作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽、作为活性药物成分的塞美兰肽、或作为用于注射的活性药物成分的塞美兰肽。
367.如实施例364所述的方法,其中该药物产品包含mc4rap作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分。
368.如实施例364所述的方法,其中该药物产品包含bim-22511。
369.如实施例364所述的方法,其中该药物产品包含bim-22287。
370.如实施例364所述的方法,其中该药物产品包含bim-22512。
371.如实施例364所述的方法,其中该药物产品包含001152c。
372.如实施例364所述的方法,其中该药物产品包含001543c。
373.如实施例364所述的方法,其中该药物产品包含001003c。
374.如实施例364所述的方法,其中该药物产品包含001574c。
375.如实施例364所述的方法,其中该药物产品包含001555c。
376.如实施例364所述的方法,其中该药物产品包含001554c。
377.如实施例364所述的方法,其中该药物产品包含001556c。
378如实施例364所述的方法,其中该药物产品包含001358c。
379.如实施例364所述的方法,其中该药物产品包含001576c。
380.如实施例364所述的方法,其中该药物产品包含001364c。
381.如实施例364所述的方法,其中该药物产品包含001258c。
382.如实施例364所述的方法,其中该药物产品包含mc4r-11。
383.一种制造包含塞美兰肽、组分a(例如,gdo)、组分b(例如,大豆pc)、组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液)和预定量的醇的药物产品的方法,该方法包括:
以指定顺序,将该塞美兰肽、组分a、组分b、组分d和添加量的醇合并,其中该添加量的醇导致该药物产品中预定量的醇,其中该指定顺序按顺序包括以下步骤:
(i)提供混合物(塞美兰肽-醇-缓冲液混合物),该混合物包含该塞美兰肽、添加量的醇和组分d例如极性溶剂例如缓冲液例如在ph6.4下的柠檬酸盐缓冲液,例如与醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液接触,例如溶解或分散在醇例如乙醇和在ph6.4下的柠檬酸盐缓冲液中的塞美兰肽;以及
(ii)将该塞美兰肽-醇-缓冲液混合物与一定量的组分a(例如,gdo)、组分b(例如,大豆pc)或组分a和b的全部合并;
其中在密闭器皿中进行(i)、(ii)、或(i)和(ii),从而制造药物产品,该药物产品包含塞美兰肽、组分a(例如,gdo)、组分b(例如,大豆pc)、组分d(例如,极性溶剂,例如缓冲液,例如在ph6.4下的柠檬酸盐缓冲液)和预定量的醇,例如10wt.%醇,例如乙醇。
384.一种制造包含以下的药物产品的方法:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法按顺序包括以下步骤:
i)将一定量的组分a、b、c和d中的一种或多种(例如,全部)合并;
ii)向此混合物提供包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e);以及
iii)将(i)和(ii)的混合物混合指定的时间长度以溶解或分散包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e);
从而制造具有组分(e)的药物产品,该组分(e)是塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该药物产品例如为包含组分(e)且包含预定量的醇例如10wt.%醇例如乙醇的药物产品,该组分(e)包含:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
385.如实施例384所述的方法,其中该药物产品包含塞美兰肽。
386.如实施例384所述的方法,其中该药物产品包含作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽、作为活性药物成分的塞美兰肽、或作为用于注射的活性药物成分的塞美兰肽。
387.如实施例384所述的方法,其中该药物产品包含mc4rap,例如,作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分。
388.如实施例384所述的方法,其中该药物产品包含bim-22511。
389.如实施例384所述的方法,其中该药物产品包含bim-22287。
390.如实施例384所述的方法,其中该药物产品包含bim-22512。
391.如实施例384所述的方法,其中该药物产品包含001152c。
392.如实施例384所述的方法,其中该药物产品包含001543c。
393.如实施例384所述的方法,其中该药物产品包含001003c。
394.如实施例384所述的方法,其中该药物产品包含001574c。
395.如实施例384所述的方法,其中该药物产品包含001555c。
396.如实施例384所述的方法,其中该药物产品包含001554c。
397.如实施例384所述的方法,其中该药物产品包含001556c。
398.如实施例384所述的方法,其中该药物产品包含001358c。
399.如实施例384所述的方法,其中该药物产品包含001576c。
400.如实施例384所述的方法,其中该药物产品包含001364c。
401.如实施例384所述的方法,其中该药物产品包含001258c。
402.如实施例384所述的方法,其中该药物产品包含mc4r-11。
403.如实施例384-402中任一项所述的方法,其中将该混合进行至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30小时。
404.如实施例384-402中任一项所述的方法,其中将该混合进行1-30小时。
405.如实施例384-402中任一项所述的方法,其中将该混合进行不超过30、40或50小时。
406.一种制造包含组分(e)的药物产品的方法,该组分(e)包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法按顺序包括以下步骤:
i)将一定量的组分a、b、c中的一种或多种(例如,全部)和包含塞美兰肽的组分(e)或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)合并;
ii)向此混合物提供预定量的组分c;以及
iii)将(i)和(ii)的混合物混合指定的时间长度以溶解或分散包含塞美兰肽或mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)的组分(e);
从而制造具有组分(e)的药物产品,该组分(e)包含塞美兰肽,作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽,作为活性药物成分的塞美兰肽,作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该药物产品例如为包含组分(e)且包含预定量的醇例如10wt.%醇例如乙醇的药物产品,该组分(e)包含:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11)。
407.如实施例406所述的方法,其中该药物产品包含塞美兰肽。
408.如实施例406所述的方法,其中该药物产品包含作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽、作为活性药物成分的塞美兰肽、或作为用于注射的活性药物成分的塞美兰肽。
409.如实施例406所述的方法,其中该药物产品包含mc4rap,例如,作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分。
410.如实施例406所述的方法,其中该药物产品包含bim-22511。
411.如实施例406所述的方法,其中该药物产品包含bim-22287。
412.如实施例406所述的方法,其中该药物产品包含bim-22512。
413.如实施例406所述的方法,其中该药物产品包含001152c。
414.如实施例406所述的方法,其中该药物产品包含001543c。
415.如实施例406所述的方法,其中该药物产品包含001003c。
416.如实施例406所述的方法,其中该药物产品包含001574c。
417.如实施例406所述的方法,其中该药物产品包含001555c。
418.如实施例406所述的方法,其中该药物产品包含001554c。
419.如实施例406所述的方法,其中该药物产品包含001556c。
420.如实施例406所述的方法,其中该药物产品包含001358c。
421.如实施例406所述的方法,其中该药物产品包含001576c。
422.如实施例406所述的方法,其中该药物产品包含001364c。
423.如实施例406所述的方法,其中该药物产品包含001258c。
424.如实施例406所述的方法,其中该药物产品包含mc4r-11。
425.如实施例406-424中任一项所述的方法,其中将该混合进行至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30小时。
426.如实施例406-424中任一项所述的方法,其中将该混合进行1-30小时。
427.如实施例406-424中任一项所述的方法,其中将该混合进行不超过30、40或50小时。
428.药物产品的多种制剂,例如第一制剂、第二制剂、第三制剂或更多,该药物产品具有组分(e),该组分(e)是塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该多种制剂中的每一种具有落在预定范围内的一定量的etoh,该多种制剂例如为通过根据实施方案65至427中的一项或多项所述的方法制造的多种制剂。
429.如实施例428所述的药物产品的多种制剂,该药物产品包含组分(e),该组分(e)包含:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),其中在该多种制剂中的每一种中etoh的量在彼此的2、1或0.5重量%内。
430.如实施例428所述的药物产品的多种制剂,该药物产品包含组分(e),该组分(e)包含:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),其中在该多种制剂中的每一种中etoh的量在彼此的10重量%+/-5、10重量%+/-4、10重量%+/-3、10重量%+/-2或10重量%+/-1范围内。
431.如实施例428-430中任一项所述的药物产品的多种制剂,该药物产品具有组分(e),该组分(e)包含:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),其中该多种制剂中的第一制剂和第二制剂在彼此的10、20、30、60、180或365天内制造。
432.如实施例428-431所述的药物产品的多种制剂,该药物产品包含组分(e),该组分(e)包含:塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),其中第二制剂在第一制剂的小于10、20、30、60、180或365天制造。
433.如实施例428所述的方法,其中该多种制剂包含塞美兰肽。
434.如实施例428所述的方法,其中该多种制剂包含作为被配制用于注射的唯一活性药物成分的塞美兰肽,作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽、或作为用于注射的活性药物成分的塞美兰肽。
435.如实施例428所述的方法,其中该多种制剂包含mc4rap,例如,作为活性药物成分或作为用于注射的活性药物成分。
436.如实施例428所述的方法,其中该多种制剂包含bim-22511。
437.如实施例428所述的方法,其中该多种制剂包含bim-22287。
438.如实施例428所述的方法,其中该多种制剂包含bim-22512。
439.如实施例428所述的方法,其中该多种制剂包含001152c。
440.如实施例428所述的方法,其中该多种制剂包含001543c。
441.如实施例428所述的方法,其中该多种制剂包含001003c。
442.如实施例428所述的方法,其中该多种制剂包含001574c。
443.如实施例428所述的方法,其中该多种制剂包含001555c。
444.如实施例428所述的方法,其中该多种制剂包含001554c。
445.如实施例428所述的方法,其中该多种制剂包含001556c。
446如实施例428所述的方法,其中该多种制剂包含001358c。
447.如实施例428所述的方法,其中该多种制剂包含001576c。
448.如实施例428所述的方法,其中该多种制剂包含001364c。
449.如实施例428所述的方法,其中该多种制剂包含001258c。
450.如实施例428所述的方法,其中该多种制剂包含mc4r-11。
451.一种向受试者提供组分(e)的方法,该组分(e)包含塞美兰肽;作为被配制用于注射的唯一活性药物成分的塞美兰肽;作为唯一活性成分的塞美兰肽;作为活性药物成分的塞美兰肽;作为用于注射的活性药物成分的塞美兰肽;或作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分的mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),该方法包括向该受试者施用有效量的如实施例1-450中任一项所述的药物产品或由如实施例65-427所述的方法中的一种或多种制造的药物产品。
452.如实施例451所述的方法,其中该药物产品包含塞美兰肽。
453.如实施例451所述的方法,其中该药物产品包含作为被配制用于注射的唯一活性药物成分的塞美兰肽、作为唯一活性成分的塞美兰肽、作为活性药物成分的塞美兰肽、或作为用于注射的活性药物成分的塞美兰肽。
454.如实施例451所述的方法,其中该药物产品包含mc4rap(例如,bim-22511、bim-22287、bim-22512、001152c、001543c、001003c、001574c、001555c、001554c、001556c、001358c、001576c、001364c、001258c或mc4r-11),作为唯一活性成分、作为用于注射的唯一活性成分、作为活性药物成分或作为用于注射的活性药物成分。
455.如实施例451所述的方法,其中该药物产品包含bim-22511。
456.如实施例451所述的方法,其中该药物产品包含bim-22287。
457.如实施例451所述的方法,其中该药物产品包含bim-22512。
459.如实施例451所述的方法,其中该药物产品包含001152c。
460.如实施例451所述的方法,其中该药物产品包含001543c。
461.如实施例451所述的方法,其中该药物产品包含001003c。
462.如实施例451所述的方法,其中该药物产品包含001574c。
463.如实施例451所述的方法,其中该药物产品包含001555c。
464.如实施例451所述的方法,其中该药物产品包含001554c。
465.如实施例451所述的方法,其中该药物产品包含001556c。
466.如实施例451所述的方法,其中该药物产品包含001358c。
467.如实施例451所述的方法,其中该药物产品包含001576c。
468.如实施例451所述的方法,其中该药物产品包含001364c。
469.如实施例451所述的方法,其中该药物产品包含001258c。
470.如实施例451所述的方法,其中该药物产品包含mc4r-11。
471.如实施例451所述的方法,其中该受试者患有对黑皮质素-4受体(mc4r)的调节有反应的障碍,或具有患该障碍的风险。
472.如实施例471所述的方法,其中该障碍选自:1型糖尿病、2型糖尿病、肥胖症、胰岛素抵抗、代谢综合征、男性勃起功能障碍、女性性功能障碍、非酒精性脂肪肝病、非酒精性脂肪性肝炎、包括酗酒在内的物质滥用障碍、饮食障碍、恶病质、炎症或焦虑、普拉德-威利综合征、巴-比二氏综合征和阿尔斯特伦综合征。
473.如实施例472所述的方法,其中该障碍是肥胖症。
474.如实施例472所述的方法,其中该障碍是1型糖尿病。
475.如实施例472所述的方法,其中该障碍是2型糖尿病。
476.如实施例472所述的方法,其中该障碍是普拉德-威利综合征。
477.如实施例472所述的方法,其中该障碍是巴-比二氏综合征。
478.如实施例472所述的方法,其中该障碍是阿尔斯特伦综合征。
实例
实例1:塞美兰肽配制品的药代动力学。
本文披露的药物产品的缓释例如延长释放的实施例具有期望的药代动力学特性,例如cmax降低而曲线下面积(auc)没有变化或增加。
方法
制造了十一种不同的药物产品配制品,并且评估了它们在食蟹猴中的体内药代动力学特性。配制品5a-5d描述于表2中。配制品3a和4a描述于表3中。配制品1a-1e描述于表4中。
对于每种药物产品配制品,将六只雄性食蟹猴用单次sc注射0.5mg/kg(配制品1a-1c、3a-4a和5a-5c)或1.5mg/kg(配制品1d-1e和5d)给药。在48到240小时的时间段内,从每个受试者中抽取九到十一个之间的系列血液样品(约0.8ml/样品)。将血浆(含有1%halttm蛋白酶抑制剂)收集、冷冻并且运送到德克萨斯州奥斯汀市的全球临床试验处(worldwideclinicaltrials,austin,texas)进行分析。分析猴血浆样品中的肽。基于对0.100ml血浆的分析,针对5.00至2000ng/ml的范围验证了本研究中使用的方法。使用从校准标准品产生的加权1/x2线性最小二乘回归分析进行定量。
结果
图1a和1b展示了来自药物产品1a-1c、5a-5c和3a/4a的sc注射和先前研究的sc输注施用的平均浓度数据。肽配制品(3a和4a)的sc输注展示了低的cmax和大的auc,而相同药物产品的sc注射示出了更高的cmax和小得多的auc。
图2a和2b展示了来自药物产品1d-1e、5d的平均浓度数据和先前研究的剂量归一化sc输注数据。如图2a和2b所示,药物产品的sc输注展示了低的cmax和大的auc。药物产品1d、1e和5d具有浓度时间曲线,具有在2小时的初始峰、48与96小时之间的次级峰或平台以及然后在96与240小时之间缓慢下降。数据显示,这些药物产品剂量提供了在sc注射后药物立即初始持续突释。初始突释之后是连续释放的时间段和随后药物产品释放速率略微增加的24至48小时时间段。
表2:实例1中所用的配制品5a-5d。
表3:实例1中所用的配制品3a和4a。
表4:实例1中所用的配制品1a-1e。
rym=塞美兰肽;spc=大豆磷脂酰胆碱;gdo=二油酸甘油酯;etoh=乙醇;pg=丙二醇;p80=聚山梨酯80;wfi=注射用水,含有0.1mg/ml的edta
实例2.塞美兰肽配制品的药代动力学
为了评估塞美兰肽的药代动力学,对健康肥胖的受试者进行了两部分研究,包括单剂量施用(a部分)和多剂量施用(b部分)。
a部分是剂量递增、安慰剂对照的研究,包括至多3个顺序小组。对于每个小组,将10名21和54岁之间、身体健康的正常肥胖受试者分配到随机顺序的治疗中,其中包括8个活性剂治疗和2个安慰剂治疗。从a部分获得的数据用于确定b部分的剂量和给药方案。在b部分中,将12名正常健康的肥胖患者随机分配以接受6种活性剂治疗和6种安慰剂治疗。受试者每周接受皮下注射分配的配制品一次,持续4周。b部分中的患者在临床单位中居住28天。
将塞美兰肽配制在由大豆磷脂酰胆碱、二油酸甘油酯、乙醇和柠檬酸盐缓冲液组成的无菌液体极性脂质相中。配制品中每种组分的浓度总结在表5中。不受理论的束缚,塞美兰肽配制品以长效方式起作用,其中当皮下注射时,水性体液被脂质相吸收以形成由原位形成的液体晶体组成的凝胶状贮库。
表5.用于pk研究的配制品组分
a部分(单剂量阶段)
招募了10名正常肥胖受试者用于a部分的每个剂量水平;8名接受活性药物,2名接受安慰剂。在单剂量阶段中使用3种剂量水平,根据顺序的递增剂量设计施用这些剂量水平。按以下顺序施用单次塞美兰肽剂量:2.5mg、10mg和30mg。在下一个更高剂量水平开始之前,分析塞美兰肽浓度并且评估安全性。在给药早晨皮下施用该药物。在给药前和给药后0.5、1、2、3、4、6、8、10、12、16、24、30和36小时(在诊所),然后在作为门诊病人给药后约48、60、72、96、120、168、240和336小时,收集血液样品。基于首次给药的pk分析,在给药后21天(480小时)和28天(648小时)包括了针对30mg剂量的另外的血液样品。记录血液收集的实际时间。
在所有三个剂量水平下对每个样品的平均塞美兰肽浓度进行定量并且示于图3中。通常,塞美兰肽在最早的血浆样品时间(0.5小时)出现,并且在给药后约4小时缓慢上升至最大浓度。给药后2周或更长时间,塞美兰肽在血浆中是可测量的。从半对数图中,10mg和30mg剂量的终末阶段显现是线性的和平行的。然而,与其他两种治疗相比,针对2.5mg剂量的平均特征指示血浆中的塞美兰肽浓度显著更低,并且给药后24到96小时浓度降底至可定量水平之下。针对2.5mg剂量的所有值被报道为到96小时(给药后4天)时在可定量水平之下。
b部分(多剂量阶段)
b部分招募了十二(12)名肥胖受试者;6名接受活性药物,6名被给予安慰剂。基于a部分的结果,选择10mg塞美兰肽每周一次作为b部分的剂量。在整个4周的研究中,受试者在临床设施中居住。合格的受试者在第一剂量前的晚上进入临床设施。分配到活性治疗的受试者在第1天的早晨皮下接受塞美兰肽10mg。安慰剂受试者接受与活性治疗相同体积的安慰剂注射。从给药前的傍晚至给药后4小时,受试者禁食。提供标准的低脂餐。在第1天给予治疗的情况下,还在第8、15和22天向受试者给药。
在给药前某一时间,以及在第一周期间与第四周期间在0.5、1、2、3、4、6、8、10、12、16、24、30、36、48、60、72、96、120、168、240和336小时收集血液样品。记录实际采样时间。另外,针对谷塞美兰肽浓度,恰在给药前的某一时间收集血液样品,以评价达到稳定状态。
在b部分的多剂量阶段期间,六名受试者的谷塞美兰肽浓度示于图4。通过目视检查,显现在4个周剂量的测试配制品后第4周期间达到稳定状态。
结论
本研究的pk目的是评价被设计为每周一次施用的研究性塞美兰肽可注射配制品的pk性能。本研究的结果显示,对于单剂量施用,没有早期突释效应或剂量倾卸。注射后很快开始塞美兰肽的吸收,几乎没有滞后时间。平均cmax浓度是2.92、11.5和34.1ng/ml,以及2.5、10和30mg剂量的中值tmax值分别是3.5、4.0和6.0小时。平均auc∞值分别是92.9、1142和3474hr*ng/ml。对于2.5mg剂量,给药后24至72小时,塞美兰肽浓度是可测量的。相比之下,在168小时后定义了10mg和30mg剂量的特征。10和30mg剂量的长半衰期值(平均值分别是123和159小时)指示在给药后一周期间仍发生吸收。此外,cmax在2.5至30mg剂量范围内大致成比例。10mg和30mg剂量的auc∞成比例。2.5mg剂量的auc∞不太成比例,因为在24至72小时之后,血浆浓度是不可检测的。
对于多剂量施用,以10mg剂量每周一次提供塞美兰肽,持续4周,产生在4小时的中值tmax下平均cmax为11.4mg/ml。吸收没有滞后,并且在1周的给药间隔中塞美兰肽的浓度下降至168小时处2.92ng/ml的平均浓度。第4周的平均aucτ在幅度上与第1周的平均auc∞相似,并且塞美兰肽的累计指数是1.46。
实例3.塞美兰肽配制品的稳定性分析。
为了评估塞美兰肽配制品随时间对塞美兰肽的稳定性的影响,改变示例性塞美兰肽配制品的组分。在第一研究中,使用以下不同形式的gdo,如实施例2中所述用30mg/ml塞美兰肽制备塞美兰肽配制品:1)商业纯度的gdo;2)商业纯度的gdo,已经进一步纯化以除去脂肪酸化合物;和3)合成的gdo。将配制品在配备有桩钉的不锈钢注射筒和橡胶柱塞的1ml玻璃注射筒中在40℃下储存至多三个月。将样品随时间从每个注射筒中移除,并且通过hplc对塞美兰肽的降解进行定量,如图5所示。如所示,用合成的gdo制备的配制品展现出与其他测试的配制品相比更低的塞美兰肽降解量。
在第二研究中还研究了edta浓度对塞美兰肽降解的影响。制备了容纳具有较高edta连同各种来源的gdo的塞美兰肽配制品的注射筒,并且通过hplc对塞美兰肽随时间的降解进行定量。本研究的结果描绘于图6中,并且指示在商业纯度的gdo或合成的gdo存在的情况下,较高浓度的edta对塞美兰肽的稳定性具有较小的影响。
在第三研究中,在合成的gdo存在的情况下,探索了塞美兰肽和edta浓度的影响。在那里,与30mg/ml配制品相比,含有15mg/ml塞美兰肽的配制品展现更高的降解水平,并且随着塞美兰肽浓度的降低,渐增的edta浓度显现具有更大的作用;参见图7。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



