他克莫司的自微乳组合物及其制备方法与流程
 2021-01-08 11:01:06|
2021-01-08 11:01:06| 324|
324| 起点商标网
起点商标网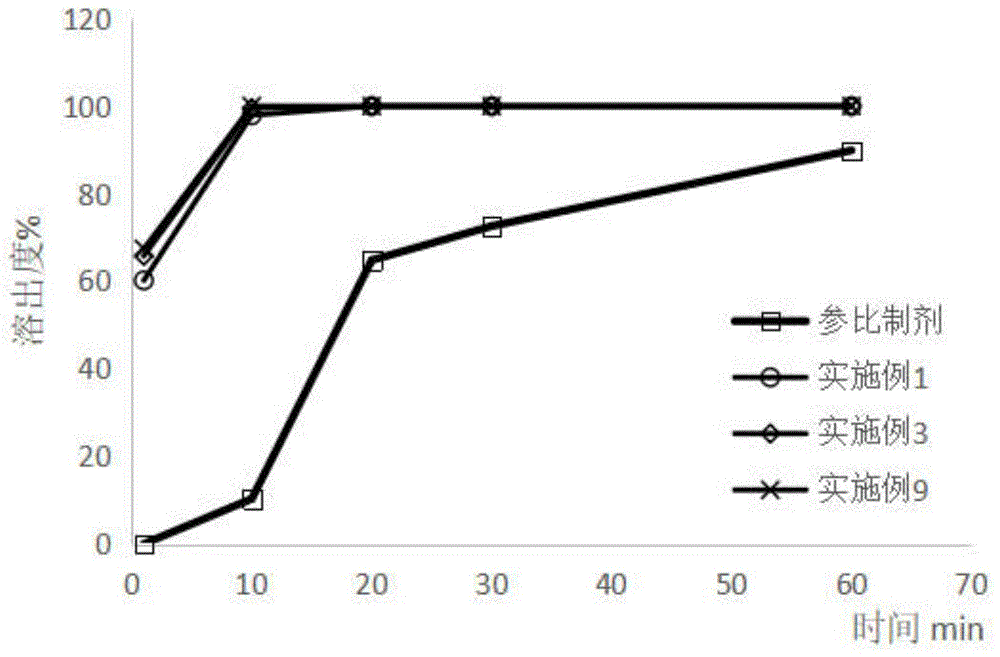
本发明涉及医药
技术领域:
,具体涉及一种他克莫司的自微乳组合物及其制备方法。
背景技术:
:他克莫司以白色晶体或结晶性粉末的形式存在,几乎不溶于水,易溶于乙醇,极易溶于甲醇和氯仿。他克莫司,商品名为普乐可复,是日本藤泽公司(fujisawa)于1984年从tsukubaensis链霉菌(一种类似真菌的细菌,由tsukuba在土壤样本中发现)的发酵培养基中分离而得的一种大环内酯类强效免疫抑制剂。他克莫司的免疫抑制作用比环孢素a(csa)强10~100倍,因而大大降低了临床使用剂量,同时不良反应也明显降低。他克莫司是一种强效免疫抑制剂,主要用于预防和治疗患者器官移植后的排斥反应,具有与环孢霉素a相似而更加广泛的免疫抑制作用,但其效力比环孢霉素a高而毒副作用却更低。其作用机制可能与其抑制t淋巴细胞激活有关:他克莫司与t细胞质的fk-506结合蛋白fkbp-12、钙离子、钙调蛋白、钙调神经磷酸酶形成复合物,从而抑制钙调神经磷酸酶的活性。这一过程通过抑制t细胞核因子的去磷酸和核转位而抑制细胞因子如白介素-1和γ-干扰素等的基因转录,最终抑制细胞因子的产生和t淋巴细胞活化,形成免疫抑制。他克莫司可用于各种剂型,包括胶囊、注射剂和软膏剂,可用于肝脏、肾脏或心中移植的患者预防器官排斥。由于胃肠道功能和食物摄入的差异,他克莫司的药代动力学特征在个体中变化很大,他克莫司是细胞色素p450(cyp3a)的底物,导致个体代谢差异较大,肝脏首过效应明显,其生物利用度差,并且其生物利用度是个体可变的。这种变化性连同它的治疗指数窄,监测他克莫司的血药浓度对达到最佳疗效同时使毒性的风险最少化是有必要的。其中他克莫司胶囊最早于1993年在日本上市,商品名为prograf,是一种需要每天服用两次的速释型胶囊;2007年、2011年和2013年他克莫司缓释型胶囊分别在欧洲、中国和美国上市,该剂型每天只需服用一次,使患者用药更加方便,改善患者的药物依从性。cn1301157a公开了一种大环内酯类化合物的口服制剂,其中大环内酯类化合物延释溶出;含有在固体溶液中的组合物的延释制剂,其中大环内酯类化合物在固体基质中以无定形状态存在。这种大环内酯类化合物的延释制剂,其中大环内酯类化合物溶出最大量的63.2%所需要的时间(t63.2%)为0.7-15小时,上述数据的测定是根据日本药典第13版溶出实验no.2(桨法,50rpm)进行的,采用的实验溶液是ph调节为4.5的0.005%的羟丙基纤维素水溶液。该专利文献还具体公开了一种含固体分散组合物的延释制剂,其中所述固体分散组合物的特征在于:(1)藤霉素或其水合物存在于羟丙甲纤维素和乙基纤维素的混合物中,其中所述羟丙甲纤维素和乙基纤维素相对于藤霉素的重量比分别为0.2∶1-0.4∶1和0.1∶1-5∶1,(2)包含乳糖作为赋形剂,及(3)所述固体分散组合物的颗粒大小等于或小于250μm。。cn105687161a公开了一种他克莫司缓释微丸及其制备方法,包括含药微丸、包衣层,所述包衣层将含药微丸包裹,所述含药微丸包括:5mg他克莫司、70mg空白丸芯、120-220mg填充剂、25-125mg润滑剂、5-50mg粘合剂,所述的包衣层包括:35-175mg尤特奇ne30d、5-52mg滑石粉,其制备方法的工序为:备料;混合;粘合剂的配制;制丸;包衣剂的配制;包衣;灌装;铝塑、成品。cn1301157a公开了一种他克莫司的缓释制剂,是成胶囊剂和片剂形式的缓释药物组合物。该缓释药物组合物中包括他克莫司、乙基纤维素、亲水性高分子材料例如羟丙甲基纤维素和聚维酮等、水溶性稀释剂例如乳糖和甘露醇等、润滑剂。还涉及缓释药物组合物的制备方法和质量测定方法。提供的他克莫司缓释药物组合物具有优异的制剂品质与性能以及高效的释放性质。上述专利申请所记载的他克莫司缓释制剂以及例如市售商品名为astagrafxl的他克莫司缓释胶囊的缓释机理,是使药物在水不溶性高分子物质乙基纤维素中形成固体分散体,从而通过该水不溶性高分子物质延缓药物的释放。自微乳组合物在胃肠道中形成微乳,药物存在于这些细小的油滴中,快速分布于整个胃肠道内,药物在油/水两项之间分配,依靠细小油滴的巨大表面积大大提高水不溶出性药物的溶出,提高生物利用度。自微乳组合物已被证明能够提高药物在血液循环中的稳定性,延长药物作用时间,另外由于其粒径和粒径分布均一,可以将药物输送到特定的细胞和组织。自微乳组合物不仅粒径小,而且能够避免微乳聚集成团,更能深入病变部位,改变药物分布,提高药物疗效,降低副作用。因此,需要提供一种简单、可靠、降低不同个体药物吸收差异的他克莫司制剂。技术实现要素:本发明的目的在于提供一种他克莫司的自微乳组合物及其制备方法,以提高他克莫司的生物利用度和缓解他克莫司的不良反应同时降低不同个体药物吸收差异的问题。为了解决上述技术问题,本发明采用如下技术方案:一方面,本发明提供一种他克莫司的自微乳组合物,由以下组分组成:他克莫司、油相、表面活性剂、助表面活性剂、有机酸和抗氧化剂。进一步地,所述自微乳组合物中他克莫司、油相、表面活性剂、助表面活性剂、有机酸和抗氧化剂的质量比为1:2~80:10~300:10~150:0.1~20:0.1~10。进一步地,所述自微乳组合物中他克莫司的质量百分比为0.1%~1%,进一步地,所述他克莫司的质量百分比为0.1%、0.2%、0.4%、0.6%、0.8%、1%。进一步地,所述自微乳组合物中油相的质量百分比为5~30%,进一步地,所述油相的质量百分比为5%、10%、15%、20%、21.27%、25%、30%。进一步地,所述自微乳组合物中表面活性剂的质量百分比为10%~90%,进一步地,所述表面活性剂的质量百分比为10%、20%、25%、30%、40%、44.11%、45%、50%、55%、60%、65%、70%、80%或90%。进一步地,所述自微乳组合物中助表面活性剂的质量百分比为5%~50%,进一步地,所述助表面活性剂的质量百分比为5%、10%、15%、20%、25%、30%、32.64%、32.65%、35%、40%、45%或50%。进一步地,所述自微乳组合物中有机酸的质量百分比为0.1%~10%,进一步地,所述有机酸的质量百分比为0.1%、0.2%、0.5%、0.9%、1%、2%、5%、6%、8%或10%。进一步地,所述自微乳组合物中抗氧化剂的质量百分比为0.1%~10%,进一步地,所述抗氧化剂的质量百分比为0.1%、0.2%、0.4%、0.5%、0.9%、1%、2%、5%、6%、8%或10%。进一步地,所述自微乳组合物中他克莫司、油相、表面活性剂、助表面活性剂、有机酸和抗氧化剂的质量比为1:10~50:50~150:50~100:1~5:1~5。进一步地,所述抗氧化剂选自叔丁基对羟基茴香醚bha、丁羟基甲苯bht、维生素e(dl-α-生育酚)中的一种或两种。进一步地,所述有机酸选自柠檬酸、酒石酸、草酸、苹果酸中的一种。进一步地,所述油相为药学上可接受的各种油相,选自天然植物油、经结构改造和水解后的植物油、或链长在c8-c10之间的中等链长脂肪酸甘油酯中的一种或多种。进一步地,所述油相选自:玉米油、葵花油(如精制葵花油)、芝麻油、花生油、大豆油、红花油、橄榄油、棕榈油、棉籽油、薏仁油、蓖麻油、氢化蓖麻油、椰子油c8/c10甘油单酯或双酯(capmulmcm)、椰子油c8/c10丙二醇双酯(captex200)、椰子油c8/c10甘油三酯(captex355)、椰子油氨丙基甜菜碱、纯化乙酰化的单甘油酯(miglyol812)、纯化向日葵油单甘油酯、聚乙二醇月桂酸甘油酯、单油酸甘油酯、油酰聚氧乙烯甘油酯、单亚油酸甘油酯、中链甘油三酯、聚乙二醇油酸甘油酯、聚乙二醇亚油酸甘油酯、聚乙二醇辛酸癸酸甘油酯、辛酸癸酸甘油酯、聚氧乙烯油酸甘油酯、聚氧乙烯亚油酸甘油酯、山茶酸甘油酯、杏仁油油酸peg-6甘油酯、玉米油亚油酸peg-6甘油酯、油酸甘油酯:丙二醇(90:10体积比)、蛋黄卵磷脂、大豆卵磷脂、二油酰基卵磷脂、二月桂酰基卵磷脂、二肉豆蔻酰基卵磷脂、二棕榈酰基卵磷脂、二硬脂酰基卵磷脂、脑磷脂、肌酐、肌醇磷脂、溶血磷脂、磷脂酸、磷脂酰甘油、硬脂酰/棕榈酰/油酰磷脂酰胆碱、硬脂酰/棕榈酰/油酰磷脂酰乙醇胺、磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰乙醇胺、磷脂酰甘油和磷脂酰肌醇、二硬脂酰磷脂酰乙醇胺、油酰磷脂酰胆碱、己酸、辛酸、油酸、维生素e、硬脂酸、月桂酸异丙酯、棕榈酸异丙酯、肉豆蔻酸异丙酯、丙二醇单月桂酸酯、丙二醇单辛酸酯、油酸山梨醇酯、月硅酸乙酯、肉豆蔻酸乙酯、油酸乙酯(部分实施例缩写为eo)、亚油酸乙酯中的一种或至少两种。进一步地,所述油相选自葵花油(如精制葵花油)、大豆油、油酸、蓖麻油、单亚油酸甘油酯、油酰聚氧乙烯甘油酯、单油酸甘油酯、中链甘油三酯(mct)、辛酸、油酸乙酯、肉豆蔻酸异丙酯、丙二醇单月桂酸酯、油酸乙酯中的一种或至少两种。其中进一步地,所述油相选自单亚油酸甘油酯、单油酸甘油酯、油酰聚氧乙烯甘油酯、单油酸甘油酯和油酰聚氧乙烯甘油酯的混合油相(二者质量比为1~2:1)、油酸乙酯、肉豆蔻酸异丙酯、辛酸、油酸和中链甘油三酯的混合油相(二者的质量比为1~9:1~9,进一步地为8:2或6:4)、单油酸甘油酯和辛酸的混合油相(二者的质量比为1~9:1~9,进一步地为4:1)、油酸和单亚油酸甘油酯(二者的质量比为1~9:1~9,进一步地为1:4)、油酸乙酯和单亚油酸甘油酯(二者的质量比为1~9:1~9,进一步地为1:3)、肉豆蔻酸异丙酯和单亚油酸甘油酯(二者的质量比为1~9:1~9,进一步地为1:1)中的一种或至少两种。进一步地,所述的表面活性剂选自非离子型、阴离子型、阳离子型和两性离子表面活性剂。进一步地,所述表面活性剂选自蛋黄卵磷脂、大豆卵磷脂、二油酰基卵磷脂、二月桂酰基卵磷脂、二肉豆蔻酰基卵磷脂、二棕榈酰基卵磷脂、二硬脂酰基卵磷脂、脑磷脂、肌酐、肌醇磷脂、溶血磷脂、磷脂酸、磷脂酰甘油、硬脂酰/棕榈酰/油酰磷脂酰胆碱、硬脂酰/棕榈酰/油酰磷脂酰乙醇胺、磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰乙醇胺、磷脂酰甘油和磷脂酰肌醇、二硬脂酰磷脂酰乙醇胺、油酰磷脂酰胆碱、二肉豆蔻酰基磷脂酰乙醇胺、二棕榈酰基磷脂酰乙醇胺、二硬脂酰基磷脂酰乙醇胺、二肉豆蔻酰基磷脂酰丝氨酸、乙酰化单甘油酯、脱水山梨糖醇脂肪酸酯、杏仁油酸聚乙二醇甘油酯、椰子油c8/c10聚乙二醇甘油酯、聚氧乙烯十二羟硬脂酸酯、聚乙二醇100维生素e琥珀酸酯、聚氧乙烯-聚氧丙烯共聚物、聚氧乙烯蓖麻油(cremophorel35)、聚氧乙烯氢化蓖麻油(cremophorrh40)、聚氧乙烯聚氧丙烯共聚物(例如泊洛沙姆188和407)、聚氧乙烯甘油酯、聚氧乙烯山梨醇酐三油酸脂、聚氧乙烯甘油三油酸脂、聚氧乙烯脱水山梨糖醇脂肪酸酯、琥珀辛酯钠、琥珀辛酯钙、琥珀辛酯钾、十二烷基硫酸钠、月桂基硫酸钠、二棕榈酰磷脂酸、乙氧基化蓖麻油、甘露醇油酸脂聚氧乙烯醚、聚乙二醇甘油酯类、油酰聚氧乙烯甘油酯、聚乙二醇脂肪酸酯、聚乙二醇脂肪酸酯、聚乙二醇-15羟基硬脂酸酯(solutol)、聚乙二醇-8-甘油辛酸/癸酸酯、月桂酸聚乙二醇-32甘油酯、月桂酰聚乙二醇-32甘油酯、辛癸酸聚乙二醇甘油酯、山梨醇酐倍半油酸脂、聚山梨酯(如聚山梨酯20、聚山梨酯80)、水溶性天然维生素e、司盘80、吐温80、聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(soluplus)、辛酸、辛酸钠、胆汁酸及其盐、熊果脱氧胆酸、胆酸钠、脱氧胆酸钠、牛磺胆酸钠、甘胆酸钠、n-十六烷基-n,n-二甲基-3-氨(ammonio)-1-丙烷磺酸盐、棕榈酰溶血磷脂酰-l-丝氨酸、溶血磷脂(例如,乙醇胺、胆碱、丝氨酸或苏氨酸的1-酰基-sn-甘油-3-磷酸酯)、n-烷基-n,n-二甲基氨-1-丙烷磺酸盐、3-胆酰胺-1-丙基二甲基氨-1-丙烷磺酸盐、十二烷基磷酸胆碱、肉豆蔻酰溶血磷脂酰胆碱、鸡蛋溶血卵磷脂、丙二醇单月桂酸酯、十六烷基-三甲基铵溴化物、十六烷基吡啶氯化物、聚环氧乙烷/聚环氧丙烷嵌段共聚物(pluronics/tetronics、曲通x-100、十二烷基β-d-吡喃葡糖苷)、牛磺二氢梭链孢酸钠、油酸、酰基肉毒碱、赖氨酸、精氨酸、组氨酸、赖氨酸中的一种或至少两种。进一步地,所述的表面活性剂选自聚氧乙烯蓖麻油(cremophorel35,el35)、聚氧乙烯氢化蓖麻油(cremophorrh40)、月桂酰聚乙二醇-32甘油酯、辛癸酸聚乙二醇甘油酯(labrasol)、油酰聚氧乙烯甘油酯、聚乙二醇甘油酯、聚山梨酯(如聚山梨酯20、聚山梨酯80)、丙二醇单月桂酸酯中的一种或至少两种。进一步地,所述的表面活性剂选自聚氧乙烯氢化蓖麻油(cremophorrh40)、油酰聚氧乙烯甘油酯、聚氧乙烯蓖麻油、月桂酸聚乙二醇-32甘油酯、辛癸酸聚乙二醇甘油酯、聚氧乙烯氢化蓖麻油(cremophorrh40)和油酰聚氧乙烯甘油酯的混合表面活性剂(二者的质量比为1~9:1,进一步地为4~5:1)、辛癸酸聚乙二醇甘油酯和聚氧乙烯氢化蓖麻油的混合表面活性剂(二者的质量比为1~9:1,进一步地为2~3:1)、聚山梨酯80和rh40的混合表面活性剂(3:1)中的一种或至少两种。进一步地,所述的助表面活性剂选自中/短链醇、醚中的一种或多种。进一步地,所述助表面活性剂选自乙醇、丙二醇、异丙醇、正丁醇、聚乙二醇(分子量范围为100da-10kda,300da-2000da,或400da-1000da)如聚乙二醇200~600(如:peg400、聚乙二醇600)、聚乙二醇维生素e琥珀酸酯、碳酸丙二酯、碳酸亚丙酯、四氢糠醇、乙二醇糠醇、甘油糠醛、二甲基异山梨酯、二甲基乙酰胺、n-甲基吡咯烷酮、二乙二醇单乙基醚(transcutol或transcutolp或transcutolhp或tp)、乙二醇单乙基醚、二十二碳六烯酸、胆固醇、氮酮、甘油、乙酸乙酯、聚氧化乙烯、辛癸酸聚乙二醇甘油酯、丙烯碳酸酯、丙烯碳酸酯、单硬脂酸甘油酯、双硬脂酸甘油酯、聚甘油-6-二油酸脂中的一种或至少两种。进一步地,所述的助表面活性剂选自:乙醇、丙二醇、异丙醇、二乙二醇单乙基醚、聚乙二醇400、甘油、聚乙二醇600中的一种或至少两种。进一步地,所述助表面活性剂选自丙二醇、甘油、聚乙醇400、二乙二醇单乙基醚中的一种或至少两种。进一步地,所述自微乳组合物分散到水性介质中形成的微乳的粒径小于500nm。进一步地,所述自微乳组合物分散到水性介质中形成的微乳的粒径小于300nm。进一步地,所述自微乳组合物分散到水性介质中形成的微乳的粒径小于200nm。进一步地,所述自微乳组合物分散到水性介质中形成的微乳的粒径小于100nm。进一步地,所述自微乳组合物分散到水性介质中形成的微乳的粒径小于50nm。进一步地,所述自微乳组合物分散到水性介质中形成的微乳的粒径小于30nm。进一步地,所述自微乳组合物分散到水性介质中形成的微乳的粒径小于500nm、450nm、400nm、350nm、300nm、250nm、200nm、150nm、100nm、90nm、80nm、60nm、55nm、53nm、52nm、51.5nm、51nm、50.5nm、50nm、49.5nm、49nm、48nm、47nm、46nm、45nm、43nm、42nm、40nm、35nm、30nm、25nm、20nm、15nm、10nm或甚至更小。进一步地,所述自微乳组合物分散到水性介质中形成的微乳的粒径为5~500nm或5~400nm或5~300nm或5~200nm或5~100nm或5~60nm或5~30nm。本发明的制剂通过将各组分物料进行混合溶解制备得到,混合溶解的方式可以有多种,例如:微射流、搅拌、震荡等,目的在于利于提高自微乳组合物的稳定性和降低自微乳在水介质中分散的纳米乳的粒径。进一步地,所述他克莫司的活性成分可包括他克莫司的晶体或无定型、盐、无水合物或水合物、溶剂化物、前药、代谢产物等,所有形式都可以用于本发明制剂。进一步地,所述他克莫司的自微乳组合物,由以下组分组成:他克莫司、油相、表面活性剂、助表面活性剂、有机酸和抗氧化剂;所述自微乳组合物中他克莫司、油相、表面活性剂、助表面活性剂、有机酸和抗氧化剂的质量比为1:10~50:50~150:50~100:1~5:1~5。进一步地,所述抗氧化剂选自维生素e。进一步地,所述有机酸选自柠檬酸。通过有机酸和抗氧化剂的加入,使得自微乳组合物的稳定性明显增强,长时间稳定不形成任何沉淀,乳化时间短以快速溶出他克莫司。进一步地,所述油相选自:油酰聚氧乙烯甘油酯、单油酸甘油酯中的一种或两种。其中进一步地,所述油相选自单油酸甘油酯和油酰聚氧乙烯甘油酯的混合油相(二者质量比为1~5:1)、单油酸甘油酯中的一种。进一步地,所述表面活性剂选自聚氧乙烯氢化蓖麻油(cremophorrh40)、油酰聚氧乙烯甘油酯中的一种或两种。进一步地,所述的表面活性剂选自聚氧乙烯氢化蓖麻油(cremophorrh40)、聚氧乙烯氢化蓖麻油(cremophorrh40)和油酰聚氧乙烯甘油酯的混合表面活性剂(二者的质量比为1~9:1,进一步地为4~5:1)中的一种或至少两种。在本发明的实施例中,油酰聚氧乙烯甘油酯既可作为油相,又能作为表面活性剂。通过采用混合的油相和混合的乳化剂,使得本发明制备的自微乳组合物乳化的纳米乳颗粒在500nm以下,甚至小于100nm,基本可稳定在30nm附近,大大提高了自微乳组合物的溶出度,提高了生物利用度。通过采用混合的油相和混合的乳化剂、添加有机酸和抗氧化剂,有效延长他克莫司的保质期,降低他克莫司的不良反应同时降低不同个体药物吸收差异。进一步地,所述的助表面活性剂选自丙二醇、peg600或二乙二醇单乙基醚。本发明实施例采用的助乳化剂,能够加快自微乳组合物的乳化,提升溶出速率且不易降解后续制成的胶囊剂外衣。进一步地,所述自微乳组合物分散到水性介质中形成的微乳的粒径小于50nm。进一步地,所述自微乳组合物分散到水性介质中形成的微乳的粒径小于30nm。进一步地,所述自微乳组合物分散到水性介质中形成的微乳的粒径小于30nm、25nm、20nm、15nm、10nm或甚至更小。进一步地,所述自微乳组合物分散到水性介质中形成的微乳的粒径为5~60nm或5~30nm。一方面,本发明提供一种剂型,将所得自微乳组合物灌装入软或硬胶囊中,也可以加入吸收剂制成固体自乳化片剂、丸剂、散剂、颗粒剂等。进一步地,所述自微乳组合物为胶囊剂,包括自微乳组合物和胶囊壳,其中,所述自微乳组合物如本发明所述;所述胶囊壳由硬胶囊或软胶囊材料制得。所述胶囊壳均为本领熟知的硬胶囊和/或软胶囊材料,如明胶硬胶囊或明胶软胶囊,均可以通过商业途径购得或制备,在此不做特殊限定。本发明采用自微乳化技术将其制成自微乳化软胶囊,口服后可迅速形成微乳,大大地提高了药物的溶出度和胃肠道粘膜的通透性,从而提高药物的生物利用度,降低不良反应。另一方面,本发明提供一种他克莫司自微乳组合物的制备方法,具体过程如下:步骤一:将有机酸溶于助表面活性剂中,形成混合物一;步骤二:将抗氧化剂溶于油相中,形成混合物二;步骤三:将他克莫司溶于混合物一中,形成混合物三;步骤四:将表面活性剂加入混合物三中,形成混合物四;步骤五:将混合物二溶于混合物四,形成均一透明的自微乳组合物。本发明制备过程中形成的混合物一、混合物三和混合物四,采取逐一混合均匀的方式,避免出现浑浊现象进而导致部分物质未溶解,可快速实现分散均匀;再将混合物二分散于混合物四中,可实现均一透明的自微乳组合物的制备;运用本发明的制备方法,可减少乳化时间,提高药物的溶出率和溶解读,提高药物的生物利用度。进一步地,所述混合物一形成的具体步骤如下:将有机酸溶于助表面活性剂中37℃且在避光条件下进行超声混合,辅以100~400rpm的速度进行机械搅拌。进一步地,所述混合物二形成的具体步骤如下:将抗氧化剂溶于油相中37℃且在避光条件下进行超声混合,辅以100~400rpm的速度进行机械搅拌。进一步地,所述混合物三形成的具体步骤如下:将他克莫司溶于混合物一中37℃且在避光条件下进行超声混合,辅以100~400rpm的速度进行机械搅拌。进一步地,所述混合物四形成的具体步骤如下:将表面活性剂加入混合物三中37℃且在避光条件下进行超声混合,辅以100~400rpm的速度进行机械搅拌。进一步地,所述均一透明的自微乳组合物形成的具体步骤如下:将混合物二溶于混合物四37℃且在避光条件下进行超声混合,辅以100~400rpm的速度进行机械搅拌。本发明制备的自微乳组合物经口服进入胃肠道后,遇胃肠液能够自微乳化成o/w纳米乳,通过将药物分子包裹在载体内,所形成的o/w型纳米乳小于500nm甚至小于100nm,保持在30nm左右,可使药物快速分布于整个胃肠道中,使得药物更容易和小肠上皮细胞直接接触,通过胞饮或胞吞等作用能够促进药物经小肠粘膜上皮细胞吸收,使得药物的溶出过程不再成为体内吸收的限速步骤,显著提高了他克莫司在胃肠液中的溶解度和溶出速率,增加药物口服吸收率和生物利用度,提高了渗透率,降低胃肠道反应,降低不良反应;自微乳组合物经乳化后形成纳米乳,促进药物的跨膜吸收,同时他克莫司被空白微乳载体包裹,实现药物的缓释,药物释放速度平稳,可防止血药浓度起伏过大,提高了药物的疗效同时,降低不良反应。将他克莫司制成自微乳组合物,口服给药后与胃肠道液体接触,立即自乳化为纳米乳,纳米级的粒径能够增加总表面积进而增强药物的溶出度,从而促进药物的分散、溶解、稳定性吸收,从而提高个体的生物利用度。同时可以使药物平稳缓慢的释放,避免服药后血药浓度过高而引起严重的消化系统不良反应,也可避免溶出度不合格带来的影响,显著降低不良反应,提高疗效。显著提高了生物利用度,可减少每日施用的剂量单位的数量,并减轻或排除对服药同时进食的要求,为受者提供更多自由,可以显著提高患者的接受度和/或顺从度。附图说明图1在水中他克莫司自微乳组合物和参比制剂的溶出度的对比图图2在磷酸盐缓冲液(ph6.8)中他克莫司自微乳组合物和参比制剂的溶出度的对比图图3本发明实施例1和参比制剂普乐可复(固体分散体)的药代动力学对比图。具体实施方式下面结合具体实施例,进一步阐述本发明。这些实施例仅用于说明本发明而不用于限制本发明的范围。试验一:自乳化制剂的制备过程如下:步骤一:将有机酸溶于助表面活性剂中37℃且在避光条件下进行超声混合,辅以100~400rpm的速度进行机械搅拌,形成混合物一;步骤二:将抗氧化剂溶于油相中37℃且在避光条件下进行超声混合,辅以100~400rpm的速度进行机械搅拌,形成混合物二;步骤三:将他克莫司溶于混合物一中37℃且在避光条件下进行超声混合,辅以100~400rpm的速度进行机械搅拌,形成混合物三;步骤四:将表面活性剂加入混合物三中37℃且在避光条件下进行超声混合,辅以100~400rpm的速度进行机械搅拌,形成混合物四;步骤五:将混合物二溶于混合物四37℃且在避光条件下进行超声混合,辅以100~400rpm的速度进行机械搅拌,形成均一透明的自微乳组合物,搅拌均匀充分溶解后填充于软胶囊中。试验二:微乳大小的测定对实施例所制备的他克莫司制剂的粒径进行测试。将制备的他克莫司自微乳制剂用ph6.8的水介质稀释100倍后,用纳米粒度仪进行测定。每一个样品进行至少三次测试,以确保结果的准确性。实施例1处方如下:他克莫司:1mg;smedds载体总质量为200mg:23.4mg单油酸甘油酯,20mg油酰聚氧乙烯甘油酯,90mgrh40,66.6mg二乙二醇单乙基醚;有机酸:2mg枸橼酸抗氧化剂:1mg维生素e。制备过程参照试验一,粒径测试参照试验二。所得他克莫司制剂的纳米乳的粒径为20.54nm。实施例2处方如下:他克莫司:1mg;smedds载体总质量为200mg:10mg单油酸甘油酯,50mg油酰聚氧乙烯甘油酯,90mgrh40,50mg二乙二醇单乙基醚;有机酸:5mg枸橼酸抗氧化剂:5mg维生素e。制备过程参照试验一,粒径测试参照试验二。所得他克莫司制剂的纳米乳的粒径为25.82nm。实施例3处方如下:他克莫司:1mg;smedds载体总质量为200mg:10mg单油酸甘油酯,40mg油酰聚氧乙烯甘油酯,50mgrh40,100mg二乙二醇单乙基醚;有机酸:1mg枸橼酸抗氧化剂:3mg维生素e。制备过程参照试验一,粒径测试参照试验二。所得他克莫司制剂的纳米乳的粒径为20.14nm。实施例4处方如下:他克莫司:1mg;smedds载体总质量为200mg:40mg单油酸甘油酯,10mg油酰聚氧乙烯甘油酯,90mgrh40,60mg二乙二醇单乙基醚;有机酸:4mg枸橼酸抗氧化剂:3mg维生素e。制备过程参照试验一,粒径测试参照试验二。所得他克莫司制剂的纳米乳的粒径为28.82nm。实施例5处方如下:他克莫司:1mg;smedds载体总质量为200mg:15mg单油酸甘油酯,10mg油酰聚氧乙烯甘油酯,150mgrh40,25mg二乙二醇单乙基醚;有机酸:2mg枸橼酸抗氧化剂:1mg维生素e。制备过程参照试验一,粒径测试参照试验二。所得他克莫司制剂的纳米乳的粒径为21.02nm。实施例6处方如下:他克莫司:1mg;smedds载体总质量为200mg:11.7mg单油酸甘油酯,15mg油酰聚氧乙烯甘油酯,104mgrh40,69.3mg二乙二醇单乙基醚;有机酸:3mg枸橼酸抗氧化剂:2mg维生素e。制备过程参照试验一,粒径测试参照试验二。所得他克莫司制剂的纳米乳的粒径为23.29nm。实施例7处方如下:他克莫司:1mg;smedds载体总质量为200mg:23.4mg单油酸甘油酯,20mg油酰聚氧乙烯甘油酯,90mgrh40,66.6mg丙二醇;有机酸:2mg枸橼酸抗氧化剂:1mg维生素e。制备过程参照试验一,粒径测试参照试验二。所得他克莫司制剂的纳米乳的粒径为35.49nm。实施例8处方如下:他克莫司:1mg;smedds载体总质量为200mg:30mg单油酸甘油酯,20mg油酰聚氧乙烯甘油酯,130mgrh40,20mg丙二醇;有机酸:2mg枸橼酸抗氧化剂:1mg维生素e。制备过程参照试验一,粒径测试参照试验二。所得他克莫司制剂的纳米乳的粒径为33.96nm。实施例9处方如下:他克莫司:1mg;smedds载体总质量为200mg:30mg单油酸甘油酯,20mg油酰聚氧乙烯甘油酯,130mgrh40,20mgpeg600;有机酸:2mg枸橼酸抗氧化剂:1mg维生素e。制备过程参照试验一,粒径测试参照试验二。所得他克莫司制剂的纳米乳的粒径为34.12nm。实施例10处方如下:他克莫司:1mg;smedds载体总质量为200mg:40mg单油酸甘油酯,130mgrh40,30mgpeg400;有机酸:2mg枸橼酸抗氧化剂:1mg维生素e。制备过程参照试验一,粒径测试参照试验二。所得他克莫司制剂的纳米乳的粒径为142.23nm。实施例11处方如下:他克莫司:1mg;smedds载体总质量为200mg:30mg单油酸甘油酯,150mgrh40,20mg二乙二醇单乙基醚;有机酸:2mg枸橼酸抗氧化剂:1mg维生素e。制备过程参照试验一,粒径测试参照试验二。所得他克莫司制剂的纳米乳的粒径为303.92nm。实施例12处方如下:他克莫司:1mg;smedds载体总质量为200mg:30mg单油酸甘油酯,150mgrh40,20mgpeg600;有机酸:2mg枸橼酸抗氧化剂:1mg维生素e。制备过程参照试验一,粒径测试参照试验二。所得他克莫司制剂的纳米乳的粒径为323.53nm。试验例1分散性和溶解性的测定将实施例所提供的他克莫司自微乳组合物和市售参比制剂普罗可复固体分散体胶囊分散于250ml水性介质中测定药物的分散性和溶解性,并观察是否有药物析出。水性介质包括水和磷酸盐缓冲液(ph6.8)。研究方法:美国药典方法ii(浆法)。溶出仪器:tdt-08l,水性介质:250ml,转速50rpm,温度37℃。具体方法:将1g本发明实施例制备的他克莫司自微乳组合物和市售参比制剂普罗可复固体分散体胶囊分别置于溶出杯中分散,分别于10,20,30,60min取样2ml,样品用0.45微米的聚丙烯过滤器过滤并稀释后进行hplc分析。结果如下表:表1在水中他克莫司自微乳组合物和参比制剂的溶出度(%)表2在磷酸盐缓冲液(ph6.8)中他克莫司自微乳组合物和参比制剂的溶出度(%)取样点/min参比制剂实施例1实施例3实施例91055.760.464.11022.890.793.997.12056.71001001003079.51001001006096.7100100100从表1、表2、图1、图2中可知,本发明实施例分别分散于水(ph7.0)或磷酸盐缓冲液(ph6.8)中,在10min基本溶出完全,而上市的他克莫司参比制剂要在60min才能基本完全溶出;本发明的他克莫司自微乳组合物的药物分散性和溶解性良好,在0.5~2min内乳化完全,形成透明略泛蓝光的o/w型微乳,37℃下24h未见药物析出,有利于提高他克莫司的口服生物利用度,减小个体差异。试验例2稳定性测试本试验例提供实施例所提供的他克莫司软胶囊的稳定性测试。将他克莫司软胶囊装入聚乙烯塑料瓶后,分别在冷藏2-8℃、常温25℃±2℃、避光(25℃±2℃)、高温(60℃)和光照(4500lx,温度25℃光照)的条件下放样5天、10天、30天、2个月,将药物组合物用ph6.8的水介质稀释100倍后,取上清液测试他克莫司的含量,结果见表3。可见,本发明制备的他克莫司的软胶囊稳定性好。试验例3本试验例提供本发明实施例1和参比制剂普乐可复(固体分散体)的药代动力学测试。测试方法及对象:健康大鼠16只,随机分成2组,每组8只,分别进行2个周期试验,周期间洗脱期7天,大鼠在年龄、性别、体重、体表面积等方面无统计学差异(p>0.05)。试验设计为空腹试验。空腹试验:试验前禁食10小时,空腹给药(给药在30分钟内完成),按10mg/kg的标准进行给药。参比制剂为普乐可复,单粒中含有他克莫司1mg;试验胶囊为本发明实施例1所提供的他克莫司软胶囊,单粒中含有他克莫司1mg。采样设计:给药后30min、1h、1.5h、2h、3h、4h、6h、8h、12h、24h采集血样2ml,离心分离血浆,采用hplc/ms/ms测得血浆中他克莫司的具体血药浓度。结果显示,发现本实施例1制备的他克莫司软胶囊与参比制剂普乐可复的达峰时间均值分别在1.5小时和2小时,峰值浓度均值分别为86ng/ml和22ng/ml,与参比制剂相比,本发明实施例1制备的他克莫司软胶囊的生物利用度是参比制剂的4倍左右,生物利用度明显得到提高。以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页1 2 3
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



