一种基于CRISPR的细胞核靶向药物递送系统的制作方法
 2021-01-08 11:01:57|
2021-01-08 11:01:57| 404|
404| 起点商标网
起点商标网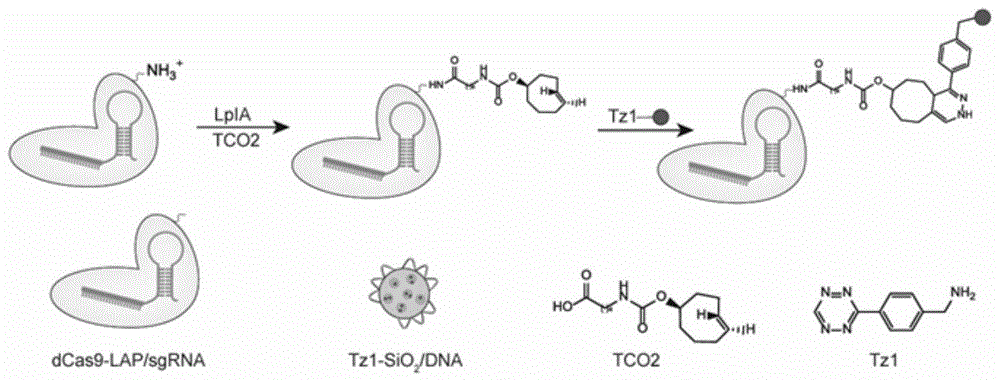
本发明涉及生物医药技术领域,具体涉及一种基于crispr的细胞核靶向药物递送系统。
背景技术:
近年来,各种生物相容性纳米载体广泛用于细胞内靶向药物递送,以改善治疗效果并降低药物毒性。这些纳米载体大多用于在细胞质中进行特异性定位,而不是用于细胞核中。事实上,遗传信息和转录机制存在于细胞核中,细胞核是纳米药物递送系统的最终目的地。由于生物屏障的存在,游离的抗癌药物在进入肿瘤细胞的细胞核的过程中容易失去活性。因此,开发细胞核靶向纳米载体以提高抗癌药物的效率具有重要意义。
crispr(成簇的规律间隔的短回文重复序列)系统是一种强大且通用的生物学工具,可用于细胞基因编辑和动态成像。crispr系统以cas9蛋白识别靶dna序列,其特异性由小向导rna(sgrna)和前间区序列邻近基序(pam)确定。对于真核细胞中的基因编辑,crispr系统已经实现了dna识别可编程且靶向的基因切割。在用于基因编辑的同时,crispr系统也已应用于内源基因组元件的可视化。使用荧光标记的核酸内切酶缺陷型cas9蛋白和结构优化的sgrna,可以很好地对活细胞中的染色体的构象和动力学进行成像。在上述两种应用之外,本发明人试图将crispr系统用作细胞核靶向药物递送平台,以用于高效率的肿瘤治疗。
技术实现要素:
本发明的目的是提供一种新的基于crispr的细胞核靶向药物递送系统,可以高靶向性、高效率地向肿瘤部位进行药物递送,并且避免药物在递送过程中失去活性或者过早释放。
因此,本发明提供一种基于crispr的细胞核靶向药物递送系统,其包括药物载运部分、crispr靶向部分、连接酶核苷酸序列和第一连接分子,
其中,该药物载运部分包括药物活性剂、纳米载体粒子、第二连接分子和包裹dna,该药物活性剂荷载在该纳米载体粒子上,该第二连接分子与该纳米载体粒子连接,该包裹dna包裹该药物活性剂,该包裹dna包含寡核苷酸序列,该寡核苷酸序列在端粒酶存在下延伸以使该包裹dna形成发夹状结构;该crispr靶向部分包括核酸酶缺陷型cas9核苷酸序列(dcas9)、连接酶受体肽核苷酸序列和靶向端粒重复序列的小向导rna(即端粒sgrna)核苷酸序列;
其中,当将该药物载运部分、该crispr靶向部分、该连接酶核苷酸序列和该第一连接分子导入细胞内时,该crispr靶向部分表达dcas9蛋白、连接酶受体肽和端粒sgrna,该dcas9蛋白和该连接酶受体肽形成融合蛋白,该端粒sgrna与该融合蛋白形成dcas9-连接酶受体肽/端粒sgrna复合物;该连接酶核苷酸序列表达连接酶,该连接酶使该第一连接分子与该dcas9-连接酶受体肽/端粒sgrna复合物连接;该第一连接分子与该第二连接分子发生连接。
在本发明的一个具体实施方案中,该基于crispr的细胞核靶向药物递送系统中,该连接酶为硫辛酸连接酶(lp1a),该连接酶受体肽为硫辛酸连接酶受体肽(lap),该第一连接分子为反式环辛烯(tco2),该第二连接分子为四嗪(tzl)。
也即,本发明提供一种基于crispr的细胞核靶向药物递送系统,其包括药物载运部分、crispr靶向部分、硫辛酸连接酶(lpla)核苷酸序列和tco2,
其中,该药物载运部分包括药物活性剂、纳米载体粒子、tzl和包裹dna,该药物活性剂荷载在该纳米载体粒子上,该tzl与该纳米载体粒子连接,该包裹dna包裹该药物活性剂,该包裹dna包含寡核苷酸序列,该寡核苷酸序列在端粒酶存在下延伸以使该包裹dna形成发夹状结构;该crispr靶向部分包括核酸酶缺陷型cas9核苷酸序列(dcas9)、硫辛酸连接酶受体肽(lap)核苷酸序列和靶向端粒重复序列的小向导rna(即端粒sgrna)核苷酸序列;
其中,当将该药物载运部分、该crispr靶向部分、该连接酶核苷酸序列和该tco2导入细胞内时,该crispr靶向部分表达dcas9蛋白、lap和端粒sgrna,该dcas9蛋白和该lap形成融合蛋白,该端粒sgrna与该融合蛋白形成dcas9-lap/端粒sgrna复合物;该lpla核苷酸序列表达lpla,该lpla使该tco2与该dcas9-lap/端粒sgrna复合物连接;该tco2与该tzl通过diels-alder环加成反应发生连接,从而将该dcas9-lap/端粒sgrna复合物与该药物载运部分偶联。
在本发明的另一个具体实施方案中,该基于crispr的细胞核靶向药物递送系统中,该连接酶为生物素连接酶(bira),该连接酶受体肽为生物素连接酶受体肽(bap),该第一连接分子为生物素(biotin),该第二连接分子为链霉亲和素(sa)。
也即,本发明提供一种基于crispr的细胞核靶向药物递送系统,其包括药物载运部分、crispr靶向部分、生物素连接酶(bira)核苷酸序列和biotin,
其中,该药物载运部分包括药物活性剂、纳米载体粒子、sa和包裹dna,该药物活性剂荷载在该纳米载体粒子上,该sa与该纳米载体粒子连接,该包裹dna包裹该药物活性剂,该包裹dna包含寡核苷酸序列,该寡核苷酸序列在端粒酶存在下延伸以使该包裹dna形成发夹状结构;该crispr靶向部分包括核酸酶缺陷型cas9核苷酸序列(dcas9)、生物素连接酶受体肽(bap)核苷酸序列和靶向端粒重复序列的小向导rna(即端粒sgrna)核苷酸序列;
其中,当将该药物载运部分、该crispr靶向部分、该连接酶核苷酸序列和该biotin导入细胞内时,该crispr靶向部分表达dcas9蛋白、bap和端粒sgrna,该dcas9蛋白和该bap形成融合蛋白,该端粒sgrna与该融合蛋白形成dcas9-bap/端粒sgrna复合物;该bira核苷酸序列表达bira,该bira使该biotin与该dcas9-bap/端粒sgrna复合物连接;该biotin与该sa通过生物偶联反应发生连接,从而将该dcas9-bap/端粒sgrna复合物与该药物载运部分偶联。
在本发明的具体实施方案中,该纳米载体粒子为介孔二氧化硅纳米粒子(msn)。
在本发明的具体实施方案中,该包裹dna包含的寡核苷酸序列为5’-(ccctaa)6aatccgtcgagcagagtt-3’(seqidno:1),该端粒sgrna核苷酸序列为5’-tagggttagggttagggtta-3’(seqidno:2)。
在本发明的具体实施方案中,该药物载运部分可以采用本领域公知的脂质体包封技术进行包封,并以脂质体的形式提供。
在本发明的具体实施方案中,该连接酶核苷酸序列以质粒形式提供。例如,当该连接酶为硫辛酸连接酶(lp1a)时,硫辛酸连接酶核苷酸序列以质粒pcdna3.1-lpla(w37v)提供;当该连接酶为生物素连接酶(bira)时,生物素连接酶核苷酸序列以质粒pcdna3.1-bira提供。
在本发明的具体实施方案中,该crispr靶向部分以质粒的形式提供。例如,当该连接酶受体肽为硫辛酸连接酶受体肽(lap)时,该crispr靶向部分以质粒px335-cas9(δh840a)-lap/端粒sgrna提供;当该连接酶受体肽为生物素连接酶受体肽(bap)时,该crispr靶向部分以质粒px335-cas9(δh840a)-bap/端粒sgrna提供。
该药物活性剂为任何感兴趣的起治疗作用的物质。优选地,该药物活性剂为抗肿瘤剂,例如抗生素类抗肿瘤剂、抗体类抗肿瘤剂等。抗肿瘤剂的一个具体优选的实例为多柔比星。
本发明的基于crispr的细胞核靶向药物递送系统中的药物载运部分以脂质体的形式提供,可以通过脂质体技术导入细胞中;crispr靶向部分和连接酶核苷酸序列以质粒的形式提供,可以通过质粒转染到细胞中;第一连接分子如tco2和biotin为有机小分子,可以穿过细胞膜直接扩散进入细胞中。
端粒酶在肿瘤组织中过表达,但在正常组织中不表达。dcas9-lap/端粒sgrna复合物中的端粒sgrna由于能靶向端粒重复序列,可以将药物载运部分靶向肿瘤组织。药物载运部分的包裹dna在通常情况下保护药物载运部分的药物活性剂免于在细胞内失去活性或者过早释放,而在肿瘤组织中存在端粒酶的情况下,包裹dna可以延伸以形成刚性的发夹状结构,从而脱离纳米载体粒子的表面,使药物活性剂暴露并释放出来,以杀灭肿瘤细胞。
因此,本发明的基于crispr的细胞核靶向药物递送系统可以高靶向性、高效率地向肿瘤部位进行药物递送,并且避免药物在递送过程中失去活性或者过早释放。
附图说明
图1显示dcas9-msn/dox/dna的构造和制备;
图2显示dcas9-msn/dox/dna在被靶向的细胞核中的药物释放的示意图;
图3显示msn/dox/dna的表征:(a)msn/dox/dna的透射电子显微镜(tem)成像,(b)msn/dox/dna的动态光散射(dls)分布,(c)msn-cooh、msn-tz1和msn/dox/dna的zeta电位,(d)msn-cooh、msn-tz1和msn/dox/dna的x射线光电子能谱(xps);
图4显示msn-cooh和msn-tz1的表征:(a)msn-cooh的tem成像,(b)msn-cooh的dls分布,(c)msn-tz1的tem成像,(d)msn-tz1的dls分布;
图5显示在孵育24小时时,msn-cooh和msn-tz1对hela细胞的细胞毒性;
图6显示细胞毒性测定结果:(a)与20μg/ml的msn/dox、msn/dox/dna、dcas9-msn/dox和dcas9-msn/dox/dna孵育不同时间后的hela细胞活力,(b)与不同dox浓度的游离dox、msn/dox、msn/dox/dna、dcas9-msn/dox和dcas9-msn/dox/dna孵育24小时后的hela细胞活力;
图7显示与游离dox、msn/dox、msn/dox/dna、dcas9-msn/dox和dcas9-msn/dox/dna孵育8小时的hela细胞的荧光信号的共聚焦图像,红色荧光来自dox,蓝色荧光来自用于细胞核染色的hoechst33342,比例尺:5μm;
图8显示将hela细胞与dcas9-msn/dox/dna一起孵育8小时后沿z轴获取荧光信号的光学切片,红色荧光来自dox,蓝色荧光来自用于细胞核染色的hoechst33342,比例尺:5μm;
图9显示与dcas9-msn/dox孵育4-8小时的hela细胞的荧光信号的共聚焦图像,红色荧光来自dox,蓝色荧光来自用于细胞核染色的hoechst33342,比例尺:5μm;
图10显示与dcas9-msn/dox/dna孵育4-8小时的hela细胞的荧光信号的共聚焦图像,红色荧光来自dox,蓝色荧光来自用于细胞核染色的hoechst33342,比例尺:5μm;
图11显示与dcas9-msn/dox/dna孵育12-24小时的hela细胞的荧光信号的共聚焦图像,红色荧光来自dox,蓝色荧光来自用于细胞核染色的hoechst33342,比例尺:5μm;
图12显示与dcas9(对照)-msn/dox/dna孵育4-8小时的hela细胞的荧光信号的共聚焦图像,红色荧光来自dox,蓝色荧光来自用于细胞核染色的hoechst33342,比例尺:5μm;
图13显示与dcas9(对照)-msn/dox/dna孵育12-24小时的hela细胞的荧光信号的共聚焦图像,红色荧光来自dox,蓝色荧光来自用于细胞核染色的hoechst33342,比例尺:5μm;
图14显示与dcas9-msn/dox/dna孵育4-8小时的hl7702细胞的荧光信号的共聚焦图像,红色荧光来自dox,蓝色荧光来自用于细胞核染色的hoechst33342,比例尺:5μm;
图15显示与dcas9-msn/dox/dna孵育12-24小时的hl7702细胞的荧光信号的共聚焦图像,红色荧光来自dox,蓝色荧光来自用于细胞核染色的hoechst33342,比例尺:5μm。
说明:图7-15为灰度图,原图为彩色图,每个图的最左边一列显示红色荧光,hoechst列显示蓝色荧光,merge列显示红色荧光和蓝色荧光,dic列为黑白图像。
具体实施方式
以下结合附图对本发明进行进一步的详细描述。应当理解,这些描述仅出于说明本发明的目的,并不意在以任何方式限制本发明。
除非另外定义,本文使用的所有技术和科学术语与本公开所属领域技术人员通常理解的含义相同。如果有冲突,以本说明书的定义为准。本文中使用的材料、方法和示例仅作说明用途,无意作为限制,除非特别指明。
图1示意性地显示了本发明的基于crispr的细胞核靶向药物递送系统,其中tzl-sio2/dna代表药物载运部分,其中圆圈表示sio2载体,圆圈中的小圆点代表sio2载体负载的药物活性剂,圆圈表面上的弧线代表包裹dna,该包裹dna包裹该药物活性剂,为简化表示,其中未显示四嗪分子(tzl)的连接,但事实上四嗪分子作为连接分子与sio2载体连接。dcas9-lap/端粒sgrna表示crispr靶向部分,其包括核酸酶缺陷型cas9核苷酸序列(dcas9)、lap核苷酸序列和靶向端粒重复序列的小向导rna(端粒sgrna)核苷酸序列。dcas9-lap/端粒sgrna在硫辛酸连接酶(lpla)的作用下,与反式环辛烯(tco2)反应连接,然后反式环辛烯(tco2)与tzl-sio2/dna上的tzl发生diels-alder环加成反应,从而使tzl-sio2/dna部分与dcas9-lap/端粒sgrna部分偶联。端粒酶在肿瘤细胞中过表达,但在正常组织中不表达。靶向端粒重复序列的端粒sgrna将tzl-sio2/dna部分导向肿瘤细胞的细胞核中。
图2示意性地显示了包含药物活性剂的tzl-sio2/dna部分在端粒酶作用下药物活性剂的释放。简单地讲,tzl-sio2/dna部分中的包裹dna包裹药物活性剂,该包裹dna的寡核苷酸序列在端粒酶存在下延伸以使包裹dna形成发夹状结构,从而从tzl-sio2/dna部脱离下来,以便药物活性剂暴露并释放出来,杀灭肿瘤细胞。由此,本发明的基于crispr的细胞核靶向药物递送系统实现对肿瘤细胞的靶向药物递送和靶向治疗,治疗效率大大提高。
以下通过非限制性实施例对本发明作进一步的说明。以下实施例中用到的试剂可市售获得,除非另有说明。
为构建px335-cas9(δh840a)-lap/端粒sgrna质粒,将用于precrrna的dna区段克隆到px335载体(addgene)中以产生crispr-dcas9构建体,并且将编码具有起失活作用的d10a和h840a突变的dcas9基因的dna序列与lap融合。端粒sgrna序列为5'-tagggttagggttagggtta-3’(seqidno:2),对照sgrna序列为5'-cctcgttcaccgccgtcgcg-3’。质粒pcdna3.1-lpla(w37v)可以市售获得,例如可以从addgene购买。
实施例中使用的hela细胞和hl7702细胞购自美国典型培养物保藏中心(atcc)。hela细胞在含有10%热失活的fbs(gibco)的dmem培养基(gibco)中培养,hl7702细胞在含有10%fbs的rpmi-1640培养基(gibco)中培养。根据制造商的方案,使用transineltransfectionreagent(transgenebiotech)将质粒转染到hela细胞或hl7702细胞中。
实施例1:msn-cooh、msn-tz1和msn/dox/dna的制备与表征
1.msn-cooh、msn-tz1和msn/dox/dna的制备
msn指代介孔二氧化硅纳米粒子,tz1指代四嗪,dox指代多柔比星,为抗肿瘤剂的典型例子。
在强烈搅拌下,将十六烷基三甲基氯化铵(ctac,0.5g)和三乙醇胺(tea,69μl)在95℃下溶于水(20ml)中。1小时后,滴加原硅酸四乙酯(teos,1.5ml)并将混合物再搅拌1小时。然后,加入3-氨基丙基三乙氧基硅烷(aptes,50μl),并将混合物搅拌2小时。离心提取产物并用丙酮、乙醇和nh4no3洗涤数次以除去模板ctac,得到氨基修饰的msn(msn-nh2)。将琥珀酸酐(0.07g)和msn-nh2(45mg)溶解在乙醇(3ml)中,并将混合物搅拌24小时。离心收集产物并用乙醇洗涤数次以除去残余的反应物,得到羧基官能化的msn(msn-cooh)。
将1.45ml的edc·hcl/mes-t溶液(2mg/ml,ph=5.0)和1.45ml的nhs/mes-t溶液(1.15mg/ml,ph=5.0)加入10mg/15mlmsn-cooh溶液中,并将混合物搅拌30分钟。然后,在超声下将tz1/乙醇溶液(1mg/ml,sigma)加入混合物中2分钟,将溶液密封并在黑暗中搅拌过夜。离心收集产物,用乙醇洗涤,得到四嗪修饰的msn(msn-tz1)。
将msn-tz1(10mg)与2ml的dox溶液(2mg/ml)混合,在黑暗条件下搅拌24小时后,离心收集颗粒物,得到荷载了dox的msn-tz1(msn-tz1/dox)。为了评估dox荷载能力,收集上清液并通过uv-vis测量法在480nm波长下测量残余的dox含量。将含有设计的dna序列(5’-(ccctaa)6aatccgtcgagcagagtt-3’(seqidno:1),下划线部分为端粒酶引物序列)的溶液加入msn-tz1/dox溶液中,密封混合物并在黑暗中搅拌4小时,使该dna序列包裹到msn-tz1/dox上以将dox密封在msn上。经离心收集,得到msn/dox/dna。
2.msn-cooh、msn-tz1和msn/dox/dna的表征
通过透射电子显微术(tem)和动态光扫描(dls)表征msn-cooh、msn-tz1和msn/dox/dna的形态和尺寸。如图3(a)所示,msn/dox/dna分散良好并呈球形,平均尺寸约为30nm,类似于msn-cooh和msn-tz1(图4(a)和(c))。由于包裹有dna序列,msn/dox/dna的dls直径为65.97nm(图3(b)),略大于msn-cooh和msn-tz1的dls直径(图4(b)和(d))。
与msn-cooh相比,msn-tz1由于tz1的修饰而具有正zeta电位,而msn/dox/dna在dna结合后显示出明显的负zeta电位(图3(c))。
x射线光电子能谱(xps)表明,与msn-cooh和msn-tz1相比,msn/dox/dna在133ev处具有新峰,其对应于p(2p)(图3d),证明了msn/dox/dna表面的确包裹有dna序列。
实施例2:细胞毒性测定
1.msn-cooh和msn-tz1的细胞毒性测定
为了测定不荷载dox的msn-cooh和msn-tz1的细胞毒性,将hela细胞(美国典型培养物保藏中心,atcc)以每孔105个细胞的密度接种到96孔板中,并在含有10%热失活的fbs(gibco)的dmem培养基(gibco)中,在5%co2、37℃下培养24小时。然后,将msn-cooh和msn-tz1加入培养基中,并将细胞孵育24小时。在孵育结束时,去除培养基,并向每个孔中加入20μl的mts溶液并孵育4小时。使用nanodrop2000在450nm的波长下监测吸光度。细胞毒性以与未处理的对照细胞相比的细胞活力百分比表示。如图5所示,用不同浓度的msn-cooh和msn-tz1处理hela细胞24h,细胞存活率仍高于80%,表明介孔二氧化硅纳米粒子(msn)具有很高的生物安全性。
2.dox、msn/dox、msn/dox/dna、dcas9-msn/dox和dcas9-msn/dox/dna的细胞毒性测定
为了测定dox、msn/dox和msn/dox/dna的细胞毒性,使用transineltransfectionreagent(transgenebiotech)将质粒pcdna3.1-lpla(w37v)和px335-cas9(δh840a)-lap/端粒sgrna共转染hela细胞,没有添加tco2。然后,分别将dox、msn/dox和msn/dox/dna加入培养基中,并将细胞孵育4-24小时。为了测定dcas9-msn/dox和dcas9-msn/dox/dna的细胞毒性,用质粒pcdna3.1-lpla(w37v)转染hela细胞,并培养12小时。然后用质粒px335-cas9(δh840a)-lap/端粒sgrna转染hela细胞,并将tco2加入培养基中。在转染12小时时,分别向培养基中加入msn/dox和msn/dox/dna,并将细胞孵育4-24小时。细胞毒性以与共转染的对照细胞相比的细胞活力百分比表示。
图6中显示了dox、msn/dox、msn/dox/dna、dcas9-msn/dox和dcas9-msn/dox/dna对hela细胞的细胞毒性。msn/dox和msn/dox/dna与crispr-dcas9缀合后都表现出高很多的细胞毒性,表明荷载dox的纳米粒子大量递送到细胞核中。由于包裹dna的存在,dox在短的孵育时间内密封在msn/dox/dna中,导致很少的非特异性扩散和低细胞毒性,特别是对于没有端粒酶表达的正常细胞。随着孵育时间的延长,延伸的dna序列从msn上脱离,dox被靶向释放到细胞核中,大大有助于提高抗癌效率(图6(a))。还考察了用不同dox浓度的游离dox、msn/dox、msn/dox/dna、dcas9-msn/dox和dcas9-msn/dox/dna处理的细胞的活力的对比。随着dox浓度的增加,抗癌活性增强,并且荷载dox的dcas9-msn缀合物的细胞核内定位对细胞毒性产生积极影响(图6(b))。这些结果证明dcas9-msn/dox/dna能够可持续地在细胞核中释放dox,导致高效率的药物抗癌作用。
实施例3:细胞摄取与成像分析
为了研究dox、msn/dox和msn/dox/dna的细胞摄取,将hela细胞置于30mm的以玻璃为底的器皿上,并在培养基中在37℃下在5%co2环境中生长。然后分别用含有dox(5μg/ml)、msn/dox(50μg/ml)和msn/dox/dna(50μg/ml)的新鲜培养基替换hela细胞的上清液,在37℃下孵育8小时。使用ultraviewvox共聚焦显微镜(perkinelmer公司),用60×、1.4na的油浸物镜对样本成像。dox和hoechst33342/dapi分别用488nm和405nm激光激发。dox作为一种典型的抗癌药物,对dna损伤具有药效学作用,并显示出红色荧光。如图7所示,游离dox的红色荧光遍布整个细胞,msn/dox和msn/dox/dna的红色荧光也显示它们仅定位于细胞质。
为了研究dcas9-msn/dox和dcas9-msn/dox/dna的细胞摄取,用质粒pcdna3.1-lpla(w37v)(1μg,从addgene获得)转染hela(作为肿瘤细胞的代表)或hl7702细胞(正常肝细胞,作为正常细胞的代表)。将hela细胞置于30mm的以玻璃为底的器皿上,并在培养基中在37℃下在5%co2环境中培养12小时。然后用质粒px335-cas9(δh840a)-lap/端粒sgrna(2μg)转染细胞,并将tco2(200μm)加入培养基中。转染12小时后,用含有msn/dox(50μg/ml)或msn/dox/dna(50μg/ml)的新鲜培养基替换hela细胞的上清液,并在37℃下孵育8小时。使用ultraviewvox共聚焦显微镜(perkinelmer公司),用60×、1.4na的油浸物镜对样本成像。基于diels-alder环加成,细胞中形成了dcas9-msn/dox和dcas9-msn/dox/dna,并且在细胞核中观察到它们的红色荧光信号,提示它们被定位于细胞核。与msn/dox和dcas9-msn/dox荧光的扩散分布相反,dcas9-msn/dox/dna的荧光集中,表明dox已通过包裹dna被成功密封在msn上。为进一步确认dcas9-msn/dox/dna被定位在细胞核内,通过三维共聚焦显微镜(ultraviewvox)沿z轴获取hela细胞的细胞核的光学切片。如图8所示,z切片图像清楚地表明细胞核中有很多荧光。这些结果表明,msn/dox/dna和dcas9-lap的缀合(dcas9-msn/dox/dna)为药物在活细胞中的细胞核靶向递送和控制释放提供了极好的平台。
实施例4:dox的细胞内和细胞核内释放
为了进一步测定dox的细胞内和细胞核内释放,将dcas9-msn/dox和dcas9-msn/dox/dna转移到hela细胞中以使dox释放可视化。在不同的孵育时间观察dcas9-msn/dox和dcas9-msn/dox/dna的定位。如图9和图10所示,孵育4小时时,细胞核中信号非常弱,随着孵育时间延长,来自dox的荧光逐渐点亮细胞核。在孵育4-8小时时,dcas9-msn/dox中荷载的dox扩散到细胞中,而包裹dna的存在,使荷载的dox仍然被封闭在dcas9-msn/dox/dna纳米体系中,没有向细胞中扩散。
图11中显示在孵育12-24小时期间,dcas9-msn/dox/dna中所封闭的dox释放,从而高度集中的荧光逐渐扩散到整个细胞,尤其是细胞核中,这是由于hela细胞中端粒酶的过度表达所致。hela细胞在本研究中用作测试细胞核内递送系统的模型。包裹dna在端粒酶存在下延伸,在包裹dna的3'端产生的端粒重复序列可与其5'端互补,通过在5'末端和3'末端的互补序列的杂交形成刚性的发夹样dna结构,并脱离msn的表面,从而导致dox的释放。dox的释放受细胞内端粒酶活性的调节,并通过荧光信号的原位跟踪可以进行监测。
端粒酶通过在人染色体末端添加端粒重复序列(ttaggg)n来保护基因组完整性,其具有极低的丰度,每个hela细胞仅约250个拷贝。大多数端粒酶快速扩散通过细胞核,寻找端粒。为了增强抗肿瘤功效,靶向端粒重复序列的crispr-dcas9系统不仅使dcas9-msn/dox/dna能够被转运到细胞核中,而且还促进端粒酶介导的包裹dna脱离以释放药物dox。
用在人类基因组中没有同源靶标的sgrna作为阴性对照。随着孵育时间的延长(4-24h),负载有dox的纳米体系逐渐进入细胞核,由于没有和端粒酶靶向序列结合,其周围的端粒酶浓度较低,使介孔纳米载体仍然被包裹dna密封,dox无法被有效快速释放而扩散进入细胞中(图12和图13)。
将正常肝细胞(hl7702)用作缺乏端粒酶活性的正常模型。hl7702细胞在含有10%fbs的rpmi-1640培养基(gibco)中培养,使用transineltransfectionreagent(transgenebiotech)将质粒pcdna3.1-lpla(w37v)和px335-cas9(δh840a)-lap/端粒sgrna共转染hl7702细胞。dcas9-msn/dox/dna被成功转运到hl7702细胞的细胞核中,由于没有端粒酶的存在,dox被包裹dna密封于介孔纳米颗粒中,几乎没有释放到细胞中(图14和图15)。这些结果表明,通过crispr-dcas9体系靶向肿瘤细胞中的端粒重复序列,对有效调节msn/dox/dna纳米载体中的药物释放是至关重要的。
以上应用了具体实例对本发明进行了阐述,只是用于帮助理解本发明,并不用以限制本发明。本发明所属技术领域的技术人员依据本发明的构思,还可以做出若干简单推演、变形或替换。这些推演、变形或替换方案也落入本发明的权利要求范围内。
sequencelisting
<110>深圳市第二人民医院
<120>一种基于crispr的细胞核靶向药物递送系统
<130>19i28475
<160>2
<170>patentinversion3.3
<210>1
<211>54
<212>dna
<213>人工序列
<400>1
ccctaaccctaaccctaaccctaaccctaaccctaaaatccgtcgagcagagtt54
<210>2
<211>20
<212>dna
<213>人工序列
<400>2
tagggttagggttagggtta20
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 


