SRCAPATPase抑制剂在结直肠癌治疗中的应用的制作方法
 2021-01-08 11:01:45|
2021-01-08 11:01:45| 343|
343| 起点商标网
起点商标网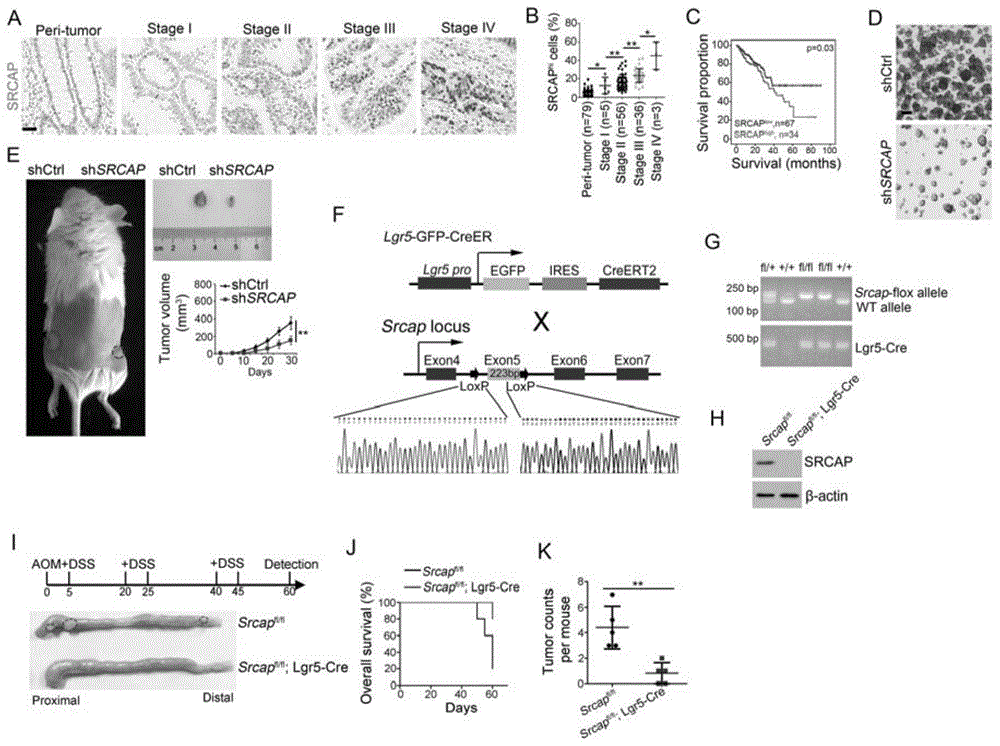
本发明提供了srcapatpase抑制剂抑制结直肠癌干细胞的应用。
背景技术:
肠道上皮细胞覆盖肠道整个表面,在体内发挥营养吸收、黏膜屏障、分泌及免疫调节等诸多重要功能,维持机体的动态平衡。肠上皮由快速增殖的肠隐窝及分化的绒毛构成基本的组织结构,分布有肠道干细胞(intestinestemcell,isc)、潘氏细胞及增殖细胞组成的隐窝,还包括吸收上皮细胞、杯状细胞、内分泌细胞及tuft细胞。生理条件下isc的自我更新与多能性分化维持了肠上皮稳态。病理状态则会导致上皮功能的严重障碍。isc位于肠隐窝底部并与邻近作为微环境的潘氏细胞紧密联系。目前已经知道微环境可提供wnt/β-catenin、notch、bmp、erbb及hedgehog等信号支持isc的自我更新与分化。隐窝底端lgr5+细胞作为活化的isc,活性主要受wnt等信号调控,以维持生理状态下的肠道稳态。
结直肠癌是西方国家常见肿瘤。伴随经济社会发展及生活方式改变,我国每年新发病例和死亡病例均占全世界同期结直肠癌病例的20%。结直肠癌是北京市最为常见消化道恶性肿瘤。10年间发病率由27.42/10万上升至39.93/10万。肿瘤干细胞的存在已经在白血病及乳腺癌、结肠癌等多种实体肿瘤中证实。肿瘤干细胞具有自我更新和多向分化能力,在肿瘤细胞中占比极少,但与肿瘤复发、转移、耐药及治疗失败密切相关。肠癌干细胞起源问题目前仍是领域内争论的焦点,有研究认为正常干细胞突变可导致肠上皮组织结构功能异常和内部环境失稳,从而有发展为结肠癌的潜能。lgr5是g蛋白偶联受体家族蛋白。其既可以作为肠道干细胞标志物参与细胞的分化,也是重要的肠癌干细胞标志物。同时,结肠癌干细胞涉及wnt信号、pi3k/akt信号、受体酪氨酸激酶ras-mapk通路等,这些通路也与正常干细胞的增殖和分化相关。
染色质重塑复合物是一类依赖dna的具有atpase活性的类解螺旋酶蛋白复合体,是表观遗传调控的重要组分。在干细胞自我更新、细胞命运决定及重编程过程中发挥着重要的调节作用。染色质重塑复合物主要包括swi/snf、chd、iswi及ino80等4个蛋白家族。由染色质重塑酶srcap、ruvbl1、yl-1、arp6等11个亚基组成的srcap复合物也属于ino80家族,其染色质重塑活性主要是催化组蛋白变体h2a.z置换经典组蛋白h2a形成核小体,调控基因转录开放。srcap基因突变导致遗传疾病floating-harbor综合征,全长蛋白由hsa、atp酶、cbp结合、sant等结构域组成。srcap所调控的组蛋白变体h2a.z在胚胎干细胞自我更新过程中作用于oct4/mll/prc2调控了干性基因的表达,在成体发育过程中参与调控肌肉细胞分化及造血干细胞分化等关键基因的表达。srcap复合物活性调控对lgr5+肠癌干细胞的作用至今尚未被确定。
amtizole,中文名1,2,4-噻二唑-3,5-二胺,cas#:34283-30-2,英文化学名称:1,2,4-thiadiazole-3,5-diamine,分子式:c2h4n4s。amtizole为已知抗氧化剂和na+/k+atpase抑制剂。该化和物对其他atpase活性的抑制作用,对lgr5+肠癌干细胞自我更新及结直肠癌的调控作用尚没有报道。
技术实现要素:
本发明试图探索lgr5+肠癌干细胞自我更新与srcapatpase活性之间的关系,并试图探索小分子化合物amtizole及其可能的每一种活性修饰产物对结直肠癌的治疗作用,从而为疾病治疗提供更为便利的方法。尽管在理解lgr5+肠癌干细胞自我更新及结直肠癌的机制方面已经取得了巨大进展,但是仍然需要确定特异性通路和作为可药用靶标的活化lgr5+肠癌干细胞自我更新的蛋白质,从而为治疗由其介导的结直肠癌提供新途径。本发明实现了这个和相关需求。
因此,本发明提供以下各项:
1.srcapatpase酶活性或其调控的下游转录因子的抑制剂/拮抗剂在制备用于预防或治疗哺乳动物的结直肠癌疾病的药物/试剂盒中的应用。
2.根据以上1所述的应用,其中所述下游转录因子为pparδ分子。
3.根据以上1或2所述的应用,其中所述抑制剂/拮抗剂为单克隆/多克隆抗体、反义rna或小分子化合物抑制剂。
4.根据以上1-3中任一项所述的应用,其中所述抑制剂/拮抗剂为amtizole或其前体或衍生物,其中所述前体或衍生物保留amtizole的srcapatpase酶活性的抑制剂/拮抗剂活性。
5.根据以上4所述的应用,其中所述amtizole或其前体或衍生物具有以下式(i)的结构,
其中:
式(i)上任选的修饰基团独立地选自:c1-c12烷基(如c1-c6烷基)、c1-c6亚烷基、c2-c12烯基(如c3-c6烯基)、c3-c10环烷基、苯基、取代的苯基、任选取代的五或六元杂芳基、或c6-c10芳烷基、卤素、-oh、-o-ra、c4-c12二烯基、c6-c12三烯基、c8-c12四烯基、c6-c10芳基(任选地被独立地选自c1-c6烷基、卤素、c1-c6烷氧基、或羟基的一、二、或三个取代基取代)、c1-c10烷氧基、羧基、氰基、c1-c10烷酰氧基、c1-c10烷硫基、c1-c10烷基磺酰基、c1-c10烷氧基羰基、c1-c10烷酰氨基、-s-rb、-so2rc、-nhso2rd和-nhco2re;其中ra、rb、rc、rd、和re独立地是被选自c1-c6烷基、c6-c10芳基、c1-c6烷氧基、卤素、和羟基杂芳基的一至三个基团取代的c1-c6烷基、c2-c6烯基、c3-c10环烷基、苯基或萘基,所述羟基杂芳基含有独立地选自硫、氮、和氧的一至五个杂原子。
6.根据以上1-5中任一项所述的应用,其中所述哺乳动物为人、小鼠或家畜,如猫、狗、猪、牛、绵羊、山羊、马和兔。
7.根据以上1-6中任一项所述的应用,其中所述结直肠癌疾病是结肠癌或直肠癌。
8.用于检测srcapatpase酶活性或其调控的下游转录因子的表达水平的试剂在制备用于诊断或预后哺乳动物的结直肠癌疾病的诊断剂/试剂盒中的应用。
9.根据以上8所述的应用,其中所述哺乳动物为人、小鼠或家畜,如猫、狗、猪、牛、绵羊、山羊、马和兔。
10.根据以上8或9所述的应用,其中所述结直肠癌疾病是结肠癌或直肠癌。
附图说明
图1中a至k所示的结果证明了srcap能够促进结直肠癌发生及肠癌干细胞自我更新。具体地,图1,a所示为人结直肠癌组织芯片上观察到srcap在人正常结直肠上皮细胞低表达,而在结直肠癌肿瘤高表达,并随肿瘤演进过程表达不断升高。图1,b所示为srcap在结直肠癌不同分期分级中的表达统计。图1,c所示为srcap表达与生存期分析,显示srcap高表达病人结直肠癌预后差。图1,d所示为在srcap敲低的hct116上,肿瘤干细胞体外成球能力收到抑制。图1,e所示为srcap敲低hct116细胞体内皮下成瘤能力显著降低。图1,f所示为srcap在肠道lgr5+干细胞中特异性基因敲除小鼠构建策略。图1,g所示为srcap在肠道lgr5+干细胞中特异性基因敲除小鼠基因型pcr鉴定结果。图1,h所示为应用抗srcap蛋白抗体在免疫印迹实验中证明srcap蛋白在小鼠肠道lgr5+干细胞中实现了特异性敲除。图1,i所示为在硫酸葡聚糖钠(dextransulfate,sodium,dss)/化学诱变剂偶氮甲烷(azoxymethane,aom)诱导的小鼠结直肠癌模型中,在肠道的组织特异性srcap敲除小鼠形成肿瘤的数量显著降低。图1,j所示为srcap敲除鼠诱导结直肠癌生存率提高。图1,k所示为srcap在肠道的组织特异性敲除小鼠形成肿瘤的数量显著降低。
图2中a至j所示的结果证明了srcapatpase抑制剂amtizole对由肠癌干细胞自我更新导致的结直肠癌有抑制效果。具体地,图2,a所示为小分子化合物amtizole在体外srcapatpase酶活检测体系中显著抑制srcapatpase活性。图2,b所示为在培养体系中抑制肠癌干细胞形成类器官cco的比例。图2,c所示为amtizole对apcmin小鼠自发结直肠癌有明显的抑制作用。图2,d所示为amtizole缓解小鼠体重的减低。图2,e所示为amtizole降低小鼠死亡率。图2,f所示为amtizole处理组小鼠结直肠癌肿瘤数量减少。图2,g所示为amtizole处理组小鼠结直肠癌肿瘤体积减小。图2,h所示为病理切片染色显示amtizole处理组小鼠结直肠癌肿瘤数量减少。图2,i所示为临床病人肿瘤样本来源的细胞注入nsg小鼠皮下诱导pdc模型,发现amtizole在瘤内的使用也能有效抑制肿瘤的生长。图2,j所示为对pdc肿瘤标本进行进一步的免疫组化染色分析,发现amtizole抑制了增殖相关标志物分子pcna及信号通路分子pparδ的表达。
具体实施方式
本发明的发明人在对lgr5+肠癌干细胞自我更新及结直肠癌肿瘤发生的相关研究中发现:srcap在人正常结直肠上皮细胞低表达,而在结直肠癌肿瘤高表达,并随肿瘤演进过程表达不断升高。srcap高表达病人结直肠癌预后差。srcap敲低hct116细胞体外成球和体内皮下成瘤能力显著降低。在硫酸葡聚糖钠(dextransulfate,sodium,dss)/化学诱变剂偶氮甲烷(azoxymethane,aom)诱导的小鼠结直肠癌模型中,srcap在肠道的组织特异性敲除小鼠形成肿瘤的数量显著降低,小鼠生存率提高。小分子化合物amtizole在体外srcapatpase酶活检测体系中显著抑制srcapatpase活性。在培养体系中抑制肠癌干细胞形成类器官cco的比例。amtizole对apcmin小鼠自发结直肠癌也有明显的抑制作用。有效缓解小鼠体重的减低,降低小鼠死亡率。肿瘤的数量减少、体积减小。将临床病人肿瘤样本来源的细胞注入nsg小鼠皮下诱导pdc模型,发现amtizole在瘤内的使用也能有效抑制肿瘤的生长。对pdc肿瘤标本进行进一步的免疫组化染色分析,发现amtizole抑制了增殖相关标志物分子pcna及信号通路分子pparδ的表达。
本发明的第一个方面提供了srcap在促进肠癌演进及肠癌干细胞自我更新中的作用,其特征在于,srcap在结直肠癌晚期标本高表达并与预后相关,srcap能够促进结直肠癌发生及肠癌干细胞自我更新。
在本发明的一些实施方案中,在人正常结直肠上皮细胞低表达,而在结直肠癌肿瘤高表达,并随肿瘤演进过程表达不断升高。srcap高表达病人结直肠癌预后差。
在本发明的一些实施方案中,srcap敲低hct116细胞体外成球和体内皮下成瘤能力显著降低。
在本发明的另一些实施方案中,在硫酸葡聚糖钠(dextransulfate,sodium,dss)/化学诱变剂偶氮甲烷(azoxymethane,aom)诱导的小鼠结直肠癌模型中,srcap在肠道的组织特异性敲除小鼠形成肿瘤的数量显著降低,小鼠生存率提高。
本发明的第二个方面提供了一种在肠癌干细胞中抑制srcapatpase的方法,所述方法包括使所述细胞与有效量的srcapatpase的抑制剂amtizole及其可能的每一种活性修饰产物接触。并提供了一种在需要其的患者中治疗由肠癌干细胞自我更新导致的结直肠癌的方法,所述方法包括向所述患者施用治疗有效量的srcapatpase的抑制剂amtizole及其可能的每一种活性修饰产物。
在本发明的一些实施方案中,在通过建立srcapatpase体外酶活筛选体系中验证小分子化合物amtizole在体外抑制srcapatpase并抑制肠癌cco类器官形成。
在本发明的一些实施方案中,amtizole抑制apcmin小鼠自发结直肠癌。能有效缓解小鼠体重的减低,降低小鼠死亡率。使肿瘤的数量减少、体积减小。
在本发明的另一些实施方案中,amtizole瘤内注射抑制肠癌pdc模型肿瘤的生长,抑制增殖相关标志物分子pcna及信号通路分子pparδ的表达。
在第三方面中,在以上第一和第二方面中任一项的方法是,srcapatpase的抑制剂是式(i)的化合物及其可能的每一种活性修饰产物:
在第四方面中,本方法涉及抑制srcapatpase酶的每一种的化合物或其药用盐,其用于抑制肠癌干细胞自我更新。
在第五方面中,本方法涉及抑制srcapatpase酶的每一种的化合物或其药用盐,其用于治疗由肠癌干细胞自我更新所致结直肠癌。
在前述方面中的任一项中,srcapatpase酶的每一种的抑制剂可以是相同化合物或不同的化合物。
在本发明中,术语“srcap(ncbi数据库基因id:10847)”是指具有目前国际共用核酸数据库genebank中srcap基因所示原始序列的srcap,其包括天然的或合成来源的srcap及其类似物。srcap类似物指其经取代、缺失或添加一个或几个核苷酸,或经过生物学化学修饰后仍具有生物活性的衍生物或变体形式。
在本发明中,术语“pcna(ncbi数据库基因id:5111)”是指具有目前国际共用核酸数据库genebank中pcna基因所示原始序列的pcna,其包括天然的或合成来源的pcna及其类似物。pcna类似物指其经取代、缺失或添加一个或几个核苷酸,或经过生物学化学修饰后仍具有生物活性的衍生物或变体形式。
在本发明中,术语“ppard(ncbi数据库基因id:5467)”是指具有目前国际共用核酸数据库genebank中ppard基因所示原始序列的ppard,其包括天然的或合成来源的ppard及其类似物。ppard类似物指其经取代、缺失或添加一个或几个核苷酸,或经过生物学化学修饰后仍具有生物活性的衍生物或变体形式。
本发明的amtizole的有效剂量可以随给药的模式和待治疗疾病的严重程度等进行相应的调整。优选的有效量的可以由本领域普通技术人员综合各因素来确定。所述因素包括但不限于:amtizole或其类似物的药代动力学参数、受治疗患者的健康状况、体重、给药途径等。
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
以下为本发明实施例所用材料和一般性方法:
抗体和试剂
抗小鼠及人srcap抗体(esl104)购自kerafast(boston,usa).抗ppar-δ(10156-2-ap)抗体购自proteintech(chicago,usa).抗小鼠pcna(ab29)抗体购自abcam(cambridge,usa).atpase/gtpaseactivityassaykit,ezprepnucleiisolationkit购自sigma-aldrich(st.louis,usa).matrigel(356234)w购自corning(corning,usa).
统计分析
在本发明中使用未配对的学生t检验作为统计分析。使用microsoftexcel或spss13进行统计学计算。当p<0.05时,p值显著。
实施例
实施例1:证明srcap能够促进结直肠癌发生及肠癌干细胞自我更新。
在人结直肠癌组织芯片(购自上海芯超生物科技有限公司,结肠癌180点生存期组织芯片,产品编号hcola180su15)上观察到srcap在人正常结直肠上皮细胞低表达,而在结直肠癌肿瘤高表达,并随肿瘤演进过程表达不断升高,如图1,a所示。srcap在结直肠癌不同分期分级中的表达统计,如图1,b所示。srcap表达与生存期分析显示srcap高表达病人结直肠癌预后差,如图1,c所示。在srcap敲低的人结肠癌细胞系hct116(hct116细胞购自中国科学院上海细胞库,目录号tchu99。srcap敲低细胞系由实验室自行筛选,shsrcap:5’-gctttccatggaggagctatt-3’)上,肿瘤干细胞体外成球能力受到抑制,如图1,d所示。srcap敲低hct116细胞体内皮下成瘤能力显著降低,如图1,e所示。通过crispr-cas9方法构建srcap条件基因敲除小鼠,与肠道干细胞特异表达的lgr5-cre小鼠(b6.129p2-lgr5tm1(cre/ert2)cle/j,购自美国jackson实验室,stockno.008875)交配得到在小鼠肠道干细胞中特异性敲除srcap基因的基因敲除小鼠(srcapfl/fl;lgr5-cre)及对照鼠(srcapfl/fl),如图1,f所示。srcap在肠道lgr5+干细胞中特异性基因敲除小鼠基因型pcr鉴定结果如图1,g所示。srcap蛋白在小鼠肠道lgr5+干细胞中实现了特异性敲除,如图1,h所示。在硫酸葡聚糖钠(dextransulfate,sodium,dss)/化学诱变剂偶氮甲烷(azoxymethane,aom)诱导的小鼠结直肠癌模型(模型构建方法见参考文献[1])中,在肠道的组织特异性srcap敲除小鼠(具体敲除方法以及实验验证结果见图1f-1h)形成肿瘤的数量显著降低,如图1,i所示。srcap敲除鼠诱导结直肠癌生存率提高,如图1,j所示。srcap在肠道的组织特异性敲除小鼠形成肿瘤的数量显著降低。如图1,k所示。
实施例2:证明srcapatpase抑制剂amtizole对由肠癌干细胞自我更新导致的结直肠癌有抑制效果。
小分子化合物amtizole在体外srcapatpase酶活检测体系(参考文献[2])中显著抑制srcapatpase活性,如图2,a所示(在od620下比色读值,以igg作为阴性对照,阳性读值与igg的差值作为相对酶活值,dmso=0.38±0.04,amitizole=0.09±0.02)。在培养体系中抑制肠癌干细胞形成类器官cco(colorectalcancerorganoid,人结直肠癌类器官)的比例,如图2,b所示。amtizole(1.5mg/kg体重)对apcmin小鼠自发结直肠癌(动物模型/方法的参考文献参见[1])有明显的抑制作用,如图2,c所示。amtizole(1.5mg/kg体重)缓解小鼠体重的减低,如图2,d所示。amtizole(1.5mg/kg体重)降低小鼠死亡率,如图2,e所示。amtizole处理组(1.5mg/kg体重)小鼠结直肠癌肿瘤数量减少,如图2,f所示。amtizole处理组(1.5mg/kg体重)小鼠结直肠癌肿瘤体积减小,如图2,g所示。病理切片染色显示amtizole处理组小鼠结直肠癌肿瘤数量减少,如图2,h所示。临床病人肿瘤样本来源的细胞(升结肠癌手术样本来源于解放军301医院)注入nsg(nod-prkdcscidil2rgtm1/bcgen,购自百奥赛图公司)小鼠皮下诱导pdc(patient-derivedcells)模型(动物模型/方法的参考文献参见[1]),发现amtizole在瘤内的使用(10μg瘤内注射,每3天一次)也能有效抑制肿瘤的生长,如图2,i所示。对pdc肿瘤标本进行进一步的免疫组化染色分析,发现与对照dmso相比,amtizole抑制了增殖相关标志物分子pcna(proliferatingcellnuclearantigen,增殖细胞核抗原)及信号通路分子pparδ的表达,如图2,j所示。
本领域技术人员应该理解,尽管参照上述实施例对本发明进行了具体的描述,但是本发明并不限于这些具体的实施例。基于本发明所教导的方法和技术方案,在不背离本发明的精神的前提下,本领域技术人员能够进行适当的修改或改进,由此所得的等价实施方案都在本发明的范围内。参考文献
1.zhu,p.etal.lncgata6maintainsstemnessofintestinalstemcellsandpromotesintestinaltumorigenesis.natcellbiol20,1134-1144(2018).
2.ye,b.etal.suppressionofsrcapchromatinremodellingcomplexandrestrictionoflymphoidlineagecommitmentbypcid2.natcommun8,017-01788(2017).
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 


