一种化合物在制备治疗肿瘤的药物中的用途的制作方法
 2021-01-08 11:01:39|
2021-01-08 11:01:39| 243|
243| 起点商标网
起点商标网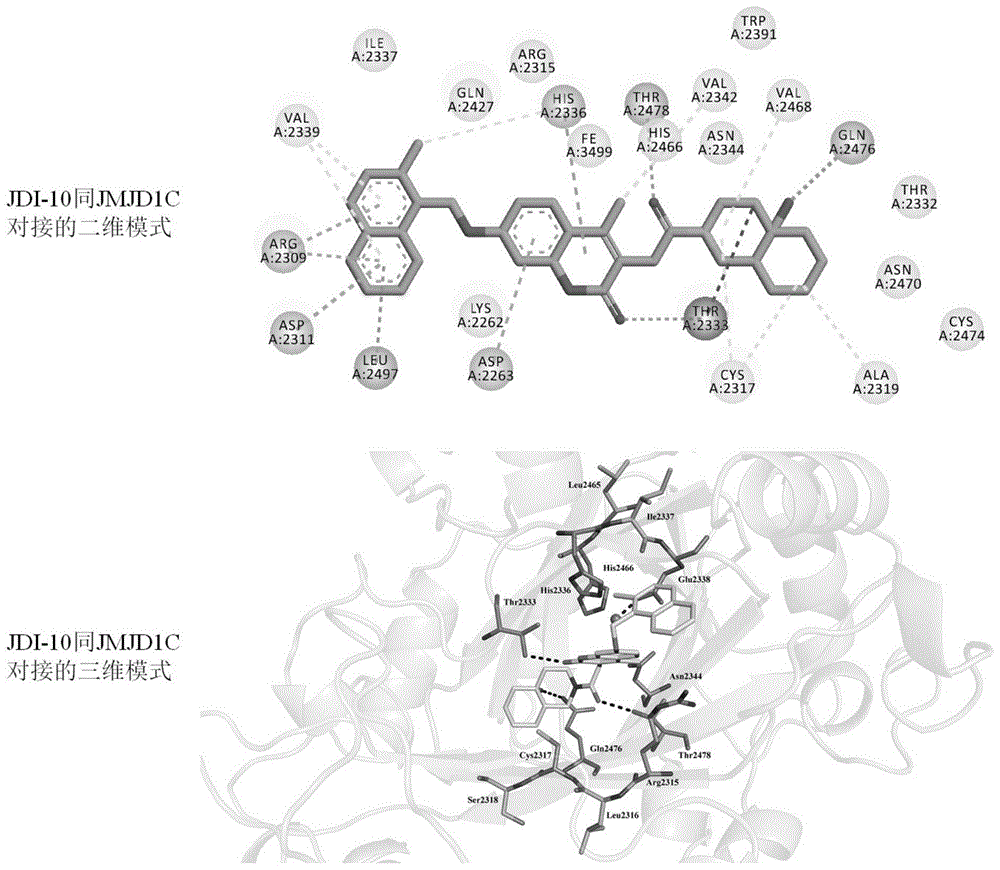
本发明涉及生物医药领域,具体地,涉及一种化合物在制备治疗肿瘤的药物中的用途。
背景技术:
急性白血病(acuteleukemia,al)是中国成人发病率最高的白血病类型,其亚型预后差别很大。混合系白血病基因异位(mixedlineageleukemiarearrangement,mllr)约占al的10%,而且预示中等或不良预后。目前针对mllral最有希望的策略是靶向治疗。
多种染色质相关蛋白是mllral维持必需蛋白,例如组蛋白h3k79位甲基转移酶dot1l,包含组蛋白h3k27位甲基转移酶组分的prc2复合物,组蛋白去甲基化酶lsd1(kdm1a),kdm4c,组蛋白修饰结合蛋白brd4,rnf20,menin,ledgf,cbx8。这些mllral维持必需蛋白是mllral的潜在药靶。针对其中一些蛋白的小分子抑制剂已经研发成功。例如jq1和i-bet151能抑制brd4同组蛋白之间的相互作用;epz004777能抑制dot1l介导的h3k79甲基化;mi-2和mi-3能抑制menin-mll相互作用;gsk126、epz-6438和ei1抑制ezh2介导的h3k27甲基化;ory-1001能抑制lsd1介导的h3k4去甲基化。这些小分子抑制剂都能有效地选择性杀伤白血病细胞,有的已经进入临床。尽管如此,更多的药靶有待发现,更多的药靶特异性抑制剂有待开发。
组蛋白h3赖氨酸9位(h3k9)去甲基化酶jmjd1c也是一个mllraml维持的必需蛋白,是包括mllraml白血病在内的多种造血系统恶性异常的一个很好的药靶。
sroczunska等(blood.2014mar20;123(12):1870-82.)在mll-af9融合癌基因诱导的小鼠aml模型中以及作为对照的小鼠骨髓中,采用shrna文库敲除了319个染色质相关蛋白。结果发现jmjd1c对mll-af9白血病细胞的生存最为关键,但对正常骨髓没有显著影响,表现出最强的药靶潜力。相比之下,白血病维持关键分子和药靶brd4位列mll-af9生存关键基因第29位。进一步的体外和体内实验表明,mll-af9融合癌基因诱导小鼠白血病细胞、人白血病细胞系对jmjd1c的敲除敏感,细胞增殖下降明显。相比之下,正常骨髓细胞、c-kit+/sca-1+/lin-造血干细胞对jmjd1c的敲除不敏感。zhu等(jclininvest.2016mar1;126(3):997-1011.)针对mll-af9aml进行了另一项筛选,目标是149个mll-af9靶基因。jmjd1c位列mll-af9白血病干细胞和正常干细胞差异表达基因的第3位,前两位分别是hoxa9和hoxa10。jmjd1c敲除在体外导致mll-af9白血病细胞集落形成削弱,凋亡增加和终末分化,产生更多的类似中性粒细胞和巨噬细胞的细胞,在体内导致造血干细胞频率的下降。jmjd1c对于白血病的维持是必需的,但是对白血病的起始则不是必需的。这些结果表明,jmjd1c是mll异位aml维持的关键因子。
chen等(genesdev.2015oct15;29(20):2123-39.)发现jmjd1c对于含有aml1/eto融合基因的aml也非常关键。jmjd1c能够和aml1/eto复合物相互作用。jmjd1c对于aml1/eto融合基因细胞系kasumi-1和skno-1的生存是必需的。这些结果表明,jmjd1c也是aml1/etoaml维持的关键因子。
sroczunska等(blood.2014mar20;123(12):1870-82.)的研究发现,不仅含有mll异位和aml1/eto融合基因的aml细胞对jmjd1c敲除敏感,其它造血系统恶性异常包括急性淋巴细胞白血病(acutelymphoblasticleukemia,all)细胞系sem(b-all),慢性髓细胞白血病(chronicmyelogenousleukemia,cml)细胞系k562,淋巴瘤细胞系u-937,都对jmjd1c敲除敏感。peeken等(blood.2018mar8.pii:blood-2017-10-810622.)发现骨髓增殖性肿瘤同样对jmjd1c敲除敏感。
总之,jmjd1c是多种造血系统恶性异常的一个很好的药靶。具有1)肿瘤靶向特异性:jmjd1c的敲除特异性杀死肿瘤细胞而不是正常细胞;和2)肿瘤靶向广谱性:多种含有不同细胞遗传学改变的造血系统恶性异常对jmjd1c敲除敏感。jmjd1c是否是其它恶性肿瘤的必需蛋白尚不清楚。尽管如此,目前还没有针对jmjd1c的小分子抑制剂。开发针对jmjd1c的小分子抑制剂对于造血系统恶性异常,尤其是mll异位等分子遗传学异常的白血病,以及其它恶性肿瘤的靶向治疗具有重要的意义。
技术实现要素:
本公开提供了组蛋白去甲基化酶调节剂jdi-10及其结构类似物在抑制造血系统恶性肿瘤中的药物应用。
本公开提供了一种化合物在制备治疗肿瘤的药物中的用途,其中,该化合物如式(1)所示:
式(1)中,a单元各自独立选择以下基团:
q单元选自以下基团时,
r1单元为h;
q单元选自以下基团时,
r1单元各自独立选自以下基团:
通过上述技术方案,本公开鉴定出一类针对jmjd1c的小分子调节剂;这些jmjd1c小分子调节剂能选择性杀伤白血病细胞,但并不影响正常造血,具有良好的白血病治疗效果。
本公开的其他特征和优点将在随后的具体实施方式部分予以详细说明。
附图说明
附图是用来提供对本公开的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本公开,但并不构成对本公开的限制。在附图中:
图1是虚拟筛选中jdi-10(式a1)同jmjd1c的分子对接结果。
图2是jdi-10(式a1)对多种造血系统恶性异常细胞系、原代白血病细胞以及健康供体脐血细胞的集落形成影响。
图3是jdi-10(式a1)对小鼠异种移植白血病模型的影响。
具体实施方式
以下结合附图对本公开的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本公开,并不用于限制本公开。
本公开提供了一种化合物在制备治疗肿瘤的药物中的用途,其中,该化合物如式(1)所示:
式(1)中,a单元各自独立选择以下基团:
q单元选自以下基团时,
r1单元为h;
q单元选自以下基团时,
r1单元各自独立选自以下基团:
其中,优选地,所述化合物为式a1-式a13中的任意一者:
本公开还提供了如上所述的化合物在制备治疗肿瘤的药物中的用途。
其中,所述肿瘤可以为造血系统恶性肿瘤,更具体地为白血病、骨髓增殖性肿瘤、骨髓增生异常综合征、多发性骨髓瘤或淋巴瘤。
以下,通过实施例进一步详细说明本发明。
实施例1
潜在jmjd1c小分子调节剂jdi-10(式a1)的鉴定。如图1描述。
对于从近20万种天然组分和中药有效成分中通过虚拟筛选得到的潜在的jmjd1c调节剂中,选择虚拟筛选对接分值最高的化合物jdi-10(式a1)。
如图1所示,虚拟筛选分子对接显示jdi-10(式a1)能同jmjd1c相互作用。其中,上图表示jdi-10(中间棍状模型所示分子)同jmjd1c蛋白催化结构域上关键的氨基酸之间的相互作用的二维模式;下图表示jdi-10(中间棍状模型所示分子)同jmjd1c蛋白催化结构域上关键的氨基酸之间的相互作用的三维模式。
实施例2
通过细胞增殖实验检测jdi-10对多种造血系统恶性细胞系的抑制。
所采用的细胞系包括:mv4-11,sem,molm-13,thp-1,kasumi-1,hl-60,k562,jurkat,kg-1,mutz-3,mutz-8,nb-4,oci-aml5。这些细胞系来源于德国国家细胞研究所(leibnizinstitutedsmz-germancollectionofmicroorganismsandcellcultures)。细胞按照dsmz网站(https://www.dsmz.de/catalogues/catalogue-human-and-animal-cell-lines.html)上提供的培养方法放置于37℃,5%二氧化碳的环境中培养。培养基(rpmi1640或者α-mem)及胎牛血清来自thermalfisher。
细胞按照30000/ml的浓度以100微升接种于v字底96孔板,从而保证在6天的培养中细胞保持指数生长。接种后24小时,加入不同浓度(25,10,5,2.5,1,0.5,0.25,0.1μm)的jdi-10(溶解于dmso)孵育6天,dmso的浓度不超过0.1%。然后采用atp检测试剂盒(货号lt07-121,公司lonza,德国)检测化学发光,衡量atp的含量从而反映细胞增殖的情况。根据不同浓度的jdi-10的细胞增殖抑制率来计算jdi-10对各种细胞的半数抑制率(ic50)。每组数值是指实验数据的平均值±标准差,至少有三次独立重复的实验数据。
如表1所示,jdi-10能抑制列表中列举的细胞系的增殖。
表1:
实施例3
通过集落形成实验检测jdi-10对多种造血系统恶性细胞系、原代白血病细胞,以及健康供体脐血细胞的影响。
将mll异位白血病细胞系mv4-11(2000/ml),molm-13(1000/ml),thp-1(2000/ml)等接种到甲基纤维素半固体培养基(货号h4100,stemcelltechnologies公司,美国),处理组采用10μm的jdi-10,对照组采用等体积的dmso,确保dmso总体积不超过0.1%。处理8-10天后,检测克隆形成结果,计算克隆数。
将来自病人样本的核型正常(p91)或者含有mll-ell融合基因(p93)或者含有aml1-eto融合基因(p94)的白血病细胞按照5000/ml接种到甲基纤维素半固体培养基(货号h4434,stemcelltechnologies公司,美国),处理组采用10μm的jdi-10,对照组采用等体积的dmso,确保dmso总体积不超过0.1%。处理14-16天后,检测克隆形成结果,计算克隆数。
将来自健康供体(con134,con135,con136)脐血的细胞按照25000/ml接种到甲基纤维素半固体培养基(货号h4434,stemcelltechnologies公司,美国),处理组采用25μm的jdi-10,对照组采用等体积的dmso,确保dmso总体积不超过0.1%。处理14-16天后,检测克隆形成结果,计算克隆数。
如图2所示,10μm的jdi-10能强烈抑制mv4-11,molm-13,thp-1以及多种不同核型的白血病细胞的集落形成,而高达25μm的jdi-10对健康脐血的集落形成没有影响。这些结果表明jdi-10能选择性杀伤造血系统恶性异常细胞,但是对正常造血无明显影响。
实施例4
动物实验:采用非肥胖糖尿病/重症联合免疫缺陷(nod-scid)小鼠(北京维通利华实验动物技术有限公司)。结果如图3描述。
小鼠实验采用jdi-10(式a1)。6-8周龄小鼠(对照和处理各n=8)采用亚致死剂量(200cgy)射线全身照射后,尾静脉注射1000万mv4-11细胞。在注射mv4-11后的第21天,将jdi-10粉末溶解于含5%二甲基亚砜(dmso,体积-体积比)和10%羟丙基β-环糊精(kleptosehpb,质量-体积比)的生理盐水,计量按30mg/kg/天(5ml/kg/天),用1ml注射器抽取配好的药物行小鼠腹腔注射。之后每天观察2次。图3的结果表明,jdi-10(式a1)具有白血病抑制活性。
以上结合附图详细描述了本公开的优选实施方式,但是,本公开并不限于上述实施方式中的具体细节,在本公开的技术构思范围内,可以对本公开的技术方案进行多种简单变型,这些简单变型均属于本公开的保护范围。
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本公开对各种可能的组合方式不再另行说明。
此外,本公开的各种不同的实施方式之间也可以进行任意组合,只要其不违背本公开的思想,其同样应当视为本公开所公开的内容。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 


