透明质酸及其盐的治疗用途的制作方法
 2021-01-08 11:01:52|
2021-01-08 11:01:52| 338|
338| 起点商标网
起点商标网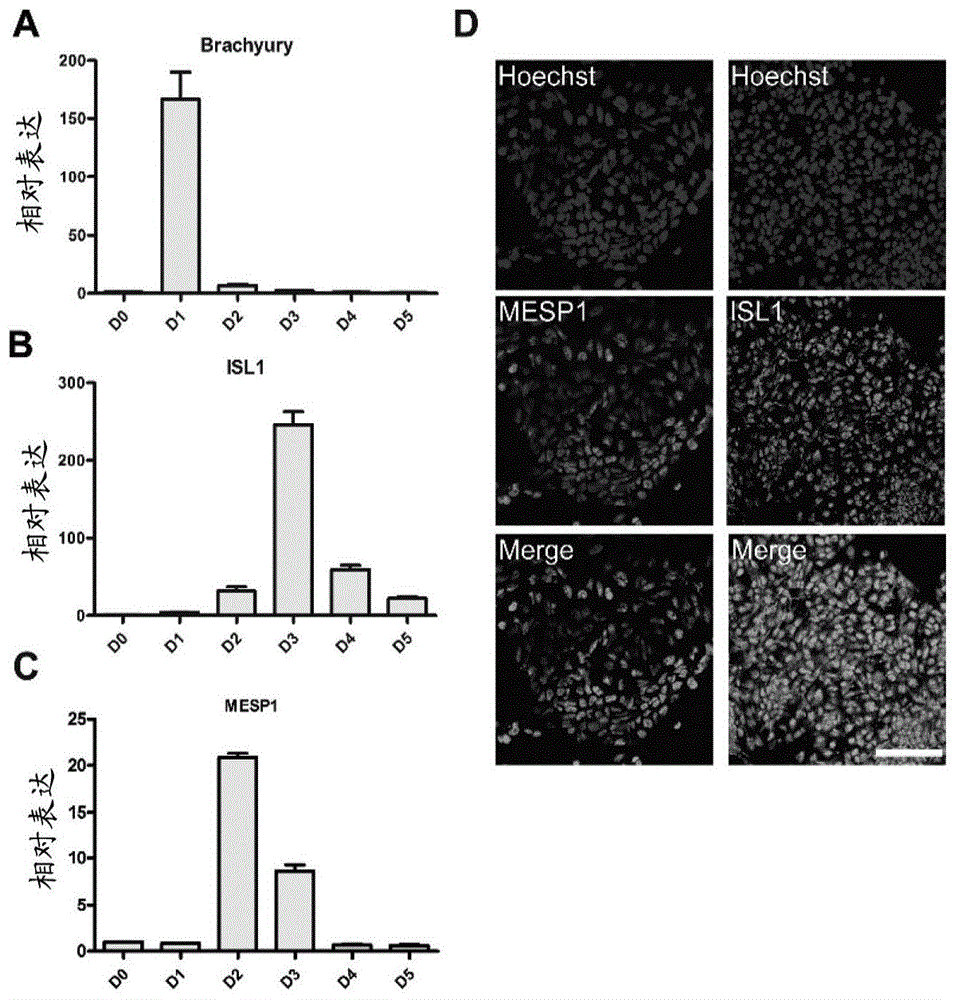
发明背景
随着社会发展,心血管疾病特别是动脉粥样硬化引起的心肌梗死成为了人类社会中主要的死亡原因。2030年左右,全世界估计每年会有2.33千万人死于心血管疾病。目前,冠心病患者的治疗方案主要包括药物、支架植入、心脏植入辅助性装置及心脏移植。但是,心脏移植受器官来源以及其它问题限制,导致仅很少部分病人能够获益,相对于不断增加的心脏病患者而言并不是理想的解决手段。
细胞在心血管疾病治疗方面作为一种再生医疗资源,无论是临床前还是临床研究,均取得了巨大进展。但是,目前细胞移植后在心脏组织内滞留并存活的效率极其低下,大约在1%到15%之间(vanlaakelw等人,humanembryonicstemcell-derivedcardiomyocytessurviveandmatureinthemouseheartandtransientlyimprovefunctionaftermyocardialinfarction.stemcellresearch.2007;1(1):9-24)。细胞移植后残存率低下的原因有很多,主要包括细胞死亡、缺血、免疫排斥以及心脏收缩时的挤压作用。先前的研究将移植的细胞在体内的变化分为三个阶段:第一阶段,细胞随针孔流出或冠状动脉内血流的冲洗作用;第二阶段,细胞的逐渐死亡;第三阶段,少量心肌前体细胞增殖(teng,c.j.等人,massivemechanicallossofmicrosphereswithdirectintramyocardialinjectioninthebeatingheart:implicationsforcellularcardiomyoplasty.jthoraccardiovascsurg132,628-632,doi:10.1016/j.jtcvs.2006.05.034(2006))。目前有大量的研究旨在减少细胞移植后前两个阶段的丢失,譬如在心脏停跳的条件下注射细胞、用生物胶封闭注射针孔、细胞和材料混合后移植、细胞移植前热激抗凋亡处理,以及与促进细胞增殖和抗凋亡的细胞因子共移植。
生物材料和细胞共移植可以模拟细胞周围微环境,激活抗凋亡信号通路,从而改善细胞的存活和移植区滞留。目前,人胚胎干细胞来源的心肌细胞(hesc-cms)临床前实验涉及将细胞和matrigel共移植(laflamme,m.a.等人,cardiomyocytesderivedfromhumanembryonicstemcellsinpro-survivalfactorsenhancefunctionofinfarctedrathearts.natbiotechnol25,1015-1024,doi:10.1038/nbt1327(2007))。然而,matrigel是从小鼠肉瘤里提取的一种胶状生物基质,含有多种细胞外基质、因子以及其它未确定的不明成分。它的动物源性不明成分以及含有各种复杂的生长因子,限制了其今后临床应用。因此,我们需要筛选成分单一、明确的生物材料和心肌细胞共移植。
技术实现要素:
本发明人出人意料地发现,将透明质酸或其药学上可接受的盐与心肌细胞或前体细胞共移植,能够有效改善心肌细胞或其前体细胞在心脏移植后的存活和功能,在患有心脏组织损伤或心功能不全相关疾病的受试者中促进心功能改善和疾病治疗。
相应的,在一方面,本公开提供了一种在有需要的受试者中治疗心脏组织损伤或心功能不全相关疾病的方法,其包括将透明质酸或其药学上可接受的盐和心肌细胞或其前体细胞的组合移植至所述受试者的心脏。
术语“心肌细胞”是心脏的主要组成部分,受植物性神经支配,属于有横纹的不随意肌,具有兴奋收缩的能力。心肌细胞可以作为心肌再生或心脏疾病治疗移植用的细胞使用。
经分离获得c-kit阳性细胞,并在体外培养扩增后用于自体细胞移植。临床结果表明,细胞移植组病人病情转归较好,心脏瘢痕质量减轻、活力心肌组织质量增加、心脏局部运动改善、收缩状态下心室壁厚度增加(makkarrr,smithrr,chengk,etal.intracoronarycardiosphere-derivedcellsforheartregenerationaftermyocardialinfarction(caduceus):aprospective,randomisedphase1trial.lancet.2012;379(9819):895-904)。并且,病人在冠状动脉搭桥手术时进行hesc-cms细胞补片移植,心功能得到明显改善(menaschep,vanneauxv,hagegea,etal.humanembryonicstemcell-derivedcardiacprogenitorsforsevereheartfailuretreatment:firstclinicalcasereport.europeanheartjournal.2015;36(30):2011-2017)。
术语“前体细胞”或“心肌前体细胞”是指已经部分分化的细胞,其具有在体内环境下分化成心肌细胞的能力。例如,前体细胞可以是干细胞例如多能干细胞向心肌细胞分化的中间状态细胞,或者是成体细胞向心肌细胞转分化的中间状态细胞,其具有分化潜能,并能够在移植至心脏后分化成心肌细胞。
在另一方面,本公开提供了一种在患有心脏组织损伤或心功能不全相关疾病的受试者中改善移植的心肌细胞的存活和/或功能的方法,其包括将透明质酸或其药学上可接受的盐应用于接受心肌细胞移植的受试者的心脏。
在一些实施方案中,所述方法用于在受试者中促进移植的心肌细胞的增殖。在另一些实施方案中,所述方法用于在受试者中抑制移植的心肌细胞的凋亡。在一些实施方案中,所述方法用于在受试者中促进移植的心肌细胞在改善心脏功能和/或修复心脏结构中的作用。
在一些实施方案中,所述方法用于在受试者中延缓或抑制心室重构的病理改变。
在一些实施方案中,所述方法用于在受试者中改善心室收缩功能,促进心功能恢复。
在一些实施方案中,所述方法用于在受试者中改善心脏电生理稳定性,抑制心率失常。
在一些实施方案中,透明质酸或其药学上可接受的盐从天然或合成来源分离和/或纯化,例如在进一步配制使用前纯度为至少90%,至少95%,至少98%或至少99%。
如本文所用,术语“从天然或合成来源分离和/或纯化”是指物质不以天然或合成来源中的天然或初始状态存在,例如该物质至少部分地从与其性质相关的一种或多种,或所有天然存在或人工合成的其它成分分离和/或纯化。例如,纯化的物质在进一步配制使用前可以是成分单一且明确的(除了纯化过程中产生的杂质外),例如纯化的物质可以是指纯度为至少90%,至少95%,至少98%或至少99%的物质。
在一些实施方案中,透明质酸的分子量为约400000da至约2200000da,优选约400000da至约1200000da。在一些实施方案中,透明质酸的分子量为约400000da至约2000000da,约400000da至约1800000da,约400000da至约1600000da,约400000da至约1400000da或约400000da至约1200000da。
随着细胞治疗研究不断发展,水凝胶已常规作为细胞移植递送和/或组织工程应用到多种疾病治疗中,包括心脏疾病、眼科疾病、软骨类疾病、生殖系统疾病等。水凝胶形式是指极为亲水的交联聚合物链的网络结构,其可以在水中迅速溶胀并在此溶胀状态可以保持大量体积的水而不溶解。在本公开的一些实施方案中,透明质酸或其药学上可接受的盐配制成水凝胶形式。
在一些实施方案中,透明质酸或其药学上可接受的盐配制成浓度为约0.1%-约4%(w/v)的水凝胶,例如浓度为约0.5%-约2%(w/v)的水凝胶,浓度为约0.6%-约1.5%(w/v)的水凝胶,浓度为约0.8%-约1.2%(w/v)的水凝胶,或浓度为约1%(w/v)的水凝胶。
本文中,术语“药学上可接受的盐”是指在适当的医学判断范围内适合与人或其它动物的组织或器官接触而没有过度的毒性、刺激性、过敏反应、免疫原性或其他问题的盐,与合理的效益/风险比相称。在一些实施方案中,透明质酸的药学上可接受的盐选自透明质酸钠、透明质酸锌和透明质酸硒。在优选的实施方案中,透明质酸的药学上可接受的盐是透明质酸钠。
在一些实施方案中,心肌细胞从干细胞例如多能干细胞分化获得,或从成体细胞转分化获得。在一些实施方案中,心肌细胞从胚胎干细胞(esc),例如已经建立成细胞系的胚胎干细胞分化获得,例如人胚胎干细胞源心肌细胞(humanembryonicstemcell-derivedcardiomyocytes,hesc-cm)。hesc-cm作为人类心血管研究的一种重要细胞资源,特别是在心肌细胞毒性分析、药物筛选和疾病模型方面具有重要的用途。hesc-cm也可以作为心脏疾病再生医疗的种子资源细胞应用于临床背景。
根据心肌细胞的组织学特点、电生理特性以及功能上的区别,可以大致将其分为两大类型:工作心肌细胞和自律心肌细胞。在一些实施方案中,从干细胞例如多能干细胞分化获得的心肌细胞包括工作心肌细胞(例如心房肌细胞和心室肌细胞),自律心肌细胞(例如窦房结细胞和浦肯野细胞)。在一些实施方案中,从成体细胞转分化获得的心肌细胞包括工作心肌细胞,如心房肌细胞。
在一些实施方案中,心脏组织损伤或心功能不全相关疾病选自缺血性心脏病、风湿性心脏病、遗传性或先天性心脏病、心功能不全、心肌病、心律失常、冠心病、心脏瓣膜病、炎性心脏病、高血压性心脏病、肺性心脏病、扩张性心肌病、主动脉瓣狭窄、肺动脉瓣狭窄、心房中膈缺损、心室中膈缺损、心内膜垫缺损、主动脉窄缩、开放性动脉导管、心力衰竭例如急性心力衰竭,和心肌梗死例如急性心肌梗死。
在一些实施方案中,将透明质酸或其药学上可接受的盐和心肌细胞的混合物移植至所述受试者的心脏损伤或缺陷部位,或邻近部位。
在一些实施方案中,方法还包括将海藻糖酸或其药学上可接受的盐例如海藻糖酸钠应用于所述受试者的心脏。例如,可以将透明质酸或其药学上可接受的盐、海藻糖酸或其药学上可接受的盐和心肌细胞或其前体细胞的混合物移植至受试者的心脏。
在一些实施方案中,受试者是人。在另一些实施方案中,所述受试者是非人哺乳动物。
在一些实施方案中,当所述受试者是人时,移植的心肌细胞或其前体细胞的数量可以是1×106至1×108个,例如1×107至5×107个,例如约1×107个,约2×107个,约3×107个,约4×107个或约1×107个。在一些实施方案中,将透明质酸或其药学上可接受的盐配制成浓度为0.1%-4%(w/v)例如0.5%-2%(w/v)的水凝胶,并与心肌细胞或其前体细胞的悬液混合,例如等体积混合后移植至所述受试者的心脏。
在一方面,本公开提供了透明质酸或其药学上可接受的盐和心肌细胞或其前体细胞在制备用于在有需要的受试者中治疗心脏组织损伤或心功能不全相关疾病的药物组合物中的用途,其中所述透明质酸或其药学上可接受的盐和心肌细胞或其前体细胞用于组合移植至所述受试者的心脏。
在另一方面,本公开提供了透明质酸或其药学上可接受的盐在制备用于在患有心脏组织损伤或心功能不全相关疾病的受试者中改善移植的心肌细胞的存活和/或功能的药物组合物中的用途。
在一方面,本公开提供了一种药物组合物,其包括透明质酸或其药学上可接受的盐和心肌细胞或其前体细胞,所述组合物用于在受试者中治疗心脏组织损伤或心功能不全相关疾病,其中所述透明质酸或其药学上可接受的盐和心肌细胞或其前体细胞用于组合移植至所述受试者的心脏。
在另一方面,本公开提供了一种药物组合物,其包括透明质酸或其药学上可接受的盐,所述组合物用于在患有心脏组织损伤或心功能不全相关疾病的受试者中改善移植的心肌细胞的存活和/或功能。
在上述用途和组合物的一些实施方案中,所述用途或药物组合物用于在受试者中促进移植的心肌细胞的增殖。在另一些实施方案中,所述用途或药物组合物用于在受试者中抑制移植的心肌细胞的凋亡。在一些实施方案中,所述用途或药物组合物用于在受试者中促进心肌细胞在改善心脏功能和/或修复心脏结构中的作用。
在一些实施方案中,所述用途或药物组合物用于在受试者中延缓或抑制心室重构的病理改变。
在一些实施方案中,所述用途或药物组合物用于在受试者中改善心室收缩功能,促进心功能恢复。
在一些实施方案中,所述用途或药物组合物用于在受试者中改善心脏电生理稳定性,抑制心率失常。
在上述用途和组合物的一些实施方案中,透明质酸或其药学上可接受的盐从天然或合成来源分离的和/或纯化,例如在进一步配制使用前纯度为至少90%,至少95%,至少98%或至少99%。
在一些实施方案中,透明质酸的分子量为约400000da至约2200000da,优选约400000da至约1200000da。在一些实施方案中,透明质酸的分子量为约400000da至约2000000da,约400000da至约1800000da,约400000da至约1600000da,约400000da至约1400000da或约400000da至约1200000da。
在上述用途和组合物的一些实施方案中,透明质酸或其药学上可接受的盐配制成水凝胶形式。在一些实施方案中,透明质酸或其药学上可接受的盐配制成浓度为约0.1%-约4%(w/v)的水凝胶,例如浓度为约0.5%-约2%(w/v)的水凝胶,浓度为约0.6%-约1.5%(w/v)的水凝胶,浓度为约0.8%-约1.2%(w/v)的水凝胶,或浓度为约1%(w/v)的水凝胶。
在上述用途和组合物的一些实施方案中,透明质酸的药学上可接受的盐选自透明质酸钠、透明质酸锌和透明质酸硒。在优选的实施方案中,透明质酸的药学上可接受的盐是透明质酸钠。
在上述用途和组合物的一些实施方案中,心肌细胞从干细胞例如多能干细胞分化获得,或从成体细胞转分化获得。在一些实施方案中,心肌细胞从胚胎干细胞(esc)例如已经建立成细胞系的胚胎干细胞分化获得。
在上述用途和组合物的一些实施方案中,心脏组织损伤或心功能不全相关疾病选自缺血性心脏病、风湿性心脏病、遗传性或先天性心脏病、心功能不全、心肌病、心律失常、冠心病、心脏瓣膜病、炎性心脏病、高血压性心脏病、肺性心脏病、扩张性心肌病、主动脉瓣狭窄、肺动脉瓣狭窄、心房中膈缺损、心室中膈缺损、心内膜垫缺损、主动脉窄缩、开放性动脉导管、心力衰竭例如急性心力衰竭,和心肌梗死例如急性心肌梗死。
在一些实施方案中,药物组合物还包含海藻糖酸或其药学上可接受的盐例如海藻糖酸钠。
在一些实施方案中,受试者是人。在另一些实施方案中,所述受试者是非人哺乳动物。
在上述用途和组合物的一些实施方案中,当所述受试者是人时,移植的心肌细胞或其前体细胞的数量可以是5×106至1×108个,例如1×107至5×107个,例如约1×107个,约2×107个,约3×107个,约4×107个或约1×107个。在一些实施方案中,将透明质酸或其药学上可接受的盐配制成浓度为0.1%-4%(w/v)例如0.5%-2%(w/v)的水凝胶,并与心肌细胞或其前体细胞的悬液混合,例如等体积混合后移植至所述受试者的心脏。
附图说明
图1-vn诱导q-cts-hesc-2源心肌细胞分化早期特异性基因表达(标尺:200μm)。a-c.qpcr分析心肌细胞早期标记物在分化时程中的表达水平随时间变化趋势。d.分化3天时,免疫荧光染色显示心肌细胞早期表达。errorbars表示三个重复样本的sem。
图2-vn诱导q-cts-hesc-2源心肌细胞分化晚期特异性基因表达(标尺:200μm)。a,b.qpcr分析心肌细胞表面标记物在分化时程中的表达水平随时间变化趋势。c.分化14天时,免疫荧光染色显示心肌细胞表面标记物表达。errorbars表示三个重复样本sem。
图3-构建心肌梗死动物模型中大鼠前降支结扎后肢体导联心电图变化。
图4-心脏程序性电刺激诱发心律失常。a.s1s2刺激心脏最长有效不应期(线段标记)。b.心脏程序电刺激诱发持续性心动过速(线段标记)。
图5-免疫组织化学原位染色:ctnt(红色)和人特异性抗体(znf397,sigmaaldrich)双染显示三组材料和q-cts-hesc-2-cms共移植到大鼠体内后的存活情况(标尺:200μm)。
图6-超声检测q-cts-hesc-2-cms移植后左心室射血分数(ef)变化。a.三组材料和细胞共移植后改善大鼠心脏ef。b.t检验统计分析发现三组材料和细胞共移植后δef值与生理盐水组差异性显著。c.onewayanova统计分析表明δef在四组中有显著性差异。
图7-超声检测q-cts-hesc-2-cms移植后左心室内径和容积变化。a,b.onewayanova统计大鼠左心室收缩末/舒张末内径绝对值变化,其中δlvsd在四组中有显著性差异。c,d.onewayanova统计大鼠左心室收缩末/舒张末容积绝对值变化。注:lved,左心室舒张末内径;lvsd,左心室收缩末内径;lvvol,d,左心室舒张末容积;lvvol,s,左心室收缩末容积。
图8-超声检测q-cts-hesc-2-cms移植后左心室短轴缩短率(fs)变化。a.三组材料和细胞共移植后大鼠心脏收缩功能均有改善。b,c.t检验和onewayanova统计分析表明透明质酸和细胞共移植显著改善统大鼠梗死后左心室收缩功能。
图9-超声检测q-cts-hesc-2-cms移植后左心室面积变化分数(fac)。a,b.透明质酸钠和细胞共移植以后提高大鼠左心室面积变化分数。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
实施例1.hesc-cms的制备及纯化
在本实施例中,使用已建立的人胚胎干细胞系q-cts-hesc-2进行心肌细胞的诱导分化。q-cts-hesc-2细胞系为临床级人胚干细胞(guq,wangj,wangl等人,accreditationofbiosafeclinical-gradehumanembryonicstemcellsaccordingtochineseregulations.stemcellreports.2017;9(1):366-380)。具体步骤如下。
1.诱导向心肌细胞分化
1)培养的q-cts-hesc-2细胞当细胞密度达到90%以上时,进行心肌细胞诱导分化;在诱导分化的d0,弃培养上清,用dpbs清洗细胞一次,将培养液更换为心肌细胞分化液i(rpmi/1640+vn+4μμchir99021);
2)d1弃培养上清,更换为心肌细胞分化液ii(rpmi/1640+vn);
3)d3弃培养上清,更换为心肌细胞分化液iii(rpmi/1640+vn+5μμiwr1),d5再次更换心肌细胞分化液iii;
4)d8弃培养上清,更换为心肌细胞分化液iv(rpmi/1640+vn+4μg/l胰岛素),隔天换液;
5)d10可以观察到跳动的心肌细胞。
vn添加物的成分如下。
2.hesc源心肌细胞(q-cts-hesc-2-cms)的表征
利用qpcr和免疫荧光染色的方法检测细胞的蛋白表达情况。hesc在体外向心肌细胞分化的过程和体内心脏发育相似,早期阶段表达多种心脏发育过程中的特异性转录因子,如brachyury、中胚层晚期碱性螺旋-环-螺旋转录因子1(mesp1)和胰岛素基因增强子结合蛋白1(isl1)。
qpcr结果显示,细胞分化24小时后brachyury高表达,随后逐渐下降(图1a),而心肌祖细胞的标记物mesp1开始表达(图1c)。isl1是第二心区前体细胞特异性表达基因,在胚胎发育11-18周表达,随后逐步分化发育成ctnt阳性细胞。isl1在分化的d3表达最高,随后逐渐下降(图1b)。免疫荧光染色结果显示,vn诱导心肌细胞分化早期mesp1和isl1呈阳性(图1d)。
分化晚期,q-cts-hesc-2-cms规律跳动,并表达参与形成心肌肌钙蛋白复合物的ctnt。本实施例中分析了ctnt在分化时程中的表达趋势,其被认为是hescs-cms的标记物。qpcr结果表明ctnt在细胞分化d5开始表达并逐步升高,在d9达到最高峰,然后趋于稳定(图2a)。肌球蛋白轻链3(myl3)是心室肌细胞另一个标记物,qpcr结果表明其表达趋势和ctnt相近(图2b)。同样,在此阶段免疫荧光检测显示ctnt和α-actinin表达阳性(图2c)。
3.蔗糖密度梯度离心法分离纯化hesc-cm
1)用ctsknockoutdmem基础液将vitronectin-nc稀释为1μg/ml后包被6孔板,每孔加入0.3ml,放入co2培养箱中37℃静置1-2小时后待用;
2)制备浓度分别为40.5%和58.5%的蔗糖液,配制方法如下(25ml):
3)弃培养上清,用pbs清洗细胞一次,24孔板每孔加0.5mlaccutase,37℃消化20-25min,消化至细胞之间连接松散;
4)加ctsknockoutdmem培养液,将细胞轻轻吹下,收集到15ml离心管中,1200r/min离心3min;
5)弃上清,用10ml心肌细胞分化液重悬,用移液器轻轻将12ml40.5%percoll加到重悬液下面,再轻轻将12ml58.5%percoll加到40.5%percoll下面;1500g离心30min;
6)离心后,可以大致看到5个不同的层:
最上层几乎没有细胞,主要是重悬培养基;
位于重悬培养基与40.5%percoll之间的细胞层,主要是非心肌细胞;
40.5%percoll层;
位于40.5%percoll层与58.5%percoll之间的细胞层,大部分是心肌细胞,仅含少量非心肌细胞;
58.5%percoll层,含有纯度最高的心肌细胞,但量少;
7)将上面三层吸走,留下面两层,将离心管用培养基补满,1000rpm离心5min;
8)将培养基吸走,用新鲜的心肌细胞分化液重悬,接种到6孔板中;细胞置于湿润的培养箱中在5%co2和37℃条件下培养。
实施例2心肌梗死动物模型制作
在本实施例中,按照以下步骤构建心肌梗死大鼠动物模型。
1.动物准备
1)实验中选取8周龄的spraguedawley(sd)大鼠进行急性心肌梗死(acutemyocardialinfraction,ami)模型实验。建模前一周购买130只雌性大鼠,5只/笼;
2)动物移入动物中心时打耳标标记,大鼠急性心肌梗死造模手术前两天超声评价心脏功能,左心室射血分数(ejectionfraction,ef)小于55%的大鼠淘汰,总计淘汰5只。具体步骤如下:
用5%水合氯醛(9ml/kg)麻醉大鼠,理发器剔除胸腹部毛发,涂抹适量脱毛膏,等待约5min;
用湿毛巾擦拭涂抹脱毛膏区域,暴露超声操作区域;
用小动物超声vevo2000评价动物心功能;
超声测量心功能共三个时间节点:急性心肌梗死造模手术前2-5天、细胞移植前2天及细胞移植后4周。
2.急性心肌梗死造模
1)5%水合氯醛(9ml/kg)麻醉大鼠,理发器剔除胸腹部和颈部毛发,涂抹适量脱毛膏,等待约5min;
2)大鼠手术区适当喷洒消毒酒精,消毒酒精浸润的医用脱脂棉擦洗脱毛部位,仰卧位固定于手术台;
3)碘伏消毒皮肤,盖上手术盖布(医用纱布),调整位置,使手术部位刚好露出于纱布中间空洞处;
4)连接肢体导连,测心电图,术前心电图异常的动物淘汰,淘汰7只大鼠;
5)用眼科剪纵向剪开颈部皮肤,切口1cm左右,用眼科镊钝性分离肌肉和筋膜,暴露并剪开气管,行气管插管,呼吸机频率调至80bpm,呼气吸气比1:1,观察心电图的变化;
6)左侧3-4肋间用眼科剪剪开皮肤,眼科镊钝性分离皮下筋膜和肌肉,并用牵引线向两侧牵开肌肉;
7)用眼科弯镊钝性分离3-4肋间肌肉,然后用撑开器撑开胸廓,暴露左冠状动脉,在前降支发出分支后用7.0血管缝线结扎前降支;
8)观察心电图变化,结扎前降支后可观察到心电图st段抬高,t波高耸;
9)用无菌棉球吸尽胸腔内液体后关胸,2.0缝合线分别缝合肌肉和皮肤。
3.实验动物造模结果
实验准备130只sd大鼠,急性心肌梗死造模前淘汰5只ef值低于55%的大鼠。125只大鼠全身麻醉,肢体导联心电图发现有7只大鼠心电图异常,剩下118只大鼠行气管插管。然后打开胸腔并暴露左心耳和左心室前壁,可以在冠状动脉沟看到左冠状动脉干和前降支。7.0血管线结扎前降支中段,此时可以观察到肢体导联心电图qrs波、st段和t波异常,表现st段抬高与qrs波群相连,t波高耸(图3)。
实施例3.细胞移植
在本实施例中,如下在动物模型中进行细胞移植。
1.急性心肌梗死造模后6天,用超声评价造模后大鼠心脏功能,按照25%≤ef≤45%标准入组。总计43只大鼠入组。将大鼠随机分为四组:生理盐水组、matrigel(corning,356237)和心肌细胞混合移植组(m+cm)、海藻糖酸钠和心肌细胞混合移植组(a+cm)、透明质酸钠和心肌细胞混合移植组(h+cm)。
2.细胞移植前2天大鼠开始腹腔注射环孢素a(15mg/kg)。
3.水凝胶材料准备
称量海藻糖酸钠和葡萄糖酸钙,用超纯水分别配成浓度为4%和1.2%。海藻糖酸钠溶液经高压灭菌后分装并于4℃储存;葡萄糖酸钙用0.22目滤器过滤,然后4℃储存。
matrigel置于冰上解冻,并在冰上将其分装为30μl并于-20℃储存。
透明质酸钠用dpbs配成1%的浓度后置于4℃冰箱溶解至少24h。
海藻糖酸钠和细胞混合前,将海藻糖酸钠和葡萄糖酸钙按体积1:1混匀进行交联。
4.细胞准备
1)纯化的hesc-cm在移植前24小时换液,培养液为rpmi/1640+vn+4μg/l胰岛素+100ng/l胰岛素样生长因子(igf1)+0.2μm环孢素a,置于43℃培养箱中热休克处理30min,然后置于37℃培养箱中继续培养24h;
2)24小时后,弃培养上清,用pbs洗一遍,用accutase37℃消化20~25min,消化至细胞之间连接松散,加ctsknockoutdmem培养液,将细胞轻轻吹下,收集到15ml离心管中,1200bpm离心3min;弃去上清,加pbs重悬,用细胞计数仪统计细胞数;
3)1200r/min离心3min,弃去上清,按每只鼠注射25μl细胞悬液、细胞量为2×106加入培养液重悬细胞;培养液的配制如下:rpmi/1640+vn+4μg/l胰岛素+100ng/ligf+0.2μm环孢素a+50nmbcl-xlbh4+50μm吡那地尔;
4)将悬浮细胞和matrigel、海藻糖酸钠或透明质酸钠分别等体积混匀,置于4℃一小时内移植;
5)心肌梗死建模后第8天,将心肌梗死模型大鼠二次开胸手术,分离心脏表面粘连,暴露心脏梗死区,用胰岛素针将细胞悬液多点注射到梗死区和梗死周边区心肌层内;
6)检查是否有明显出血点,将胸腔的液体用无菌棉球擦拭干净,然后关胸。大鼠放置于37℃热毯上直至苏醒;
7)细胞移植后7天内大鼠腹腔注射环孢素a(15mg/kg),然后改为口服给药,保证每天能摄入15mg/kg的剂量。
以下表1显示了大鼠进行细胞移植后的存活情况。
表1实验大鼠细胞移植和存活情况
注:m,matrigel;a,海藻糖酸钠;h,透明质酸钠;cm,vn诱导分化的hesc-cms。
实施例4.心脏程序性电刺激
为了检测细胞移植后心脏电生理的稳定性,我们用心脏程序性电刺激(programmedelectricalstimulation,pes),评估细胞移植后各组大鼠心脏在电刺激下诱导下心率失常的情况。刺激方案具体如下:
1.细胞移植4周后,超声测量大鼠心功能,暴露大鼠的心脏,安放电极,将两根电极分别紧贴心尖和左心室高位侧壁;
2.将电极和刺激器相连,进行程序性电刺激,步骤如下:
将刺激器频率设为500bpm,施行s1s1刺激,先将刺激电压设为0,然后逐渐加大,直至大鼠心电图变为起搏心电图;
心脏有效不应期刺激:起搏心率停止后间隔5-10min,直至心电图恢复,然后将刺激电压设为起搏电压的2倍,开始刺激,心电图会出现代偿间期,找到最长有效不应期。参数如下:s1频率120ms重复8次后再增加一个额外刺激,其起始频率120ms,3ms递减;
s1s2刺激:完成有效不应期刺激后间隔5min,待心电图恢复正常后开始刺激,如果没有诱发性心律失常,则间隔5min后s1s2刺激。刺激参数如下:s1频率120ms,s1s2间期为最长有效不应期加10ms,重复刺激3次;
s1s2s3刺激:完成s1s2刺激后间隔5min,待心电图恢复正常后开始刺激,s2s3间期为s1s2间期,重复刺激3次。如仍没有诱发性心律失常,则间隔5min后开始s1s2s3s4刺激,s3s4间期同s2s3,重复3次;
首先找到大鼠心脏最长有效不应期(图4a),然后在8个s1s1刺激后添加一个额外刺激,其时间间隔是最长有效不应期基础上加10ms。结果,我们在四组大鼠中均发现了室性心动过速的诱导性心律失常(图4b)。其中,细胞移植组中透明质酸钠发生率最低(表2)。
表2.各组中程序性电刺激诱发心律失常的比例
实施例5.细胞共移植后在大鼠心脏组织内的存活
完成心脏程序性电刺激后取材,检测移植hesc-cms在大鼠心脏组织中的存活情况。检测步骤如下:
1.组织取材
1)用自制灌流装置盛装250ml生理盐水,调节流速适中;暴露大鼠的心脏,手术操作过程见急性心肌梗死手术;
2)将针头从心尖扎入左心室,剪破右心房并打开水龙头缓慢冲走血液;
3)注射10%kcl使心脏在舒张期停跳;
4)生理盐水灌流完成后加200ml4%pfa继续灌注;
5)灌注完成后用眼科剪取下心脏,剪去心房和右心室,剩下左心室放入液氮速冻,然后置于可以固定左心室的模具中将其切成5个环状组织。将梗死区域所在组织置于4%pfa4℃保存,其它组织置于-80℃冰箱保存。
2.心脏组织石蜡切片与免疫组织化学染色
1)心脏组织样品4%pfa过夜后取出,用刀片修正样品使组织切开光滑,并将样本编号;
2)切片脱水、二甲苯置换、石蜡置换、石蜡包埋、石蜡切片,取15-25cm切片条带用毛笔转移到43℃水浴中贴片;
3)免疫组织化学染色后,加适量防荧光淬灭剂,中性树脂封片;
4)激光共聚焦显微镜获取染色图像,用lasaflite3.1.3(leica)软件进行分析。
石蜡组织切片用ctnt和人中心粒特异性抗体(znf397)原位共染。在三组细胞移植组中找到了双阳性的细胞(图5),表明hesc-cms移植到大鼠体内后能存活。
实施例6.大鼠左心室收缩功能检测
在本实施例中,检测了细胞和材料共移植后,对急性心肌梗死模型大鼠左心室收缩功能的影响,其代表了细胞和材料促进心功能恢复的能力。
在生理盐水对照组中,实验终止点时心功能明显下降,ef值从36.23±7.14%下降到32.94±10.96%。m-cm、a-cm、h-cm这三组的ef均有改善,分别从细胞移植前的36.06±3.39%、34.25±5.22%及35.12±5.84上升到39.55±12.12%、35.82±5.18%及40.33±7.41%(图6a)。三组细胞移植组和生理盐水相比,大鼠心脏ef均有改善。
用t检验统计分析了每组大鼠在细胞移植治疗前后的δef(实验终止点和细胞移植前ef值之差)和对照组之间的差异,结果显示三组实验结果与生理盐水相比均有差异性(图6b)。然后,将四组实验数据用onewayanova统计分析,结果显示总体有差异性,p值为0.009;但是tukey′smultiplecomparisontest时仅h-cm和生理盐水组之间有差异性(图6c)。数据均采用graphpadprism5.01统计软件进行数据分析,统计分析方法为one-wayanova,t检验,用均数加减标准差(mean±sem)显示,*p<0.05表示有统计学意义,**p<0.01,***p<0.001表示差异显著。
这些结果表明,细胞和材料共移植后能够阻止大鼠急性心肌梗死后心功能进一步恶化。其中,透明质酸钠和细胞共移植后能有效改善模型大鼠的心功能。
实施例7.大鼠左心室重构病理变化
在本实施例中,检测了细胞和材料共移植后,对急性心肌梗死模型大鼠左心室重构的病理改变的影响。
心肌梗死后左心室会发生重构,梗死区域瘢痕化,左心室内径在收缩末和舒张末增大,随着这种病理改变不断加剧,左心室最后出现心衰。因此,检测了大鼠在细胞和材料共移植后左心室重构相关参数的变化。
结果显示,生理盐水和m-cm这两组实验大鼠左心室舒张期/收缩期末内径和左心室容积均明显增大,左心室重构加剧。h-cm实验组左心室内径和容积在左心室舒张期末内径有所增加,但是增加程度相对于生理盐水和m-cm要轻,同时在收缩期末其相关参数增加不明显,表明左心室收缩功能增强。a-cm组在舒张期/收缩期末相关参数均没有明显变化,有效的延缓了左心室重构的病理改变(表3和图7)。使用onewayanova统计分析左心室重构参数数据,发现左心室收缩期末左心室内径在四组数据之间有差异性(p=0.049)(图7b)。上述结果表明,透明质酸钠或海藻糖酸钠与cms共移植后有效延缓或阻止了大鼠急性心肌梗死后左心室重构的病理变化。
表3左心室内径和容积数据
实施例8.大鼠左心室短轴缩短率和心室面积变化
在本实施例中进一步统计分析了左心室短轴缩短率(fs)和心室面积变化分数(fac),其均为评价心功能的重要指标。
生理盐水组大鼠的fs在生理盐水注射后4周下降,从移植前18.15±3.93%下降到16.51±5.9%。三组材料细胞共移植组fs在移植后4周均有改善,其中以透明质酸钠和细胞共移植后改善最明显,从移植前17.54±3.28%增加到移植后4周的20.66±4.30%,m-cm和a-cm两组仅轻微改善,分别从移植前的18.02±1.87%、17.02±2.88%上升到19.87±7.74%和17.88±2.83%(图8a)。统计δfs时发现,四组总体上差异性明显(p=0.013),tukey′smultiplecomparisontest时仅h-cm和生理盐水组之间有差异性(图8b)。我们将四组实验数据每两组之间做t检验,仅有生理盐水和h-cm两组之间有差异性(p=0.0065)(图8c),其它每两组之间均没有差异性。
心室面积变化分数(fac)是评价心功能的另一个重要指标。超声数据显示,生理盐水、m-cm和a-cm三组大鼠的fac在心肌注射后4周均下降,但注射前和注射后4周之间没有明显的差异(图9a)。h-cm组的fac有改善(图9b)。
fs和fac相关数据表明,透明质酸钠和心肌细胞共移植后能有效改善大鼠心功能。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



