可用于致密结缔组织的医用黏合剂的制作方法
 2021-01-08 10:01:01|
2021-01-08 10:01:01| 340|
340| 起点商标网
起点商标网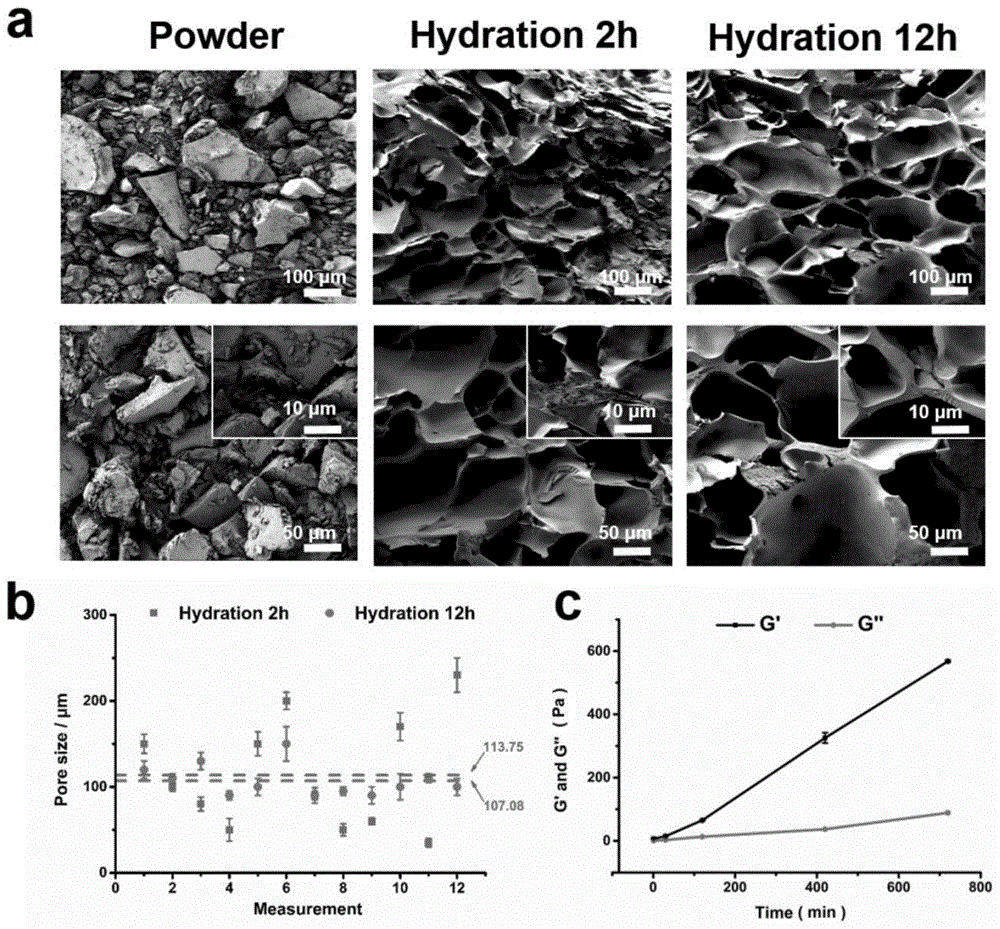
本发明属于生物材料领域,涉及一种利用天然成分做为原料制备的黏合剂,具体涉及可用于致密结缔组织的医用黏合剂。
背景技术:
肌腱和韧带是纤维结缔组织所组成的致密且坚韧的条带组织结构,其通常将肌肉与骨骼相连。肌腱的实例包括将小腿肌肉与跟骨相连的跟腱,以及将膝盖骨与胫骨相连的髌腱。韧带的实例包括位于关节腔周围的囊外韧带,和位于关节腔内的囊内韧带。
肌腱和韧带的损伤是常见的骨科问题。许多途径都可以使肌腱或韧带受到损伤,包括过度使用、扭伤、疾病和一般老化,等。随着人类寿命的延长与越来越多的中年人参与运动或者剧烈运动,肌腱损伤和韧带损伤的发病率正逐年增高。
目前对于肌腱或韧带的断裂或撕裂,通常使用缝合等外科方法治疗。因为缺少血供等原因导致肌腱或韧带损伤后易并发感染且愈合缓慢,目前没有一种手术方案能使受损的肌腱或韧带恢复到正常的组织结构和机械强度,所以肌腱损伤或韧带损伤在临床上仍是一个严重的并且悬而未决的问题。
肌腱损伤可以分为急性和慢性损伤,其原因包括内在或外在的因素,无论是内在因素或内外因素组合都会引起肌腱损伤。肌腱损伤主要发生在运动和工作场所,这通常会导致患处疼痛、僵硬和肌腱强度损伤。跟腱和髌腱损伤是最常见的两种运动肌腱损伤。
肌腱损伤难以修复。肌腱愈合的发生可以分为三个阶段。在初始的炎性反应阶段,红细胞和炎症细胞,特别是噬中性细胞,进入到损伤部位。然后,肌腱细胞将逐渐迁移到伤口,iii型胶原蛋白的合成也在此阶段被启动。过了几天,增生期开始。iii型胶原在此阶段的合成达到峰值,并将持续数周。约六周后重塑阶段开始,期间细胞构成降低、胶原蛋白减少,并且开始合成糖胺聚糖。然而,愈合后肌腱组织的生化和机械性能仍于那些完好的肌腱相差甚远。
以现有的医疗手段,肌腱损伤会产生长期的不健全状态,且无论采用什么样的护理方法,其造成的残疾可能会持续数月。现有的用于肌腱病症的治疗管理手段,只有少数临床对照试验已经完成。大多数手段仍然属于临床前的研究,并且有些治疗手段的结果具有争议。在大鼠的由胶原酶诱导的跟腱炎模型中,体外冲击波治疗已被证明通过诱导tgfβ1(transforminggrowthfactor-beta,转化生长因子-β)和igf-i(insulin-likegrowthfactor1,胰岛素样生长因子1)的表达促进肌腱的愈合;在大鼠跟腱炎模型,17赫兹脉冲磁场和电磁场可以提高胶原纤维的排列;此外,某些细胞因子和生长因子例如tgf-β和igf-i,以及基因治疗和组织工程用的间充质干细胞(mesenchymalstemcell,msc)被用于肌腱损伤的治疗,并表现出较好的前景。但生长因子的价格昂贵并且容易降解,给患者带来很大的经济负担。
跟腱撕裂是临床常见的肌腱撕裂病症之一,跟腱断裂发病率为(6-37)/105,其中约3/4的病例与体育运动有关。跟腱长约15cm,由小腿三头肌的肌腱融合形成。是人体最粗大最强壮的肌腱,是小腿肌肉力量传导至足部的最主要的解剖结构。如果单侧跟腱断裂,患者会出现跛行,如果双侧跟腱均断裂,则不能行走。临床常见的跟腱自发性断裂一般发生在单侧肢体。这种断裂可以在跟腱-跟骨连接部,也可以在跟腱-肌腹连接处或是跟腱组织本身。70%以上的自发性断裂在运动时发生,例如在进行羽毛球、篮球、足球、网球等球类运动或跑步等田径运动。跟腱断裂一般不会出现明显的疼痛,但会立即出现跛行和不能单足提踵,以后逐渐出现足跟上方的肿胀淤血。临床上亦常见外伤性跟腱断裂,多因铁锹等锐器直接切割伤造成跟腱开放性断裂,皮肤伤口与跟腱断裂都在同一水平。此外,如果跟腱本身存在病理改变,则易于受外力牵扯而断裂。所述病理改变包括:经过可的松封闭,或职业性运动伤造成小血管断裂,导致肌腱营养不良,发生退行性改变和跟腱钙化等。外力牵扯包括:踝关节处于背伸位时用力跳起,小腿三头肌突然猛力收缩等。
利用医用黏合剂对肌腱或韧带进行粘合治疗以替代缝合治疗方法,目前未见报道。临床上广泛应用的替代缝合法的组织黏合剂主要包括氰基丙烯酸酯和血纤维蛋白。氰基丙烯酸酯有明显的细胞毒性,黏固过程中因为剧烈的氧化还原反应产热,黏固后出现显着的刚性和难降解等缺陷,使其难以应用致密结缔组织的愈合;产热、细胞毒性和动物实验中的致瘤性限制了其进一步应用。而血纤维蛋白虽在美容缝合中可与缝线搭配使用,以减少缝针的次数和瘢痕增生,但因为其固化缓慢,机械强度差,很难用于肌腱或韧带的粘合。
用于致密结缔组织的黏合剂,除了需要具备较强的黏合性外,由于肌腱或韧带组织会随着人体活动而不断受力,因此必须具备抵抗张力的效果。此外,基于术后恢复的角度考虑,所使用的黏合剂必须具有良好的生物相容性,易于被组织吸收和较高的生物安全性。可见,临床上缺乏供应充足,生物兼容性好,粘结强度高,且易于生物降解的用于致密结缔组织的黏合剂。
大鲵(andriasdavidianusblanchard)为大型两栖纲、有尾目、隐鳃鲵科,俗名“娃娃鱼”,属国家二级保护动物。大鲵在遇到电刺激或机械擦刮等外部刺激时,身体表层会分泌出一种黏液。目前有研究成果显示可以利用大鲵黏液制备黏合剂。关于利用大鲵黏液制备黏合剂,中国发明专利申请公告第cn104815349b号中公开一种大鲵黏液制备黏合剂的方法,其中仅初步说明大鲵黏液经过γ射线消毒后用于制造黏合剂的黏合性能,未对这种方法产制出的大鲵黏液冻干粉有任何材料学描述及检测。此外,中国发明专利公开第cn106581736a号仅简单说明一种制造大鲵黏液冻干粉末的方法,缺乏科学实证支持该方法带来的效果。将大鲵黏液用于制备致密结缔组织的黏合剂,目前未见报道。
技术实现要素:
综合上述现有技术的缺陷,本发明提供使用大鲵皮肤受刺激后分泌的粘液(简称大鲵粘液)制成的医用黏合剂,以解决前述的技术问题。本发明提出的可用于致密结缔组织的医用黏合剂是使用所述大鲵粘液为原料,经过适当的工艺制成符合临床使用要求的冻干粉状制剂,用于对部分撕裂或完全撕裂的致密结缔组织进行黏合,有助于部分撕裂或完全撕裂的创口愈合。所述的致密结缔组织包括肌腱和韧带。本发明提出的可用于致密结缔组织的医用黏合剂,具备较好的安全性、较好的生物兼容性、可降解、促再生效果,是满足致密结缔组织黏合及治疗需求的理想材料。
为解决上述技术问题,本发明采用的技术方案是提供可用于致密结缔组织的医用黏合剂,其主要含有大鲵粘液冻干粉,与水性溶液混合后可以迅速产生物理化学交联,形成水凝胶。
所述可用于致密结缔组织修复的医用黏合剂的制备包括如下步骤:制备大鲵粘液冻干粉,从活体大鲵皮肤采集粘液,将所述粘液冷冻干燥;将冷冻干燥后的所述粘液粉碎,得到粒径符合要求的粘液冻干粉;对所述大鲵粘液冻干粉进行灭菌,保存备用。
所述水性溶液可以选用纯水或含有生物相容性物质的水溶液,且所述生物相容性物质不应导致所述大鲵粘液中的活性有效成分失活或影响所述成胶。优选的,所述水性溶液可选自以下任意一种或多种:蒸馏水、去离子水、生理盐水(nacl缓冲液)、磷酸盐缓冲液(pbs)、tris缓冲液(tbs)、柠檬酸盐缓冲液、2%氯己定、人类全血、富血小板血浆(prp)、富血小板血浆纤维蛋白(prf),治疗时伤口附近渗出的血液或组织液亦可成为所述水性溶液的一部分。
附图说明
图1表示本发明实施例2成胶后不同时间(2h和12h)的凝胶孔径分布。
图2a表示本发明实施例3的实验组和两种常见商用市售医用黏合剂:氰基丙烯酸酯(商用胶)和纤维蛋白胶(生物胶)的体外粘附性能比较,其中以猪皮为生物基质,做标准伤口闭合检测水凝胶的粘附强度(n=4):改良的粘附强度标准试验方法(astmf2458-05)示意图(i);有代表性的应变-应力曲线(ii);不同组别黏附强度的定量比较(iii)(统计上的差异:**p<0.01,***p<0.001)。
图2b表示本发明实施例3的实验组和两种常见商用市售医用黏合剂:氰基丙烯酸酯(商用胶)和纤维蛋白胶(生物胶)的体外粘附性能比较,其中以猪皮为生物基质,进行猪皮下脂肪面黏附后的剪切强度测试:改良的剪切试验标准方法(astmf2255-05)示意图(i);有代表性的应变-应力曲线(ii);不同医用黏合剂黏附强度的定量比较(iii)(统计上的差异:**p<0.01,***p<0.001)。
图2c表示本发明实施例3的实验组和两种常见商用市售医用黏合剂:氰基丙烯酸酯(商用胶)和纤维蛋白胶(生物胶)的体外粘附性能比较,其中以猪皮为生物基质,采用三点弯试验法测定猪皮肤经过水凝胶粘结后的弹性和延展性:改良三点弯曲实验法检测猪皮肤粘接后弹性和延展性的示意图(i);具有代表性的应变-位移曲线(ii);不同医用黏合剂在固定形变(11.5%)需要荷载力的定量比较(iii)(统计上的差异:*p<0.05,**p<0.01,***p<0.001)。
图3表示本发明实施例4,体内降解的组织学分析。
图4表示本发明实施例7,手术18天后同一只大鼠治疗组与对照组he切片染色照片。
图5是sd大鼠最大脚印长度对比图片。最大脚印长度:爪子触地的最大长度。脚印长度越短,愈合越良好。由图可知正常脚印长度短于手术后的脚印长度,说明肌腱损伤后,因为无力足弓塌陷。
图6是sd大鼠步长图片。步长(stridelength):同一爪子连续两个脚印中点之间的距离,步长越大说明愈合越好。如图6显示实验组比对照组要长。
图7是步行周期中的站立时间。站立时间:是指爪子在一个步行周期中爪子接触地面的时间。
图8,是手术28天后,实验组与对照组大鼠右后腿he切片染色照片。
具体实施方式
为了使本发明的目的、技术特征及优点,能更为相关技术领域人员所了解,并得以实施本发明,在此配合所附的附图、具体阐明本发明的技术特征与实施方式,并列举较佳实施例进一步说明。以下文中所对照的附图,为表达与本发明特征有关的示意,并未亦无需依据实际情形完整绘制。而关于本案实施方式的说明中涉及本领域技术人员所熟知的技术内容,亦不再加以陈述。
本发明提供可用于致密结缔组织的医用黏合剂以及制备此医用黏合剂的对应方法。本发明提供之可用于致密结缔组织的医用黏合剂的制备方法包括以下步骤:步骤a,从活体大鲵皮肤采集粘液,将粘液冷冻干燥;步骤b,将冷冻干燥后的粘液粉碎及过筛,得到所需粒径范围的大鲵粘液冻干粉;步骤c,对所述大鲵粘液冻干粉进行灭菌得到可用于致密结缔组织的医用黏合剂。
为达成良好的黏合、抗剪切等总体效果,大鲵粘液冻干粉的粒径选择小于1000μm,优选为10-300μm之间。
本发明提供的可用于致密结缔组织的医用黏合剂,利用大鲵粘液冻干粉及水性溶剂混合成胶后对致密结缔组织进行粘合。所述成胶指的是当所述大鲵粘液冻干粉与水性溶液混合后,会改变大鲵粘液冻干粉由氢键驱动的纠缠蛋白网络,形成凝胶体的过程。在成胶过程中,多肽交联网络膨胀而不是溶解,多肽链的氨基酸残基发生构象转变,形成类似凝胶的黏合剂,酚醛羟基和氨基作为氢键供体向高表面能或亲水界面转变,通过氢键和范德瓦尔斯力促进生物粘附。另外,苯环在接触低表面能或疏水界面时,会通过π-π电子或阳离子-π相互作用与基底形成强烈的相互作用。鉴于致密结缔组织的伤口界面富含蛋白质等细胞外基质,因此在成胶时需要选择合适的粉水比率(大鲵粘液冻干粉与水性溶剂的重量比),所述水性溶液和伤口组织中细胞间质液发生协同作用,使得可用于致密结缔组织的医用黏合剂与伤口之间通过氢键和范德华力形成最佳的粘附力。
由上可知,出于本发明的目的,所述水性溶液可以选择纯水亦可选择含有生物相容性物质的水溶液,所述生物相容性物质的选择和添加剂量以不会导致大鲵粘液中的活性有效成分失活和并不影响成胶为限。伤口所渗出的血液、组织液亦可作为所述水性溶液。
由上可知,出于本发明的目的,步骤3所述的灭菌方法的选择应以不会导致大鲵粘液中的活性有效成分失活和并不影响所述大鲵粘液冻干粉成胶为宜。
实施例1,可用于致密结缔组织修复的医用黏合剂的制备
步骤a,从活体大鲵皮肤采集粘液。步骤a之取得粘液方法,应严格按照中国的动物保护法进行,无须杀害大鲵亦不应造成大鲵的永久残疾。可采用机械刺激法或者电刺激法,以获取大鲵粘液,并将大鲵黏液搜集备用。
所述步骤b,将收集到的大鲵粘液制成冻干粉。在采集之后应尽快冻干,从完成采集到开始冻干的时间以不超过1h为宜。冻干的速度设定为每小时下降10~15℃,在4h内温度降到-20℃。随后粉碎得到细粉,去除粒径不符合要求的所述细粉,得到粉末粒径不超过一定范围的大鲵粘液冻干粉。出于本发明的目的,大鲵粘液冻干粉的粒径均匀且粒径不超过1000μm为佳,优选的粒径为10-300μm,以达成更好的黏附效果。推荐使用目数大于60目的筛子过筛,以得到粉末粒径不超过300μm的大鲵粘液冻干粉。为避免未经灭菌处理的大鲵黏液冻干粉由于长期储存而导致变性和细菌滋生,可以置于密闭容器内,亦可储存在低于-20℃的冰箱备用。
步骤c,大鲵粘液冻干粉灭菌处理。大鲵粘液冻干粉的灭菌与消毒是将制品应用于临床使用的重要步骤,攸关施用在病患上的安全性和性能。
根据当前的技术,大鲵粘液冻干粉的消毒灭菌方法可以采用低温、紫外线、辐照(例如γ射线)灭菌为主,然而,这些方法在临床安全上仍有缺陷。辐照会破坏和改变生物大分子的结构,导致大鲵粘液相关产品的黏附性能降低。且辐照方法由于涉及放射性物质,其使用受到法律的限制与管控,大规模工业应用的门槛较高。采用低温、紫外线虽可以满足本发明实验室研究的黏附强度需要,但是其灭菌不完全。致密结缔组织供血不足,如果灭菌不完全,其导致感染的风险大于皮肤或皮下组织。因此治疗致密结缔组织需要采用杀菌更彻底的灭菌方法。优选的,本实施例对大鲵粘液消毒灭菌的方法采用环氧乙烷灭菌法,实验表明此方法既能完善消毒亦能保有本发明医用黏合剂的优异黏附性能。
承前述技术方案,根据本发明的优选实施方式,依据《gb18279-2000“医疗器械环氧乙烷灭菌确认和常规控制”》执行环氧乙烷灭菌法。具体灭菌步骤包括:将所述大鲵粘液冻干粉封装入环氧乙烷专用灭菌包装袋中,或装入开口容器并在容器口疏松塞入棉球后封装入环氧乙烷专用灭菌包装袋中。将该灭菌包装袋放入环氧乙烷(eo)灭菌容器,使用环氧乙烷浓度(30%),组成成分:70%co2+30%eo,灭菌时间为48小时,灭菌温度不加限制。随后将完成灭菌的大鲵粘液冻干粉放置48小时。最后,参考《gb/t16886.7-2001“医疗器械生物学评价”》第七部分:“环氧乙烷灭菌残留量评价环氧乙烷的残留”检验环氧乙烷残留率。检验合格后,即完成整体灭菌步骤。
若无特别说明,以下各实施例所使用的所述大鲵粘液冻干粉(ssad)均为通过上述步骤所得到。将上述检验合格的大鲵粘液冻干粉与所述水性溶液混合,即可得到可用于致密结缔组织的医用黏合剂。
实施例2:不同水性溶液的成胶效果
本实施例使用10毫米长和5毫米深的聚二甲基硅氧烷(pdms)模具测试本发明所提供的可用于致密结缔组织修复的医用黏合剂与不同水性溶液的成胶性。在室温环境下,分别取1份本发明实施例1所得到的大鲵粘液冻干粉(ssad),分别与不同种类及不同重量份数的水性溶液混合。水性溶液种类与份数见下表1。
表1:本实施例中大鲵粘液冻干粉与水性溶液的重量比
将ssad与不同体系的水性溶液混合后发现,在表1中提及的各水溶液体系中,当ssad和上述水性溶液的质量份数在表格范围内,均可成胶。将混合后的液体缓缓倒入模具内,在室温下静置3分钟以上直到其成胶后形成均匀凝胶状。以扫描电子显微镜(hitachi,s-3400nii,japan)分析本实施例所得到的医用水性黏胶,发现其内部呈现多孔结构。图1为水性溶液选用pbs的电镜照片(图1a)和成胶后不同水化时间的孔洞结构对比(图1b),凝胶化12小时后的孔洞结构中,空洞结构均质性增大,明显大于凝胶化2小时后的侧壁,最后达成的孔洞直径在20-300μm之间,主要孔洞直径在75-150μm之间,平均直径约为110μm。表明随着凝胶化时间的增加,多孔结构更加明显,孔洞尺寸更加均匀。
实施例3:对于组织粘附强度的体外测定
本实施例主要依据astm(美国测试与材料协会)标准进行测试,其中因应材料和操作环境不同做出的改良,应为本领域技术人员可理解且可接受,不再赘述。本实施例使用万能试验机(mtscriterion,model43,usa)进行实验室剪切试验,实验组使用实施例1制备的大鲵粘液冻干粉,对照组分别采用市售商用的传统医用黏合剂氰基丙烯酸酯(cyanacrylate,baiyunmedical
实验组粘接时,先将所述大鲵粘液冻干粉涂在猪皮上,用移液枪加入少量pbs,将猪皮与另一猪皮覆盖,使所述大鲵粘液冻干粉和pbs成胶。对照试验则根据制造商的说明使用氰基丙烯酸酯和纤维蛋白胶,分别按照前述的两种方式黏接猪皮。粘接两小时后,在万能试验机上测试粘接部位的粘接能力和弹性和延展性。用100n测力传感器以1mm/min的速度将粘结样品加载至完全分离。
粘附能力和抗剪切能力测试,并与现有的二种医用黏合剂氰基丙烯酸酯合成胶和纤维蛋白胶进行了比较,结果显示本发明的可用于致密结缔组织的医用黏合剂在不同的基质上表现出巨大的差异。
采用搭接剪切试验,根据astmf2255-05标准确定水凝胶的抗剪强度,如图2a中的i图所示。切口边缘对切口边缘粘接形式(如图2a中的i图所示)的抗剪切粘附能力,在氰基丙烯酸酯黏合剂对照组可能达到30.30±5.43kpa,而在实验组是21.82±2.23kpa,纤维蛋白胶对照组的粘附强度只有3.76±0.16kpa(如图2a中的ii图及iii图所示)。与纤维蛋白胶对照组相比,实验组的粘合强度(p<0.05)和氰基丙烯酸酯对照组的效果差异(p<0.01)有显著统计意义。纤维蛋白胶的低粘接性能符合其使用说明:纤维蛋白胶不是单独使用而是需要配合使用缝合线。需特别说明的是,虽然氰基丙烯酸酯粘接能力最强,但只有表皮层能够粘合,皮下脂肪层不能粘合(图未示出)。相比之下,在粘附皮下脂肪至皮下脂肪时(如图2b中的i图所示),实验组的粘附能力明显优于氰基丙烯酸酯粘结剂和纤维蛋白胶。
根据如图2b中的ii图及iii图所示,实验组在皮下脂肪的粘附能力有显着的抗剪切粘附能力,剪切黏附力约为37.62±6.52kpa,而两个对照组的剪切粘附力则小于5.0kpa。
弹性和延展性对比测试。三点粘合测试在猪皮中间做2厘米切口(如图2c中的i图所示),当得到相同的位移,实验组只需要8.34±1.16n,类似于纤维蛋白胶对照组(6.99±0.99n),但显著低于氰基丙烯酸酯黏合剂对照组(16.33±1.53n)(如图2c中的i图及iii图所示)。
以上数据说明本发明的可用于致密结缔组织的医用黏合剂的粘接性能更适合用作致密结缔组织胶粘剂。对照组所使用的2种黏合剂并不适用于粘合致密结缔组织。
实施例4:体内降解的评估和效果
在深吸入异氟醚全身麻醉下,sd大鼠俯卧位,背部无菌准备手术。在脊柱轴外的备皮肤切口(3厘米),和底层皮下组织分离为水凝胶提供足够的空间,将100毫克实施例1所得到的大鲵粘液冻干粉与100μlpbs混合成胶后,将得到的凝胶植入皮下空间,植入后缝合关闭皮肤。术后3、7、14天收集周围组织及全皮肤进行组织学分析,评估降解效果。
如图3所示。凝胶在体内植入3、7和14天后,h&e染色显示出轻度炎症反应(图3a.b)。植入3天后,在植入的凝胶最外层观察到中度急性炎症反应,有典型的炎性细胞染成深蓝色(即图3中颜色相对较深的细胞)。植入7天后,凝胶结构开始失去完整性,几乎被侵入的炎性细胞所填满,几乎没有观察到纤维囊,说明宿主对所植入凝胶的反应较弱。此外,植入14天后,植入部位几乎没有凝胶残留,皮肤结构与空白对照一样正常,说明本发明的可用于致密结缔组织的医用黏合剂在体内可以完全降解。
使用淋巴细胞(cd3)和巨噬细胞(cd68)标志物染色可以发现,植入后第3天,在凝胶移植物周围淋巴细胞浸润率为0.23±0.06%,仅见少量巨噬细胞浸润(图3.c);巨噬细胞浸润在第7天达到最大值(3.21±0.87%);随着时间的推移,淋巴细胞和巨噬细胞的浸润的数量都减少,到第21天几乎完全消失(图3c-图3e);这一观察结果证明凝胶具有良好的生物相容性,在体内可完全降解且几乎无刺激性,未见明显的免疫排斥反应。
实施例5:体内生物兼容性的评估和效果
用本发明实施例2的多例不同水性溶液和不同粉水比例的水凝胶植入大鼠的创口35天后,取大鼠心脏、肝脏、脾脏、肺、肾进行组织学分析,评价生物兼容性。采集血样进行血生化分析(乳酸脱氢酶(ldh)、血尿素氮(bun)、丙氨酸转氨酶(alt)和天冬氨酸转氨酶(ast)以评估本发明可用于致密结缔组织的医用黏合剂对于生理数值的影响。
在治疗期间和随后的观察(损伤后第35天)中,未观察到对大鼠总体健康或行为的影响。此外,h&e染色对心脏、肝脏、脾脏、肺和肾脏的组织学检查没有发现任何系统性损伤。此外,还对大鼠的肾脏(血尿素氮)和肝脏(谷草转氨酶、谷丙转氨酶)以及一般损害(乳酸脱氢酶)的毒性作用进行了评估。这些参数与对照组相比均在正常参考值范围内,提示本发明可用于致密结缔组织的医用黏合剂治疗后各主要器官无明显损伤。
实施例6:不同灭菌方法的评估
依据临床安全性需求,本实施例对不同灭菌方法进行比较。
实验组参考《gb18279-2000“医疗器械环氧乙烷灭菌确认和常规控制”》执行具体灭菌步骤:本实施例1所得大鲵粘液冻干粉封装入环氧乙烷专用灭菌包装袋中,或装入开口容器后,容器口疏松塞入棉球,封装入环氧乙烷专用灭菌包装袋中。将该灭菌包装袋放入环氧乙烷(eo)灭菌容器,温度为常温,使用环氧乙烷浓度(30%),组成成分:70%co2+30%eo,灭菌后在室温25℃下放置48小时后备用。在灭菌后参考gb/t16886.7-2001“医疗器械生物学评价”第七部分:环氧乙烷灭菌残留量评价环氧乙烷的残留(残留率应≤10ppm)完成检验合格后,即完成整体灭菌步骤。
对照组分别采用低温灭菌、紫外线灭菌以及辐照灭菌。其中低温灭菌的温度和冷冻时间分别为:低温灭菌,-20℃,24小时;-50℃,24小时;-80℃,24小时;液氮,24小时。紫外灭菌所使用的紫外线波长为280~400nm,照射时间为24小时。辐照杀菌使用的放射源为钴-60,辐照强度为600~1000千拉德,照射时间为120分钟。
灭菌结束后采用测试灭菌效果:采取平板涂布后菌落计数的方法。取1000倍无菌生理盐水稀释样品,以涂布法接种于平板,经过24小时的培养之后,直接统计平板上的菌落数(cfu);并且采用本发明实施例3所述的方法测试粘结性:在万能试验机上测试粘接部位的粘接能力,用100n测力传感器以1mm/min的速度将粘结样品加载至完全分离。每种灭菌方法分别进行5个样品的实验,取其平均值如表2所示。
结果显示,采用钴60γ射线消毒,虽可满足灭菌要求,但γ射线对大鲵粘液冻干粉中所含蛋白质和多肽产生变性,对粘附性影响较大,无法满足后期的粘附强度。采用环氧乙烷消毒方法,其灭菌效果优于以往常用的低温灭菌(-20℃、-50℃、-80℃、液氮)、紫外线,等消毒方法,并能兼顾良好粘合性能。
表2不同灭菌方法效果比较
实施例7:本发明对肌腱治疗效果评估
采用sd大鼠为实验动物,其中正常组采用不进行任何手术的正常大鼠;实验组在切断跟腱后采用本发明的可用于致密结缔组织的医用黏合剂进行治疗;对照组在切断跟腱后采用pbs(磷酸缓冲盐溶液)处理,任其自然愈合。
选用3月龄spf级雄性sd大鼠20只(重庆医科大学实验动物中心提供),体重(280±30)g。适应性喂养7d。根据已经建立好的大鼠跟腱离断缺损模型,任选大鼠一条后腿为实验组(例如右后腿),切开皮肤分离出腱鞘膜(图4.a)。暴露跟腱和跖肌腱(图4.b)。切断跟腱,为了防止内固定,跖跟腱也要切除(图4.c)。腱鞘膜可以增强生长因子促跟腱愈合能力,在切断肌腱及缝合时注意不过度损伤(图4.跟腱离断手术步骤)。
将大鼠随机分为实验组和对照组,每组各10只,以上述手术方法切断跟腱。实验组采用实施例1所得到的可用于致密结缔组织的医用黏合剂治疗:取大鲵粘液冻干粉10mg置于肌腱断端(图4.d),与30微升pbs混合形成水凝胶包绕跟腱断端(图4.e),关闭创面(图4.f)。空白对照组采用30微升pbs滴注跟腱断端后关闭创面。
术后所有动物自由摄水及摄食(标准饲料,含钙1.33%,磷0.95%),在室温25~28℃,湿度75~80%清洁级环境中喂养。在术后第28天采用小动物步态仪分析术后各组大鼠的运动情况,并取部分样品进行力学测试(n=6),剩余部分肌腱进行固定处理,之后进行石蜡切片和he及masson染色等。
对比实验组和对照组的肌腱强度。力学测试的方法按照以下方法进行。首先,分离出完整的肌腱组织,用两个并在一起的手术刀片沿肌腱组织上下各5mm的安全距离切掉周边的原有肌肉组织而保留所有肌腱组织。将带有5mm肌肉的两端固定在万能试验机(mtscriterion,model43,美国)。力学测试所用的参数为15毫米/分钟,当到达新生肌腱组织所能承受的最大力时肌腱发生断裂,此时机器会记录力与位移的曲线。根据最大拉力和预先测得的新生肌腱组织的横截面积计算出最大断裂强度(以n/mm2为单位);杨氏模量则可以根据曲线的斜率计算得到。
力学测试显示,实验组比对照组有更大的断裂拉力(实验组:25.5±8.2n,对照组:13.8±3.9n);更大的断裂强度(实验组:2.8±1.1mpa,对照组:0.9±0.2mpa);更大的刚度(实验组:17.7±7.5n/mm,对照组:6.9±1.2n/mm)。说明本发明的可用于致密结缔组织的医用黏合剂可以提高愈合跟腱强度,减少再次断裂的风险。
对比实验组、对照组和空白组的跑步态仪。其中实验组和对照组的动物模型均为左后腿正常,右后腿手术。空白组的左右腿均未进行手术。使用啮齿类小动物跑步仪(诺达思,catwalk,荷兰)评估术后大鼠的行动能力。
测定最大脚印长度、步长、健侧腿步行周期中的站立时间%、手术侧腿(实验组或对照组)步行周期中的站立时间%、移动速度、速度变化率、爪子摆动速度、步行周期、单只腿站立时间、站立时间等指标,实验组与对照组每组分别测量10只大鼠,取平均值。根据已有文献报道和健侧与术侧指标对比,跟腱愈合良好的表现为:最大脚印长度减小、步长增加、健侧和手术侧后腿的步行周期中的站立时间%减小、移动速度增加、速度变化率减小、爪子摆动速度增加、步行周期减小、单只腿站立时间增加、站立时间减小。本次实验结果发现,最大脚印长度(图5)为实验组(3.16±0.23cm)<对照组(3.54±0.059cm)、步长(图6)为实验组(14.90±0.89cm)>对照组(11.64±0.77cm)、健侧腿步行周期中的站立时间%(图7)为实验组(73.16±2.89%)<对照组(83.58±3.38%)、术侧步行周期中的站立时间%为实验组(72.15±3.44%)<对照组(82.29±2.51%)、移动速度为实验组(31.00±4.08cm/s)>对照组(16.38±2.85cm/s)、速度变化率为实验组(6.97±1.90%)<对照组(20.28±2.46%)、爪子摆动速度为实验组(117.65±3.03cm/s)>对照组(104.18±10.09cm/s)、步行周期为实验组(0.46±0.05s)<对照组(0.70±0.15s)、单只腿站立时间为实验组(0.12±0.017s)>对照组(0.093±0.0055s)、站立时间为实验组(0.34±0.05s)<对照组(0.64±0.21s)。以上指标均表明实验组跟腱愈合比对照组更加良好,差异均有统计学意义,除了爪子摆动速度(p=0.053),和最大脚印长度(p=0.057)外。
手术28天后,取实验组和对照组两只大鼠的右后腿he切片染色。发现对照组(图8a)胶原纤维较少,且无方向性,内部有脂肪细胞浸润。实验组(图8b)胶原纤维丰富,纤维呈一定方向性,未见明显脂肪细胞浸润。说明本发明对肌腱的治疗效果明显。
以上结果均说明实验组的跟腱愈合优于对照组。但由于恢复时间较短(28天),实验组的大鼠运动能力暂未恢复到正常状态。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



