培养基组合物及促进动物胚胎体外发育的培养方法与流程
 2021-02-02 18:02:30|
2021-02-02 18:02:30| 322|
322| 起点商标网
起点商标网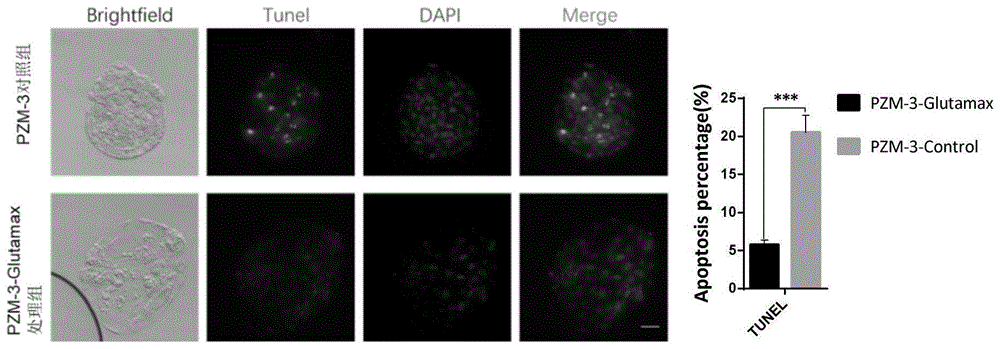
本发明涉及生物
技术领域:
,特别涉及培养基组合物及促进动物胚胎体外发育的培养方法。
背景技术:
:早在1962年,人们就在两栖类利用体细胞核移植技术将终末分化的体细胞重编程到全能性状态。自从1997年首例哺乳动物克隆在羊上取得成功,现已获得超过20种克隆的哺乳动物。利用scnt技术可以从单个体细胞的细胞核中生产出一个完整的生物体,因此这项技术在研究生物反应器,生产珍贵的医用蛋白、生产异种器官移植的供体、加速家畜的遗传改良过程及濒危物种保护等方面具有极大的应用潜能。此外,从scnt囊胚中可以分离得到多能性胚胎干细胞,这使得scnt有望成为一种人类疾病治疗的新技术。近年来随着首例人类核移植胚胎干细胞系的成功建立,以及来源于老人或患者细胞的人类核移植胚胎干细胞的获得,使得这种期望更加趋近实现。核移植胚胎干细胞可以作为构建疾病模型和细胞组织替代治疗的有效细胞来源。虽然小鼠、家兔在研究重编程机制方面较为方便,但是由于其体型、生理学特征、短暂的生命周期等原因,以其推断克隆技术在人类临床应用上的安全性具有很大的缺陷;就相似性而言,猴子是十分理想的模式动物,但在某种程度上,猴子仍然涉及到了伦理道德问题,并且其饲养与繁殖十分困难。猪在免疫学与生理学上与人类十分类似,其器官在大小、结构、功能上都与人相似,并且在人与猪之间进行器官移植产生疾病的概率较低,所以它是人类器官移植的理想来源。另外,猪的平均生命周期超过20年,可以进行长期的靶向实验,因此以猪作为研究对象具有许多其它动物模型无可比拟的优势。此外,猪作为我国最重要的产肉动物之一,体细胞核移植技术对于培育适合市场需要的优良种猪,实现高产、优质、高效的现代养猪生产,以及对其遗传育种的高效改良都将发挥巨大作用。尽管已经进行了深入的研究与探讨,但人们对scnt胚胎发育过程中表观遗传重编程的潜在机制依然知之甚少,目前仍存在一些阻碍scnt实际应用的限制。其中之一就是生产克隆动物的效率较低。例如,将近50%的小鼠scnt胚胎在植入前表现出发育阻滞,只有1%-2%的胚胎在移植到代孕母鼠中可以发育到个体。猪的效率还不到1%,绵羊效率为5-8%,牛的有10-15%。因此,致力于寻找提高猪克隆效率的方法对于促进猪体细胞核移植技术的广泛应用具有重要作用。为了提高重编程效率,人们尝试了很多的方法,包括选择激活重构胚的时机,胞质分裂抑制剂的影响,去核和注核时机的影响,电融合法(oguraetal.,2000)以及显微操作技术方面的影响,但都没有取得显著的效果。考虑到dna甲基化和组蛋白乙酰化都是影响体细胞重编程和克隆胚胎发育的重要表观遗传标记,人们研究了用病理学药剂改变供体细胞和胚胎的表观遗传修饰来提高体细胞重编程的效率。研究发现,sah(s-adenosyl-homocysteine)处理供体细胞后能够显著提高克隆胚胎的体外发育率到32.4%,而tsa处理供体细胞或者重构胚均能够显著提高囊胚率到40%。但是这些药物对克隆胚胎长期影响及应用还有待研究。研究发现,体外培养环境对胚胎发育也有重要的影响。那么,改变体外培养条件或者优化体外培养环境是否可以提高克隆胚胎体外发育能力呢?chatot等通过对小鼠2细胞胚胎阻滞的研究发现,培养液中的葡萄糖在胚胎发育早期可能抑制一些关键的代谢过程,而谷氨酰胺是胚胎早期发育过程中首选的能量来源。体细胞胞质中的各个独立区域和分子团是依培养环境中成分的变化而重新定位的,表观遗传状态会受到培养环境的影响,例如培养液中的血清能改变与基因组印迹相关的表观遗传信息。michele等研究发现,与那些正常受精合子不同,克隆胚胎的囊胚率和多能性标记oct4在囊胚中的区域性分布高度依赖于核移植后的培养环境。第一个细胞周期以后,体细胞核的表观遗传修饰仍在继续;重构胚中核重塑的改变是有利于还是不利于建立合子基因程序要依赖于培养液中的特异物质(micheleetal.,2005)。heindryckx等用czb、g1/g2和ksom/g2培养克隆和孤雌胚胎的研究发现,克隆胚胎和孤雌胚胎对体外培养环境非常敏感,选择的培养液是否合适将显著影响胚胎的体外发育。由此可见,体外培养环境对小鼠来源的胚胎的发育是非常关键的,这也提示我们除了以上报道的提高克隆效率的方法外,研究和选择更好的胚胎体外培养体系将是影响猪胚胎尤其是克隆胚胎体外发育的重要因素。使用现有scnt技术产生的猪scnt胚胎发育效率低,囊胚质量差。现有的提高胚胎发育效率的方法都效果不显著,而且操作方法不够便利。因此,提供一种能够通过简单换液就能完成的显著提高猪scnt胚胎发育率和囊胚质量的培养基和培养方法具有重要的现实意义。技术实现要素:有鉴于此,本发明提供了培养基组合物及促进动物胚胎体外发育的培养方法。本发明采用一种改良的胚胎培养方法,显著提高猪scnt胚胎的体外发育效率和囊胚质量。现有技术猪体细胞核移植胚胎体外发育效率较低,囊胚质量较差,还没有找到显著提高效率的有效方法。为了实现上述发明目的,本发明提供以下技术方案:在平时的培养过程中,本申请人发现,不同的培养液支持胚胎发育的时期不一样,有的培养液对胚胎早期发育很好,有的对后期发育好,因此,本申请人认为,将不同的培养液组合使用,各取优点,可以找到一个更能促进猪scnt胚胎体外发育的培养体系。试验证明,确实能够得到这种培养体系,能显著提高了克隆胚胎的发育率。本发明提供了培养基组合物,包括pzm-3(-)和pzm-3-glutamax;所述pzm-3(-)包括如下组分:所述pzm-3-glutamax包括如下组分:在本发明的一些具体实施方案中,所述pzm-3(-)包括如下组分:所述pzm-3-glutamax包括如下组分:或pzm-3(-)配方如下:pzm-3-glutamax包括如下组分:或pzm-3(-)配方如下:pzm-3-glutamax包括如下组分:本发明还提供了所述的培养液组合物在促进动物胚胎体外发育中的应用。在本发明的一些具体实施方案中,所述动物包括猪,所述胚胎包括克隆胚胎。本发明还提供了所述的培养基组合物在促进动物体细胞重编程中的应用。本发明还提供了促进动物胚胎体外发育的培养方法,采用所述的培养基组合物培养所述动物胚胎。在本发明的一些具体实施方案中,所述培养方法具体为:获得动物胚胎,融合激活后以30个/60μl的密度在所述改良的pzm-3(-)的培养基中培养24~48h后,换液到所述改良的pzm-3-glutamax中继续培养7d至形成囊胚。本发明还提供了,所述培养的条件为38.5℃,5%co2。本发明提供的方法关键在于不同的发育阶段使用不同的培养基进行胚胎培养,特别是在发育阻滞的关键阶段使用利于突破发育阻滞的培养液,即2倍提高培养液中的谷氨酰胺的浓度。主要有两点:一是培养液的不同,使用两种不同的培养液,培养液中的谷氨酰胺的浓度不同;二是培养方法的不同,使用pzm-3(-)培养24h~48h后,换液使用pzm-3-glumax继续培养至7d。本发明的优点在于能够显著提高猪scnt胚胎的体外发育效率。在正常的pzm-3的胚胎培养液中的scnt胚胎囊胚率是18%-20%,采用换液的方法可以显著提高猪scnt的囊胚率到45.7%,同使用正常胚胎培养液pzm-3的囊胚率相比,囊胚率提高了25.7%。同时,此方法还操作方便,只要在scnt胚胎激活24~48h后从pzm-3(-)的培养基中换液到pzm-3-glutamax中继续培养即可,操作简单方便,适宜后续应用。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。图1示7d囊胚发育情况图;图2示胚胎囊胚期的凋亡染色检测;细胞核用dapi染色进行定位,绿色细胞核指示凋亡(400x)。具体实施方式本发明公开了培养基组合物及促进动物胚胎体外发育的培养方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本发明提供的培养基组合物及促进动物胚胎体外发育的培养方法中所用原料及试剂均可由市场购得。下面结合实施例,进一步阐述本发明:实施例1猪体细胞核移植1.猪卵母细胞的体外成熟培养:从当地的一家屠宰场采集刚刚处死的猪卵巢,采集后放在含适量青霉素钠(0.768%)的生理盐水中(预热35-38.5℃),2小时内尽快运回实验室。用含适量青霉素(0.384%)的生理盐水冲洗卵巢,选取直径大小在3-6mm左右的卵泡,用无菌的10ml注射器吸取卵泡液。在体式显微镜下选取胞质均匀、外周包裹的卵丘细胞至少三层的卵丘卵母细胞复合体(cocs)进行体外成熟培养(ivm)。将150-200个cocs放入1ml含激素的体外成熟培养液中,此时记为0h,培养22-24h,培养条件为38.5℃、5%co2。随后将卵母细胞转移到1ml不含激素的ivm培养液中继续培养到第42-44h。在体视显微下进行观察,挑选出排出第一极体的卵母细胞用于后续实验。2.体细胞核移植操作:挑选排出第一极体的卵母细胞放置在覆盖有石蜡油的胚胎操作滴(含5μg/ml细胞松弛素b)中,在倒置显微镜下利用显微操作系统采用盲吸法对卵母细胞进行去核,具体为去除第一极体及其相连的胞质(大约卵母细胞胞质总体积的10%)。随后,选取体积大小适中的供体细胞注入去核卵母细胞的卵周隙中,构建重构胚。用电融合的方法对重构胚进行融合和激活,具体操作为将构建好的重构胚在融合液中进行平衡,以每次20个的量转移到融合槽中,使供体细胞和融合槽保持平行状态进行融合并激活,融合参数为1.45kv/cm,两次直流脉冲,每次100μs。30分钟后挑拣出供体细胞融进卵母细胞胞质的重构胚。实施例2提前4小时在60mm的培养皿中以每滴60ul的体积做pzm-3(-)培养滴,放在38.5℃,5%co2的二氧化碳培养箱中平衡,实施例1制得的体外scnt重构胚融合完成后,将0h的重构胚以每60ul培养滴放30个密度放入提前平衡的pzm-3(-)的培养滴中培养24h,培养条件为38.5℃,5%co2,然后换液到pzm-3-glutamax中继续培养到7d。在48h的时候统计卵裂率,在7d的时候统计囊胚率。其中,pzm-3(-)配方如下:表1pzm-3-glumax配方如下:表21nacl108.00mm2kcl10.00mm3kh2po40.35mm4mgso4·7h2o0.40mm5nahco325.07mm6na-pyruvate0.20mm7ca-(lactate)2·5h2o2.00mm8glutamaxtmsupplement2.00mm9hypotaurine5.00mm10bsa45.15mm11bmeaminoacid20ml/l12memnon-essentialaminoacid10ml/l13超纯水定容至50ml实施例3提前4小时在60mm的培养皿中以每滴60ul的体积做pzm-3(-)培养滴,放在38.5℃,5%co2的二氧化碳培养箱中平衡,实施例1制得的体外scnt重构胚融合完成后,将0h的重构胚以每60ul培养滴放30个密度放入提前平衡的pzm-3(-)的培养滴中培养48h,培养条件为38.5℃,5%co2,然后换液到pzm-3-glutamax中继续培养到7d。在48h的时候统计卵裂率,在7d的时候统计囊胚率。其中,pzm-3(-)配方如下:表3氯化钠(nacl)106.00mm氯化钾(kcl)10.05mm磷酸二氢钾(kh2po4)0.33mm7水合硫酸镁(mgso4·7h2o)0.45mm碳酸氢钠(nahco3)25.00mm丙酮酸钠(na-pyruvate)0.25mm5水合乳酸钙(ca-(lactate)2·5h2o)1.50mm亚牛磺酸(hypotaurine)5.15mm牛血清白蛋白(bsa)43.55mm氨基酸复合试剂(bmeaminoacid)20ml/l非必需氨基酸(memnon-essentialaminoacid)10ml/l超纯水定容至50mlpzm-3-glutamax包括如下组分:表4实施例4提前4小时在60mm的培养皿中以每滴60ul的体积做pzm-3(-)培养滴,放在38.5℃,5%co2的二氧化碳培养箱中平衡,实施例1制得的体外scnt重构胚融合完成后,将0h的重构胚以每60ul培养滴放30个密度放入提前平衡的pzm-3(-)的培养滴中培养36h,培养条件为38.5℃,5%co2,然后换液到pzm-3-glutamax中继续培养到7d。在48h的时候统计卵裂率,在7d的时候统计囊胚率。其中,pzm-3(-)配方如下:表5pzm-3-glutamax包括如下组分:表6对比例按照实施例2的操作,区别在于:体外scnt重构胚融合完成后,将0h的重构胚以每60ul培养滴放30个密度放入提前平衡的pzm-3的培养滴中培养到7d,培养条件为38.5℃,5%co2。在48h的时候统计卵裂率,在7d的时候统计囊胚率。实施例5猪体外受精将猪卵母细胞进行体外成熟培养,方法同实施例1中所述,将排出第一极体的卵母细胞放入提前24h做好的受精滴pgm中,以每50ul受精滴放20个卵母细胞的密度。采用密度梯度离心法处理精子,在15ml离心管中先加入2ml90%percoll,再在其上加入2ml45%percoll液,然后将2ml鲜精加入到分离液上层,以300g转速离心20分钟,将上层精液层和45%percoll层吸去,留中层精液和90%percoll层,加入4mldpbs液混合均匀,以300g转速离心10分钟,将上清液吸去,向沉淀物加入适量pgm,用1ml移液器吹打混匀,在恒温箱中预热5分钟后使用细胞计数板计数,使最终精子浓度为2х105,在38.5℃,5%co2的培养箱中培养5-6h后,用预热的pzm-3(-)洗去多余的精子,并将此时的受精卵记为0h。将0h的受精卵以每60ul培养滴放30个密度放入提前平衡的pzm-3(-)的培养滴中培养48h,培养条件为38.5℃,5%co2,然后在pzm-3-glutamax中继续培养到5d,换液到添加10%血清的pzm-3-glutamax中继续培养到7d。在48h的时候统计卵裂率,在7d的时候统计囊胚率。其中,pzm-3(-)配方如下:表7氯化钠(nacl)110.00mm氯化钾(kcl)9.85mm磷酸二氢钾(kh2po4)0.37mm7水合硫酸镁(mgso4·7h2o)0.35mm碳酸氢钠(nahco3)25.18mm丙酮酸钠(na-pyruvate)0.15mm5水合乳酸钙(ca-(lactate)2·5h2o)2.15mm亚牛磺酸(hypotaurine)4.95mm牛血清白蛋白(bsa)45.65mm氨基酸复合试剂(bmeaminoacid)20ml/l非必需氨基酸(memnon-essentialaminoacid)10ml/l超纯水定容至50mlpzm-3-glutamax包括如下组分:表8实施例6猪孤雌激活将猪卵母细胞进行体外成熟培养,方法同实施例1中所述,将排出第一极体的卵母细胞使用电融合的方法对其进行融合和激活,具体操作为将排除第一极体的卵母细胞在融合液中进行平衡,以每次20个的量转移到融合槽中,尽量保持卵母细胞放在融合槽的中心位置进行融合并激活,融合参数为1.2kv/cm,两次直流脉冲,每次30μs。将此融合和激活后的孤雌激活胚胎记为0h。将0h的孤雌激活胚胎以每60ul培养滴放30个密度放入提前平衡的pzm-3(-)的培养滴中培养24h,培养条件为38.5℃,5%co2,然后在pzm-3-glutamax中继续培养到7d。在48h的时候统计卵裂率,在7d的时候统计囊胚率。其中,pzm-3(-)配方如下:表9pzm-3-glutamax包括如下组分:表10效果例表11pzm-3中添加glutamax对克隆胚胎发育的影响具有不同上标的同一列中的值差异显著(p<0.05)。表12pzm-3中添加glutamax对体外受精胚胎发育的影响具有不同上标的同一列中的值差异显著(p<0.05)。表13pzm-3中添加glutamax对孤雌激活胚胎发育的影响具有不同上标的同一列中的值差异显著(p<0.05)。此外,对使用改良的pzm-3换液组培养的囊胚质量进行分析,发现使用实施例1提供的培养方法获得的囊胚凋亡细胞数(6.7%)明显少于pzm-3对照组(22.0%),差异极显著。如图1和图2。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页1 2 3
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



