油酸水合酶突变体及其在制备10-羟基硬脂酸中的应用的制作方法
 2021-02-02 18:02:16|
2021-02-02 18:02:16| 483|
483| 起点商标网
起点商标网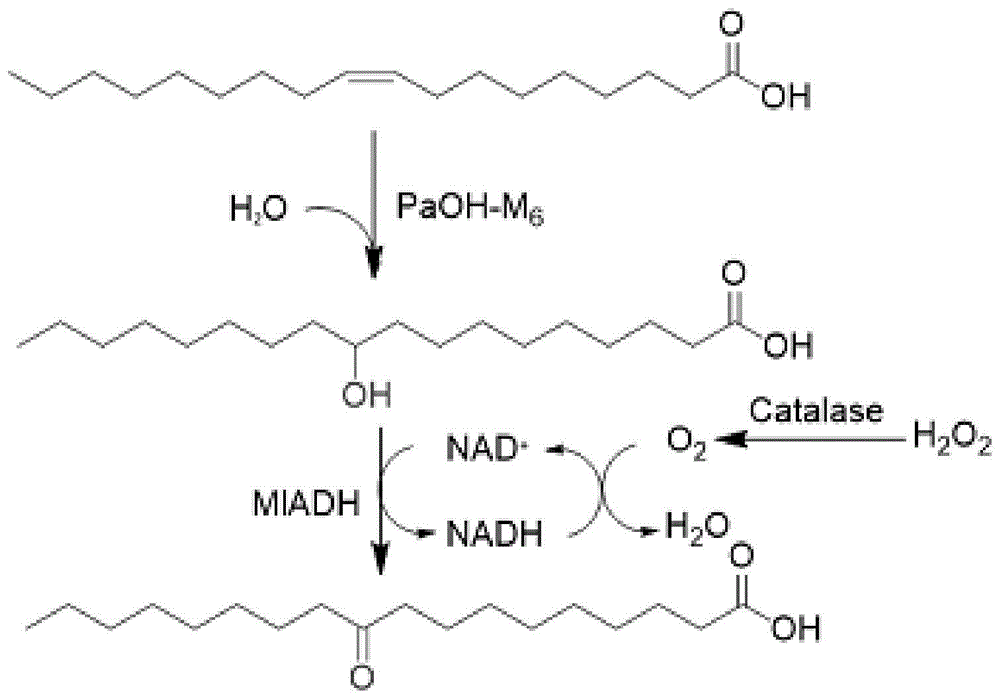
本发明属于生物工程技术领域,具体涉及一种嗜氨副球菌(paracoccusaminophilus)来源的油酸水合酶的突变体,其编码基因,含有该基因序列的重组表达载体和重组表达转化体;重组油酸水合酶突变体催化剂,还涉及油酸水合酶突变体或重组油酸水合酶突变体催化剂在制备10-羟基硬脂酸,以及与10-羟基硬脂酸脱氢酶级联制备10-羰基硬脂酸中的应用。
背景技术:
油酸作为一种重要的天然产物,是典型的可再生资源,价格低廉、来源丰富。随着高纯度油酸生产技术的研发成功及高油酸植物的推广,我国油酸的生产量呈逐年增长趋势。2015年我国高纯油酸行业产量约为1.65万吨(中国油酸行业发展研究报告),同比增长22.2%,且随着油酸市场的不断扩大,其生产规模还在不断扩大。
油酸是一种含有碳碳双键的长链脂肪酸,通过对其官能团进行修饰,可以获得10-羟基硬脂酸和10-羰基硬脂酸等产物。其中10-羟基硬脂酸和10-羰基硬脂酸可以作为精细化学品和药物等合成的化学中间体,具有较高的工业应用价值。有报道称,10-羟基硬脂酸具有有益的美容作用,可以用于治疗或预防由健康皮肤的生理体内平衡的负面发展引起的任何症状,以及促进头发生长和脱发保护,改善皮肤老年斑和明显的毛孔。
2011年,oh等使用野生型的硝化短营养单胞菌(stenotrophomonasnitritireducens)整细胞,在无氧条件下催化油酸水合反应,底物浓度为30g·l-1,湿细胞上载量为20g·l-1时,反应4h可以完全转化,而在有氧条件下4h仅可转化63%(biotechnol.lett.,2011,33:993-997)。2019年,许建和等挖掘到来源于paracoccusaminophilus的油酸水合酶(简称paoh),在油酸浓度为90g/l,冻干酶粉上载量为5ku/l时,反应4h转化率高于95%;在此基础上,使用羟基硬脂酸脱氢酶催化水合产物10-羟基硬脂酸脱氢反应生成10-羰基硬脂酸,耦联乳酸脱氢酶催化丙酮酸氧化反应实现辅酶nad+的循环再生,继续反应2h,10-羰基硬脂酸的最终生成得率为95.8%(中国专利cn110004133a)。
目前油酸水合酶的活力相对较低,由于缺乏有效的高通量筛选方法,因此活性以及稳定性改造研究较少;油酸水合酶级联羟基硬脂酸脱氢酶制备10-羰基硬脂酸的过程中,使用昂贵的丙酮酸做为辅酶循环再生的辅底物,辅酶循环成本较高,不利于其在工业上的利用。
技术实现要素:
鉴于目前已报道的油酸水合酶活性低、稳定性差,催化反应时空产率低的缺陷,本发明建立了高效简便的油酸水合酶高通量筛选方法,从嗜氨副球菌(paracoccusaminophilus)来源的油酸水合酶paoh出发,通过分子工程手段提高其活性和稳定性,得到催化性能更高的油酸水合酶突变体。在此基础上,将油酸水合酶突变体用在制备10-羟基硬脂酸中,改善了10-羟基硬脂酸酶法转化制备10-羰基硬脂酸的辅酶再生过程,有效降低了10-羰基硬脂酸的生产成本。
本发明总体目标是建立高效的高通量筛选方法,通过分子改造手段,提高油酸水合酶的活力及热稳定性,并建立较为廉价适宜的辅酶循环体系,以降低生产成本。
本发明的目的可以通过以下技术方案来实现:
本发明的技术方案之一,获得催化性能明显改善的油酸水合酶突变体。
本发明以来源于嗜氨副球菌(paracoccusaminophilus)jcm7686的一个油酸水合酶(命名为paoh)作为母本,通过氨基酸序列以及空间结构的比对,找到底物结合位点附近的关键氨基酸残基,采用定点饱和突变的策略,成功获得稳定性及催化活力有所提高的突变体,并在此基础上,通过易错pcr等改造策略对其进行定向进化改造,结合酶标仪高通量初筛和气相色谱法复筛,鉴别获得一批稳定性及催化活性明显提高的油酸水合酶突变体。
其中,所述油酸水合酶paoh的核酸序列如seqidno.1所示,其氨基酸序列如seqidno.2所示。所述菌株嗜氨副球菌(paracoccusaminophilus)jcm7686购自日本微生物菌种保藏中心。
目前已知的油酸水合酶均是黄素蛋白,催化油酸转化生成10-羟基硬脂酸的反应中不涉及有色化合物,因此难以直接通过高通量的分光光度法进行突变体的筛选。本发明中,将油酸水合酶催化的反应与产物10-羟基硬脂酸的酶促氧化反应进行偶联,建立了一种快速的酶标仪高通量初筛方法。所述酶标仪高通量初筛方法在酶标板中进行,将油酸水合酶突变体加到含有油酸底物的缓冲液中,反应一定时间,控制反应转化率在10%以内,然后取适量水合反应液加到含有10-羟基硬脂酸脱氢酶、nad+,吩嗪硫酸乙酯(phenazineethosulfate,pes)和3-(4,5-二甲基-2-噻唑基)-2,5-二苯基四氮唑鎓溴化物(3-(4,5-dimethylthiazol-2yl)-2,5-diphenyltetrazoliumbromide,mtt,噻唑蓝)的显色反应液中。10-羟基硬脂酸脱氢酶可以催化10-羟基硬脂酸氧化,同时将nad+转化为nadh;随后nadh可以使pes由氧化态还原为还原态,同时再生nad+;而还原态的pes又可使mtt由氧化态转变为还原态,同时再生氧化态pes,如此反复,可使10-羟基硬脂酸完全转化为10-羰基硬脂酸,同时生成相同计量的还原态mtt。还原态的mtt呈蓝紫色,在580nm处有最大吸收峰,可以通过酶标仪快速检测,换算得到油酸水合反应中10-羟基硬脂酸的产量,进而计算油酸水合酶突变体的活力。
本发明所述的油酸水合酶突变体,是将如seqidno.2所示氨基酸序列的第15位苏氨酸、第122位苯丙氨酸、第233位苯丙氨酸、第332位组氨酸、第444位酪氨酸、第451位天冬氨酸、第622位谷氨酸中的一个或多个氨基酸残基替换为其他氨基酸残基所形成的新氨基酸序列对应的蛋白质。
具体的,所述的油酸水合酶突变体是由下述任一氨基酸序列组成的蛋白质:
(1)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸;
(2)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸,第122位苯丙氨酸替换为亮氨酸;
(3)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸,第622位谷氨酸替换为甘氨酸;
(4)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸,第122位苯丙氨酸替换为亮氨酸,第15位苏氨酸替换为丙氨酸;
(5)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸,第122位苯丙氨酸替换为亮氨酸,第15位苏氨酸替换为丝氨酸;
(6)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸,第122位苯丙氨酸替换为亮氨酸,第15位苏氨酸替换为天冬酰胺;
(7)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸,第122位苯丙氨酸替换为亮氨酸,第15位苏氨酸替换为甘氨酸;
(8)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸,第122位苯丙氨酸替换为亮氨酸,第15位苏氨酸替换为半胱氨酸;
(9)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸,第122位苯丙氨酸替换为亮氨酸,第15位苏氨酸替换为异亮氨酸;
(10)将如seqidno.2所示氨基酸序列的第332位组氨酸替换为酪氨酸;
(11)将如seqidno.2所示氨基酸序列的第444位酪氨酸替换为苯丙氨酸,第451位天冬氨酸替换为谷氨酸;
(12)将如seqidno.2所示氨基酸序列的第332位组氨酸替换为酪氨酸,第451位天冬氨酸替换为苏氨酸。
本发明所述油酸水合酶突变体的获得方法可以采用本领域常规方法,较佳地为从重组表达上述油酸水合酶突变体的转化体中分离获得;或者人工合成获得。
本发明的技术方案之二,提供了所述油酸水合酶突变体的编码基因,以及含有所述编码基因的重组表达载体。所述编码基因编码表达如技术方案一所述的改造获得的油酸水合酶突变体,其来源包括:通过基因工程技术对技术方案一所述的系列油酸水合酶突变体的基因序列进行克隆;或者通过人工全序列合成的方法得到编码如技术方案一所述油酸水合酶突变体的核酸分子。
所述的重组表达载体可通过本领域常规方法,将本发明所述的油酸水合酶突变体基因的核苷酸序列连接于各种市售空载载体上构建而成。所述的市售空载载体可以是本领域常规的各种质粒载体,只要所述重组表达载体可以在相应的表达宿主中正常复制,并表达相应的油酸水合酶突变体即可。针对不同的表达宿主,优选的质粒载体是不同的。本领域一般技术人员都清楚如何选择适当的载体、启动子、增强子和宿主细胞。对于大肠杆菌宿主,所述质粒载体优选的为质粒pet-28a(+)。可通过下述方法制得本发明所述的大肠杆菌重组表达载体:将通过pcr扩增所得的油酸水合酶突变体基因序列dna片段用限制性内切酶ecori和xhoi双酶切,同时将空载质粒pet28a同样用限制性内切酶ecori和xhoi双酶切,回收上述酶切后的油酸水合酶突变体的dna片段以及空载质粒,利用t4dna连接酶连接,构建获得用于大肠杆菌表达的含有所述油酸水合酶突变体编码核酸分子的重组表达载体。
本发明的技术方案之三,提供了一种包含本发明所述油酸水合酶突变体基因或其重组表达载体的重组表达转化体。所述重组表达转化体可通过本领域常规技术,将上述重组表达载体转化至相应宿主细胞中制得。所述宿主细胞为本领域常规的宿主细胞,只要能满足重组表达载体可稳定地自行复制,并且其所编码的油酸水合酶突变体基因能被有效表达即可。本发明首选大肠杆菌作为宿主细胞,更优选大肠杆菌e.colibl21(de3)用于高效表达本发明所述的油酸水合酶突变体。
本发明的技术方案之四,提供一种重组油酸水合酶突变体催化剂,所述的重组油酸水合酶突变体催化剂是以下形式中的任意一种:
(1)培养本发明所述的重组表达转化体,分离含有所述油酸水合酶突变体的转化体细胞;
(2)培养本发明所述的重组表达转化体,分离含有所述油酸水合酶突变体的粗酶液;
(3)将所述油酸水合酶突变体的粗酶液干燥得到的粗酶粉。
其中所述重组表达转化体的培养方法和条件为本领域常规的方法和条件,其包括如下步骤:培养发明的重组表达转化体,获得重组油酸水合酶突变体。对于重组大肠杆菌,优选培养基为lb培养基:蛋白胨10g/l,酵母膏5g/l,nacl10g/l,ph6.5-7.0。优选的培养方法为:将如上所述构建的重组大肠杆菌,接种至含有卡那霉素的lb培养基中,37℃、180rpm振荡培养过夜。按1-2%(v/v)的接种量接入装有100mllb培养基(含卡那霉素)的500ml三角烧瓶中,置于37℃、180rpm摇床振荡培养,当培养液的od600达到0.6-0.8时,加入终浓度为0.1-0.5mmol/l的异丙基-β-d-硫代半乳糖苷(iptg)作为诱导剂,16-25℃诱导16-24h后,将培养液离心,收集沉淀,然后用生理盐水洗涤两次,获得重组表达转化体细胞。将收获的重组细胞进行冷冻干燥,即可获得含有所述油酸水合酶突变体的冻干细胞。将收获的重组细胞悬浮于5-10倍体积(v/w)的缓冲液中,超声破碎,离心收集上清液,即可获得所述重组油酸水合酶突变体的粗酶液。收集的粗酶液放置在-80℃下冷冻,然后使用真空冷冻干燥机低温干燥,即可得到冻干酶粉。将所获得的冻干酶粉保存在4℃冰箱内,可以方便地使用。
本发明中所述油酸水合酶突变体的活力测定方法:在2ml圆底ep管进行反应,将适当稀释的酶液加入到含有底物油酸的磷酸钾缓冲液(100mm,ph6.5)中,反应在30℃、1,000rpm的振荡反应器进行5min后,加入20μl硫酸(20%,w/v)终止反应。再加入等体积的含有2mm内标棕榈酸的乙酸乙酯振荡萃取,离心分离,离心力为16,200×g,时间2min。用移液枪吸出350μl上层有机相于新的ep管中,加入适量无水硫酸钠干燥过夜。取40μl萃取上清液加入到气相色谱分析瓶的内衬管中,再加入40μl甲醇/乙醚(1:1)混合液和20μl三甲基硅烷化重氮甲烷,在20℃-40℃下保温15min,再进行气相色谱分析,检测底物和产物的含量。
油酸水合酶的活力单位(u)定义为:上述反应条件下,每分钟催化1.0μmol油酸转化生成10-羟基硬脂酸所需的酶量。
本发明的技术方案之五,提供了所述重组油酸水合酶突变体或油酸水合酶突变体催化剂在10-羟基硬脂酸合成中的应用,即提供利用重组油酸水合酶突变体酶法转化制备10-羟基硬脂酸的方法。
所述油酸水合酶突变体催化油酸生成10-羟基硬脂酸的具体反应条件如底物浓度、缓冲液组成、ph、酶用量等可按本领域此类反应的常规条件进行选择。优选的,反应缓冲液为kpb缓冲液,ph6.0-7.5,缓冲液浓度为0.05-0.2mol/l,更优选浓度为0.1mol/l的kpb缓冲液,ph6.5;反应温度为15-35℃,更优选30℃;底物油酸在反应液中的浓度为10-100g/l,所述油酸水合酶突变体的活力上载为0.1-5ku/l。
反应结束后,可采用本领域常规方法进行产物的提取。在反应液中加酸,将反应液的ph调节至强酸性,优选的,加入浓盐酸,将反应液ph调节至2左右,用乙酸乙酯进行多次萃取,合并萃取液,旋转蒸发除去溶剂,然后再加入适量甲醇进行重结晶,抽滤,滤饼干燥,得到目标产物。
本发明的技术方案之六,提供了所述重组油酸水合酶突变体或油酸水合酶突变体催化剂在10-羰基硬脂酸合成中的应用,即提供利用重组油酸水合酶突变体酶法转化制备10-羟基硬脂酸,再加入10-羟基硬脂酸脱氢酶以制备10-羰基硬脂酸的方法。其中,本发明采用一种绿色廉价的辅酶循环方法,降低了辅酶应用的成本。
所述10-羰基硬脂酸的制备途径可参照如下方式:
使用本发明所述的重组油酸水合酶突变体作为催化剂,催化油酸水合生成10-羟基硬脂酸;反应的转化率达到预期水平时,调整反应体系ph,然后加入10-羟基硬脂酸脱氢酶mladh、nad(p)h氧化酶smnoxvar、过氧化氢酶、过氧化氢以及辅酶nad+,原位催化第一步反应中生成的10-羟基硬脂酸转化为10-羰基硬脂酸。
所述10-羟基硬脂酸脱氢酶可以采用本领域常规选择,本发明提供了一种10-羟基硬脂酸脱氢酶的来源方式:其来源于藤黄微球菌(micrococcusluteus),命名为mladh,其氨基酸序列如seqidno.3所示。所述10-羟基硬脂酸脱氢酶催化10-羟基硬脂酸生成10-羰基硬脂酸的具体反应条件如底物浓度、缓冲液组成、ph、酶用量等可按本领域此类反应的常规条件进行选择。优选的,反应缓冲液的ph为7.5-9.0,更优选ph为8.0;反应温度为15-35℃,更优选30℃;所述10-羟基硬脂酸脱氢酶的活力上载为0.1-10ku/l。
10-羟基硬脂酸脱氢酶催化10-羟基硬脂酸生成10-羰基硬脂酸的反应需要辅酶nad+的参与,辅酶nad+的浓度为0.1-0.5mm,反应过程中辅酶nad+还原为nadh。可以通过与nad(p)h氧化酶催化的反应进行耦合实现反应过程中nad+的原位再生。所述nad(p)h氧化酶以氧气为底物,催化nadh氧化产生nad+,同时氧气被还原生成水。由于体系中氧气有限,因此通过过氧化氢酶分解过氧化氢以提供氧气。
所述nad(p)h氧化酶来源于变形链球菌(streptococcusmutans)的突变体,命名为smnoxvar,氨基酸序列如seqidno.4所示。所述smnoxvar催化氧气氧化nadh生成nad+,同时生成副产物水的具体反应条件如缓冲液组成、ph、酶用量等可按本领域此类反应的常规条件进行选择。优选的,所述smnoxvar的活力上载为0.1-10ku/l。
所述过氧化氢酶购自生工生物工程(上海)股份有限公司,活力为2000-5000u/mg。所述过氧化氢酶可以在smnoxvar催化反应相同条件下催化过氧化氢分解生成氧气。
反应结束后,可采用本领域常规方法进行产物的提取。在反应液中加酸,将反应液的ph调至强酸性,优选的,加入浓盐酸,将反应液ph调节至2左右,再用乙酸乙酯进行多次萃取,合并萃取液,旋转蒸发除去溶剂,然后再加入适量甲醇进行重结晶,抽滤,滤饼干燥,得到目标产物。
与现有技术相比,本发明的优势在于:本发明提供了一种活性和热稳定性显著提高的油酸水合酶突变体,可以高效催化油酸生成10-羟基硬脂酸,在10-羟基硬脂酸和10-羰基硬脂酸合成应用中,催化剂用量少,底物油酸的浓度高达100g/l,实现99%以上的转化率;并且提供了一种更为绿色廉价的辅酶循环方式,使用廉价的双氧水作为氧化剂,酶法级联实现昂贵辅酶nad+的循环再生,有效地降低了酶法级联生产10-羰基硬脂酸的成本,具有很好的工业应用前景。
附图说明
图1:油酸水合酶突变体和10-羟基硬脂酸脱氢酶级联催化油酸转化生成10-羰基硬脂酸示意图。
具体实施方式
本发明内容中所述的各反应或检测条件,可根据本领域常识进行组合或更改,并可通过实验得到验证。下面将结合具体实施例,对本发明中的技术方案和技术效果进行清楚、完整地描述,但是本发明的保护范围并不限于这些实施例,凡是不背离本发明构思的改变或等同替代均包括在本发明的保护范围之内。
下列实施例中的材料来源为:
母本重组质粒pet28a-paoh,含有如序列表seqidno.1所示的核酸序列,在专利cn110004133a中也有公开。
质粒载体pet28a购自novagen公司。
e.colidh5α、e.colibl21(de3)、2×taqpcrmastermix、琼脂糖凝胶dna回收试剂盒均购自北京天根生化科技有限公司。
限制性内切酶ecori、xhoi均为newenglandbiolabs(neb)公司的市售产品。
除非另有说明,下列实施例中的具体实验按照本领域常规方法和条件进行,或遵照试剂盒的商品说明书。
实施例1油酸水合酶突变体的高通量筛选方法
将突变改造的油酸水合酶突变体基因dna转化到大肠杆菌e.colibl21(de3)感受态细胞中,将转化后平板上生长的单菌落用灭菌牙签挑至每孔含有200μllb培养基的96孔深孔板中,37℃、220rpm培养,即为一级板。待一级板培养12h后,每孔中的菌液生长情况在经过指数式生长后趋于一致,即可转接二级深孔板。用排枪吸取20μl一级板菌液,转接至每孔含有600μllb培养基的96孔深孔板中,培养2.5h,在od600达到1~2后,加入50μl含有iptg的lb培养基,使二级板中iptg的终浓度为0.1mm,于16℃诱导20h后,2395×g离心10min收集细胞,倒掉上清液。一级板在转接完二级板后保存在4℃。
二级板每孔加入200μl裂解液(含750mg/llysozyme和10mg/ldnasei,溶解于100mm,ph7.5的kpb),盖好盖子,于振荡器上剧烈振荡悬浮细胞,然后将二级板置于30℃摇床保温,180rpm振荡使细胞充分裂解,反应1h。
油酸水合酶突变体的筛选分两步进行:第一步,在上述细胞裂解混合物中加入300μl含有油酸底物的磷酸钾缓冲液(100mm,ph7.5),油酸的终浓度为8mm,置于30℃摇床保温,180rpm振荡反应1h。
第二步,在第一步反应的基础上,每孔取20μl反应液至酶标板的相应孔洞中,再加入180μl比色反应液。所述比色反应液中含有kpb(100mm,ph7.5),50u/mlmladh,0.8mmnad+,1mmpes和2mmmtt,置于酶标仪中,振摇5min,然后进行检测,读取580nm下的吸光度值。每块深孔板中第一列为母本,以母本为基准,挑取吸光度值明显高于母本的油酸水合酶突变体,即为优选的高活性或高稳定性突变体。
实施例2半理性设计构建油酸水合酶突变体
对油酸水合酶母本paoh进行同源建模,并将其与底物分子进行分子对接,进而对底物口袋附近的氨基酸进行定点饱和突变,以提高酶活。通过uniprot、ncbiblast以及空间结构模建,如序列表seqidno.1所示氨基酸序列的油酸水合酶paoh的立体空间结构中,在底物油酸的结合位点周围的氨基酸残基包括:108位甘氨酸、110位谷氨酸、112位天冬酰胺、214位甲硫氨酸、233位苯丙氨酸、245位半胱氨酸、377位色氨酸、442位色氨酸以及537位苯丙氨酸。采用定点饱和突变技术,对这些位点的氨基酸残基进行定点饱和突变。
使用引物如表1所示:
表1引物表
其中n代表a/t/c/g四种碱基中任意一种,k代表g/t两种碱基中任意一种,m代表c/a两种碱基中任意一种。在单点饱和突变时,nnk需要90多个克隆子就能达到95%覆盖率。
以pet28a-paoh为模板,用primestarhspremix进行pcr扩增,构建定点饱和突变库。pcr体系(20μl):2×primestarhspremix10μl,上下游引物(10μm)各1μl,pet28a-paoh质粒0.5ng,二甲基亚砜1μl,加灭菌蒸馏水补足至20μl。pcr反应程序:(1)95℃预变性5min;(2)94℃变性30s;(3)55℃退火30s;(4)72℃延伸8min;步骤(2)~(4)共进行15个循环;最后72℃延伸10min,4℃保存产物。反应结束后,加1μl的限制性内切酶dpni到20μl的pcr产物中,并在37℃条件下保温2h,使模板充分消化降解,将消化产物转化到大肠杆菌e.colibl21(de3)感受态细胞中,并均匀涂布于含有50μg/ml卡那霉素的lb琼脂平板上,置于37℃培养箱中静置培养约12h。将所得到的单克隆菌落挑取到96孔深孔板中进行培养,按实施例1所述的方法对表达的蛋白进行高通量活力筛选,对活性较高的突变体进行纯化表征,对相应的基因进行测序。
所述油酸水合酶突变体的活力测定方法:在2ml圆底ep管进行反应,将适当稀释的酶液加入到含有底物油酸的磷酸钾缓冲液(100mm,ph6.5)中,在30℃、1,000rpm振荡反应5min后,加入20μl硫酸(20%,w/v)终止反应。再加入等体积的含有2mm内标棕榈酸的乙酸乙酯振荡萃取,离心分离,离心力为16,200×g,时间2min。用移液枪吸出350μl上层有机相于新的ep管中,加入适量无水硫酸钠干燥过夜。取40μl萃取上清液加入到气相色谱分析瓶的内衬管中,再加入40μl甲醇/乙醚(1:1)混合液和20μl三甲基硅烷化重氮甲烷,在20℃-40℃下保温15min,再进行气相色谱分析,检测底物油酸和产物10-羟基硬脂酸的含量。
通过筛选发现油酸水合酶paoh的第233位苯丙氨酸替换为亮氨酸获得的突变体paohf233l的稳定性以及催化油酸水合反应的活性均有所提高。
实施例3随机突变筛选稳定性提高的油酸水合酶突变体
在实施例2所述突变体paohf233l的基础上,对其进行易错pcr改造进一步提高酶的稳定性和活性。
使用的引物为:
上游引物序列:ggaattcatgagccccaagacctccaaaccc
下游引物序列:ccgctcgagtcacttgcgggtcctctctttga
其中上游引物下划线所示序列为ecori的酶切位点,下游引物下划线所示序列为xhoi的酶切位点。
以pet28a-paoh为模板,用rtaqdna聚合酶进行易错pcr,构建随机突变库。pcr体系(50μl):rtaqdna聚合酶0.5μl,10×pcrbuffer(mg2+plus)5.0μl,dntpmixture(各2.0mm)4.0μl,终浓度为75μm的mncl2,pet28a-paoh质粒0.5ng,上下游引物(10μm)各2μl,加灭菌蒸馏水补足至50μl。pcr反应程序:(1)95℃预变性5min;(2)94℃变性30s;(3)50℃退火30s;(4)72℃延伸2min;步骤(2)~(4)共进行20个循环;最后72℃延伸10min,4℃保存产物。pcr产物经琼脂糖凝胶电泳分析验证后切胶纯化回收,对回收后的目的基因dna片段与空载质粒pet28a分别用限制性内切酶ecori和xhoi在37℃双酶切12h。双酶切产物经琼脂糖凝胶电泳分析验证后切胶纯化回收,用t4dna连接酶将得到的线性化pet28a质粒与纯化后的目的基因dna片段置于16℃连接过夜。将连接产物转化到大肠杆菌e.colibl21(de3)感受态细胞中,并均匀涂布于含有50μg/ml卡那霉素的lb琼脂平板上,置于37℃培养箱中静置培养约12h。将所得到的单克隆菌落挑取到96孔深孔板中进行培养,按实施例1所述的方法对表达的蛋白进行高通量活力筛选,对活性和稳定性较高的突变体进行纯化表征,对相应的基因进行测序。
通过筛选,得到了对油酸活性显著提高的突变体,进而对这些突变体的热稳定性进行了表征,优选热稳定性提高的系列突变体,这些突变体的序列以及这些突变体催化油酸水合反应的活性和稳定性列于表1中。在表1中,序列标号分别对应于表1后面的一系列序列。在活性列中,与母本paoh相比,一个加号“+”表示突变体蛋白对油酸的活性提高了1-2倍;两个加号“++”表示突变体蛋白对油酸的活性提高了2-3倍;三个加号“+++”表示突变体蛋白对油酸的活性提高了3-4倍。在热稳定性列中,一个加号“+”对应于30℃保温1h后,突变体蛋白的残余活性保留10.0-20.0%;两个加号“++”对应于30℃保温1h后,突变体蛋白的残余活性保留20.1-30.0%;三个加号“+++”对应于30℃保温1h后,突变体蛋白的残余活性保留30.1-40.0%。
表1:油酸水合酶突变体序列和相应的活性改进列表
对应序列标号的油酸水合酶突变体的氨基酸序列分别如下:
(1)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸;
(2)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸,第122位苯丙氨酸替换为亮氨酸;
(3)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸,第622位谷氨酸替换为甘氨酸;
(4)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸,第122位苯丙氨酸替换为亮氨酸,第15位苏氨酸替换为丙氨酸;
(5)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸,第122位苯丙氨酸替换为亮氨酸,第15位苏氨酸替换为丝氨酸;
(6)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸,第122位苯丙氨酸替换为亮氨酸,第15位苏氨酸替换为天冬酰胺;
(7)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸,第122位苯丙氨酸替换为亮氨酸,第15位苏氨酸替换为甘氨酸;
(8)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸,第122位苯丙氨酸替换为亮氨酸,第15位苏氨酸替换为半胱氨酸;
(9)将如seqidno.2所示氨基酸序列的第233位苯丙氨酸替换为亮氨酸,第122位苯丙氨酸替换为亮氨酸,第15位苏氨酸替换为异亮氨酸;
(10)将如seqidno.2所示氨基酸序列的第332位组氨酸替换为酪氨酸;
(11)将如seqidno.2所示氨基酸序列的第444位酪氨酸替换为苯丙氨酸,第451位天冬氨酸替换为谷氨酸;
(12)将如seqidno.2所示氨基酸序列的第332位组氨酸替换为酪氨酸,第451位天冬氨酸替换为苏氨酸;
实施例4重组油酸水合酶突变体paohm6的表达及活力测定
将实施例3中获得的表达突变体m6的重组大肠杆菌e.colibl21(de3)/pet28a-paohm6接种至含50μg/ml卡那霉素的lb培养基中,37℃摇床振荡培养12小时,之后按1%(v/v)的接种量接入装有100mllb培养基(含50μg/ml卡那霉素)的500ml三角烧瓶中,置于37℃、180rpm摇床振荡培养,当培养液的od600达到0.6时,加入终浓度为0.2mm的iptg作为诱导剂,16℃诱导24h。将培养液以8000×g离心10min,收集细胞,并用生理盐水洗涤两次,得到静息细胞。将100ml培养液中获得的细胞悬浮于10ml的磷酸钾缓冲液(100mm,ph8.0)中,冰水浴中进行如下超声破碎:功率400w,工作4s,间歇6s,进行99个循环,4℃下12000×g离心40分钟,收集上清粗酶液,活力为9.0u/ml;将粗酶液冷冻干燥,获得粗酶粉,活力为1.9u/mg。另外,将收获的细胞冷冻干燥,获得冻干细胞活力为0.5u/mg。
实施例5paoh和paohm6催化性能对比
在0.5mlkpb(100mmol/l,ph6.5)中加入0.1mg/mlpaoh纯酶或paohm6纯酶,加入终浓度为10g/l的油酸。在30℃,1000rpm振荡反应12小时。反应结束后用硫酸(20%,w/v)调节ph至2以下,加入0.5ml乙酸乙酯(含有2mm的内标棕榈酸)进行萃取,重复萃取3次,合并萃取液,加入适量无水硫酸钠干燥过夜,气相色谱分析测定结果表明母本酶paoh催化反应的转化率为40%,而突变体paohm6催化反应转化率为99%。
产物的具体分析条件如下:使用气相色谱仪进行分析,色谱柱为色谱柱为rxi-5silms,以氮气为载气,进样口和氢火焰检测器的温度都为280℃,初始柱温为180℃,4℃/min升至250℃。样品进样量为1μl,分流比为25:1,恒压模式控制。油酸的保留时间为12.24min,10-羟基硬脂酸的保留时间为16.34min。
实施例6paohm6催化油酸转化生成10-羟基硬脂酸
反应在250ml三口烧瓶中进行,反应体系为100ml,含有kpb缓冲液(100mm,ph6.5),10g油酸,0.2g吐温-80,油酸和吐温-80预先使用高压匀浆剂乳化,然后加入0.5ku如实施例4所述油酸水合酶paohm6的破碎上清粗酶液,反应在25℃、200rpm搅拌下进行,反应4小时,转化率为99.5%。
实施例7paohm6催化油酸转化生成10-羟基硬脂酸
反应在250ml三口烧瓶中进行,反应体系为100ml,含有kpb缓冲液(100mm,ph6.5),5g油酸,0.2g吐温-80,油酸和吐温-80预先使用高压匀浆剂乳化,然后加入0.5ku如实施例4所述油酸水合酶paohm6的破碎上清粗酶液,反应在40℃、200rpm搅拌下进行,反应2小时,转化率为96.8%。
实施例8paohm6催化油酸转化生成10-羟基硬脂酸
反应在1l机械搅拌反应釜中进行,反应体系为600ml,含有kpb缓冲液(100mm,ph6.5),30g油酸,1.2g吐温-80,油酸和吐温-80预先使用高压匀浆剂乳化,然后加入1.5ku如实施例4所述油酸水合酶paohm6的破碎上清粗酶液,反应在30℃、200rpm搅拌下进行,反应2小时。用浓盐酸将反应液ph调节到2以下,使用等体积乙酸乙酯进行萃取,重复3次,合并萃取液,加入无水硫酸钠干燥,旋转蒸发除去溶剂,用甲醇重结晶,纯化获得27.8g的10-羟基硬脂酸,纯度为99.0%。
实施例9mladh催化10-羟基硬脂酸转化生成10-羰基硬脂酸
反应在250ml机械搅拌反应釜中进行,反应体系为100ml,含有kpb缓冲液(100mm,ph8.0),5g如实施例8所述的10-羟基硬脂酸,0.2g吐温-80,10-羟基硬脂酸和吐温-80预先使用高压匀浆剂乳化,然后加入0.5mmnad+、0.4kumladh、2kusmnoxvar和2ku过氧化氢酶的冻干酶粉,并以25μl/min的速率流加15%的h2o2,开始第二步的反应,30℃、200rpm搅拌下继续反应4h,转化率98.7%。
实施例10paohm6与mladh级联催化油酸转化生成10-羰基硬脂酸
如附图1所示,利用本发明的油酸水合酶突变体(paohm6)和10-羟基硬脂酸脱氢酶(mladh)级联催化油酸转化生成10-羰基硬脂酸。
反应在1l机械搅拌反应釜中进行,反应体系为600ml,含有kpb缓冲液(100mm,ph6.5),30g油酸,1.2g吐温-80,油酸和吐温-80预先使用高压匀浆剂乳化,然后加入1.5ku如实施例4所述油酸水合酶paohm6的破碎上清粗酶液,反应在30℃、200rpm搅拌下进行,反应2小时,油酸水合生成10-羟基硬脂酸。然后加入naoh溶液调节反应体系ph为8.0,再加入0.1mmnad+、2.4kumladh、9kusmnoxvar和12ku过氧化氢酶的冻干酶粉,并以0.15ml/min的速率流加15%的h2o2,开始第二步的反应,继续反应4h。用浓盐酸将反应液ph调节到2以下,使用等体积乙酸乙酯进行萃取,重复3次,合并萃取液,加入无水硫酸钠干燥,旋转蒸发除去溶剂,用甲醇重结晶,纯化获得25.3g的10-羰基硬脂酸,纯度为99.0%。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
序列表
<110>华东理工大学
苏州百福安酶技术有限公司
<120>油酸水合酶突变体及其在制备10-羟基硬脂酸中的应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>1965
<212>dna
<213>嗜氨副球菌(paracoccusaminophilus)
<400>1
atgagccccaagacctccaaacccttccacgtcgagaacgacacgaccgccggatattgg60
tcaaatcgaccagaaaataccctgcctgtgcccgatatgatgggcgcttatatgcgcaac120
cacccctatcccggcaaccaggtcgagggtcgcaaggcctggatcattggcagcggtatc180
gccgggctggcagcggcgttctacctgatccgtgatggcgggatgaaagggcaagacatc240
accattctggatgcgctggatgtcacgggcggctcgctcgacggggctggcaatcccgag300
gatggctatatcatccgcggcggccgcgagatgaactttaattacgacaacctttgggac360
atgttccaggacgtgcaggcgctggagctgcccgagggctacagcgtgctcgacgagtat420
cgccaactgaacgatgccgatcccaactggtcaaagtctcggctgatgcacaatcagggc480
gagattcgcgatttctcaaccttcggcctgaccaagccgcagcaatgggagctgatccgc540
ctgctcttgaagcgcaaagaggatctcgatgatctgaccatcgaggattatttcagcccc600
ggcttcctgcagtcgaacttttggttcctgtggcgctcgatgttcgcctttgagaactgg660
cagagcttgctggagatgaagctttatacccaccgctttctcgattccatcgacgggttt720
gcggatatgtcctgcctcgttttcccgaagtataatcagcatgataccttcgttaagccg780
ctggtcgaccacctaaagaagctcggcgttcaggtccagttcgcgacccgtgtctctgat840
ttggaaatgaccgaagacgcaggcaagcgcagtgtgacgggcattctggccagcgtgaac900
ggtcaggaacaccgcatcccagtcgatgaaaaggatgtggtctttgcgctgaccggctcg960
atgaccgagggcaccgcctatggcgatatggatcatgcccccgtgatggagcgcgggcgc1020
tcggatccgggaccagacagtgattgggctttgtggcaaaacctcgccgcgaaatcgccg1080
atctttggcaatcccaagaagttctatggcgatatcgacaagtcgatgtgggaatccggc1140
acgctgacgtgcaagccctcgcccctgactgaccggctgacagagctgtcggtcaacgac1200
ccctattccggcaagaccgtgaccggcggcatcattaccttcaccgactcgaattgggtg1260
atgagcgtgacctgtaaccgccagccgcatttcctcggccagcccaaggatgttctggtg1320
ctctgggtctatgcgctgctgatggacaaggatggcaacaaggtcaaaaagcccatgccc1380
gcctgcaccgggcgcgagattttggccgagctgtgccatcatttgggcattcccgacgat1440
caattcgaggccgtcgccgcgaagaccaaggtacggttggcgttgatgccctatattacc1500
tcgatgttcatgccgcgtgccaaaggtgaccgtccccatgtcgtgcccgagggctgcacg1560
aacctcgcgctgatgggccagttcgtcgagacggcgaatgatatcgtcttcaccatggat1620
agctcgatccgcacggcgcgcattggcgtctatacgctgttggggctgcgcaagcaggtg1680
cccgatatcagcccggtgcaatatgatatccgcaccttgatcaaggccgcccgcacggtg1740
aacaacaaccagcccttcccgggtgaacgcctgctgcatcgtctcttgggaaagacctac1800
tatgcccatatcctgccgccgctgcccgatcgcacccaaaccacccgcgacgctgccgag1860
accgaactgaaggcgtttctcggtactggcggcactgctctggcggccgtgggcggttgg1920
ctgcaaagggttcgcgaggacctcaaagagaggacccgcaagtga1965
<210>2
<211>654
<212>prt
<213>嗜氨副球菌(paracoccusaminophilus)
<400>2
metserprolysthrserlysprophehisvalgluasnaspthrthr
151015
alaglytyrtrpserasnargprogluasnthrleuprovalproasp
202530
metmetglyalatyrmetargasnhisprotyrproglyasnglnval
354045
gluglyarglysalatrpileileglyserglyilealaglyleuala
505560
alaalaphetyrleuileargaspglyglymetlysglyglnaspile
65707580
thrileleuaspalaleuaspvalthrglyglyserleuaspglyala
859095
glyasnprogluaspglytyrileileargglyglyargglumetasn
100105110
pheasntyraspasnleutrpaspmetpheglnaspvalglnalaleu
115120125
gluleuprogluglytyrservalleuaspglutyrargglnleuasn
130135140
aspalaaspproasntrpserlysserargleumethisasnglngly
145150155160
gluileargasppheserthrpheglyleuthrlysproglnglntrp
165170175
gluleuileargleuleuleulysarglysgluaspleuaspaspleu
180185190
thrilegluasptyrpheserproglypheleuglnserasnphetrp
195200205
pheleutrpargsermetphealaphegluasntrpglnserleuleu
210215220
glumetlysleutyrthrhisargpheleuaspserileaspglyphe
225230235240
alaaspmetsercysleuvalpheprolystyrasnglnhisaspthr
245250255
phevallysproleuvalasphisleulyslysleuglyvalglnval
260265270
glnphealathrargvalseraspleuglumetthrgluaspalagly
275280285
lysargservalthrglyileleualaservalasnglyglngluhis
290295300
argileprovalaspglulysaspvalvalphealaleuthrglyser
305310315320
metthrgluglythralatyrglyaspmetasphisalaprovalmet
325330335
gluargglyargseraspproglyproaspserasptrpalaleutrp
340345350
glnasnleualaalalysserproilepheglyasnprolyslysphe
355360365
tyrglyaspileasplyssermettrpgluserglythrleuthrcys
370375380
lysproserproleuthraspargleuthrgluleuservalasnasp
385390395400
protyrserglylysthrvalthrglyglyileilethrphethrasp
405410415
serasntrpvalmetservalthrcysasnargglnprohispheleu
420425430
glyglnprolysaspvalleuvalleutrpvaltyralaleuleumet
435440445
asplysaspglyasnlysvallyslysprometproalacysthrgly
450455460
arggluileleualagluleucyshishisleuglyileproaspasp
465470475480
glnpheglualavalalaalalysthrlysvalargleualaleumet
485490495
protyrilethrsermetphemetproargalalysglyaspargpro
500505510
hisvalvalprogluglycysthrasnleualaleumetglyglnphe
515520525
valgluthralaasnaspilevalphethrmetaspserserilearg
530535540
thralaargileglyvaltyrthrleuleuglyleuarglysglnval
545550555560
proaspileserprovalglntyraspileargthrleuilelysala
565570575
alaargthrvalasnasnasnglnpropheproglygluargleuleu
580585590
hisargleuleuglylysthrtyrtyralahisileleuproproleu
595600605
proaspargthrglnthrthrargaspalaalagluthrgluleulys
610615620
alapheleuglythrglyglythralaleualaalavalglyglytrp
625630635640
leuglnargvalarggluaspleulysgluargthrarglys
645650
<210>3
<211>310
<212>prt
<213>藤黄微球菌(micrococcusluteus)
<400>3
metsergluphethrargphegluglnvalthrvalleuglythrgly
151015
valleuglyserglnileilemetglnalaalatyrhisglylyslys
202530
valmetalatyraspalavalproalaalaleugluasnleuasplys
354045
argtrpalatrpileargglnglytyrglualaaspleuglyglugly
505560
tyraspalaalaargpheaspglualailealaargilethrprothr
65707580
seraspleualaglualavalalaaspalaaspilevalilegluala
859095
valprogluasnleugluleulysarglysvaltrpalaglnvalgly
100105110
gluleualaproalathrthrleuphealathrasnthrserserleu
115120125
leuproseraspphealaaspalaserglyhisprogluargpheleu
130135140
alaleuhistyralaasnargiletrpalaglnasnthralagluval
145150155160
metglythralaalathrserproglualavalalaglyalaleugln
165170175
phealaglugluthrglymetvalprovalhisvalarglysgluile
180185190
proglytyrpheleuasnserleuleuileprotrpleuglnalagly
195200205
serlysleutyrmethisglyvalglyasnproalaaspileasparg
210215220
thrtrpargvalalathrglyasngluargglypropheglnthrtyr
225230235240
aspilevalglyphehisvalalaalaasnvalserargasnthrgly
245250255
valasptrpglnleuglyphealaglumetleuglulysserileala
260265270
gluglyhisserglyvalalaaspglyglnglyphetyrargtyrgly
275280285
proaspglygluasnleuglyprovalgluasptrpasnleuglyasp
290295300
lysaspthrproleugly
305310
<210>4
<211>457
<212>prt
<213>变形链球菌(streptococcusmutans)
<400>4
metserlysilevalilevalglyalaasnhisalaglythralaala
151015
ileasnthrvalleuaspasntyrglysergluasngluvalvalval
202530
pheaspglnasnserasnileserpheleuglycysglymetalaleu
354045
trpileglylysglnileserglyproglnglyleuphetyralaasp
505560
lysgluserleuglualalysglyalalysiletyrmetgluserpro
65707580
valthralaileasptyraspalalysargvalthralaleuvalasn
859095
glyglngluhisvalglusertyrglulysleuileleualathrgly
100105110
serthrproileleuproproilelysglyalaalailelysglugly
115120125
serargasppheglualathrleulysasnleuglnphevallysleu
130135140
tyrglnasnalagluaspvalileasnlysleuglnasplysthrgln
145150155160
asnleuasnargilealavalvalglyalaglytyrileglyvalglu
165170175
leualaglualaphelysargleuglylysgluvalileleuileasp
180185190
arghisaspthrcysleualaglytyrtyraspglnaspleuserglu
195200205
metmetargglnasnleugluasphisglyilegluleualaphegly
210215220
gluthrvallysalailegluglyaspglylysvalgluargileval
225230235240
thrasplysalaserhisaspvalaspmetvalileleualavalgly
245250255
pheargproasnthralaleuglyasnalalysleulysthrphearg
260265270
asnglyalapheleuvalasplyslysglngluthrserileproasp
275280285
valtyralaileglyaspcysalathrvaltyraspasnalaileasn
290295300
aspthrasntyrilealaleualaserasnalaleuargserglyile
305310315320
valalaglyhisasnalaalaglyhislysleugluserleuglyval
325330335
glnglyserasnglyileserilepheglyleuasnmetvalserthr
340345350
glyleuthrglnglulysalalysargpheglytyrasnprogluval
355360365
thralaphethrasppheglnlysalaserpheilegluhisaspasn
370375380
tyrprovalthrleulysilevaltyrasplysaspserargleuval
385390395400
leuglyalaglnmetalaserlysgluaspmetsermetglyilehis
405410415
metpheserleualaileglnglulysvalthrilegluargleuala
420425430
leuleuasptyrphepheleuprohispheasnglnprotyrasntyr
435440445
metilelysalaalaleulysalalys
450455
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



