一种与植物抗逆性相关基因及其编码蛋白与应用的制作方法
 2021-02-02 18:02:41|
2021-02-02 18:02:41| 409|
409| 起点商标网
起点商标网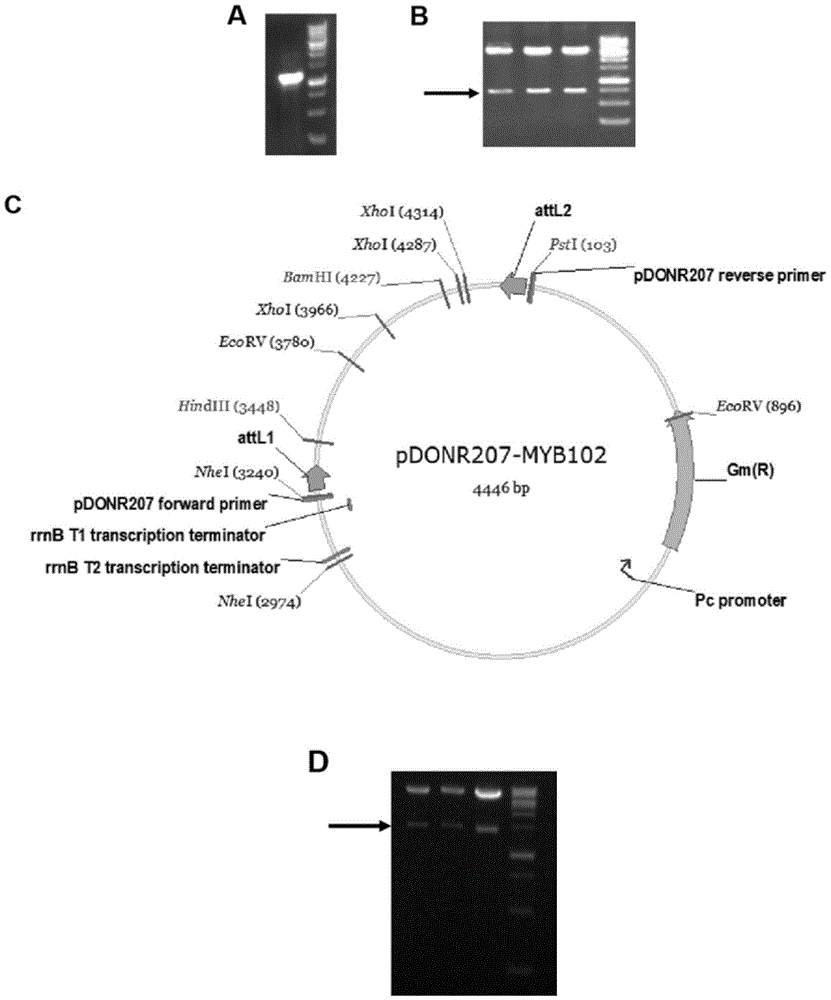
本发明属于生物
技术领域:
,特别涉及一种与植物抗逆性相关基因atmby102、其编码蛋白及其在植物抗逆中的应用。
背景技术:
:植物在生长发育的每个阶段都可能受到非生物胁迫的危害,直接影响植物的生存以及农作物产量和品质。这些非生物胁迫中干旱和盐胁迫造成的不利影响最为严重,对世界粮食产量的危害相当于其它自然灾害的总和。我国是世界上干旱和半干旱地区面积较大的国家,旱地面积占全国总土地面积的52.5%,干旱严重制约了我国的农业生产。在干旱胁迫下,由于缺少水分的供应,造成植物体内渗透势改变,细胞膨压降低,引起细胞膜流动性和膜蛋白构象的变化,造成体内代谢紊乱,产生大量的活性氧毒害植物,严重影响植物的生长发育及产量。土壤盐碱化也是世界范围内日益严重的农业问题,目前世界上陆地大约有10亿hm2遭受盐碱化危害,约占陆地总面积的7%。我国约有3000万hm2以上的土地属于盐碱地,相当于现有耕地面积的25%左右。高盐环境下,植物种子体内的渗透势和酶活性被改变,造成离子中毒以及打破激素平衡抑制种子萌发。高盐也会抑制植物生长,一方面它通过降低植物根系吸收水分的能力,从而导致生长减缓;其次,它可能进入蒸腾流,损伤叶片细胞,进一步抑制生长。近年来,随着生态环境的变化使土壤干旱和盐碱化问题日益加重,我国的干旱和盐碱化区域也不断增大,加上人口的急剧增长,对现代农业提出了巨大的挑战,应对各种环境胁迫造成的农作物损失是可持续性农业生产的基础。如何高效利用有限的淡水资源进行最大限度的农业生产,是全球性的问题,迫切需要解决。因此,深入研究植物的抗逆机制,提高农作物抗逆性,培育抗逆新品种是一项至关重要的任务。不同植物对干旱和盐胁迫的适应能力存在巨大差异,因此了解植物界各种抗逆策略的分子机制,对于改良农作物抗逆性十分必要。技术实现要素:本发明的目的在于提供植物抗逆相关基因atmby102在提高植物抗逆性、培育抗逆性转基因植物及选育抗逆性提高的植物品种中的应用,该基因响应逆境胁迫,过表达该基因可显著提高转基因植物的抗盐性和抗渗透胁迫能力。为此,本发明第一方面提供了一种抗逆相关蛋白在调节植物抗逆性中的应用,所述蛋白为:1)由seqidno:2所示的氨基酸序列组成的蛋白;或2)由与seqidno:2所示的氨基酸序列相比存在保守取代、缺失或添加一个以上的氨基酸序列组成,且活性与具有seqidno:2所示的氨基酸序列的蛋白相同的衍生蛋白。在本发明的一些优选的实施方式中,所述衍生蛋白具有的氨基酸序列与seqidno:2所示的氨基酸序列具有至少90%的同源性。在本发明的另一些优选的实施方式中,所述衍生蛋白具有的氨基酸序列与seqidno:2所示的氨基酸序列具有至少95%的同源性。在本发明的一些实施方式中,编码所述抗逆相关蛋白的基因为:1)seqidno:1所示的dna分子;2)与seqidno:1所示的dna序列相比存在保守取代、缺失或添加一个以上碱基,且与seqidno:1所示的dna序列具有相同功能的dna分子。在本发明的一些优选的实施方式中,所述与seqidno:1所示的dna序列具有相同功能的dna分子的dna序列与seqidno:1所示的dna序列具有至少90%的同源性。在本发明的另一些优选的实施方式中,所述与seqidno:1所示的dna序列具有相同功能的dna分子的dna序列与seqidno:1所示的dna序列具有至少95%的同源性。在本发明的一些实施方式中,所述抗逆性为抗盐性和/或抗渗透胁迫。在本发明的另一些实施方式中,编码所述抗逆相关蛋白的基因的dna序列还可以为在高严谨条件下可与序列表中seqidno:1所示的dna序列杂交的核苷酸序列;其中,所述高严谨条件为:在6×ssc,0.5%sds的溶液中,在65℃下杂交,然后用2×ssc,0.1%sds和1×ssc,0.1%sds各洗膜一次。在本发明的一些实施方式中,编码所述抗逆相关蛋白的基因为atmby102。在本发明中,seqidno:1所示的dna序列由1053个核苷酸组成,seqidno:2所示的氨基酸序列由350个氨基酸组成。本发明第二方面提供一种抗逆相关蛋白及其编码基因在提高植物抗逆性中的应用。在本发明的一些实施方式中,所述抗逆相关蛋白为:1)由seqidno:2所示的氨基酸序列组成的蛋白;或2)由与seqidno:2所示的氨基酸序列相比存在保守取代、缺失或添加一个以上的氨基酸序列组成,且活性与具有seqidno:2所示的氨基酸序列的蛋白相同的衍生蛋白。在本发明的一些优选的实施方式中,所述衍生蛋白具有的氨基酸序列与seqidno:2所示的氨基酸序列具有至少90%的同源性。在本发明的另一些优选的实施方式中,所述衍生蛋白具有的氨基酸序列与seqidno:2所示的氨基酸序列具有至少95%的同源性。在本发明的另一些实施方式中,编码所述抗逆相关蛋白的基因为:1)seqidno:1所示的dna分子;2)与seqidno:1所示的dna序列相比存在保守取代、缺失或添加一个以上碱基,且与seqidno:1所示的dna序列具有相同功能的dna分子。在本发明的一些优选的实施方式中,所述与seqidno:1所示的dna序列具有相同功能的dna分子的dna序列与seqidno:1所示的dna序列具有至少90%的同源性。在本发明的另一些优选的实施方式中,所述与seqidno:1所示的dna序列具有相同功能的dna分子的dna序列与seqidno:1所示的dna序列具有至少95%的同源性。在本发明的一些实施方式中,所述抗逆性为抗盐性和/或抗渗透胁迫。本发明第三方面提供一种抗逆相关蛋白及其编码基因在培育抗逆性转基因植物中的应用。在本发明的一些实施方式中,所述抗逆相关蛋白为:1)由seqidno:2所示的氨基酸序列组成的蛋白;或2)由与seqidno:2所示的氨基酸序列相比存在保守取代、缺失或添加一个以上的氨基酸序列组成,且活性与具有seqidno:2所示的氨基酸序列的蛋白相同的衍生蛋白。在本发明的一些优选的实施方式中,所述衍生蛋白具有的氨基酸序列与seqidno:2所示的氨基酸序列具有至少90%的同源性。在本发明的另一些优选的实施方式中,所述衍生蛋白具有的氨基酸序列与seqidno:2所示的氨基酸序列具有至少95%的同源性。在本发明的另一些实施方式中,编码所述抗逆相关蛋白的基因为:1)seqidno:1所示的dna分子;2)与seqidno:1所示的dna序列相比存在保守取代、缺失或添加一个以上碱基,且与seqidno:1所示的dna序列具有相同功能的dna分子。在本发明的一些优选的实施方式中,所述与seqidno:1所示的dna序列具有相同功能的dna分子的dna序列与seqidno:1所示的dna序列具有至少90%的同源性。在本发明的另一些优选的实施方式中,所述与seqidno:1所示的dna序列具有相同功能的dna分子的dna序列与seqidno:1所示的dna序列具有至少95%的同源性。在本发明的一些实施方式中,所述抗逆性为抗盐性和/或抗渗透胁迫。在本发明的一些优选的实施方式中,所述植物为拟南芥。本发明第四方面提供一种抗逆相关蛋白及其编码基因在选育抗逆性提高的植物品种中的应用。在本发明的一些实施方式中,所述抗逆相关蛋白为:1)由seqidno:2所示的氨基酸序列组成的蛋白;或2)由与seqidno:2所示的氨基酸序列相比存在保守取代、缺失或添加一个以上的氨基酸序列组成,且活性与具有seqidno:2所示的氨基酸序列的蛋白相同的衍生蛋白。在本发明的一些优选的实施方式中,所述衍生蛋白具有的氨基酸序列与seqidno:2所示的氨基酸序列具有至少90%的同源性。在本发明的另一些优选的实施方式中,所述衍生蛋白具有的氨基酸序列与seqidno:2所示的氨基酸序列具有至少95%的同源性。在本发明的另一些实施方式中,编码所述抗逆相关蛋白的基因为:1)seqidno:1所示的dna分子;2)与seqidno:1所示的dna序列相比存在保守取代、缺失或添加一个以上碱基,且与seqidno:1所示的dna序列具有相同功能的dna分子。在本发明的一些优选的实施方式中,所述与seqidno:1所示的dna序列具有相同功能的dna分子的dna序列与seqidno:1所示的dna序列具有至少90%的同源性。在本发明的另一些优选的实施方式中,所述与seqidno:1所示的dna序列具有相同功能的dna分子的dna序列与seqidno:1所示的dna序列具有至少95%的同源性。在本发明的一些实施方式中,所述抗逆性为抗盐性和/或抗渗透胁迫。在本发明的一些优选的实施方式中,所述植物为拟南芥。本发明第五方面提供一种培育抗逆性提高的转基因植物的方法,包括如下步骤:1)将所述基因导入目的植物细胞,获得表达转基因植物;2)从步骤1)所得转基因植物中得到与所述目的植物相比,抗逆性提高的转基因植物。在本发明的一些实施方式中,所述基因为:1)seqidno:1所示的dna分子;2)与seqidno:1所示的dna序列相比存在保守取代、缺失或添加一个以上碱基,且与seqidno:1所示的dna序列具有相同功能的dna分子。在本发明的一些优选的实施方式中,所述与seqidno:1所示的dna序列具有相同功能的dna分子的dna序列与seqidno:1所示的dna序列具有至少90%的同源性。在本发明的另一些优选的实施方式中,所述与seqidno:1所示的dna序列具有相同功能的dna分子的dna序列与seqidno:1所示的dna序列具有至少95%的同源性。在本发明的一些实施方式中,所述抗逆性为抗盐性和/或抗渗透胁迫。在本发明的一些优选的实施方式中,所述植物为拟南芥。在本发明的一些实施方式中,在所述转基因植物中,抗逆相关蛋白或所述的基因过量表达。在本发明的另一些实施方式中,所述抗逆相关蛋白为:1)由seqidno:2所示的氨基酸序列组成的蛋白;或2)由与seqidno:2所示的氨基酸序列相比存在保守取代、缺失或添加一个以上的氨基酸序列组成,且活性与具有seqidno:2所示的氨基酸序列的蛋白相同的衍生蛋白。在本发明的一些优选的实施方式中,所述衍生蛋白具有的氨基酸序列与seqidno:2所示的氨基酸序列具有至少90%的同源性。在本发明的另一些优选的实施方式中,所述衍生蛋白具有的氨基酸序列与seqidno:2所示的氨基酸序列具有至少95%的同源性。在本发明中,所述的基因为拟南芥与抗逆相关基因atmby102,“atmby102”或“mby102”均是指拟南芥中的抗逆相关基因atmby102。在本发明的另一些实施方式中,本发明中所用植物为哥伦比亚生态型的野生型拟南芥(arabidopsisthaliana);所述抗逆转基因株系为atmyb102过表达株系,在本发明中命名为ox。在本发明中,“col-0”及“wt”均指未经转基因的野生型的拟南芥哥伦比亚株系。本申请的发明人在拟南芥中,创造性的发现基因atmby102与植物抗逆性相关。所述的植物抗逆的功能是指在盐(nacl),甘露醇(mannitol)和脱落酸(aba)处理的条件下具有一定生长优势(种子萌发率高和主根长)。具体的,通过分子克隆和植物转基因技术,获得转基因植株,并对转基因植株进行抗性筛选,纯合体鉴定及转录水平上表达量的检测,确定atmyb102的表达水平被提高,从而获得35s启动子驱动atmyb102基因表达的过表达株系ox;同时,从拟南芥种子库abrc获得了一个转座子插入at4g21440基因外显子上的缺失突变体cs128365,开展了种子萌发和根系伸长实验。统计结果发现,在nacl、mannitol(甘露醇)、aba处理条件下,ox株系的种子萌发率、主根长和鲜重显著优于对照野生型col-0。结果证明了atmyb102正调控植物的抗逆性,过表达该基因显著提高植物耐盐和耐渗透胁迫能力。该发现有利于人们进一步了解植物抗逆策略的分子机制,也对改良农作物、提供抗逆新品种提供了参考。附图说明下面将结合附图来说明本发明。图1:(a)示出本发明中myb102基因编码区片段扩增结果(使用生工生物工程(上海)股份公司的realbanddna分子量标准marker,250-10000bp);(b)示出本发明中pdonr207-myb102质粒的酶切鉴定图,使用bamhi和hindiii双酶切,箭头指示酶切阳性片段(使用生工生物工程(上海)股份公司的realbanddna分子量标准marker,250-10000bp);(c)示出本发明中pdonr207-myb102成功构建的最终载体图谱;(d)示出本发明中pcb2004-myb102质粒的酶切鉴定图,使用bamhi和ncoi双酶切,箭头指示酶切阳性片段(使用生工生物工程(上海)股份公司的realbanddna分子量标准marker,250-10000bp);(e)示出本发明中pcb2004-myb102成功构建的最终载体图谱;(f)示出本发明中拟南芥过表达株系ox中myb102基因的表达水平鉴定结果;图2:(a)示出本发明中过表达株系ox-20、ox-29、ox-63、col-0种子在分别添加0、150mmnacl、250mmmannitol和0.5μmaba的ms培养基上的萌发情况;(b)示出本发明中不同处理条件下ox-20、ox-29、ox-63、col-0株系的种子萌发率统计结果;图3:(a)示出本发明中过表达株系ox-20、ox-29、ox-63及col-0幼苗在分别添加0、120mmnacl、250mmmannitol和5μmaba的ms培养基上的根系生长情况;(b)示出本发明中不同处理条件下col-0、ox-20、ox-29及ox-63株系的幼苗主根长统计结果;(c)示出本发明中不同处理条件下col-0、ox-20、ox-29及ox-63株系的鲜重统计结果;图4:(a)示出本发明中col-0和缺失突变体myb102-12及myb102-14种子在分别添加0、120mmnacl、250mmmannitol的ms培养基上的生长情况;(b)示出本发明中不同处理条件下col-0、myb102-12和myb102-14株系主根长统计结果;(c)示出本发明中col-0和缺失突变体myb102-12及myb102-14株系幼苗在分别添加0、120mmnacl、250mmmannitol的ms培养基上的生长情况;(d)示出本发明中不同处理条件下col-0、myb102-12和myb102-14株系主根长统计结果;图5:(a)示出本发明中150mmnacl处理条件下,myb102基因在转录水平的表达量;(b)示出本发明中250mmmannitol处理条件下,myb102基因在转录水平的表达量;(c)示出本发明中20%peg8000处理条件下,myb102基因在转录水平的表达量;(d)示出本发明中5μmaba处理条件下,myb102基因在转录水平的表达量。具体实施方式为使本发明容易理解,下面将详细说明本发明。在本发明的一些具体的实施方式中,myb102过表达的纯合转基因株系的获得方法如下:1)将包含myb102基因编码区片段的重组表达载体导入植物细胞;2)通过步骤1),获得转基因植物细胞,由转基因植物细胞产生过表达myb102基因的转基因阳性苗;3)将获得的转基因阳性苗进行抗性筛选,扩繁后代,获得纯合体株系,并在转录水平上鉴定基因的表达量,确定目的基因的表达水平被提高,从而获得纯合转基因株系。将转基因株系与野生型对照植株在含有nacl、mannitol(甘露醇)和aba(脱落酸)的培养皿上培养处理,发现所述转基因植株在种子萌发和根系伸长阶段具有显著的耐盐和耐渗透胁迫能力。在本发明的另一些具体的实施方式中,含有本发明atmyb102的植物表达载体可通过使用农杆菌介导的转化、外源dna转化(电转、基因枪)、植物病毒载体转化等本领域常规转化方法进行植物细胞或组织的转化。在本发明的一些实施方式中,在植物中过量表达植物抗逆性相关基因atmyb102并进一步获得耐盐和耐渗透胁迫的植物。下面参照具体的实施例进一步描述本发明,但是本领域技术人员应该理解,本发明并不限于这些具体的实施例。下述实施例中的实验方法,如果没有特殊说明,均为常规实验方法。实验所用到的试剂盒实验仪器,如无特殊说明,均可在生物仪器和试剂公司购买到。实施例1拟南芥myb102过表达株系的获得1.1重组表达载体的获取分别将全接头attb1-ha-tag序列和attb2序列连接到myb102编码区(cds)的左端引物p1和右端引物p2,由生工生物工程(上海)股份有限公司合成。使用kodfx酶(购自toyobo)通过pcr技术获得myb102编码区片段(图1a)。将获得的pcr产物进行琼脂糖凝胶电泳并回收正确的目的条带。采用gatewaytechnology高通量载体构建的技术(汪宗桂,郑文岭,马文丽;通路克隆系统:dna重组技术的新进展。中国生物工程杂志(2003),第23卷第7期),利用gatewayrbpclonasetmiienzymemix试剂盒(invitrogen)将myb102目的片段重组克隆到pdonr207的穿梭载体(购自invitrogen)中。通过菌落pcr及质粒双酶切鉴定,获得正确的穿梭载体pdonr207-myb102(图1b,c)。利用gatewayrlrclonasetmiienzymemix试剂盒(invitrogen)将pdonr207-myb102载体重组克隆到pcb2004终载体(xiangetal.,1999;leietal.,2007),并通过菌落pcr及质粒双酶切鉴定获得正确的pcb2004-myb102终载体(图1d,e)。pcr引物如下:上游引物(p1)(小写字母表示attb1接头和ha-tag序列):5’-ggggacaagtttgtacaaaaaagcaggctatgtacccatacgatgttccagattacgctatggcaaggtcaccttgttgc-3’,如seqidno:3所示;下游引物(p2)(小写字母表示attb2接头):5’-ggggaccactttgtacaagaaagctgggtttatataataaaaccattaacgtcc-3’,如seqidno:4所示。过表达植物载体构建过程中,编码区片段扩增体系如下(50μl):2×kod缓冲液25μl2.5mmdntp5μl20ump12μl20ump22μlkodfx1μl模板1μlddh2o14μlkodfx酶的pcr扩增条件:完成后保存于25℃。1.2过表达纯合株系的获取通过电转技术将构建成功的pcb2004-myb102转入农杆菌c58c1感受态(该菌株由美国isu大学oliverd.j.教授惠赠),并浸花转化野生型拟南芥植株,获得t1代转基因种子。将收到的种子进行无菌清洗和春化后,使其萌发于含有50mg/l除草剂(glufosinateammonium,商用名为liberty,法国aventis作物科学公司)的ms培养基(配制方法见下述实施例2)。筛选成功转入atmyb102基因的抗除草剂阳性苗,将t2代阳性苗进行单株扩繁。将收获后的t3代种子萌发于含有50mg/l除草剂的ms培养基,进行纯合体鉴定。将能在含有50mg/l除草剂的ms培养基上正常生长并且没有野生型分离的株系作为纯合体株系。1.3过表达纯合株系基因表达水平的鉴定提取在抗性板上正常生长纯合株系小苗的rna,反转录得到cdna,以该cdna为模版,以ubiqutin5基因作为内参,通过qrt-pcr(荧光实时定量pcr)技术检测atmyb102基因在转基因株系中的表达量。结果表明,通过qrt-pcr技术对多个纯合株系中atmyb102基因的表达量鉴定,获得了多个过表达株系ox(图1f)。拟南芥rna的提取步骤:(1)取约0.1g新鲜拟南芥组织,加入适量液氮将其研磨至粉末,并加入1ml的trizol试剂(购自北京全式金生物技术有限公司),继续低温下充分研磨,然后将其转移到1.5ml的无菌ep管;(2)向ep管中加入10μl的β-巯基乙醇,室温静置5分钟,充分反应;(3)继续向管中加入200μl三氯甲烷,混匀,室温静置5分钟,4℃条件下12000rpm的转速离心15分钟;(4)将上清转移至新的1.5ml的ep管,加入等体积的异丙醇混匀,室温静置10分钟,4℃条件下12000rpm转速离心10分钟;(5)弃上清,加入1ml75%的冰乙醇,清洗两遍,4℃条件下12000rpm转速离心10分钟;(6)弃上清,晾干rna,加入15μlrnase-free水溶解rna。rna反转录步骤:使用easyscriptone-stepgdnaremovalandcdnasynthesissupermix反转录试剂盒,取适量的rna模板进行反转录形成cdna,用于qrt-pcr检测。反转录体系如下(20μl):总rna50ng-5μg2×esreactionmix10μlanchoredoligo(dt)18primer1μleasyscriptrt/rienzymemix5μlgdna去除剂1μlrnase-free水9μl总体积20μl将配制好的反转录体系,42℃孵育30min,85℃加热5秒失活easyscriptrt/ri和gdna去除剂,用于进行qrt-pcr。qrt-pcr引物如下:上游引物(p1):5’-ctccgaccagatataaagcgag-3’,如seqidno:5所示;下游引物(p2):5’-tgatgtgaagatgaattgtatagag-3’,如seqidno:6所示。ubiqutin5基因引物序列为:上游引物p3:5’-agaagatcaagcacaagcat-3’,如seqidno:7所示;下游引物p4:5’-cagatcaagcttcaactcct-3’,如seqidno:8所示。通过荧光实时定量pcr仪器(steponereal-timepcrsystem)检测atmyb102基因在转录水平的表达量,其中使用的sybrgreen试剂购自北京全式金生物技术有限公司。反应体系如下(10μl):sybrgreen5μl20ump1(p3)0.25μl20ump2(p4)0.25μl模板0.25μlddh2o4.25μl荧光实时定量pcr的扩增条件:95℃预变性20s95℃变性10s退火温度60℃延伸时间30s循环数40实施例2拟南芥种子萌发率统计首先,将实施例1中成功构建的过表达纯合体株系ox-20、ox-29、ox-63和野生型拟南芥col-0(对照)种子使用10%bleach清洗液进行无菌清洗20分钟后,继续在超净工作台用无菌纯水清洗4-5遍,置于4℃黑暗条件下春化两天。将饱满的ox-20、ox-29、ox-63、col-0种子分别点在含有0、150mmnacl、250mmmannitol和0.5μmaba的ms培养基,完成后将培养皿置于22℃和16h光照及8h黑暗条件下水平培养。将种子白色胚根的伸出定义为种子已萌发,计算一周内不同材料的种子萌发率。图2a和b统计结果表明ox-20、ox-29、ox-63、col-0株系在ms培养皿上的萌发率大致相同,培养基以上部分子叶的生长状态无明显差异。当不同浓度的盐,甘露醇和aba处理时,过表达株系ox-20和ox-29的种子萌发率显著高于野生型col-0,ox-63的种子萌发率略高于对照(图2a,b)。这一结果证实了atmyb102基因在盐胁迫和渗透胁迫中发挥正调控功能,相对于野生型对照,过表达该基因,植物对非生物胁迫表现为更不敏感。10%bleach清洗液配方(1l):ms培养基配方(1l):10×大量元素100ml100×微量元素10ml100×铁盐10ml蔗糖10gddh2o补足至1l10×大量元素配方(1l):nh4no316.5gkno319gcacl2·2h2o4.4gmgso4·7h2o3.7gkh2po41.7gddh2o补足至1l100×微量元素配方(1l):ki0.083gh3bo30.62gznso4·7h2o0.86gmnso4·4h2o2.23gna2moo4·2h2o0.025gcuso4·5h2o0.0025gcocl2·6h2o0.0025gddh2o补足至1l100×铁盐配方(1l):feso4·7h2o2.78gna2-edta·2h2o3.73gddh2o补足至1l注:feso4·7h2o与na2-edta·2h2o试剂需分别溶解,再混合定容,置于65℃水浴螯合2-4小时。实施例3拟南芥主根根长统计首先将ox-20、ox-29、ox-63、col-0株系的种子进行无菌清洗并春化后,使其萌发于ms培养基上,待生长5天后,将不同株系中长势一致且主根长度接近的幼苗转移至分别含有不同浓度0、120mmnacl、250mmmannitol和5μmaba的ms培养基上,并多次重复。观察并统计生长8天后的不同材料的平均主根长度(primaryrootlength)和鲜重(freshweight)。结果发现,在正常培养条件下,4个株系的主根长和鲜重没有明显差异。但在不同浓度的盐,甘露醇和aba处理条件下,ox-20株系的主根显著长于对照,在鲜重方面也具有明显优势。同时ox-29、ox-63株系在的主根和子叶对盐和aba处理更不敏感(图3a-c)。这一结果说明在非生物胁迫条件下转基因株系的地上部分子叶和地下部分主根的生长相对于野生型具有明显优势。该发现与实施例2的结果相吻合,进一步证明atmyb102基因能提高植物在盐胁迫和渗透胁迫中的抗逆性。为了进一步确定atmyb102基因在非生物胁迫中发挥的功能。我们从拟南芥种子库abrc(arabidopsisbiologicalresourcecenter,theohiostateuniversityrightmirehall1060carmackroad,columbus,oh43210usa)获得了一个转座子插入at4g21440基因的缺失突变体cs128365。通过转录水平鉴定,缺失突变体cs128365株系中的atmyb102基因几乎不表达。我们将实验中使用的缺失突变体cs128365命名为myb102,重复种子萌发和主根伸长实验。首先将myb102、col-0株系的种子分别直接点在含有0、120mmnacl和250mmmannitol的ms培养基,竖直培养10天,分别统计幼苗平均主根长度(图4a,b)。同时将myb102和col-0株系的种子直接萌发于ms培养基,竖直培养5天后,将其分别转移至含有0、120mmnacl和250mmmannitol的ms培养基,继续培养7天,分别统计幼苗平均主根长度(图4c,d)。结果发现,nacl和mannitol处理条件下,myb102-12和myb102-14株系的主根都显著短于对照。此结果和myb102过表达株系ox的表型相反,进一步证实了myb102基因正调控植物的抗逆性。实施例4atmyb102基因对非生物胁迫的响应实施例2和3的结果充分证明了在非生物胁迫条件下,拟南芥atmyb102基因促进种子萌发和主根伸长。为了探究atmyb102基因是否在转录水平对非生物胁迫有响应。我们将正常ms培养基上生长7天大的col-0幼苗分别转移至含有150mmnacl、250mmmannitol、20%peg8000和5μmaba的液体ms培养基中,分别处理0、3、6、12、24小时。如实施例1中的步骤提取rna,反转录形成cdna,用于qrt-pcr检测。图5结果发现,当nacl、mannitol和aba处理时,短时间内atmyb102基因的表达量上调至最高,然后逐渐下调(图5a,b,d)。peg8000处理时,atmyb102基因的表达量虽然也出现短时间内上调的趋势,但转录本水平远远低于其他处理(图5c)。综上,当面临非生物胁迫时,atmyb102基因会快速响应,从而进一步调控植物生长发育。应当注意的是,以上所述的实施例仅用于解释本发明,并不构成对本发明的任何限制。通过参照典型实施例对本发明进行了描述,但应当理解为其中所用的词语为描述性和解释性词汇,而不是限定性词汇。可以按规定在本发明权利要求的范围内对本发明作出修改,以及在不背离本发明的范围和精神内对本发明进行修订。尽管其中描述的本发明涉及特定的方法、材料和实施例,但是并不意味着本发明限于其中公开的特定例,相反,本发明可扩展至其他所有具有相同功能的方法和应用。当前第1页1 2 3
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



